II.2. Nature des radicaux libres
II.2.1. Les espèces réactives
dérivées de l'oxygène
Les ROS résultent de réductions
mono-électroniques successives du dioxygène (O2)
aboutissant à la formation d'eau (Fig. 6).
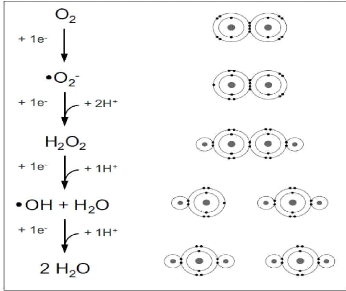
Figure 6 : Les radicaux
libres oxygénés «ROS» représentant les
différents états de réduction
du dioxygène
(Farr & Kogoma, 1991).
La configuration électronique du dioxygène
montre qu'il est avide d'électrons, ce qui lui confère un
caractère oxydant. Sa faible réactivité s'explique par sa
structure électronique. En effet, bien qu'il possède un nombre
pair d'électrons, il présente deux électrons non
appariés au niveau de ses orbitales moléculaires. Au contraire,
le dioxygène réagit en transférant un seul électron
à la fois, ce qui conduit, par ordre de réduction, à la
formation du radical superoxyde
(·O2-), du
peroxyde d'hydrogène (H2O2) et du radical hydroxyle
(·OH)
(Fig.6).
II-2-1-1 L'anion superoxyde : ·O2 -
Si l'oxygène, dans son état fondamental, accepte
un premier électron, celui-ci va occuper l'une des orbitales antiliantes
et former le radical superoxyde
·O2-. Il est plus
instable et plus réactif que la molécule d'oxygène du fait
que l'électron supplémentaire se place dans une orbitale
antiliante.
?O-O + e- O-O (O2 -).
31
Synthèse Bibliographique
II-2-1-2 Le peroxyde: H2O2
Le peroxyde est considéré comme une
espèce réactive dérivée de l'oxygène (ROS),
même s'il n'a pas une structure radicalaire car il est capable d'initier
ou de propager des dommages oxydatifs. Le peroxyde d'hydrogène (H2O2)
provient d'une réaction entre deux anions superoxyde, qui met fin au
processus radicalaire.
2 O2 -+ 2 H+ H2O2 + O2
II-2-1-3 L'hydroxyle : OH
L'hydroxyle (?OH) est très
réactif. Son temps de demi-vie en milieu aqueux est de 10-6
secondes. La coupure homolytique de la liaison O-O du peroxyde
d'hydrogène donne deux radicaux hydroxyles.
H2O2 2 ?OH
Cette rupture de liaison peut être causée par la
chaleur ou par des radiations ionisantes. Cependant, une solution de peroxyde
d'hydrogène avec des ions ferreux suffit à fournir des radicaux
hydroxyle. Cette réaction fut observée pour la première
fois par Fenton en 1894 (Dersoti, 1991).
H2O2 + Fe2 + ?OH + OH- + Fe 3+.
III- Dommages causés par les radicaux libres
Les radicaux libres sont à l'origine de
réactions en chaîne qui conduisent à des destructions
cellulaires. Leurs structures cibles essentielles sont l'ADN, les membranes
cellulaires, les lipides, les glucides et les protéines.
| 


