III- Caractérisation de la Ji-glucosidase d'A.
niger
n
Ccen
Avit stse
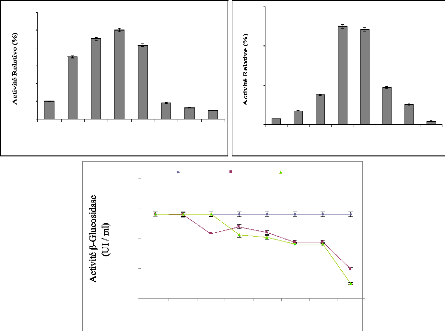
III-1 Détermination de pH optimum
L'étude caractéristique du jus enzymatique a
été développée afin de déterminer le pH
optimum de l'activité 3-glucosidase. L'enzyme est
testée dans un large domaine de pH (de 2 à 10).
Conformément à la Fig 17a les résultats
montrent une meilleure activité pour les pH acide que pour les pH
alcalin. A pH 4,8 l'enzyme montre 100 % d'activité. Cependant, une
négligeable activité est obtenue pour les pH de 7 à 10.
Donc la 3-glucosidase obtenue est active dans des environnements acides de pH
allant de 4 à 5. Ceci est assez avantageux pour des applications
industrielles par cette enzyme et notamment pour le traitement des margines.
88
Résultats et Discussion
III-2 Détermination de la température
optimale
L'étude thermique de l'activité enzymatique a
été également effectuée. La température
optimale de la préparation enzymatique est déterminée
à pH 4,8. Une variation de température de 25 °C à 100 °C a
été choisie. Les résultats relatifs à cette
étude thermique sont collectés et présentés sur
la Fig. 17b. La préparation enzymatique est plus active
à 50 °C et l'activité 13-glucosidase décroit à
40 % à 70 °C (Fig. 17b). Donc cette enzyme
s'avère non thermophile. La stabilité thermique de la
13-glucosidase est déterminée par incubation du jus enzymatique
à trois différentes températures à savoir : 4
°C, 25 °C et 50 °C. L'activité résiduelle est
déterminée après 1 heure d'intervalle durant 48 heures
d'incubation. Le résultat est résumé dans la Fig.
17c. D'après ce résultat, la conservation à 4
°C garde la bonne activité de la 13-glucosidase durant la
période d'étude. Ainsi, la demi-vie de l'enzyme est de 24 heures
à 50 °C. A la température optimale de 50 °C au bout de
3 h, on trouve encore 75% d'activité résiduelle. Cette enzyme est
alors non thermostable mais elle est convenable à la température
optimale pour des applications en bioconversion.
100
80
60
40
20
0
b
120
80
40
0
120
a
2 3 4 4,8 5 6 7 8
pH
25 30 40 50 60 70 80 100
Température (°C)
4 °C 25 50 °C
c
0 1 2 3 4 6 24 48
Temps (h)
10000
8000
6000
4000
2000
Figure 17 : Caractérisation de la
13-glucosidase d'A. niger: Influence du pH (a), Influence de la
température (b), stabilité du jus enzymatique à 4°C,
25 °C et 50 °C (c).
89
Résultats et Discussion
| 


