II-Identification biochimique des espèces de
Candida
spp. isolées
II. 1. Echantillonnage
Les échantillons analysés dans
cette étude ont été prélevés dura nt
trois campagnes d'échantillonnage à partir des
différentes phases de traitement des lixivi ats
de la station de Borj Chakir. La période de c
ollecte s'est étendue du mois de Novembr e
2011 au mois de Février 2012, date au cours de
laquelle la station est mise hors service. Les
échantillons de lixiviats sont prélevés
stérilem ent dans des bouteilles en verre (1 L)
préa l ablement stérilisées par la
chaleur sèche (volume fi nal 1 L) et conservées
dans des glacières contenant de la glace. Les
échantillons sont analysés d ès le retour
au laboratoire puis conservés à
-20°C.
Candida
II.2. Isolement et caractéris ation biochimique
des espèces de II.2.1. Isolement des es pèces de Candida
sur milieu chromogénique
L'isolement des espèces de Candida
à partir des différents
prélèvements a été
réalisé sur gélose CHROMagarTM
Candida (BioMérieux, France). Cette
gélose est un milieu
La floculation des isolats de Candida a
été testée en incubant les cellules (DO600nm=1) dans 10 ml
de bouillon YPD pendant 24h à 37°C. La lecture visuelle des
résultats est réalisée
Méthodologie &
Protocoles
chromogénique qui sert pour l'isolement sélectif
des levures et l'identification directe des espèces de Candida.
L'identification des isolats de C. albicans est
caractérisée par une coloration des colonies de cette
espèce en vert par l'hydrolyse spécifique d'un substrat
chromogène après une incubation de 24 à 48 h à
37°C. L'hydrolyse d'un deuxième substrat permet de
différencier les cultures mixtes et d'orienter l'identification vers
d'autres espèces à savoir C. tropicalis de couleur
«bleu métallique» et C. krusei
caractérisée par des colonies roses (Odds et
Bernaerts, 1994; Beighton et al., 1995;
Pfaller et al., 1996). Ce milieu permet de discriminer entre
ces trois espèces et de les isoler même si elles sont en culture
mixte et à faible quantité (UFC/ml).
Pour cela, dix millilitres de chaque prélèvement
sont enrichis dans 90 ml de bouillon YPD (10g extrait de levure; 10g peptone et
20g glucose) et sont incubés pendant 48h à 37°C
(Noumi et al., 2011a). Après incubation, l'isolement
sur le milieu chromogénique a été réalisé
selon la méthode d'isolement par cadrons.
II.2.2. Purification des espèces de Candida sur
gélose Sabouraud-chloramphénicol
La purification des espèces de Candida
poussant sur milieu CHROMagarTM Candida a
été réalisée sur des boites de gélose de
Sabouraud supplémentée par un antibiotique à large
spectre, le chloramphénicol (Bio-rad, France). En effet, la
gélose de Sabouraud constitue un milieu sélectif classique pour
la culture et l'isolement des levures et des moisissures en particulier les
espèces du genre Candida. Pour cela, 45,5 g de la gélose
de Sabouraud-chloramphénicol (pH=7) sont chauffés dans un litre
d'eau distillée puis autoclavés pendant 15 min à
120°C. Le milieu est coulé dans des boites de Pétri,
laissé refroidir puis mises dans l'étuve (37° C) pendant une
nuit (Chabasse et al. ,1999). Une fois ensemencées, les
boites sont incubées à 37°C pendant 24 à 48h.
II.2.3. Observation microscopique
Après isolement des souches de Candida sur
gélose Sabouraud-chloramphénicol, une colonie bien
individualisée a été étalée sur une lame
contenant une goutte d'eau physiologique stérile et puis fixée
par la flamme du bec Bunsen et colorée à la fuschine 1%. Les
observations ont été réalisées par un microscope
optique (hund H 500 WETZLAR, Germany) au fort grossissement (Gx100)
après ajout d'une goutte d'huile à immersion.
II.2.4. Test de floculation
Méthodologie &
Protocoles
après la sortie des tubes de l'étuve d'une à
deux heures. Le dépôt des cultures cellulaires au fond des tubes
en verre témoigne d'un test positif (Noumi et al.,
2012). II.2.5. Etude des caractères biochimiques sur
galeries Api Candida
Les caractères biochimiques des différents isolats
purifiés sur gélose Sabouraud-Chloramphénicol sont
déterminés en utilisant le système de galerie Api
Candida représenté par une galerie constituée de
10 microtubes contenant des substrats déshydratés pour
réaliser 12 tests d'identification. Les réactions produites
pendant la période d'incubation se traduisent par des virages
colorés spontanés. Après incubation, la lecture de ces
réactions se fait à l'aide du tableau de lecture et
l'identification est obtenue à l'aide du catalogue analytique ou d'un
logiciel d'identification (Tableau I).
Tableau I. Caractères enzymatiques
étudiés sur les galeries Api Candida
Tests Composants actifs
1) GLU D-glucose
2) GAL D-galactose
3) SAC D-saccharose
4) TRE D-tréhalose
5) RAF D-raffinose
6) BMAL 4-nitrophényl-BD-maltopyranose
7) áMAL
2-chloro-4-nitrophényl-áD-maltotrioside
8) BXYL 4-nitrophényl-BD-xylopyranoside
9) BGUR 4-nitrophényl-BD-glucuronide
10) URE Urée
11) BNAG (dans tube n°8)
5-bromo-4-chloro-3-indoxyl-N-acétyl-BDglucosminide
12) BGAL (dans tube n°9)
5-bromo-4-chloro-3-indolyl-BD-galactopyranoside
Pour cela, le fond et le couvercle d'une boîte Api sont
réunis et de l'eau distillée stérile est ajoutée
dans les alvéoles pour créer une atmosphère humide.
Ensuite, la galerie est déposée stérilement dans la
boîte d'incubation. Une suspension fongique très dense est alors
préparée à partir de colonies séparées pures
et jeunes sur gélose Sabouraud-Chloramphénicol dans une ampoule
d'NaCl 0,85% Medium qui sera répartie uniquement dans les tubes en
évitant de faire des bulles. Les 5 premiers tests et le dernier sont
recouverts d'huile de paraffine stérile. Les galeries sont par la suite
incubées pendant 24 h à 37°C.
La lecture de la galerie doit se faire en se
référant au tableau de lecture du guide d'utilisateurs. Les tests
sont regroupés en groupe de 3, et une valeur (1,2 ou 4) est
indiquée pour chacun. A l'intérieur de chaque groupe, les nombres
correspondants aux tests positifs sont additionnés. On obtient un nombre
de quatre chiffres qui sert de code d'identification. Le
Méthodologie &
Protocoles
code est par la suite entré dans la base de
données du logiciel Api Web (BioMérieux, France) et l'isolat est
ainsi identifié.
III. Etude phénotypique de la résistance
des isolats
de Candida spp. aux agents
antifongiques
La résistance des différents isolats a
été testée vis-à-vis de deux agents antifongiques
utilisés dans le traitement des candidoses buccales
(Amphotéricine B) et vaginales (Acide borique) selon deux
méthodes: sur milieu solide et milieu liquide.
III.1. Test de résistance à l'acide
borique
On prépare un milieu de culture de gélose
Sabouraud-Chloramphénicol et on lui ajoute 1,8 g d'acide borique/L par
filtration en utilisant un filtre seringue de diamètre 0,22 um (IWAKI,
Japan). Le milieu est par la suite coulé dans des boites de
Pétri, laissé refroidir à température ambiante.
Tous les isolats sont repiqués sur ce milieu (technique d'isolement par
cdrons) et les boites sont alors incubées de 24 à 48h à
37°C. Si la colonie pousse, elle est donc résistante à
l'acide borique sinon la souche est dite sensible à l'acide borique.
III.2. Test de résistance à
l'amphotéricine B
III.2.1. Sur milieu solide
La résistance des différents isolats à
l'amphotéricine B a été testée selon la
méthode CLSI (Wayne, 1997) sur milieu MHGBM
(Mueller-Hinton Glucose Bleu de méthylène de composition: MH 38
g, Glucose 2 % et 0,5 ug/ml Bleu de Méthylène). Des disques de
papier Wattman stériles de 6 mm de diamètre (Biolife, Milan,
Italie) ont été placés sur les tapis de levures (les
suspensions ont été ajustées à une
DO520nm=0,4 équivalent à une charge de 10
cellules/ml). L'amphotéricine B est diluée dans du DMSO
(diméthylsulfoxyde) 10% de façon à déposer 100
ug/disque (volume déposé: 10 ul). Les boites sont par la suite
incubées à 37°C pendant 24 à 48h. L'apparition d'un
halo autour de chaque disque traduit l'inhibition de la croissance des levures.
La mesure de cette activité consiste à mesurer le diamètre
d'inhibition avec une règle plate (L=20 Cm). Si le diamètre est
=9 mm la souche est dite résistante (R), si le diamètre est
compris entre 10 et 14 mm la souche est dite Sensible Dose Dépendante
(SDD) et si le diamètre et supérieur à 15 mm, la souche
est dite sensible à l'amphotéricine B.
Méthodologie &
Protocoles
III.2.2.Détermination de la Concentration
Minimale Inhibitrice et (CMI) et de la Concentration Minimale Fongicide
(CMF)
Les CMIs et CMFs ont été
déterminées selon le protocole décrit par Noumi
et ses collaborateurs (2009). Des inocula de chaque
souche ont été préparés dans l'eau physiologique
à partir d'une culture jeune sur gélose
Sabouraud-Chloramphénicol et la densité optique a
été ajustée DO520nm=0,4 équivalente
à 10 cellules/ml. Une solution mère d'amphotéricine B de
concentration (16ug/ml) a été préparée dans le
diméthylsulfoxyde à 10% (DMSO). Des dilutions en cascade sont
réalisées dans des tubes à hémolyse stériles
de 5 ml contenant le DMSO à 10%. Les plaques ELISA à 96 puits
(fond rond) ont été préparées de façon que
chaque puits contienne 95 ul de bouillon Sabouraud, 5 ul de la suspension
fongique et 100 ul de chaque dilution de l'amphotéricine B. Le puits
témoin positif contient 195 ul de bouillon Sabouraud stérile et 5
ul de la suspension fongique. Le volume final dans chaque puits est de 200 ul.
Après incubation à 37°C pendant 18 à 24 h, les
plaques sont lues à l'oeil nu pour la détermination des CMIs et
CMFs.
IV. Etude des activités enzymatiques
La production d'enzymes hydrolytiques telles que les
aspartylprotéases, les phospholipases, l'estérase et les
hémolysines par les espèces de Candida est un facteur de
virulence de cette levure (Ibrahim et al., 1995; Hube,
1998) pour cela, nous nous sommes intéressés à
l'étude de ces activités.
IV.1. Détermination de l'activité de la
phospholipase
Les souches isolées sont transférées dans
les tubes contenant 5 ml du bouillon YPD puis incubées à
37C° pendant 18 h. Après incubation, 1,5 ml de la culture fongique
sont transférés dans des tubes eppendorf et centrifugés
à 3000 rpm pendant 5 min. Le culot obtenu est lavé deux fois par
une solution de PBS stérile (PBS: Na2HPO4 7Mm,
NaH2PO4 3Mm et NaCl 130Mm, pH=7,2), puis
centrifugé à 3000rpm pendant 5 min. La gélose pour tester
l'activité phospholipase est préparée (10 g peptone, 30 g
glucose, 57,7 g NaCl, 0,55 CaCl2 et 20 g d'agar agar dans 1 litre
d'eau distillée). Après autoclavage et refroidissement du milieu,
100 ml de jaune d'oeuf sont stérilement récupérés
et additionné au milieu préparé. Après ajustement
de la densité à 0,5 McFarland, un volume de 1ul est mis en
triplicate à des points équidistants sur des boites des
Pétri qui sont par la suite incubées à 37°C pendant 4
jours. La présence de la phospholipase est déterminée par
la formation d'une zone opaque autour des
Méthodologie &
Protocoles
colonies. L'activité enzymatique (Pz) est
mesurée en calculant le rapport entre le diamètre de colonie et
le diamètre de la colonie avec la zone de précipitation. La
valeur de PZ est inversement proportionnelle à la nature de
l'activité. En effet, si le Pz est égale à 1, la souche
est dite phospholipase négative, si Pz est supérieur à
(0,63), la souche est dite phospholipase positive et enfin si Pz est
inférieur à (0,63), l'activité de phospholipase est
très élevée ou fortement positive (Price et al.,
1982).
IV.2. Détermination de l'activité de
l'aspartylprotéase secrétée
Les étapes de détermination de
l'activité de l'aspartylprotéase sont similaires à celles
de la phospholipase, la seule différence réside au fait
qu'après ajustement de la densité à 0,5 McFarland, un
volume de 1 ul est mis en triplicate à des point équidistants sur
des boites de gélose préalablement préparées (2g de
BSA: Sérum Bovine Albumine; 1,45 g sulfate d'ammonium, 20 g glucose, 20
g agar-agar dans 1 litre d'eau distillée). Les boites de Pétri
contenant l'inoculum des différentes souches sont incubées
à 37 C° pendant 7 jours (Aoki et al., 1990).
La sécrétion de l'aspartylprotéase par
les isolats testés est déterminée par la formation d'un
halo clair autour des colonies et l'activité enzymatique (Pz) est
mesurée de la même façon que celle pour la phospholipase
tout en divisant le diamètre de la colonie par le diamètre total
(le diamètre de la colonie avec la zone de précipitation). Nous
différencions quatre classes d'activité de cette enzyme: une
activité très faible (0,9<Pz<1), une activité faible
(0,8<Pz<0,89), une activité élevée
(0,7<Pz<0,79) et une activité très élevée
(Pz<0,69).
IV.3. Détermination de l'activité de
l'estérase
La détermination de cette activité a
été réalisée en adoptant la méthode
décrite par Ge et al. (2011). Les étapes de
détermination de l'activité de l'estérase sont similaires
à celles de la phospholipase. Après ajustement de la
densité à 0,5 McFarland, un volume de 1ul est mis en triplicate
à des points équidistants sur des boites de gélose
d'estérase préalablement préparée (10 g peptone, 5
g NaCl, 0,1 g CaCl2 et 15 g agar-agar dans 1 litre d'eau distillée; pH
6,8). Après autoclavage et refroidissement du milieu, 50 ml de Tween 80
sont stérilement additionnés au milieu préparé. Les
boites de Pétri contenant l'inoculum des différents isolats sont
incubées à 37°C pendant 10 jours. La présence de
l'estérase est déterminée par la formation d'une zone
opaque autour des colonies. L'activité enzymatique (PZ) est
mesurée en calculant le rapport entre le diamètre de la colonie
et le diamètre de la colonie avec la zone de précipitation
(Diamètre total). La valeur de PZ est inversement proportionnelle
à la nature
Méthodologie &
Protocoles
de l'activité. En effet, si la valeur du PZ est
égale à 1, la souche est dite estérase négative, si
PZ est supérieur à 0,63, la souche est dite estérase
positive, enfin si PZ est inférieur à 0.63, l'activité
estérase est très élevée ou fortement positive.
IV.4. Etude de pouvoir hémolytique
La production d'hémolysines par les espèces de
Candida isolées des différentes phases de traitement des
lixiviats à Borj-Chakir a été évaluée en
utilisant la technique décrite par Manns et ses
collaborateurs (1994). Les souches purifiée sur
gélose sabouraud-chloramphénicol sont
récupérées et lavées avec une solution saline
stérile (PBS, pH 7,2). Une suspension de 10 cellules /ml a
été préparée en ajustant sa densité optique
à 0,4 sous une longueur d'onde de 520nm (Samaranayake et Mac
Farlane, 1981). Un microlitre de cette suspension est inoculé
sur gélose au sang du mouton enrichie par du glucose (3%). La
gélose au sang du mouton enrichie par du glucose a été
préparée en ajoutant 7 ml de sang frais de mouton à 100 ml
de gélose de sabouraud-chloramphénicol supplémentée
avec 3% de glucose (m/v). Le pH final du milieu ainsi préparé est
de 5,6#177;0,2.
Les boites sont incubées à 37 °C sous
atmosphère à 5% de CO2 pendant 48 h. La
présence d'halo translucide autour de l'inoculum témoigne d'une
activité hémolytique positive. Le rapport des diamètres de
la zone de lyse et celui de la colonie est considéré comme un
indice hémolytique pour présenter l'intensité de la
production d'hémolysines par les différentes espèces de
Candida (Wu et al., 1996). L'analyse est
réalisée en triplicate et à deux occasions
séparées pour chaque isolat. Trois différents types
d'hémolyse peuvent être observés sous la lumière
autour de la colonie de Candida (Yigit et Aktas,
2009). Le premier type est caractérisé par un anneau
translucide relatif à une bêta hémolyse et le second est un
halo verdâtre à noirâtre correspondant à l'alpha
hémolyse et le dernier qualifié de gamma hémolyse (pas
d'activité). Le calcul de l'indice d'hémolyse a été
fait en adoptant la formule proposée par Yigit et Aktas (2009)
tout en divisant le diamètre de la colonie par le
diamètre total (diamètre de la colonie additionné du
diamètre de la zone d'hémolyse). Cet indice donne une idée
sur l'intensité de production des hémolysines par les souches de
Candida.
IV.5. Identification des enzymes par les galeries Api
ZYM
Le système Api ZYM est une micro méthode semi
quantitative pour la recherche des activités enzymatiques applicable
à des différents types d'échantillons (microorganismes,
suspensions cellulaires, tissus, liquides biologiques, etc.). Il permet
d'étudier rapidement et simultanément 19 activités
enzymatiques à partir de très faibles quantités
d'échantillons. La
Méthodologie &
Protocoles
galerie Api ZYM contient 20 cupules spécialement
adaptées à l'étude des réactions enzymatiques. Les
tests enzymatiques sont inoculés avec une suspension dense, qui
réhydrate les substrats. Les réactions produites pendant la
période d'incubation (4h) se traduisent par des virages colorés
révélés par l'addition des réactifs Zym A et Zym B
(Tableau II).
En effet, 100 ìl de la suspension de chaque isolat de
levure sont utilisés pour inoculer les différentes cupules des
galeries Api Zym. Après 4 h d'incubation à 37°C, les
réactifs Zym A et Zym B sont ajoutés dans les différentes
cupules et les galeries sont soumises après 5 min de réaction
à la lumière blanche pour la révélation des
différentes réactions enzymatiques (variation de couleurs). Les
couleurs obtenues sont comparées à celles décrites dans le
manuel d'utilisation fourni par le fabriquant.
Tableau II. Caractères enzymatiques
étudiés sur les galeries Api Zym (BioMérieux).
|
N°
|
Enzyme recherchée
|
Substrats
|
|
1
|
Témoin
|
|
|
2
|
Phosphatase alcaline
|
2-naphtol phosphate
|
|
3
|
Estérase (C4)
|
2-naphtol butyrate
|
|
4
|
Estérase Lipase (C8)
|
2-naphtol caprylate
|
|
5
|
Lipase (C14)
|
2-naphtolmyristate
|
|
6
|
Leucine arylamidase
|
L-leucyl-2-naphtylamide
|
|
7
|
Valine arylamidase
|
L-valyl-2- naphtylamide
|
|
8
|
Cystine arylamidase
|
L-cyctil-2- naphtylamide
|
|
9
|
Trypsine
|
N-benzoyl-DL-arginine-2- naphtylamide
|
|
10
|
á-chymotrypsine
|
N-glutaryl-fenylalanine-2- naphtylamide
|
|
11
|
Phosphatase acide
|
2-naphtyl phosphate
|
|
12
|
Naphtol-AS-BI -phosphohydrolase
|
Naphtol-AS-BI-phosphate
|
|
13
|
á-galactosidase
|
6-Br-2-naphtyl-áD-galactopyranoside
|
|
14
|
3-galactosidase
|
2-naphtyl-3D- galactopyranoside
|
|
15
|
3-glucuronidase
|
Naphtol-AS-BI-3D-glucuronide
|
|
16
|
á-glucosidase
|
2-naphtyl-áD-glucopyranoside
|
|
17
|
3-glucosidase
|
6-Br-2-naphtyl-3D-glucosaminide
|
|
18
|
N-acétyl-3-glucosaminidase
|
1-naphtyl-N-acétyl-3D-glucosaminide
|
|
19
|
á-mannosidase
|
6-Br-2-naphtyl-áD-monnopyranoside
|
|
20
|
á-fucisidase
|
2-naphtyl-áL-fucopyranoside
|
V. Etude qualitative et quantitative de l'adhésion
des
souches de Candida isolées
Pour expliquer la persistance des souches de Candida
dans les différentes phases de traitement des lixiviats, nous avons
testé la capacité de ces levures à s'adhérer et
à former un
Méthodologie &
Protocoles
biofilm sur une surface inerte qui est le polystyrène
ainsi que la production de « slime » ou exopolysaccharides sur
milieux liquide et solide.
V.1. Etude qualitative de l'adhésion V.1.1.
Coloration à la safranine
La production de « slime » ou exopolysaccharides a
été déterminée selon la technique décrite
par (Noumi et al., 2011). Brièvement, quelques colonies
de Candida cultivées sur gélose Sabouraud dextrose agar
ont été inoculées dans les tubes contenant 10 ml de
bouillon Sabouraud supplémenté avec du glucose à 8%. Les
tubes ont été incubés pendant 24 h à 35°C,
puis égouttés et colorés avec 5 ml de safranine 1% pour
vérifier la présence ou l'absence d'un culot. La production de
slime par chaque isolat est considérée faible (+), moyenne (++),
ou forte (+++) selon l'intensité du culot obtenu. Le résultat a
été lu par trois observateurs différents.
V.1.2. Production de « slime » sur
gélose préparée au rouge Congo
L'aptitude de souche de Candida à produire un
biofilm a été évaluée sur milieu rouge Congo en
utilisant la technique décrite par Dag et al. (2010).
Ce milieu est préparé en ajoutant 0,8 g de rouge Congo (Sigma,
France) et 80 g de glucose (Labosi, France) à un 1itre
de gélose coeur cervelle (Bio-rad, France). Le milieu a
été autoclavé à 115 C° pendant 10 min. Les
boites sont incubées pendant 24 h à 37°C en aérobie,
suivi d'une nuit à l'obscurité à température
ambiante. Les souches productrices de biofilm « slime Producer »
apparaissent sous forme de colonies noires, tandis que les souches biofilm
négatif sont non pigmentées (blanches, roses avec un point noir
au centre).
V.2. Etude quantitative de l'adhésion V.2.1. Test
de hydrophobicité
L'hydrophobicité des souches de levures est
mesurée selon le protocole décrit par Rosenberg
et ses collaborateurs (1983). Le test consiste
à mesurer l'adhésion de cette levure au cyclohexane
(hydrocarbure) et au xylène .Pour cela, les isolats de levures sont
incubés toute une nuit dans 5 ml de bouillon YPD à 28 C°.
Les cellules de Candida sont par la suite lavées avec du PBS et
leur densité optique (DOi) est ajustée à 1 (DO600 nm =1).
Pour le test d'adhésion, 3 ml de la suspension de levure sont
mélangés avec 150 ul de cyclohexane ou xylène et dans un
tube en verre lavé avec de l'acide sulfurique.
Méthodologie &
Protocoles
Le mélange est agité (vortex) durant 1 min puis
laissé à température ambiante de 20 min à 1 h.
L'absorbance (Af) de la phase aqueuse est mesurée à 600 nm puis
comparée avec l'absorbance initiale (A ). Le pourcentage des cellules
adhérentes formant une membrane fine à la surface des solvants
testés (le cyclohexane et le xylène) est déterminé
pour estimer le pourcentage l'hydrophobicité des souches de levure selon
l'équation suivante (I).
(I) % d'hydrophobicité= [(DOi-DOf)/DOi] x
100
V.2.2. Adhésion des Candida spp. sur les
plaques en polystyrène
Afin de quantifier la formation de biofilm formé par
les différentes espèces de Candida isolées, nous
avons recours à une première méthode basée sur un
dosage spectrophotométrique du Cristal violet 1% dans des plaques ELISA
96 puits à font rond et une deuxième technique
colorimétrique basée sur la réduction du 2,3- bis
(2-méthoxy-4-nitro-5-sulfophenyl)-5 [(phénylamino)
carbonyl]-2H-tétrazolium (XTT) en un composé coloré
hydrosoluble (le formazan) sous l'effet de la déshydrogénase
mitochondriale des Candida dans des plaques ELISA de 96 puits à
font plat (Hawser, 1998b).
Toutes les espèces de Candida spp. ont
été cultivées pendant 18h à 37°C sur milieu
Sabouraud- Chloramphénicol. Par la suite, les souches ont
été incubées dans un bouillon YNB (Yeast Nitrogen Base;
Sigma - Aldrich, St Louis, Mo, India) supplémenté par 100 Mm de
glucose (18g/l). Après une nuit de culture, les levures ont
été récupérées à la fin de la phase
exponentielle de croissance et lavées deux fois avec 5 ml d'une solution
saline tamponnée (PBS; pH 7,2). Une suspension de 10 cellules/ ml a
été préparée en ajustant la densité optique
à 0,4 mesurée à 520 nm.
Les biofilms ont été produits sur des plaques
ELISA en polystyrène à 96 puits et à fond plat pour le XTT
et à fond rond pour le Cristal violet 1% (Nunc, Roskilde, Danemark)
selon le protocole précédemment décrit par Noumi et ses
collaborateurs (2010). Cent microlitres de la suspension
cellulaire (10 cellules/ml) sont transférés dans les puits de
chaque type de plaques à l'aide d'une micropipette. Les plaques sont
incubées à 37°C durant 1 h 30 min dans un shaker à 75
rpm pour permettre à la levure d'adhérer aux surfaces des
puits (Kuhn al., 2002). Pour chaque plaque, trois puits ne
renfermant pas la suspension de Candida sont considérés
comme témoin négatif.
Après la phase d'adhésion, les suspensions de
cellules ont été aspirées et les plaques ont
été lavées deux fois avec 150 ul de PBS stérile
pour enlever les cellules non adhérentes. Cent microlitres du bouillon
YNB ont été alors transférés dans chaque puits et
les plaques ont
Méthodologie &
Protocoles
été incubées à 37° C dans un
shaker à 75 rpm. Les biofilms ont été
développés durant 66 h et la viabilité cellulaire a
été mesurée par analyse de la réduction du XTT
(cellule viables) et au Crystal violet (cellules fixées). Le milieu a
été renouvelé quotidiennement par aspiration du milieu
épuisé et addition d'un nouveau milieu chaque jour. Toutes les
analyses ont été effectuées en triplicate (Melo et
al ., 2006).
L'analyse de la réduction du XTT est
réalisée selon la technique décrite par
Kuhn et ses collaborateurs (2002). Brièvement,
la solution de XTT (1 mg/ml de PBS; Sigma-Aldrich, Inc.Germany) a
été préparée et stérilisée par
filtration à travers un filtre de 0,22 um de porosité (Millipore,
Satorius Minisart CE 0297, Germany) puis stockée à -70°C. La
solution de ménadione (0,4 mM dans l'acétone; Sigma-Aldrich, St
Louis, Mo., Switzerland) a été préparée et
stérilisée par filtration (filtre 0,22 um juste avant chaque
analyse). Avant chaque essai, la solution de XTT et décongelée et
mélangée avec la solution de ménadione (5 :1; v/v). Les
biofilms ont été lavés cinq fois avec 200 ul de PBS
stérile puis nous avons ajouté 200 ul de PBS additionnés
par 12 ul de la solution de XTT-ménadione. Les plaques ont
été incubées à l'obscurité pendant 2 h
à 37 °C.
Pour la méthode au Cristal violet 1%, les biofilms ont
été lavés cinq fois avec 200 ul de PBS stérile et
colorés avec 200 ul de Cristal violet 1% pendant 15 min. Les plaques
sont séchées en position inversée. Les puits sont
lavés de nouveau avec du PBS stérile et le Crystal violet a
été solubilisé dans 200ul d'une solution
éthanol-acétone (80:20 v/v).
Après incubation, 100 ul de la solution ont
été transférés dans de nouveaux puits et le
changement de couleur de la solution a été mesuré avec un
lecteur ELISA (BioRad, France) à 492 nm pour les plaques contenant le
XTT et à 595 nm pour le Cristal violet 1%. Les valeurs des absorbances
pour les puits témoin ont été alors soustraites des
valeurs des puits inoculés par les suspensions pour éliminer les
faux résultats dus à l'interférence de fond
(Ramage et
al., 2001).

RÉSULTATS
Résultats
I. Caractérisation phénotypique des
espèces de
Candida spp. isolées
1. Etude morphologique
1.1. Caractéristiques macroscopiques
Sur milieu chromogénique, plusieurs morphotypes sont
décrits pour les échantillons analysés (Tableau III):
colonies de couleur bleue, colonie de couleur blanche et colonies de couleur
rose ou blanche à centre rose, colonies de couleur mauve et colonies de
couleur beige (Figure 5).
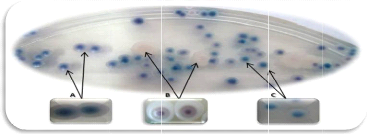
Figure 5. Les principaux morphotypes obtenus sur
milieu CHROMagarTM Candida (A): colonies de couleur bleue;
(B): colonies de couleur blanche à centre rose; (C): clonies de couleur
turquoise.
L'examen macroscopique des espèces de Candida
cultivées en aérobiose à 37°C sur gélose
Sabouraud-Chloramphénicol (pH 7,2) montre qu'il s'agit de colonies
crémeuses, lisses, rondes et bombées (Figure 6) ayant une odeur
de levure. La croissance de Candida sur ce milieu sélectif nous
a permis de remarquer que la couleur des colonies est variable selon
l'espèce. En effet, sur la gélose
Sabouraud-Chloramphénicol, C. albicans est
blanchâtre.
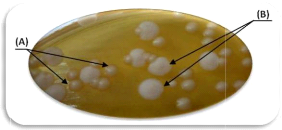
Figure 6. Observation microscopique des colonies
de Candida sur gélose Sabouraud-Chloramphénicol. (A):
colonies blanches ou crémeuses et lisses; (B): colonies grandes et
sèches.
Résultats
Tableau III. Couleur des isolats obtenue sur
milieu CHROMagarTM Candida en fonction de l'origine
d'isolement.
|
Code
|
Origine
|
Milieu
|
Couleur obtenue
|
|
M1
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M2
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M5
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M7
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M8
|
E5
|
CHROMagarTM Candida
|
Colonie beige
|
|
M9
|
E8
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M10
|
E8
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M11
|
E8
|
CHROMagarTM Candida
|
Colonie rose
|
|
M13
|
E7
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M14
|
E7
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M16
|
E5
|
CHROMagarTM Candida
|
Colonie beige
|
|
M17
|
E5
|
CHROMagarTM Candida
|
Colonie beige
|
|
M18
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M19
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M20
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M21
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M22
|
E5
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M23
|
E10
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M24
|
E2
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M25
|
E2
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M28
|
E10
|
CHROMagarTM Candida
|
Colonie mauve claire
|
|
M30
|
E1
|
CHROMagarTM Candida
|
Colonie mauve claire
|
|
M31
|
E1
|
CHROMagarTM Candida
|
Colonie grande blanche
|
|
M32
|
E4
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M36
|
E2
|
CHROMagarTM Candida
|
Colonie beige
|
|
M39
|
E2
|
CHROMagarTM Candida
|
Colonie bleue
|
|
M40
|
E2
|
CHROMagarTM Candida
|
Colonie blanche
|
|
M41
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M42
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M43
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M44
|
E5
|
CHROMagarTM Candida
|
Colonie blanche à centre rose
|
|
M45
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M46
M47
|
E5
E5
|
CHROMagarTM
CandidaCHROMagarTM Candida
|
Colonie mauve Colonie bleue
|
|
M49
|
E5
|
CHROMagarTM Candida
|
Colonie grande blanche à centre
|
|
M50
|
E5
|
CHROMagarTM Candida
|
Colonie grande blanche à centre
|
|
M56
|
E5
|
CHROMagarTM Candida
|
Colonie mauve
|
|
M57
|
E5
|
CHROMagarTM Candida
|
Colonie bleue
|
1.2. Caractéristiques microscopiques
L'aspect microscopique de toutes les espèces de
Candida est semblable. L'observation microscopique des cellules de
Candida au grossissement (*100) a montré qu'on a 62,16 % de
souches de forme ovalaire (Figure 7A) de 2 à 8 um de diamètre.
Les autres 37,83% de souches ont une forme allongée ou en forme de grain
de riz (Figure 7 B).
Résultats
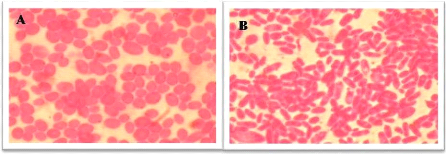
Figure 7. Observation microscopique des cellules
de Candida colorées à la fushine au microscope optique
(G*100). (A) : cellules de Candida de forme ovoïde, (B) :
cellules de Candida ayant la forme des grains de riz.
2. Différentes espèces de Candida
spp. Isolées à partir de la station de traitement des
lixiviats de Djebel Chakir
L'identification des souches a été
réalisée par les galeries Api Candida pour 37 isolats.
Par la suite, l'interprétation des résultats a été
effectuée par le logiciel Api Web (bioMérieux, France). Deux
genres sont identifiés : Candida et Saccharomyces
regroupent les espèces suivants isolées C.
albicans, C. krusei, C. famata, C. tropicalis,
C. guilliermondii et C. lusitaniae et l'espèce
Saccharomyces cerevisiae (Tableau IV).
Tableau IV. Différentes espèces
de levures isolées à partir de la station de traitement des
lixiviats de Djebel Chakir en se basant sur les caractères obtenus sur
les galeries Api Candida.
|
Espèces identifiées
|
Nombre
|
Codes obtenu sur Api Candida
|
|
C. albicans C. krusei
|
15
14
|
7512 ; 7712 ; 4512
1000 ; 1010 ; 1020 ; 1030
|
|
C. famata
|
3
|
2100 ;
|
3100
|
; 5100
|
|
C. tropicalis
|
2
|
|
7710
|
|
|
C. guilliermondii
|
1
|
|
7320
|
|
|
C. lusitaniae
|
1
|
|
7520
|
|
|
Saccharomyces cerevisiae
|
1
|
|
7300
|
|
Nous avons noté au cours de ce travail que les deux
espèces isolées est C. albicans (n =15) et C. krusei
(n=14) sont majoritairement isolées. Les profils biochimiques des
différentes espèces de Candida isolées sont
illustrés dans le tableau V ci-dessous.
Résultats
Tableau V. Origine, fo rme
et caractères biochimiques des levures isolées
et testées par les galeries Api Candida
(BioMérieux, France).
|
Isolats testés Origine
|
Date de prélèvement
|
Forme*
|
Identification biochimique par Api
Code Identification (%)
|
|
Candida albicans
|
|
|
|
|
|
|
M2 E5
|
25/11/2011
|
Ovale
|
4512
|
C. albicans
|
ND
|
|
M5 E5
|
25/11/2011
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M7 E5
|
25/11/2011
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M8 E5
|
25/11/2011
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M16 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M20 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M21 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M24 E2
|
25/11/2011
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M25 E2
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M36 E2
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M42 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M45 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M47 E5
|
06/01/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
M56 E5
|
06/02/2012
|
Ovale
|
7712
|
C. albicans
|
61,7
|
|
M57 E5
|
06/02/2012
|
Ovale
|
7512
|
C. albicans
|
70,1
|
|
Candida krusei
|
|
|
|
|
|
|
M13 E7
|
25/11/2011
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M22 E5
|
06/01/2012
|
Grains de riz
|
1030
|
C. krusei
|
ND
|
|
M30 E1
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M31 E1
|
06/01/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
M32 E4
|
06/01/2012
|
Grains de riz
|
1010
|
C. krusei
|
99,5
|
|
M39 E2
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M40 E2
|
06/01/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
M41 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M43 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M44 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M49 E5
|
06/02/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M17 E5
|
06/01/2012
|
Grains de riz
|
1000
|
C. krusei
|
97,6
|
|
M18 E5
|
06/01/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
M50 E5
|
06/02/2012
|
Grains de riz
|
1020
|
C. krusei
|
87,6
|
|
Candida famata
|
|
|
|
|
|
|
M9 E8
|
25/11/2011
|
Ovale
|
5100
|
C. famata
|
99,2
|
|
M10 E8
|
25/11/2011
|
Ovale
|
2100
|
C. famata
|
57,6
|
|
M11 E8
|
25/11/2011
|
Ovale
|
3100
|
C. famata
|
57,6
|
|
C. tropicalis
M28 E10
|
06/01/2012
|
Ovale
|
7710
|
C. tropicalis
|
95,7
|
|
M46 E5
|
06/01/2012
|
Ovale
|
7510
|
C. tropicalis
|
99,9
|
|
C. lusitaniae
M1 E5
|
25/11/2011
|
Ovale
|
7520
|
C. lusitaniae
|
99,3
|
|
C. guilliermondii
M14 E7
|
25/11/2011
|
Ovale
|
7320
|
C. guilliermondii
|
96,5
|
|
Saccharomyces cerevisiae
M23 E10
|
06/01/2012
|
Ovale
|
7300
|
S. cerevisiae
|
98,8
|
ND : Non Déterminé par le logiciel
API WEB;
3. Test de floculation
Après incubation de 24 h dans l'étuve 37
° C, nous avons pu remarquer que toutes les
souches testées floculent dans le bouillon
Sabouraud-Chloramphénicol avec dépôt des
cellules
au fond des tubes (culot blanc).
Résultats
4. Test de résistance à l 'a cide
borique
Le but de la réalisation de ce test
est de voir le taux de sensibilité ou de
résistance des souches de Candida sur un
milieu qui contient de l'acide borique (agent
antifongique). On a pu remarquer que 22 souches parmi 43
poussent après incubation de 24 h à 37 °C.
En effet, ces dernières sont résistantes
à l'acide borique. Les autres souches sont
alors considérés sensibles.
II. Activité anti fo
ngique
disque
1. Méthode de diffusion de
Sur milieu MHGBM, nous avons montré
que toutes les souches testées ne répondent pas
de la même façon à l'amphotéricine B (100
ug/disque). En effet, seize souches sont résistantes à
l'amphotéricine B puisque les diamètres d'inhibition de la
croissance sont inférieurs à 9 ; treize souches
sont sensibles à l'amphotéricine B pu i
sque les diamètres d'inhibition de la croissance sont
compris entre 10 et 14 mm, alors que q uatorze
souches ont une susceptibilité dose dépendante
avec des diamètres d'inhibition de la cr
oissance supérieurs à 15 mm (Figure 8).

Figure 8.
Détermination des diamètres des zones
d'inhibition de la croissance des levures sur milieu
Mueller-Hinton-Glucose-Bleu de Méthylène par
l'amphotéricine B (100 ug/disque). (A): Souche
résistante; (B): Souche à Sensibilité
Dose Dépendante; (C): Souche sensible.
(CMI) et de la
2. Détermination de la Concentration Minimale
Inhibitrice Concentration Minimale Fongicide (CMF)
La détermination des concentrations
minimales inhibitrices (CMIs) et des concentrations minimales
fongicides (CMFs) a été faite selon une lecture
visuelle. Les valeurs
Résultats
de CMIs sont comprises entre 0,015 et 0,0312 ug/ml alors que
les CMFs varient de >0,5 à >16 ug/ml.
Tous ces résultats sont résumés dans le tableau
VI ci-dessous.
Tableau VI. Résistance
phénotypique
l'amphotéricine B (sur milieu MHGBM et
sur
vis-à-vis de
milieu liquide) et à l'acide borique.
des différentes souches testées
Souche
|
Résistance à l'acide
borique (1,8 g/L)
|
Amph otéricine B
|
|
|
Sur milieu MHGBM* Milieu liquide
(100ug/disque) (ug/ml)
ZI#177;DS* Interprétation CMIs CMFs
|
|
Candida albicans
|
|
|
|
|
|
|
C. albicans ATCC 2091
|
Sensible
|
6#177;0
|
R
|
0.0312
|
>16
|
|
C. albicans ATCC 90028
|
Sensible
|
6#177;0
|
R
|
0.0312
|
>16
|
|
C. albicans SC5314
|
Sensible
|
6#177;0
|
R
|
0.015
|
>4
|
|
M2
|
Résistante
|
6#177;0
|
R
|
0.015
|
=8
|
|
M5
|
Résistante
|
17#177;1
|
S
|
0.015
|
>8
|
|
M7
|
Résistante
|
15#177;1
|
S
|
0.015
|
>8
|
|
M 8
|
Sensible
|
20#177;0
|
S
|
0.015
|
>16
|
|
M16
|
Résistante
|
19#177;1
|
S
|
0.0312
|
>4
|
|
M20
|
Résistante
|
13#177;1
|
SDD
|
0.015
|
>8
|
|
M2 1
|
Sensible
|
19#177;0
|
S
|
0.0312
|
>0.5
|
|
M24
|
Résistante
|
14,33#177;0,5
|
SDD
|
0.0312
|
>4
|
|
M25
|
Résistante
|
13,33#177;1,52
|
SDD
|
0.0312
|
>4
|
|
M36
|
Résistante
|
14,33#177;3,21
|
SDD
|
0.015
|
>4
|
|
M42
|
Sensible
|
16,33#177;0,57
|
S
|
0.015
|
>2
|
|
M45
|
Résistante
|
18#177;1
|
S
|
0.0312
|
>4
|
|
M47
|
Résistante
|
16,33#177;2,30
|
S
|
0.015
|
>4
|
|
M56
|
Résistante
|
17#177;1
|
S
|
0.015
|
>4
|
|
M57
|
Résistante
|
18#177;1,73
|
S
|
0.015
|
>4
|
|
Candida krusei
|
|
|
|
|
|
|
C. krusei ATCC 6258
|
Résistante
|
18#177;1
|
S
|
0.015
|
>16
|
|
C. krusei 05 (054)
|
*
|
*
|
*
|
0.015
|
>8
|
|
M1 3
|
Sensible
|
13#177;1
|
SDD
|
0.0312
|
>16
|
|
M22
|
Résistante
|
11,33#177;0,57
|
SDD
|
0.0312
|
>16
|
|
M30
|
Résistante
|
7,67#177;0,57
|
R
|
0.015
|
>16
|
|
M31
|
Résistante
|
9,67#177;1,15
|
SDD
|
0.015
|
>16
|
|
M32
|
Sensible
|
13,67#177;0,57
|
SDD
|
0.015
|
>16
|
|
M39
|
Sensible
|
14,67#177;1,15
|
SDD
|
0.015
|
>4
|
|
M4 0
|
Sensible
|
7,33#177;0,57
|
R
|
0.0312
|
>16
|
|
M4 1
|
Sensible
|
6,67#177;0,57
|
R
|
0.015
|
>16
|
|
M43
|
Sensible
|
11,67#177;0,57
|
SDD
|
0.015
|
>4
|
|
M44
|
Résistante
|
12#177;1
|
SDD
|
0.0312
|
>4
|
|
M49
|
Sensible
|
9#177;1
|
R
|
0.015
|
>4
|
|
M1 7
|
Sensible
|
9#177;1
|
R
|
0.0312
|
>16
|
|
M18
|
Résistante
|
12,67#177;0,57
|
SDD
|
0.015
|
>16
|
|
M5 0
|
Sensible
|
9#177;0
|
R
|
0.015
|
>2
|
|
Candida famata
|
|
|
|
|
|
|
C. famata V 2
|
Sensible
|
6#177;0
|
R
|
0.015
|
>1
|
|
M9
|
Résistante
|
6,33#177;057
|
R
|
0.015
|
>16
|
|
M1 0
|
Sensible
|
10,67#177;0,57
|
SDD
|
0.015
|
>16
|
|
M1 1
|
Sensible
|
18,33#177;1,52
|
S
|
0.0312
|
>16
|
|
Candida tropicalis
|
|
|
|
|
|
|
C. tropicalis 06(085 )
|
*
|
*
|
*
|
0.015
|
>16
|
|
M28
|
Résistante
|
15,67#177;0,57
|
S
|
0.015
|
>4
|
|
M46
|
Résistante
|
6#177;0
|
R
|
0.015
|
>2
|


Sensible 7,33#177;0,57 R
Sensible 6#177;0 R
Sensible 9,33#177;057 R
14#177;1 S DD
Candida lusitaniae
C. lusitaniae CECT 11458
M1
Candida guilliermondii
M1 4
Saccharomyces cerevisiae
M23 Résistante
0.015 >16
0.015 >1
0.015 >16
0.0312 >4
*MHGBM: gélose Mueller-Hinton Glucose
|
Bleu de Méthylène; ZI: Diamètre de la zone
d'inhibition; DS: Déviation
|
Standard; R: Résistante; S: Sensible; SDD:
Susceptibilité Dose Dépendante; *: Non
testé.
de l'aspartylprotéase présente une
variation intra et inter-espèces (Figure 1
0).
Résultats
|
III. Etude de la
|
virulence des différentes
|
espèces de
|
|
Candida spp. isolées
1. Détermination de l'activité
|
de la phospholipase
|
|
Parmi les 43 souches testées dont
celles isolées à partir de la station de
traitement des
lixiviats de Borj Chakir, 19
souches ont une activité phospholipase
positive (PZ >0,63)
révélée par la présence d'un halo
opaque autour des colonies sur gélose à
base de jaune d'oeuf, 14 souches ont une activité
phospholipase négative (PZ = 1) et 10 souches
ont une activité fortement positive (PZ<0,63).
Les valeurs de PZ qui sont inversement
proportionnelles à la nature de l'activité,
se sont étendues de 0,48 à 0,63 (Figure 9).
A travers notre étude, nous avons aussi
remarqué que la nature de l'activité de cette
enzyme varie d'une souche à une autre d'une même espèce. En
effet, au sein de l'espèce C. albicans, nous
avons décelé deux types d'activité
(négative et positive) .(figure9)
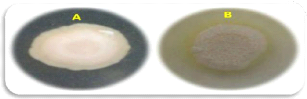
Figure 9. Aspect de l'activité
de la phospholipase sur gélose à base de jaune
d'oeuf. (A):
Souche phospholipase négative;
(B): Souche phospholipase positive.
2. Détermination de l'activité de
l'aspartylprotéase secrétée
L'incubation des colonies de levures pendant 8
jours à 37 °C sur la gélose à base de BSA a
montré que parmi les 43 souches testées, 32 ont
une activité protéase très
élevée (PZ < 0,69), deux ont une
activité élevée (PZ=0,7), trois isolats
ont une activité faible (0,8<PZ<0,89) et 6
présentent une activité très faible ou
pas d'activité (PZ =1). Pour l'espèce la plus
fréquente, C. albicans , les activités
varient de très faible à très élevée
alors que toutes les souches de C. krusei
possèdent une activité
aspartylprotéase secrétée très
élevée.
|
Pendant notre étude, nous
|
avons remarqué que la distribution des
valeurs
|
de l'activité
|
Résultats

Figure 10. Différents exemples
de l'activité de la protéase obtenue sur
gélose à base de BSA.
(A): Absence d'une
activité; (B): Activité faible; (C):
Activité élevée; (D): Activité
très
élevée.
3. Détermination de l'activité de
l'estérase
L'incubation des colonies de Candida
pendant 10 j à 37°C sur l a gélose de
base de Tween 80 à montré que parmi les 43
souches testées, 20 souches ont une activité
estérase négative (PZ) = (1), 12 souches ont une
activité estérase positive (PZ>0.6 3) et 11
souches ont une activité estérase fortement positive
(PZ<0,63).
4. Etude de pouvoir hémolytique
Les résultats ont montré
qu'après 48 h d'incubation sur gélose au sang du
mouton sous atmosphère à 5% CO2, la
plupart des espèces de Candida ont la
possibilité de dégrader l'hémoglobine par
lyse des érythrocytes. Trois différents types
d'hémolyse ont été observés sous
la lumière autour de la colonie ensemencée: le
premier type est caractérisé par un anneau
translucide relatif à une hémolyse de type alpha
et le second type est caractérisé par un halo
verdâtre à noirâtre correspondant à
une béta hémolyse (Figure 11 ). Le dernier type
caractérisent les souches non hémolytiques
(gamma-hémolytiques). En effet, 19 souches sont â
hémolytiques, 17 á hémolytiques et sept
souches sont de type gamma.
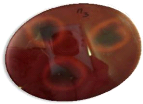
|
Figure 11. Aspect des
|
colonies ayant un pouvoir hémolytique de type â sur
gélose à base de sang de mouton.
|
Résultats
L'ensemble des résultats des
activités enzymatique est résumé dans le
Tableau VII ci -dessous.
Tableau VII. Activités enzymatiques
(phospholipase, estérase et aspartylprotéase) et
pouvoir hémolytique des différentes souches isolées.
Les différentes enzymes hydrolytiques
testées
|
Isolats testés
|
Phospholipase
|
|
Estérase Aspartyl
|
protéase Pouvoir
|
Pz#177;DS Interprétation
Pz#177;DS Interprétation Pz#177; DS
Interprétation (IH)* Type
C. albicans
C. albicans ATCC 2091 0,76#177;0,09
Positive
C.albicans ATCC 90028 0,73#177;0,06
Positive
C. albicans SC 5314 0,86#177;0,015
Positive
M2 0,78#177; 0,41
Positive
M5 1#177;0
Négative
M7 1#177;0
Négative
M8 0,75#177;0,09 Positive
M16 1#177;0
négative
M20 0,71#177;0 Positive
M21 1,18#177;0,01
Positive
M24 0,62#177;0,09 Fortement
positive
M25 0,58#177;0,065 Fortement
positive
M36 0,66#177;0,02
Positive
M42 0,62#177;0,04 Fortement
Positive
M45 1#177;0
Négative
M47 1#177;0
Négative
M56 0 ,58#177;0,01 Fortement
positive
M57 0,57#177;0,08 Fortement
positive
| 

