Introduction
Les lixiviats représentent des effluents d'eaux
fortement polluées issus des centres d'enfouissements
contrôlés. De nos jours une préoccupation des
autorités concernées par la gestion durable des déchets
est accordée.
En Tunisie, les centres d'enfouissements techniques compte 20
décharges contrôlées dont 9 sont en phase d'exploitation.
La forte humidité des déchets en Tunisie (moyenne de 65%) produit
un volume important des lixiviats qui doivent être traitées avant
leurs rejets dans un milieu récepteur. Le stockage des lixiviats
produites des centres d'enfouissement a été la solution la plus
adoptée comme pour le cas de la décharge contrôlée
de Djebel Chakir. La décharge de Djebel Shakir est d'une importance et
particularité nationale. En fait, 40% des déchets produits en
Tunisie sont enfouis dans cette décharge. Jusqu'au nous jours les
lixiviats de cette décharge sont collecté sans traitement dans 13
bassins.
Les souches de Candida isolées des lixiviats
qui sont des effluents toxiques issus des centres de stockage des
déchets de Djébel Chakir figurent parmi les dix micro-organismes
pathogènes les plus fréquemment isolés et sont
responsables de 7% de tous les épisodes fébriles d'origines
infectieuses. Les levures du genre Candida peuvent être à
l'origine de mycoses superficielles ou invasives. Ces dernières sont
responsables d'une lourde morbidité et mortalité chez les
patients immunodéprimés.
L'accroissement du nombre de sujets atteints de candidose,
l'émergence de nouveaux agents pathogènes et la volonté de
diminuer cette morbidité sont l'origine du développement de
nouvelles technologies appliquées au diagnostique, au suivi de maladies
fongiques ainsi qu'au développement de nouvelles molécules
antifongiques. En effet, les biofilm fongiques sont des structures très
résistantes et complexes. Il a été démontré
que l'expression de certaine gènes est induite en fonction de la
colonisation des souches de Candida sur les supports, La formation de biofilm
ainsi que la communication intercellulaire ce qui induit leur virulence, leur
pathogénicité et leur résistance à certains agents
antifongiques.
2
Introduction
Notre rapport comporte une première partie
bibliographique avec un rappel épidémiologique, et l'étude
de caractéristiques biochimiques des souches de Candida spp.
Cette première partie est suivie d'une partie pratique
dont les objectifs sont :
1- Identifier biochimiquement les différentes
espèces de Candida isolées de la station de traitement
des lixiviats (Djébel Chakir).
2- Etudier la virulence des espèces identifiées
(activités des enzymes hydrolytiques et hémolytiques) sur milieux
solides spécifiques et sur galeries Api Zym.
3- Etudier qualitativement et quantitativement la formation
de la biofilm par deux méthodes (XTT et Cristal Violet).
4- Etudier la résistance phénotypique aux
antifongiques (méthode de disque et méthode liquide pour la
détermination des CMIs et CMFs).

SYNTHÈSE
BIBLIOGRAPHIQUE
Synthèse Bibliographique
I. Définition des lixiviats
Les lixiviats, appelés aussi lessivats, percolât
ou « jus de décharge », on désigne« L'eau qui a
percolé à travers les déchets en se chargeant
bactériologiquement et surtout chimiquement de substances tant
minérales qu'organiques. Le lixiviat (ou Percolât) est le liquide
résiduel qui provient de la percolation de l'eau à travers un
matériau.
Ce terme désigne notamment tous les «jus»
issus de décharges, de déchets, de composts, ... etc. Il vient de
l'adjectif latin « lixivius », qui signifie: «de lessive, eau
qui sert à laver». Dans le cas de déchets, le lixiviat se
charge de polluants organiques, minéraux et métalliques, par
extraction des composés solubles (lixiviation facilitée par la
dégradation biologique des déchets) et risque ainsi de provoquer
la pollution de la nappe phréatique. Cette contrainte est
particulièrement importante pour la localisation des décharges.
C'est en fait le résultat du chemin de l'eau qui s'est infiltré,
qui a percolé et ruisselé à travers les déchets
jusqu'à ce qu'elle se retrouve au fond de l'alvéole de stockage.
Il s'agit en quelque sorte du « jus de poubelle ». L'estimation des
taux de génération des lixiviats dans la décharge de Djbel
Chakir a été réalisée à partir de plusieurs
modèles numériques. Elle se base essentiellement sur les
paramètres climatiques lors du calcul des quantités de lixiviats
et le modèle du bilan hydrique qui tient compte des principales
composantes affectant la génération des lixiviats. Ces
composantes font inclure les paramètres climatiques et l'humidité
initiale des déchets.
En Tunisie, la quantité de lixiviats stockée
à Djbel Chakir est estimée à 100000 m3/an soit
270 m3/j qui sont stockés dans 8 bassins ayant une capacité
totale égale à 130000 m3. C'est en grande partie la
nature du lixiviat qui détermine la capacité des mâchefers
d'incinération d'ordures ménagères. La source principale
en eaux d'une décharge vient des précipitations. Il faut
toutefois tenir compte de l'humidité des déchets ainsi que du
niveau de la nappe phréatique qui peut remonter jusqu'à la base
d'une décharge.
1. Mécanisme de formation des
lixiviats
La formation des lixiviats est principalement causée
par l'infiltration directe de l'eau météoritique dans les
déchets qui va se charger en substances polluantes tels que la
matière organique soluble résultant de l'activité
biologique de la décharge (Leclerc et Bonneau) des
constituants inorganiques comme les métaux lourds et des germes qui
peuvent être très
dangereux pour la santé et l'environnement.
Synthèse Bibliographique
2. Composition de lixiviat
Les compositions chimiques et biochimiques des lixiviats sont
non seulement très diverses mais aussi variables dans le temps et dans
l'espace relèvent classiquement quatre types de polluants: (i) la
matière organique dissoute ou en suspension, issue de la biomasse,
exprimée généralement en DCO (les AGV, les substances
humiques et fulviques...); (ii) les micropolluants organiques (hydrocarbures,
composés aromatiques...) ; (iii) les composés minéraux
majeurs sous forme ionique (Ca2+, Mg2+, Na+,
K+ ,NH4+ ,Fe2+) et (iiii) les cations de
métaux lourds à l'état de trace.
D'autre part, les lixiviats peuvent aussi contenir certains
micro-organismes pathogènes. Plus de 200 familles de composés
organiques ont pu être identifiées au cours des nombreuses
études menées sur la caractérisation des lixiviats des
décharges. La composition globale des lixiviats est le plus
fréquemment déterminée grâce à des analyses
physico-chimiques. La qualité physico-chimique dépend de nombreux
facteurs qui sont cités dans les paragraphes
précédents.
3. Type de lixiviat
Suivant le stade d'évolution biologique des
déchets, trois types de lixiviats ont été
distingués.
· Les lixiviats stabilisés (Age de la
décharge > 10 ans)
· Les lixiviats intermédiaires 5 à 10 ans
· Les lixiviats jeunes (Age de la décharge < 5
ans)
Ces lixiviats se caractérisent par une charge organique
élevée biodégradable (très chargé par la
biomasse bactérienne) par rapport à celle de lixiviat
stabilisé.
II. Généralités sur les
Candida
1. Taxinomie et classification
Les Candida sont des champignons microscopiques. Ce
sont des organismes nucléés eucaryotes appartenant au
règne des champignons unicellulaires ou Fungi au phylum des
Ascomycètes, au sous-phylum des Saccharomycotina, de la classe des
Saccharomycètes, de l'ordre des Saccharomycétales, du groupe des
Saccharomycétales mitosporiques et du genre Candida.
Synthèse Bibliographique
Ce sont des organismes hétérotrophes,
constituant un groupe autonome dans le monde vivant indépendant des
bactéries. Ce genre regroupe plus de 200 espèces dont les plus
rencontrées en pathologie humaine sont C.
tropicalis, C. galabrata, C. krusei,
C.
guilliermondii, C. parapsilosis, C. kefyr,
C. dubliniensis et C. albicans. Cette dernière
étant la plus importante et la plus fréquemment
étudiée pour sa pathogénicité (Pfaller,
2006).
2. Morphologie et reproduction 2. 1.
Caractéristiques macroscopiques
L'examen macroscopique des espèces de Candida
cultivées en aérobiose, sur un milieu sélectif dont
le pH varie de 2.5 à 7.5 et à une température de 37°C
montre qu'il s'agit de colonies ovalaires, crémeuses, non
pigmentées et ayant une odeur de levure (Mc Culloudh et al.,
1996).
2. 2. Caractéristiques microscopiques
L'aspect microscopique brut de toutes les espèces de
Candida est semble. Ce sont des levures non capsulées, à
bourgeonnement multilatéral et productrices ou non filaments. Toutes les
espèces de Candida ont la forme de blastopores qui peuvent changer de
l'aspect ovoïde à allongé et même
sphérique (Odds, 1988). Macroscopiquement, C.
albicans apparaît une espèce dimorphique
caractérisée par la transition de la forme levure (blastopore
ovoïdes) à la forme filamenteuse (hyphes parallèles). En ce
qui concerne la taille, on remarque bien une variation entre les
espèces. En effet, la taille de C. albicans est de 2,9 à
7,2 x 2.9 à 14.4 ìm et C. krusei 2.2 à 5.6 x 4.3
à 15,2 ìm. Les cellules de C. krusei apparaissent
allongées et ayant l'aspect de grain de riz. C. kefyr est une
autre espèce médicalement importante ayant un aspect
microscopique semblable à celui de C. krusei
(Samaranayake et Samaranayake, 1994).
2.3. Caractéristiques biochimiques
Le principal caractère biochimique des espèces
de candida est la composition de la membrane cellulaire. En effet , la membrane
cellulaire est formé de 80 à 90% de carbohydrates qui sont des
polymères de glucose (â-glucanes), de
N-acétyl-D-glucosamine (chitine) et des polymères de mannose
associés d'une façon covalente aux protéine
(mannoprotéines), 6 à 25% de protéines et 1 à 7% de
lipides (Chaffin et al .,1998).
Synthèse Bibliographique
Le terme d'enveloppe cellulaire de
peut être défini comme étant l'ensemble de
la membrane plasmique, l'espace péri plasmatique, la membrane cellulaire
et la couche fibreuse associée à la région externe de la
membrane. La membrane plasmique forme une barrière perméable
entre le cytosol de la cellule et l'environnement extérieur. L'espace
péri plasmatique constitue la région entourée par la
membrane cellulaire et la membrane plasmique y compris l'espace
créé par évagination de la membrane. La membrane
cellulaire est essentielle pour la biologie de la biologie de la levure et la
présentation de son contenu cellulaire et aussi pour ses interactions
avec les cellules humaines hôtes (Cannon et Chaffin,
1999).
a. Structure cellulaire
C. albicans est un eucaryote avec un noyau, une
double membrane nucléaire, des chromosomes, des mitochondries et des
inclusions lipidiques. IL existe également dans ces cellules des
activités enzymatiques de type phosphatase, oxydase et peroxydase .la
membrane plasmique est recouverte d'une paroi qui donne à la levure sa
forme et sa stabilité mécanique .Elle est aussi une zone de
contact entre la cellule et son environnement et sa structure varie selon
l'âge et le stade morphologique de la levure (Calderone, 2002).
La paroi est l'élément le plus étudié de
la cellule.
b. Structure générale de la
paroi
La paroi de la levure représente environ 15 à 25
% du poids sec de la cellule. C'est un arrangement ordonné de
différents constituants. Certains sont liés par des liaisons
covalentes alors que d'autre sont retenus dans la paroi par des liaisons
covalentes alors que d'autres sont retenus dans la paroi par des liaisons
hydrogènes, des interactions ioniques, ou encore par des interactions
hydrophiles ou hydrophobes. Différent constituants comme les
polysaccharides, la chitine (N-acétylglucosamine ) et les
protéine constituent cette paroi Une structure rigide de polymère
complexes de glucose (-1,3 et -1,6 glucanes) et de chitine enveloppe la cellule
comme une armure et protège le champignon des stress environnementaux
tels que la pression osmotique ( Ruiz-Herrera,2006).
4. Distribution des espèces de
Candida
Les espèces de Candida sont des organismes
ubiquitaires (Odds, 1988).Ce sont des levures
pathogènes naturellement présentes dans la microflores de
l'être humain et des animaux, commensales du tractus digestif, de la
sphère or pharyngée et de l'appareil vaginal.
Synthèse Bibliographique
Cependant, en présence d'un déséquilibre
de la flore microbienne ou d'un affaiblissement du système immunitaire,
cette levure peut entrainer des pathologies (candidoses) parfois très
sévères. Celles-ci vont de la simple infection superficielle
(buccale et vaginale) à la propagation systémique
(candidémies) pouvant aller jusqu'à la mort (Shepherd et
al., 1985). Les Candida de la flore buccale sont
présentes chez 40% de la population humaine (Mac Farlance et
Samaranayake, 1989). Candida albicans est l'espèce
fongique majoritairement isolée de la cavité orale dont la
principale localisation est la face dorsale de la langue, la muqueuse buccale
et la surface des dents (Arendorf et walker, 1980;
budtz-jorgensen, 2000). Les autres espèces
isolées sont C. glabrata, C. tropicalis, C.
kefyr, C. krusei et C. guilliermondii (Mac
Farlance et Samaranayake, 1989 ; Pfaller, 2006).
4. Epidémiologie
L'épidémiologie des candidoses s'est
considérablement modifiée ces dernières décennies
avec l'apparition de nouvelles espèces (C. dubliniensis). En
effet, le genre Candida représente 83% des levures
isolées chez l'homme dont C.albicans constitue l'espèce la plus
fréquente (52%) vu qu'elle est saprophyte des muqueuses digestives. Les
autres espèces ayant une importance médicale sont C.
tropicalis (11%), C. parapsilosis (8%) et C. krusei (5%)
(Banerjee et al., 1991; Beck-sague et Jarvis, 1993;
klepser et al., 1998). Cependant, de nouvelle données
épidémiologique révèlent que l'incidence des
infections par des espèces de Candida autres que C.albicans telles que
C. glabrata, C. tropicalis, C. parapsilosis et
C. krusei est en voix d'augmentation (Wingard, 1993;
Colombo, 2003).
Les dernières données
épidémiologique montrent que les Candida spp. occupent
la quatrième place des germes isolés des
bactériémies et que les candi demies représentent 9% des
bactériémies nosocomiales (PFaller, 2001) avec
un pourcentage de mortalité allant jusqu'à 40% des cas
(Colombo et Guimarães, 2003). Cette augmentation de
l'incidence des infections fongiques par les espèces de Candida a
souvent été reliée à la déficience du
système immunitaire des patients (Horn et al., 1985;
Wey et al., 1989; Beck-Sague et Jarvis,
1993). De plus, le taux de colonisation de cette levure au niveau de
la cavité orale
augmente avec la sévérité de la maladie et
la durée de l'hospitalisation.
(C) pseudohyphes (Odds, 1998).
Synthèse Bibliographique
III. Facteurs de pathogénicité des
Candida spp.
La virulence de Candida spp. est due
à un ensemble complexe de facteurs. En effet, le genre
Candida possède des caractéristiques
communes à tous les microorganismes pathogènes
tels que la capacité de coloniser et d'envahir
l'ensemble des tissus et des organes de l'organisme, la
capacité de croitre rapidement à 37°C et la
possession d'une paroi cellulaire résistante aux
enzymes de dégradation de l'hôte.
Cependant, le genre Candida possède des
caractéristiques propres comprenant la sécrétion
d'adhésive servant à la reconnaissance de
l'hôte et à l'attachement aux muqueuses, la production
d'enzymes hydrolytiques telles que les phospholipases et les
aspartylprotéases et la variation de la morphologie
assurée par la transition (dimorphisme) entre la forme
levure et la forme mycélienne (Calderone et
Fonzi, 2001).
1. Variabilité morphologique
La cellule fongique peut être
considérée comme polymorphique, C'est-à-dire
qu'elle pourra prendre plusieurs aspects, visibles en
microscopie photonique. Les principaux stades morphologiques
sont le blastopore, la forme pseudo-mycélienne, le tube
germinatif, la forme mycélienne varie et enfin la
chlamydospore (Figure 1). Ces
différents stades morphologiques peuvent être
obtenus pas simple modification des paramètres
environnementaux (Odds, 1988).
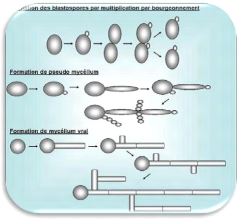
Figure 1. Différentes formes de
croissance des Candida: (A) levure, (B)
Hyphes et
Synthèse Bibliographique
2. Le dimorphisme
Le dimorphisme est la capacité du champignon à
changer de morphologie selon les conditions environnementales. Cette
capacité des souches de Candida à modifier leurs
phénotypes en fonction de l'environnement est un facteur de virulence.
Deux formes principales peuvent être observées, soit la forme
levure ou la forme mycélienne qui a été
considérée comme pathogène, celle-ci étant
observée dans les tissus infectés évitant ainsi les
mécanismes de défense du système immunitaire
(Odds, 1988).
3. Les enzymes
L'activité protéolytique de C. albicans
lui permet d'utiliser les protéines comme seule source d'azote. Les
protéases sont certainement les enzymes de C.albicans les mieux
étudiées. Leurs activité protéolytique est due
à la famille des gènes SAP qui codent pour des Secreted Aspartic
Protéinases (Wi hte et al., 1998). D'autre enzymes sont
sécrétées par C.albicans comme les phospholipases ( PL) et
les lipases .Le terme phospholipase décrit un groupe d'enzymes qui ont
la capacité d' hydrolyser une ou plusieurs liaisons ester des
glycéro-phospholipides. Chez C. albicans, les phospholipases
extracellulaires sont considérées comme des facteurs de
virulence. Différentes sous-classes ont été
détectée chez C. albicans: PLA, PLB, PLC et PLD
(Hube et al., 1998).
4. Adhérence de C. albicans
L'adhérence à des substrats de l'hôte est
essentielle à toute colonisation par un pathogène. La
réussite de la colonisation et de l'infection des tissus de l'hôte
par les espèces de Candida dépend de leur
capacité à adhérer aux muqueuses .Les adhésines de
Candida sont des protéines qui se retrouvent à la surface des
cellules (Chandra, 2001). Les espèces de Candida
sont capables de produire en grandes quantités des exo
polysaccharides ou «slime». Ces dernières sont
considérés un des facteurs de virulences des isolats de Candida
responsable de la dissémination de l'infection chez les organismes
hôtes ainsi que leurs persistance et colonisation au niveau des tissus
(Ramage et al., 2005). La possibilité de production
d'exo-polysaccharides par les souches de Candida spp. peut être
testée sur deux milieux différents : soit par leur croissance sur
gélose au rouge Congo soit par la méthode de coloration à
la
safranine (Davenport et al., 1986).
Synthèse Bibliographique
IV. différents types de candidoses
Les candidoses sont les infections à champignons
levuriformes les plus fréquentes et qui se développent en faveur
de la chaleur et de l'humidité. Elles se manifestent aux mêmes
endroits que les dermatophytoses, mais il existe aussi des formes buccales,
génitales et systémiques (Calderone et Fonzi,
2001). Il y a même eu rapport d'endocardites à C.
albicans (Maertens et al., 2001; Kaloterakis et
al., 2003).
1. Les candidoses cutanées
Les candidoses cutanées sont très
répandues chez l'homme (Hay, 1999). Elles sont
favorisées par l'humidité et la macération, ce qui
explique l'atteinte préférentielle des plis et leur
fréquence chez l'obèse. Elles peuvent résulter de
l'extension d'une candidose digestive ou génitale où l'on
retrouve des facteurs favorisants comme le très jeune âge, le
diabète, la prise d'antibiotique et des corticoïdes.
Il existe également une forme rare de candidoses
appelée la candidose mucocutanée chronique qui touche les
membranes muqueuses, mais qui peut s'étendre à la peau ou aux
ongles .Cette forme de candidoses est associée à des
problèmes de l'immunité cellulaire (Garber,
2001). Des données récentes tendraient aussi à
l'associer avec des déficient sélectives en anticorps
(Kalfa et al., 2003). Les groupes à fort risque de
développer une candidose systématique opportuniste sont donc
composés de patients ayant des atteintes hématologiques malignes
ayant reçu la greffe d'un organe solide et sous une médication
immunosuppressive, ceux ayant reçu une chimiothérapie
immunosuppressive en prévision d'une greffe de moelle et ceux ayant
été victimes de brûlures entraînant le perte de la
protection fournie par la peau (Garber, 2001).
2. Les candidoses vaginales
La candidose vulvo-vaginale (CVV) est l'une des plus
fréquentes infections gynécologique de la femme en période
d'activité génitale (Vasquez, 2002). Ces
dernières années, les CVV dues à des Candida non
albicans tels que C. glabrata, C. tropicalis et
C. krusei occupent une importance croissante. Le rôle des
facteurs hormonaux dans la survenue des CVV est illustré par plusieurs
faits: sa rareté avant la puberté, l'augmentation de sa
prévalence à la fin de la deuxième décennie avec un
pic persistant les deux décennies suivantes. Après la
ménopause, la prévalence de ce type de candidose
décroît. Chez l'homme,
les formes génitales sont les balanites et les
balano-posthites.
Synthèse Bibliographique
3. Les candidoses buccales et digestives
La candidose orale est une infection opportuniste de la
cavité buccale, ayant la plus forte prévalence chez l'humain et
causée par la croissance accélérée des champignons
unicellulaires du genre Candida (Abu-Elteen et Abu-Elteen,
1998). Plusieurs espèces de Candida sont responsables de cette
infection dont C. albicans, C. tropicalis, C.
glabrata, C. pseudotropicalis, C. guillieirimondii,
C. krusei, C. lusitaniae, C. parapsilosis et C.
stellatoidea avec une forte fréquence de C.
albicans (Odds, 1988). La population est en
général porteuse asymptomatique de C. albicans dans une
proportion de 20 à 75% (Farah et al ., 2000).
V. Résistance aux antifongiques
L'apparition de souches résistantes à certains
composés et la gravité des problèmes de toxicité
des antifongiques disponibles commercialement créent une situation
préoccupante dans les domaines de la santé publique. On assiste
au développement d'un secteur de recherche de plus en plus important et
qui semble maintenant s'orienter vers deux approches générales :
la recherche de cibles spécifique aux cellules fongique et
l'étude des mécanismes immunitaires impliqués lors de ce
type d'infection. Ceci pourrait permettre le développement de nouveaux
médicaments ayant moins d'effets secondaires
1. Différent types de
résistance
La résistance aux antifongiques peut être
classée deux catégories: une résistance clinique et une
résistance in vitro (expérimentales). La
résistance clinique signifie un manque de la réponse clinique
vis-à-vis de l'agent antifongique utilisé. Le plus souvent,
l'échec du traitement résultant des faibles concentrations de
l'agent antifongique dans le sérum et le tissus peut être du
à de nombreuses raisons, notamment au choix inadéquat du
médicament. De plus, une des raisons significatives de l'échec du
traitement est l'état immun déficient avancé du patient,
chez qui les fortes doses fongicides de l'agent utilisé sont incapables
d'éradiquer la prolifération et la colonisation de l'agent
pathogène.
Le deuxième type de résistance aux antifongiques
est la résistance in vitro qui peut être divisée en une
résistance primaire et une résistance secondaire.
(Sanglard et Odds, 2002). La résistance primaire,
connue aussi sous le nom de résistance intrinsèque ou
innée, est
Synthèse Bibliographique
produite lorsque l'organisme est naturellement
résistant à un antifongique donné (exemple C. krusei
qui est universellement connue par sa résistance au fluconazole,
Wingard et al., 1991).
La résistance secondaire ou acquise est décrite
lorsque l'isolat responsable de l'infection devient résistant à
l'agent antifongique suite à des mutations et une surexpression de
certains gènes (Sanglard et Odds, 2002). Cette forme de
résistance qui était rare durant les années
précédentes, est devenue de nos jours fréquemment
reportée chez les patients infectés par le SIDA et qui souffrent
d'une résistance accrue des candidoses oropharyngées et
oesophagiques au groupe des azoles (Johnson et al.,
1995; Kitchen et al., 1995). Actuellement, les seules
résistances connues avec une fréquence non négligeable
sont celles concernant la résistance à la 5-fluorocytosines et au
fluconazole. C. glabrata qui résistante pour 20% des isolats
(Pfaller, 2002; Pfaller, 2006) et C.
krusei qui est génétiquement résistante.
VI. Les biofilm fongiques
Les biofilm sont des structures tridimensionnelles de
micro-organismes qui se développent sur différents supports. En
ce qui concerne les levures du genre Candida, ces micro-organismes peuvent se
développer sur les cathéters ou encore sur des prothèses
(Donlan, 2001a; Donlan, 2001b;
Douglas, 2003). La formation du biofilm par les levures
pathogènes du genre Candida a été identifiée comme
un problème médical important du fait
que ces structures complexes sont de plus en plus
impliquée dans les pathologies
nosocomiales chez des population
à risque comme les patients immunodéprimés
(Khardori, 1995; Baillaie et Douglas,
1999a; Chandra et al., 2001a).
1. Structure d'un biofilm
L'organisation générale d'un biofilm de
Candida est similaire à celle du biofilm bactérien mais
le détail dans la composition d'un biofilm de Candida réside au
fait que sa structure est fortement dépendante des conditions de
formation du biofilm (Costerton, 1999). Cette
plasticité de structure suggère que l'architecture du biofilm
à Candida formé chez l'homme (hôte) peut aussi
varier selon la nature des implants sur lesquels il se développe et
leur localisation (Kumamoto, 2002) laissant
envisager des mécanismes de régulation
génétique
hautement spécifiques, dépendants de la réponse au contact
avec la surface
(Douglas, 2003).
Synthèse Bibliographique
2. Propriétés du biofilm
Les organismes qui croissent au sein d'un biofilm ont des
propriétés qui distingues des cellules planctoniques .Ces
caractéristiques incluent :
- La protection : lorsque la structure ou le phénotype
du biofilm protège les microorganismes des défenses de
l'hôte, des agents de traitement, de la dessiccation, des fluides
hydrodynamiques et des forces mécaniques.
- Les différences des expressions phénotypiques
et des caractéristiques de croissance. - La compétition et les
échanges des nutriments : augmentation des concentrations des
nutriments, hétérogénéité
microbienne et environnementale pour assurer le flux des
nutriments.
- Communication intercellulaire et inter espèces
(Kumamoto, 2002; Chen et al., 2004).
3. Développement du biofilm à
Candida
La formation du biofilm candidal répond aux mêmes
étapes que celle d'un biofilm bactérien, toutefois lors de la
phase de colonisation, une modification morphologique est observée
caractérisée par l'apparition de filaments appelés hyphes
(Figure 2). La formation de biofilm inclue l'adhésion
irréversible des cellules planctonique aux surfaces, la croissance et la
sécrétion de polymères extracellulaires (formation de
biofilm mature) et enfin le détachement des cellules (Smith et
al., 2003).
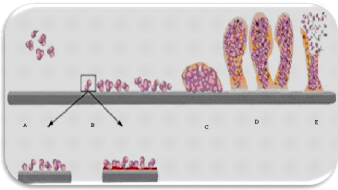
Figure 2. Schéma d'un biofilm
formé aux surfaces polymérique. (A): Cellule
planctonique,
(B): Attachement à la surface et formation de membrane cellulaire,
(C):
Prolifération cellulaire et production de polymères
extracellulaires, (D): maturation du
biofilm, (E): Détachement des
cellules.
Synthèse Bibliographique
4. Facteurs favorisant le développement d'un
biofilm à Candida
Il est à noter que la nature chimique de la surface
influence à la formation du biofilm. En effet, les surfaces comme le
latex favorisent cette formation, tandis qu'elle apparaît plus difficile
sue des surfaces de polyuréthane ou de silicone (Hawser et
Douglas, 1994). L'hydrophobicité de la surface semble
positivement corréler avec la formation du biofilm (Li et al.,
2003). Aussi, les conditions environnementales comme les turbulence
rencontrées dans les cathéters vasculaire ou urétraux
favorisent la croissance de la levure au sein d'un biofilm
(Hawser et al., 1998a; Kojic et
Darouiche, 2004).

MÉTHODOLOGIE
&
PROTOCOLES
Méthodologie & Protocoles
I-Description du site d'étude
C'est la première et la plus grande
décharge contrôlée en Tunisie
utilisée pour la récupération des déchets
des quatre gouvernorats du grand Tunis (Tunis, Ben Arous,
Ariana et Mannouba) qui a été crée en 1993 dans un
programme national de gestion des déchets
solides et mise en fonctionnement en 1999. La
décharge de Djbel-Chakir est située à 10
Km au Sud Ouest de la ville de Tunis d'une superficie
égale à environ 47 ha bâtie sur une
surface totale de 124 ha. Elle reçoit 2000 tonnes de
déchets/jour dont 68% des déchets organiques. La
production des lixiviats est de 270
m3.j-1. Ces lixiviats sont stockés dans 13
bassins avec une
|
capacité totale de 300 000 m3
|
(Figure 3).
|

Figure 3. Photo aérienne du
centre d'enfouissement technique de Djbel- Chakir et l
es bassins de stockage des lixiviats.
Après la réception des déchets, les camions
poubelles déversent leurs cargaisons dans les
alvéoles qui sont l'origine du lixivat jeune. Le traitement des
lixiviats (Figure 5) passe par plusieurs étapes.
L'échantillonnage a été fait au
départ à partir de deux bassins de stockage des
lixiviats: lixiviats jeunes (E8), lixiviats âgées (E6). A
l'arrivé des l ixiviats brutes (E1)
mélangées 2/3 jeunes et 1/3 âgées à la
station de traitement collective, elles passent par plusieurs
processus d'épuration. D'abord, les lixiviats brutes
subissent une filtration à sable qui est dans notre cas
non fonctionnelle, ensuite, traitées par l'acide
sulfurique à 98% suivi par un filtre à cartouche
(E2 ). Puis, les lixiviats passent par un système
d'ultrafiltration par osmose inverse de trois étages:
1er étage (E10), 2éme étage (E9) et
3éme étage (E3) qui s'effectue
à travers des membranes mi croporeuses retenant les
particules dont la taille est comprise entre 0,1 et 0,001 um
et qui ne laissent passer que les molécules d'eau.
Une fois le traitement
Méthodologie &
Protocoles
achevé, on obtient deux phases : le
concentrât (E4) qui va entrer de nouveau dans le cycle
de traitement, et le perméat épuré (E7)
qui est rejeté au niveau de l'embouchure de l'oued El
Attar (E5).

|
Figure 4. Unité de
traitement des lixiviats de la décharge de Djebel
|
-Chakir.
|
| 


