II.2.5 L'élimination des ions par résines
échangeuses d'ions
L'extraction solide-liquide se fait par des résines
synthétiques et celle liquide-liquide par des solvants organiques.
L'échange d'ions est la même que celle de l'extraction par
solvant, mais dans l'échange d'ions, les résines organiques sont
basées sur une matrice en polystyrènes et opère en fixant
le lit des solides dans une série des réacteurs [11]. Le
débit d'échange d'ions est strictement limité par le temps
de séjour. Ce mode de précipitation est la meilleure pour
purifier la solution de cobalt.
II.2.6 Précipitation par cristallisation
Cette méthode d'extraction est basée sur la
différence de solubilité des sels en fonction de la
température [17].
Par un refroidissement de la solution, la cristallisation de
certains métaux sous forme de sels s'effectue.
Une cristallisation partielle est effectuée par
évaporation ; on obtient ainsi des cristaux riches en sels insolubles et
une solution composée principalement de corps solubles. Cette
opération doit être répétée jusqu'à
l'obtention de composés purs.
La cristallisation nécessite donc une succession
d'opérations qui rend son coût prohibitif et a été
remplacée par l'extraction par solvant ou l'échange d'ions
[17].
II.2.7 Précipitation d'un composé insoluble
ou précipitation chimique
La précipitation est une opération analytique
consistant à faire passer un ion sous forme d'un composé peu
soluble appelé précipité [4].
Dans cette méthode, les composés insolubles du
métal désiré peuvent être formés par addition
d'agent précipitant, par élévation de pH de la solution
grâce à l'ajout d'une base.
Par cette méthode, nous pouvons précipiter des
hydroxydes, sulfures, carbonates, phosphates, arséniates, etc... [8]
La précipitation joue un rôle très
important dans les processus
hydrométallurgiques. Elle est utilisée comme un
moyen de séparation pour récupérer les métaux de
leur solution. Durant le processus de lixiviation, hormis le métal
valorisable, certains
Projet Multidisciplinaire_Groupe 6
Page | 9
autres métaux peuvent entrer en solution. Il est
essentiel que ces métaux précipitent et soient
éliminés de la solution pour qu'enfin soit
récupéré le métal valorisable [4].
a. Principe de formation d'un
précipité
La formation d'un précipité est régie par
la loi suivante : le produit des concentrations des ions dans la solution doit
être au moins égal au produit de solubilité de la substance
pour cette température [4].
Autrement dit, le produit de solubilité
théorique doit être inférieur ou égal au produit de
solubilité pratique ou quotient de solubilité.
KS = QS (II.10)
avec KS: produit de solubilité théorique ;
QS: produit de solubilité pratique ou quotient de
solubilité.
La solubilité est la concentration d'une solution
saturée à une température donnée. Elle correspond
à la quantité maximum de soluté que l'on peut dissoudre
dans une quantité déterminée de solvant. La
solubilité s'exprime en g/L ou en mol/L.
Le produit de solubilité est le produit des
concentrations des ions dans une solution saturée d'un
électrolyte peu soluble, lesquelles concentrations sont affectées
chacune d'un exposant égal à l'indice de l'ion dans la
molécule.
Le produit de solubilité est constant à une
température déterminée.
Trois cas distincts sont à envisager pour un
électrolyte de type AxBy dont la réaction peut s'écrire
:
AxBy ? xA"- + yBm+ (II.11)
Ks < [A"-] x[Bm+]y : La
solution est dite insaturée ; Ks = [A"-]x[
Bm+]y : La solution est dite saturée ; Ks >
[A"-]x[ Bm+]y : La solution est dite
sursaturée.
C'est lorsque la solution est saturée qu'il y a formation
d'un précipité du
composé.
Page | 10
b. Quelques phénomènes rencontrés
lors d'une réaction de précipitation
b.1 la coprécipitation
La coprécipitation est le dépôt de la
substance principale avec des substances étrangères qui ne
précipitent pas avec le réactif employé dans des
conditions expérimentales déterminées [13]. A titre
d'exemple, l'addition d'acide sulfurique à une solution chlorhydrique
d'ions Ba2+ et Fe3+ précipite le sulfate de baryum
mais également le sulfate de Fer (III) généralement
soluble dans l'eau. Ainsi donc, la coprécipitation est une source
d'erreur très importante en gravimétrie.
b.2 L'adsorption
L'adsorption est la fixation d'ions ou des molécules
à la surface d'un précipité. Par exemple, le
précipité de chlorure d'argent formé lors de l'addition
d'une solution de nitrate d'argent à une solution de NaCl adsorbe les
ions Ag+ en excès. Les ions ou les molécules
adsorbés sont éliminés par lavage du précité
[13].
b.3 L'occlusion
C'est l'emprisonnement des particules
coprécipitées à l'intérieur des particules du
précipité principal. Pour éliminer les particules
occluses, il faut dissoudre le précipité dans un solvant
approprié [13].
c. Précipitation des hydroxydes, des phosphates,
des arséniates et des sulfures c.1 Précipitation des
hydroxydes
La précipitation sélective des hydroxydes des
métaux par variation de pH est peut être la méthode la plus
utilisée pour l'élimination de certains métaux des
solutions de lixiviation impures [5].
La précipitation dépend grandement du produit de
solubilité de l'hydroxyde.
Les valeurs de pH auxquelles les différents hydroxydes
commencent à précipiter des solutions peuvent être
déterminées de la manière suivante :
Projet Multidisciplinaire_Groupe 6
Pour un hydroxyde du type Me(OH)n, la
réaction peut s'écrire :
Projet Multidisciplinaire_Groupe 6
Page | 11
Me(OH)n ? Men+
+ n OH- (II.12)
Ks= [Men+][ OH-]n (II.13)
log Ks = log[Men+] + n log[OH-]
(II.14)
Nous trouvons finalement :
Ks
pH = 14- 1 log
(II.15)
n [Me??+]
où Ks est le produit de solubilité, fonction de la
température et [Mn+] est la concentration en ions
métalliques.
Le diagramme de précipitation des hydroxydes des
métaux est donné à la figure II.1 [5]; il permet d'estimer
les solubilités théoriques des hydroxydes des métaux pour
une valeur donné de pH.
Sur ce diagramme, nous pouvons lire l'ordre de
précipitation des hydroxydes des certains métaux en fonction du
pH croissant.
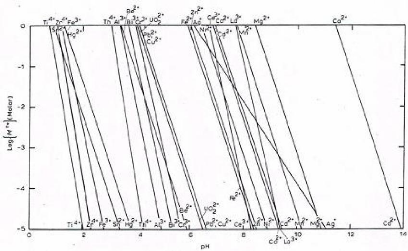
Figure II.1. Diagramme de solubilité des hydroxydes
des métaux en fonction de la concentration molaire et du pH
Projet Multidisciplinaire_Groupe 6
Page | 12
Les réactifs utilisés dans ce procédé
de purification sont la chaux, le calcaire, la soude caustique... Dans la
métallurgie du cuivre, la chaux reste l'agent le plus utilisé
[8].
Les valeurs de pH de début de précipitation des
certains hydroxydes sont données dans le tableau II.1. Nous pouvons
remarquer que la séparation des certains métaux est difficile ;
c'est pour le cas par exemple du cuivre et du zinc.
Tableau II.1-Valeurs de pH de précipitation de
certains hydroxydes [5].
pH Ion métallique
3 Sn++, Fe+++, Zr++++
4 Th++++
5 Al+++
6 Zn++, Cu++,
Cr+++
7 Fe++
8 Co++, Ni++,
Cd++
9 Ag+, Mn++,
Hg++
11 Mg++
c.2 Précipitation des sulfures
La précipitation des sulfures des métaux se
produit à des pH caractéristiques des sulfures à obtenir.
L'ordre suivant lequel les sulfures précipitent avec l'augmentation du
pH est de sulfures de : arsenic, mercure, argent, cuivre, bismuth, cadmium,
plomb, étain, zinc, cobalt, nickel, fer, manganèse [5].
Les sulfures de Hg(III), As(III), Sb(III), Sn(IV), Pb(II),
Bi(III), Cd(III) et Cu(II) précipitent dans les solutions acides ; par
contre les sulfures de Fe(II), Zn(II), Ni(II), Co(II) précipitent dans
les solutions faiblement acides ou neutres. Le premier groupe des métaux
est précipité sous forme des sulfures à pH entre 1.0 et
2.5 alors que le second donne ses précipités a pH
supérieur à 4 mais inférieur à 4.3 de
préférence [8].
Pour un sulfure du type MeS, nous aurons en solution aqueuse
MeS ? Me2+ + S2- (II.16)
Projet Multidisciplinaire_Groupe 6
Page | 13
Le produit de solubilité peut s'écrire :
Ks = [Me2+][S2-] (II.17)
log Ks = log [Me2+] + log [S2-] (II.18)
Pour le système de sulfure, on assume que les solutions
soient en équilibre avec du H2S gazeux, et l'équilibre
impliqué est [5] :
H2S(g) ? 2H+ + S2-
(II.19)
Kp est la constante d'équilibre de cette
réaction
Ainsi, la relation entre pH et l'activité ionique de
sulfure est donnée par la
relation:
log [S2-] = 2pH +
log????2??+ log Kp (II.20)
Nous pouvons ainsi relier le pH de précipitation des
sulfures avec la concentration en ions métalliques en combinant les
relations (II.18) et (II.20), nous obtenons alors
pH = 1 ????
2 (?????? ([????2+]*????2??*????))
(II.21)
Le diagramme de précipitation des sulfures des
métaux est donné à la figure II.2 ; il permet d'estimer
les solubilités théoriques des sulfures des métaux pour
une valeur de pH donné et d'activité en ions S2-.
Projet Multidisciplinaire_Groupe 6
Page | 14
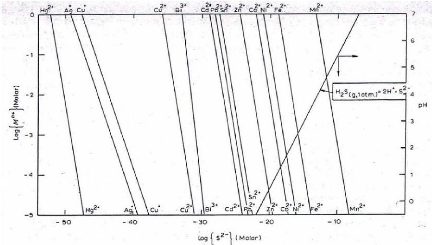
Figure II.2. Diagramme de précipitation des sulfures
des métaux en fonction de la concentration molaire en sulfure, en ion
métallique ainsi que du pH [5]
Dans ce procédé, on peut utiliser plusieurs
agents sulfurants dont le sulfure de calcium (CaS), le sulfure de sodium
(Na2S), le sulfure d'hydrogène (H2S), l'hydrogénosulfate de
sodium (NaHS) [8].
c.3 Précipitation des phosphates et
arséniates
Comme pour les hydroxydes et les sulfures, la
précipitation des phosphates et arséniates est gouvernée
par le produit de solubilité du composé et le pH [10].
Pour le système d'arséniate, la dissociation de
l'acide arsénique est considérée comme la source d'ions
arséniates. Les équilibres impliqués sont :
K13
H+ + H2As04 # H3AsO4 (II.22)
K12
H+ + HAs04- # H2As04 (II.23)
K1
H+ + As04- # HAs04- (II.24)
L'équilibre généralisé sera alors
:
/31n
nH+ + As04- # HnAs043-n)- (/31n
= K1.K12...K1n) (II.25)
Projet Multidisciplinaire_Groupe 6
Page | 15
La relation qui lie le pH à l'activité de l'ion
arséniate dans le cas des arséniates des métaux est
donnée par :
log [As??43-] = log [HnAs??4
(3-??)-] + npH- logâ1n (II.26)
|
D'où pH= 1 (?????? [??????4
3-]*??1??
?? [??????????4 (3-??)-]
|
) (II.27)
|
Le même raisonnement peut être appliqué aux
phosphates des métaux !
Les figures II.3 et II.4 reprennent les diagrammes de
précipitation des arséniates et des phosphates des métaux
pris à 25°C [5]. Ils permettent d'estimer les solubilités
théoriques des arséniates et phosphates des métaux pour
une valeur de pH donné et d'activité en ions
As??43- ???? ????43-.
Projet Multidisciplinaire_Groupe 6
Page | 16
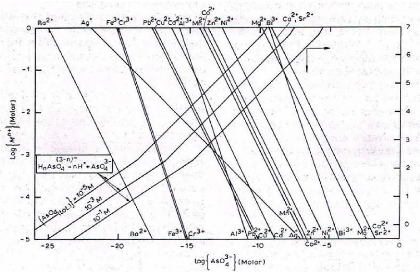
Figure II.3. Diagramme de précipitation des
arséniates en fonction de la concentration molaire des ions
métalliques, des arséniates et du pH.
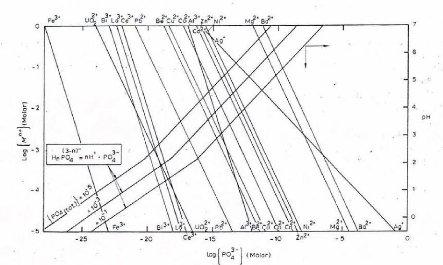
Figure II.4. Diagramme de précipitation des phosphates
en fonction de la concentration molaire des ions métalliques, des
phosphates et du pH.
Projet Multidisciplinaire_Groupe 6
Page | 17
| 


