CHAPITRE III: DIAGRAMMES DE POURBAIX DES SYSTEMES
Cu-H2O, Zn-H2O, Fe-H2O et S-H2O
III.1 Introduction
Dans une solution, il peut s'établir une succession
d'équilibres entre différentes espèces et le calcul de
leurs concentrations peut être relativement complexe. Pour
résoudre ce problème, les chimistes ont établi de nombreux
diagrammes d'équilibres thermodynamiques. Leur utilisation permet de
prévoir les réactions thermodynamiquement possibles lorsque l'on
met en présence différents réactifs ou solutions et de
connaître les espèces prédominantes une fois les
équilibres établis [1].
Les diagrammes potentiel-pH présentent
l'évolution du potentiel standard des couples redox en fonction du pH
pour différentes valeurs du logarithme décimal des concentrations
des espèces dissoutes. Ces diagrammes sont tracés à la
température de 25°C.
III.2 Diagramme de Pourbaix du système
cuivre-eau
Dans le diagramme du système cuivre-eau à
25°C [6], nous remarquons que le cuivre sous forme Cu2+ est
stable à des pH acides et en milieu oxydant. D'une façon
générale, il faudrait des conditions acides et oxydantes pour
rompre l'équilibre afin d'obtenir les ions cuivriques, les conditions
acides sont suffisantes pour se retrouver dans le domaine de stabilité
de Cu2+.
Pour obtenir l'hydroxyde de cuivre, il nous faudrait des
conditions peu acides ou basiques et oxydantes.
La précipitation des ions Cu2+ sous forme
d'hydroxyde se fait suivant la réaction ci-dessous :
Cu2+ + 2H2O = Cu(OH)2 + 2H+ (III.1)
log [Cu2+] = 9,21 -2pH (III.2)
Projet Multidisciplinaire_Groupe 6
Page | 18
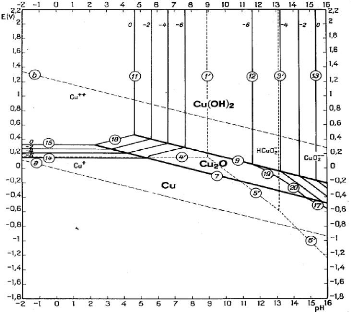
Figure III.1. Diagramme E-pH du système Cu-H2O
tracé à 25°C. Les droites (a) et (b) délimitent le
domaine de stabilité de l'eau.
III.3 Diagramme de Pourbaix du système
zinc-eau
Dans le diagramme du système zinc-eau, nous retrouvons
les ions zinciques (Zn2+) dans le domaine des pH acides et des
potentiels légèrement réducteurs et oxydants.
La réaction entre l'oxyde de zinc et les ions
H+ conduit à la solubilisation du zinc et l'obtention des
ions zinciques selon l'équilibre suivant [6] :
ZnO + H+ = Zn2+ + H2O (III.3)
log [Zn2+] = 10,96 - 2pH (III.4)
La précipitation des ions zinciques sous forme
d'hydroxyde s'obtient par la réaction suivante :
Zn2+ + 2H2O = Zn(OH)2 + 2H+ (III.5)
log [Zn2+] = 12,26 -2pH (III.6)
Projet Multidisciplinaire_Groupe 6
Page | 19
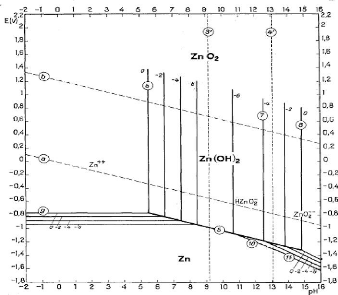
Figure III.2. Diagramme E-pH du système Zn-H2O
tracé à 25°C. Les droites (a) et (b) délimitent le
domaine de stabilité de l'eau.
III.4 Diagramme de Pourbaix du système
soufre-eau
Tous les corps de nombre d'oxydation intermédiaire
entre les extrêmes -2 (sulfures) et +6 (sulfates), hormis le nombre
d'oxydation 0 présenté par le soufre solide, sont
thermodynamiquement instables et tendent à se dismuter. Ainsi, les
thiosulfates, les hydrosulfites, les sulfites et les polythionates sont en faux
équilibre en présence de solutions aqueuses; d'autre part, les
persulfates sont thermodynamiquement instables en présence d'eau. Si les
équilibres étaient réalisés, on ne devrait trouver
en solution que H2S, HS-, S2-, S,
HSO4-et SO42-
[6].
Projet Multidisciplinaire_Groupe 6
Page | 20
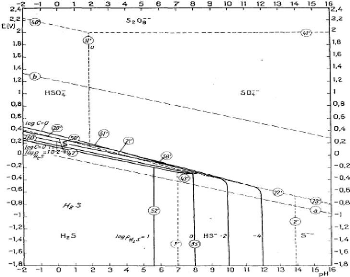
Figure III.3. Diagramme E-pH du système S-H2O
tracé à 25°C. Les droites (a) et (b) délimitent le
domaine de stabilité de l'eau.
| 


