I)-L'uridine monophosphate kinase d'Escherichia coli
(UMPKeco)
Les nucléotides sont essentiels à tout
processus vivant. Les enzymes responsables de leur
synthèse constituent depuis plusieurs années
la cible de médicaments antiviraux, antibactériens et
antiparasitaires. Parmi ces enzymes figurent les nucléosides
monophosphate kinases (NMPK).
A-Les NMPK
1-Définition et Rôles biologiques
: Les NMPK sont ubiquitaires, elles représentent une
famille de protéines globulaires relativement homologues du point de
vue structural et catalytique (Yan & Tsai,
1999). Ces enzymes catalysent la phosphorylation
réversible d'un nucléoside monophosphate (NMP)
en un nucléoside diphosphate (NDP) en
présence de Mg2+, le phosphate transféré
provient d'un nucléoside triphosphate (NTP)(Noda, 1973),
[réaction ci-dessous]. Le principal donneur de phosphate
est l'ATP, mais ce n'est pas le seul possible : la
spécificité des NMPK vis-à-vis des donneurs de
phosphate n'est pas très étroite.




Phosphorylation réversible des NMP
NMP + ATPMg2+
NMPK
NDP + ADPMg2+
N est une base azotée : A, G, T, U ou
C
Cette étape métabolique est critique dans la
synthèse des NTP. Ces derniers jouent plusieurs
rôles au sein de la cellule (Vonrhein et al, 1995)
:

ils sont les précurseurs dans la synthèse des
acides nucléiques et des phospholipides ;
 ils
interviennent dans la signalisation cellulaire ; ils
interviennent dans la signalisation cellulaire ;
 ils
jouent un rôle dans le cycle : polymérisation /
dépolymérisation des microtubules ; ils
jouent un rôle dans le cycle : polymérisation /
dépolymérisation des microtubules ;
 ils
constituent une source importante d'énergie cellulaire ; ils
constituent une source importante d'énergie cellulaire ;
 ils
entrent dans la structure du site actif de certaines coenzymes. ils
entrent dans la structure du site actif de certaines coenzymes.
L'échange du phosphate est facilité par
les chaînes très conservées d'arginine ; les NMPK
suivent une cinétique du type bi-bi aléatoire
: ceci implique l'existence de trois formes : libre (sans
substrats), semi fermée (avec le NTP ou le NMP) et
fermée (avec le NTP et le NMP). Le 1er substrat
fixé peut être indifféremment le NTP ou le
NMP.
Les NMPK sont au nombre de 4 chez les eucaryotes (AMP, GMP, TMP
et UMP/CMP kinases) et de 5
chez les procaryotes (AMP, GMP, TMP, UMP et CMP kinases)
(Dreusicke et al, 1988 ; Zhou et al,
1998) (Figure 4). Chez
les eucaryotes l'UMP/CMP kinase phosphoryle avec la même
efficacité l'UMP et la CMP, par contre les chez bactéries
se sont deux enzymes distinctes qui assurent cette fonction. Ces CMP
et UMP kinases bactériennes ont une spécificité et
une structure différentes de celles de leurs homologues
eucaryotes. Cela en fait des cibles attractives pour la recherche et
la
conception de nouveaux antibactériens.
Etude cristallographique de l'UMPKeco et de la
CKOm
Phosphorylation des nucléotides
Chez les procaryotes : une NMPK pour chaque
NMP
NMP
AMP GMP dTMP
UMP
CMP
dCMP
AMP
kinase
GMP
kinase
TMP
Phosphorylation des nucléotides
Chez les procaryotes : une NMPK pour chaque
NMP
AMP GMP dTMP UMP CMP dCMP
AMP GMP TMP UMP kinase UMP/CMP CMP
kinase
kinase kinase kinase bactérienne kinase
bactérienne
eucaryote
ADP GDP UDP CDP
RR RR RR RR
dADP dGDP dTDP dUDP dCDP
Phospho- rylation
oxydative, Nucléoside diphosphate kinase
Glycolyse
...
dATP dGTP dTTP dUTP dCTP
ATP GTP UTP CTP
RR : Ribonucléoside
diphosphate Réductase
NDP dNDP RR




kinase
UMP kinase bactérienne
UMP/CMP
kinase eucaryote
CMP kinase bactérienne
NMPK
ADP GDP
UDP
CDP
RR RR
RR RR
dADP
dGDP
dTDP
dUDP
dCDP
NDP
Phospho-
rylation oxydative, Glycolyse
...
Nucléoside diphosphate kinase
NDPK
dATP
dGTP
dTTP
dUTP
dCTP
ATP GTP
UTP
CTP
NTP
RR : Ribonucléoside
diphosphate Réductase
NDP dNDP RR
Figure 4 : Les NMPK et la phosphorylation des
NMP
La production de NTP dans la cellule à
partir des NMP passe par deux étapes : (1)
phosphorylation
des NMP en NDP par des NMPK spécifiques ;
(2) transformation des NDP en NTP par la NDPK non
spécifique de chaque base azotée.
2-Structure 3D : Les NMPK partagent la
même structure 3D globale comprenant trois domaines : le
domaine CORE, le domaine LID et le domaine NMPbind
(Figure 5). Le domaine CORE, rigide et très
conservé, comporte un feuillet â à cinq brins
parallèles, des hélices á (généralement au
nombre de 8 ou
9) et une P-loop. Le domaine LID (flexible) joue le rôle
de « couvercle » en venant recouvrir le site donneur
de phosphate, permettant l'échange du phosphate ã à l'abri
des molécules d'eau. Le domaine flexible NMPbind lie l'accepteur de
phosphate. (Yan & Tsai, 1999).
B-L'UMPKeco : modèle intéressant de la
régulation enzymatique et cible potentielle de
nouveaux ATB
1-Une NMPK atypique : Avec un point
isoélectrique (pI) de 7,24 et une MM de 156 kDa (28,5kDa / sous
unité), l'UMPKeco représente environ 0,05 % des protéines
totales d'E. coli. Elle est codée par le gène pyrH
découvert en 1992, ce gène très conservé est
propre aux bactéries est sans homologue chez
les eucaryotes (Serina et al, 1995). L'UMPKeco
ne présente aucune similarité significative de
séquence ou de repliement avec les autres NMPK. Elle ressemble
d'avantage aux aspartokinases (30 % d'identité de séquence),
et à un degré moindre (moins de 20% d'identité)
à la N-acétyl glutamate kinase (NAGK) et la carbamate kinase
(Bucurenci et al, 1996). Elle est présente dans le cytoplasme
et près de la membrane bactérienne.
2-Structure 3D et propriétés
catalytiques : A la différence des NMPK classiques,
généralement monomériques [sauf la TK qui est
homodimérique : Haouz et al, 2003], l'UMPKeco est
hexamérique
(Serina et al, 1995). La régulation de son
activité et assez complexe (Figure 6) :
(1) l'UTP est un inhibiteur, cette inhibition est
levée par des concentrations élevées de Mg2+
(2) le GTP agit comme
un activateur allostérique, il se fixe
sur un site allostérique distinct du site actif, indépendamment
de
Mg 2+ (Briozzo et al,
2005).
Une propriété de l'UMPKeco, qui a
empêché pendant plusieurs années la détermination de
ses structures cristallographiques, est sa très basse solubilité
: < 0,1 mg de protéines/ml (Bucurenci et al,
1996).
Nucléoside monophosphate kinases
NMP + ATP-Mg2+ NDP + ADP-Mg2+
Domaines flexibles
LID
NMP-bind
NMP kinases
ADP NMP



-P-
Domaine rigide
- Courtes : AMPK eucaryotes, GMPK, TMPK, UMP/CMPK eucaryotes
Insert
CORE
-Les AMPK des bactéries, plantes et
mitochondries ont un insert supplémentaire dans le
LID
- Longues : AMPK des bactéries, plantes et mitochondries :
grand LID avec insert
CMPK et GMPK ont un NMPbind plus long
-Les CMPK bactériennes et GMPK ont un insert au
niveau du NMP bind
Figure 5 : Les trois domaines des
NMPK.
Toutes les NMPK ont un repliement de base similaire,
organisé en trois domaines. Un domaine
principal et central CORE qui est rigide et qui contient la
P-loop. Un domaine LID et un domaine
NMPbind qui se referme sur le site de
l'accepteur du phosphate.
Excès de NTP
puriques : A et G
Excès de NTP
puriques : A et G
Excès de NTP
Excès de NTP
pyrimidiques : C, T et U
pyrimidiques : C, T et U
GTP
Activation
UTP
?? Inhibition
Allostérique
Allostérique
Site allostérique C
UMPK Bactérienne
ompétitif
Site allostérique
Compétitif
de P




















UMPK Bactérienne
neur de P P Site accepteur
Site don
Site donneur de P
P Site accepteur de P
ADP
ATP UMP
UDP
Figure 6 : L'UMPKeco / impliquée
dans la synthèse de novo des nucléotides
pyrimidiques
Figure 6 : Régulation de
l'activité de l'UMPKeco
3-Rôles : L'UMPKeco est essentielle
à la croissance bactérienne, elle est indispensable à la
synthèse
des nucléotides pyrimidiques en catalysant la
transformation spécifique de l'UMP en UDP. Les CMP
et UMPK bactériennes n'ont pas d'équivalents
chez l'homme, des inhibiteurs pourraient être conçus pour inhiber
ces enzymes et bloquer ainsi la croissance bactérienne, sans
pour autant entraîner des effets secondaires chez le malade.
Cependant, des E. coli sans activité CMPK restent viables
(Fricke et
al, 1995). Ceci s'explique par le fait que ces
bactéries peuvent produire le CTP à partir de l'UTP
grâce
à la CTP synthétase. Au contraire,
l'UMPK est essentielle à la croissance bactérienne et constitue
de
ce fait une cible privilégiée pour la
recherche et la conception (« drug design ») de nouveaux
antibiotiques (ATB) (Kholti et al, 1998 ; Fassy et al,
2004).
En plus de son rôle dans la conversion de l'UMP en UDP,
l'UMPKeco participe à la régulation
de la transcription et joue très probablement un
rôle dans la division des cellules bactériennes (Londais
et al, 1999).
4-Contexte et objectifs du stage :
Avant 2005, il n'existait aucune structure 3D de l'UMPKeco
(faible solubilité / cristallogenèse impossible). Après la
découverte par A.-M. Gilles et al du mutant ponctuel soluble
qui a les mêmes caractéristiques catalytiques que l'enzyme sauvage
: mutant D159N.
P. Briozzo et al ont résolu sa structure 3D
sous différentes formes : avec l'UTP / inhibiteur,
l'UMP / substrat naturel et l'UDP / produit
(Figures 7 & 8). Le caractère hexamèrique et
le repliement de son monomère distinguent l'UMP kinase d'E. coli
des autres NMPK. La structure avec l'UTP montre de
manière surprenante que ce nucléotide se
fixe sur le même site accepteur de phosphate que l'UMP et l'UDP (c'est la
première fois qu'un NTP est retrouvé sur ce site). Cela
suggère fortement que l'UTP
est un inhibiteur compétitif, et pas
allostérique comme il a été décrit par les auteurs
travaillant sur les NMPK. En conséquence, seule la structure avec
GTP permet de visualiser et de décrire le site
allostérique. La structure de l'UMPKeco avec le GTP est connue depuis
2005 (article en préparation), mais elle n'explique pas clairement le
phénomène d'allostérie. Nos collaborateurs de l'Institut
Pasteur
ont constaté que le mutant D93A n'est
plus régulé allostériquement par le GTP
(D93 est impliqué dans
les interactions de maintien de l'hexamère).
Résoudre sa structure 3D pourrait nous permettre de mieux
comprendre le phénomène de régulation
allostérique.
7 6
2
C 7 5
9 1
3
![]()
6 8
1 2 4
7 6
2
7 5
9 1
3
6 8
1 2 4
3
8 4 5
1
3
8 4 5
1
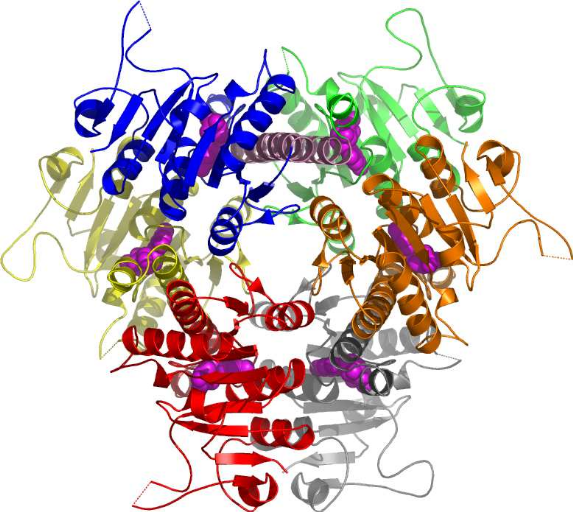
Figure 7 : Repliement de l'UMP kinase d'E.
coli : le monomère avec l'UMP (Briozzo et al, 2005)
Figure 8 : Repliement de l'UMP kinase d'E.
coli : l'hexamère fonctionnel avec l'UMP (Briozzo et al,
2005)
| 


