IV.2. Choix du modèle thermodynamique
Pour décrire le comportement des fluides réels
durant une chaine de transformations; nous faisons appel soit au facteur de
compressibilité, soit aux équations d'états [17].
IV.2.1. Utilisation du facteur de
compressibilité
Les différences de comportement entre un fluide
réel et un gaz parfait peuvent être mises en évidence en
suivant l'évolution du rapport du volume du fluide réel V
à celui du gaz parfait ??? en fonction des conditions
de pression et de température dans lesquelles se trouve le fluide .
Ce rapport noté Z set appelé facteur de
compressibilité.
?
? = (IV.1)
???
V Volume molaire du fluide réel
??? Volume molaire du gaz parfait
On sait que le volume d'un gaz parfait est donné par la
relation:
??
??? = (IV.2)
?
En conséquence:
??
? =
??
Soit :
?? = ???
Cette loi peut être qualifiée de loi des gaz
réels ,le facteur de compressibilité apparaissant comme
coefficient de correction à la loi des gaz parfaits ,quand le facteur de
compressibilité prend la valeur 1son comportement est identique à
celui du gaz parfait et cela intervient quand le fluide est un gaz à
très basse pression[17].
IV.2.2. Utilisation des équations d'état
:
Une autre voie permettant de résoudre le même type
de problème tout en étant plus adaptée aux calculs
numériques sur ordinateur s'est beaucoup développée, il
s'agit de l'utilisation des équations d'état.
IV.2.2.1. Equation de Van der Waals (1872) :
Les équations d'état ont pour objet de
représenter le comportement des fluides réels à l'aide
d'une expression mathématique ?(?, ? , ?) = 0 .
La plus ancienne est celle de Van der Waals (1872) qui modifie
la loi des gaz parfaits en y Introduisant deux termes correctifs :
-la pression du gaz parfait est réduite pour tenir compte
des forces de cohésion intermoléculaires existant dans les gaz
réels, celles-ci freinent les molécules qui créent en
conséquence une pression plus faible, le facteur correctif correspondant
appelé pression de cohésion est pris égal à
?/? ?, a étant une constante dépondant de la
nature du gaz et V étant le volume du gaz [1].
?????é?? = ? ??????????- ?/?2
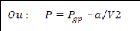
(IV.3)
(IV.4)
-le volume du gaz parfait est augmenté d'un facteur b qui
tient du volume propre des molécules du gaz réel dépend de
la nature du gaz et est appelé covolume.
L'équation d'état des gaz parfaits écrite
pour une mole de gaz
?????? = ??
Devient en conséquence
??+ ? ???(?-?)=??
|
Equation d'état de Van der Waals
|
|
| 


