REVUE BIBLIOGRAPHIQUE
1. La xanthine oxydoréductase

XOR
XOR
La xanthine oxydoréductase (XOR) est un complexe
métalloflavo-protéine, qui a été découverte
la première fois au niveau du lait bovin par Schardinger (1902). Chez
les mammifère XOR existe sous deux formes interconvertibles: la xanthine
déshydrogénase (XDH; EC 1.1.1.204 ) est la forme la plus dominant
in vivo et la xanthine oxydase (XO; EC 1.1.3.22) Bien que la XOR peut
réagir avec plusieurs substrats dont les purines, les pyrimidines et les
ptérines (Krenitsky et al., 1974), la propriété
catalytique principale la plus connue est le catabolisme des purines où
elle convertit l'hypoxanthine en xanthine et la xanthine en acide urique qui
est le produit finale du catabolisme des purines chez l'homme (Parks and
Granger, 1986) (figure 1)
1.1. Structure
La XOR est une enzyme homodimère constituée de
deux sous unités identiques de 150kDa de chacune, chaque sous
unités est partagé en 3 domaines :
- le domaine C terminale de 85kDa (590-1332
acides aminés) est le molybdo-protéique (Mo) -
le domaine central de 40kDa (226-531 acides aminés), est une
molécule de flavine adénine di nucléotides
(FAD)
- le domaine N terminale de 20kDa (1-165
acides aminés) se constitue de deux sousdomaines, avec deux centres
(Fe2/S2) combinés jusqu'à quatre résidu
de cystéine (figure 2) (Bray, 1975)
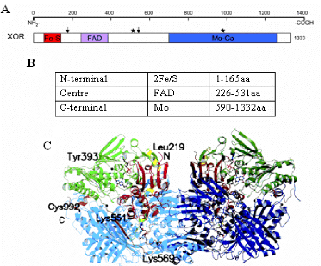
Figur2 : Structure secondaire et tertiaire de
la XOR. A, structure secondaire de la XOR, les flèches
indiquent les sites de clivage par la trypsine (Lys186, Lys552) (Amaya et
al., 1990), les étoiles indiquent les résidus de
cystéine modifiés dans la conversion réversible de XOR
(Cys535, Cys992) (Nishino and Nishino, 1997). B, domaines de
sous-unité de la XOR, leurs tailles et leurs cofacteurs associés
(Enroth et al., 2000). C, structure
cristallisée de l'homodimère de la XOR bovine (Enroth et al.,
2000).
1.2 Les propriété enzymatique
Le mécanisme réactionnel de la XOR est
constitué de deux demi-réactions indépendantes;
réductive et oxydative (Berry and Hare, 2004). La demi-réaction
réductive a eu lieu au site Mo où se produit une hydroxylation
oxydative du substrat (RH) avec réduction simultanée de l'enzyme
(Xia et al. 1999). Le NADH est le seul substrat réducteur qui
réagit avec le centre FAD et non avec le centre Mo (Berry and Hare,
2004). Les inhibiteurs de la XOR sont généralement des analogues
du substrat, tels que l'allopurinol, oxypurinol et certaines purines et
pyrimidines, inactivent l'enzyme en agissant sur le site Mo (Berry and Hare,
2004; Pacher et al., 2006).
Contrairement à la réaction
demi-réductive, la réaction demi-oxydative prenne lieu au site
FAD qui transfert des électrons aux accepteurs physiologiques (O2 et
NAD+) (Hille and Nishino, 1995). La réoxydation de l'enzyme
réduite permet d'oxyder l'oxygène en O
·- 2 et en H2O2
(Hille and Massey, 1981).

O2 + H2O O
·- 2 + H2O2
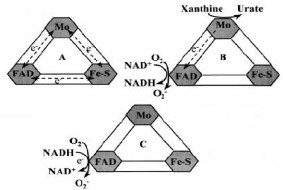
Les trois centres redox peuvent aussi transférer les
électrons entre eux (Figure 3) (Massey and Edmonson,
1970). Cependant, les accepteurs artificiels d'électrons (Ferricyanure
ou bleu de methylène) reçoivent leurs électrons des
centres Fe/S.
La XOR a deux formes inactives, démolybdo et
désulfo-XOR, ces formes représentent environ 60 % de l'enzyme du
lait bovin et plus de 97 % du lait humain (Baghiani et al., 2002;
2003). Ces deux formes ne peuvent pas oxyder les composés qui
réagissent au niveau du centre Mo, mais elles peuvent réagir avec
le NADH au niveau du centre FAD (Bray, 1975). Dans la forme désulfo,
l'atome de soufre au niveau du site Mo est remplacé par un atome
d'oxygène. Cette enzyme désulfo peut récupérer son
activité après une résulfuration en l'incubant avec des
composés sulfurés comme le (Na2S) (Baghiani et al.,
2003).
| 


