|
FACULTE DES SCIENCES AGRONOMIQUES
DEPARTEMENT DE CHIMIE ET
INDUSTRIES AGRICOLES
B. P. 117. Kinshasa XI
Détermination
des isothermes de sorption (adsorption-désorption)
[Cas de l'aubergine
(SolanummelongenaL.)]
|
KALENGI
MBWALALA
Gradué en Sciences
Agronomiques
|
Mémoire
présenté et défendu en vue de l'obtention du grade
d'Ingénieur Agronome
Département : Chimie et
Industries Agricoles
Directeur : David MAYELE KIPOY
Professeur Associé
Année Académique 2013 -
2014
TABLE DES MATIERES
TABLE DES MATIERES
ii
FIGURES ET TABLEAUX
iv
EPIGRAPHE
v
REMERCIEMENTS
vi
RESUME
vii
INTRODUCTION
1
CHAPITRE I. REVUE DE LA
LITTERATURE
3
I.1. Origine de la plante
3
I.2. Description de la plante
3
I.3. Composition et vertus de la
plante
3
I.4. Généralité sur les
Isothermes de sorption
5
I.4.1. Teneur en eau (Xéq)
5
I.4.2. Activité de l'eau dans un produit
(aw)
6
I.4.3. Relation teneur en eau (Xéq) et
activité de l'eau (aw)
6
I.4.4. Isothermes de sorption
7
I.4.5. Les méthodes d'obtention des
Isothermes de sorption
8
I.4.6. Hystérésis
10
I.4.7. Détermination de la Chaleur
Isostérique
10
I.4.8. Modélisation des isothermes de
sorption
11
I.4.9. Intérêt des
Isothermes
12
CHAPITRE II. MATERIEL ET
METHODES
14
II.1. Matériel
14
II.2. Méthodes
14
II. 2. 1. Détermination de
l'activité de l'eau à une température
déterminée
14
II. 2. 2. Détermination de la teneur en
eau de l'échantillon
15
II.2.3. Traçage de la courbe de
sorption
16
II.2.4. Mise en évidence des
hystérésis
17
II.2.5. Détermination de la chaleur
isostérique de sorption
17
CHAPITRE III. RESULTATS ET
DISCUSSION
18
III. 1. Activité de l'eau et Teneurs en
eau de nos échantillons à différentes
températures
18
III.2. Courbes de sorption
19
III.3. Hystérésis
Obtenues
22
III.4. Détermination de la chaleur
isostérique de sorption
24
CONCLUSION ET PERSPECTIVES
26
BIBLIOGRAPHIE
28
FIGURES ET TABLEAUX
FIGURES
Figure 1: Forme générale des isothermes
Figure 2 : Isothermes d'adsorption et de
désorption
Figure 3 : Isothermes de sorption illustrant le
phénomène d'hystérésis
Figure 4 : Schéma d'un montage
expérimental type pour la détermination des isothermes de
sorption pour le Solanummelongena L.
Figure 5 : Appareillage pour la détermination des
isothermes de sorption
Figure 6 : Isotherme d'adsorption du
Solanummelongena L.obtenue à 40°C
Figure 7 : Isotherme d'adsorption du
Solanummelongena L.obtenue à 50°C
Figure 8 : Isotherme d'adsorption du
Solanummelongena L.obtenue à 60°C
Figure 9 : Isotherme de désorption du
Solanummelongena L.obtenue à 40°C
Figure 10 : Isotherme de désorption du
Solanummelongena L. obtenue à 50°C
Figure 11 : Isotherme de désorption du
Solanummelongena L. obtenue à 60°C
Figure 12 : Hystérésis du
Solanummelongena L. obtenue à 40°C
Figure 13 : Hystérésis du
Solanummelongena L. obtenue à 50°C
Figure14 : Hystérésis du
Solanummelongena L. obtenue à 60°C
Figure 15 : Chaleur isostérique de
désorption du Solanummelongena L.
Figure16 : Chaleur isostérique d'adsorption du
SolanummelongenaL.
TABLEAUX
Tableau 1 : Modèles de description des isothermes
de sorption sélectionnés
Tableau 2 : Activités de l'eau des solutions
salines saturées
Tableau 3 : Teneurs en eau des échantillons
d'aubergines en partant des awdes solutions salines saturées
en fonction de différentes Températures
EPIGRAPHE
« Le Souverain Seigneur lui-mêmefait
germer l'herbe verte pour les bêtes, et la végétation pour
le service des humains, pour faire sortir la nourriture de la
terre. »
Psaumes 104 :14
REMERCIEMENTS
Au dénouement de nos années d'études
en Sciences agronomiques, formation chapeautée par ce présent
travail, la gratitude nous oblige à adresser nos remerciements les plus
ardents, d'abord à notre Grand Dieu de qui nous avons la vie, puis
à tous les corps académique et scientifique en
général, et en particulier au professeur David
MAYELE,Directeur de ce travail.
Nous tenons aussi à remercier l'assistant
HervéTSHIALApour sa disponibilité.
Nous remercions aussi nos parents Willibrod et Evelyne
KALENGI, car sans ces derniers, ce travail allait demeurer une simple vision
d'esprit.
Aussi, nous ne faillirons pas de remercier tous ceux dont
les noms n'ont pas été cités dans ces lignes, mais qui de
près ou de loin nous ont assisté soit par un conseil, soit par un
quelconque apport matériel ou moral, nous ayant permis d'achever avec
beauté ce présent travail, puissent-ils trouver à travers
ces lignes nos considérations les plus jointes.
KALENGI MBWALALA
RESUME
Cette étude,visait à déterminer
expérimentalement les isothermes d'adsorption-désorption pour
trois températures (40, 50 et 60°C) du
SolanummelongenaL.,desquelles nous avions établi la relation
entre l'activité de l'eau et la teneur en eau de notre produit. Cette
détermination a été effectuée par la méthode
gravimétrique statique des trois solutions de sels saturées (KOH,
KCl et NaCl).
Les courbes expérimentales obtenues pour
l'adsorption, montrent que pour une activité de l'eau donnée
aw, la teneur en eau d'équilibre Xéq augmente
inversement avec la température (c'est-à-dire
décroît lorsqu'on augmente la température ou inversement).
Pour la désorption, les courbes
expérimentales obtenues montrent que pour une activité de l'eau
donnée aw, la teneur en eau d'équilibre Xéq
évolue de façon variable, car, on observe une grande
désorption à 40°C et 60°C, phénomène
faiblement observé à 50°C.
Les résultats expérimentaux montrent
qu'à 50°C, la courbe d'absorption ne se superpose pas avec celle de
la désorption, mettant en évidence le phénomène
d'hystérésis, contrairement à ce qui est observé
à 40 et 60°C où la courbe d'absorption se superpose avec
celle de la désorption, ne mettant donc pas en évidence le
phénomène d'hystérésis.
La chaleur isostérique d'adsorption de notre
produit, augmente inversement à la teneur en eau contrairement à
ce qui est observé dans le cas de la désorption.
INTRODUCTION
Avec une production mondiale de 5,6 millions de tonnes,
soit le 9éme rang parmi les légumes, l'aubergine fait
l'objet de très peu d'échanges internationaux et alimente en
priorité les marchés de proximité et nationaux (Caburet et
al., 2002).
Les connaissances scientifiques modernes ont permis de
mettre en place des procédés qui transforment lesaliments,
améliorent efficacement la conservation de ces derniers et les
pertes dues aux avaries diminuent ; les aliments gardent alors leurs
qualités tant sanitaires qu'organoleptiques ce qui facilitent ainsi
l'exportation.Ceci laisse sous-entendre l'influence de la teneur en eau des
produits dont le rôle est primordial dans la stabilité des
aliments (Cheftel et Cheftel, 1984).
La première étape dans la
compréhension scientifique de l'état de l'eau dans les aliments,
et donc leur conservation, est la détermination des isothermes de
sorption. En effet, elles permettent entre autres, de prévoir les
changements de teneur en eau d'un produit pendant sa manipulation et son
stockage (Martinez et Chiralt, 1996).
Elles permettent aussi de déterminer la
température et la teneur en eau finale à atteindre à la
fin d'une opération de séchage d'un produit donné de
manière à assurer sa stabilité physique, chimique et
biologique pendant le stockage (Aghfiretal., 2005). Aussi dans le
même contexte, pour Benhamou et al., 2010, l'isotherme de
sorption lie la teneur en eau d'équilibre, pour une température
donnée, et l'humidité relative de l'environnement entourant le
produit. Elle est donc caractéristique des nombreuses interactions entre
le squelette solide et les molécules d'eau qui ont lieu à
l'échelle microscopique. Elle offre donc pour ainsi dire des
informations précieuses sur l'équilibre hygroscopique du produit.
Et Noumi et al., 2004, d'insister sur le fait que
cela est nécessaire pour contrôler la qualité du produit
séché durant le stockage.Cependant, à notre connaissance,
dans notre faculté des sciences agronomiques, aucune étude n'est
encore effectuée sur les isothermes de sorption en général
et des aubergines en particulier.Nous nous sommes donc intéressés
à la détermination de ces isothermes à des
températures de40, 50 et 60°Cdans ce travail de fin
d'études.
Hypothèse
Pour une activité de l'eau donnée
awde trois sels permettant de tracer la courbe de sorption de nos
aubergines, la teneur en eau d'équilibre Xéq augmente inversement
avec la température (c'est-à-dire décroît lorsqu'on
augmente la température ou inversement).
Objectif global
Déterminer les conditionsde séchage
permettant de mieux stocker les produits.
Objectifs spécifiques
Le présent travail vise comme objectifs
spécifiques :prévoir l'activité de l'eau
awen fonction de la teneur en eau du produit,déterminer la
teneur en eau d'équilibre du produit, la chaleur isostérique de
sorptionainsi que les isothermes d'adsorption-désorption des
aubergines.
Intérêts
- décider du mode de conditionnement pour une
denrée en fonction de l'humidité relative de l'atmosphère
dans laquelle elle est maintenue ;
- donner les conditions (température, HRE) qui
protège le mieux les produits alimentaires lors de la
conservation.
Méthodologie
La détermination des isothermes
d'adsorption-désorption de nos aubergines (SolanummelongenaL.)
a été effectuée par la méthode gravimétrique
statique. Nous avons ainsi utilisé des solutions de
sels saturées telles : KOH, NaCl et KCl.
Canevas
Hormis l'introduction et la conclusion et suggestions, le
présent travail est subdivisé en trois chapitres : le
premier, est une étude bibliographique sur l'aubergine ainsi que celui
des isothermes des sorptions ; le second,matériel et
méthodes,aborde tous les éléments entrant en ligne de
compte pour l'établissement du sujet ; le dernier,résultats
et discussion,présente la finalité du travail.
1. CHAPITRE I. REVUE DE LA
LITTERATURE
L'aubergine (SolanummelongenaL.)
est une
plante
potagère annuelle de l'
ordrede
Solanales
et de la
famille
de
Solanaceae,
cultivée pour son
fruit
consommé comme
légume
(Anonyme 1, 2002).
I.1. Origine de la plante
L'aubergine est originaire de l'Inde orientale où
l'on trouve toujours des espèces sauvages. Déjà
cultivée en Chine quatre siècles avant notre ère, ce sont
les Arabes qui en rapportèrent des graines en Espagne et dans le bassin
méditerranéen. Cultivée en Espagne dès le
XIVème siècle, elle se répand en France, en
Allemagne et en Grande-Bretagne.
C'est aussi l'un des légumes les plus importants de
l'Afrique de l'Ouest et Centrale, ensemble avec l'amarante, le piment et le
gombo. Dans certaines régions, comme le Ghana, le Togo, le Bénin
et le Nigeria, les aubergines sont populaires pour leurs jeunes feuilles
succulentes qui sont consommées. Dans d'autres pays, comme le
Sénégal, la Côte d'Ivoire, le Cameroun, le Gabon et le
Congo, ces espèces sont cultivées pour leurs fruits de dimensions
et formes très variables (Benies, 1999).
I.2. Description de la
plante
C'est une plante annuelle cultivée dans les pays
tempérés, où elle craint le gel. Dans les pays tropicaux,
c'est une plante pérenne. L'espèce est originaire d'Asie
méridionale (
Inde,
Birmanie)
(Anonyme 1, 2002).
La plante, à port dressé, atteint 50cm
à 1,2m de haut. Les fleurs, de couleur blanche ou violette, solitaires,
sont portées à l'aisselle des feuilles. Les fruits de la
variété la plus commune en
France sont
allongés et de couleur violet sombre, mais il existe des
variétés, de formes et de couleurs différentes (blanches,
tigrées, ...).
I.3. Composition et vertus de
la plante
 Comme la tomate, l'aubergine est le fruit d'une plante
potagère de la famille des solanacées. Sa chair crue offrant une
consistance spongieuse et un goût amer, elle se consomme cuite. Elle
devient alors douce et moelleuse. Très peu calorique, ce légume
est source de vitamines, de minéraux, de composés antioxydants et
de fibres. Sa peau est non seulement comestible, mais particulièrement
riche en substances nutritives (Anonyme 2, 2002). Comme la tomate, l'aubergine est le fruit d'une plante
potagère de la famille des solanacées. Sa chair crue offrant une
consistance spongieuse et un goût amer, elle se consomme cuite. Elle
devient alors douce et moelleuse. Très peu calorique, ce légume
est source de vitamines, de minéraux, de composés antioxydants et
de fibres. Sa peau est non seulement comestible, mais particulièrement
riche en substances nutritives (Anonyme 2, 2002).
Riche en eau (plus de 92% en moyenne), l'aubergine compte
peu de nutriments énergétiques. Les lipides et les
protéines ne sont présents qu'en très faibles
quantités, tandis que sa teneur en glucides (glucose et fructose
essentiellement) ne dépasse pas 4g aux 100g.
Elle offre en revanche un large éventail de
vitamines : vitamines du groupeB, notamment B3, B6 et B9 (folates),
vitamine C, provitamine A, vitamine E.Sa chair renferme de nombreux
minéraux et oligo-éléments : potassium,
magnésium, zinc, manganèse.Sa peau présente d'importantes
concentrations de composés antioxydants, anthocyanines et acides
phénoliques notamment (Anonyme 2, 2002).
Ses fibres sont composées en
majeure partie par des protopectines (pectines liées aux parois
cellulaires du végétal), et en moindre quantité par des
pectines et des celluloses. Toutes sont des fibres solubles. Lors de la
cuisson, les protopectines, comme les pectines, acquièrent une
consistance moelleuse et tendre.
Ø Pour une meilleure
digestion
Les fibres solubles comme les protopectines et les
pectines de l'aubergine augmentent l'activité bactérienne du
côlon. Leur dégradation par les bactéries produit des
substances capables de stimuler les contractions de l'intestin, ce qui permet
ainsi l'évacuation des selles.
Comme tous les légumes, sa composition en fibre
alimentaire, idéal pour combattre la constipation, est très haut.
Au-delà des propriétés nutritives, l'aubergine a des
propriétés dépuratives et doucement laxatives; elle
régularise et stimule l'activité du foie.Toutes ces
propriétés contribuent à assurer une activité
dépurative et désintoxiquant. Pour cette raison elle est
indiquée en cas de goutte, artériosclérose, inflammations
des voies urinaires, hépatite et constipation.
En cosmétologie on utilise la pulpe pour
préparer des masques nourrissants pour la peau (Anonyme 3,
2002).
Ø En prévention contre le cancer du
côlon
Dans le cadre de la prévention du cancer du
côlon, il est recommandé un régime riche en fibres
provenant de l'alimentation, en particulier celles des fruits et des
légumes. De telles fibres naturelles sont bénéfiques pour
ce qu'elles contiennent, mais aussi pour ce qu'elles ne contiennent pas : des
graisses et des calories en excès (Goodlad,2002).
Ø En synergie avec un potentiel antioxydant
élevé
Des spécialistes en cancérogenèse ont
souligné l'importance d'un apport adéquat en fibres provenant non
seulement des céréales, mais également des légumes
et fruits. Les fibres alimentaires côtoient les antioxydants et les
vitamines, susceptibles ensemble, en jouant sur des cibles différentes,
de réduire les risques de maladies chroniques.
L'aubergine possède un potentiel antioxydant
élevé avec un indice TAC (de l'anglais Total AntioxidantCapacity)
de 1 748umol par portion de 69g, la capacité de l'aubergine à
neutraliser les radicaux libres dans l'organisme humain intéresse de
près les chercheurs dans leurs luttes contre des maladies
cardiovasculaires, de certains cancers et d'autres maladies liées au
vieillissement (Goodlad, 2002).
Ø Un aliment rassasiant et fort peu
calorique
L'aubergine riche en fibres permet donc un effet
rassasiant par impression de volume, avec un apport énergétique
supplémentaire limité et peut ainsi contribuer à la
régulation du poids. Aliment pauvre en glucides (3 à 4g de
glucides aux 100g, essentiellement des glucides simples, glucose et fructose)
l'aubergine peut être consommée librement par les personnes
diabétiques.
Peu énergétique (18Kcal aux 100g soit 75Kj),
l'aubergine présente une bonne densité en minéraux
(notamment en potassium) et en vitamines (essentielle)(Anonyme 2, 2002).
Ø Des effets diurétiques contre
l'hypertension artérielle
Selon quelques chercheurs, boire «l'eau
d'aubergine» (l'infusion de morceaux du légume) pourrait baisser la
pression artérielle grâce à une action pharmacologique
similaire à celle de certains médicaments anti-hypertensifs
(Anonyme 3, 2002).
De sa richesse en eau (92 %), l'aubergine tire une
abondance remarquable de minéraux. Outre la quantité
intéressante de magnésium et de zinc qu'elle apporte, elle a
l'avantage d'être diurétique grâce à sa forte teneur
en potassium (260mg/100g) tandis que le sodium ne dépasse pas 3mg. Des
propriétés qui en font un légume adapté au
régime sans sel et intéressant dans le cadre de l'hypertension
artérielle (Goodlad, 2002).
I.4.
Généralité sur les Isothermes de sorption
Le séchage est l'un des procédés de
conservation des aliments les plus anciens dont le principe consiste à
abaisser l'activité de l'eau jusqu'à ce que les microorganismes
ne puissent plus se développer, il ne tue donc pas les microorganismes
qui contaminent les aliments mais arrête leur développement
(Mayele, 2014).
I.4.1. Teneur en eau
(Xéq)
La teneur en eau d'un matériau hygroscopique
où l'humidité absolue est définie par la masse en
quantité d'eau contenue dans un produit, exprimée en pourcentage
de la masse sèche de ce produit. Cette valeur est importante pour tous
les produits vendus au poids.
Avec :
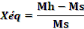
Xéq: teneur en eau d'équilibre (%
MS)
Ms : masse sèche (kg)
Mh : masse humide (kg).
I.4.2. Activité de l'eau
dans un produit (aw)
Si le produit est en équilibre hygroscopique avec
l'air qui l'entoure, l'activité de l'eau awest identique
à l'humidité relative d'équilibre (aw=HRE).
Elle est définie comme suit :
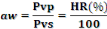
Avec :
Pvp : pression partielle de vapeur d'eau dans
l'air (Pa)
Pvs : pression partielle de vapeur saturante
(Pa)
HR : humidité relative de l'air (%).
L'activité de l'eau (aw) est la mesure
du degré de liberté de l'eau retenue dediverses façons
dans un produit hygroscopique. L'activité de l'eau détermine
directement lespropriétés physiques, mécaniques, chimiques
et microbiologiques d'un matériauhygroscopique.
I.4.3. Relation teneur en eau
(Xéq) et activité de l'eau (aw)
Notons que, dans le cas général des
denrées alimentaires, la relation entre l'activité de l'eau qui
entoure la denrée et la teneur en eau permet d'approcher de
manière intéressante le comportement de l'eau dans les
denrées. Précisons toute fois que pour une même teneur en
eau, l'aw d'un produit hygroscopique est nettement inférieur
à celle d'un produit non hygroscopique car, par définition, un
produit hygroscopique contient bien évidemment plus d'eau liée
qu'un produit non hygroscopique (Etoumaud, 2007).
L'étude pratique de cette relation se fait
principalement au moyen des isothermes d'absorption-désorption : graphes
qui, par convention, représentent la teneur en eau (Xéq) en
fonction de l'activité de l'eau (aw).
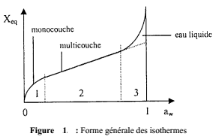
De manière générale, on obtient une
courbe en S, plus ou moins marquée, avec 2 points d'inflexion qui
permettent de délimiter plus ou moins nettement 3 zones
(Figure1).
Chaque zone correspond à un mode de fixation
particulier de l'eau sur le produit :
Zone 1 : eau fortement
liée, constitution d'une monocouche moléculaire à la
surface du produit.
Zone 2 : eau faiblement
liée, adsorption des molécules sur la monocouche
initiale.
Source : Boumediene, 2004
Zone 3 : eau libre, eau
disponible pour toutes les fonctions de l'eau contenue dans les denrées
fraîches. C'est une eau présente à l'état liquide
dans les pores du matériau.
I.4.4. Isothermes de
sorption
L'activité de l'eau awdans un produit
dépend principalement de sa teneur en eau (Xéq) et de sa
température(T) (Boumediene, 2004).
La courbe représentant pour une température
donnée la teneur en eau (Xéq) d'un produit en fonction de la
valeur de l'activité de l'eau (aw) ou de l'humidité
relative de l'air en équilibre (HRE) est appelée :
- isothermes d'adsorption si elle a été
déterminée expérimentalement en partant d'un produit
sec,
- isothermes de désorption si elle a
été déterminée expérimentalement en partant
d'un produit saturé en eau.
La figure 2 montre que les deux courbes sont en
général différentes car le séchage d'un Produit
(passage d'aw = 1 à aw = 0,6) entraîne des
modifications de structure et de porosité. Il y a un
phénomène d'hystérésis.
Figure 2.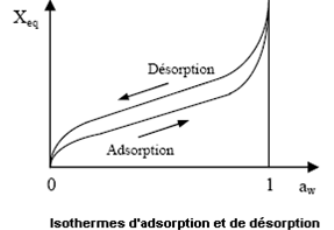
Source : Boumediene, 2004
I.4.5. Les méthodes
d'obtention des Isothermes de sorption
Les procédures d'obtention des isothermes de
sorption de l'eau des produits agroalimentaire sont décrites
différemment en détail par plusieurs auteurs, et cela en fonction
de leur entendement (Ahouannouetal., 2010). Parmi ces
procédures, on utilise soit des méthodes manométriques,
soit hygrométriques ou encore gravimétriques (dynamique et
statique) (Nkouam, 2007). D'autres méthodes utilisent les
humidificateurs mécaniques et des dessiccateurs (Rizvi, 1986).
I.4.5.1.Les méthodes
manométriques
La mesure manométrique, est une mesure basée
sur les propriétés colligatives. Ici, l'échantillon
(10-50g) est placé sous vide (moins de 200 umHg) dans un dessiccateur
pendant 1-2 minutes. 30 à 50 minutes après l'arrêt du vide
à l'équilibre, la pression de vapeur d'eau est mesurée
à l'aide d'un manomètre. La température doit être
maintenue constante. Pour plus de précision, il importe que les
changements de l'activité de l'eau dus à la perte d'eau par
évaporation soient très faibles (le rapport du volume de
l'échantillon sur le volume de vapeur est grand), et que le fluide
manométrique soit de masse volumique et de pression de vapeur
faibles.
Cette méthode présente les
inconvénients des gradients de température, des changements de
valeur de l'awpar vaporisation et l'incompatibilité avec les
aliments volatiles ou en processus de respiration.
I.4.5.2.Les méthodes
hygrométriques
On retrouve : les mesures du point de rosée et
de dépression du bulbe humide à l'aide des hygromètres
à cheveux et électriques permettant de mesurer l'activité
de l'eau.
Pour ce qui est de la mesure de la température de
rosée, un courant d'air (vapeur d'air) en équilibre avec
l'échantillon étudié est soumis à la condensation
à la surface d'un miroir refroidi. L'apparition de la première
goutte d'eau sur le miroir est détectée à l'aide d'une
cellule photoélectrique et correspond au point de rosée (Cheftel
et al.,1983).
A partir de la mesure du point de rosée,
l'humidité relative de l'échantillon est enregistrée par
l'utilisation des paramètres psychrométriques. En combinaison
avec des microprocesseurs, les valeurs directes de l'awpourraient
être obtenues. L'exactitude de ces instruments est moindre à des
niveaux d'awbas, à cause de l'insuffisance de vapeur dans
l'espace principal pour couvrir le miroir.
Quant au principe des hygromètres à
résistance électrique, il est basé sur le fait que la
résistance de certaines substances est fonction de l'humidité
relative.
Quant aux hygromètres à cheveux,
après calibrage, donne une indication de l'humidité relative du
milieu ambiant. Cette mesure indirecte de l'awest peu
précise, surtout à des humidités relatives
élevées.
I.4.5.3. Les méthodes
gravimétriques
Pour Jannot (2008), ce sont des méthodes
quantitatives qui sont basées sur des mesures de masse d'un
composé. Le principe d'obtention d'un point de l'isotherme est le
suivant : on place un échantillon du produit dans une enceinte
maintenue à température T et à humidité relative
d'équilibre HRE de l'air constante. L'échantillon est pesé
à intervalle régulier jusqu'à ce que sa masse ne varie
plus, il est alors en équilibre avec l'air à (T, HRE).
Connaissant sa masse humide, il suffit alors de déterminer sa masse
sèche pour en déduire sa teneur en eau Xéq, le couple (HR,
Xéq), ce qui fournit un point de l'isotherme d'adsorption ou de
désorption. On distingue les méthodes gravimétriques
statique et dynamique.
Dans la méthode gravimétrique statique,
seule la diffusion gouverne les transferts entre le produit et son
environnement. Le produit est placé dans une enceinte étanche
à l'intérieur duquel une solution maintient une humidité
relative constante. La régulation de l'humidité relative de
l'ambiance étant assurée soit par des solutions salines
saturées, soit par des solutions diluées d'acide,
communément l'acide sulfurique de concentration fixée. La
température est maintenue constante en plaçant les
récipients dans une enceinte thermostatée. Et on utilise autant
de sels ou de concentration d'acidesdifférents (et donc de
récipients) que l'on veut obtenir des points sur l'isotherme. Toutefois,
cette méthode est très longue car l'équilibre air/produit
n'est parfois atteint qu'après plusieurs semaines. (Jannot,
2008).
Dans les méthodes gravimétriques dynamiques,
un courant gazeux est conditionné par un dispositif humidificateur avant
d'atteindre l'échantillon. L'appareil est principalement
constitué d'un cylindre calibré dans lequel évolue un
piston et d'une éprouvette dans laquelle on place l'échantillon
dont on veut mesurer la courbe de sorption. On rencontre également dans
cette catégorie des appareils comportant une balance électronique
incorporée, qui donnent en continu les mesures de la masse de
l'échantillon (Nkouam, 2007).
I.4.6.
Hystérésis
Le phénomène par lequel à une
température et une activité de l'eau données, un absorbant
contient plus d'eau pendant la désorption que pendant l'adsorption est
appelé `hystérésis' (Nkouam, 2007).
De manière générale, les isothermes
d'adsorption-désorption présentent la propriété
dynamique d'hystérésis, la courbe d'adsorption est
décalée par rapport à celle de désorption (figure
2)
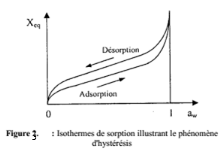
Source : Boumediene, 2004
Les courbes d'isothermes de sorption donnent des
informations sur la répartition et l'intensité des liaisons des
molécules d'eau ainsi que leur disponibilité fonctionnelle dans
les substances biochimiques et biologiques. La connaissance de ces courbes est
indispensable pour étudier le séchage des produits (Boumediene,
2004).
I.4.7. Détermination de
la Chaleur Isostérique
La courbe donnant l'activité de l'eau
(aw) en fonction de l'inverse de la température (1/T)
à une teneur en eau (Xéq) constante est donnée par la
formule de Clausius-Clapeyron suivante (Iglesias&Chirife, 1976) :
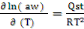 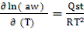 (1) (1)
En intégrant l'équation (1) on obtient :
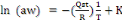 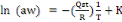 (2) (2)
De la pente des isostères et pour chaque teneur en
eau X, on peut déduire la chaleur isostérique correspondante et
tracer la courbe Qst= f (Xeq).
La diminution rapide de la chaleur isostérique pour
les faibles teneurs en eau du produit est due à l'existence des sites
polaires de grande activité dans le produit qui sont couverts de
molécules d'eau formant la monocouche moléculaire (Tsami,
1991).
D'autres auteurs (Boki, 1990 ; Salgado, 1994) ont
expliqué
ce phénomène par le fait que dans un domaine
très restreint d'humidité, quand la teneur en
eau augmente,
certains produits se gonflent et favorisent l'ouverture de nouveaux
sites
d'adsorption de fortes liaisons, ce qui augmente la chaleur
isostérique.
I.4.8. Modélisation des
isothermes de sorption
Plusieurs modèles mathématiques, relations
empiriques reposant sur des bases plus ou moins physiques, décrivent la
relation entre la teneur en eau d'équilibre, l'humidité relative
d'équilibre et la température. Huit modèles
différents trouvés dans la littérature peuvent être
étudié: Henderson modifié, Chung-Pfost modifié,
Oswin modifié, Halsey modifié, GAB, Peleg, Langmuir, et BET
modifié. Le but est de déterminer le ou les modèles les
plus adéquats pour la description des isothermes de sorption de notre
produit(Boumediene, 2004).
Tableau 1 : Modèles de description des isothermes
de sorption sélectionnés
|
Auteurs
|
Equation du modèle
|
Domaine de validité de
courbe
|
|
Henderson modifié
|
|
Complète
|
|
Chung-Pfost modifié
|
|
Complète
|
|
Oswin modifié
|
|
Complète
|
|
Halsey modifié
|
|
Complète
|
|
GAB
|
|
Complète
|
|
Peleg
|
|
Complète
|
|
Langmuir
|
|
Complète
|
|
BETmodifié
|
|
Zone 1et Zone 2
|
Les modèles sont comparés en se basant sur
le coefficient de corrélation (r), l'erreur moyenne relative (EMR),
l'erreur standard de la teneur en eau du produit (EST) et le résidu de
sorption ei.
Le meilleur modèle sera celui présentant la
plus grande valeur de (r), les plus petites valeurs de (EMR), de (EST) et de
ei. Ces valeurs sont calculées comme suit :
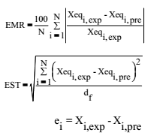
avec :
Xeqi,exp : la ième teneur en eau d'équilibre
expérimentale,
Xeqi,pre : la ième teneur en eau d'équilibre
prédite,
N : le nombre de points expérimentaux
df : le degré de liberté de la
régression du modèle
I.4.9. Intérêt des
Isothermes
Les isothermes ont comme intérêt
de :
- prévoir l'activité de
l'eauawenfonction de la teneur en eau ;
- prévoir l'évolution de l'activité
de l'eau awen fonction de la modification de la teneur en eau
(hydratation, déshydratation) ou du passage, pour les denrées
sucrées (confiserie), du sucre de l'état amorphe à
l'état cristallisé ;
- prévoir l'activité de l'eau
awà l'équilibre dans le cas de mélanges
complexes de produits plus ou moins complètement
déshydratés (préparations pour potages, soupes, ketchup) ;
- déciderdu mode de conditionnement emballage pour
une denrée en fonction de l'humidité relative de
l'atmosphère dans laquelle elle est maintenue ;
- donner les conditions (température, HRE) qui
protègele mieux les produits alimentaires lors de la
conservation ;
- prédire et prévenir les
phénomènes de dégradation lors du stockage de
l'aliment.
Cependant, de par la complexité des
phénomènes de sorption, les isothermes de sorption ne peuvent pas
être prédites par la théorie mais doivent être
établies expérimentalement pour un produit quelconque.
CHAPITRE II. MATERIEL ET
METHODES
II.1. Matériel
Le matériel végétal utilisé
dans cette expérimentation est l'aubergine
(SolanummelongenaL.).
II.2. Méthodes
La détermination des isothermes
d'adsorption-désorption de nos aubergines (SolanummelongenaL.)
a été effectuée par la méthode gravimétrique
statique. Cette mesure se faisantà des températures
déterminées,nous avons donc choisi de travailler avec trois
différentes températures,à savoir 40, 50 et
60°C.
L'isotherme de sorption représente une courbe de la
teneur en eau en fonction de l'activité de l'eau.
II. 2. 1. Détermination
de l'activité de l'eau à une température
déterminée
Pour déterminer l'awde notre produit,
nous avons utilisé des solutions salines saturéesde KOH, KCl et
NaCl, expérience réalisée au laboratoire de
pédologie et au laboratoire de chimie et industries agricoles
(faculté des sciences agronomiques/Université de Kinshasa). La
préparation de ces solutions étaitfaite selon les concentrations
suivantes :
- NaCl (35,9g/100g H2O),
- KOH (121g/100g H2O) et
- KCl (34,2g/100g H2O).
En partant de ces concentrations, les étapes
suivies étaient les suivantes :
- Peser préalablement X g de soluté de sel
à utiliser
- Mesurer Y ml d'eau distillée correspondante dans
un bêcher
- Verser X g de soluté de sel lentement et surement
dans le Y ml d'eau distillée
- Agiter la solution (par un agitateur
magnétiquemarque Mini MR Standard)
- Continuer ainsi l'opération jusqu'à
saturation de la solution c'est à dire jusqu'au point où le
solvant ne dissout plus le soluté de sel
- Refaire pour ainsi dire l'opération pour les
trois sels à préparer partant de concentrations à
préparer NaCl (35,9g/100g H2O), KOH (121g/100g
H2O) etKCl (34,2g/100g H2O)
A ces différentes concentrations, correspondent des
différentes awà différentes températures
données par la littérature comme nous la présente le
tableau 2 ci-dessous.
Tableau 2 : Activités de l'eau des solutions
salines saturées à différentes températures
|
Solutions salines saturées
|
Activité de l'eau aw
|
|
40°C
|
50°C
|
60°C
|
|
KOH
|
0,062
|
0,057
|
0,055
|
|
KCl
|
0,823
|
0,812
|
0,803
|
|
NaCl
|
0,747
|
0,744
|
0,745
|
(Source : Jannot, 2008)
II. 2. 2. Détermination
de la teneur en eau de l'échantillon
Avec des flacons vides tarés préalablement
à l'aide d'une balance de précision de marque JT2003B, nous
avons pesé1, 25g des échantillons frais (après lesavoir
découpés en tranche de 1 cm d'épaisseuravec un couteau).
Avec une pince, nous avons pris l'échantillon frais et l'avons
placé dans le flacon.Puis pesé.Nous avons obtenu le poids
(A). La figure 3 ci-dessous nous présente
l'équipement.
Couvercle étanche
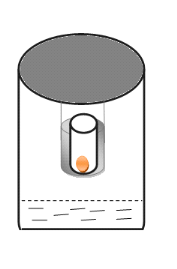
Figure 4 : Schéma d'un montage
expérimental type pour la détermination des isothermes de
sorption pour le SolanummelongenaL.
Papier aluminium
Flacon en verre
Toile en aluminium
Echantillon
Bocal en verre
Solution saline saturée
Nous avons ainsi placéle flacon contenant
l'échantillon dans une étuve à 105°C, pendant 24
heures.
A la fin du séchage à 105°C,
l'échantillon est placé dans le dessiccateur pendant 10 min.
Après l'avoir pesé, nous avons obtenu le poids
(B), puis l'ensemble a été suspendu dans le
bocal contenant la solution saturée de sel.Avec du papier aluminium, le
bocal a été fermé hermétiquement, nous avons
ainsimaintenuisotherme dans l'étuve le bocal (pour le préparer au
phénomène d'adsorption) en fonction de la température
comme nous le présente la figure 4 ci-dessous.

Figure 5 : Appareillage pour la détermination
des isothermes de sorption
II.2.3. Traçage de la
courbe de sorption
Nous avons effectué des pesées
régulières du flacon contenant l'échantillon toutes les 48
heures tout en notant les valeurs jusqu'à un poids constant
(C). Ensuite, le flacon contenant l'échantillon a
été réintroduite dans l'étuve (pour le
préparer au phénomène de désorption) à
température isotherme, puis au dessiccateur pendant 10 min. Nous avons
donc effectuédes pesées régulières du flacon
contenant l'échantillon chaque48heureen notant les valeurs
jusqu'à obtenir un poids constant (D).Ainsi,
après avoir obtenu les masses humides et sèches de toutes les
prises d'essais par despesées régulières, les teneurs en
eau d'équilibre sont calculées à l'aide de la
relation :
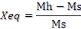
De part ce procéder, nous avons
déterminé les points qui nous ont permis de tracer la courbe de
désorption et d'adsorption pour toutes les températures.
II.2.4. Mise en évidence
des hystérésis
Après avoir obtenu les isothermes
d'adsorption-désorption, nous avons mis en évidence une
hystérésis qui montre la corrélation pouvant être
établie entre ces isothermes.
II.2.5. Détermination
de la chaleur isostérique de sorption
La chaleur isostérique de sorption est obtenue par
la pente de la courbe des isostères et pour chaque teneur en eau
Xéq, on peut déduire la chaleur correspondante et tracer la
courbe Qst= f (Xeq).
CHAPITRE III. RESULTATS ET DISCUSSION
III. 1. Activité de l'eau et Teneurs en eau de nos
échantillonsà différentes températures
Les résultats dedifférentes teneurs en eau
de nos échantillons d'aubergines en fonction des activités de
l'eau des solutions salines, à différentes
températures sont présentés dans le tableau 3 ci-dessous.
Tableau 3 : Teneurs en eau des
échantillonsd'aubergine en partant des awde solutions salines
saturées en fonction de différentes Températures
|
40°C
|
50°C
|
60°C
|
|
aw
|
Xéq-dés
|
Xéq-ads
|
aw
|
Xeq- dés.
|
Xeq- ads.
|
aw
|
Xeq- dés.
|
Xeq- ads.
|
|
KOH
|
0,0626
|
4,637
|
0,01
|
0,0572
|
2,202
|
0,025
|
0,0558
|
4,168
|
0,015
|
|
NaCl
|
0,747
|
5,083
|
0,054
|
0,744
|
2,619
|
0,044
|
0,745
|
4,907
|
0,041
|
|
KCl
|
0,823
|
5,274
|
0,119
|
0,812
|
3,193
|
0,083
|
0,803
|
4,922
|
0,042
|
De manière
générale, les résultats du tableau 3 nous montrent que la
teneur en eau d'adsorption (Xéq-ads) et l'activité de l'eau de
trois sels décroît lorsqu'on augmente la température.Et de
façon particulière, les résultats du tableau 3 nous
montrent que les activités de l'eau (aw) diminuent avec la
température quand il s'agit du KOH et du KCl, contrairement à ce
qui est observé quand il s'agit duNaCl car à 50°C, on
obtient une diminution brusque de l'awmais qui augmente à
60°C ; pour ce qui est de la Xéq, elle est très
variable, surtout quand il s'agit :
- de la désorption pour toutes les solutions
salines saturées utilisées. Nous obtenons donc, une diminution de
Xéq à 50°C puis une augmentation brusque et rapide à
60°C pour revenir presque à ce qui a été
observé à 40°C.
- de l'adsorption, l'évolution est inverse à
la température pour ce qui est duNaCl et du KCl mais pour ce qui est du
KOH, l'évolution est variable puisque à 50°C la valeur
augmente pour ensuite redescendre à 60°C, on obtient donc une
valeur comme presque celle qui a été observée à
40°C.
III.2. Courbes de sorption
La déterminationexpérimentale des isothermes
de sorption ont nécessité un temps assez long.
L'obtention d'un premier point de la courbe d'isotherme a
duré environ 192 heures pour l'adsorption et 144 heures pour la
désorption. Par conséquent, Il nous a donc fallu environ 42 jours
(6 semaines) pour obtenir expérimentalement les courbes d'isotherme de
désorption et d'adsorption pour nos aubergines, résultats que
nous présentons dans les figures 6, 7,8, 9, 10, et 11, nous aurons
donc :
Les résultats de la figure6, montrent de
façon générale que l'adsorption à 40°C,
présente une évolution croissante de la teneur en eau en fonction
de l'awtrès marquée.
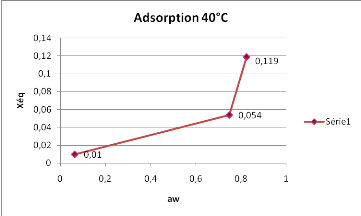
Figure 6 : Isotherme d'adsorption du
SolanummelongenaL. obtenue à 40°C
Les résultats de la figure 7, montrent qu'à
50°C, l'adsorption présente une croissance de la teneur en eau en
fonction de l'awmoins marquée que celle qui a
été observée à 40°C.
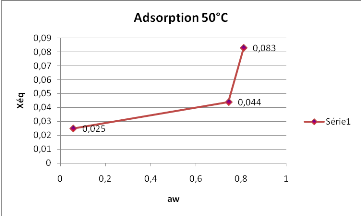
Figure 7 : Isotherme d'adsorption du
SolanummelongenaL. obtenue à 50°C
Les résultats de la figure 8, montrent que
l'adsorption à 60° présente une croissance de la teneur en
eau très moins importante que celle qui a été
observée à 40° et 50°.
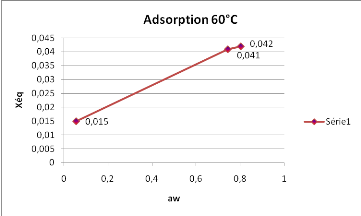
Fig. 8 : Isotherme d'adsorption du
SolanummelongenaL.obtenue à 60°C
Les résultats de la figure 9, prouvent
réellement qu'à la désorption d'un produit, la teneur en
eau diminue inversement à la température, ce qui est une
observation très marquée à 40°C.
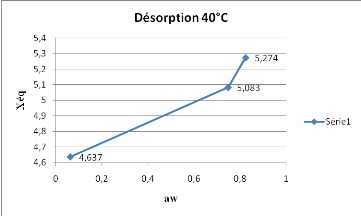
Figure 9 : Isotherme de désorption du
SolanummelongenaL. obtenue à 40°C
Contrairement à ce qui a été
observé à la figure 9, l'évolution décroissante de
la teneur en eau est faiblement marquée pour la figure 10.
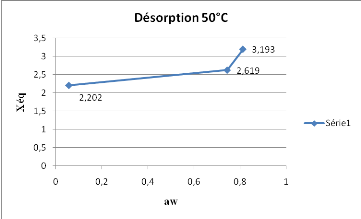
Figure 10 : Isotherme de désorption du
SolanummelongenaL..obtenue à 50°C
Les résultats de la figure 11, montrent une
diminution très marquée de la teneur en eau inversement à
celle qui a été signalée pour la figure 9 et une
augmentation presque marquée que ce qui a été
observée à la figure 10.
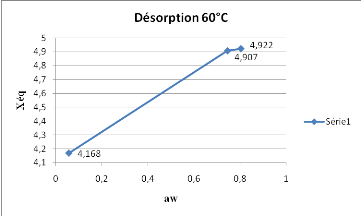
Figure 11 : Isotherme de désorption du
SolanummelongenaL. obtenue à 60°C
III.3. Hystérésis
Obtenues
Les figures 12, 13, et 14, montrent respectivement les
résultatsexpérimentaux obtenus pour les hystérésis
d'adsorption-désorption du produit étudiéspour les
températures 40, 50 et 60°C. Nous avons donc :
La courbe d'absorption observée sur la figure 12,
se superpose avec celle de la désorption, ce qui selon la
littérature, ne met donc pas en évidence le
phénomène d'hystérésis.
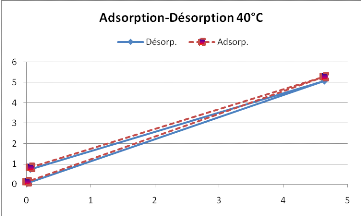
Figure 12 : Hystérésis du
SolanummelongenaL. obtenue à 40°C
La figure 13, montre que la courbe d'absorption ne se
superpose pas avec celle de désorption, mettant en évidence un
phénomène d'hystérésis très importante.
L'isotherme d'adsorption est donc inférieure à celle de la
désorption, ce qui vérifie la littérature (Boumediene,
2004).
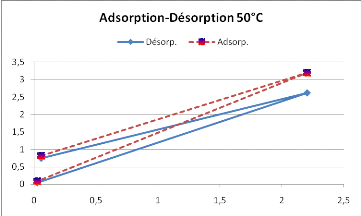
Figure 13 : Hystérésis du
SolanummelongenaL.obtenue à 50°C
La courbe d'absorption observée sur la figure 14,
se superpose avec celle de la désorption, ne met donc pas en
évidence le phénomène d'hystérésis.
Rappelons que c'est le même phénomène observé avec
la figure 12. L'isotherme d'adsorption n'est donc pas inférieure
à celle de la désorption.
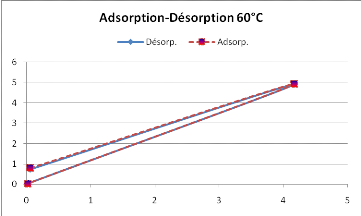
Figure 14 : Hystérésis du
SolanummelongenaL. obtenue à 60°C
Ainsi, pour Boumediene (2004), différentes
hypothèses sont émises dans la littérature pour expliquer
ce phénomène d'hystérésis, montrant que
l'hystérésis de corps susceptibles de gonfler est due au fait que
les déformations de ces corps lors de leur gonflement et de leur
déshydratation ne se déroulent pas de manière
élastique. En effet, même en diminuant ou en éliminant les
forces de déformation en action, l'état de déformation de
ces corps se maintient partiellement. Il en résulte des tensions
diminuées, une pression de gonflement réduite et une
capacité de sorption plus importante lors de la désorption. Lors
d'une déshydratation importante ou totale, des modifications
structurelles irréversibles peuvent apparaître.
Les courbes expérimentales (figure 6, 7 et 8)
obtenues pour l'adsorption, montrent que pour une activité de l'eau
donnée aw, la teneur en eau d'équilibre
Xéqaugmente inversement avec la température (c'est-à-dire
lorsque la température diminue). Des résultats similaires ont
été rapportés dans la littérature (Benhamou et
al.,2010).
Pour la désorption, les courbes
expérimentales (figure 9, 10 et 11) obtenues montrent que pour une
activité de l'eau donnée aw,la teneur en eau
d'équilibre Xéq évolue de façon variable, on
observe une grande désorption à 40°C et 60°C,
phénomène faiblement observé à 50°C.
III.4. Détermination de la chaleur isostérique
de sorption
Les chaleurs isostériques nettes de
désorption et d'adsorption de l'eau du SolanummelongenaL. ont
été corrélées avec la teneur en eau
d'équilibre du produit par les relations empiriques suivantes :
Qst(désorption) = 199,7955 - 25,1683Xeq
+1,0678X2eq - 0,015X3eq
R2= 0,996
Qst (adsorption) = 18,
9545 - 2,2430Xeq +0,0894X2eq - 0,0012X3eq
R2 = 1
Les valeurs obtenues on abouties aux figures
ci-dessous :
La figure15, présente une évolution
quasi-ambigüe de la chaleur isostérique d'adsorption de notre
produit, car nous observons une augmentation brusque et rapide de Qst puis une
rapide diminution ce qui fait en sorte que dans un état brusque, la
teneur en eau diminue très fortement puis augmente pour presque revenir
à l'état initial.
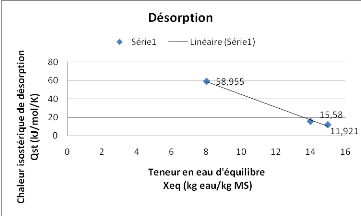
Figure 15 : Chaleur isostérique de
désorption du SolanummelongenaL.
La figure 16, montre que la chaleur isostérique
d'adsorption de notre produit, augmente inversement avec la teneur en eau
contrairement à ce qui est observé à la figure 15.
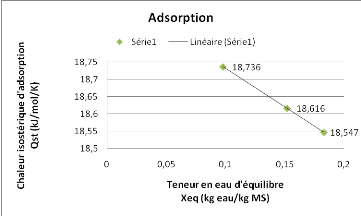
Figure 16 : Chaleur isostérique d'adsorption du
SolanummelongenaL
CONCLUSION ET PERSPECTIVES
Notre travail a consisté à l'étude
théorique et expérimentale des isothermes
d'adsorption-désorption des Aubergines. Ces isothermes de sorption,
appelées souvent courbes de sorption, traduisent l'hygroscopicité
des produits déterminés par les relations physiques et
physico-chimiques existant entre l'eau et les autres constituants. Les courbes
de sorption expérimentales de l'aubergine (SolanummelongenaL.)
ont été déterminées par la méthode
gravimétrique statique pour trois températures (40, 50 et
60°C).
Elles ont permis de déterminer les seuils de
température maximale et les teneurs en eau finales qui servent à
optimiser les conditions de séchage du SolanummelongenaL. de
manière à assurer sa stabilité physico-chimique et
microbiologique durant le stockage.
Les courbes expérimentales obtenues pour
l'adsorption, montrent que pour une activité de l'eau donnée
aw, la teneur en eau d'équilibre Xéq augmente
inversement avec la température (c'est-à-dire
décroît lorsqu'on augmente la température ou inversement).
Pour la désorption, les courbes
expérimentales obtenues montrent que pour une activité de l'eau
donnée aw, la teneur en eau d'équilibre Xéq
évolue de façon variable, car, on observe une grande
désorption à 40°C et 60°C, phénomène
faiblement observé à 50°C.
Les résultats expérimentaux montrent
qu'à 50°C,la courbe d'absorption ne se superpose pas avec celle de
la désorption, mettant en évidence le phénomène
d'hystérésis,contrairement à ce qui est observé
à40 et 60°C où la courbe d'absorption se superpose avec
celle de la désorption, ne mettant donc pas en évidence le
phénomène d'hystérésis.
La chaleur isostérique d'adsorption de notre
produit, augmente inversement à la teneur en eau contrairement à
ce qui est observé dans le cas de la désorption.
Notrehypothèse s'avère être
exacte en partant de nos observations sur les tableaux et courbes obtenues,en
ce que la teneur en eau d'équilibre Xéq augmente inversement avec
la température (c'est-à-dire décroît lorsqu'on
augmente la température ou inversement) phénomène
observé lors de l'adsorption.
Nous avons noté que l'influence de la
température sur les isothermes est bien remarquableet également
que le prétraitement à une influence sur le traçage des
isothermes.
L'étude thermodynamiques ou la détermination
des courbes de sorption constitue une étape préliminaire pour
étudier la cinétique de séchage d'un produit.
Ainsi, dans nos perspectives, nous souhaitons prolonger
nos travaux par :
- Une étude dynamique des isothermes de sorption
- La détermination d'une cinétique de
séchage du Solanummelongena L.
- L'étude de l'influence des paramètres du
séchage sur la qualité du produit à sécher
- L'étude des modèles mathématiques
reposant sur des bases plus ou moins physiques des isothermes de sorption du
produit afin de décrire la relation entre la teneur en eau
d'équilibre, l'humidité relative d'équilibre et la
température.
BIBLIOGRAPHIE
1. AGHFIR, M., KOUHILA, M., JAMALI, A., IDLIMAM, A.,
LAMHARRAR, A., et RHAZI, M., 2005. Isothermes d'adsorption-désorption
des Feuilles de Romarin (Rosmarinusofficinalis), 12èmes
Journées Internationales de Thermique. Laboratoire d'Energie Solaire et
des Plantes Aromatiques et Médicinales. Ecole Normale Supérieure,
pp. 215-218
2. AHOUANNOU, C., JANNOT, Y., SANYA, E., et DEGAN, G.,
2010. Détermination expérimentale et modélisation des
isothermes de désorption de produits agricoles tropicaux. Afrique
SCIENCE 06(3) (2010) pp. 1 - 17
3. ANONYME 1, 2002. Aubergine, Saison(s) Eté, via
www.legumes.ch/public/index.php?cid=1111&ekuid=22/consulté
le 28/03/2014
4. ANONYME 2, 2002. Aubergine, via
www.sante.lefigaro.fr/mieux-etre/.../aubergine/que-contient-l'aubergine/consulté
le 28/03/2014
5. ANONYME 3, 2002. Aubergines, via
www.termeantoniano.it/pdf/fr/aubergines.pdf/consulté
le 29 /03/2014
6. BENHAMOU, A., KOUHILA, M., ZEGHMATI,B.etBENYOUCEF, B.,
2010. Modélisation des isothermes de sorption des feuilles de
marjolaine. Revues des énergies renouvelables vol. 13 N°2 (2010)
pp. 233-247.
7. BENIES, J. 1999. Recherche de types d'aubergine
Africaine, via. www.vohikala.net/telecharger/aubergine.pdf consulté le
22/11/2014
8. BOKI, K. 1990. Moisture sorption characteristics of
kudzu starch and sweet potato starch, Journal of Food Science, vol. 55, n°
1, pp. 232-235.
9. BOUMEDIENE, T., 2004. Etude théorique et
expérimentale du séchage Solaire des feuilles de la menthe
verte (Mentha viridis), thèse de doctorat
d'état, faculté des sciences appliquées de lyon, 166 p.
10. CABURET, A., DALY, P., de BON, H., HUAT, J., LANGLAIS,
C., LYANNAZ, J. P., et RYCKEWAERT, P., 2002. Les Légumes.
Mémento de l'agronome, ministère des affaires
étrangères, CIRAD-GRET, Paris pp. 1023-1049
11. CHEFTEL, J. C. et CHEFTEL, H., 1984. Introduction
à la biochimie et à la technologie des aliments, vol. 1, chapitre
1, Techniques et Documentation lavoisier, paris, pp. 6-22 ;
303-332.
12. CHEFTEL, J. C., CHEFTEL, H. & BESANCON, P., 1983.
Introduction à la biochimie et à la technologie des aliments, vol
2, Techniques et Documentation Lavoisier, Paris, pp 167-198, 201-204,
210.
13. ETOUMAUD, A., 2007. Chimie des denrées
alimentaires/eau via
www.epsic.ch/branches/chimie/---/21eau---
) consulté le 05/02/2015
14. GOODLAD, 2002. Les atouts santé de l'aubergine,
via
www.lanutrition.fr/.../aubergines/les-atouts-sante-de-l-aubergine.htm/consulté
le 29 mars 2014
15. IGLESIAS, H. & CHIRIFE, J., 1976. Isosteric heats
of water vapour sorption on dehydrated foods. Part II: hysteresis and heat of
sorption comparison with BET theory, Lebensmittel-Wissenchaft und Technologie,
vol. 9, pp. 123-127.
16. JANNOT, Y., 2008. Isothermes de sorption :
modèles et détermination via www.
Thermique55.com/.../sorption.pdf consulté le 24/12/2014
17. MARTINEZ, N. & CHIRALT, A., 1996. Influence of
roasting on the water sorption isothrems of nuts, food SciTechnolInt, 2 (6),
pp. 6268-6273
18. MAYELE, D., 2014. Froid et Séchage, notes
de cours Deuxième grade Chimie et Industries Agricoles, Faculté
des Sciences Agronomiques, UNIKIN, 76p. Inédit.
19. NKOUAM, G., 2007. Conservation des fruits du
karité (VitellariaparadoxaGaertn.) et de l'aiéte
(CanzriumschweinfurthiiEngl.) : isothermes de sorption d'eau et
d'extraction des matières grasses des fruits stockés,
thèse de doctorat, Université de Ngaoundéré,
288p.
20. NOUMI, G.B., LAURENT, S., NGAMENI, E., KAPSEU, C.,
JANNOT, Y. et PARMENTIER, M., 2004. Modélisation de la
déshydratation de la pulpe des fruits du
CanariumschweinfurthiiEngl. TROPICULTURA, pp. 2, 22, 70-76
21. RIZVI, S. H., 1986. Thermodynamic Properties of Foods
in Dehydration. In M. A. RAO & S. S. H. RIZVI (eds), Engineering Properties
of Foods, chapter 2, Marcel Dekker, Inc, New York 10016, pp 140-164.
22. SALGADO, M.,1994. Modelling of water activity and
enthalpy of water sorption in cassava chips, Drying Technology, vol. 12, pp.
1743-1752.
23. TSAMI, E., 1991. Net isosteric heat of sorption in
dried fruits, Journal of Food Engineering, vol. 14, pp. 327-335.
| 


