CHAPITRE 1: ETUDE BIBLIOGRAPHIQUE
1.1. POLLUTION PAR LES PRODUITS PHARMACEUTIQUES 1.1.1.
Définitions
Les micropolluants dans l'environnement aquatique sont un
problème majeur tant pour la population humaine, utilisatrice des
ressources en eau, que pour les écosystèmes aquatiques. Parmi les
micropolluants émergents, les produits pharmaceutiques ont attiré
l'attention depuis plusieurs années. Ce sont des substances actives qui
peuvent rester longtemps dans l'eau. De plus, de nombreuses recherches montrent
que différentes classes pharmaceutiques, telles que les antibiotiques,
les analgésiques, les anti-inflammatoires, les agents de contraste ou
les antiépileptiques, sont contenues dans les eaux (Soufan, 2011).
Les résidus de médicaments sont rejetés
en continu dans les eaux usées par l'utilisation domestique, les rejets
de l'industrie pharmaceutique, l'agriculture et les établissements de
santé. De plus, les composés pharmaceutiques assimilés par
l'homme et les animaux peuvent se dégrader au sein des organismes
vivants, et les produits de dégradation issus de la
métabolisation, également excrétés dans les urines
ou les excréments, peuvent aussi être considérés
comme micropolluants (Soufan, 2011). Les stations d'épuration, bien
qu'elles se soient significativement améliorées sur le plan
technique ces dernières années, n'ont pas été
conçues pour éliminer la totalité des molécules
pharmaceutiques. Par exemple, même si le paracétamol y est
dégradé à plus de 90 %, on en trouve des traces dans les
eaux usées remises en circulation, puis dans les eaux de surface (Kolpin
et al., 2002). Ces résidus de produits pharmaceutiques,
rejetés dans les eaux de surface, peuvent donc présenter un
risque environnemental non négligeable, de même que leurs
métabolites ou sous-produits de dégradation, parfois plus
dangereux que le produit d'origine (Soufan, 2011).
1.1.2. Sources de contamination par les produits
pharmaceutiques
Après usage, les produits pharmaceutiques sont
excrétés sous leur forme native ou sous forme de
métabolites et peuvent accéder aux systèmes aquatiques par
différentes voies. Ce sont les eaux usées municipales qui
constituent la source principale de contamination de l'environnement par les
médicaments à usage humain. Les effluents des hôpitaux et
de l'industrie pharmaceutique, ainsi que les lixiviats de décharge des
centres d'enfouissement représentent aussi une source non
négligeable. Ces produits pharmaceutiques sont plus ou
4
moins éliminés par les stations de traitement de
l'eau et se retrouvent dans les rivières, les lacs, les estuaires, voire
plus rarement dans les eaux souterraines et l'eau potable. L'épandage de
boues d'épuration contaminées peut également
entraîner la pollution des sols et des eaux de surface par ruissellement.
En outre, les produits pharmaceutiques à usage vétérinaire
peuvent entrer dans les systèmes aquatiques à travers
l'utilisation de fumier dans les champs, mais aussi directement en aquaculture
(Velichkova, 2014).
1.1.3. Impacts environnementaux des produits
pharmaceutiques
Au cours des dernières années, les
composés pharmaceutiques sont considérés comme des
contaminants de l'environnement. Les risques potentiels liés à la
présence de faibles concentrations de composés pharmaceutiques
dans l'environnement sont très mal connus. De même, les risques
possibles dus à la présence de telles substances en
mélange sont actuellement sous le débat (Soufan, 2011).
Toutefois, plusieurs études ont
révélé des cas de féminisation de certains poissons
dans les eaux douces et les milieux marins. Ces phénomènes de
perturbation du système endocrinien pourraient provenir de l'exposition
de certains poissons à des hormones de synthèse féminines
ou d'autres composés d'origine industrielle ou agricole présents
dans les milieux (Soufan, 2011).
1.1.4. Cas du paracétamol
Le paracétamol, dérivé de l'aniline, est
l'analgésique le plus couramment utilisé dans différentes
spécialités médicamenteuses pour le soulagement de la
fièvre, des maux de tête et de certaines douleurs mineures. Il est
transformé dans le foie en métabolites sulfates et
glucuroconjugués, et est excrété dans l'urine. C'est l'un
des médicaments les plus vendus au monde à la fois pour son effet
antalgique mais aussi pour son effet antipyrétique (Driad, 2009). Les
intoxications médicamenteuses restent un problème de santé
publique. Le paracétamol représenterait 4 à 12 % des
intoxications médicamenteuses volontaires. Sa fréquence est
d'autant plus élevée qu'il est accessible rapidement et
disponible sans ordonnance. Compte tenu de la banalisation de son usage, il
passe pour une molécule presque anodine, mais son surdosage demeure un
problème de santé publique important. Le problème
réside dans le fait qu'en cas de surdosage ou de prise volontaire
abusive, le paracétamol peut entraîner des lésions
hépatiques sévères voire mortelles (Driad, 2009). Si ses
effets toxiques à forte dose sont bien connus pour l'homme (dommages
hépatiques), les conséquences sur l'environnement de sa
présence sont moins bien renseignées (Driad, 2009).
5
Lorsqu'il se trouve en solution aqueuse, il est susceptible de
subir une hydrolyse pour former un produit de dégradation primaire:
« para-aminophénol », lui-même
susceptible de donner des produits de dégradation secondaires: «
quinone-imine ». La vitesse de dégradation du paracétamol
croît avec l'augmentation de la température et à la
lumière. Indépendamment de l'hydrolyse, la molécule de
paracétamol subit un autre type de décomposition par formation
d'une quinone-imine susceptible de se polymériser en donnant naissance
à des polymères azotés. Ces polymères et notamment
ceux de N-acétyl para-benzoquinone-imine ont été
décrits en outre comme étant les métabolites toxiques du
paracétamol, notamment cytotoxique et hémolytique. La
décomposition de ce métabolite en milieu aqueux est encore plus
complexe et donne naissance à de la para-benzoquinone et à de
l'hydroquinone (Driad, 2009).
Ils sont très toxiques et peuvent provoquer des
irritations locales. Leur absorption en grande quantité peut provoquer
des modifications neurologiques et musculaires. En expositions
répétées ou prolongées par voie orale, il agit sur
le système nerveux central des hommes et des animaux et provoque une
irritation du pré-estomac, entraine des lésions rénales
sévères et hépatiques (Suresh et al., 2012).
L'utilisation abusive de ce produit en moyenne pendant quatre ans, à des
concentrations élevées sur la peau provoque une pigmentation
inégale de la peau avec des parties complètements
décolorées ou au contraire d'aspect plus sombre, des dermatites
irritantes, des sensations de brulures ou de piqûres (Suresh et
al., 2012).
? Structures et propriétés
physico-chimiques
Le paracétamol se présente sous la forme d'une
poudre cristalline blanche, inodore et de goût amer. C'est un acide
faible, ce caractère a pour conséquence qu'il se trouve
essentiellement sous forme ionisée dans l'estomac et l'intestin
grêle, condition favorable à son absorption à ce niveau. Sa
structure, la structure du N-acétyl-para-benzoquinone imine et les
propriétés physico-chimiques du paracétamol sont
données respectivement par la figure 1.1, figure 1.2 et le tableau 1.1
ci-après.
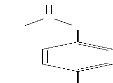
H3C
O
C
NH
OH
Figure 1.1: Structure du
Paracétamol
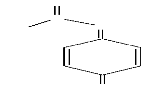
N
H3C
O
C
O
6
Figure 1.2 : structure du
N-acétyl-para-benzoquinone imine
Tableau 1.1: Propriétés
physico-chimiques du paracétamol (Driad, 2009).
|
Paracétamol
|
|
Formule brute
|
C8H9NO2
|
|
Nom scientifique
|
N-acétyl-para-animophénol
|
|
Masse molaire
|
151,2 g/mol
|
|
Point de fusion
|
168-172°C
|
|
PKa
|
9,5
|
|
Solubilité (eau)
|
14 g/L à 20 °C
|
|
Solubilité (alcool)
|
facilement soluble
|
1.2. LES PROCEDES D'ELIMINATION DES PRODUITS
PHARMACEUTIQUES DANS L'ENVIRONNEMENT
1.2.1. Procédés chimiques
? Les procédés d'oxydation classique
(POC)
Les techniques d'oxydation classique utilisent des oxydants
puissants tels que le sodium hypochlorite (NaOCl), l'ozone (O3), l'eau
oxygénée (H2O2) pour dégrader les polluants en solution.
Ces méthodes de traitement sont couramment utilisées pour
l'épuration d'effluents contenant des polluants organiques et
inorganiques en raison de leur mise en oeuvre relativement facile. Cependant,
certains de ces oxydants (le sodium hypochlorite en particulier) sont de moins
en moins utilisés dans ces processus en raison des effets
négatifs qu'ils induisent. Ils réagissent avec les polluants en
solution et donnent lieu à la formation d'amines aromatiques et
d'organochlorés qui sont des composés cancérigènes
(Alvares et al., 2001).
7
? Les procédés d'oxydation avancée
(POA)
Les POA regroupent des méthodes chimiques,
photochimiques ou électrochimiques. Leur développement est en
plein essor depuis environ trois décennies. Elles consistent à
dégrader les molécules de colorants en CO2 et H2O au moyen de
l'UV en présence de peroxyde d'hydrogène. Ces POA regroupent les
technologies qui cherchent à dégrader les polluants organiques
par oxydation via des procédés photocatalytiques susceptibles de
développer des radicaux hydroxyles (
·OH) dont le
pouvoir oxydant est nettement supérieur à celui des oxydants
traditionnels. En plus des systèmes UV-peroxyde, UV-Ozone et du
processus Photo-Fenton, qui a largement démontré leur
efficacité dans l'oxydation des composés organiques, la
photocatalyse hétérogène a aussi émergé
depuis quelques années (Alvares et al., 2001). 1.2.2.
Procédés Physiques
? La filtration sur membrane
Les procédés membranaires sont des techniques de
séparation qui se font à travers une membrane, sous l'action d'un
gradient de pression. La séparation se fait en fonction des tailles
moléculaires des composés, mais aussi en fonction de leur forme
et leur structure (Robinson et al., 2001). Dans ce
procédé, les polluants sont retenus par une membrane
semi-perméable dont le diamètre des pores est inférieur
à celui des molécules à éliminer. Ce
procédé nécessite un post-traitement, ce qui augmente
considérablement le coût de dépollution (Robinson et
al., 2001).
? L'adsorption
L'adsorption est un procédé de traitement, pour
éliminer une très grande diversité de composés
toxiques dans notre environnement. Elle est essentiellement utilisée
pour le traitement de l'eau et de l'air. Au cours de ce processus les
molécules d'un fluide (gaz ou liquide), appelé adsorbat, viennent
se fixer sur la surface d'un solide, appelé adsorbant. Ce
procédé définit la propriété de certains
matériaux de fixer à leur surface des molécules (gaz, ions
métalliques, molécules organiques, etc.) d'une manière
plus ou moins réversible. Au cours de ce processus, il y aura donc un
transfert de matière de la phase aqueuse ou gazeuse vers la surface
solide (Mechrafi, 2002).
1.3. PHENOMENE D'ADSORPTION
L'adsorption est un processus au cours du quelle les
molécules d'un fluide (gaz ou liquide), appelé adsorbat, viennent
se fixer sur la surface d'un solide, appelé adsorbant. Selon
8
la nature des liaisons formées ainsi que la
quantité d'énergie dégagée lors de la
rétention d'une molécule à la surface d'un solide
permettent de distinguer deux types d'adsorption: adsorption physique et
adsorption chimique (Mechrafi, 2002).
1.3.1. Adsorption physique
L'adsorption physique est un phénomène
réversible qui résulte de l'attraction entre les molécules
d'adsorbant composant la surface du solide et les molécules du
soluté de la phase fluide, ces forces attractives sont de nature
physique, comprenant les forces dites de Van der Waals et correspondent
à des énergies faibles qui sont de l'ordre de 5 et 40 kJ/mol. Ce
phénomène consiste essentiellement dans la condensation de
molécules sur la surface du solide et il est favorisé en
conséquence par un abaissement de la température (Mechrafi,
2002).
1.3.2. Adsorption chimique
Les énergies de liaison mises en jeu sont de l'ordre de
40 kJ.mol-1 et plus. C'est un phénomène qui, par sa
spécificité, son énergie d'activation et sa chaleur
dégagée, s'apparente à une réaction chimique entre
molécule en solution et la surface du support. Il y a formation de
fortes liaisons entre adsorbat et adsorbant (covalent par exemple). La couche
adsorbée est au mieux monomoléculaire. Ce phénomène
est plus lent que la physisorption et nécessite une énergie
d'activation (Mechrafi, 2002).
1.3.3. Facteurs influençant sur le
phénomène d'adsorption
L'équilibre d'adsorption, entre un adsorbant et un
adsorbât dépend de nombreux facteurs dont les principaux sont
(Creangã, 2007):
? les caractéristiques de d'adsorbant: polarité,
volume poreux, surface spécifique, fonctions superficielles ;
? les caractéristiques de l'absorbât:
polarité, solubilité, poids et saturation moléculaire ; ?
les paramètres physiques: température, pH.
1.3.4. Mécanisme d'adsorption
Au cours de l'adsorption d'une espèce sur un solide, le
transfert de masse des molécules se fait de la phase fluide vers le
centre de l'adsorbant. Ce processus s'opère au sein d'un grain
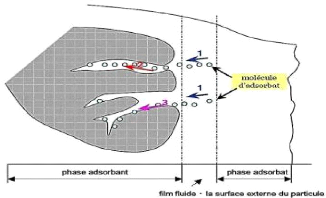
d'adsorbant en plusieurs étapes. La figure 1.2 ci-après
représente le mécanisme de transport d'un adsorbat.
9
Figure 1.3: Schéma du
mécanisme de transport d'un adsorbat au sein d'un grain
( Creangã, 2007).
1. Diffusion externe: Elle correspond au transfert du
soluté (molécules de la phase liquide) du sein de la solution
à la surface externe des particules. Le transfert de la matière
externe dépend des conditions hydrodynamiques de l'écoulement
d'un fluide dans un lit d'adsorbant.
2. Diffusion interne dans la structure poreuse du solide: Les
particules de fluides pénètrent à l'intérieur des
pores. Elle dépend du gradient de concentration du soluté.
3. Diffusion de surface. Elle correspond à la fixation
des molécules sur la surface des pores.
1.3.6. Les isothermes d'adsorption
Une isotherme d'équilibre d'adsorption est la courbe
caractéristique, à une température donnée, de la
quantité de molécules adsorbées par unité de masse
d'adsorbant en fonction de la pression ou de la concentration en phase fluide.
On distingue cinq catégories d'isothermes d'adsorption qui sont : le
type I, II, III, IV, V.
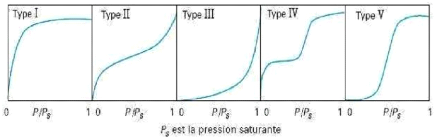
10
Figure 1.4: Types d'isothermes
d'équilibre d'adsorption pour les systèmes gazeux (Reungoat,
2007).
y' Isotherme de type I: l'adsorption est favorable sur des
solides microporeux. La quantité adsorbée est importante
même pour de faibles concentrations de polluant.
y' Isothermes de type II et III: elles sont
généralement observées pour des adsorbants ayant une large
gamme de tailles de pores. Pour chaque système, il y a une progression
continue avec la création de multicouches d'adsorption.
y' Isothermes de type IV et V: dans ces cas, l'adsorption est
dite défavorable puisqu'il faut une forte concentration de
composé en phase liquide pour avoir des quantités
adsorbées importantes.
Plusieurs auteurs ont élaboré des formulations
mathématiques modélisant les isothermes d'adsorption:
+ Isotherme de Langmuir
L'isotherme de Langmuir, fut la première à
être développée en 1918. Elle est définie par une
capacité maximale d'adsorption qui est liée à la
couverture des sites de surface par une monocouche. Les hypothèses de ce
modèle sont les suivantes:
> Les sites d'adsorption sur la surface solide sont
homogènes d'un point de vue énergétique: on parle de
« surface d'adsorption homogène » ;
> Chacun de ces sites peut adsorber une seule molécule,
et l'adsorption est monocouche; > Chacun des sites à la même
affinité pour les molécules en solution;
> Il n'y a pas d'interactions entre les molécules
adsorbées.
L''isotherme est donnée par :
(1.1)
Cette équation est généralement
utilisée sous la forme linéaire:
11
(1.2)
Où Ce est la concentration
de l'adsorbat à l'équilibre dans la solution (mg/g),
Qm est la capacité d'adsorption
maximale de l'adsorbant (mg/g) et K est la constante de
Langmuir. Les constantes Qm et KL
sont calculées de la pente et de l'interception du tracé
linéaire de Ce/Qe en fonction de
Ce. On observera qu'une faible valeur de KL
correspond à une forte affinité du soluté pour la
surface de l'adsorbant (Ajifack et al,. 2014).
? L'isotherme de Freundlich
Le modèle de Freundlich est semi-empirique. Il est
basé sur l'hypothèse d'une surface
hétérogène de l'adsorbant, avec une distribution
exponentielle des sites actifs en fonction des énergies d'adsorption.
L'expression non linéaire de cette isotherme est:
(1.3)
Où Kf est le paramètre relatif à la
capacité d'adsorption (mg1 -1/n L1/n g-1). Sa forme linéaire
obtenue par la transformation logarithmique est :
(1.4)
Cette équation permet de déterminer les constantes
empiriques (Kf et 1/n) de ce modèle.
Partant du tracé linéaire lnQe = f(lnCe), on
pourra déterminer les constantes de Freundlich (Kf et 1/n). Quand la
valeur de 1 /n est inférieure à l'unité, l'adsorption est
favorable ; au contraire quand la valeur 1/n est supérieure à
l'unité, cela indique une adsorption défavorable. La constante Kf
représente l'affinité du solide pour les composés (Ajifack
et al., 2014).
? L'isotherme de Dubinin-Radushkevich
Le modèle de Dubinin-Radushkevich fut
développé pour l'adsorption des substances à l'état
de traces en phase aqueuse sur les solides poreux. Ce modèle est plus
général que celui de Langmuir car il est applicable même
pour les sites d'adsorption non homogènes (Sousa et al., 2012).
Cette isotherme est donnée par l'équation (1.5)
(1.5)
Où Qe est la quantité de
molécules adsorbées par unité de masse d'adsorbant en mg/g
; Qmla capacité maximale d'adsorption de l'adsorbant par
unité de masse mg/g; å le potentiel de Polanyi (kJ/mol), son
expression est donnée par l'équation (1.6)
å= RT ln (1+1/Ce) (1.6)
12
R constante des gaz parfaits (R = 8,314 x 10-3
kJ/mol/K); T la température absolue (T= 298 K) et K': constante
liée à l'énergie d'adsorption
(mol2K/J2).
La forme linéaire de l'isotherme de D-R est donnée
comme suit :
(1.7)
K' est obtenue à partir de la pente du tracé de
lnQe en fonction de å2, et l'énergie moyenne
d'adsorption E (KJ/mol) peut être obtenue à partir de la valeur de
K' en employant l'équation suivante (Sousa et al., 2012):
E = (-2K')-1/2 (1.8)
Les valeurs de l'énergie d'adsorption (E) trouvées
à partir de cette isotherme permettront d'élucider le processus
ou le mécanisme mis en jeu au cours du processus d'adsorption.
E< 8 kJ/mol, la physisorption domine le processus
d'adsorption;
E située entre 8 et 16 kJ/mol, l'échange ionique
est le processus dominant;
E > 16 kJ/mol, l'adsorption est dominée par la
diffusion intra particulaire.
? L'isotherme de Temkin
La dérivation de l'isotherme de Temkin suppose que
l'abaissement de la chaleur d'adsorption est linéaire plutôt que
logarithmique, comme appliqué dans l'équation de Freundlich
(Sousa et al., 2012). L'isotherme de Temkin est donnée par
l'équation
(1.9)
La forme linéaire de ce modèle est donnée
par
(1.10)
Où B= est la Constante de Temkin relative à
l'énergie d'adsorption (KJ/mol); A est la
Constante d'isotherme de Temkin (L/mg) ; R
est la Constante des gaz parfaits (8,314J/mol.K);
Ce la concentration à l'équilibre des
adsorbants (mg/L); Qe est la quantité
adsorbée à l'équilibre en (mg/g); T la
température absolue (K) et ?Q (en kJ/mol) est la
variation de la chaleur d'adsorption.
Le tracé linéaire Qe =
f(lnCe) permet de déterminer la pente B = , puis en
introduisant une valeur de Qm (par exemple issue du
modèle de Langmuir), on peut aisément déterminer la
variation de la chaleur d'adsorption ?Q.
13
1.3.7. Modélisation de la cinétique
d'adsorption
La cinétique d'adsorption donne la vitesse du
processus, le temps minimum nécessaire pour que l'adsorption soit
complète et les informations sur l'étape limitante du processus.
Nous ne décrivons ici ceux qui seront utilisé dans notre
étude.
? Modèle de pseudo-premier ordre
Dans ce modèle la vitesse d'adsorption à
l'instant t est proportionnelle à la différence entre la
quantité adsorbée à l'équilibre Qe et la
quantité Qt adsorbée à cet instant et que l'adsorption est
réversible. La constante de vitesse d'adsorption du premier ordre est
déduite à partir du modèle établi par Lagergren. La
loi de vitesse s'écrit (Ho, 2004):
(Qe-Qt) (1.11)
Où Qe et
Qt sont respectivement les capacités d'adsorption à
l'instant t (min) et à l'équilibre (mg/g) et k1 la Constantes de
vitesse d'adsorption pour le premier ordre (min-1).
L'intégration de l'équation (1.10) donne :
(1.12)
.
La valeur de k1 sera déterminée à partir du
tracé linéaire ? Modèle de la cinétique du
pseudo- second ordre
L'équation du pseudo-second ordre est souvent
utilisée avec succès pour décrire la cinétique de
la réaction de fixation des polluants sur l'adsorbant. Le modèle
du pseudo-second ordre permet de caractériser la cinétique
d'adsorption en prenant en compte à la fois le cas d'une fixation rapide
des solutés sur les sites les plus réactifs et celui d'une
fixation lente sur les sites d'énergie faible:
(1.13)
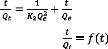
Où k2 (g mg-1 min-1)
représente la constante de vitesse pour une cinétique du
deuxième ordre. L'intégration de l'équation ci-dessus
donne:
. (1.14)
Le tracé de la courbe permet de déterminer la
vitesse initiale (ho)
d'adsorption qui est donnée par (Ho & Mckay, 1999): h0
= K2Qe2
14
? Modèle de diffusion
intraparticulaire
L'équation du modèle de diffusion intraparticulaire
est donné par :
P= kidta . (1.16)
La transformée linéaire de cette équation
donne :
(1.17)
Où P est le pourcentage
d'élimination; kid est la constante de
vitesse de diffusion intraparticulaire ou le facteur de vitesse c'est-à-
dire le pourcentage d'adsorbat par unité de temps (min-1);
a est le gradient de la droite et dépend du
mécanisme d'adsorption
Le tracé de lnP = f (lnt) donne une droite si ce
modèle est applicable et permet de déduire a et kid
qui sont respectivement la pente et l'ordonnée à l'origine.
L'étape limitante est la diffusion des molécules à
l'intérieur des pores de l'adsorbant. Lorsque a tend vers 0
l'agglomération à la surface est importante et lorsque a tend
vers 1, l'agglomération y est faible (Zora et al., 2006).
1.4. LES CHARBONS ACTIFS (CA)
Le Charbon actif est l'un des premiers matériaux
adsorbants utilisés à grande échelle. L'utilisation du
charbon remonte à l'antiquité. Dans le cadre de la
médecine et du traitement des odeurs, les propriétés
d'adsorption des charbons actifs ont été utilisées par les
Égyptiens dans les années 1550 avant Jésus Christ. Un
siècle plus tard, les Phéniciens furent les précurseurs de
son utilisation pour rendre l'eau potable (Tatianne, 2011).
1.4.1. Définitions et description
Les charbons actifs sont les matériaux carbonés
amorphes préparés de manière à exhiber un
degré de porosité élevé et une surface intra
particulaire étendue (Pope, 2001). Ceux-ci ont une
caractéristique essentielle qu'est l'existence d'un réseau
très développé de micropore, lesquels sont à
l'origine de leur pouvoir adsorbant très important. Par
conséquent, ces derniers constituent les adsorbants les plus
fabriqués et les plus utilisés industriellement. Les pores bien
répartis de façon non uniforme à la surface de ces
derniers d'où l'existence d'un important majoritaire des micropores et
mésopores.
Les CA ont des structures moléculaires et cristallines
semblables à celles du graphite. La structure graphitique est
hexagonale, les atomes de carbone s'y trouvant sont distants d'environ 1,45
Å, formant des plans parallèles les uns aux autres. Le charbon
actif est un
15
carbone microporeux inerte qui a subi un traitement permettant
l'augmentation de sa surface interne. Il possède ainsi une très
grande surface spécifique pouvant aller de 200 à 2000
m2/g de charbon actif. Ce qui lui permet ainsi d'avoir une grande
capacité d'adsorption (Zue, 2012).
1.4.2. Préparation des charbons actifs
Le charbon actif est un produit adsorbant obtenu à
partir des matières premières riches en carbone (le bois, la
tourbe, le lignite, l'écorce de coco...). Une fois ces matières
premières sélectionnées, elles sont activées
physiquement ou chimiquement dans des fours d'activation. Par cette activation
on obtient, une structure de carbone hautement poreuse et très active.
La préparation des charbons activés s'effectue en deux grandes
étapes : la carbonisation et l'activation (Slasli, 2002).
? La carbonisation
La carbonisation ou pyrolyse est la décomposition
thermique d'un matériau organique sous vide ou sous atmosphère
inerte à des températures comprises entre 400 et 1000°C. Les
hétéroatomes (oxygène et hydrogène) sont
éliminés sous l'effet de la chaleur et le matériau devient
plus riche en carbone. Les atomes de carbone restants se regroupent en
feuillets aromatiques possédant une certaine structure planaire. Ces
feuillets s'arrangent ensuite d'une manière irrégulière
laissant ainsi des interstices entre eux. Ces interstices donnent naissance
à une porosité primaire du produit carbonisé. Le produit
obtenu par la pyrolyse ne possède qu'une porosité rudimentaire et
ne peut pas être employé comme adsorbant sans une activation
supplémentaire (Slasli, 2002).
? Activation
L'activation consiste à développer la structure
poreuse en éliminant les goudrons qui obstruent les pores, et à
créer des fonctions de surface (généralement
oxydées) qui sont à l'origine des interactions entre le solide et
les molécules adsorbées. Elle peut être physique ou
chimique.
? L'activation physique
Elle comporte deux étapes successives sous
atmosphère contrôlée. Après séchage des
matières premières à 170°C environ, une carbonisation
est effectuée afin d'éliminer les matières volatiles dans
le squelette carboné du matériau. Cette étape se fait
à 600-700°C
16
durant 6 à 8 heures. La seconde étape est
l'activation qui permet de développer les pores existants et d'en
créer d'autres Cette opération se fait à 800-1000°C,
en présence d'un gaz faiblement oxydant (air), du dioxyde de carbone, de
l'oxygène et/ou de la vapeur d'eau, durant 24 à 72 heures
(Cherraye, 2012).
? L'activation chimique
Elle consiste à imprégner le matériau de
départ avec une solution concentrée d'agent très oxydant
et/ou déshydratant (acide phosphorique, chlorure de zinc...). Le
matériau subit ensuite une pyrolyse entre 400°C et 600°C
à l'abri de l'air, puis est lavé et séché. Le
charbon actif est ainsi obtenu en une seule étape. C'est le degré
d'imprégnation du matériau en matière oxydante qui
définit la structure poreuse finale (Slasli, 2002).
1.4.3. Types de charbons actifs
Le CA peut se présenter sous trois formes: en poudre
(CAP), en grain (CAG) et en tissus (CAT), dont chacun présente ses
avantages suivant l'application visée. Le tableau 1.2 ci-apres classifie
la forme des charbons actifs.
Tableau 1.2: Classification de la forme des
charbons actifs (Kafack, 2012).
|
Type de CA
|
Granulométrie
|
Avantages
|
Inconvénients
|
Applications
|
|
CAP
|
Inférieure à
0,2mm
|
Bonne capacité
d'adsorption
Recyclable
|
Quantité Importante
|
Traitement en
phases gazeuse et
aqueuse
|
|
CAG
|
Inférieure à 0,4mm
|
Bon filtre
|
|
Traitement en phase
aqueuse
|
|
CAT s
|
|
meilleure
cinétique
|
risques de déchirement
pour des débits
de
fluides élevés
|
Traitement en phase
Gazeuse
|
1.4.4. Propriétés d'un charbon actif ?
Structure d'un charbon actif
La structure cristalline du CA consiste en un assemblage de
couches planes d'atomes de carbone, ordonnés en hexagones
réguliers, comparables aux cycles aromatiques (figure 1.3 ci-dessous).
L'analyse de diffraction aux rayons X, révèle que sa structure
est graphitique, mais
17
avec quelques différences, notamment par la disposition
de ces couches planes d'atomes de carbone en un agencement
désordonné et par la formation de groupements fonctionnels, dus
à la présence d'hétéroatomes (oxygène,
azote, soufre) dans le réseau cristallin. Ces modifications de structure
pourront engendrer des interactions spécifiques (groupements
fonctionnels) et des interactions non spécifiques
(hétérogénéité du réseau) pour cet
adsorbant (Zue, 2012).
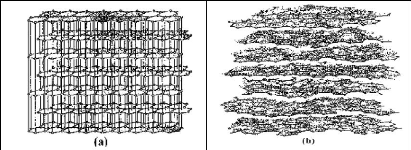
Figure 1.5 : Structure cristalline : (a)
graphite ; (b) charbon actif ? Surface spécifique d'un
charbon actif
Par définition, la surface spécifique d'un
adsorbant est sa surface par unité de masse. Elle est
généralement exprimée en m2/g. Son estimation
est conventionnellement fondée sur des mesures de la capacité
d'adsorption (Qm) de l'adsorbant en question, correspondant à
un adsorbat donné. La molécule adsorbée doit avoir une
surface connue et acceptable. Il suffit à cet effet, de
déterminer la valeur de la capacité de la monocouche à
partir de l'isotherme d'adsorption (Zue, 2012).
? Les tailles des pores et le volume poreux d'un charbon
actif
La classification des pores adoptée actuellement par
l'Union Internationale de Chimie Pure et Appliquée (U.I.C.P.A.) est
fondée sur leurs tailles. Trois catégories de pores ont
été définies dans le Tableau (1.3).
18
Tableau 1.3 : Répartition des pores
d'un adsorbant.
|
Désignation
|
Rayon moyen de
pores (nm)
|
Volume poreux
(Cm3/g)
|
Surface
spécifique
(m2/g)
|
|
Micropores
|
< 2
|
0,2 - 0,6
|
400 - 900
|
|
Mésopores
|
2 - 50
|
0,02 - 0,1
|
20 - 70
|
|
Macropores
|
> 50
|
0,2 - 0,8
|
0,5 - 2
|
1.4.5. Utilisation des charbons actifs
Les CA sont des matériaux poreux couramment
utilisés depuis des siècles dans de nombreuses applications
domestiques et industrielles (purification de l'air, dépollution des
effluents domestiques et industriels, purification ou décoloration de
produits agroalimentaires). Ces applications ont considérablement
évolué, et aujourd'hui, les CA peuvent même être
utilisés comme support de catalyse (Tatianne, 2011).
19
| 


