CHAPITRE 2 : MATERIELS, REACTIFS ET METHODES
Ce chapitre présente brièvement les
différents matériaux, les réactifs chimiques, les
équipements ainsi que la description du mode opératoire du
processus d'adsorption du paracétamol en solution aqueuse.
2.1. MATERIAUX
2.1.1. Collecte des balles de riz
Les balles de riz utilisées dans le cadre de ce travail
ont été récoltées dans l'Arrondissent de Ndop
(région du Nord-Ouest Cameroun). Les balles de riz ont été
lavées à l'eau du robinet, ensuite rincées à l'eau
distillée pour éliminer les impuretés et enfin
séchées à température ambiante pendant 72
heures.
2.1.2. Préparation du charbon actif
Apres la récolte les balles de riz lavées ont
été imprégnées. Pour la réaliser, une masse
de 20 g de biomasse a été mise en contact avec 35 mL d'une
solution de NaOH 1M. L'activation a duré 30 minutes et a
précédé le séchage à 105°C pendant 24
heures.
Les échantillons de balles de riz
imprégnés ont été carbonisés pendant 1heure
à 450°C et 500°C à la vitesse de chauffage de
5°C/min en utilisant un four de marque ISUNU. Les produits de la
calcination obtenus ont été lavés à l'eau
distillée dans l'optique d'éliminer l'excès de NaOH ainsi
qu'augmenter la pureté des CA. Les différents charbons actifs
ainsi obtenus, dénommés: CANa1(500°C)et CANa2(450°C),
ont été séchés pendant 24 heures à la
température de 105°C, puis broyés et tamisés pour
obtenir les particules de taille inférieure à 100 um.
2.1.3. Méthodes de caractérisations des
charbons actifs 2.1.3.1. Spectroscopie IR-TF
Les différents charbons actifs ont été
caractérisés par spectroscopie Infra-Rouge à Transformer
de Fourrier (IR-TF). Cette technique permet d'identifier les fonctions
chimiques de surface (Kifuani et al., 2012). C'est une technique
analytique présentant trois principaux avantages à savoir sa
rapidité, sa non destructivité et l'utilisation de faible
quantité d'échantillon.
La méthode de Réflexion Totale
Atténuée (RTA) utilisée dans le cadre de ce travail est
une technique de réflexion dans laquelle on utilise un dispositif
optique de réflexion interne
20
possédant un indice de réfraction
élevé (diamant, germanium, silicium, etc) pour les mesures
(Kenne, 2011). Dans ces travaux, l'enregistrement a été
effectué par le biais d'un spectrophotomètre JR de marque Alpha-P
de la firme Brüker. Dans la pratique, quelques milligrammes de
matériau ont été déposés sur la surface de
mesure constituée d'un cristal RTA diamant. Après avoir recouvert
l'échantillon grâce à un dispositif intégré
à l'appareil, l'enregistrement du spectre a été
directement réalisé.
2.1.3.2. Détermination du point de charge nulle
(pHpzc)
Le pHpzc correspond à la valeur de pH pour lequel la
charge globale de la surface du charbon actif est nulle. Ce paramètre
est très important dans les phénomènes d'adsorption,
notamment lorsque les forces électrostatiques sont impliquées
dans les mécanismes. Le pHpzc permet de déterminer le
caractère acide ou basique d'un charbon et de connaître, selon le
pH de la solution, la charge de surface nette du matériau. Ainsi,
lorsque le pHpzc > pH, la surface du CA est chargée positivement, et
lorsque pHpzc < pH la surface du CA est chargée négativement
(Tatianne, 2011). Il a été déterminé pour
l'ensemble des charbons actifs en utilisant la méthode décrite
par Lopez-Ramon et al., (1999).
Afin de connaitre la charge globale du matériau en
fonction du pH de la solution, des solutions de NaCl 0,1M dont les pH ont
été ajustés entre 2et 10 (par ajout d'une solution aqueuse
de NaOH ou de HCl de concentrations10-3M) ont été
préparées à l'avance. Le pH-mètre (pHS-25) a
été utilisé pour la mesure du pH. Le charbon actif sec
(0,1 g) est mis en contact avec 20 mL de chacune des solutions
précédentes contenues dans des flacons. Les suspensions ont
été ensuite agitées sur une table d'agitation pendant 24
heures à température ambiante. Chaque mélange a
été ensuite filtré à l'aide d'un papier filtre
(Whatman) et une nouvelle mesure du pH est effectuée. Le tracé de
la courbe pHfinal = f (pHinitial) permet de déterminer le
pHpzc (intersection entre cette courbe et la première bissectrice).
2.1.3.3. pH du charbon
Nous avons eu à déterminer le pH de la surface
du charbon en mettant en contact 50 mL d'eau distillée, et 0,5 g de
charbon actif dans un flacon suivi de l'agitation du mélange pendant
24heures à température ambiante. Après ce temps, les
suspensions ont été filtrées et le pH du filtrat a
été déterminé (Tchuifon et al,. 2014a).
2.1.3.4. Densité de
l'échantillon
La densité apparente des charbons a ont
été déterminée en remplissant un flacon de 15mL par
charbon actif jusqu'à la marque, le flacon étant
préalablement pesé. La nouvelle masse obtenue nous a permis de
calculer la différence de masse (Tchuifon et al,. 2014a). La
densité apparente se trouve à l'aide de l'équation
suivante :
(2.1)
2.1.3.5. Taux d'humidité
C'est le rapport, exprimé en pourcentage de la
quantité d'eau contenue dans l'adsorbant, au poids du même
matériau sec. Dans un bécher préalablement pesé,
nous avons introduit 1g de CA. Après avoir séché le
bécher contenant le CA à l'étuve à 110°C
pendant une heure, il a été refroidi dans un dessiccateur.
Après refroidissement, le bécher a été pesé
de nouveau. Le pourcentage de masse obtenu à partir de la
différence de masse nous a donné le taux d'humidité dans
l'échantillon (Tchuifon et al,. 2014a).
(2.2)
Où mi la masse initiale, mf la masse finale et T le taux
d'humidité. 2.1.3.6. Surface spécifique
La surface spécifique d'un adsorbant est sa surface par
unité de masse. Lorsque l'isotherme est exploitée avec
l'équation de BET (Brunauer, Emmet et Teller) on parle de surface
spécifique de BET(SBET) et quand elle est exploitée
avec l'équation de Langmuir, on parle de surface spécifique de
Langmuir (SL). Une autre méthode de détermination de la surface
spécifique est basée sur l'adsorption de la molécule
d'acide acétique (Avom et al., 2001) qui a une surface
moléculaire de 21 Å2 proche de celle de N2 (16,2
Å2).
Pour déterminer la surface spécifique, 20 mL de
solution d'acide acétique de concentration comprise entre
4x10-3et 8x10-3M ont été mis en contact
avec 0,1g de charbon actif. Ce mélange a été filtré
après 60 minutes d'agitation. A l'issue de la filtration, la
concentration résiduelle a été déterminée
par la technique de dosage volumétrique (Avom et al., 2001).
Les surfaces spécifiques SL (en m2/g) sont
déterminées en utilisant l'équation (2.3):
21
SL = Qo.N.SA .(2.3)
22
Où N = 6,02 x 1023mol-1 (nombre
d'Avogadro), SA = 21Å2 (surface moléculaire d'acide
acétique) et Q0 la quantité maximale d'acide adsorbée
obtenue à partir du tracé de l'isotherme de Langmuir.
2.1.3.7. Indice d'iode
L'indice d'iode a été mesuré en utilisant
la procédure établie par la société
américaine pour les tests des matériaux. Il est
défini comme le nombre de milligramme d'iode adsorbé par gramme
de charbons actifs en poudre. Il mesure les micropores de dimensions
inférieures à 2 nm contenus dans le CA.
Dans une fiole de 250 mL a été introduit I2 et
KI de concentration respective 0,02N et 0,04N ensuite dans une seconde fiole de
250 mL a été introduit Na2S2O3.5H2O de concentration
0,005N. Par la suite, 0,1g de chaque CA a été pesé et
introduit dans un flacon, ensuite nous avons ajouté 30 mL d'une solution
de I2 de concentration 0,02N. Le mélange a été
agité, pendant 3 heures puis filtré. Après filtration 10
mL du filtrat ont été titrés par une solution de sodium
thiosulphate de concentration 0,005N (l'indicateur coloré étant
l'amidon) (Tchuifon et al,. 2014b). L'équation de dosage
suivant a été utilisée pour déterminer la
concentration finale d'iode:
2 Na2S2O3 (aq) + I2 ? Na2S4O6 (aq) + 2NaI (2.4)
La quantité adsorbée (indice d'iode) a
été déterminé comme suit:
.(2.5)
Où m : la masse de CA,
Co : est la concentration initiale d'iode, Ct : la
concentration à l'instant t d'iode, V : le volume de la solution
d'iode.
2.2. Réactifs chimiques et équipements
2.2.1. Réactifs chimiques
Les produits chimiques utilisés pour ces travaux sont
regroupés dans le tableau ci-dessous.
23
Tableau 2.1: Formules chimiques, noms,
pureté et origines des produits chimiques.
|
Noms
|
Formules
chimiques
|
Pureté
|
Origines
|
|
Paracétamol
|
C8H9NO2
|
98%
|
BDH
|
|
Acide nitrique
|
HNO3
|
63 %
|
Riedel-de-Häen
|
|
Sodium hydroxyde
|
NaOH
|
98%
|
Fischer
|
|
Sodium nitrate
|
NaNO3
|
98%
|
Fischer
|
|
Diode
|
I2
|
99,90%
|
Fischer
|
|
Sodium thiosulfate eau- (1/5)
|
Na2S2O3.5H2O
|
99,66%
|
Fischer
|
|
Acide acétique
|
CH3COOH
|
99,5%
|
ANALAR
|
|
Acide chlorhydrique
|
HCl
|
36%
|
Phillip Harris
|
2.2.2. Equipements
Dans le cadre de ce travail nous avons utilisé les
équipements et appareils ci-dessous:
V' Quelques matériels du laboratoire couramment
utilisés au laboratoire ;
V' Des papiers filtres de type whatman ;
V' Une balance de précision de marque Sartorius ;
V' Une table d'agitation de marque EDMUND BOHLER GmbH ;
V' Une étuve de marque Binder ;
V' Un four de marque ISUNU ;
V' Un spectrophotomètre UV-Vis de marque JENWAY de
modèle 6715 ;
V' pH-mètre de marque pHS-25 ;
V' Un spectrophotomètre IR-FT de marque Brüker;
2.2.3. Adsorption du paracétamol en solution
aqueuse 2.2.3.1. Principe
Dans un flacon, une solution de paracétamol de volume V
(en mL) de concentration initiale Ci (en mg/L) est mise en contact avec une
masse m (en g) du matériau adsorbant. Le mélange obtenu est
porté sous agitation sur une table d'agitation à une vitesse
v (en tr/min) pendant un temps de contact t précis. A cause de
l'affinité qui pourrait exister entre l'adsorbant et l'adsorbat en
solution, ce dernier est attiré par le matériau. Les liaisons
formées
entre ces deux entités dépendent des
mécanismes mis en jeu. Ce processus prend place jusqu'à ce qu'un
équilibre soit établi entre la quantité de
paracétamol adsorbée et la quantité résiduelle en
solution. A l'équilibre, la solution est filtrée et le filtrat
obtenu est dosé par spectrophotométrie UV-Vis à une
longueur d'onde de 242 nm.
La quantité de paracétamol adsorbée par
unité de masse d'adsorbant (en mg/g) est donnée par la relation
suivante :
(2.6)
C0 (en mg/L) est la concentration initiale du
paracétamol; Ct (en mg/L) est sa concentration résiduelle
à l'équilibre, V (en L) est le volume de la solution et m (en g)
est la masse du l'adsorbant.
Les pourcentages du paracétamol adsorbés %R ont
été calculé à partir de la relation suivante :
(2.7)
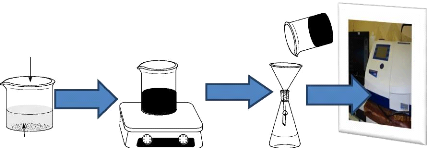
L'adsorption en mode batch du paracétamol se
résume par le schéma présenté à la figure
2.1 ci-après.
Charbon Actif
Agitation
Filtration
Analyse
24
Table d'agitation Filtration simple avec
Spectrophotomètre
un papier filtre UV-Vis
paracetamol
Figure 2.1 : Mode opératoire de
l'adsorption en mode batch.
soluton de
2.2.3.2. Courbe d'étalonnage
Avant adsorption en mode batch du paracétamol en
solution aqueuse, une droite d'étalonnage a été
établie dans le but de convertir à chaque fois les absorbances
obtenues en concentrations résiduelles. Cette droite de calibration a
été établie à partir d'une gamme de concentrations
allant de 10 à 120 mg/Let elle donne une relation directe entre
l'absorbance mesurée et la concentration de l'espèce chimique en
solution.
Les résultats obtenus sont donnés par le tableau
2.2 et la figure 2.2 ci-après :
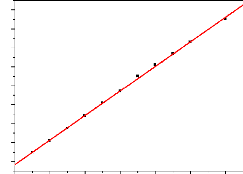
2,0
0,8
0,6
0,4
1,8
1,6
1,4
1,2
1,0
R2= 0,999
Y = 0,013X + 0,3673
0 20 40 60 80 100 120
25
Concentration (mg / L)
Figure 2.2: Droite de calibration du
paracétamol en solution aqueuse.
Cette droite, donnée par la figure 2.2 a pour
équation y = 0,013x +0,367 et son coefficient de corrélation est
égale à R2 = 0,9993. Dans cette équation, y
représente l'absorbance du paracétamol en solution aqueuse et x
représente sa concentration finale.
2.2.3.3. Optimisation de l'adsorption en mode batch du
paracétamol
La procédure expérimentale du processus
d'adsorption a été faite en étudiant l'influence de
quelques paramètres physico-chimiques sur le dit processus. L'objectif
de cette investigation est de réunir les meilleures conditions
expérimentales permettant une rétention optimale du polluant par
les adsorbants. Les paramètres qui ont été mis en
évidence sont : le pH, le temps de contact, la masse de l'adsorbant, la
concentration initiale du paracétamol et la force ionique. Ces
paramètres seront étudiés suivant la procédure
décrite dans les travaux de Tchuifon et al,. (2014b).
? Etude de l'influence du pH
Dans des flacons étiquetés, 20 mL de solutions
de paracétamol de concentration 100 mg/L ont été mises en
contact avec 100 mg de chaque CA. L'effet du pH a été
étudié en ajustant le pH des solutions de paracétamol (2 ;
2,5 ; 3 ; 3,5) à l'aide des solutions de HNO3.
26
Les mélanges ont été portés sous
agitation pendant 90 minutes puis filtrés. Les filtrats obtenus ont
été analysés par spectrophotométrie UV-vis à
242 nm.
? Etude de l'influence du temps de contact :
Dans des flacons étiquetés, 20 mL de solutions
de paracétamol de concentration 100 mg/L ont été mises en
contact avec 100 mg de chaque CA. Les mélanges ont été
portés sous agitation constante, pendant des durées progressives
allant de 5 jusqu'à 150 minutes, puis filtrés. Les filtrats ont
été analysés par spectrophotométrie UV-vis.
? Etude de l'influence de la masse de l'adsorbant
:
Des flacons étiquetés, 20 mL de solutions de
paracétamol de concentration 100 mg/L ont été mises en
contact avec des masses variant de 25 à 450 mg de chaque CA. Les
mélanges ont été portés sous agitation constante,
pendant le temps d'équilibre puis filtrés. Les filtrats ont
été analysés par spectrophotométrie UV-vis.
? Etude de l'influence de la concentration initiale du
paracétamol
Dans les flacons étiquetés, 20 mL d'une solution
de paracétamol dont les concentrations varient de 70 à 120 mg/L
ont été mises en contact avec 100 mg de chaque CA. Les
mélanges ont été portés sous agitation constante,
pendant le temps d'équilibre puis filtrés. Les filtrats ont
été analysés par spectrophotométrie UV-vis.
? Etude de l'influence de la force ionique
Dans les flacons étiquetés, 20 mL d'une solution
de paracétamol de concentration 100 mg/L contenant le NaNO3 dont les
concentrations varient de 0,01 à 0,06 mol/L ont été mises
en contact avec 100 mg de chaque CA afin de faire varier la force ionique du
milieu. Les mélanges ont été portés sous agitation
constante, pendant le temps d'équilibre puis filtrés. Les
filtrats ont été analysés par spectrophotométrie
UV-vis.
27
| 


