III.2.3. Conductivité électrique (CE)
La conductivité électrique est mesurée
sur l'extrait de sol dilué au 1/5. Elle doit être exprimée
en dicisiemens par mètre (ds/m) (BAIZE, 2000). Elle a
été déterminée par un conductimètre.
IIII.3.Isolement des microorganismes
Pour la dilution des échantillons, nous avons besoin d'eau
physiologique stérile, tubes Stériles, une micropipette et un
vortex, une balance.
Pour l'ensemencement et la purification, nous utilisons des
boites de Pétri contenant de la Gélose nutritive ordinaire (GN)
et de gélose au cétrimide.
IIII.3.1. Enrichissement IIII.3.1.1. Dilution
décimale
Afin de dénombrer la microflore bactérienne
existant dans l'échantillon, la solution mère du Sol est
préparé (10gr de sol dans 90mL de bouillon nutritif) suivie d'une
série de dilutions Décimales allant de 10 -1 (solution
mère) à 10-6en conditions d'asepsie.
IIII.3.1.2. Isolement des bactéries sur milieu
solide
On prélève 0,1 ml de chaque dilution
préparée qu'on ensemence par étalement sur les boites De
Pétri contenant de la GN et de cétrimide à l'aide d'un
râteau. L'incubation des boites se fait à 30°C pendant
24h.
IIII.3.2. Dénombrement des
bactéries
Le dénombrement après culture concerne,
évidement les cellules viables de l'échantillon Autrement dit,
les cellules capables de croitre. Il est basé sur l'aptitude de chaque
bactérie, fixée par la solidification du milieu
gélosé, à former une colonie visibles à l'oeil nu
(AUSTIN, 1988).
Après 24h d'incubation à 30°C, les colonies
développées sont dénombrées à l'aide d'un
Compteur de colonies en UFC (Unité Formant Colonie).
Le nombre de germes par gramme de sol est déterminé
en calculant la moyenne
Arithmétique des résultats obtenus et en tenant
compte des facteurs de dilution, selon la formule (MARCHAL et BOURDON
,1982)
N = n / d. v
35
Où :
N : Nombre des microorganismes en UFC/ ml.
n: Nombre des colonies
dénombrées.
v: Volume prélevé (0.1ml).
d: Dilution).
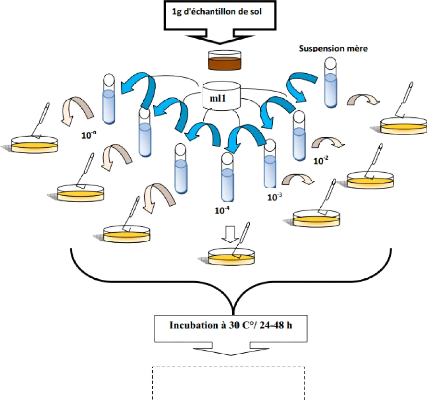
Dénombrement des colonies
Figure 9 : Schéma de l'isolement et de
dénombrement des bactéries IIII.3. Observation
macroscopique
L'observation macroscopique des colonies permet d'effectuer une
première caractérisation (aspect des colonies et de leur revers,
la taille et la couleur.
D'après JOFFIN et LEYRAL (2006), les
éléments d'identifications macroscopiques sont:
· La forme des colonies : rondes,
irrégulières,...etc.
· La taille des colonies par la mesure du diamètre:
ponctiformes ou non ponctiformes.
· La chromogénèse: couleur de la colonie.
· L'élévation: convexe, concave, plate.
·
36
L'opacité: opaque, translucide ou transparente.
· La surface: lisse, rugueuse, sèche,
dentelée,...etc. IIII.3.4. Observation microscopique
IIII.3.4.1.Coloration de Gram
C'est une double coloration qui nous permet de connaître
la forme, l'arrangement, la pureté ainsi que la nature biochimique de la
paroi des cellules purifiées. Cette coloration est réalisé
systématiquement sur les différentes colonies purifiés
pour préciser le caractère Gram+ ou Gram-. Avec cette coloration
double, les bactéries Gram positive apparaissent en violet foncé
tandis que les bactéries Gram négatives sont colorées en
rose ou en rouge (DELARRAS, 2008).
La technique est comme suit :
-A partir des boîtes de pétri faire
un frottis.
-Déposer une goutte d'eau physiologique sur la lame.
-Frotter la pointe dans la goutte d'eau physiologique. Laisser
sécher à l'air.
-Passer 3 fois la lame dans la petite flamme du bec Bunsen pour
fixer l'échantillon à la
chaleur.
-Déposer quelques gouttes de solution de violet de
gentiane (cristal violet) sur le frottis fixé.
-Laisser agir 1 minute. Jeter l'excès de colorant dans un
bécher.
-Rincer très brièvement
-Déposer quelques gouttes de lugol sur le frottis.
-Laisser agir 1 minute. Jeter la solution de Lugol dans un
bécher et rincer brièvement à l'H2O.
-Déposer quelques gouttes d'alcool sur le frottis et
laisser agir 30 secondes.
-Rincer à l'H2O.
-Déposer la solution de fishine pendant 1 minute.
-Rincer à l'H2O.
-Laisser sécher à l'air.
-Observer au microscope (grossissement 400x ou, avec une goutte
d'huile à immersion, au
grossissement 1000x).
37
IIII.3.4.2.Coloration de spores
La coloration au bleu de méthylène permet
l'observation de la morphologie cellulaire et la présence ou l'absence
de spore (DELARRAS, 2008).
La technique est comme suivante :
-Réaliser un frottis fixé sur la lame.
-Recouvrir la lame de vert de malachite.
-Chauffer jusqu'à émission de vapeurs sans faire
bouillir le colorant ni laisser sécher la
préparation. Le chauffage doit durer 10 min.
-Laisser refroidir et laver à l'eau.
- Recouvrir la lame de fishine durant 1min.
-Laver et sécher
-Observation à l'objectif 100 à immersion.
IIII.4.Purification des isolats
Après 24 h d'incubation, nous passons à
l'étape de purification des cultures. Celle-ci
Nous permet d'obtenir des cultures pures à partir des
différentes colonies isolées.
La sélection des colonies est basée sur l'aspect
macroscopique des colonies à savoir la couleur, la forme, le
diamètre, l'opacité. Un échantillon de chaque type de
colonie est prélevé et ensuite purifié par repiquages
successifs et alternés en milieu liquide, puis en milieu solide
jusqu'à l'obtention au sein d'une boite de Pétri de colonies
identiques par l'aspect et la couleur (Delarras, 2007).
IIII.5. Conservation des isolats
A partir d'une boite de pétri contient des colonies
bien purifie, prélever une colonie bien isolé. -ensemencer dans
un milieu BN, incuber a 30 °C /24 avec agitation.
-centrifuger a 6000 rpm pendant 10 min dans des tubes
Eppendorf (1ml de la suspension bactérienne)
-éliminer le surnageant et garder le culot.
-ajouter 0.8ml BN stérile et 0.2 solution glycérol
stérile a l'Eppendorf qui contient le culot. -vortexer et conserver a
-20 °C (congélation).
(HOHZOH K, 1982) (JYOTHI K, K SURENDRA BABU 2012)
38
IIII.6. Identification des microorganismes
Elle comporte une série de tests permettant de mettre
en évidence le type respiratoire des souches, leur métabolisme
énergétique et celle du sulfure d'hydrogène (H2S), la
réduction des nitrates. Des activités enzymatiques telles que
l'oxydase, la catalase, et les enzymes de transformation des acides
aminés (ADH et LDC) ont été également
recherchées. Les souches ont été testées aussi pour
l'utilisation des citrates, du glucose et de lactose.
IIII.6.1. Recherche des enzymes respiratoires
IIII.6.1.1. Recherche de la catalase
La catalase est une enzyme ayant la propriété de
décomposer le peroxyde d'hydrogène (H2O2 ) Avec dégagement
d'oxygène (Marchal et Bourdon, 1982).
Sur une lame et à l'aide d'une pipette Pasteur, on
dépose une colonie bactérienne à laquelle On ajoute de
l'eau oxygénée (à 10 volumes = 3%).
La présence d'une catalase est
révélée immédiatement par des bulles de gaz qui
Correspondent à l'oxygène
dégagé.
IIII.6.1.2. Recherche de l'oxydase
Ce test permet la détection de la
phénylène-diamine-oxydase ou le cytochrome oxydase Enzyme entrant
dans divers couples d'oxydoréduction (Singleton, 1999).
Pour réaliser ce test, un disque d'oxydase
préalablement imbibé d'une goutte d'eau distillée
Stérile est déposé sur une lame et mis en contact avec une
colonie bactérienne fraîchement cultivée.
L'apparition d'une coloration violette immédiatement
indique que le test est positif.
IIII.6.2.Test ONPG
- Faire une suspension dense en eau physiologique de la souche
à étudier, puis ajouter un disque ONPG
(MARCHAL et BOURDON, 1982).
IIII.6.3. Recherche de Citrate
(Utilisation du citrate comme seule source de carbone)
Pour réaliser ce test :
39
Ensemencer la pente selon une strie longitudinale
avec une pipette chargée de suspension (préparée
à partir d'une culture sur milieu gélosé, en
prenant soin de ne pas racler le milieu pour ne pas apporter
d'éléments nutritifs susceptibles de fausser les
résultats).
- incuber à 37°C/24, sans trop visser le
bouchon
(JOFFIN et LEYRAL, 2006).
IIII.6.4. Clark et Lubs (tests RM et VP)
-Ensemencer un milieu Clark et Lubs avec
quelques gouttes de suspension bactérienne.
- Incuber à 37°C pendant 24 à 48 h.
Après vérification de la culture
(trouble du milieu) :
Test RM (rouge de méthyle)
-Transférer a l'aide d'une pipette
Pasteur environ 0,5 ml de milieu Clark et Lubs dans un tube
à hémolyse.
- Ajouter 1 goutte de rouge de
méthyle.
Test VP (Vosges-Proskauer)
- Transférer dans un tube à hémolyse
à l'aide d'une pipette Pasteur, environ 0,5 ml de milieu
Clark et Lubs, y ajouter 1 goutte de
réactif.
- Attendre 10 min avant de conclure à un résultat
négatif
(JOFFIN et LEYRAL, 2006).
IIII.6.4. Hydrolyse a l'amidon
Ensemencer la gélose par une strie ou un spot de 3
à 5 mm de diamètre, à l'aide de l'anse de platine
chargée de culture (plusieurs souches possibles sur la même
boîte).
Incuber à 30 ou 37°C pendant 1 à 5
jours, en position retournée
(MARCHAL et BOURDON, 1982)
IIII.6.5. Mannitol mobilité
Ensemencer par piqûre centrale à l'aide du fil droit
chargé de suspension de la culture à étudier.
Incuber 24 heures à 37°C
(MARCHAL et BOURDON, 1982).
40
IIII.6.6.Viande-foie
-Régénérée la gélose VF par
ébullition au bain-marie bouillant pendant environ 30 minutes.
-Ensemencer lorsque le milieu est encore liquide, vers 45°C.
L'ensemencement se fait à la pipette Pasteur scellée (ou
boutonnée) et chargée. On introduit la pipette Pasteur au fond du
tube et on remonte en spirale.
-Ne pas visser le bouchon à fond.
-On place ensuite le tube à l'incubateur (à
37°C) pendant 24 heures (JOFFIN et LEYRAL, 2006).
IIII.6.7. Étude du métabolisme
protéique
IIII.6.7.1. Recherche des décarboxylases (ODC,
LDC, ADH)
- Ensemencer chaque milieu avec quelques gouttes de suspension de
la culture à étudier. - incuber à 37°C/24h
(MARCHAL et BOURDON. ,1982).
IIII.6.I. Sélection des bactéries par
utilisation de milieux de culture spécifiques IIII.6.I.1.Croissance sur
milieu King (King A et King B)
Les milieux de King (milieu King A et milieu King B permettent de
différencier entre elles les différences espèces du genre
Pseudomonas, par la mise en évidence de la production de pigments
spécifiques (MARCHAL et BOURDON, 1982).
La technique est comme suivante
- A partir d'une culture sur gélose (faire une
suspension), ensemencer le milieu en faisant une strie à la surface de
la gélose avec l'anse (ou en déposant une goutte de
suspension).
- L'incubation est réalisée en aérobiose.
IIII.6.J. Bouillon nitraté
Ensemencer un milieu nitraté avec quelques gouttes de
suspension bactérienne. Après incubation (culture visible),
ajouter:
-Du réactif de Griess (2 gouttes)
-Ou une goutte de réactifs :
o
41
réactif Nitrites 1 (acide sulfanilique),
o réactif Nitrites 2
(á-naphtylamine).
Le réactif de Greiss est un mélange des
réactifs nitrites 1 & 2 (MARCHAL et BOURDON, 1982).
IIII.7.isolement de bactéries qui
dégradent le pétrole :
-Ensemencer les souches dans un milieu minéral qui
contient MSM.
-Lancer une culture des souches isolées dans du
bouillon nutritif et incuber pendant 24heures. -Centrifuger la culture à
3000t/min pendant 10 minutes, récupérer le culot et effectuer un
lavage avec msm liquide 5 fois.
-Laver l'agar puis préparer MSM solide, le couler dans
des boites préalablement numérotées et les laisser
solidifier.
-Après solidification de la gélose (verser une
grande couche de la gélose), étaler 100 ul de pétrole
filtré sur la surface des boites puis laisser sécher devant le
bec benzène 3heures de temps.
- A partir des différents culots, prendre avec une ance
stérile une goute et déposer sous forme de spots le
concentré de culture dans les carreaux appropriés a chaque
souche.
-Laisser sécher devant le bec benzène puis
incuber a l'abri de la lumière à 30°C pendant 7 à
15jours et la lecture doit se faire quotidiennement
Remarque : l'incubation de certaines souches peut durer
jusqu'à 21jours.
-Faire la lecture des boites tous les jours pour voir s'il y
apparition de zones claire.
(HOHZOH K, 1982) (JYOTHI K, K SURENDRA BABU 2012)
IIII.8.Détection de l'activité de biodégradation
des bactéries
La croissance bactérienne a été suivie
par mesure de la DO par spectrométrie à une longueur d'onde de
595nm de 0heure jusqu'à 15 jours et a des intervalles réguliers
de 2 jours (avec MSM comme Blanc).
(HOHZOH K, 1982) (JYOTHI K, K SURENDRA BABU 2012)
42
Résultats et discussion
I. Analyses physico-chimiques
I.1. Caractéristiques du sol
étudié
Tableau 2 : Caractéristiques de quatre types de
sols étudiés.
|
Echantillon
|
Site de prélèvement
|
Description
|
|
1
|
Mascara
|
Couleur marron foncée.
|
|
2
|
Ouargla
|
Couleur orange, sableux,
sèche.
|
|
3
|
Raffinerie d'Arzew
|
Couleur noir avec des
particules marron
foncé, forte odeur de polluant
|
|
4
|
Sfisef
|
Couleur marron.
|
|
|
|
|
|
|
|
|
E4
|
|
E3 E1 E2
|
|
|
|
|
Figure 10 : Différents échantillons des
sols étudiés.
|
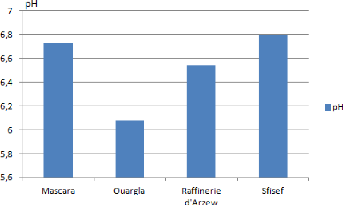
I.2. Mesure du potentiel d'hydrogène
Tableau 3 : Potentiel d'hydrogène des quatre sols
étudies.
|
Echantillon
|
pH
|
|
1
|
6.73
|
|
2
|
6.08
|
|
3
|
6.54
|
|
4
|
6.8
|
43
Les valeurs de pH obtenues pour les 4 sols
étudiés varient entre 6.08 et 6.73. Les échantillons de
sol appartenant à E1, E3, E4 sont des sols acidifiés mais
présente des valeurs proche de la neutralité alors que E2 est un
sol acidifié. On constate aussi une diminution de la valeur de pH pour
E2.
Le pH apparait ainsi comme un paramètre qui influence
de manière majeure la structure et la diversité des
communautés bactériennes dans les sols, et impose directement une
contrainte physiologique sur les bactéries du sol. (NICOLAS T.,
2013).
L'activité biologique d'un sol varie avec le pH, la
diversité, l'abondance et l'activité de la microflore
(bactéries) sont en effet influencées par le pH. Chaque
espèce possède une plage optimale de pH, par exemple, Un pH de 7
est optimal pour l'activité des bactéries responsables des
transformations de la matière organique, et par conséquent il
assure un bon déroulement de la biodégradation des
hydrocarbures.
I.3. Teneur en eau ou humidité
Tableau 4 : Taux d'humidité des quatre sols
étudies.
|
Echantillon
|
Humidité
|
|
1
|
4
|
|
2
|
0.95
|
|
3
|
4.3
|
|
4
|
4.4
|
Les échantillons de sols étudiés sont
aussi caractérisés par une humidité relative variant de
0.95 à 4.4%. Les valeurs les plus élevées sont celles de
l'échantillon d'E4 (4.4%), de l'échantillon d'E3 (4.3%) et d'E1
(4%), l'échantillon E2 présente la valeur d'humidité la
plus faible 0.95%.
Les faibles teneurs en eau des échantillons peuvent
d'une part être expliquées par les faibles humidités
relatives des sols sahariens (MONOD, 1999), il est à noter
qu'un faible taux d'humidité peut avoir un effet négatif sur
l'activité microbienne en limitant le contact microorganisme / polluant
et en inhibant le processus de dégradation enzymatique (LECOMTE,
1995).
ERIKSON et al. (2001) ont montré l'influence
de la structure du sol sur le transport de l'oxygène dans ce dernier.
Ces auteurs indiquent que plus un sol est dense, moins les nutriments et l'O 2
sont transportés vers la flore indigène du milieu, responsable de
la
biodégradation. De même, NAM et al. (2003)
ont observé que les agrégats de sols réduisaient la
biodégradation. Cependant, dans les zones arides où le sable est
la fraction dominante, les micro-organismes et leurs produits de
synthèse sont faiblement reliés aux particules du sol
(DOMMERGUES ET MANGENOT, 1970).
I.4. Conductivité électrique
(CE)
Tableau 5 : Conductivité électrique des
quatre sols étudies.
|
Echantillon
|
Conductivité
|
|
1
|
2.5
|
|
2
|
14.7
|
|
3
|
3.4
|
|
4
|
3
|
La valeur de la conductivité électrique de l
échantillon E2 est très élevée 14.7 dS/m, les trois
autres échantillons présentent des valeurs de conductivité
électrique similaires variables de 2.5 à 3 dS/m.
44
Figure 11 : Potentiel d'hydrogène des quatre
sols étudies.
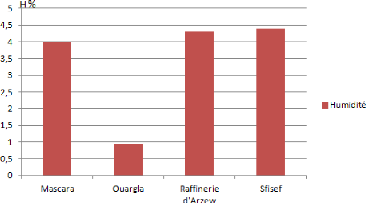
Figure 12 : Taux d'humidité des quatre sols
étudies.
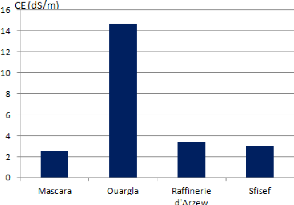
45
Figure 13 : Conductivité électrique des
quatre sols étudies.
II. Analyses microbiologiques du sol
Le résultat du dénombrement sur gélose
nutritive obtenus pour les différentes dilutions a permis d'avoir une
idée sur la charge bactérienne du site pollué ainsi que de
sa diversité. Les valeurs sont rapportées dans les tableaux
suivants.
Tableau 6 : Dénombrement sur gélose
nutritive pour l'échantillon 3.
|
Dilution
|
10-1
|
10-2
|
10-3
|
10-4
|
10-5
|
10-6
|
|
Dénombrement(boite1)
|
nappe
|
nappe
|
nappe
|
nappe
|
118
|
53
|
|
Dénombrement(boite2)
|
nappe
|
nappe
|
nappe
|
nappe
|
40
|
40
|
Tableau 7 : Dénombrement sur gélose
nutritive pour l'échantillon 4.
|
Dilution
|
-1
|
-2
|
-3
|
-4
|
-5
|
-6
|
|
Dénombrement(boite1)
|
nappe
|
nappe
|
nappe
|
346
|
nappe
|
280
|
|
Dénombrement(boite2)
|
nappe
|
nappe
|
nappe
|
18
|
nappe
|
10
|
Tableau 8 : Dénombrement sur gélose
nutritive pour l'échantillon 1.
|
Dilution
|
10-1
|
10-2
|
10-3
|
10-4
|
10-5
|
10-6
|
|
Dénombrement(boite1)
|
nappe
|
nappe
|
nappe
|
280
|
152
|
270
|
|
Dénombrement(boite2)
|
nappe
|
nappe
|
nappe
|
310
|
210
|
80
|
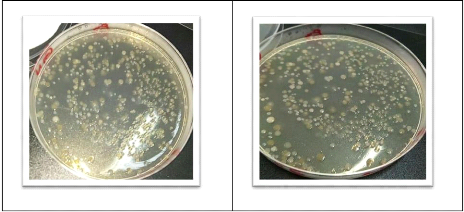
Figure 14 : Dénombrement sur gélose
nutritive pour l'échantillon 3.
46
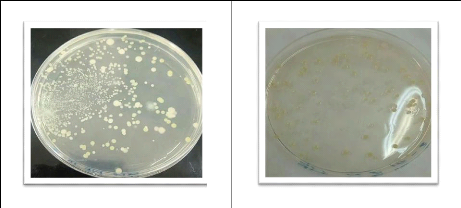
47
Figure 15 : Dénombrement sur gélose
nutritive pour l'échantillon 1.
Le dénombrement a montré une charge
bactérienne aux alentours de 11.4×106 UFC/g de sol pour
l'échantillon 3 et de 59.1×106 UFC/g de sol pour
l'échantillon 1, cela ne s'explique que par les conditions
éco-climatique du site et la présence des polluants.
En tenant compte uniquement des bactéries cultivables,
la variété des aspects, par contre n'est pas très
élevée, cela nous a permis de sélectionner à partir
de 17 isolats 5 seulement qui sont vraiment différentes sur le plan
macroscopique.
II.1. Caractéristiques des isolats
purifiés
Un sol qui contient des hydrocarbures va modifier
l'activité des microorganismes. Ceux-ci doivent donc adapter leur
activité enzymatique afin de pouvoir s'y attaquer. Les bactéries
vont ensuite subir une période de forte croissance au cours de laquelle
ils seront capables d'assimiler les produits de la dégradation des
hydrocarbures. Cette biodégradation peut prendre plusieurs mois. Une
fois qu'ils ont consommé les composés les plus facilement
dégradables, leur nombre diminue jusqu'à atteindre de nouveau la
taille d'une population normale. (Ce qui explique l'écart au niveau de
nombre des souches isolées entre les deux échantillons). Parfois,
seule une partie des polluants est dégradés car les hydrocarbures
se lient partiellement à la matière organique du sol et
deviennent alors moins accessibles aux microorganismes. Le niveau de
dégradation des pétroles (mélange de composés
facilement dégradables et de composés récalcitrants) est
donc totalement dépendant de la diversité métabolique des
bactéries hydrocarbonoclastes présentes dans l`environnement
pollué. La diversité des espèces bactériennes est
un facteur décisif dans la réponse des communautés
bactériennes à ce type de variation environnementale. (SAURET
C.,2011).
48
Les colonies sont généralement lisses et ont un
diamètre de plus de 1mm, de tous les microorganismes du sol, les
bactéries sont les plus nombreuses et les plus petites : la taille de
leurs colonies ne dépasse pas en général, 0.5 à 2
mm de diamètre. (ROGET et al,.2001) cité dans
(DJAOUD M.,2013).
III. Etude des caractères
morphologiques
Les caractères macroscopiques des souches
isolées sont regroupés dans le tableau 9. Tableau 9 :
Caractères macroscopiques des colonies isolées sur gélose
nutritive.
|
Souche
|
Taille
|
Forme
|
Aspect de
surface
|
Contour
|
Opacité
|
Consistance
|
Couleur
|
|
SC
|
Petite
|
Allure bombé
|
Lisse
|
Régulier
|
Translucide
|
Grasse
|
Banche
|
|
SG
|
Grande
|
Allure bombé
|
Lisse
|
Régulier
|
Translucide
|
Grasse
|
Verte
|
|
SH
|
Grande
|
Allure bombé
|
Lisse
|
Régulier
|
Translucide
|
Grasse
|
Verte
|
|
SI
|
Petite
|
Allure
Demi
bombé
|
Lisse
|
Régulier
|
Translucide
|
Crémeuse
|
Banche
|
|
SJ
|
Moyenne
|
Allure Demi bombé
|
Lisse
|
Régulier
|
Opaque
|
Grasse
|
Rouge
|
|
SL
|
Grande
|
|
Rigoureuse
|
Dentelé
|
Opaque
|
Sèche
|
Beige
|
L'observation macroscopique montre des colonies bien
séparées avec des caractères spécifiques qui
différencient les souches.
49
Tableau 10 : Etude microscopique des souches
isolées.
|
Critères
|
Coloration de Gram
|
Présence de spores
|
|
Gram
|
Forme des cellules
|
|
SC
|
+
|
Cocci
|
Spore -
|
|
SG
|
-
|
Bacille
|
Spore -
|
|
SH
|
-
|
Bacille
|
Spore -
|
|
SI
|
-
|
Coccobacille
|
Spore -
|
|
SL
|
+
|
Bacille
|
Spore +
|
|
SJ
|
-
|
Petit bacille
|
Spore -
|
D'après les observations, il ressort que les souches
isolées sont de forme et de Gram différents. La souche (SB) est
une Cocci à Gram positive. Les souches (SG) et (SH) sont des bacilles
à Gram négative, la souche (SI) Coccobacille à Gram
négative alors que la souche (SJ) appartient à des petits
bacilles à Gram négative, tandis que la souche (SL) est bacille
à Gram positive.
La coloration de spore a révélé la
présence de spore uniquement chez les bacilles, les coques et les
colibacilles en sont dépourvus.
Selon PELMONT, (1995), Les caractéristiques
des bactéries aptes à biodégrader les hydrocarbures sont
les suivantes :
· La majorité des souches bâtonnées
Gram négatives
· 32% des bactéries motiles ou mobiles
· 20% des bactéries à Gram positives,
filamenteux.
Les figures en dessous illustrent les différents
aspects macroscopiques et quelques aspects microscopiques.
50
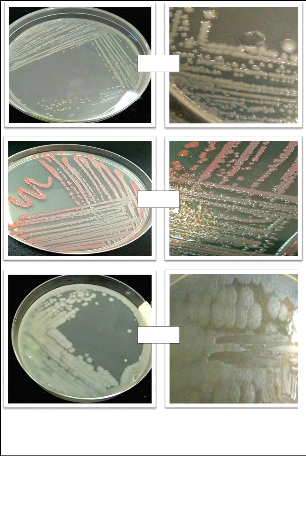
51
Souche C
Souche J
Souche L
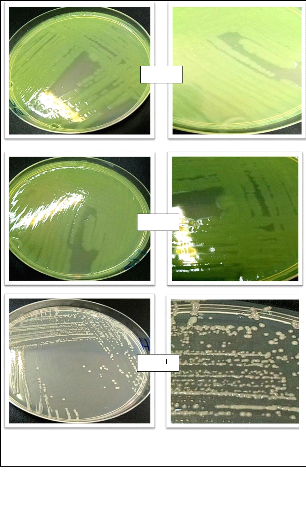
52
Figure 16 : Différents aspects des colonies
bactériennes obtenus.
Souche H
Souche
Souche G
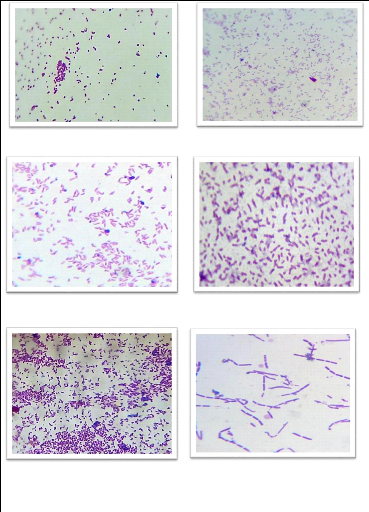
Figure 17 : Différents aspects microscopiques
obtenus.
53
IIII. Recherche des enzymes respiratoires
Le dégagement des bulles de gaz par les souches (SG),
(SI), (SJ), et (SL) révèle la présence de l'enzyme
catalase sauf pour les souches (SC), et (SH) qui ne possède pas
d'enzyme.
54
Pour le test de l'oxydase toutes les souches ont un
résultat négatif à part les deux souches (SG), et (SH).
Tableau 11 : Présence des enzymes
respiratoire.
|
Souche
|
Oxydase
|
Catalase
|
|
SC
|
-
|
-
|
|
SG
|
+
|
+
|
|
SH
|
+
|
-
|
|
SI
|
-
|
+
|
|
SJ
|
-
|
+
|
|
SL
|
-
|
+
|

Figure 19 : Test oxydase.
Figure 18 : Test catalase.
IV. Tests biochimiques
Le tableau 12 regroupe les résultats des tests que nous
avons effectués sur chacune des souches isolées.
55
Tableau 12 : Résultats des tests
biochimiques.
|
Souches /tests
|
SC
|
SG
|
SH
|
si
|
SJ
|
SL
|
|
Enzymes Respiratoires
|
Catalase
|
-
|
+
|
+
|
+
|
+
|
+
|
|
Oxydase
|
_
|
+
|
+
|
_
|
-
|
-
|
|
Viande foie
|
Ana
Fac
|
AS
|
AS
|
AAF
|
Ana
Fac
|
AAF
|
|
Nitrate
|
+
|
+
|
_
|
+
|
+
|
+
|
|
Métabolismes glucidique
|
Glucose
|
-
|
+
|
-
|
-
|
+
|
+
|
|
Diholoside
|
-
|
-
|
-
|
+
|
-
|
-
|
|
Gaz
|
+
|
-
|
-
|
+
|
+
|
+
|
|
H2s
|
-
|
-
|
-
|
+
|
-
|
-
|
|
ONPG
|
+
|
+
|
-
|
-
|
+
|
-
|
|
RM
|
+
|
+
|
+
|
+
|
-
|
-
|
|
VP-
|
|
-
|
-
|
-
|
-
|
-
|
|
Mannitol
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Citrate perméase
|
-
|
+
|
+
|
-
|
+
|
+
|
|
Métabolisme protéique
|
ADH
|
_
|
+
|
+
|
_
|
_
|
_
|
|
LDC
|
+
|
+
|
+
|
+
|
+
|
_
|
|
ODC
|
_
|
+
|
+
|
_
|
+
|
_
|
|
King A
|
/
|
_
|
_
|
/
|
/
|
/
|
|
King B
|
/
|
+
|
+
|
/
|
/
|
/
|
56
|
|
|
|
|
|
|
|
|
|
|
|
Mannitol
|
TSI
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Citrate
|
|
Clark et Lubs
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ONPG
|
VF
|
|
Figure 20 : Résultats des tests biochimiques
obtenus (métabolisme glucidique).
|
57
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ADH
|
LDC
|
ODC
|
|
Figure 21 : Résultats des tests biochimiques
obtenus (métabolisme protéique).
|

Figure 22 : Résultats des tests biochimiques
obtenus (King A et B).
V. Identification des souches isolées
L'identification a pu être réalisée
à l'échelle du genre ou de la famille. En effet, parmi les cinq
bactéries isolées, nous avons pu affilier les souches comme
appartenant aux familles suivantes (BERGEY, 1984 ) :
58
Pseudomonaceae
D'après sa morphologie macroscopique, les souche SG et
SH ont été affiliées au genre Pseudomonas en
raison de la morphologie de ses petites colonies circulaires, lisses et
brillantes. Ces souches ont une forme bacillaire, isolées ou en amas
avec les caractéristiques suivantes : Gram négatif, oxydase
positive, catalase positive, non sporulées. Ceci nous a orientés
vers la culture de ces souches sur milieux King A et King B spécifiques
des Pseudomonas.
La révélation d'une couleur bleu verte sur King
A et un jaune verdâtre fluorescent sur King B confirme l'appartenance au
genre Pseudomonas (Figure 22). Ces bactéries ont un
caractère aérobie strict, ADH et citrate positif (BERGEY,
1984 ;LARPENT, 1992 ; PREVOT, 1961 et SINGLETON, 1999). Une identification
biochimique (tableau 12) a permis de différencier ces souches
bactériennes et de les identifier au tant que : Pseudomonas putida
(SH) et Pseudomonas fluorescens (SG).
L'incapacité de la souche SH à dégrader
le mannitol avec ONPG positive (tableau 12) nous permet de supposer qu'il
s'agit de Pseudomonas putida. (LEYRAL et JOFFIN, 1998).
Les colonies de la souche SG sont incolores dans le milieu
King A et elles sont de couleur jaune dans le milieu King B. A coté de
ce paramètre, les caractères biochimiques permettent de
déduire que cette souche correspondrait à P.fleoresens.
(LEYRAL et JOFFIN,1998).
Moraxellaceae
Ce sont de petits Coccobacille G- de 0,9 um sur 1,36 um,
immobiles. La souche (SI) répond positivement au catalase et de nitrate
réductase, ainsi que l'ONPG. Elle n'utilise pas le glucose. Elle produit
l'H2S, et peut utiliser les nitrates. Elle est LDC positive mais ADH et ODC
négative. D'après les résultats des tests biochimiques
(tableau 12) et par comparaison avec ceux établis par BERGEY (1984),
il est probable que la souche (SD) correspondrait à l'espèce
Acinetobacter sp.
Bacillaceae
En raison de la morphologie de leurs cellules en forme de
bacilles (figure 6), Gram positif, sporulés (tableau 10) catalase
positive, oxydase négative et un citrate perméase positif
(tableau 12). La souche (SL) a été affiliée au genre
Bacillus.
La souche (SL) a un ONPG, ADH, LDC et ODC négatives,
elle oxyde le glucose et le saccharose, ne produit pas H 2 S (tableau 12).
D'après ces caractéristiques, cette souche pourrait
être Bacillus sp. (BERGEY, 1984 ; LEYRAL et JOFFIN, 1998).
Enterococcaceae
59
La souche (SC) est apparentée au genre Enterococcus
en raison de sa forme de chaînettes. Les colonies blanches,
régulières et lisses (figure 22). Cette souche n'oxyde pas le
glucose, à mobilité, oxydase négative et résistante
(NACL= 6).
D'après les résultats des tests biochimiques et
par comparaison avec ceux établis par BERGEY (1984), il est
probable que la souche SC correspondrait à l'espèce
Entérococcus sp.
Enterobacteriaceae
La souches (SJ) a été rattachée à
la famille des Enterobacteriaceae et présente les
caractéristiques suivantes : une forme bacillaire (figure 22), à
Gram négatif, catalase positive et oxydase négative.
L'étude des caractères biochimiques, nous a permis de rattacher
la souche (SJ) au genre Serratia.
La souche bactérienne (SJ) est mobile, capable
d'utiliser le citrate de sodium comme unique source de carbone, elle est ONPG
positive, LDC, ADH, ODC, indole et VP négatives (tableau12). Compte tenu
de ces résultats, l'espèce serait probablement Serratia
marcescens (BERGEY, 1984, LEYRAL et JOFFIN, 1998).
La synthèse des résultats obtenus et leur
comparaison à ceux de nombreux auteurs (BERGEY, 1974 ; MARCHAL, 1987
; LARPENT et al., 1990 et LARPENT et al., 1998) nous conduisent aux
conclusions suivantes :
SG :
Famille : Pseudomonadaceae Genre :
Pseudomonas
Espèce : Pseudomonas fluorescens
SH :
Famille : Pseudomonadaceae Genre :
Pseudomanas
Espèce : Pseudomanas putida
60
SI :
Famille : Moraxellaceae Genre : Acinetobacter
Espèce : Acinetobacter sp
SL :
Famille : Bacillaceae Genre : Bacillus
Espèce : Bacillus sp
SJ :
Famille : Enterobacteriaceae Genre :
Serratia
Espèce : Serratia marcescens VI. Test de
biodégradation
Après une incubation de 5 jours à
l'obscurité, les colonies qui montrent une dégradation sont
entourées de zones claires sur la surface opaque de la gélose.
Cette technique s'appelle: (OIL SPREADING THECHNIQUE) (HOHZOH K et al.,
1982).
Après l'incubation des boites, la lecture se fait
quotidiennement pour voire s'il y a eu apparition de zones clair.
La biodégradation des hydrocarbures se manifeste par
l'apparition de zones claires sur le milieu de culture. Cette méthode
s'avère, simple et pratique pour l'isolement des bactéries qui
ont le potentiel de dégrader les hydrocarbures.
Ces bactéries isolées sont capables de
digérer le pétrole et cette méthode peut être
applicable pour la détection de souches qui dégradent d'autres
hydrocarbures non volatiles.
Cette méthode peut être utilisée aussi
pour l'étude de la dégradation du naphtalène,
phénanthrène, et l'anthracène en plus de la
détection des bactéries mutantes, auxotrophes
61
d'après HOHZOH K et al., 1982.
Dans quelques cas, il y a eu des colonies qui ont
montré une dégradation du pétrole vaporisé sur la
gélose, et qui ont donné des zones beaucoup plus importantes que
celles observées dans le travail de ce dernier. Le diamètre des
zones varie de 2 mm à 10 mm, et cela est important comme résultat
par rapport aux résultats cités dans la littérature.
(HOHZOH K et al., 1982).
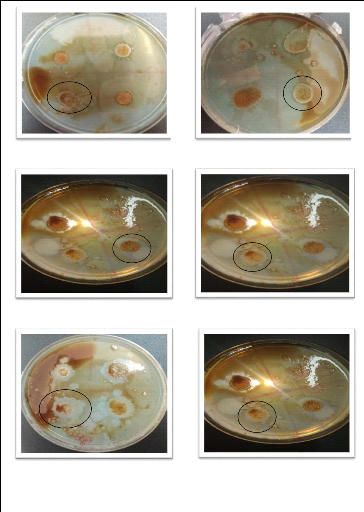
La souche C (avec un diamètre de 10 mm) La souche G (avec
un diamètre de 2mm)
La souche H (avec un diamètre de 4mm) La souche I (avec un
diamètre de 2mm)
La souche J (avec un diamètre de 4mm) La souche L (avec un
diamètre de 2mm)
Figure 23 : Les zones claires du test de
biodégradation.
62
VII. Détection de l'activité de
biodégradation des bactéries
La variation de biomasse au cours de temps (jour) des quatre
souches testé au cours de croissance dans le milieu de sels
minéraux (MSM) additionné de 1% de pétrole brute comme
seul source de carbone et de phénol a été suivi en
mesurant la concentration microbienne en fonction du temps ce qui nous a permis
de tracer les courbes représentées par les figure (24,
25, 26, 27 et 28). Les valeurs de Log UFC/ml en fonction du
temps sont données dans les tableaux (voir annexe).
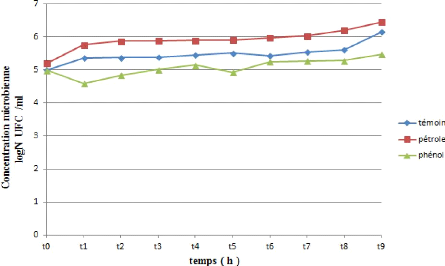
63
Figure 24 : Cinétique de croissance d'une souche
bactérienne (SI) durant la
biodégradation du pétrole et
du phénol.
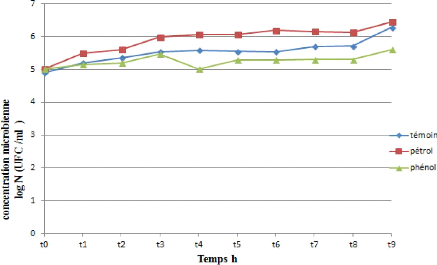
64
Figure 25 : Cinétique de croissance d'une souche
bactérienne (SL) durant la
biodégradation du pétrole et
du phénol.
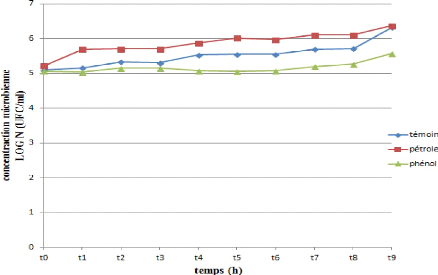
Figure 26 : Cinétique de croissance d'une souche
bactérienne (SH) durant la
biodégradation du pétrole et
du phénol.
65
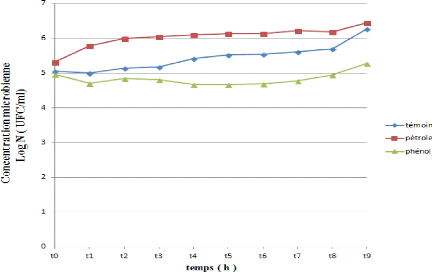
Figure 27 : Cinétique de croissance d'une souche
bactérienne (SG) durant la
biodégradation du pétrole et
du phénol.
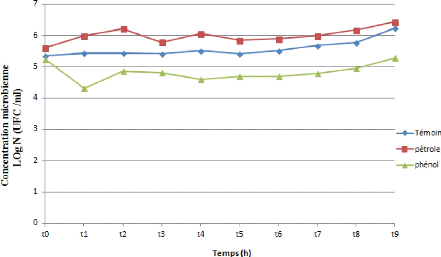
Figure 28 : Cinétique de croissance d'une souche
bactérienne (SJ) durant la
biodégradation du pétrole et
du phénol.
Cinétique de croissance des souches
bactériennes testées (dégradation du
pétrole)
D'après les figures (24, 25, 26, 27 et 28) on observe
une similarité de trajet de croissance pour les cinq souches
testés toutes presque présentent le même troc .La
croissance pour les cinq
66
souches commence par un DO= 5, puis on observe une
augmentation de la croissance de T0 jusqu'à 30 minutes puis une
augmentation exprimée par un phase de croissance exponentielle courte
.Cette augmentation ralentie correspond a la phase stationnaire pas
fixée dans même valeur mais presque stable, observée a
partir d'une heure a 24 heures pour les 5 souches et après la 5
éme heure il ya une recroissance de biomasse des souches jusqu`à
un valeur maximale (DO SI =6.456) (DO SL =6,453) (DO SH =6,369) (DO SG =6,447)
(DO SJ =6,429). Cette DO atteint son maximum à la fin de
l`incubation.
Les variations des densités optiques (DO)
constatées dans les milieux de culture des différentes souches
bactériennes étudiées (SI, SL, SH, SG, SJ) peuvent
être dues à la distribution différente de ces
bactéries entre les deux phases de notre culture, ou par leur vitesse
d`adaptation au substrat utilisé (AKMOUCI, 2009).
L`absence de phase latence démontre une adaptation plus
rapide des souches étudiées à la source de carbone
utilisée (hydrocarbure pétrole), ils ont dégradé
les fractions soluble des hydrocarbures pétrolières.
Par ailleurs, l`augmentation de la biomasse microbienne
correspondrait à la phase exponentielle, phase durant laquelle la
dissolution du substrat «hydrocarbure pétrole» suffit aux
besoins métaboliques des souches. Ainsi, La stabilisation de la
concentration microbienne au-delà d'une heure montre que le niveau des
exigences nutritionnelles surpassent la vitesse de dissolution du substrat, la
biodisponibilité deviendra alors limitant (ROCHA et al. 2007),
la diminution explique peut être par la migration de la cellule vers
le nutriment par augmentation de hydrophobicité pour facilité
l`accession de hydrocarbure. Puis on observe encore une 2 éme phase
exponentielle s'explique par la richesse du milieu par des composés
facile à dégrader qui s'exprime aussi par un indicateur
biologique de croissance élevé.
Cinétique de croissance des souches
bactériennes testées (dégradation du
phénol)
On observant l'évolution de la croissance pendant 24
heures dans des courbes des (24, 25, 26, 27 et 28). Au temps initial de la
croissance, la concentration microbienne diminue pour les souches (SI, SH, SG,
SJ) durant le premier temps (30 minutes) au même temps il y a une
augmentation notable de croissance de souche SL. Pour 1 heure on remarque une
perturbation des valeurs de la concentration microbienne pour toutes les
souches et après 3
67
heures il ya une recroissance de biomasse des souches
jusqu`à une valeur maximale (DO SI =5,481) (DO SL =5,610) (DO SH =5,574)
(DO SG =5,279) (DO SJ =5,279).
Ce résultat peut être expliqué par
l'adaptation des cellules au phénol comme seule source de carbone, la
cinétique de biodégradation est plus rapide, et le
phénomène de biodégradation se déclenche
immédiatement après la mise en culture des cellules
adaptées (SL), contrairement aux cellules non adaptées (SI, SH,
SG, SJ).
L'amélioration de la capacité des
microorganismes adaptés au phénol à le biodégrader
se manifeste par l'amélioration de la cinétique de croissance des
cellules bactériennes, ainsi que l'augmentation du taux de croissance
des bactéries libres Les cellules non adaptés prennent plus de
temps à croître et à consommer (biodégrader) le
phénol. Ces résultats sont conformes avec les travaux de
SHIMP et al .,(1987)
68
| 


