Chapitre. V. Résultats et discussions
1. L'analyse physique 1.1. La densité
:
L'examen du tableau n°
11 nous révèle les densités des miels pris en
échantillons pour notre étude, nous remarquons ainsi que la
densité des 14 échantillons de miel analysés est comprise
entre 1.41 et 1.49.
Tableau 11 : Valeurs de la densité des
échantillons du miel:
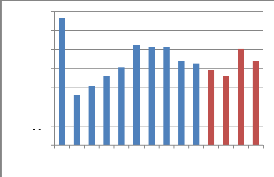
Densité
1.47 1.46 1.46
1.46
1.49
1.45
1.44
1.43
1.43
1.42
1.41
1.45 1.45
1.44
1 2 3 4 5 6 7 8 9 10 11 12 13 14
1.50
1.48
1.46
1.44
1.42
1.40
1.38
1.36
Figure 16 : Représentation graphique
des valeurs de la
densité
Miels locaux
|
N° Ech
|
Densité
|
Origine florale
|
|
1
|
1.49
|
Jujubier
|
|
2
|
1.41
|
Toutes fleurs
|
|
3
|
1.42
|
Toutes fleurs
|
|
4
|
1.43
|
Toutes fleurs
|
|
5
|
1.44
|
Toutes fleurs
|
|
6
|
1.47
|
Toutes fleurs
|
|
7
|
1.46
|
Les épineux
|
|
8
|
1.46
|
Toutes fleurs
|
|
9
|
1.45
|
Toutes fleurs
|
|
10
|
1.45
|
Les agrumes
|
|
import&
|
11
|
1.44
|
Toutes fleurs
|
|
12
|
1.43
|
Toutes fleurs
|
|
13
|
1.46
|
Toutes fleurs
|
|
14
|
1.45
|
Toutes fleurs
|
|
Moyenne
|
1.45
|
|
|
E. Type
|
0.02
|
|
Var
|
0.0004
|
De là nous pouvons dire que tous les
échantillons de miel répondent aux normes
préconisées par l'Association française
de normalisation et qui sont de 1.39 à 1.41
jusqu'à 1.52. LOUVEAUX (1985), indique que les
variations de la densité des miels proviennent surtout des variations de
la teneur en eau. Plus un miel est riche en eau et moins il est dense,
c'est ainsi que l'échantillon 1
présente le miel le plus dense à 1.49 avec une teneur en eau la
plus faible soit 13.10%.
En revanche, on observe que l'échantillon
2 est le moins dense avec une densité de 1.41, ce miel présente
une teneur en eau de 18.50%.
L'analyse de la variance relative à la
densité des miels des différents échantillons montre une
différence hautement significative (p=0.01) entre les
différents miels. (Voir l'annexe
n° 1)
Tandis qu'elle ne montre aucune
différence significative entre les miels locaux et les miels
importés.
1.2. Le pH :
Les résultats issus de cette analyse nous donnent
indication sur la réaction acide des miels analysés. Les valeurs
du pH sont présentées dans le tableau ci-dessous.
Tableau 12 : Les valeurs du pH obtenues:
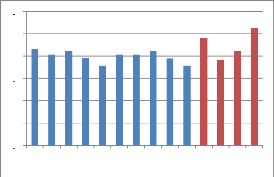
1 2 3 4 5 6 7 8 9 10 11 12 13 14
6
pH
5.25
4.82
5
4.23
3.82
4
3.57
3
2
1
0
4.32 4.07 4.243.91
4.06 4.07 4.213.89
3.56
Figure 17 : Représentation graphique des
valeurs du pH
Miels locaux
|
N° Ech
|
pH
|
Origine florale
|
|
1
|
4.32
|
Jujubier
|
|
2
|
4.07
|
Toutes fleurs
|
|
3
|
4.24
|
Toutes fleurs
|
|
4
|
3.91
|
Toutes fleurs
|
|
5
|
3.56
|
Toutes fleurs
|
|
6
|
4.06
|
Toutes fleurs
|
|
7
|
4.07
|
Les épineux
|
|
8
|
4.21
|
Toutes fleurs
|
|
9
|
3.89
|
Toutes fleurs
|
|
10
|
3.57
|
Les agrumes
|
|
import&
|
11
|
4.82
|
Toutes fleurs
|
|
12
|
3.82
|
Toutes fleurs
|
|
13
|
4.23
|
Toutes fleurs
|
|
14
|
5.25
|
Toutes fleurs
|
|
Moyenne
|
4.14
|
|
|
E. Type
|
0.45
|
|
Var
|
0.2034
|
Les valeurs du pH de nos échantillons de miel miels
oscillent entre 3.56 et 5.25 avec une moyenne de 4.14. Donc touts les miels
étudiés sont acides.
DONADIEU (1984), et GONNET (1982), signale que le miel est
acide, son pH est en moyenne entre 3.5 et 6. Le pH d'un miel
est en relation avec la quantité d'acides ionisables
qu'ils renferment (ions H+), ainsi de sa
composition minérale.
GONNET (1986), ajoute que le pH est une mesure qui permet la
détermination de l'origine florale du miel. Ainsi les
miels issus de nectar ont un pH compris entre 3.5 et 4.5, par contre ceux
provenant des miellats sont compris entre 5 et 5.5.
Nous remarquons ainsi que les échantillons 14 et 11,
ont un pH de 5.25 et 4.82 respectivement, ces échantillons
représentent les miels importés, et peuvent être issus des
mélanges de nectar et de miellat. Les autres échantillons sont
tous, des miels de nectar selon les normes préconisées par GONNET
(1986).
Le même auteur, affirme qu'un pH faible
de l'ordre de 3.5 pour un miel, prédétermine un
produit << fragile >> pour la
conservation duquel faudra prendre beaucoup de précautions. Par contre
un miel à pH 5 ou 5.5 se conservera mieux et plus longtemps.
Une relation indirecte peut apparaître entre le pH et la
conductibilité électrique des miels, et nous avons trouvé
que les miels ont une CE élevée, enregistrent un pH
élevé, cette relation peut donner une idée sur
l'origine des miels.
L'analyse de la variance du pH montre une
différence très hautement significative
(p=0.001) entre les différents échantillons
expérimentés, tandis qu'elle montre une
différence significative (p=0.05) entre les miels
locaux et les miels importés.
Comparativement aux normes préconisées relatives
au pH des miels, nous pouvons conclure que les miels locaux sont des miels de
nectar, tandis que les miels introduits contiennent une quantité de
miellat.
1.3. La Conductibilité
électrique
Les résultats issus de cette analyse sont portés
sur le tableau N° 13. Les valeurs de la
conductibilité électrique obtenues comprises entre 2.23 et 7.60,
avec une moyenne de 4.02 x10-4 s/cm.
Ces valeurs correspondent à ceux rapportées par
le Codex, ces dernières ne dépassent pas
8x10-4 s/cm pour les miels de nectar, et
n'abaissent pas moins de 8 x10-4
s/cm pour les miels de miellat.
GONNET (1982), signale que les miels foncés sont les
plus riches en matières minérales ionisables, donc bon conducteur
de courant. LOUVEAUX (1976), affirme que les sels sont apportés par le
pollen, par le nectar des fleurs ou par les miellats.
Nous remarquons que les échantillons 14 (CE=
7.60x10-4 s/cm) et 13 (CE=
7.01x10-4 s/cm) sont des miels importés,
peuvent contenir une certaine quantité du miellat, ils sont les plus
foncés (allant à la couleur noire), ces miels sont les meilleurs
conducteurs du courant électrique.
Tableau 13 : Les valeurs de la
conductibilité électrique :
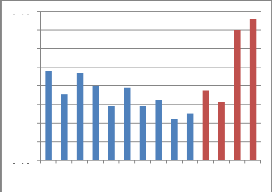
1 2 3 4 5 6 7 8 9 10 11 12 13 14
8.00
7.6
CE
7.01
7.00
6.00
4.80
4.68
5.00
4.00
3.89
3.76
4.00
3.55
3.14
3.00
2.53
2.23
2.00
1.00
0.00
2.933.25
2.92
Figure 18 : Représentation graphique
des valeurs de la
conductibilité électrique
Miels locaux
|
N° Ech
|
CE ×10-4 s/cm
|
Origine florale
|
|
1
|
4.80
|
Jujubier
|
|
2
|
3.55
|
Toutes fleurs
|
|
3
|
4.68
|
Toutes fleurs
|
|
4
|
4.00
|
Toutes fleurs
|
|
5
|
2.92
|
Toutes fleurs
|
|
6
|
3.89
|
Toutes fleurs
|
|
7
|
2.93
|
Les épineux
|
|
8
|
3.25
|
Toutes fleurs
|
|
9
|
2.23
|
Toutes fleurs
|
|
10
|
2.53
|
Les agrumes
|
|
import&
|
11
|
3.76
|
Toutes fleurs
|
|
12
|
3.14
|
Toutes fleurs
|
|
13
|
7.01
|
Toutes fleurs
|
|
14
|
7.6
|
Toutes fleurs
|
|
Moyenne
|
4.02
|
|
|
E. Type
|
1.58
|
|
Var
|
2.4843
|
Nous remarquons par contre que les autres échantillons
sont des miels de nectar, ils sont les plus clairs et conduisent relativement
mal le courant.
Dans ce conteste, GONNET, (1986), affirme que la
conductibilité électrique du miel apporte une indication
précieuse dans la définition d'une appellation,
les miels issus de nectar ont une CE allant de 1 à 5
x10-4 s/cm, et ceux issus de miellats de 10
à 15 x10-4 s/cm, par contre, les valeurs
médianes correspondent souvent à des mélanges naturels des
deux origines.
Donc, nous pouvons conclure que tous nos miels sont des miels
de fleurs, excepté les échantillons importés
n° 14 et 13 qui présentent des valeurs
médianes, donc ils s'agissent d'un
mélange de nectar et de miellat. Nous remarquons ainsi au niveau de
l'analyse statistique relative à la CE une
différence significative (p=0.05) entre les miels
locaux et les miels introduits. (Annexe n°1)
1.4. L'absorbance
Le tableau ci-après, nous donne les valeurs de la teneur
de l'absorbance obtenue des différents
échantillons et qui varie de 0.045 à 0.292 avec une moyenne de
0.097.
Les échantillons 14 et 13, qui sont des miels
importés, présentent respectivement une absorbance de 0.292 et
0.144, cela est dû à leur couleur très foncée. Cette
couleur pourra être expliquée par la présence de certaine
quantité de miellat.
WHITE et al (1962), cités par CHAUVIN (1968), et
LOUVEAUX (1968), indique que la couleur du miel est liée à la
teneur en matière minérale et en protéines. Ainsi les
miels foncés sont plus riches en cendres, en protéines, et en
colloïdes.
Tableau 14 : Classement des valeurs de
l'absorbance:
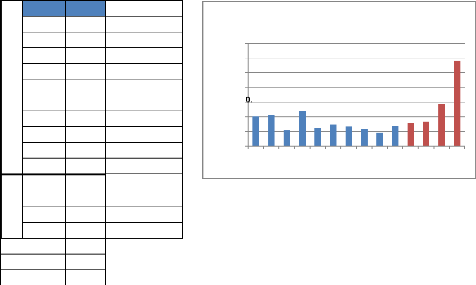
|
Miels locaux
|
N° Ech
|
Abs
|
Origine florale
|
|
1
|
0.101
|
Jujubier
|
|
2
|
0.106
|
Toutes fleurs
|
|
3
|
0.053
|
Toutes fleurs
|
|
4
|
0.120
|
Toutes fleurs
|
|
5
|
0.062
|
Toutes fleurs
|
|
6
|
0.074
|
Toutes fleurs
|
|
7
|
0.066
|
Les épineux
|
|
8
|
0.058
|
Toutes fleurs
|
|
9
|
0.045
|
Toutes fleurs
|
|
10
|
0.069
|
Les agrumes
|
|
import&
|
11
|
0.079
|
Toutes fleurs
|
|
12
|
0.084
|
Toutes fleurs
|
|
13
|
0.144
|
Toutes fleurs
|
|
14
|
0.292
|
Toutes fleurs
|
|
Moyenne
|
0.097
|
|
|
E. Type
|
0.062
|
|
Var
|
0.0039
|
Figure 19 : Représentation graphique
des valeurs de
l'absorbance
Absorbance
0.350
0.300
0.250
0.200
0.150
0.100
0.050
0.000
1 2 3 4 5 6 7 8 9 10 11 12 13 14
0.292
101
0.106
0.053
0.120
0.062
0.074
0.066
0.058
0.045
0.069
0.079
0.084
0.144
La comparaison des moyennes de l'absorbance
ne montre pas une différence significative entre les différents
échantillons de miel. Tandis qu'elle montre une
différence significative (p<0.05) entre les miels
locaux et les miels introduits. Nous pouvons expliquer cette différence
par :
> L'origine du miel, nectar ou miellat,
> L'espèce végétale
dont provient ce miel ;
> La composition chimique et notamment la concentration en
cendres et la teneur en protéines.
2. L'analyse chimique 2.1. La teneur en eau
Après avoir rapporté les indices de
réfraction obtenus à la table de CHATAWAY (tableau
n°5), nous avons obtenus les résultats suivants
classés dans le tableau ci-après.
Tableau 15 : Les valeurs de la teneur en eau
des échantillons de miel:
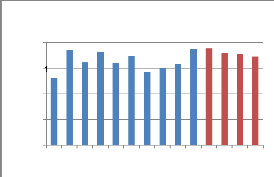
T. en eau
1 2 3 4 5 6 7 8 9 10 11 12 13 14
3.10
18.50
16.20
18.20
16.00
17.40
15.10 14.30
15.80
18.8018.90
18.00
17.80
17.30
20.00
15.00
10.00
5.00
0.00
Figure 20 : Représentation graphique
des valeurs de la
teneur en eau
Miels locaux
N° Ech
|
Eau%
|
Origine florale
|
|
13.10
|
Jujubier
|
|
18.50
|
Toutes fleurs
|
|
16.20
|
Toutes fleurs
|
|
18.20
|
Toutes fleurs
|
|
16.00
|
Toutes fleurs
|
|
17.40
|
Toutes fleurs
|
|
14.30
|
Les épineux
|
|
15.10
|
Toutes fleurs
|
|
15.80
|
Toutes fleurs
|
|
18.80
|
Les agrumes
|
import&
|
11
|
18.90
|
Toutes fleurs
|
|
18.00
|
Toutes fleurs
|
|
17.80
|
Toutes fleurs
|
|
17.30
|
Toutes fleurs
|
Moyenne
|
16.81
|
|
E. Type
|
1.78
|
|
3.1644
|
|
Nous remarquons que la teneur en eau de nos
échantillons du miel varie de 13.10 à 18.90, avec une moyenne de
16.81. Ces valeurs se situent bien dans l'intervalle
préconisé par le Codex alimentarius, et qui ne
dépasse pas 21% en général, et ne dépasse pas 25%
pour les miels industriels. Selon CHAUVIN (1968), les miels
commercialisés ont une teneur en eau très variées, allant
de 14 à 25, l'optimum se situe en 17 et 18.
La teneur en eau est une donnée très importante
à connaitre, car elle conditionne la qualité du miel, en effet
seuls les miels dont la teneur en eau est inférieur à 18% sont
bon à conserver (GONNET, 1982).
Les valeurs enregistrées de nos miels
n'excèdent pas cette norme excepté les
échantillons 11, 10, 2, et 4, qui présentent les plus
élevées, soit 18.90%, 18.80%, 18.50%, 18.20% respectivement. Ceci
pourra être expliqué par :
> une récolte précoce de ce miel,
c'est-à-dire avant leur maturation. C'est le cas de
l'échantillon 2 qui est récolté au mois
d'avril 2009, avant la maturation et
l'operculation totale.
> le nombre de jours que ces miels ont passé dans les
maturateurs.
> une extraction dans un milieu humide. LOUVEAUX (1968),
et PROST (1972) signalent que l'extraction du miel dans un
milieu assez humide peut entrainer une absorption
d'humidité.
> des conditions dans les quelles ce miel est
élaboré, récolté, transformé et
entreposé dans la ruche, c'est le cas de
l'échantillon n° 10 qui provient
de la Mitidja région caractérisée par le taux
élevé de l'humidité atmosphérique
surtout durant le printemps, la période de récolte de cet
échantillon de miel, dans ce contexte GONNET (1993) signale
qu'une humidité relativement élevée
pendant la récolte va conduire à une déshumidification
difficile du nectar par l'abeille, donc production
d'un miel riche en eau, instable sur le plan physique et
biologique et susceptible de se dégrader rapidement.
Les échantillons 1 et 7 sont les miels les plus
pauvres en eau, soit respectivement 13.10% et 14.30 %, ces derniers offrent une
très bonne conservation. Leur faible teneur en eau pourra être
expliquée par :
> l'extraction qui est effectuée
durant une période très chaude (mois
d'août pour l'échantillon 1)
ainsi que le miel de jujubier est pratiquement sec, et qui se conserve quelque
soit la température du stockage et le nombre de levure qui contient, car
selon GONNET (1982), en dessous de 15 % d'eau, la fermentation
n'intervient jamais.
Les 6 échantillons les plus pauvres en eau
n° (3, 5, 9, 8, 7 et 1) présentent des miels
locaux de la région steppique caractérisée par un climat
chaud et sec.
Les miels importés ont une teneur de 17.30 à
18.90, ils sont conservés longtemps à température ambiante
dans les étalages de commerce, mais ils n'ont pas
montrés des signes de fermentation, ceci pourra être
expliqué par une pasteurisation qui a tué les levures
responsables de la fermentation.
La comparaison des valeurs de la teneur en eau montre une
différence très hautement significative
(p<0.001) entre les différents miels
analysés. Tandis qu'elle montre qu'il
n y a aucune différence significative entre les miels locaux et les
miels introduits.
2.2. La teneur en protéines
L'analyse de tableau n° 16
nous a permet de constater que les miels présentent une teneur en
protéines comprise entre 0.09 et 0.88% avec une moyenne de 0.50.
LOUVEAUX (1968), signale que la teneur en protéines est
d'environ 0.26% en moyenne avec un maximum de 0.83%. Il ajoute
que les matières azotées peuvent être présente dans
les secrétions salivaires de l'abeille.
WHITE (1962), signale que les miels convenablement
récolté sont pauvres ou très pauvres en
protéines.
Tableau 16 : Les valeurs de la teneur en
protéines obtenues:
teneur en pro nes
1 2 3 4 5 6 7 8 9 10 11 12 13 14
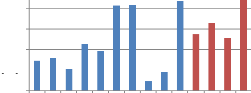
0.45
0.39
0.29 0.31
0.21
0.09
0.18
0.55
0.66
0.51
0.80
0.60
0.40
0.20
0.00
Figure 21 : Représentation graphique
des valeurs de la
teneur en protéines
Miels locaux
|
N° Ech
|
Prot%
|
Origine florale
|
|
1
|
0,29
|
Jujubier
|
|
2
|
0,31
|
Toutes fleurs
|
|
3
|
0,21
|
Toutes fleurs
|
|
4
|
0,45
|
Toutes fleurs
|
|
5
|
0,39
|
Toutes fleurs
|
|
6
|
0,83
|
Toutes fleurs
|
|
7
|
0,84
|
Les épineux
|
|
8
|
0,09
|
Toutes fleurs
|
|
9
|
0,18
|
Toutes fleurs
|
|
10
|
0,87
|
Les agrumes
|
|
import&
|
11
|
0,55
|
Toutes fleurs
|
|
12
|
0,66
|
Toutes fleurs
|
|
13
|
0,51
|
Toutes fleurs
|
|
14
|
0,88
|
Toutes fleurs
|
|
Moyenne
|
0.50
|
|
|
E. Type
|
0.27
|
|
Var
|
0.0755
|
Nos échantillons sont conformes aux normes requises.
Les échantillons 14 et 10 sont exceptés, avec une teneur en
protéines de 0.88 et 0.87% respectivement, ces échantillons
enregistrent des valeurs dépassent la norme, mais sont très
proches. Cette teneur peut être expliquée par :
> La forte concentration du pollen dans ces miels. GONNET
(1985), rapporte que lors de l'extraction manuelle par
pression des gâteaux de cire, quelques larves d'abeilles
ainsi que des pollens sont très souvent écrasés.
32.0
35.0
|
Miels locaux
|
N° Ech
|
Ac L meq/kg
|
Origine florale
|
|
1
|
15.0
|
Jujubier
|
|
2
|
25.0
|
Toutes fleurs
|
|
3
|
11.0
|
Toutes fleurs
|
|
4
|
25.0
|
Toutes fleurs
|
|
5
|
25.0
|
Toutes fleurs
|
|
6
|
22.5
|
Toutes fleurs
|
|
7
|
19.0
|
Les épineux
|
|
8
|
17.5
|
Toutes fleurs
|
|
9
|
15.0
|
Toutes fleurs
|
|
10
|
25.0
|
Les agrumes
|
|
import&
|
11
|
23.0
|
Toutes fleurs
|
|
12
|
29.0
|
Toutes fleurs
|
|
13
|
32.0
|
Toutes fleurs
|
|
14
|
14.0
|
Toutes fleurs
|
|
Moyenne
|
22.0
|
|
|
E. Type
|
5.81
|
|
Var
|
33.7308
|
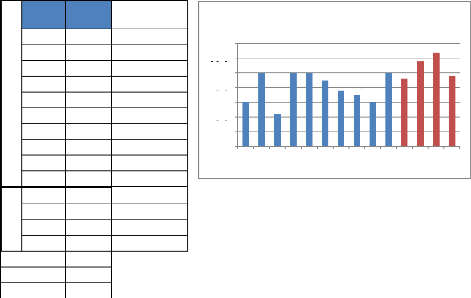
Figure 22 : Représentation graphique
des valeurs de
l'acidité
Acidité
1 2 3 4 5 6 7 8 9 10 11 12 13 14
30.0
25.0
20.0
15.0
10.0
5.0
0.0
15.0
25.0
11.0
25.0 25.0
22.5
19.017.5
15.0
25.023.0
29.0
24.0
Les autres échantillons présentent des teneurs
en protéines répondent à la norme requise, ces
échantillons sont convenablement récoltés et par
conséquent, ils sont généralement pauvres en
protéines (LOUVEAUX, 1968).
L'analyse de la variance de la teneur en
protéines révèle une différence très
hautement significative (p=0.001) entre les différents
échantillons du miel. Ceci pourra être expliqué par la
variation de la quantité de pollens présentent dans chaque miel,
récolté dans des conditions différentes.
En revanche, elle ne marque aucune différence
significative entre les miels locaux et les miels importés.
D'après LOUVEAUX (1968), les miels
foncés sont plus riche en azote que les miels clairs. Les
échantillons 14, 10, et 7, les plus foncés se montre les plus
riches en protéines que les échantillons 1, 3, 9, 8.
La plus faible valeur est enregistrée pour
l'échantillon n°8 qui est le plus
clairs avec une valeur de 0.09%.
2.3. L'acidité
D'après le tableau
n° 17, nous remarquons que les valeurs de
l'acidité libre des miels varient de 11.0 à 32.0
milliéquivalent/kg, avec une moyenne de 22.0.
Tableau 17 : Les valeurs de
l'acidité libre:
Selon les normes internationales de Codex (2001),
l'acidité libre du miel ne doit pas dépasser 50
milliéquivalents d'acide par 1000 g. Nos miels sont conformes aux normes
préconisées.
GONNET (1982), affirme que tous les miels sont acides. Ils
contiennent des acides organiques libres ou combinés sous forme de
lactones.
D'après BOGDANOV (1999), et GONNET
(1992), l'acidité est un critère de
qualité important, elle donne des indications fort importantes de
l'état du miel. Les échantillons 12, 2, 4, 5, 10
et plus particulièrement l'échantillon 13,
prédéterminent des produits fragiles pour la conservation car
l'acidité forte de milieu favorise la
dégradation des hexoses en HMF qui déprécie la
qualité du miel. La fermentation du miel provoque une augmentation de
l'acidité dans le miel.
La présence de certains acides dans ces miels est
probablement due au nectar ou miellat, mais leur origine principale est
à recherché dans les secrétions salivaires de
l'abeille et dans les processus enzymatiques et fermentatifs
(LOUVEAUX, 1968).
La comparaison des moyennes de
l'acidité révèle une différence
très hautement significative (p=0.001) entre les
différents miels analysés. Tandis qu'elle ne
marque aucune différence significative entre les miels locaux et les
miels d'importation commercialisés.
2.4. L'Hydroxyméthylfurfural (HMF):
Le tableau n° 18 nous a permet de constater
que les miels présentent une teneur en HMF comprise entre 0.05 et 98.80
mg/kg, avec une moyenne de 18.91 mg/kg.
MARCEAU, et al. (1994), signale que le principal critère
d'évaluation mesurable de la qualité du miel est la concentration
en Hydroxyle méthyle furfural.
D'un point de vue législatif, tous les
miels analysés sont conformes aux normes de Codex alimentarius qui
limitent l'HMF à 60 mg/kg, à
l'exception l'échantillon
n° 11 et 12, qui sont des miels importés, ils
enregistrent une teneur d'HMF élevée, soit 98.80
et 67.69 mg/kg. Cette teneur élevée pourra être
expliqué par :
> la teneur élevée en eau, selon MARCEAUX et
al. (1994), une teneur en eau élevée favorise la transformation
des sucres en HMF, nous avons enregistré une teneur en eau
respectivement de 18.90 % et 18.00 %.
> l'excès de la chaleur et
l'entreposage prolongé sont des facteurs encore plus
importants dans ce processus (MARCEAUX et al. 1994).
> une acidité élevée du miel
favorisent la dégradation du fructose en HMF (GONNET, 1982 et MARCEAUX
et al. 1994), nous avons enregistré pour ces deux échantillons
une acidité de 23.0 et 29.0 meq/kg.
> PROST (1987), mentionne que la
pasteurisation peut augmenter très sensiblement la couleur et le taux de
l'HMF qu'il caractérise les miels
chauffés et vieux, de là nous pouvons dire que les
échantillons 11 et 12 sont des vieux miels chauffés, et leur date
de récolte ne pourra pas être celle mentionnée sur
l'étiquette.
Tableau 18 : Les des valeurs de
l'HMF :
HMF
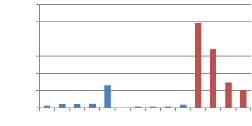
120.00
100.00
80.00
67.69
60.00
29.32
40.00
25.89
3.89
20.39
1.20
1.19 3.44
20.00
2.69
4.194.79
0.05
1.15
0.00
98.80
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Figure 23 : Représentation graphique
des valeurs de la
teneur en HMF
Miels locaux
|
N° Ech
|
HMF mg/kg
|
Origine florale
|
|
1
|
2.69
|
Jujubier
|
|
2
|
3.89
|
Toutes fleurs
|
|
3
|
4.19
|
Toutes fleurs
|
|
4
|
4.79
|
Toutes fleurs
|
|
5
|
25.89
|
Toutes fleurs
|
|
6
|
0.05
|
Toutes fleurs
|
|
7
|
1.15
|
Les épineux
|
|
8
|
1.20
|
Toutes fleurs
|
|
9
|
1.19
|
Toutes fleurs
|
|
10
|
3.44
|
Les agrumes
|
|
import&
|
11
|
98.80
|
Toutes fleurs
|
|
12
|
67.69
|
Toutes fleurs
|
|
13
|
29.32
|
Toutes fleurs
|
|
14
|
20.39
|
Toutes fleurs
|
|
Moyenne
|
18.91
|
|
|
E. Type
|
29.57
|
|
Var
|
874.1539
|
Les échantillons 10, 1, 8, 9, 7, et 6 ont une teneur
faible en HMF, ces échantillons présentent des miels frais de
l'année 2009. D'après BOGDANOV,
(2001), la teneur en HMF d'un miel est pratiquement nulle au
moment de la récolte. Ces le cas du miel n° 6 qui
est récolté avant quelques jours de faire
l'analyse. Le même auteur ajoute
qu'elle augmente progressivement, lentement tout
d'abord pour s'accélérer par la
suite.
L'analyse de la variance du dosage
d'HMF révèle une différence très
hautement significative (p=0.001) entre les différents
échantillons de miel. Elle révèle aussi une
différence très hautement significative
(p=0.001) entre les miels locaux et les miels
importés.
Les miels 11 et 12 sont des miels importés, dont on
ignore leurs dates de récolte, ils peuvent être des miels qui ont
passé une longue durée pour être commercialiser (vieux
miels).
3. L'analyse pollinique :
Nous avons observé nos échantillons de miel sous le
microscope, de là et selon la quantité de pollens
présente, nous avons classé les miels analysées en 3
groupes :
Classa I : Beaucoup de pollens (+++)
Classe II : peu de pollens (++)
Classe III : Très peu de pollens (+)
Les variations quantitative et qualitative en pollens sont due
à :
> La diversité des espèces
végétales butinées par l'abeille, et leur
intérêt apicole: soit l'espèce
butinée est pollinifère, nectarifère ou les deux à
la fois.
> Le travail et les besoins de la colonie
d'abeille.
> La technologie du miel : le mode
d'extraction (mécanique ou manuelle), LOUVEAUX et al, (1970),
constatent que les miels d'extracteur centrifuge contiennent
peu de sédiment. La filtration : Les miels
importés (commercial) qui ont subit à une ultrafiltration, va
causer l'élimination des pollens.
Classa I : Beaucoup de pollens (+++) :
Ce sont les miels qui renferment un nombre important de pollens,
dans cette classe, nous avons observé beaucoup de pollens dans les
échantillons 1, 2, et 6.
Nos observations au niveau de
l'échantillon N°01 nous
révèle la présence d'un nombre important
de graines de pollen, et après l'identification par
comparaison avec des pollens de référence, nous pouvons dire
qu'il confirme son appellation florale présumée,
puisque il est dominé par les grains de pollen de Ziziphus
lotus, et nous pouvons dire aussi qu'il est un miel
monofloral.
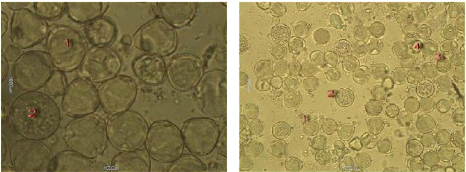
Figure 24 : Vue microscopique des grains de
pollen du miel n°1 (gx100)
Figure 25 : Vue microscopique des grains de
pollen du miel n°1 (gx40)
Les échantillons 2 et 6, sont des miels de toute fleur,
ils présentent des déférentes formes de pollens,
après identification par comparaison avec des pollens de
référence nous citons par exemple quelques pollens trouvé
dans ces échantillons "1- Prunus sp. 2- Papaver rhoeas.
3- Malva sylvestris 5- Eucalyptus sp" pour
l'échantillon 2, et "1- Rosmarinus officinalis
2-Borrago officinalis 3- Galactites tomentosa 4- Prunus
sp. 5- Eucalyptus sp. 6-, vicia sp ", pour
l'échantillon 6, donc nous pouvons dire
qu'ils confirment l'appellation florale
présumée, donc ce sont des miels toutes fleurs.
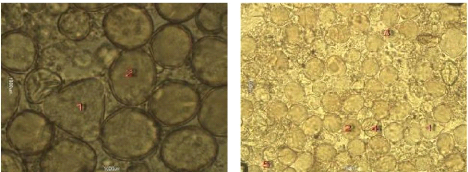
Figure 26 : Vue microscopique des grains de
pollen du miel n°2 (g×100)
Figure 27 : Vue microscopique des grains de
pollen du miel n°2 (g×40)
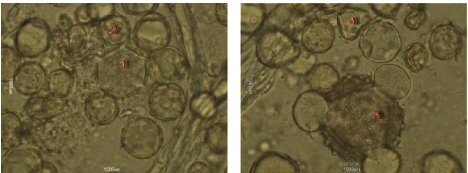
Figure 28 : Vue microscopique des grains de
pollen du miel n°6 (g×100)
Figure 29 : Vue microscopique des grains de
pollen du miel n°6 (g×100)
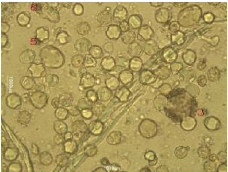
Figure 30 : Vue microscopique des grains de
pollen du miel n°6 (g×40)
Classe II : peu de pollens (++) :
Dans cette classe nous avons regroupé les miels qui
représentent une faible quantité en pollens sous le microscope,
nous retiendrons ainsi dans cette classe les échantillons 4, 5, 7, et
12.
Nous remarquons que les échantillons 4, et 5 renferment
plusieurs formes de pollens, donc ils confirment l'appellation
et sont tous des miels multifloraux.
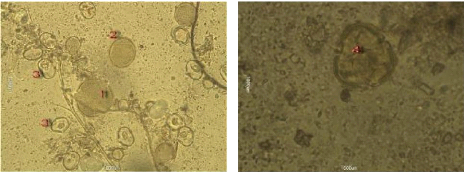
Figure 31 : Vue microscopique des grains de
pollen du miel n°4 (g×40)
Figure 32 : Vue microscopique des grains de
pollen du miel n°4 (g×100)
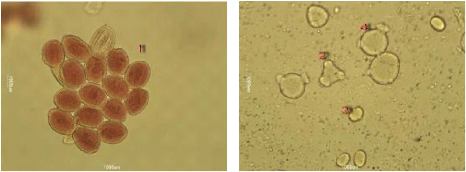
Figure 33 : Vue microscopique des grains de
pollen du miel n°5 (g×40)
Figure 34 : Vue microscopique des grains de
pollen du miel n°5 (g×40)
Après l'identification des pollens de
l'échantillon 7 (les épineux), nous constatons
qu'il ne confirme pas l'appellation florale
présumée puisque il renferme plusieurs formes de pollens, 1-
Galactites tomentosa 2- Peganum harmala. 3- Vicia sp.
4- pyrus sp. 5- Raphanus raphanistrum. 6- Olea
europaea. Ainsi que les pollens du chardon (Galactites tomentosa)
ne sont pas dominants, donc c'est un miel de toutes fleurs.
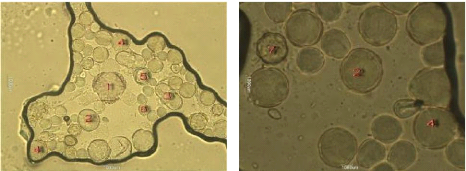
Figure 35 : Vue microscopique des grains de
pollen du miel n°7(g×40)
Figure 36 : Vue microscopique des grains de
pollen du miel n°7(g×40)
Tandis que l'échantillon 12 illustre
des formes variées de grains de pollen tels que 1- pyrus sp. 2-
Achillea sp. 3- Vicia sp. 6- Aster sp, ce miel
présente un miel importé qu'il
confirme son appellation florale.
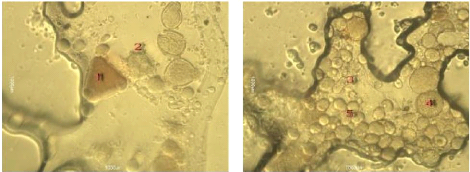
Figure 37 : Vue microscopique des grains de
pollen du miel n°12 (g×40)
Figure 38 : Vue microscopique des grains de
pollen du miel n°12 (g×40)
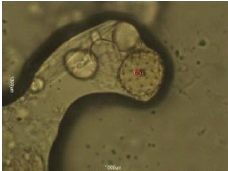
Figure 39 : Vue microscopique des grains de
pollen du miel n°12 (g×100)
Classe III : Très peu de pollens (+) :
C'est la classe qui regroupe les
échantillons de miel qui ont une très faible quantité de
grains de pollen sous le microscope, les échantillons 3, 8, 9, 10, 11,
13, et 14 appartiennent à cette classe.
L'échantillon 10,
présumé miel d'agrumes, cette miel ne confirme
pas cette appellation car les grains de pollen trouvées
présentent des différentes formes, parmi ces dernières
nous citons : 1- Polygonum equisteforme 2- Eucalyptus sp et
les pollens de Citrus sp (3) qui ne sont pas dominantes.

|
Figure 40 : Vue microscopique des grains de
pollen du miel n°10 (g×100)
|
Figure 41 : Vue microscopique des grains de
pollen du miel n°10 (g×100)
|
|
|
|
Figure 42 : Vue microscopique des grains de
pollen du miel n°10 (g×100)
|
|
Les échantillons 3, 8, et 9, découvrent des
différentes formes de pollens en faible quantité, ils confirment
l'appellation présumée, qui sont tous provenant
des miels multifloraux.

Figure 43 : Vue microscopique des grains de
Figure 44 : Vue microscopique des grains
pollen du miel n°3
(g×40) de pollen du miel n°3
(g×40)
Les échantillons 11, 13, et 14, qui sont des
miels importés, contiennent un très peu nombre
de pollens, qui n'ont pas la même forme, donc ils
confirment l'appellation présumée, qui sont des
miels polyfloraux.
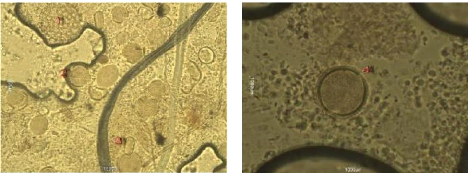
Figure 45 : Vue microscopique des grains de
pollen du miel n°11 (g×40)
Figure 46 : Vue microscopique des grains de
pollen du miel n°11 (g×100)
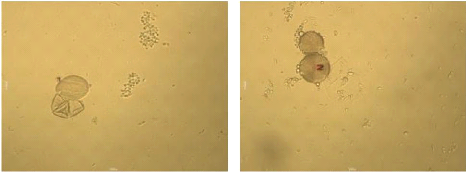
|
Figure 47 : Vue microscopique des grains de
pollen du miel n°13 (g×40)
|
Figure 48 : Vue microscopique des grains de
pollen du miel n°13 (g×40)
|
|
|
|
Figure 49 : Vue microscopique des grains de
pollen du miel n°14 (g×40)
|
|
Les résultats de l'analyse pollinique
sont résumés au niveau de tableau 19 Tableau 19
: Le spectre pollinique de 14 échantillons.
|
Echantillon
|
Origine
florale
|
Présence/
Absence
|
Pollens déterminés
|
|
1
|
Jujubier
|
+++
|
1- Ziziphus lotus (Jujuber) 2- Peganum harmala
(Harmal) 3- Aster sp. 4- Eucalyptus sp.
|
|
2
|
Toutes fleurs
|
+++
|
1- Prunus sp, Pyrus sp. 2- Papaver rhoeas. 3-
Malva sylvestris (Malvacées) 4-Indéterminé. 5-
Eucalyptus sp.
|
|
3
|
Toutes fleurs
|
+
|
1- Arbre fruitier de type Pyrus sp. 2- Helianthus
anuus (Tournesol) 3- Arbre fruitier de type Prunus sp.
|
|
4
|
Toutes fleurs
|
++
|
1- Indéterminé. 2- Caryophylacées. 3-
Hedysarum coronarium (sulla). 4- Raphanus raphanistrum.
|
|
5
|
Toutes fleurs
|
++
|
1- Indeterminé. 2- Prunus sp. 3- Apiacées
(Tapsia garganica) 4- Trifolium sp.
|
|
6
|
Toutes fleurs
|
+++
|
1- Lamiacées, (Salvia verbinaca), ou
Rosmarinus officinalis (romarin) 2- Boragonacées (Borrago
officinalis) 3- Genre Achillea, ou Galactites tomentosa (chardon
laiteux) (composées). 4- Vitacées (Vitis vinifera),
Prunus sp. 5- Eucalyptus sp. (Myrtacées)
6- Daucus carota, vicia sp (v.faba)
|
|
7
|
Les épineux
|
++
|
1- Sclofilariacées, ou Achellia sp ou
Galactites tomentosa (chardon laiteux) 2- Peganum harmala.
3- Vicia sp. 4- Prunus sp, pyrus sp. 5-
Raphanus raphanistrum. (Cruciferes) 6- Olea europaea.
(Oléacées) 7- Borrago officinalis.
(Borraginacées)
|
|
8
|
Toutes fleurs
|
+
|
Indéterminé
|
|
9
|
Toutes fleurs
|
+
|
Indéterminé
|
|
10
|
Les agrumes
|
+
|
1- Polygonum equisteforme (Polygonacées).
2- Eucalyptus sp. (Myrtacées) 3- Citrus
sp (Rutacées).
|
|
11
|
Toutes fleurs
|
+
|
1- Indéterminé. 2- Acacia cyanophylla
(mimosa). 3- Indeterminé. 4- Olea europaea ou Citrus sp
5- Centauria sp, Raphanus sp.
|
|
12
|
Toutes fleurs
|
++
|
1- Arbre fruitier de type pyrus sp. 2- Achillea
sp. 3- Vicia sp. 4- Oscalis prescaprae (oscalis)
(Oxalidacées). 5- Indéterminé. 6- Aster sp.
|
|
13
|
Toutes fleurs
|
+
|
1 et 2 sont Indéterminés.
|
|
14
|
Toutes fleurs
|
+
|
1 est indéterminé.
|
(+++) : Beaucoup de pollens, (++) : Peu de pollens, (+) :
Très peu de pollen.
| 


