|
ESSAI D'ELABORATION ET ANALYSE
CHIMICO-CALORIFIQUE D'UN BIOCARBURANT
À
BASE DE MANIOC
|


MINISTÈRE DE L'ENSEIGNEMENT REPUBLIQUE
DUCAMEROUN
SUPERIEUR PAIX-TRAVAIL-PATRIE
UNIVERSITE DE DOUALA
UNIVERSITY OF DOUALA
DIVISION DES TECHNIQUES INDUSTRIELLES
DEPARTEMENT DE
GENIE MECANIQUE
OPTION: MECANIQUE AUTOMOBILE
BP 1872 DOUALA Tél. / Fax: 340 42 91 e-mail
: enset@
camnet.cm
ECOLE NORMALE SUPERIEURE D'ENSEIGNEMENT
TECHNIQUE
MEMOIRE DE FIN D'ETUDE PRESENTE EN VUE DE
L'OBTENTION
DU DIPLÔME DE PROFESSEUR D'ENSEIGNEMENT TECHNIQUE
DE
2ème GRADE (DIPET II)
Rédigé et présenté
par:
AYISSI Zacharie Merlin
(DIPET I Technique Automobile)
Directeur :
NJEUGNA Ebenezer
Encadreurs :
Dr. AZEBAZE Anatole Guy Blaise (HDR-Chargé de
Cours à L'ENSET) Dr. DJUINA André
(Chargé de Cours à L'ENSET)
M. TIMBA Sadrack
(Chargé de Cours à L'ENSET)
Année académique 2006 - 2007
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007


UNIVERSITE DE DOUALA
ECOLE NORMALE SUPERIEURE
D'ENSEIGNEMENT TECHNIQUE (ENSET)
Ce mémoire intitulé :
« ESSAI D'ELABORATION ET ANALYSE
CHIMICO-
CALORIFIQUE D'UN BIOCARBURANT À BASE
DE
MANIOC »

Présenté par:
AYISSI Zacharie Merlin
En vue de l'obtention du diplôme de Professeur
d'Enseignement
Technique de Deuxième Grade (DIPET II)
A été soutenue le Jeudi 07 Juin 2007
Devant un Jury constitué de :
o Pr. NJEUGNA Ebenezer (Président)
o Dr AZEBAZE Anatole Guy Baise (Rapporteur) o Dr. DJUINA
André (Membre)
o M. NZUSSUO Bernabé (Membre)
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
A mes parents :
AYISSI NG'AWONA Cyprien et ESSOLA Marie
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
REMERCIEMENTS
Ce travail a été rendu possible grâce au
précieux concours de nos encadreurs qui sont : Pr. NJEUGNA
Ebenezer
Dr. DJUINA AndréDr. AZEBAZE Anatole Guy
Blaise
M. TIMBA Sadrack
Nous tenons à leur adresser nos sincères
remerciements et à leur exprimer notre profonde reconnaissance pour leur
disponibilité et leur suivie.
Nous remercions également le :
- Personnel et enseignants de l'ENSET pour leur
disponibilité.
- Mlle. Augustine ; le personnel du Lycée Technique de
Nkolbison
Je remercie mes frères et soeurs :
NGAWONA Julie ; ESSAH Angeline ; ZANG Michel B. et Madame
ZANG; NVONDO AYISSI Maurice ; NVONDO AYISSI Maurice ; KOA Reine Marie ; EMBOLO
AYISSI Pierrette ; NAMA Marthe M. ; KENENG Augustine ; AYISSI Cyprien
Junior ; BALLA Ndzie ; NFOUMOU Delphine ; MENGUE NDZIE ; EYENGA Ndzie
; ZANG Ndzie ; ABENA N...
Je remercie :

Monsieur EPEE Jules sa femme ainsi que leurs enfants.
M. et Mme. POM ; POM Victorien ; POM Alvine.
Mme MENGUE Jeanne ; BEBENE Lucie.
M. et Mme ESSAMA NGONO Gérard ; M. NOAH MENOUNGA B. M.
AMOUGUI Sylvestre
M.NKODO ; M. FOUDA ZIBI J. M; M. et Mme NDZIE Joseph
La Révérende soeur Apolline BIAKOLO AVIDI.
Mes amis : ETETI Ambassa Olivier ; NGO Minette ; ZE Eric ; MPIANG
NJATTOH G. ; EKOMANE ; MANI Barthélemy ; EBOUGA Claude.
Tous mes camarades de promotion.
Mon coéquipier PAKA TCHINDA Basile.
Que tous ceux qui ne trouveront pas leurs noms sur cette page,
veuillent croire à ma sympathie et ma reconnaissance.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
RESUME
Prix du pétrole, dépendance
énergétique, pollution atmosphérique, valorisation des
espaces cultivables, les biocarburants apparaissent
aujourd'hui comme une réponse crédible face à ces
problèmes. En effet, les combustibles fossiles ont
démontré leurs limites à travers les problèmes
qu'ils ont fait naître jusqu'à présent (menaces sur
l'écosystème...)
Ce travail est destiné à extraire du manioc
(Manihot Esculenta Grantz), de l'éthanol et d'en faire
un carburant végétal pour moteurs à combustion interne.
Considérant que la combustion de l'éthanol en présence du
dioxygène est une réaction exothermique, nous avons
utilisé cette énergie pour faire fonctionner les moteurs à
combustion interne. Pour y parvenir, il a été question tout
d'abord, d'extraire l'amidon du manioc. La procédure
d'élaboration du biocarburant a consisté à la fermentation
de cet amidon suivie d'une distillation primaire (effectuée à
AYENE, banlieue de Yaoundé) et d'une distillation
fractionnée, réalisée au lycée Technique
de Nkolbisson. La deuxième étape du travail a
consisté à effectuer les analyses chimico-physiques du
bioéthanol élaboré. Par la méthode
pycnométrique nous avons déterminé sa masse
volumique et en déduit son degré d'alcool. La
réfractométrie nous a permis de le caractériser
en évaluant son indice de réfraction. Nous avons ensuite
effectué des dilutions Ethanol-Essence tout en respectant les coupes en
vigueurs. La combustion des différentes coupes de carburant ainsi
obtenues dans un calorimètre à la bombe de type PARR,
nous a permis de déterminer la chaleur de combustion et le pouvoir
calorifique de chaque coupe ici réalisée.
Les princjaux résultats obtenus au cours de ce travail
nous montre que : le bioéthanol a un pouvoir calorifique important bien
qu'il soit inférieur à celui de l'essence et qu'il est miscible
à l'essence en toute proportion.
Ces résultats sont d'une importance capitale pour le
développement de la science en général et celui de
l'industrie de la mécanique automobile en particulier, parce qu'ils
montrent que le bioéthanol issus du manioc est capable au même
titre que l'essence de faire fonctionner un moteur à combustion interne,
et réduire de deux tiers au moins le taux de CO2 à
l'échappement. La filière biocarburant peut générer
des recettes directes et indirectes. Il peut être source d'emploie dans
les régions de production et même <<booster>>
l'agriculture camerounaise sur laquelle repose notre économie.
Le bioéthanol ici élaboré, pourra
alimenter les véhicules classiques dilué à hauteur de 05
à 20% dans de l'essence super sans plomb et à 100% dans les
moteurs modifiés de type <<flex-fuel >>
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
ABSTRACT
Price of oil, energizing dependence, air pollution, arable
space valorization, biofuels appear today like a believable answer
facing these problems. Indeed, the fossil fuels demonstrated their limits
through the problems that they made born until now. This work is destined to
fetch cassava (Manihot Esculenta Grantz), bioethanol alcohol
and make a plant fuel for internal combustion engines (as additive or surrogate
gas).
Considering that the combustion of the ethanol alcohol in
presence of the oxygen is an exothermic reaction, we have been brought to use
this energy to make operate the internal combustion engines. To arrive there,
it was first of all questions, to extract the starch of cassava. The method we
used is fermentation of Brazilian arrowroot followed by a primary distillation
(done at AYENE, a suburb of Yaoundé) follwed by a fractional
distillation, achieved at the Technical high school of Nkolbisson. The
second stage of work consisted to do the chemical analyses and calorimetric of
the elaborate bioethanol. By the pychnométric method we
determined its density and deducted its alcoholic degree. The
refractométry permitted us to characterize this bioethanol
while valuing its refractive index. We did Ethanol - Gas dilutions then
while respecting the cuts in vigor. The combustion of the different cuts of
fuel thus gotten in a calorimeter PARR type, permitted us to determine
the combustion heat as well as the heating value of every cut here realized.
The main results gotten during this work shows us that: the
bioéthanol has an important heating value well that it is lower
than the one of gas and that, it is miscible to gas in all proportion. These
results have in general a fundamental importance for the development of the
science and the one of the industry of the automotive mechanics in particular,
because they show that the bioéthanol descended of cassava is
capable for the same reason as gas to make operate an internal combustion
engine, and to reduce two third party at least the rate of CO2 the exhaust.
Path biofuel can generate some returns direct and indirect through the
development economic of our country Cameroon. it can be source of uses in the
regions of production and same booster the Cameroonian agriculture on which
rests our economy.
The bioethanol alcohol here made will be able to
nourish the vehicles classic to dilute from height of 05 to 15% in the terrific
gas without lead and at 100% in the motors modified of «flex -
fuel-oil» type.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
SOMMAIRE
Résumé..........................................................................................................v
Abstract......................................................................................................
..iv Listedes
figures..............................................................................................xii
Listedes
tableaux...........................................................................................xiv
Liste des sigles et
abréviations...........................................................................xvi
Cahierde
charges...........................................................................................xvii
Introduction....................................................................................................1
PARTIE I : LES COMBUSTIBLES AUTOMOBILES ET LEURS
MATIERESPREMIERES.............................................................................3
CHAPITRE I : GENERALITES SUR LES
CARBURANTS.......................................4
I.1
Définition...................................................................................................4
I.2 Critères de performance d'un
carburant................................................................4
I.3 Classification des
carburants.............................................................................5
I.4 Etude des carburants
fossiles.............................................................................5
I.4.1 Pétrole
brut................................................................................................5
I.4.2 Les types de carburants
fossiles........................................................................5
I.4.2.1 Le
kérosène.............................................................................................5
I.4.2.2 Le
gasoil................................................................................................6
I.4.2.3 Les essences...
.........................................................................................6
I.4.2.3.1 Types d'essence...
..................................................................................7
I.4.3 Impact environnemental des carburants
fossiles.....................................................7 I.4.3.1
Exploitation pétrolière et
pollution..................................................................7
I.4.3.2 Les éléments polluants des gaz
d'échappement...................................................8
I.4.3.3 Combustion des carburants fossiles et réchauffement
climatique..............................9
I.5 Etude des
biocarburants.................................................................................10
I.5.1
La
biomasse.............................................................................................11
I.5.2 Présentation des biocarburants......
..................................................................11
I.5.2.1 Le biodiesel...
........................................................................................12
I.5.2.1.1 Méthode de production du
biodiesel.............................................................13
I.5.2.1.2 Statistique de production du biodiesel dans le
monde........................................14 I.5.2.2 Le
bioéthanol.........................................................................................14
I.5.2.2.1 Les
alcools..........................................................................................15
I.5.2.2.2 Techniques de production de
l'éthanol.........................................................16
I.5.2.2.3 Statistiques de production du bioéthanol dans le
monde.....................................21 I.5.2.3 Les Estéroles...
.......................................................................................21
I.5.3 Valeur énergétique des
biocarburants...............................................................22
I.5.4 Les atouts des
biocarburants..........................................................................22
CHAPITRE II : GENERALITES SUR LE
MANIOC...............................................25
II.1 Origine et diffusion du
manioc........................................................................25
II.2 Les variétés de
manioc..............................................................................
...25
II.3 Caractéristiques morphologique du
manioc.........................................................26
II.4 Ecologie du
manioc.....................................................................................26
II.5 Répartition géographique du manioc au
Cameroun................................................27
II.6 Les utilités du
manioc...................................................................................28
II.7 Facteurs non nutritionnels du
manioc.................................................................31
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
II.8 La récolte, la post-récolte et la
qualité des
produits................................................31
II.9 Etat actuel de production mondiale du
manioc......................................................31
II.10 L'amidon de
manioc...................................................................................32
PARTIE II: ELABORATION ET ANALYSE DU BIOCARBURANT
FAIT
À BASE DE
MANIOC................................................................................33
CHAPITRE III : MATERIELS ET METHODES D'ELABORATION DU BIO
CARBURANT...............................................................................................34
III.1 Présentation des sites de
travail.......................................................................34
III.2 Matériels
utilisés.......................................................................................35
III.2.1 Matériel
végétal......................................................................................35
III.2.2 Matériel et appareillage de production du bio
éthanol.........................................35 III.2.2.1
Matériel de récolte et parage du
manioc........................................................35 III.2.2.2
Matériel d'extraction et de conditionnement de
l'amidon....................................36 III.2.2.3 Matériel de
fermentation
.........................................................................37
III.2.2.4 Matériel de distillation simple primaire
........................................................37 III.2.2.5
Appareillages de distillation
fractionnée........................................................38
III.2.2.6 Appareillage de caractérisation
chimico-calorifique..........................................40
A. Appareil de détermination de la masse
volumique.............................................40
B. Matériel de dilution
.................................................................................42
C. Matériel de
réfractomètrie...........................................................................43
D. Matériel de
calorimétrie............................................................................45
E. Matériel d'étalonnage de la
sonde.................................................................46
F. Matériel de calibrage du
calorimètre..............................................................46
III.3 Méthodes
opératoires..................................................................................47
III.3.1 Mode opératoire d'élaboration du
bioéthanol....................................................47
III.3.1.1 Méthode de récolte et de parage du
manioc....................................................47
|
|
III.3.1.2 Méthode d'extraction de
l'amidon..............................................................
|
.48
|
|
III.3.1.3 Méthode de fermentation du jus
d'amidon.....................................................
|
50
|
|
III.3.1.4 La distillation simple ou
primaire...............................................................
|
52
|
|
III.3.1.4.1 Mode opératoire de la distillation
simple.....................................................
|
53
|
|
III.3.1.5 La rectification par distillation
fractionnée.....................................................
|
53
|
|
III.3.1.5.1 But de la rectification
fractionnée.............................................................
|
53
|
|
III.3.1.5.2 Principe de la distillation
fractionnée.........................................................
|
53
|
|
III.3.1.5.3 Mode opératoire de la distillation
fractionnée................................................
|
54
|
|
III.3.1.5.4 Autres types de
distillations....................................................................
|
57
|
|
III.3.2 Mode opératoire de la caractérisation
chimico-calorifique de la distillation.................
|
57
|
|
III.3.2.1 Présentation du
distillat...........................................................................
|
57
|
|
III.3.2.2 Détermination de la masse volumique et
déduction du degré alcoolique du distillat.....
|
57
|
|
III.3.2.2.1 Etalonnage du
pycnomètre.....................................................................
|
.58
|
|
III.3.2.2.2 Détermination de la masse volumique du bio
éthanol......................................
|
59
|
|
III.3.2.2.3 Détermination de la composition vraie par
interpolation..................................
|
.60
|
|
III.3.3 Elaboration des coupes de
biocarburants.........................................................
|
61
|
|
III.3.3.1 Miscibilité de l'éthanol avec
l'essence.........................................................
|
.61
|
|
III.3.3.2 Principe de la
dilution............................................................................
|
.61
|
|
III.3.3.3 Mode opératoire des
dilutions...................................................................
|
.62
|
|
III.3.3.3.1 Détermination des volumes de carburants dans
les coupes................................
|
.62
|
|
III.3.4 Etude réfractométrique des
coupes...............................................................
|
.63
|
|
III.3.4.1 Présentation de la
refractomètrie................................................................
|
.64
|
|
III.3.4.2 Définition de l'indice de
réfraction.............................................................
|
.64
|
|
III.3.4.3 Principe de la
refractomètrie.....................................................................
|
64
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
III.3.4.4 Méthodes de correction de l'indice de
réfraction..............................................65 III.3.4.5
Etalonnage du
réfractomètre.....................................................................65
III.3.4.6 Exemple de mesure de l'indice de réfraction de la coupe E100
............................66 III.3.4.6.1 Mode opératoire de la
mesure..................................................................66
III.3.5 Détermination des chaleurs de combustion et du pouvoir
calorifique des coupes de
carburants......................................................................................................67
III.3.5.1 Origine de la chaleur de combustion dans les
carburants....................................67 III.3.5.2 La
calorimétrie.....................................................................................68
III.3.5.3 La chaleur de combustion ou valeur
calorifique...............................................68 III.3.5.4
Capacité calorique ou chaleur
équivalente.....................................................68
III.3.5.5 Principe de mesure des chaleurs de combustion par calorimètre
à la bombe..............69 III.3.5.6 Paramètres de
détermination des chaleurs de
combustion...................................70 III.3.5.7 Etalonnage de la
soude............................................................................71
III.3.5.8 Calibrage du
calorimètre..........................................................................73
III.3.5.9 Détermination de la capacité calorifique de la bombe
calorimétrique......................76 III.3.5.10 Détermination
des chaleurs de combustion des différentes coupes de carburants.......78
III.3.5.10.1 Exemple de calcul de la chaleur de combustion de la coupe
E100......................79 III.3.6 Détermination du point
éclair du bio
éthanol.....................................................82
CHAPITRE IV : PRESENTATION ET INTERPRETATION DES RESULTATS
.........83
IV.1 Résultats de la récolte et du
parage..................................................................83
IV-1-2 Interprétation des résultats de la cueillette et du parage
du manioc...........................83 IV.1.1 Justification du choix
variétal......................................................................83
IV-1-2 Interprétation des résultats de la cueillette et du parage
du manioc...........................84
IV.2 Résultats de la fermentation et de la distillation
primaire.........................................84 IV.2-1 Difficultés
liées au processus de
fermentation..................................................84
IV.3 Résultats de la distillation
fractionnée...............................................................85
IV.3.1 Analyses et
commentaires..........................................................................85.
IV.4 Résultats de la
pycnometrie...........................................................................86
IV.4.1
Analyse des résultats de la
pycnometrie..........................................................88
IV.5 Dilution de l'éthanol (96.33
%vol.)..................................................................88
IV.5.1
Interprétation des données de dilution des coupes de
carburants..............................88
IV.6 Résultats de la refractromètrie des coupes de
biocarburant.......................................89 IV.6.1
Interprétation des résultats de la
réfractomètrie..................................................90
|
IV.7 Résultats calorimétriques des coupes de
carburants..............................................
|
.90
|
|
IV.7.1 Analyse des résultats de la calorimétrie
à la bombe..........................................
|
.107
|
|
IV.8 Point éclair du
bioéthanol...........................................................................
|
.107
|
|
CHAPITRE V : SUGGESTIONS ET
PERSPECTIVES.........................................
|
.109
|
|
V.1 Atouts du Cameroun en matière de production des
biocarburants..............................
|
109
|
|
V.2 Suggestions adressées aux pouvoirs
publics......................................................
|
.109
|
|
V.3 Impact environnemental des biocarburants au
Cameroun.......................................
|
110
|
|
V.4 Biocarburant et développement de l'économie du
Cameroun..................................
|
.110
|
|
V.4.1 Le secteur
agricole..................................................................................
|
.110
|
|
V.4.2 L'emplois
...........................................................................................
|
.111
|
|
V.4.3 Indépendance
énergétique.........................................................................
|
.111
|
|
V.5 Dilemme énergie contre sécurité
alimentaire......................................................
|
111
|
|
CONCLUSION
GENERALE..........................................................................
|
.112
|
|
REFERENCES
BIBLIOGRAPHIQUES............................................................
|
.113
|
|
ANNEXES.................................................................................................
|
.115
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

LISTE DES FIGURES
- Figure 1-1 : Schéma synoptique de
l'effet de serre
- Figure 1-2 :protocole de production des
biocarburants
- Figure 1-3 : Etapes d'élaboration d'un
biodiesel
- Figure 1-4 : Volume de production d'EMHV dans
le monde
- Figure 1-5 : Structure de la biomasse
lignocellulosique
- Figure 1-6 : Principe d'élaboration du
bioéthanol
- Figure 1-7 : Volume de production des
bioéthanol dans le monde
- Figure 1-8 : Bilan comparatif des
émissions de CO2 entre biocarburant et carburant traditionnels
- Figure 1-9 : Autre recyclage du CO2 par les
biocarburant
- Figure 2-1 : Les tubercules de manioc
(Manihot Esculenta Grantz)
- Figure 2-2 : Tubercule de manioc -
Figure 2-3 : Cossette de manioc
- Figure 2-4 : Fufu
- Figure 2-5 : Mitumba
- Figure 2-6 : Water fufu
- Figure 2-7 : Clips de manioc - Figure
2-8 : Myondo
- Figure 2-9 : Bobolo
- Figure 2-10 : Variété culinaire
du manioc
- Figure 3-1 : Une vue du bâtiment
administratif du lycée technique de Nkolbisson
- Figure 3-2 : Tubercule de manioc
- Figure 3-3 : Dispositif de distillation
fractionnée
- Figure 3-4 : Tour de distillation
fractionnée
- Figure 3-5 : Les pycnomètres
- Figure 3-6: Balance et hand book -
Figure 3-7 : Four électrique
- Figure 3-8 : La hotte chimique
- Figure 3-9 : Réfractomètre ABBE
ATAGO modèle 302
- Figure 3-10 : Rouleau de fil d'amorce
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
- Figure 3-11 : Calorimètre à la
bombe - Figure 3-12 : Récolte de manioc
- Figure 3-13 : Les grains d'amidon vu au
microscope
- Figure 3-14 : Colonie de levures en
microscopie optique
- Figure 3-15 : Une levure en microscopie
électronique à transmission
- Figure 3-16 : Préparation du
mélange et fermentation - Figure 3-17 : Premier passage
de distillation
- Figure 3-18 : Deuxime passage de distillation
- Figure 3-19 : Ebullition de flegme
- Figure 3-20 : La pompe à eau
- Figure 3-21 : Prélèvement des
têtes de distillation - Figure 3-22 : Thermomètre
sur colonne
- Figure 3-23 : Réfraction d'un faisceau
lumineux à la surface d'un liquide
- Figure 3-24 : Champ visuel de l'oculaire
pendant une mesure
- Figure 3-25 : Mesure
réfractomètrique - Figure 3-26 : Fixation de fil
d'amorce - Figure 3-27 : Porte échantillon
- Figure 3-28 : Vue de l'intérieur de la
bombe - Figure 3-29 : Bombe à oxygène
chargé
- Figure 3-30 : Fermeture du
calorimètre
- Figure 3-31 : Vue de l'intérieur du
calorimètre
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
LISTE DES TABLEAUX
- Tableau 1 - 1 : Taux indicatif des polluants
liés à l'exploitation d'une automobile
- Tableau 1 - 2 : Dilution de quelques
alcools dans l'eau - Tableau 2 - 1 : Princjaux produits
dérivés du manioc - Tableau 2 - 2 : Princjaux
pays producteur de manioc - Tableau 3 - 1 : Ingrédients
pour fermentation
- Tableau 3 - 2 : Résultat de la
pycnometrie, étalonnage du pycnomètre
- Tableau 3 - 3 : Mesure des paramètres
initiaux
- Tableau 3 - 4 : Evolution de la
température de combustion de l'acide benzoïque
- Tableau 3- 5 : Récapitulation des
données essentielles à retenir
- Tableau 3 - 6 : Mesure des paramètres
initiaux pour les coupes E100
- Tableau 3 - 7 : Evolution des
températures de la combustion du E100
- Tableau 4 - 1 : Résultat de
l'étalonnage du pycnomètre - Tableau 4 - 2 :
Données des résultats pycnomètriques -
Tableau 4 - 3: Résultat des dilutions
- Tableau 4 - 4: Résultat des valeurs des
indices de réfraction des coupes de carburants
- Tableau 4 - 5 : Résultat du dosage de
la soude
- Tableau 4 - 6 : Résultats du calibrage
du colorimètre
- Tableau 4 - 7 : Résultats
récapitulatifs ; données essentielles du calibrage du
calorimètre
- Tableau 4 - 8 : Résultat de la
combustion de la coupe E10
- Tableau 4 - 9 : Evolution de la
température de la coupe E100 - Tableau 4 - 10 :
Résultats
- Tableau 4 - 11 : Evolution des
températures de la combustion du E95
- Tableau 4 - 12 : Résultat de la
combustion du E85
- Tableau 4 - 13 : Evolution des
températures de la combustion du E 85
- Tableau 4 - 14 : Résultat de la
combustion du E20
- Tableau 4 - 15 : Evolution des
températures de la combustion du E20
- Tableau 4 - 16 : Résultat de la
combustion du E15
- Tableau 4 - 17 : Evolution de la
température de la combustion coupe E15
- Tableau 4 - 18 : Résultat de la
combustion du E10
- Tableau 4 - 19 : Evolution des
températures de la combustion de la coupe E10 - Tableau 4 - 20 :
Température d'ébullition de quelques carburants
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
SIGLES ET ABREVIATIONS
ETBE: Ethyl Tertio Butyl Ether
J-C: Jesus Christ
GIBC: Groupe intergouvernemental sur
l'évolution du climat
Av.: avant
GES: Gaz à Effet de Serre
HCN : Acide Cyanhydrique
HC : Hydrocarbure
EMHV : Ethyl Méthyl d'Huile
Végétale Fac.: Faculté
ONG : Organisation Non Gouvernementale
GIC : groupe d'initiative commune
ETA: Ecole des Techniques de l'agriculture
CRA : Centre de Recherche Agricole
USA: United State of America
PNVRA : Programme Nationale de Vulgarisation et
de Recherche Agricole
PNDRT : Programme Nationale de
Développement des Racines et Tubercules
IRAD : Institue de Recherche Agricole et de
développement
Cf.: Confère
DIPET : Diplôme de Professeur
d'Enseignement Technique
MA : Mécanique Automobile
C6H5COOH : acide benzoïque
HNO3: formule chimique de l'acide nitrique
L : longueur [m]
WCAL : capacité calorifique du
calorimètre à la bombe avant correction [cal.
°C-1]
m1 : masse d'eau utilisée au calibrage du
calorimètre [kg]
m2 : masse d'eau utilisée pendant la
mesure calorifique d'un échantillon [kg]
W' : capacité calorifique du
calorimètre à la bombe après correction [cal.
°C-1]
Técl : température éclaire
[°C]
Ce : chaleur massique de l'eau [Ce =
1J.k-1.kg-1]
K : constante évaluée à
0.736 (calcul du point éclair d'un carburant)
nD t : indice de réfraction
« Essai d'elaboration et analyse chimico-calorifiaue
d'un biocarburant a base de manioc » Mémoire DIPET II -- ENSET de
Douala 2007
% : pourcentage
m :masse [kg]
t : temps [s]
V : volume [l]
°C : degré Celsius
°K : degré kelvin
Cal. : Calorimetre
Kg : kilogramme
Cm : centimetre
J : joule
ml : millilitre
g : gramme
s : seconde
l : litre
eeb : température
d'ébullition [°C]
Q : chaleur de combustion [kJ] ou
[cal]
P : pouvoir calorifique
[kJ.k.kg-1]
NaOH : formule chimique de la soude
Tab : température
d'ébullition [°C]
mp, : masse du pycnometre vide
[kg]
Peau: masse volumique de l'eau
[kg.l-1]
AO : différence de
température [°C]
Oi : température initiale
[°C]
Of: température finale
[°C]
ti : temps initial [s]
tf : temps final [s]
ft : autre indication de la capacité
calorifique du calorimetre E100 : carburant composé de
100% d'éthanol
E10 : carburant composé de 10%
éthanol et 90% d'essence E15 : carburant composé
de 15% éthanol et 85% d'essence E20 : carburant
composé de 20% éthanol et 80% d'essence E85 :
carburant composé de 85% éthanol et 15% d'essence E95
: carburant composé de 95% éthanol et 5% d'essence
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
CAHIER DE CHARGES
1- DESCRIPTION SOMMAIRE
1-1 NOM DU PRODUIT : Bioéthanol
1-2 FONCTION DU PRODUIT : Carburant des moteurs
A combustion interne 1-3 ASPECT PHYSIQUE : liquide claire
d'odeur piquante.
1-4 CARACTERISTIQUE : inflammable
2- CONTRAINTE D'ELABORATION
2-1 MATIERE PREMIÈRE : amidon de manioc
de type Manihot Esculenta Grantz 2-2 SITES D'ELABORATION
: Lycée Technique de Nkolbisson ; Ayene-Yaounde
3- CONTRAINTE QUANTITATIF : L e
bioéthanol produit doit pouvoir être produit A grande
échelle.
4- CONTRAINTES STRUCTURELLES
o Le degré alcoolique doit être supérieur ou
égale A 95%vol. o Le pouvoir calorifique doit avoisiner 21.3
MJ.l-1
5- CONTRAINTES FONCTIONNELLES
5-1 COMPATIBILITE AVEC L'ESSENCE : le
bioéthanol doit être miscible A l'essence en toute proportion.
5-2 CRITERES DE PERFORMANCES: la combustion du
bioéthanol doit fournir une énergie calorifique susceptible de
faire fonctionner un moteur A combustion interne.
6- UTILISATION :
o moteur A combustion interne usuelle 5% bioéthanol et
95% essence ;
o moteurs A combustion interne modifier 100% éthanol.
7- CONTRAINTE ECONOMIQUE :
n son prix sur le marché doit être abordable sur le
marché des carburants
n le produit doit être accessible A tous et en toute
saison
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
INTRODUCTION
La consommation des carburants fossile est insupportable :
Elle est responsable de l'augmentation rapide du réchauffement
climatique planétaire qui a atteint des niveaux extrêmement
dangereux et qui sont pratiquement irréversibles. De plus, les pays du
sud en général et le Cameroun en particulier se trouvent sous
l'emprise des véhicules dits << d'occasion », responsables de
l'une des plus grandes pollutions de nos cités. On assiste aujourd'hui
dans le monde à une grave crise énergétique responsable de
l'instabilité des cours du pétrole et même, << des
guerres dites du pétrole ».
Face à cet état des choses, les Etats Unis
d'Amérique ont poursuivi les recherches entamées par J. Ford vers
1900 pour l'utilisation de l'éthanol comme carburant automobile. En
rapport avec certains critères climatiques et techniques, le maïs
comme matière première a donné des résultats
très prometteurs. Les Brésiliens, pour utiliser l'excédent
de production de la canne à sucre, en ont produit avec des
résultats au dessus des attentes. La France en ce qui la concerne, a
opté pour le blé et la betterave sucrière comme
matière première, avec des résultats très
encourageant. La méthode commune à ces différents pays a
été la fermentation puis la distillation des plantes
amylacées et sucrières. Dans cette recherche
effrénée des sources d'énergie de moins en moins
polluantes, plusieurs chercheurs ont mis au point des méthodes de
production de l'éthanol, telles que : L'hydratation des alcènes
(l'éthène) ; l'estérification de l'éthylène
par l'acide sulfurique suivie d'une réaction d'hydrolyse ; l'hydrolyse
de la biomasse lignocellulosique suivie par sa distillation fractionnée.
La revue de la littérature a ainsi révélé plusieurs
auteurs ayant intervenus dans ce domaine : ROBERT
[11] ; ROBERTS [12];
ASADJEU [16] ; PROSKOURIAKOU
[2]. De tous ces travaux, il ressort que la méthode
par estérification de l'éthylène est très corrosive
pour l'appareillage d'élaboration. Celle de l'hydratation des
alcènes détient le meilleur rendement en matière de
quantité produit mais reste étroitement lié au
pétrole, donc impropre pour l'environnement. L'hydrolyse et la
distillation de la biomasse lignocellulosique quant à elle est une
technique complexe qui reste à parfaire. Seule la méthode par
fermentation des plantes amylacées et sucrières a donc retenu
notre attention. Ne disposant ni de betterave sucrière ni de blé
en quantité industrielle au Cameron, nous avons orienté notre
choix vers le manioc comme matière première en raison de touts
les avantages qu'il offre.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Nous souhaitons, à travers ce mémoire
démontrer que l'éthanol à base d'amidon de manioc, est
à même de faire fonctionner un moteur à combustion interne
à travers une analyse chimique et calorimétrique. Pour se faire,
il nous est demandé l'utilisation d'une méthodologie
cohérente.
Pour mener à bien notre étude, La consultation
des personnes ressources telles que les chimistes et les agronomes sera une
nécessité. Le rapprochement vers les entreprises telles que :
Brasserie du Cameroun ; HYDRAC ; IRAD ; SONARA, aura son importance. La
réalisation du bioéthanol se fera au Lycée Technique de
Nkolbisson. Les résultats théoriques seront
vérifiés pratiquement par l'intermédiaire d'un
appareillage moderne et conforme aux normes de contrôle de qualité
en vigueur dans les industries pétrochimiques. Ce travail de recherche
scientifique est destiné aux chercheurs en pétrochimie et aux
thermiciens qui pourront exploiter les résultas obtenus ici comme
élément de comparaison. Il est aussi destiné à la
communauté Universitaire comme référence bibliographique
dans l'étude des biocarburants. En fin il s'adresse aux politiques
camerounais pour qu'ils mettent en oeuvre un cadre juridico-économique
propice à l'émergence et au développement de la
filière biocarburant.
Pour mieux comprendre cette approche des choses, notre travail
consistera d'abord à situer le lecteur dans le contexte des carburants
automobile à travers leurs corollaires environnementaux au chapitre 1.
Le chapitre 2 présentera les généralités sur la
matière première, par nous utilisée. Le chapitre 3 quant
à lui présentera le matériel utilisé ainsi que Les
méthodes d'élaboration et d'analyse chimico-calorifique du
bioéthanol. La présentation et l'interprétation des
résultats suivront au chapitre 4. Nous parachèverons notre
étude par quelques suggestions utiles au chapitre 5.
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
PARTIE I:
THEORIE DES CARBURANTS ET LEURS
MATIÈRES
PREMIÈRES
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
CHAPITRE I : GENERALITES SUR LES
CARBURANTS D'AUTOMOBILES
INTRODUCTION
Pour fonctionner le moteur thermique a besoin d'un carburant
donc la combustion avec l'air ambiant lui permettra de transformer
l'énergie thermique y résultant en énergie
mécanique nécessaire au déplacement du véhicule.
Hier encore les carburants les plus utilisés étaient ceux
dérivés du pétrole brut. Aujourd'hui, il est important de
signaler le net essor de la biomasse en générale et des
biocarburants en particulier avec les nombreuses applications faites par : le
Brésil et la canne à sucre ; les Etats-Unis d'Amérique
avec le maïs ; le Canada et l'huile de tournesol ; et la France avec la
betterave sucrière. Il sera question dans cette partie de notre
étude de faire une étude critique des carburants
pétroliers et de ressortir les avantages liés à l'essor
des nouvelles sources d'énergie.
I-1 DEFINITION D'UN CARBURANT
Un carburant est une substance dont la combustion fournit
l'énergie nécessaire au fonctionnement des moteurs thermiques
(moteur à allumage commandé, moteur diesel, moteur d'avion)
I-2 CRITERE DE PERFORMANCE D'UN CARBURANT
Plusieurs auteurs tels que : TALOR. [1] et
PROSKOURIAKOU [2] ont définit les critères de
performance des carburants. On peut citer entre autres :
a) La volatilité ;
b) Caractéristiques antidétonantes et
autoallumage;
c) La chaleur de combustion par unité de masse et de
volume ;
d) Température d'évaporation ;
e) Stabilité chimique, neutralité et pureté
;
f) La sécurité ;
g) Le coût et l'accessibilité.
Un autre critère est aujourd'hui d'actualité c'est
la propreté du point de vue environnemental. Tous ces critères
permettent au carburant de mieux s'adapter à
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
l'environnement rude, rigoureux du moteur thermique pour le
quel il est destiné et de mieux
répondre aux diverses
sollicitations de la carburation en ce qui concerne exclusivement l'essence.
I-3 CLASSIFICATION DES CARBURANTS Il existe deux
grandes familles de carburant:
> Les carburants d'origine fossile qui sont des distillats du
pétrole brut (essence, gazole, kérosène) ;
> Les biocarburants ou carburants d'origine
végétale (biodiesel, bioéthanol).
I-4 ETUDE DES CARBURANTS FOSSILES
I-4-1 Le pétrole brut
+ Formation : Les carburants les plus connus et
les plus utilisés sont ceux qui dérivent du pétrole brut.
En effet, celui-ci est un produit du passé géologique d'une
région. Il est issu de la succession de trois circonstances plutôt
exceptionnelles à savoir : L'accumulation de matières organiques,
la maturation de la matière organique et le piégeage des
hydrocarbures dans le sous sol.
+ Composition: Un pétrole a une
composition qui dépend fortement de la matière organique de
départ et donc du brut considéré. Quelque soit sont
origine, le pétrole est essentiellement composé des hydrocarbures
suivant :
> Les alcanes : ce sont les produits majoritaires. Ils
représentent 50 à 98% d'un pétrole qui en plus peut
contenir plusieurs centaines de milliers de molécules différentes
;
> Les cyclanes ou hydrocarbures cycliques (18 à 54%)
;
> Les hydrocarbures aromatiques (7 à 55%) ;
> Les composés soufrés surtout le sulfure
d'hydrogène (1 à 5%) ;
> Les composés oxygénés tels que les
acides (1%) ;
> Les composés azotés.
I-4-2 Les types de carburants fossiles I-4-2-1 Le
Kérosène
Encore appelé carburéacteur, le
kérosène alimente les moteurs à réaction
équipant les avions. Il est en particulier caractérisé par
sa fluidité aux basses températures (de l'ordre de -
50°C) et sa capacité à conduire à une
combustion rayonnante, ce qui permet de limiter les
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
échanges de chaleur. Le kérosène a une
densité de l'ordre de 0,8 A 15°C. Il libère des
quantités impressionnantes de matières et particules polluantes
pour l'atmosphère et la haute atmosphère.
I-4-2-2 Le Gasoil
Le gazole est un distillat issu du raffinage du pétrole
brut, Il est aussi obtenu par craquage catalytique. Celui ci doit subir
plusieurs traitements complémentaires pour être utiliser comme
carburant dans les moteurs diesel, tel que l'hydrodésulfuration
destinée A le débarrasser du soufre (pas plus de 0.05%). La
densité du gazole est supérieure A celle de l'essence : 0,845
contre 0,775. On caractérise et différencie le plus souvent les
gazoles par leur indice de cétane et leur tenu A froid. De par leurs
spécificités structurelles et fonctionnelles, les moteurs diesel
polluent grandement l'atmosphère A travers l'émission A
l'échappement des hydrocarbures imbrûlés et du soufre.
I-4-2-3 Les Essences
Les essences sont des composés d'hydrocarbures issus de
la distillation fractionnée du pétrole brut dans les
distilleries. Leurs propriétés physicochimiques siées bien
A leurs utilisations comme carburant des moteurs A combustion interne. Dans ces
moteurs, l'explosion du mélange, essence et oxygène de l'air dans
les cylindres (déclenchée par l'étincelle d'une bougie)
produit l'énergie nécessaire au déplacement du
véhicule.
L'essence s'évapore entre la température
ambiante et 215°C sous pression atmosphérique. Sa
densité (liquide) est d'environ 0,775 soit bien inférieure A
celle de l'eau (1,000). La vapeur d'essence est trois fois plus lourde que
l'air.
L'essence est un mélange d'hydrocarbures auxquels sont
parfois ajoutés d'autres produits combustibles adjuvants. On y trouve en
moyenne :
- 20 A 30 % d'alcanes, hydrocarbures saturés ;
- 5 % de cycloalcanes, hydrocarbures saturés cycliques
;
- 30 A 45 % d'alcènes, hydrocarbures non saturés
;
- 30 A 45 % d'hydrocarbures aromatiques de la famille du
benzène ;
- Du plomb ou du potassium.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
On différencie et caractérise le plus souvent les
essences par leur volatilité et leur indice d'octane.
1) La Volatilité
C'est la capacité qu'a un produit liquide à
passer sous forme de vapeur. Un suivi strict de la volatilité de
l'essence est essentiel pour garantir un bon fonctionnement du moteur dans
toutes les conditions. La volatilité est trop faible, le moteur
démarre difficilement par temps froid. Si elle est trop
élevée, le moteur peut caler ou présenter des
difficultés de redémarrage par temps chaud.
2) L'Indice d'octane
L'obtention d'un rendement élevé dépend
de son taux de compression : l'essence doit résister aux hautes
pressions sans explosés très tôt (avant d'atteindre le
point mort haut). Elle doit donc avoir un caractère antidétonant
efficace. Le pouvoir antidétonant d'une essence est donc défini
par son indice d'octane encore noté I.O. Plus il est
élevé, meilleur il est et meilleur est le rendement du moteur ce
ci n'était vrai que vers les années 1920 année pendant
lesquelles certains additif au plomb [tétra méthyle de plomb Pb
(CH3)4 ou le tétra éthyle de plomb Pb (C2 H5)4] ont
prouvé leur efficacité. Depuis 1975, ces produits sont
très contestés dans la lutte contre la pollution.
GROSSETÊTE, [3].
I-4-2-3-1 Types d'essences
On distingue les essences en fonction de l'indice d'octane :
- L'essence sans plomb 95 (indice d'octane 95) ;
- l'essence sans plomb (indice - L 98) ;
- le super (indice 98, en voie de disparition). Il ne contient
plus de plomb mais du
potassium.
I-4-3 Impact environnemental des carburants fossiles
I-4-3-1 Exploitation pétrolière et pollution
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
L'extraction pétrolière n'est pas sans impact
sur l'écosystème, car elle entraîne des perturbations
géophysiques importantes (affaissement des sols eaux extraites du
gisement, boues de forage...) ;
Les fuites du pétrole pendant le transport et le stockage
entraînent généralement des catastrophes écologiques
irréversibles ;
certaines opérations de traitement, telles que le
raffinage, s'accompagnent du rejet dans l'environnement de composés
organiques gazeux et de liquides (phénols, produits ammoniacaux...).
I-4-3-2 Les éléments polluants des gaz
d'échappement
Les obligations d'améliorer continuellement les
performances des moteurs ont incité les constructeurs d'automobiles et
les raffineurs de pétrole à rechercher non seulement les
solutions mécaniques, mais aussi une formulation optimale des
carburants, sous la pression des organisations mondiales antipollution.
Malgré tous ces efforts les carburants automobiles d'origine fossile
continuent de polluer. En effet, suivant les études menées par
: NDJOCK BAYOCK [4] et EBENGUE NDJIMA [5] Il
en ressort que les véhicules automobiles sont des engins important de
pollution environnementale. Ils identifient dans leurs travaux respectifs les
principaux éléments polluants issus des gaz d'échappements
tout en précisant leurs incidences environnementales. On peut ainsi
citer :
- Les oxydes d'azote NOx qui peuvent se
mettre sous diverses formes dépendant des circonstances dans lesquelles
a lieu la combustion. Ils sont la cause de nombreuses maladies, participent
à la formation des pluies acides, de l'ozone stratosphérique et
ses corollaires sur l'environnement ;
- Le monoxyde de carbone CO, issus des
combustions incomplètes des matières organiques (carburants), il
affecte le système nerveux et respiratoire ;
- Les hydrocarbures imbrûlés HC,
provenant des mauvais facteurs de combustion, ils participent à la
formation de l'ozone stratosphérique, responsable du
réchauffement climatique ;
- Les métaux toxiques : plomb Pb
provenant de la combustion des produits additifs, ceux-ci s'accumulent
dans l'organisme et empêche le bon fonctionnement des organes et la mort
par intoxication ;
- Le gaz carbonique CO2. Il est l'un des gaz
qui participent le plus à la destruction de la couche d'ozone donc la
conséquence est l'intensification de l'effet de serre ayant pour
corollaire
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
direct le réchauffement climatique. Le tableau ci-dessous
illustre le taux indicatif des divers polluants issus des automobiles.
Tableau 1-1 : Taux indicatif des polluants liés
à l'exploitation d'une automobile [3]
Eléments polluants
|
Valeur à l'échappement (en %)
|
dioxydes d'azotes NO2
|
40 à 50
|
Monoxyde de carbone CO
|
60 à 70
|
Hydrocarbures imbrûlés HC
|
30
|
Plomb PB
|
90
|
Dioxyde de carbone CO2
|
15
|
Dioxydes de soufre SO2
|
5
|
|
I-4-3-3 Combustion des carburants fossiles et
réchauffement climatique
Il est prouvé que la combustion des carburants
d'origine fossile est responsable de l'émission des gaz à effet
de serre source du réchauffement climatique. En effet d'après des
études menées par le GIBC (Groupe
intergouvernemental sur l'évolution du climat), le secteur des
transports automobiles est responsable à 30% des émission de CO2
(principal gaz à effet de serre). Les études
paléoclimatologies par lui mener, ont mis en évidence une
relation directe entre la teneur en CO2 atmosphérique relevée au
cours des 150000 dernières années et les fluctuations
climatiques. Il en ressort que le CO2 est responsable à lui tout seul de
55% de l'effet de serre, phénomène illustré par la
figure 1-1. Si des mesures drastiques ne sont pas mises en
oeuvre, on peut ainsi craindre que la hausse de la teneur en gaz carbonique
atmosphérique ne provoque dans les prochaines décennies une
augmentation des températures globales, ce qui ne serait pas sans
conséquence sur l'épanouissement de la vie sur terre.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
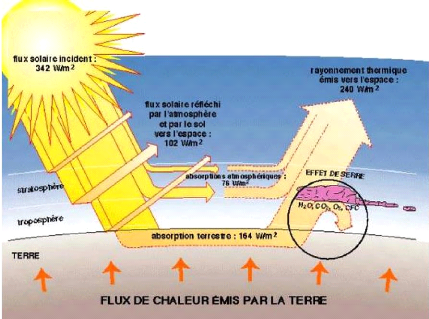
Figure 1-1 : schéma synoptique de l'effet de
serre [13]
Malgré la bonne gestion et la modernisation des
systèmes d'alimentation en essence (injection d'essence); le recyclage
des gaz d'échappement et autres... Il n'en demeure pas moins que
l'automobile est un pollueur potentiel, bien que ces mesures aient
considérablement diminuées son taux de pollution. Pour y
remédier, des solutions ont été préconisés
telle que l'addition à l'essence du
méthyltertiobutyléther, pas forcement exempt
d'inconvénients. L'une des solutions aujourd'hui envisagé et qui
offre des avantages encourageants est l'addition aux essences de
l'éthyltertiobutyléther, un produit dérivé du
bioéthanol. Produit qui démontre son efficacité à
remédier au déficit d'indice d'octane dans les carburants sans
plomb ainsi que la réduction du taux d'émission du CO2. Une fois
de plus la solution miracle est venue de la biomasse sous le label des
biocarburants.
I-5 ETUDE DES BIOCARBURANTS
Face à une prise de conscience devant les dangers que
présente les gaz à effet de serre émanant de la combustion
des carburants fossiles, eu égard à un prix du pétrole qui
ne cesse d'augmenter, avec en ligne de mire l'appauvrissement des
réserves, le développement de la
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
filière biocarburant semble prometteur. Plusieurs pays
tels que : le Brésil les USA, la France et la Suède s'y sont
lancés avec beaucoup de succès, tout simplement en utilisant la
« biomasse ».
I-5-1 La Biomasse
Ce terme désigne l'ensemble des sources
d'énergie renouvelable (biologiques) c'est-à-dire celles dont
l'exploitation présentent un risque mineur pour l'environnement
(éolienne ; biogaz ; énergie géothermale ; énergie
solaire ; biocarburants).
I-5-2 Présentation des biocarburants
En lieu et place du terme « biocarburant
», on devrait utiliser le terme « carburant
d'origine végétale ». En effet les
biocarburants sont des carburants obtenus à partir de la biomasse
végétale (d'oil leur surnom de carburant vert). Ils
possèdent des propriétés proches de celles de certains
dérivés du pétrole et peuvent parfois s'employer
directement dans des moteurs diesels ou des moteurs à essences. Ils
peuvent se substituer partiellement ou totalement aux carburants
pétroliers.
La figure 1-2 nous donne une vue synoptique du
protocole de production des biocarburants.
Il existe aujourd'hui deux grands types de biocarburants :
- les biodiesels (EMHV)1 destinés au
moteur diesel ;
- les essences biologiques (bioéthanol)
destinés au moteur à essence.
1Ethyl Methyl d'Huile Végétale
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Figure 1-2 : Protocole de production des biocarburants
[19] I-5-2-1 Le Biodiesel
Destiné au moteur diesel, ce biocarburant est produit
à partir des plantes oléagineuses, c'est-à-dire des
plantes pouvant fournir de l'huile végétale. (Colza, tournesol,
palmier à huile, coton). Cette huile n'est pas utilisée pure car
elle n'est pas compatible avec les moteurs diesels actuels. Elle subit donc une
transformation chimique (transestérifications) qui
permet d'obtenir un ester méthylique ou éthylique d'huile
végétale (diester) dont les propriétés sont proches
de celles des gazoles. L'EMHV peut être utilisé pur ou en
mélange avec le gazole. L'utilisation pure de l'EMHV nécessite
des adaptations du véhicule, ce qui limite sa diffusion. Aujourd'hui,
l'EMHV est incorporé au gazole dans le moteur diesel à une
proportion allant de 5 à 30%.
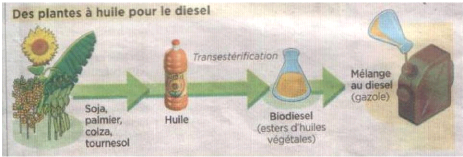
Figure 1-3: Etapes d'élaboration d'un
biodiesel [26]
- 26 -
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
I-5-2-1-1 Méthodes de production du biodiesel
Deux moyens permettent d'obtenir les biodiesels :
a) Voie chimique : on obtient les biodiesels
en estérifiant doublement les plantes oléagineuses. Le produit
final est une huile purifiée Cf. figure 1-3 qu'on nomme
Diester. Ses caractéristiques
énergétiques sont proches du gasoil, en plus sa combustion est
plus propre exemple :
- Le reformage catalytique : C'est une
méthode qui a longuement été étudiée par des
chercheurs tels que: BARTHELEMIE [7] et DIKONGUE [8]. Ceux-ci
ont étudié la transformation de l'huile de palme ainsi que celle
des palmistes comme carburant respectivement par reformage catalytique. Il en
ressort de cette étude que les acides gras et les glycérols de
ces différentes huiles peuvent être estérifiés
produisant ainsi des esters et de l'eau. Ceux ci sont ensuite traités
pour devenir des carburants utilisés dans les moteurs diesel.
b) Voie thermochimique :
-La Méthode Fischer TROPSCH.
C'est la voie chaude, les huiles naturelles sont gazefiées
(en les chauffant à 1300 °C) il se dégage alors
un « gaz de synthèse » formé de gaz carbonique et de
vapeur d'eau, d'oxyde de carbone et d'hydrogène. Ces deux corps sont
très réactifs. Par la synthèse contrôlée en
présence des catalyseurs bien choisis et en fonction de la
température on obtient un carburant liquide sous forme de biodiesel.
[6]
-La méthode thermique : Cette
méthode consiste à chauffer les fruits de certaines plantes
oléagineuses (soja, palmiste, colza, noix de palme, tournesol...), et
d'en extraire l'huile par pressage. L'huile obtenue est ensuite filtrée.
Elle peut être utilisée comme carburant des moteurs diesels par
addition dans le gasoil ou directement dans les moteurs diesel modifiés
(pour l'adaptation).
Critiques
Ces méthodes de transformations des produits
oléagineux en carburant nécessitent un appareillage
spécialisé et une technologie très avancée, Par
conséquent ils ne peuvent pas être appliquer dans les pays sous
développés, sans l'appuis extérieur. Néanmoins il
est envisagé, l'utilisation directe des huiles végétales
à la place du gasoil, mais il va falloir modifiés les
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
moteurs existants pour permettre leur bon fonctionnement. Ce
procédé diminue considérablement le taux de polluant
à l'échappement, mais il repend l'odeur de friture dans
l'atmosphère. Il reste aussi à maîtriser et à
respecter les proportions requises. La filière des esters d'huile
végétale (EMHV et EHV) produit à partir des plantes
oléagineuses connaît un essor rapide avec une consommation
mondiale de 2 millions de m3. Comme l'illustre la figure
1-4.
I-5-2-1-2 Statistique de production des biodiesel dans le
monde
Figure 1-4: Volume de production d'EMHV dans le monde
[27] I-5-2-2 Le bioéthanol
Le bioéthanol est un biocarburant destiné au
moteur à essence. Il est produit à partir de deux grands types de
culture : les plantes sucrières (canne à sucre, betterave
sucrière...) et des plantes amylacées (blé maïs,
pomme de terre, manioc...).On parle généralement de la «
filière sucre » pour désigner cette filière. Le
bioéthanol peut être incorporé dans l'essence ordinaire
sans plomb à hauteur de 5 - 24%. Ce pourcentage peut aller
jusqu'à 85% sur les moteurs adaptés appelés «
flex fuel ». Cet éthanol d'origine
végétale (de formule chimique C2 H5OH), n'est rien d'autre que de
l'alcool éthylique, au même titre que celui que l'on trouve dans
toutes les boissons alcoolisées.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
I-5-2-2-1 Les alcools
Un alcool est un composé organique dans lequel un
groupe hydroxyle -OH est fixé sur un atome de carbone tétragonal.
DURUPHTY [9]. La formule générale d'un alcool
à chaîne saturée est donc : CnH2n+1OH, souvent noté
R-OH. Parmi les alcools on peu citer : le méthanol, l'éthanol, le
propanol, le butanol, etc.... Les alcools sont certes différents du
point de vue structurel, mais tous sont liés par des
propriétés spécifiques. Ces propriétés
permettent aux alcools d'être utilisés dans bien de domaines.
Propriétés chimiques des
alcools
1- volatilité : Les alcools passe
facilement de l'état liquide à l'état gazeux. Leur
volatilité est proportionnelle au nombre d'atome de carbone Cf. annexe
2.
2- Polarité : Un alcool peut
être considéré comme un ensemble de deux charges
ponctuelles de signes opposés (-d, +d) non confondues. On dit qu'il
constitue un dipôle électrostatique ou plus simplement qu'il est
polaire. Cette propriété chimique leur offre une grande
solubilité dans l'eau.
3- solubilité : On appelle
solubilité d'un composé dans l'eau, à une
température donnée, la quantité minimale que l'on peut en
dissoudre pour obtenir 1 litre de solution saturée à cette
température. Elle s'exprime en mol.L-1ou en g.L-1
et dépend de la température. Si on mélange de
l'éthanol à l'eau dans un tube à essai, après
agitation, les deux liquides forme un mélange homogène et ne se
sépare plus, quelles que soient les quantités
mélangées : l'alcool est miscible à l'eau en toute
proportion. Le tableau 1-2 nous donne les indices de solubilité de
quelques alcools solubles à l'eau à 25°C.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Tableau 1-2 : Solubilité de quelques alcools dans
l'eau [9]
|
Noms
|
Solubilité (g. L-1)
|
|
Méthan-1-ol
|
Total
|
|
Ethan-1-ol
|
Total
|
|
Propan-1-ol
|
Total
|
|
Butan-1-ol
|
80
|
|
Pentan-1-ol
|
22
|
|
Hexan-1-ol
|
7
|
|
Heptan-1-ol
|
3
|
|
Octan-1-ol
|
1.3
|
Ce tableau nous montre que les trois premiers composés
ont une miscibilité totale dans l'eau, contrairement aux autres. C'est
pourquoi l'on est amené à séparer les alcools de l'eau par
distillation. Mais, il n'est pas aisé de les séparer car se sont
des azéotropes.
4- Propriétés
azéotropiques
ROBERT [10], définit l'azéotrope
en ces thermes :
« The vapor boiling from a liquid has the same
composition as the liquid. Or, a liquid mixture of two or more components which
can be separed by distillation was termed `azoetrope' by SWIETOLAWSKI
»
L'azéotrope est donc un mélange homogène
de deux ou plusieurs composés chimiques difficilement séparables
même par distillation, par ce que ses vapeurs ont la même
composition que le liquide de base. Considérant les
propriétés de l'un et de l'autre, l'éthanol et
l'eau sont donc des azéotropes.
Propriétés physiques
Les alcools sont des molécules saturées, cette
caractéristique les prédestine aux réactions de
destruction (la combustion) c'est pourquoi ils sont très
inflammable. En effet la combustion
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
en présence du dioxygène (comburant), de
l'éthanol (carburant), dégage du gaz carbonique, de l'eau et une
grande énergie calorifique. Ce phénomène est
illustré par l'équation suivante :

C2H5OH + 3O2 2CO2 + 3H2O + 325Kcal
C'est cette propriété qui fait des alcools
en général et l'éthanol en particulier un potentiel
combustible.
I-5-2-2-2 Techniques de production de l'éthanol
1- Estérification de l'éthylène par
l'acide sulfurique
C'est la première méthode de production de
l'éthanol par synthèse. C'est aussi un ancien
procédé de production de l'éthanol qui consistait à
une réaction d'estérification de l'éthylène (C2H4)
par l'acide sulfurique (H2SO4) et une réaction d'hydrolyse. Ces
réactions sont les suivantes :
> CH2 = CH2 + H2SO4 CH3 - CH2 - O -
SO3H
> CH3 - CH2 - O-SO3 H + H2O CH3 - CH2OH +
H2SO4
Critiques
Cette méthode a été abandonnée du
fait de la corrosion des appareillages provoquée par l'acide sulfurique
et aussi par la production non négligeable de diéthyléther
comme sous produit. ROBERT [11].
2- Méthode par hydratation de
l'éthylène
C'est le deuxième procédé de production
de l'éthanol par synthèse. celui-ci consiste essentiellement
à l'addition de l'eau sur l'éthylène en présence
d'un catalyseur constitué d'acide orthophosphorique, portée
à la température comprise entre 270 et 280 °C
sous une pression de l'ordre de 70 bar. L'éthylène utilisé
ici provient généralement des gaz de craquages des produits
pétroliers. L'équation théorique de production se
résume en ces termes :
CH2 = CH2 + H2O catalyseur CH3 - CH2OH
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Cette réaction est très exothermique et
s'effectue avec diminution de volume. La température
élevée à laquelle on opère est nécessaire
pour obtenir une vitesse d'hydratation suffisante. Le passage de
l'éthanol hydraté à l'éthanol anhydre se fait par
distillation azéotropique en présence de benzène
ROBERTS [12].
> Critiques
Ce procédé donne le meilleur rendement par rapport
à tous les autres, mais il reste classé parmi ceux qui
présentent le plus de risques pour l'environnement.
3- Méthode par hydrolyse enzymatique de la
biomasse lignocellulosique
C'est la voie biologique de production du bioéthanol
encore appelé écoéthanol. Cette
méthode a longtemps été limitée pour des raisons
d'ordres techniques. Comment transformer en sucre les résidus d'une tige
de maïs ou de manioc par exemple qui sont en général
impropre à la consommation et souvent considérés comme
déchet.
Cette technique consiste à produire l'éthanol
à partir de « la biomasse lignocellulosique » (bois ;
herbe séchée ; tiges de plantes séchées ;
résidus de cuisine séchés...). En effet, la matière
vivante est essentiellement composée de
cellulose,
d'hémicellulose et de lignine (la lignine
effectue la liaison entre les faisceaux de cellulose et confère à
la plante sa structure particulière, elle n'est pas convertie en
éthanol).
La figure 1-5 nous montre une vue synoptique
de la structure de la biomasse lignocellulosique. Grâce à une
réaction d'hydrolyse, la cellulose et l'hémicellulose donne des
monosaccharides qui sont ensuite convertis en éthanol par fermentation.
L'éthanol y résultant est alors récupéré par
distillation. Les équations théoriques de production sont
résumées de manière suivante :
A titre d'exemple, si un hectare de canne à sucre
produit environ 25 tonnes de sucre simple et 8 tonnes de molasse
(résidus constitués de tiges pressées et de feuille), il
produit 50 à 60 tonnes de biomasse non comestible mais cependant
potentiellement convertible en éthanol.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Figure 1-5 : structure de la biomasse
lignocellulosique [12] > Critiques
Bien que cette méthode présente quelques avantages
tels que :
- Disponibilité de la matière première et
à très bon coilt ;
- Matière première pas concurrente avec
l'alimentation humaine ;
Il subsiste quant même des inconvénients tels que
:
- Complexité accrue des méthodes de transformation
en alcool rendant le transfert des technologies difficiles;
- Certaines étapes doivent encore être
corrigées pour rester conforme aux normes environnementales ;
- Exige une technologie de pointe pas du tout accessible
à tous.
> Méthode par fermentation
Historiquement, l'éthanol a été obtenu
par fermentation directe de sucre naturel. La fermentation de vin ou de
bière est attestée dans l'empire Babylonien, dès 3000 av.
J.-C. Les premières obtentions pures sont attribuées aux
alchimistes perses qui développèrent l'art de la
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
distillation au VIIIè et IXè
siècle de l'ère chrétienne. Ce procédé
originel demeure la base des méthodes actuelles.
a. Cas des plantes sucrières
En effet, la fermentation des plantes sucrières tels que :
betteraves; canne à sucre.. transforme le saccharose en glucose suivant
l'équation :
C6 H12O6 levure 2C2 H5 OH + 2CO2
La zymase intervient ensuite pour transformer le glucose et la
lévulose en alcool suivant l'équation (cas du glucose) :
C6 H12 O6 2C2 H5 OH + 2CO2
Cet éthanol sera récupéré par
distillation factionnée. b. Cas des plantes
amylacées
L'hydrolyse des plantes amylacées (manioc, patate,..)
ou des plantes céréalières (maïs, blé,..),
conduit au glucose que l'on fait ensuite fermenté en présence de
la levure de bière. La distillation permet de recueillir de l'alcool
éthylique sous forme de flegme, qui sera ensuite rectifié par
distillation fractionnée. On obtiendra ainsi de l'éthanol
hydraté (95% vol). Cf. figure1-6 Le passage à
l'alcool anhydre (96% - 100% vol) se fait par distillation fractionnée
en présence de benzène.
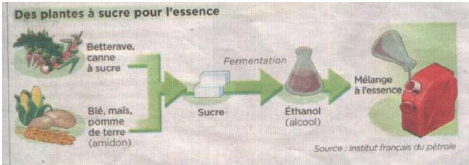
Figure 1.6 : Principe d'élaboration du
bioéthanol [27]
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
> Critiques
Cette méthode offre plusieurs avantages tels que :
- Technologie simple et facilement transférable ;
- Ne nécessite pas une énergie intermédiaire
importante ;
- Produit des sous-produits utiles pour l'élevage et
l'agriculture.
I-5-2-2-3 Statistique de production du bioéthanol
dans le monde
Le biocarburant dont la production est la plus importante dans
le monde est de loin le bioéthanol. Sa production est estimée
à 20 millions de m3 en 2004 et la figure
1-7, montre la répartition mondiale.
Figure 1-7: Volume de production de bioéthanol
dans le monde [27] I-5-2-3 Les Estérols
Il s'agit d'un mélange de bioéthanol et de
biodiesel. Ce carburant est prévu pour fonctionner dans les moteurs
diesels. Il doit combiner les avantages du bioéthanol et du biodiesel ;
moins d'émission, réduction des gaz à effet de serre,
meilleur densité énergétique que l'éthanol, pas de
modification du moteur. Par ailleurs cette filière devrait permettre de
réduire les émissions de manière encore plus sensible en
utilisant un catalyseur deux voies. Mais,
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
malheureusement, cette filière est encore en
expérimentation aux USA et en Suède ce qui laisse libre place au
développement du biodiesel et du bioéthanol. Pour cella il faut
maîtriser les techniques de production.
I-5-3 valeur énergétique des
biocarburants
La valeur énergétique d'un carburant ou d'un
biocarburant est mesurée par le pouvoir calorifique (PCI) qui
détermine la quantité d'énergie libérée lors
de la combustion. Le pouvoir calorifique (PCI) des biocarburants est
inférieur à celui des carburants fossiles. Le rapport
étant de 0.92 pour les EMHV (diester) par rapport au gasoil et de 0.66
pour l'éthanol par rapport à l'essence. Il faut 1.086 litres de
EMHV pour donner l'équivalent énergétique de 1litre de
gasoil, et 1.5 litres d'éthanol pour donner celle de 1litre
d'essence.
I-5-4 LES ATOUTS DES BIOCARBURANTS
I-5-4-1 Aspect environnemental
+ L'utilisation des biocarburants contribue grandement
à la réduction des GES. En effet, selon l'ONG française
UNIVERS NATURE, l'utilisation de l'huile de colza ou de tournesol
à la place du gazole permet une réduction de trois quarts des GES
émis pendant l'ensemble du cycle de vie du carburant (de sa production
à sa combustion, pour un même contenu énergétique).
L'utilisation de l'éthanol pur à la place de l'essence permet
quant à elle une réduction de 75% des GES. La figure 1-8
illustre un bilan comparatif entre les émissions de CO2 des
biocarburants et celles des carburants traditionnels
Figure 1-8 : Bilan comparatif des émissions
de CO2 entre biocarburant et les carburants
traditionnels
[3]
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
+ Par opposition aux rejets massifs des énergies
d'origines fossiles que rien ne compense et qui sont libérés lors
de la combustion de l'essence ou du gazole, le CO2 émis par les
biocarburants durant leur combustion est compensé par le carbone
absorbé par les plantes (phénomène de
photosynthèse) durant leur phase de végétation. C'est ce
rapport entre le CO2 retenu par les végétaux et le CO2
émis lors de la combustion qui explique la réduction des
émissions des gaz à effet de serre comme l'illustre la
Figure 1-9. De plus, durant la combustion, ces carburants
verts ne dégagent ni métaux toxique (plomb, zinc...) ni
soufre.
Figure 1-9 : Auto-récyclage du CO2 par les
biocarburants [13]
+ Les biocarburants sont produits directement sur les
territoires nationaux, il n y a donc pas d'importation, ce qui limite les
transports et la pollution qu'entraîne ce secteur. De plus, que ce soit
lors de la récolte, du stockage, de la livraison ou de l'utilisation des
biocarburants, les risques de pollution sont limités.
+ La combustion de ces carburants verts ne dégage ni
métaux lourd, ni soufre.
I-5-4-2 Indépendance énergétique
Au-delà de l'aspect environnemental, les biocarburants
contribuent également à la réduction de la
dépendance énergétique vis-à-vis des pays
producteurs de pétrole.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
I-5-4-3 Aspect économique
La production de biocarburant permet de créer et de
maintenir des emplois en milieu rural ce qui aurait une influence certaine sur
l'exode rural et par voie de conséquence sur l'économie
nationale. Le développement des filières biocarburant dans le
monde et en particulier en Afrique revêt une grande importance. Il
constitue une voie d'avenir crédible riche en retombés
Technologiques et financiers surtout dans le secteur agricole.
CONCLUSION
Le pétrole a fait son temps, il faut le
reconnaître sans être nostalgique. Même son poids
économique ne milite plus en sa faveur. Menace sur
l'écosystème et sur la biodiversité, pollution pendant sa
combustion, sont quelques griefs qui lui sont adressées. Dès
lors, de plus en plus des recherches sont engagées dans l'optique de le
remplacer par une autre source d'énergie qui soit, non seulement plus
propre, mais aussi économiquement rentable : Il s'agit ici des
biocarburants. En se réfèrent aux pays ayant réussi dans
la filière biocarburant, le constat que l'on fait est que, ceux-ci on
développé les plantes locales avant de chercher à importer
d'autres variétés. Le Brésil a utilisé la canne
à sucre, les USA le maïs et la France la betterave sucrière.
Compte tenu des conditions agro-climatiques favorables et de la
disponibilité des terres arables au Cameroun, nous avons porté
notre choix sur le manioc comme matière première dans
l'élaboration du bioéthanol. Pour se faire, il est important de
mieux connaître cette plante.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
CHAPITRE II: GENERALITES SUR LE
MANIOC
INTRODUCTION
Le développement de l'automobile passe par des coupes
de plus en plus harmonieuses, l'optimisation de la performance et la
sécurité. Mais, au-delà de ses critères classiques,
les manufacturiers s'intéressent aujourd'hui à des
matières premières nouvelles très souvent issu de la
biomasse végétales afin de pallier aux inconvénients
inhérentes à l'utilisation des dérivés du
pétrole brut comme carburant automobile. Les solutions les plus
novatrices concernent les plantes amylacés à l'instar du manioc
donc les caractéristiques biochimiques prédisposent à
être une source potentielle de matière première dans
l'élaboration d'un biocarburant. C'est eu égard à ses
considérations que nous nous proposons dans ce chapitre de
présenter les vertus de cette plantes, plus connue du domaine
culinaire.
II-1 ORIGINE ET DIFUSION DU MANIOC
A l'instar du maïs, de la tomate, de la pomme de terre,
des haricots et du tournesol, le manioc de nom d'origine latine
Manihot Esculenta est un des dons de
l'Amérique précolombienne à l'agriculture mondiale.
Originaire du Nord est du Brésil, il s'est rependu dans les zones
tropicales et subtropicales d'Afrique, d'Asie, et des Caraïbe, grâce
aux navigateurs portugais. C'est une plante classée C4
c'est-à-dire parmi les plantes à taux de production
élevé. Il est planté dans la plus part des pays africain
et au Cameroun en particulier sous forme traditionnelle. Le manihot
esculenta Grantz provient de l'hybridation successive entre plusieurs
espèces sauvages tels que le manihot glaziovü qui lui a
transmit ses gènes de résistance aux maladies et a
augmenté sa productivité de près de 18 fois. Selon les
études menées par Dr. MBIAPO, CABURET et
al [14]. Les espèces sauvages telles que le Manihot
esculenta Subsp. Flabellifolia et le Manihot esculenta Subsp Peruviana
ont grandement contribué à son hybridation.
II-2 LES VARIETES DE MANIOC
On peut grouper les nombreuses variétés de manioc
en deux catégories principales :
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
- Le manioc doux ou non vénéneux (Manihot
dulcis) cultivé pour la consommation locale de ses tubercules.
- Le manioc amer ou vénéneux (Manihot
esculenta) utilisé principalement pour la préparation de
fécule et autres dérivés.
II-3 CARACTERISTIQUE MORPHOLOGIQUE DU MANIOC
Le manioc est une plante arbustive pérenne de un
à quatre mètre de hauteur au feuillage palmé. Son mode de
propagation en culture est la bouture de tige. Une bouture émet des
racines au niveau du noeud en contact avec le sol humide (racines nodales) et
à la base (racines basales, plus nombreuses) Cf. figure
2-1. Chaque racine primaire est un cite potentiel de stockage des
réserves amylacés et commence à accumuler l'amidon sur un
secteur dès les première semaines. Il faut noter que le pouvoir
germinatif des graines de manioc est très faible (environ 20%) et reste
du ressort des programmes de recherche. Le manioc pour son
épanouissement entier, demande certaines spécificités
climatiques. CABURET et al [14]. Il est
particulièrement remarquable pour sa capacité à avoir de
bon rendement sur des sols peu fertiles, et il pousse souvent là
où d'autres cultures ont échouées.
II-4 ECOLOGIE DU MANIOC
Le mode de culture du manioc est le bouturage enfoncé
au trois quart et planté à l'horizontale, à la verticale
ou à l'oblique en fonction du type de sol (argileux ou sableux) en
respectant la polarité haut /bas. Il est cultivé dans toutes les
zones inters tropicaux avec des régimes pluviométriques à
une ou deux saisons de pluie et de pluviosité annuelle variant de 600 mm
de pluie à plus de 4000 mm. La température minimale est de 12
°C et le taux maximum de croissance se situe entre 25 et
29°C. (Cf. Annexe 1) Pour arriver à maturité, il
nécessite un développement de 6 à 36 mois selon les
variétés et le milieu.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

Figure 2-1 Tubercules de manioc (Manihot
Esculenta Grantz)
II-5 REPARTITION GEOGRAPHIQUES DE LA CULTURE DE MANIOC
AU
CAMEROUN
Le manihot dulcis espèce douce, réputer
pour la consommation de ses tubercules se trouve beaucoup plus dans les
provinces du centre, du sud, de l'est et du littoral.
Le manihot esculenta espèce amère
utilisée principalement pour l'extraction des fécules et la
préparation d'autres produits dérivés tels que : le gari,
fufu...On la retrouve au Cameroun beaucoup plus dans les provinces de l'ouest,
du nord ouest et dans le littoral avec une prédominance dans le
département du mungo.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
II-6LES UTILISATIONS DU MANIOC
Les racines de manioc sont riches en énergie et
contiennent principalement de l'amidon et des glucides solubles bien qu'elles
soient pauvres en protéine et en lipide La totalité de la plante
est parfois utilisée (tige ; feuilles ; tubercules). Le tableau 2-9 nous
présente les différents produits dérivés du
manioc
TABLEAU 2-9 Principaux produits dérivés du
manioc
|
Noms des produits
|
Caractéristiques
|
Lieux de production
|
Utilisation
|
|
Manioc (fig. 2-2.) Gari
Attiéké
Chikwangue
Myondo, mangbele (fig. 2-8) Mnitumba (fig. 2-5)
Foufou (fig. 2-10) Fufu (fig. 2 - 4.) Farinha de mandioca
Kokonte
Cassave chips
Lafun / makopa (fig. 2-4) Tapioca (fig. 2-10.)
Bobolo (fig. 2-9)
|
Frais, épluché
Produit sec (conservation plusieurs mois) Produit humide
(conservation quelques jours) Produit humide (conservation quelques jours)
Pâte cuite à l'huile de palme (conservation
plusieurs joPâte à consommation immédiate
Produit sec (conservation plusieurs mois) Produit sec
(conservation plusieurs mois) Produit sec (conservation plusieurs mois) Produit
sec (conservation plusieurs jours)
Farine de manioc fermenté, conservation plusieurs mo
Grains secs, longue conservation
Pâte cuite (conservation plusieurs jours)
|
Afrique et Amérique Afrique de l'Ouest Côte
d'Ivoire
Afrique Centrale
rs) Afrique centrale Afrique de l'Ouest Afrique Centrale
Brésil
Ghana
Caraïbes
Nigeria, Tanzanie Tous pays
Cameroun
|
Alimentation humaine
|
|
Cossettes / granulés (fig. 2-3)
Feuilles (junes pousses)
|
Produits secs, longue conservation
Fraîches ou en poudre
|
Tous pays
Afrique, Brésil (poudre)
|
Alimentation humaine
et animale
|
|
Fécule et amidon
|
Produits secs, longue conservation
|
Tous pays
|
Industrie (colles, éthanol, etc..) et aliments
|
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Figure 2-2 :Le tubercule de manioc Figure 2-3 :
cossette de manioc
Figure 2-4 :Le Fufu Figure2-5 : Le
Mintumba
Figure 2-6 : Le Water fufu Figure 2-7 : Chips
de manioc
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Figure 2-8 : Miyondo Figure 2-9 :
Bobolo

Figure 2-10 : Diversités culinaires du
manioc
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
II-7 FACTEURS NON NUTRITIONNELS DU MANIOC
Le manioc frais contient de l'acide cyanhydrique (surtout dans
la variété amère) qui est une substance toxique : c'est un
poison de l'hémoglobine des globules rouges. De plus, il provoque des
troubles de thyroïdes en empêchant l'iode de s'y fixer : c'est ce
qui est à l'origine des goitres et autre ralentissement de la croissance
chez l'enfant. C'est la raison pour laquelle il est déconseillé
de consommer excessivement du manioc cru (7 kg ou plus de racine fraîche
par jour sur une longue période). Ce poison est facilement
éliminé par cuisson, séchage au soleil, fermentation. Il
est en quantité plus importante dans l'écorce que l'on
élimine lors de la préparation. Par conséquent, lorsque le
manioc est bien préparé, il ne renferme plus de trace d'acide
cyanhydrique.
II-8 LA RECOLTE, LA POST RECOLTE ET LA QUALITE DES
PRODUITS
La récolte du manioc comprend
généralement la coupe des aériens (des tige saines et
vigoureuse sont retenues pour les boutures du cycle suivant) et l'arrachage des
tubercules. Ce travail est plus pénible en saison sèche mais
c'est à cette période que la teneur en matière
sèche est la plus élevée. Les racines
irrémédiablement se détériorent au delà de
trois jours. La blessure de la tubercule entraîne
généralement la formation de l'acide cyanhydrique (HCN) due
à la décomposition enzymatique par la linamarase et deux
glucosides (linamarine -90%, lotaustraline -10%).Ceci peut porter
préjudice sur la qualité de l'amidon si on n'y prend pas
garde.
II-9 ETAT ACTUEL DE LA PRODUCTION MONDIALE DE MANIOC
Le manioc est la septième culture mondiale en surface
cultivé. Le tableau ci-dessus classe les princjaux pays producteurs de
manioc IL faut noter avec satisfaction que la part de l'Afrique est en nette
augmentation ces dernières années. A regret, le Cameroun n'en
fait pas partie, d'où la nécessité de lancer la
filière.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Tableau 2-2 : Principaux pays producteurs de manioc
[13]
|
Pays
|
Production mondiale en (%)
|
|
Brésil
|
25%
|
|
Indonésie
|
12%
|
|
Nigeria
|
10.30%
|
|
RD du Congo
|
09.40%
|
|
Thaïlande
|
07.50%
|
II-10L'AMIDON DE MANIOC
En tant que source d'amidon le manioc (variété
amère) est hautement compétitif. La racine contient plus
d'amidon, en poids sec, que presque toutes les autres cultures
vivrières. De même, des technologies simples permettent son
extraction avec plus ou moins de succès.
L'amidon est un hydrate de carbone sous la forme d'un
polyoside de formule brute (C6H10O5)n. Celui ci est formé de
molécule de glucose associé en longue chaîne
linéaire (amylose) ou ramifié (amylopeptine) reliées par
des liaisons osidiques (pont oxygène) produit lors de la synthèse
chlorophyllienne, dans les feuilles. Ils constituent la principale
réserve glucidique des graines (céréales ; haricot,
etc....) et des tubercules (pomme de terre ; manioc ; etc....). Il est
utilisé dans l'industrie pour la préparation du glucose par
hydrolyse, l'encollage et l'apprêt des tissus mais surtout comme
matière première dans l'élaboration du
bioéthanol.
CONCLUSION
Au delà du domaine culinaire traditionnel pour lequel
il a toujours été destiné et du domaine industriel
où il a fait ses preuves, le manioc se propose d'entrer dans le domaine
privilégié des matières premières destinées
à l'industrie pétrochimique. Celui-ci possède des
arguments solides à cet effet. Il serait intéressant comme cela a
été le cas avec la canne à sucre au Brésil, la
bétérave sucrière en France et le maïs au USA, de
démontrer que le manioc tirer des plantations camerounaises est à
même d'être une source de matière première pour
l'élaboration d'un bioéthanol. Pour se faire, il est important de
maîtriser le mode opératoire de l'élaboration ainsi que
l'appareillage y afférent.
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
PARTIE II: ELABORATION ET ANALYSE DU
BIOCARBURANT FAIT À BASE DE MANIOC
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
CHAPITRE III : MATERIELS ET METHODES D'ELABORATION
DU BIOETHANOL
INTRODUCTION
Le matériel que nous allons vous présenter est
celui qui nous a permis d'élaborer et d'analyser notre biocarburant. En
fonction des opportunités qu'ils nous offraient, Trois sites ont
été sollicités pour la concrétisation de ce
projet.
III-1 PRESENTATION DES SITES DE TRAVAIL
A. Le village Ongot
Ongot est un petit village de la
banlieue de Yaoundé, situé à 10 km sur l'ancien axe lourd
Douala Yaoundé. Réputé pour leur sens de
l'hospitalité, mais surtout pour leur ardeur au travail, les habitants
du village ongot sont principalement des agriculteurs. Sous
l'assistance Technique des
agronomes du Programme Nationale de Vulgarisation et de
Recherche Agricole PNVRA (programme agricole
mis sur pied par le
ministère de l'agriculture au Cameroun), ceux-ci cultivent du manioc de
type manihot
esculenta Grantz. Le matériel
végétal en occurrence le manioc, nous vient de ce village.
B. Le village Ayene
C'est une bourgade située 1 km après Nkolbisson
sur l'ancienne route Douala Yaoundé aux encablures de la station de
réserve d'eau de Nkolmefou. C'est dans ce village que s'est
déroulé la distillation primaire, par l'intermédiaire des
dispositifs de distillation du « whisky traditionnel »,
quotidiennement élaboré par les femmes du dit village.
C. Lycée Technique Canadien de
Nkolbisson
Le lycée technique de Nkolbisson est un
établissement public construit avec l'aide de la coopération
Canadienne, destiné à former les jeunes camerounais et
étrangers aux techniques Industrielles modernes. Il est situé
dans le département du MFOUNDI, arrondissement de
Yaoundé II au lieu-dit centre agronomique, à 7km du centre
administratif. Sa superficie est de trois hectares environ. Il a pour Proviseur
actuel Monsieur ENGONGODO Dominique.
Le personnel est Camerounais à 100% et sa capacité
d'accueil est de 960 élèves pour trois niveaux : 2nd,
1ère et Tle, dans 16 spécialités
regroupées dans les quatre génies ci-après :
Génie Civil ; Génie Electrique ; Génie
Mécanique ; Génie Chimique.
«Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
C'est dans le département de Génie Chimique,
précisément au laboratoire de Chimie Industrielle CI que
nous avons effectué la distillation fractionnée du flegme issue
de la distillation simple.

Figure 3-1 : une vue du bâtiment administratif
du Lycée Technique de Nkolbisson
III-2 MATERIELS UTILISES
III-2-1 Matériel végétal
Le matériel végétal désigne ici la
matière première ayant servie pour l'élaboration du
bioéthanol. Le manioc a été récolté frais
directement des plantations à ONGOT Cette
récolte a eu lieu le 25
Janvier 2007 à 09 heures.Ce même jour, les
opérations de parage des tubercules et de décantation nous ont
permit d'obtenir de l'amidon. Celui-ci a été
fermenté puis a subit une distillation simple pour donner en fin le
flegme, matière semi-finie pour l'élaboration
finai du bioéthanol.
III-2-2 Matériel et appareillage de production du
bioéthanol III-2-2-1 Matériels de récolte et de parage du
manioc
Nous avons utilisé deux machettes, une hotte en raphia
et la force de nos bras pour la récolte de manioc, élément
de base dans l'élaboration de notre bioéthanol. Tout de suite
nous avons procédé au parage des tubercules (préparation
des tubercules de manioc pour leurs utilisations) en utilisant le
matériei suivant :
- une bassine
- deux couteaux
- 20 litres d'eau
- Un moulin à écraser
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
III-2-2-2 Matériel d'extraction et conditionnement
de l'amidon
L'extraction de l'amidon a eu lieu juste après le
parage du manioc pour éviter sa dégradation et par voie de
conséquence, la diminution du rendement de production. Pour le faire,
nous avons usé du matériel cidessous :
- une grande cuve
- du soleil (source de chaleur)
- un moulin à écraser
- du manioc de type manihot esculenta grantz
(figure 3-2)

Figure 3-2 : Tubercules de manioc (Manihot esculenta
Grantz)
III-2-2-3 Matériel de fermentation
Le tableau 3-1 récapitule les ingrédients
utilisés pour la préparation du mélange. La fermentation
proprement dite a eu lieu à Ayene, le 02 février 2007
à 08 heures. Le matériel ci-dessous a été
nécessaire :
- Un grand seau étanche en plastique
- Une spatule
Les ingrédients utilisés sont
présentés dans Le tableau ci-dessous.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala 2007 Tableau
3-1 : Ingrédients pour fermentation
Eléments
|
Quantités
|
Unités
|
Amidon de manioc
|
4
|
kg
|
Levure de bière
|
200
|
g
|
Eau
|
40
|
l
|
|
III-2-2-4 Matériel de distillation simple ou
primaire
La distillation simple s'est déroulée A
Ayene de même que la fermentation.Ce site a
été choisi parce que les femmes de cette zone ont pour habitude
de fermenter de la farine de maïs pour en faire du whisky traditionnel,
d'appellation locale « odontol ». C'est le
matériel traditionnel utilisé par celles-ci qui nous a permit de
réaliser la distillation simple de notre amidon fermenté.
Celui-ci se résume en :
- un fût vide ;
- un demi fût vide ;
- deux tuyaux en aluminium ;
- 20 litres d'eau (réfrigération) ;
- un bidon (réservoir) ;
- Manioc râpé (pour
étanchéité).
III-2-2-5 Appareillages de distillation
fractionnée
Au laboratoire de Chimie Industrielle (CI) nous avons
effectué la distillation fractionnée du flegme issue de la
distillation primaire. C'est un laboratoire équipé d'appareils
modernes à l'exemple de la tour de distillation fractionnée
présenté par la Figure 3-4. La figure
3-3 quand à elle montre une vue schématisée du
même dispositif.
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
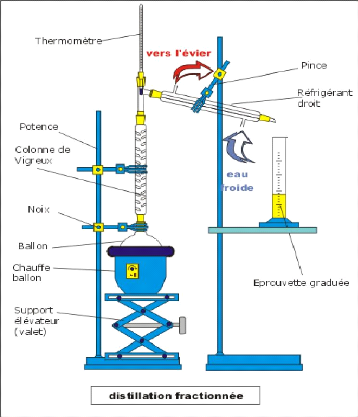
Figure 3-3 Dispositif de distillation
fractionnée [17]
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

Figure 3-4 : Tour de distillation
fractionnée
Légende
1. Rhéostat
2. Calotte chauffante
3. Pierre à ébullition
4. Ballon à fond rond
5. Colonne à distillation de type Vigreux
6. Pics de verre
7. Adaptateur
8. gaine
9. Thermomètre
10. Réfrigérant
11. Cylindre gradué
Description
1. Le chauffe ballon : Posé sur un
support à hauteur variable, il sert à apporter l'énergie
calorifique nécessaire à la production des vapeurs.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
2. Le ballon : Il est posé
directement sur le chauffe ballon et contient le flegme dans lequel on peut
apercevoir des fragments de porcelaine nécessaire à la production
des bulles (ils empêchent aussi la formation des points chauds).
3. La colonne de Vigreux: C'est un long tube
de verre possédant un ensemble de plateaux théoriques donc le
rôle est de sélectionner par condensation les composants du
liquide contenu dans le ballon. La partie inférieur de la colonne
communique avec le ballon tant dis que le haut, donne d'une part à la
tulipe via un tube en verre donc les parois sont
réfrigérées et d'autre part, communique avec une gaine
thermométrique dans laquelle loge le thermomètre.
4. Le thermomètre : Son
extrémité se trouve en contact ave les vapeurs issues du ballon.
Son rôle est d'indiquer la température d'ébullition.
5. Les réfrigérants : Se sont
des tubes de verre étanches. Une de leur extrémités
communique avec la sortie d'eau glacée de la pompe à eau, tant
dis que l'autre communique avec la sortie de la dite pompe. Le rôle des
réfrigérants est de refroidir les vapeurs issues de la colonne de
Vigreux.
III-2-2-6 appareillages de caractérisation
chimico-calorifique A. Matériel de détermination de la masse
volumique
La détermination de la masse volumique permettant la
déduction du degré d'alcool, s'est faite, au laboratoire de
chimie du Lycée Technique de Nkolbisson le 16 Février 2007
à l'aide :
- Des pycnomètres représentés par la
figure 3-5. - Une balance Figure 3-6 ;
- Un hands book of chemistry and physics Figure
3-6; - Un four électrique Figure 3-7
- Une prince
- De l'eau distillée pour étalonnage du
pycnomètre
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

Figure 3-5 Les pycnomètres Figure 3-6 balance
et hand book

Figure 3-7 Le four électrique
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
1. Le Pycnomètre : Le
pycnomètre se présente sous la forme d'un petit ballon à
goulot étiré donc le volume est préalablement
normalisé par le constructeur (Vp =10.00 ml).Celui ci
permet de déterminer la masse volumique des composés liquides.
2. La balance : La balance utilisée
ici est du type électronique, avec lecture au
100ème.
3. Le hand book : C'est le livre de
bord des laboratoires de chimie. Il contient les
valeurs de
référence des éléments chimiques. C'est lui qui
confirme les résultats d'une expérience.
B. Matériel de dilution
La réglementation en matière de carburant
autorise les mélanges entre le bioéthanol et l'essence en des
proportions biens définies et homologuées appelés
coupe. On les désigne par la lettre
E, suivie du pourcentage d'éthanol dans le
mélange. Exemple : la coupe E85. Elle représente
un carburant contenant, 85% d'éthanol et 15% d'essence. Dans cette
nomenclature, la coupe E100 désigne l'éthanol pur, utilisé
à 100 % dans le moteur sans mélange avec l'essence. On trouve
ainsi : du E5 ; E10 ; E15 ; E20 ; E85 ; E95 ; E100. Ce ci en fonction du pays
dans lequel on se trouve et de l'utilisation que l'on désire en faire.
C'est donc eu égard à ces considérations que nous avons
réalisé les différentes coupes. Le matériel suivant
nous a permis d'effectuer cette partie de notre travail:
h) Une hotte chimique figure 3-8;
i) Deux pipettes graduées ;
j) Deux Becher ;
k) Du bioéthanol ;
l) De l'essence super;
m) Deux fioles jaugées avec bouchons ;
n) Deux entonnoirs à liquide
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

Figure 3-8 Vue partielle de la hotte chimique C.
Matériel de réfractomètrie
Au laboratoire de chimie industrielle du Lycée
Technique de Nkolbisson les échantillons de coupe de carburant
réalisés ont été soumis à la
réfractométrie dans le but de caractériser chacun d'eux.
Le matériel ci-dessous donc l'élément principal est le
réfractomètre Figure 3-9 nous a permis d'y
parvenir.
Réfractomètre ABBE Atago modèle 302 ;
Six bocaux contenant les différentes coupes de combustible
; Deux compte-gouttes propres et secs.
Une bouteille de méthanol;
Un papier mouchoir.
Un verre étalon d'un indice : n D t = 1.5162 à
20°C
Du monobromonaphtalène
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

Figure 3-9: le réfractomètre ABBE Atago
modèle 302 > Légende
1. Oculaire
2. Source lumineuse pour le spécimen
3. Vis d'ouverture du prisme
4. Prisme collatéral
5. Prisme principal sur lequel on dépose le liquide
à étudier
6. Thermomètre utilisé pour indiquer la
température autour du spécimen
7. Transformateur, l'intensité lumineuse pouvant
être ajustée à 2 positions (Hi - Lo)
8. Roulette d'ajustement N°1
9. Roulette d'ajustement N°2
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
D. Matériel de calorimétrie
Dans le laboratoire de chimie du Lycée Technique de
Nkolbisson, du 20 février au 10 mars 2007 Les différentes coupes
réalisées ont été passées à un test
de combustion. Le matériel suivant a été utilisé
:
D-1 Appareillage et support d'exécution
o) Le calorimètre utilisé ici est un
calorimètre de type PARR (figure 3-11) fabriquer à
Imoline (USA) en 1996 par la firme PARR INSTRUMENT
COMPANY.
p) Rouleau de fil d'amorce (figure 3-10)
q) Une bouteille d'oxygène
r) Deux pipetes graduées
s) Un agitateur en verre
t) Deux béchers
u) Deux erlenmeyers
v) Une balance électronique (Lecture au
100ème)
w) Une règle graduée
D-2 Substances chimiques
x) De la poudre de PAK (pour le
titrage de la soude)
y) Une pastille d'acide benzoïque
(calibrage du calorimètre)
z) De la phénophtaléine
aa) De la soude (étalonnée)
bb) 20 litres d'eau distillée
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

Figure 3-10: rouleau de fil d'amorce Figure 3-11:
Calorimètre à la bombe
E. Matériel d'étalonnage de la
soude
L'étalonnage de la soude consiste à
déterminer la concentration réelle de la soude. Elle se fait
à l'aide du matériel suivant :
cc) Da la poudre de PAK ; dd)Une balance ;
ee) Une burette ;
ff) Un erlenmeyer ;
gg)De la soude à étalonner.
F. Matériel de calibrage du calorimètre a
la bombe
Il consiste à déterminer la valeur en eau du
calorimètre à la bombe à partir de la combustion d'une
pastille d'acide benzoïque de chaleur de combustion connue :
QC6H5COOH= 6318.3 cal.g-1
1. Un calorimètre à la bombe de type
PARR.
2. Un rouleau de fil d'amorce, Cf. figure 3-10
;
3. 2 litres d'eau distillée (pour le seau) ;
4. Une pastille d'acide benzoïque (combustible) ;
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
5. De la soude étalonnée de concentration
CNaOH= 0.0939M ;
6. Une bouteille d'oxygène (comburant)
7. 1 ml d'eau distillée (pour la bombe).
III-3 METHODES OPERATOIRES
Après la présentation du matériel, nous
allons passer à la phase explicative des étapes ayants
ponctuées notre travail.
III-3-1 Mode opératoire de l'élaboration du
bioéthanol
Les méthodes ici présentées sont celles
qui nous ont permis de réaliser notre bioéthanol, de le
caractériser et d'évaluer le pouvoir calorifique des coupes
issues des différentes dilutions effectuées. Il est
évoqué dans cette étude, quant cella est possible d'autres
méthodes en usages.
III-3-1-1 Méthode de récolte et de parage
du manioc 1) La récolte du manioc
Nous avons opté pour la méthode
traditionnellement de récolte, consistant à arracher les boutures
de manioc après avoir préalablement coupé les tiges
à l'aide d'une machette figure 3- 12.

Figure 3-12 : Récolte du manioc (Paka Tchinda
Basile)
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
2) Le Parage des racines
Le parage consiste à préparer le manioc pour son
utilisation. Ces principales étapes sont :
L'épluchage: Il est effectué au couteau à
large lame; après tronçonnage de la racine, la lame est
glissée sous l'écorce. Celle-ci est séparée du
corps de la racine.
L'équeutage : Il consiste à
sectionner les bouts et rejets.
Le lavage : Consiste à nettoyer les
morceaux de manioc avec de l'eau.
Broyage : Il est réalisé
mécaniquement par l'intermédiaire des moulins à
écraser modernes équipés d'un moteur asynchrone
triphasé. On obtient un résultat sensiblement identique
grâce au râpage, en utilisant des râpes de construction
locale dont le rotor est garni soit de scies, soit d'une enveloppe en fer blanc
perforé. Cette étape a pour but d'écraser les racines et
de les mettre sous la forme d'une pulpe.
C'est la pulpe issue du broyage des morceaux de manioc qui
servira de base pour l'extraction de l'amidon.
III-3-1-2 Méthode d'extraction de l'amidon
L'amidon de manioc
L'amidon est un polyoside de formule brute
(C6H10O5)n, formé de molécule de glucose
associées en longue chaîne linéaire (amylose) ou
ramifié (amylopeptine) par des liaisons osidiques (pont oxygène)
produit lors de la synthèse chlorophyllienne, dans les feuilles. Il
constitue la principale réserve glucidique des graines
(céréales ; haricot, etc...) et des tubercules (pomme de terre ;
manioc ; etc...) il est utilisé dans l'industrie pour la
préparation du glucose par hydrolyse, l'encollage des tissus, et
l'apprêt des tissus, c'est surtout la matière première dans
l'élaboration du bioéthanol.
Plusieurs procédés permettent l'extraction de
l'amidon et tous partent d'un même principe, celui de pouvoir recueillir
les particules en suspension dans le jus de manioc soumis aux mouvements de
tumulte ou de rotation. On distingue ainsi :
1) La méthode traditionnelle
Traditionnellement, la transformation du manioc en amidon aigre
passe par les opérations suivantes :
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
a. La décantation
Elle est réalisée dans une grande cuve. Son but
est d'extraire de l'amidon par centrifugation. Verser le manioc broyé
dans la cuve accompagné d'eau. Itemuer la cuve en faisant des mouvements
circulaires. Verser toutes les particules en suspensions dans l'eau dans une
autre cuve (c'est de l'amidon). Dans les amidonneries industrielles on utilise
des centrifugeuses pour la décantation, avec de grand rendement à
la fin.
b. Le séchage et conditionnement
Il permet d'ôter l'humidité dans l'amidon et de
mieux le conserver. Le séchage de l'amidon extrait se fait au soleil.
c. Le broyage
Il a pour but de réduire l'amidon en poudre pour
faciliter les traitements futurs. Celui-ci peu se faire à travers les
moulins usuels. La poudre d'amidon obtenue sera par la suite hydratée
puis fermentée. Le séchage se fait au soleil, mais la
chaîne de fabrication peut être améliorée surtout
l'étape de la décantation.
2) La méthode par décantation par les
canaux
La recherche propose un autre système, inspiré
de celui utilisé au Brésil et à Madagascar ainsi que dans
les féculeries européennes de pomme de terre : la
décantation en canaux. Les canaux serpentent avec une pente
calculée de telle sorte que l'eau circule à une vitesse de quatre
à dix mètres par minute, condition d'une bonne
décantation. L'investissement est comparable à celui
nécessaire à la réalisation d'un bac. Le séchage
continue à se faire au soleil sur des claies.
3) La méthode industrielle
Les racines, hautement périssables une fois
récoltées, sont livrées à l'usine de transformation
dans les 48 heures. Une fois lavées et pelées, les racines sont
écrasées ou râpées pour libérer les grains de
fécule Cf. figure 3-13 Le "lait
féculent"-amidon, en suspension
dans l'eau est alors séparé de la pulpe, et les grains
séparés de l'eau par l'utilisation de deux méthodes :
sédimentation ou centrifugation .Cette technique permet la
séparation, sous l'action de la force centrifuge, des partiules
inégalement dense en suspension dans le liquide. A ce stade, l'amidon
est mis à sécher au soleil ou par méthodes artificielles
pour en absorber l'humidité, avant d'être broyé,
tamisé et ensaché.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Figure 3-13 : Grains d'amidon de manioc vus au
microscope
Tous ces systèmes d'extractions produisent une
énorme quantité de résidus utiles : Les écorces des
racines peuvent être recyclées comme engrais et aliments pour
ès animaux ; une fois séchées, ès fibres
écartées peuvent être vendues comme agent floculant
à l'industrie d'extraction minière ; tandis que l'amidon à
faible densité perdu durant la sédimentation sert däliment
pour les porcs.
III-3-1-3 Méthode de fermentation du jus
d'amidon
C'est une des étapes importantes dans lëlaboration du
bioéthanol. Elle permet de changer la structure biochimique de l'amidon
et en faire d'autres éléments suivant un processus
irréversible.
a) Principe de la fermentation
Selon ès études menées par
ASADJEU et al [16], l'incorporation de la èvure de
bière à une solution aqueuse de glucose maintenue tide (environs
37°C) conduit à observer au bout d'un temps plus ou
moins long d'un ènt dégagement de dioxyde de carbone (CO2) qui
s'accélère peu à peu. Simultanément, è
glucose disparaît de la solution et l'alcool éthylique y
apparaît. La transformation du glucose en alcool dont le rendement peut
atteindre 95% s'effectue par une suie de réactions chimiques
complètes catalysées par la diastase et la zymase
secrétées par la levure en milieu légèrement
acide.
b) Généralité sur la levure
(figures 3-14 et 3-15)
La levure est un champignon unicellulaire qui forme des
colonies et possède toutes les propriétés des êtres
vivants et en particulier la capacité de reproduction sexuée ou
végétative. Dans un milieu propice, elle se multiñie
abondamment par bourgeonnement. Son activité dépend largement des
conditions du milieu. Elle a une capacité très
caractéristique : elle produit son énergie soit par respiration,
ou par fermentation. Elle respire lorsque l'oxygène du milieu est
abondant, ou fermente quand l'aération est insuffisante, comme c'est le
cas dans l'enceinte de fermentation de notre amidon.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
|
Figure 3-14: Colonies
de levures en
microscopie
optique.
[24]
|
Figure 3-15 : Une
levure
en
microscopie
électronique à
transmission.
[24]
|
Les levures sont des champignons ascomycètes. La levure
la plus utilisée en industrie agroalimentaire est la levure de
bière ou Saccharomyces cerevisiae
(étymologiquement : champignon à sucre de cervoise,
la bière des Gaulois), utilisée notamment en panification. C'est
Pasteur qui a élucidé cette double vie
de la levure qui, pour produire son énergie vitale, peut oxyder les
sucres en les décomposant complètement :
Respiration :
sucre + oxygène -------> eau + gaz carbonique
Ou les dégrader partiellement en produisant de l'alcool et
du gaz carbonique si elle ne dispose pas d'oxygène :
Fermentation :
sucre --------> alcool éthylique + gaz carbonique
c) Préparation du mélange (figure
3-16)
Etape 1 : conditionnement de l'amidon
Faire chauffer 20 litres d'eau dans une grande marmite
à une température de 40°C. Dès que cette
eau est prête, enlever la marmite du feu et transvaser la dans un
récipient étanche. Verser y les 4 kg d'amidon, tous en remuant
à l'aide d'une spatule pour éviter la formation des grumeaux.
Arrêter dès obtention d'un liquide plus ou moins visqueux. Laisser
refroidir.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Etape 2 : Ajout du ferment
Ajouter la levure de bière, et un peu d'eau
tiède si c'est nécessaire. Fermé hermétiquement le
récipient et placer le à un endroit où la
température peut être maintenue à environ
33°C. Laisser reposer pendant 4 jours. La préparation du
mélange est terminée.
L'amidon est un hydrate de carbone (plus complexe que les
sucre) et l'agencement compliqué des molécules d'oxygène
et d'hydrogène qui la compose empêche la levure de le fermenter
directement. Ces molécules doivent d'abord être scindé par
procédé biochimique en sucre simple. Pour cette raison, la poudre
d'amidon écrasée est hydrolysée (décomposé
par fixation d'eau) à l'aide d'enzymes. A ce moment, le produit obtenu
peut être couvert pour que la levure agisse figure 3-16.
Le temps de la fermentation, nous passerons à la Distillation simple.

Figure 3-16 préparation du mélange et
fermentation
III-3-1-4 La distillation simple ou primaire
Procédé de séparation de substance sous
forme liquide. Elle consiste à porter le mélange à
ébullition età récolter une fraction légère
appelée distillat et une fraction lourde appelée résidu.
Elle a été étudiée par Rayleigh
au début du XXe siècle. La technique de
l'alambic2 a été développée par
l'alchimiste Jabir ibn hayyan vers l'an 800. Celui-ci
a développé plusieurs autres appareils donc certains sont encore
utilisés en chimie. Nous avons utilisé les principes de cette
technique pour distiller notre jus d'amidon fermenté
III-3-1-4-1 Mode opératoire de la distillation
simple
Etape 1 : Répartition des
composants
Verser l'amidon fermenté dans le fût principal et
verser de l'eau dans le demie fût, celle-ci va jouer le rôle du
réfrigérant. Positionner le bidon à la sortie des
tuyaux.
Etape 2 : Préparation du matériel de
distillation.
2 Appareil de distillation composé d'une
chaudière à Laquelle est relié un tube à plusieurs
coudes.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Poser le manioc râper entre le couvercle et le fût
pour assurer l'étanchéité de la « marmite ».
Allumer le feu sous le fût principal et laisser bouillir.
Etape 3 : Sortie du flegme
Veillez à la quantité et à la
température de l'eau de refroidissement de la tuyauterie, la
remplacée dès quelle est très chaude. Environs 10 minutes
après les première ébullitions, on observe les
premières gouttes de d'alcool éthylique qui sortent de la
tuyauterie ; c'est le flegme. Surveillé sa sortie et remplacez le bidon
quant il est plein. On appelle flegme le produit issu
de la première distillation. Selon ASADJEU [16],
celui-ci est un conglomérat azéotropique constitué de :
méthanol 2 à 5% ; d'éthanol 80% ; de propanol ; de butanol
; des éthers léger ; du glycérol résiduel ainsi que
de l'eau. Tous ces produits seront séparés de l'éthanol
par distillation fractionnée.
III-3-1-5 Rectification par distillation
fractionnée du flegme III-3-1-5-1 But de la rectification
La distillation fractionnée permet de séparer
les constituants d'un mélange de liquide qui ont des températures
d'ébullition différentes. CHRISTIAN et al [3].
Elle permet d'obtenir un bioéthanol présentant un
degré d'alcool élevé en diminuant le pourcentage d'eau
présent dans le flegme. C'est la méthode idoine de
déshydratation du flegme que nous venons d'obtenir par distillation
simple.
III-3-1-5-2 Principe de la distillation
fractionnée
La distillation fractionnée consiste à faire
plusieurs vaporisations et condensations successives à
l'intérieur d'une colonne à fractionnement de type vigreux.
À chaque étape, la vapeur qui monte dans la colonne s'enrichit de
plus en plus de la substance la plus volatile.
La colonne vigreux sert à séparer un mélange
de liquides ayant des températures d'ébullition
différentes.
III-3-1-5-3 Mode opératoire de la distillation
fractionnée
CHRISTIAN et al [3] décrit le
procédé de distillation fractionnée des alcools en ces
termes : Le flegme est introduit dans un ballon et porté à
ébullition. Les vapeurs s'élèvent, la
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
température d'ébullition de l'éthanol
étant de 78.5°C à 1 atm. (Cas de la distillation
de l'éthanol), on remarque tout de suite que les vapeurs, au contact des
plateaux, se condensent et retombent dans le ballon : c'est le
reflux. De cette manière, les vapeurs les
moins volatiles n'atteignent pas le haut de la colonne, seul les vapeurs les
plus volatils parviennent à la tulipe sous forme de distillat.
Dans le cadre de cette étude, nous tirons profit de cette
technique pour réaliser la distillation fractionnée de notre
flegme. Le mode opératoire se résume comme suite :
1. Faire le montage de la tour de distillation.
2. Verser le flegme alcoolique dans
la bouilloire (ballon) et ajouter deux ou trois grains de porcelaine poreuse.
Les morceaux de porcelaine empêchent la formation d'un trop grand
bouillonnement à l'intérieur du ballon. La figure 2-19
illustre le premier passage du flegme à la tour de
distillation.
3. Mettre la pompe à eau en marche figure
3-20.
4. À l'aide du transformateur à voltage
variable (rhéostat), régler le chauffage de la calotte chauffante
de façon à ce que le distillat s'écoule à la
vitesse d'environ une goutte par seconde.
5. Maintenez le chauffage pendant le passage des vapeurs
issues du flegme chauffé.
6. Recueillez le liquide dans un cylindre gradué,
propre et sec.
7. Enlever les têtes de distillation (premières
gouttes qui tombent dans le cylindre) figure 3-31.
8. Noter la température d'ébullition. (voir
thermomètre figure 2-2) à tous les 2 mL; noter
également la pression atmosphérique, consigné les
résultats. La température d'ébullition reste constante
durant toute la première partie de cette distillation,
c'est-à-dire pendant le passage du « coeur de distillation »
(des vapeurs d'éthanol).
9. Lorsque le cylindre est plein, continuer à recueillir
ce liquide à l'aide d'un 2e cylindre gradué propre et
sec.
10. Continuer à observer la température à
laquelle s'effectue la distillation.
Lorsque l'éthanol a été
entièrement distillé, on observe une augmentation de la
température dans la colonne, le flegme contenu dans le ballon devient
légèrement trouble, se sont les « résidus ».
11. Arrêter la distillation, mettre le
rhéostat en position `off ', arrêter la
pompe à eau.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
12. A la fin du travail, sécher le
montage. Ne pas rincer avec de l'eau.
Le produit recueilli au niveau de la tulipe a pour nom,
« le distillat » figure 3-17. Celui-ci est
en vérité de l'éthanol hydraté constitué
d'un mélange azéotropique d'éthanol et d'eau. Cet
azéotrope sera passer de nouveau dans la colonne de distillation
fractionnée dans le but de le purifier d'avantage Figure
3-18.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

Figure 3-17 : 1er passage
de distillation Figure 3-18 : 2ème passage de
distillation


- 70 -
Figure 3-21 Prélèvement des têtes de
distillation
Figure 3-22 : Thermomètre sur colonne
Figure 3-19 : Ebullitions du flegme Figure 3-20 : La
pompe à eau
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
III-3-1-5-4 Autres méthodes de distillation
En dehors de la distillation fractionnée
qui est un processus consistant en plusieurs étapes de
raffinement successif d'une solution de produits multiples ayant des
températures d'ébullition rapprochées. Il existe d'autres
types de distillation :
1 Distillation sous vide: Ces techniques de
distillation visent à abaisser les
températures d'ébullition des différents
constituants du mélange à distiller, et donc permettent ainsi
d'éviter (ou de réduire) les risques de dégradation
thermique.
2 Distillations sous pression : Des
distillations peuvent être effectuées sous pression
afin de permettre la séparation des composés
très volatils.
3 Distillation continue: Elle consiste à
introduire une partie du distillat en tête de
colonne afin d'améliorer la pureté de la phase
vapeur. [17]
|
Le distillat résultant de cette étape, va
constituer l'essentiel de notre
bioéthanol. La détermination
du degré d'alcool de celui-ci constituera la
prochaine étape
de notre travail. Elle sera faite par la méthode
pycnométrique.
|
III-3-2 Mode opératoire de caractérisation
chimico-physique du distillat III-3-2-1 Présentation Du
Distillat
Le distillat est le produit obtenu après la
distillation fractionnée. Celui-ci se présente sous la forme d'un
liquide clair, incolore, d'odeur enivrante, caractéristique aux alcools.
Son arôme de banane est lié d'une part à la matière
première et d'autres part aux circonstances particulière de la
fermentation. C'est du bioéthanol hydraté.
III-3-2-2 Détermination de la masse volumique et
déduction du degré alcoolique du bioéthanol
Il existe une relation étroite entre la masse volumique
et le degré d'alcool. Le HAND BOOK OF CHIMISTRY AND PHYSICS
Cf. annexe 3 offre le tableau déductif du
degré d'alcool de l'éthanol en fonction de sa masse volumique.
Nous allons l'exploiter après avoir préalablement
déterminé la masse volumique de notre bioéthanol par la
méthode pycnométrique.
« Essai d'elaboration et analyse chimico-calorifique
d'un biocarburant a base de manioc »
Mémoire DIPET II -- ENSET de Douala
2007
La picnométrie
La pynomètrie est une technique ayant pour but la
détermination de la masse volumique d'un composé liquide
donné, par l'intermédiaire de l'utilisation d'un
pycnomètre.
Remarque : Avant toute intervention, sur un pycnometre il
est necessaire de l'etalonner pour obtenir des donnees credibles.
III-3-2-2-1 Etalonnage du pycnomitre
Comme le confirme les travaux de NJANA [18],
pour étalonner un pycnomètre, celui-ci est préalablement
nettoyé à de l'éthanol et séché dans un four
à 120°C puis il est pesé à sec. Sa masse
à vide mpv est notée. C'est ainsi qu'il est
rempli d'eau distillée jusqu'au couvercle. Après cette
pesée, la masse de l'eau distillée est obtenue en faisant la
différence entre les deux masses pesée. La masse volumique de
l'eau est obtenue et calculée à l'aide de la formule suivante
:
peau = masse volumique de l'eau en
(g.ml-1)
meau = masse de l'eau en (g)
Vp = volume du pycnomètre en (ml)
Formules de calcul
meau = masse du pycnomitre plein d'eau -- masse du
pycnomitre a vide
o Vp = masse de l'eau /masse volumique de l'eau
; o peau = masse de l'eau /masse volumique de l'eau.
<c Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
Tableau 3-2 : Résultats de la pycnomètrie,
étalonnage du pycnomètre
|
Intitulée
|
Valeurs
(essai1)
|
Valeurs (essai 2)
|
Unites
|
|
Masse
du pycnomètre
vide mpv
|
14.59
|
14.59
|
g
|
|
Masse
du pycnomètre
plein d'eau
distillée
mp+eau
|
24.59
|
24.58
|
g
|
|
Masse
de l'eau m1
|
10
|
10.1
|
g
|
|
Masse
volumique de
l'eau Peau
|
0.99707
|
0.99707
|
g/ml
|
|
Volume exact du pycnomètre
|
10.02
|
10.01
|
ml
|
|
Volume moyen du pycnomètre
|
10.01
|
10.01
|
ml
|
III-3-2-2-2 Détermination de la masse volumique du
bioéthanol
Le pycnomètre est lavé et séché dans
un four à 120 °C, ensuite il est pesé à
vide puis rempli de bioéthanol et pesé de nouveau. On obtient les
calculs suivants, cas de l'essai 1 :
Masse du pycnomètre vide mpv = 14.57g
Masse du pycnomètre + bioéthanol mpv+eth
= 22.56g Masse de l'éthanol meth =
mpv+eth - mpv
« Essai d'elaboration et analyse chimico-calorifiaue
d'un biocarburant a base de manioc »
Mémoire DIPET II -- ENSET de Douala
2007
meth = 22.56 -- 14.57
meth = 7.99g
Masse volumique de l'éthanol :OEeau= meth / Vp
avec Vp = volume du pycnomètre "eau = 7.99 /
10 = 0.799 g.ml-1
Le pourcentage massique du bioéthanol nous est
donné par le tableau Annexe 3. ROBERT [19].
C'est-à-dire que le degré d'alcool est (%A) correspondant
à une masse volumique peau = 0.799g.ml-1.
Cette valeur est comprise entre : 96.00g et 98.00 %vol. Il va falloir
déterminer la masse volumique réelle par interpolation.
III-3-2-2-3 Détermination de la composition vraie
par interpolation
A l'exemple des travaux menés par ASADJEU
[16], la composition vraie du bio éthanol se détermine
de la manière suivante : le tableau Annexe 3 montre que le degré
alcoolique correspondant à de l'éthanol de masse volumique 0.798
g.ml-1 est compris entre 96.00 et 98.00 %vol. Nous posons comme
exemple du premier essai.
|
96.00
|
0.8013
|
|
x
|
0.799
|
|
98.00
|
0.7954
|
x étant le degré d'alcool (%A)
recherché.
x - 96 / 98-x = 0.799-0.8013 /0.7954-0.799 = -0.0023 / -0.0036 =
6.38.10-1 x -96 = 6.38.10-1(98-x)
= 6.38.10-1 (98-6. 6.38.10-1x)
= 6.26.101
> x + 6.38.10 -1+
6.38.10-1x = 158.61
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
> 1.638x = 157.972
> X = 96.77966% vol
Ainsi pour cette distillation, la composition vrai en
bioéthanol au premier essai est de %A = 96.77 %vol. Après le
deuxième essai on procède au calcul de la moyenne. Les
résultats y afférents peuvent être consultés dans le
chapitre réservé à ce sujet.
III-3-3 Elaboration des coupes de biocarburant
La réglementation en matière de carburant
autorise les mélanges entre le bioéthanol et l'essence à
des proportions biens définies et homologuées appelés
coupes. On les désigne par la lettre E, suivie du
pourcentage d'éthanol dans le mélange. Exemple : la coupe
E85. Elle représente un carburant contenant,
85% d'éthanol et 15% d'essence. Dans
cette nomenclature, la coupe E100 désigne l'éthanol pur,
utilisé à 100 % dans le moteur sans mélange avec
l'essence. On trouve ainsi : du E5 ; E10 ; E15 ; E20 ; E85 ; E95 ;
E100. Ce ci en fonction du pays dans lequel on se trouve et de
l'utilisation que l'on désire en faire. L'élaboration des coupes
n'est possible que par ce que, l'éthanol et l'essence sont
miscibles.
III-3-3-1 Miscibilité de l'éthanol avec
l'essence
Si on verse environs 5 ml d'éthanol hydraté
à 90 %vol. dans un tube à essai contenant 5 ml d'essence, les
deux liquides crées une zone de séparation, l'éthanol se
place au dessus et l'essence en dessous. Si nous agitons le tube à
essai, les deux liquides ne formeront plus qu'un mélange
homogène, la zone de séparation ayant disparue. Même en
variant les proportions des deux liquides, la même observation demeure.
Cette expérience montre que l'éthanol et l'essence sont miscibles
en toute proportion, à condition que le degré d'alcool de
l'éthanol considéré ne soit pas inférieur à
80%vol. Ce ci confirme les travaux menés par: ROBERT [11] ;
ROBERT [9] et [16].
Les dilutions ici réalisées nous permettrons
d'élaborer des coupes de carburant dont la combustion sera
étudiée au prochain chapitre.
III-3-3-2 Principe de la dilution
La dilution est une opération qui consiste à
effectuer le mélange de deux liquides miscibles à des proportions
bien définies.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
III-3-3-3 Mode opératoire des dilutions
Nous effectuons la dilution entre le bioéthanol et
l'essence dans une hotte chimique, pour permettre
l'évacuation des vapeurs. Les deux pipettes gradées sont
installées sur des supports, on procède de la manière
suivante :
1 Remplir la pipette N° 1 d'éthanol
à l'aide d'un entonnoir ;
2 Poser un Becher vide sous cette pipette ;
3 Ouvrir légèrement le robinet et laissé
couler le liquide dans le Becher ;
4 Fermé le robinet dès obtention de la
quantité de produit souhaitée ;
5 Remplir la pipette N° 2 d'essence à
l'aide d'un entonnoir ;
6 Positionner un Becher sous la pipette contenant de l'essence
;
7 Répéter les mêmes opérations que
pour l'éthanol ;
8 Verser le Becher N° 2 dans le Becher
N° 1 ;
9 A l'aide d'un agitateur en verre, remué le contenu du
Becher ;
10 Conserver le mélange ainsi obtenu dans un bocal
étiqueté, sec et propre. Les coupes réalisées dans
le cadre de cette étude sont les suivants : E10 ; E15 ; E20
; E85 ; E95 ; E100.
11 Remplir la pipette N° 1 d'éthanol
à l'aide d'un entonnoir ;
III-3-3-3-1 Détermination des volumes de carburant
dans les coupes Le volume total de chaque coupe est
arrêté à 50ml.
Exemple de calcul : dilution de la coupe
E10
E10 désigne : un mélange
composé de ; 10% d'éthanol et 90% d'essence. C'est-à-dire
:
-Pour un volume d'éthanol V1 = x (inconnu) nous avons ;
Une concentration d'éthanol C1 = 96.33 mol l-1
Pour un volume total de solution V2 = 50ml nous avons :
Une concentration de C2 = 10%
Dans ces conditions, on applique la formule des dilutions :
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
a) Cherchons le volume d'éthanol à pipeter pour une
dilution totale de 50ml. Soit V1 le volume d'éthanol rechercher.
C1 V1 = C2 V2 V1 = C2 V2 / C1
Or C1 = 96.33 mol l-1 (concentration de
l'éthanol)
C2 = 10 %
V2 = 50 ml
b) Déterminons le volume d'essence à pipeter pour
un volume totale de 50ml. V2 = 50 ml (volume total de la coupe)
V1 = 5.19ml volume de bioéthanol dans la coupe:
Vessence = V2 - V1
An. Vessence = 50 - 5.19 = 44.80ml
Le volume d'éthanol et d'essence devant entré
dans l'élaboration des autres coupes de carburant se détermine
suivant la même méthodologie. Les données finales se
trouvent dans le chapitre des résultats.
III-3-4 ETUDE REFRACTROMETRIQUE DES COUPES III-3-4-1
Présentation de La réfractométrie
La réfractomètrie est une technique qui permet
de déterminer l'indice de réfraction d'un composé solide
ou liquide. L'indice de réfraction caractérise un milieu et
constitue un élément d'identification d'un carburant ainsi qu'un
déterminant fiable lors du contrôle qualité. L'appareil qui
sert à mesurer l'indice de réfraction s'appelle le
réfractomètre.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Dans le cadre de notre étude, l'indice de
réfraction nous permettra de caractériser nos différentes
coupes de carburants tout en leur attribuant un code
réfractomètrie d'identification.
III-3-4-2 Définition de l'indice de
réfraction
L'indice de réfraction d'un milieu est le rapport de la
vitesse de la lumière dans le vide à sa vitesse dans un milieu
considéré. C'est un nombre sans unité. Loi de
SNELL-Descartes. Pour un liquide il dépend de la
température et varie avec la longueur d'onde de la
lumière incidente. GROSSETÊTE et al [3].
III-3-4-3 Principe de la réfractométrie
L'indice de réfraction d'un liquide pur (noté
nDt ou `t` représente la valeur de la température
ambiante au moment de la lecture), est une caractéristique de celui-ci
qui est facilement mesurable par des méthodes optiques. Quand un
faisceau lumineux arrive à la surface d'un liquide avec un angle
d'incidence "i" à l'intérieur du liquide, cet angle devient plus
petit << r », à cause de la réfraction causée
par le liquide. Figure 3-23
Rayon incident rayon réfléchi
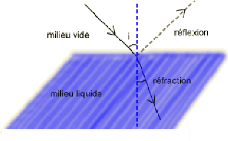
La normale au plan r Rayon réfracté
Figure 3-23 : Réfraction d'un faisceau lumineux
à la surface d'un liquide. [17] III-3-4-4 Méthode de
correction de l'indice par rapport à la température
Les valeurs de référence des indices de
réfraction des liquides sont données dans les <<Hand
book» à une température de 20°C. Pour
les composés organiques, on a trouvé que, lorsque la
température augmente de 1°C, l'indice de
réfraction diminue de 0,0004. C'est pourquoi il faut toujours ramener
les calculs à la température de 20°C.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Exemple : si à
22°C, l'indice de réfraction est 1,3603, alors à
20°C l'indice de réfraction sera de 1.3595. En utilisant
la formule suivante : nD 20 = nD 20 + 0.0004 (20-t)
Oü nDt = Indice de réfraction d'un milieu
à 20°C ;
nDt = Indice de réfraction d'un milieu à
une température « t » quelconque
(sans unité) t = température ambiante en
(°C).
Vous devrez donc noter la température à laquelle
vous avez mesuré l'indice de réfraction pour faire la correction
plus tard. [1]
III-3-4-5 Etalonnage du réfractomètre (Abbe
Atago modèle 302) Mode opératoire de
l'étalonnage
L'étalonnage du réfractomètre nous garanti
des lectures précises. Elle se fait avec un verre d'indice connu :
nDt =1.5162 à 20°C.
- Déposer le verre étalon sur l'objectif
de l'appareil ; - Déposer une goutte de
monobromonaphtalène ;
- Tourner la vis de réglage sous la Roulette d'ajustement
N°1, (Cf. page 44) à l'aide d'une clé
spéciale.
- Arrêter de tourner dès obtention de la valeur
souhaitée (indice marquée sur le verre). L'étalonnage est
terminé. On nettoie l'objectif au méthanol après chaque
essaie.
III-3-4-6 Exemple de mesure de l'indice de
réfraction de la coupe E100 III-3-4-6-1 Mode opératoire
de la mesure (figure 3-25)
Placer l'appareil avec la poignée devant soi. Brancher le
transformateur (7) à la prise de courant.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Appuyer sur le bouton << On » du transformateur (7)
sur le modèle illustré, il est situé à
l'arrière et sur le bouton << High ».
Ouvrir les prismes avec la vis (3), les nettoyer avec le
méthanol et un tissu doux (papier mouchoir), puis les sécher.
Placer quelques gouttes (3 à 5) de bioéthanol
(E100) sur le prisme principal (5) à l'aide d'un compte-gouttes (sans
toucher au prisme) et fermer les prismes avec la vis (3). Voir le schéma
de l'appareil.
Avec la roulette d'ajustement (9), déplacer
l'échelle graduée, que l'on voit dans l'oculaire aux alentours de
la valeur attendue. À ce moment, on voit apparaître les couleurs
de l'arc-en-ciel dans le carré au-dessus de l'échelle. Voir
figure 3-24.
Avec la roulette d'ajustement (8), faire un ajustement fin
jusqu'à ce que la démarcation entre l'ombre et la clarté
soit nette. Finir cet ajustement avec l'oculaire (1).
Avec la roulette d'ajustement (9), ajuster cette ligne
horizontale au centre de la croix

|
Figure 3-24 : Champ visuel de l'oculaire pendant une
mesure.
|
Figure 3-25 : Mesures
réfractométriques
|
|
|
|
Prendre la lecture. La quatrième décimale sera
approximative; la lecture. (Serait ici 1,3848 dans le cas de cette figure qui
ne représente pas l'indice de réfaction de notre
bioéthanol qui est de 1.3590 à 32°C).
Noter la température.
Ouvrir les prismes, les nettoyer avec du méthanol et les
essuyer avec un tissu doux.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Fermer les prismes.
Effectuer cette mesure assez rapidement car l'éthanol est
volatil.
L'opération est terminée.
Correction du résultat
Données :
nD 32 = 1.3590 (indice de réfraction du bioéthanol
à t = 32°C)
nD 20 = ?
La formule de correction nous donne :
nD20 = nDt + 0.0004
(20-t)
An.: nD 20 = 1.3590 + 0.0004 (20-32)
=1.3542 donc l'indice de réfraction de réfraction
de la coupe E100 est de :
nD20 = 1.3542
III-3-5 DETERMINATION DE LA CHALEUR DE COMBUSTION ET DU
POUVOIR CALORIFIQUE DES COUPES DE CARBURANTS
III-3-5-1 Origine de la chaleur de combustion dans les
carburants
Lors de la combustion d'un carburant (exemple le
bioéthanol), les liaisons C-H et O=O des réactifs sont rompus et
les liaisons C=O et O-H se forment. La rupture des liaisons C-H et O=O
nécessite un apport d'énergie: Elle est
endothermique3. Inversement, la formation des liaisons
3 Réaction chimique absorbant la chaleur
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
C=O et O-H libère de l'énergie : Elle est
exothermique4. La chaleur de combustion est donc le bilan de ces
deux étapes.
DURUPTHY et al [9] définit la chaleur
de combustion comme résultant d'une variation de l'énergie «
chimique » du système, énergie stockée dans les
liaisons intramoléculaires des réactifs et des produits.
Dans notre étude nous avons opté pour
l'utilisation du calorimètre à bombe d'oxygène pour sa
précision ainsi que parce qu'il est à même de
répondre aux problèmes qui concernent notre étude. Pour
cela, il est important de maîtriser cette technique.
III-3-5-2 La Calorimètrie
La calorimétrie est la technique de la mesure des
quantités de chaleur. L'appareil utilisé pour la mesure des
quantités de chaleurs dégagées ou absorbées pendant
une combustion s'appelle le calorimètre. La bombe calorimétrique
a été mise au point par Pierre-Eugène
Marcellin Berthelot en 1879 alors qu'il
étudiait les phénomènes de combustion à volume
constant. Ainsi on a :
-Le calorimètre à bombe
d'oxygène pour mesurer les chaleurs de combustion ;
-Le microcalorimètre à la bombe
pour mesurer les chaleurs dégagées au cours des
réactions chimiques.
III-3-5-3 La Chaleur de combustion ou valeur
calorifique
C'est le nombre d'unité de chaleur
libérée par une unité de masse d'un échantillon
brûlé avec l'oxygène dans un milieu fermé à
volume constant. Pour bien quantifier cette valeur il est bien de
maîtriser la notion de capacité calorifique.
III-3-5-4 Capacité calorifique ou chaleur
équivalente
Sellons DURUPTHY et al [4], pour toute
manipulation utilisant un calorimètre, il est nécessaire de
connaître sa capacité calorifique ou thermique u,
c'est-à-dire la chaleur qu'il faut lui fournir pour lever sa
température de 1°C. C'est aussi la quantité de
chaleur qu'un corps absorbe pour s'échauffer de 1°C ou
qu'il cède pour se refroidir de 1°C. Cette notion est
très
4 Réaction chimique dégageant de la
chaleur
« Essai d'(laboration et analyse chimico-calorifique
d'un biocarburant à base de manioc »
M(moire DIPET II - ENSET de Douala 2007
importante car elle garantie l'exactitude des résultats en
tenant compte des pertes énergétiques liées à la
fiabilité de l'appareil utilisé.
III-3-5-5 Principe de mesure des chaleurs de combustion
par le calorimètre à la bombe
Pour mesurer le pouvoir calorifique
d'une substance, il faut déterminer la chaleur dégagée par
cette substance lors d'une réaction de
combustion complète, rapide et unique.
Complète pour éviter les corrections difficiles à calculer
si une partie de la substance ne s'est pas consumée, rapide pour
éviter les déperditions de chaleur inévitables même
si le système est isolé et unique pour que des réactions
secondaires ne viennent perturber la mesure.
Le principe de fonctionnement de la bombe
calorimétrique remplit ces trois conditions. Il s'agit d'un
cylindre en acier, bon conducteur de la
chaleur et très résistant à la
pression qui peut atteindre instantanément après la
réaction, plusieurs centaines de bar. On dispose au fond de ce cylindre
un creuset dans lequel sera déposée la
substance à étudier. Le cylindre est alors rempli de comburant
(dioxygène à une pression de 20
à 30 bar pour être sûr qu'il sera en excès afin
d'assurer une combustion complète). Le dispositif de mise
à feu est constitué d'un fil métallique au
contact de la substance, qui sera traversé par un courant de forte
intensité pour déclencher la combustion. La bombe est
placée dans un calorimètre comprenant
une grande quantité d'eau distillée, muni d'un
dispositif d'agitation et d'un
thermomètre de précision. La
quantité d'eau est importante pour que l'élévation de
température ne dépasse pas quelques degrés.
Après avoir mesuré la
température initiale, on déclenche la
mise à feu puis on mesure la
température de la fin de la combustion lorsque
l'équilibre thermique du calorimètre est atteint (moment oil la
courbe de température redescend). Connaissant la
capacité thermique du calorimètre, il
est alors facile de déterminer la quantité de chaleur produite
par la combustion en la corrigeant de la chaleur apportée par le
système de mise à feu.
La substance (talon
L'étalonnage nécessite une substance
étalon ayant une chaleur de combustion prédéfinie, elle
servira de référence pour la manipulation. Dans le cadre de cette
étude nous avons utilisés de l'acide
benzoïque (C6H5COOH) donc la chaleur de combustion est de :
QC6H5COOH = 6318.3 cal.g-1.
L'étalonnage va permettre de déterminer la capacité
thermique du calorimètre.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Précaution: Une bombe
calorimétrique peut contenir des gaz à fortes pressions. Il est
donc nécessaire d'effectuer des contrôles de qualité pour
éviter tout risque de fuite, voire d'explosion.
III-3-5-6 Paramètre de détermination des
chaleurs de combustion
A) Paramètres principaux
Pour déterminer la chaleur de combustion dans un
calorimètre à la bombe, il faut tenir compte de :
1. La chaleur correspondant à la longueur du fil
d'amorce brûlé évalué de manière suivante :
1cm de fil brûlé dégage 2.3 cal,
comme le spécifie le constructeur de l'appareil. (PARR
INSTRUMENT COMPANY) [21].
2. Le volume de soude NaOH ayant permit de titrer5
les acides formés après la combustion. La correction
thermochimique stipule que : 1cm3 de base (NaOH) dans le
titrage des acides formés équivaut à 1.0
cal, avec (1cm3 = 1ml). Les acides formés sont
essentiellement l'acide nitrique (HNO3) et sulfurique (H2SO4).
B) Autres paramètres
> La masse d'eau au dessus ou en dessous de 2kg ;
> La masse de l'échantillon en dehors de celle
exigée ;
> La valeur de montée de la température
incorrecte.
Remarque1 : seul les chaleurs
dissipées à la formation des acides et à la combustion du
filament seront prise en compte dans le cas des mesures effectuées dans
un calorimètre de type «PARR », de même, la plus part
des échantillons ayant moins de 0.1% de soufre, on négligera la
quantité de chaleur dissipée lors de la formation de l'acide
sulfurique.
Remarque 2 Il est recommandé de
calibrer la soude utilisée pour le titrage ainsi que le
calorimètre dans le but d'obtenir les résultats les plus
précis possibles.
5 Déterminer la quantité de corps
dissous dans une solution
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
III-3-5-7 Etalonnage de la soude
Cette soude nous servira pendant la manipulation, il va
falloir l'étalonner. L'étalonnage de la soude consiste à
déterminer la concentration réelle de la soude. Elle se fait en
faisant réagir une substance étalon appelée
PAK de masse molaire connue : Mpak= 204.22 g/mol avec
de la soude à étalonner.
1. Mode opératoire de l'étalonnage de la
soude Au laboratoire, nous disposons d'une soude de concentration
théorique : CNaOH = 0.11M
En incorporant trois gouttes de phénophtaléine
dans un élermeyer contenant de la poudre de PAK
préalablement diluée dans un peu d'eau distillée, en y
ajoutant progressivement de la soude, on observe alors un changement de couleur
de la solution qui part de l'incolore au rouge : c'est le virage. Dans la zone
de virage, le nombre de mole de la soude : nNaOH est égale à
celui du PAK : nPAK.
La formule : nNaOH = nPAK nous permettra de
déterminer la concentration réelle de notre soude.
2. Détermination de la concentration
réelle de la soude
> CNaOH = 0.11M (concentration
théorique de la soude disponible au laboratoire) > MPAK=
204.22g/mol (masse molaire du PAK)
> V= 10.00ml (volume de chute de
burette pour le titrage de la soude)
3. Calcul de la masse de PAK
(mPAK)
La masse de PAK (mPAK) nous permettra de
déterminer le point de virage. Elle est tirée de la formule
suivante, Cf. DURUPTHY et al [9].
nPAK = mPAK/ Mpak et nNaOH =CNaOH XV
mPAK = masse de PAK en (g)
Donc : mPAK/ MPAK = CNaOH X VNaOH
V= Volume de chute de burette de la soude en ml CPAK=
Concentration du PAK en M
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala 2007
CNaOH = concentration de la soude en M
On obtient donc : mPAK= CNaOH .V .
Mpak
AN. mPAK= 0.11 x
10.10-3 × 204.22= 0.22 g
Donc, le titrage nécessite une masse de PAK :
mPAK= 0.22g
4. Détermination de la concentration exacte de la
soude
> Pesons une masse de poudre de PAK,
mPAK= 0.22g ;
> La faire dissoudre dans un peu d'eau distillée ;
> Y incorporer trois gouttes de phénophtaléine
;
> Progressivement, à l'aide d'une burette
graduée, ajouter de la soude étalonnée tout en
contrôlant l'écoulement, jusqu'au point de virage
(rouge);
Relevé le volume de soude VNaOH correspondant.
L'essai 1 nous donne : VNaOH = 11.70 ml.
Nous savons que, au point équivalent, nPAK = nNaOH
Donc : nNaOH = mPAK /Mpak
AN. nNaOH = 0.22 / 204.22 = 1.08
x10-3 mol
CNaOH = nNaOH / mPAK
AN. CNaOH =
1.08x10-3/11.7x10-3=
0.0923mol.l-1
CNaOH = 0.0923mol.l-1 est la concentration
moyenne de la soude.
Cette manipulation se fait à travers deux essais
à l'exemple du mode opératoire ci-dessus relaté. La
concentration obtenue lors des deux essais nous permettra de déterminer
la concentration moyenne. Les différents résultats de cette
manipulation sont regroupés dans le tableau des
résultats du dosage de la soude.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
III-3-5-8 Calibrage du calorimètre a la bombe
Etape 1 : Pesage de l'acide benzoïque
b) Peser et noter la masse de la pastille d'acide benzoïque
;
c) Déposer la sur le porte-échantillon.
Etape 2 : Fixation du fil d'amorce
d) Couper 10cm de fil d'amorce et noter la longueur exacte du
fil coupé ;
e) Fixer le fil d'amorce sur les électrodes de la
tête de la bombe avec un dépassement de 3 à 4 mm de chaque
côté figure 3-26.
f) placer le porte-échantillon (figure 3-27)
et faire passé le fil sur la pastille. Etape 3 :
fermeture de la bombe
g) Introduire 1ml d'eau distillée dans le cylindre de la
bombe ;
h) Poser le couvercle et visser solidement ;
i) Fermer les valves de sortie d'air.
Etape 3 : Remplissage en
oxygène de la bombe
j) fixer le tube en caoutchouc de la bouteille d'oxygène
sur celle de la bombe ;
k) Tourner la valve principale sur la bouteille d'oxygène
d'un déplacement de 1/4 maximums ;
l) Ouvrir la valve de contrôle jusqu'à 25 atm sur
le cadran (ne pas excédé 30 atm), fermer immédiatement les
valves ;
m) Descendez la valve de relaxation pour faire baisser la
pression dans la tuyauterie ;
n) Déconnecter le tube en caoutchouc de la bouteille
d'oxygène.
o) Fermer la valve de la bouteille d'oxygène et ouvrir
les valves de contrôle pour évacuer le reste d'oxygène
jusqu'à ce que le cadran indique (o).La bombe est pleine
d'oxygène figure 3-29
Etape 4 : Montage du
calorimètre
p) introduire 2 litres d'eau environs préalablement
pesée dans le seau approprié ;
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
q) Introduire la bombe de moitié dans le seau d'eau, puis
fixer les câbles externes du calorimètre sur les terminaux
externes de la bombe ;
r) Laisser reposer la bombe au fond du seau et l'introduire dans
le calorimètre (fig. 3-28) Note : Utiliser des pinces
appropriées pour la manutention de la bombe.
a. Fermer le couvercle du calorimètre (figure
3-30)
b. Enclencher le système d'agitation ;
c. Laisser tourner pendant 5 minutes pour obtenir
l'équilibre thermique du système ;
d. Relever la température initiale avant le
déclenchement de la mise à feu.
e. Déclencher le système de mise à feu.
Etape 5 : Lecture de la
montée de température
f. Lire le thermomètre et relever la montée de la
température après chaque 15 secondes ;
g. Arrêter la levée de la température
dès qu'elle devient constante ;
h. Ouvrir la valve d'air et laisser échapper les gaz ;
i. Prélever l'eau issue du fond de la bombe pour analyse,
tout en nettoyant
minutieusement ses parois avec de l'eau
distillée.
Etape 6 : Titrage de la solution
Elle permet de déterminer le volume de NaOH ayant permit
de titrer les acides (acide nitrique HNO3 particulièrement, car l'acide
sulfurique est en très faible quantité).
j. Introduire trois gouttes de phénophtaléine dans
l'eau issue du fond de la bombe, puis,
à l'aide d'un compte gouttes,
titrer la solution et prélever le volume de NaOH au point de virage
(précjité rouge).
k. Effectuer les calculs y afférents.
Etape 7 : Mesure de la longueur du fil
brûlée
Identifier les morceaux de fil non brûlé ;
l. A l'aide d'une règle graduée, mesurer la
longueur des morceaux de fil d'amorce restant après
combustion ;
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
m. Sachant que on a utilisé 10cm de fil au départ,
soustraire et obtenez la longueur de fil brûlé.
|
|
|
Figure 3-27 : porte
échantillon
|
Figure 3-26 : Fixation du fil d'amorce
|
|
|
Figure 3-29: Bombe à oxygène
chargée
|
Figure 3-28 : l'intérieur de la
bombe
Figure 3-31 : Vue de
Figure 3-30 Fermeture du calorimètre
l'intérieur du calorimètre
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Le tableau 3-3 récapitule les
paramètres de bases obtenus avant le debut du calibrage. Tableau
3-3 : Mesure des paramètres initiaux
|
Paramètres
|
Valeurs
|
Unités
|
|
Masse de l'acide benzoIque (ma)
|
0.96
|
g
|
|
Masse de l'eau (m1)
|
1998.9
|
g
|
|
Volume de soude initial (VNaOH)
|
0.00
|
ml
|
|
Longueur initiale du fil mesuré
|
10
|
cm
|
|
Temperature initiale (Oi)
|
28.8
|
°C
|
III-3-5-9 Détermination de la capacité
calorifique de la bombe calorimétrique type PARR
Tableau 3-4 : Evolution de la température de
combustion de l'acide benzoïque
|
Temps en seconde (s)
|
Température en (°C)
|
Observation
|
|
i
|
28.8
|
Précombustion
|
|
30
|
29.1
|
Combustion
|
|
60
|
30.2
|
|
90
|
30.8
|
|
120
|
31.1
|
|
150
|
31.2
|
|
180
|
31.3
|
|
Of
|
31.4
|
|
240
|
31.4
|
Post combustion
|
|
270
|
31.4
|
|
300
|
31.4
|
|
330
|
31.4
|
|
Avec Oi = temperature initiale Of = temperature finale.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
a) Détermination de la variation de
température AO = Of - Oi
==> AO =31,4 -- 28,8 = 2,6°C donc AO = 2,6 °C
b) determination de la longueur du fil brülé.
L fil brülé = L fil initiale - L fil non
brulé ; or L fil non brülé = 4.2 cm
L fil initiale = 10cm
L fil bràle = 10 - 4.2 = 5.8 cm
c) Détermination de la quantité de chaleur
(QT) fournie pendant la combustion Elle est fonction de trois facteurs
:
QT = Q1 + Q2 + Q3
Q1 = Chaleur ayant brülé le fil;
Q2 = Chaleur ayant produit la formation du HNO3 ;
Q =
Chaleur de combustion de l'acide benzoIque ;
· Sachant que : 1cm de fil brülé ==> 2.3cal.
[18] On a : Q1 = L fil brûlé X
2.3
AN. : Q1 = 5.8 x 2.5 = 13.34 cal.
· Sachant que : 1ml de NaOH ==> 1cal [18]
Q2 =5.3 x 1 = 5.3 cal
Q3 = Chaleur massique de C6H5COOH x masse d'une pastille de
C6H5COOH
Q = 6318.3calIg x 0.96 g = 6065.56 cal
<c Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
QT = 13.34 + 5.3 + 6065.56 = 6084.2 cal
QT = 6084.2 cal
d) Determination de la capacité
calorifique de la bombe calorimetrique
QT = Wcal x AO ==> Wcal =
QT/AO
Oü on a : QT = Quantité de chaleur
fournie pendant la combustion de l'acide benzoIque. Wcal = Capacité
calorifique de la bombe.
AO = Difference de temperature.
Wcal = 6084.2cal /26°C = 2340.07cal OC-1
Wcal = 2340.076cal. °C-1
Tableau 3-5 : Récapitulatif des données
essentielles a retenir
Données
|
Valeurs
|
Unites
|
Masse (réelle) d'eau m1
|
19998.9
|
g
|
Capacité calorifique du calorimètre (Wcal)
|
2340.076
|
cal0C-1
|
|
III-3-5-10 Détermination des chaleurs de
combustions des différentes coupes de carburants
€ Pouvoir calorifique P >> d'un
carburant
Le pouvoir calorifique P d'un carburant est la chaleur
obtenue par la combustion complete d'un kilogramme de ce carburant. Il
s'exprime KJ.Kg-1 et est compté positivement.
DURUPHTY et al [9]. Sa formule est :
P = Q/m
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Oü P = Pouvoir calorifique en KJ.Kg-1
m = masse du carburant utilisée en kg
Q = Quantite de chaleur fournie en KJ
La determination de la chaleur de combustion de notre
bioéthanol nous permettra d'en déduire son pouvoir calorifique
ainsi que celui des coupes issues des précédentes dilutions. Nous
pourrons établir des comparaisons et tirer des conclusions utiles.
III-3-5-10-1 Exemple de calcul de la Chaleur de
combustion de la coupe E100 Tableau 3-6 : Mesure des paramètres initiaux
pour la coupes E100
Paramètres
|
Valeurs
|
Unités
|
Masse du E100
|
1.16
|
g
|
Masse d'eau (m2)
|
1997.86
|
g
|
Volume de NaOH initial
|
0.00
|
ml
|
Temperature initiale (ei)
|
30.9
|
°C
|
Longueur L de fil brülé
|
4.3
|
cm
|
|
La manipulation de la combustion des coupes de carburant se
fait de manière identique a l'etalonnage de la bombe calorimetrique, a
la seule difference que la pastille d'acide benzoIque est remplacée par
la coupe de carburant considérée.
Avant d'effectuer tout calcul après avoir
étalonné la bombe calorimetrique de type PARR, il est
recommandé de corriger d'abord la capacité calorifique de ce
calorimètre.
a) La formule générale de
correction
Les formules ci-dessous nous permettent de corriger la
capacité calorifique Wcal du calorimètre a la bombe,
Comme le recommande PARR INSTRUMENT COMPANY [21].
> m1 = masse de l'eau au calibrage ;
> m2 = masse de l'eau pendant la manipulation de
détermination de la quantité de chaleur `Q `dégagée
par un combustible.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
> Wcal = capacité calorifique de la bombe
calorimétrique avant correction. > W'cal =
capacité calorifique de la bombe calorimétrique après
correction.
· Si m2 > m1 ==> W'cal = Wcal + (m2 - m1) Ce
· Si m2 < m1 ==> W'cal = Wcal - (m1 - m2) Ce
Avec Ce = Chaleur massique de l'eau : Ce = 1 J.
k-1. kg-1
b) Application au calcul
En ce qui concerne la combustion de la coupe E100, la formule de
correction sera: m2 < m1 ==> W'cal = Wcal - (m1 - m2) Ce avec Ce = 11 J.
k-1. kg-1
W'cal = 2340.076 - (1998.9 - 197.89) x 1
W'cal = 2339.066 cal
Tableau 3-7 : Evolution des températures de la
combustion de la coupe E100
|
Temps
|
Température en (°C)
|
Observation
|
|
ti
|
(Oi) 30.9
|
Précombustion
|
|
60
|
31.7
|
Combustion
|
|
90
|
32.7
|
|
105
|
33.1
|
|
120
|
33.3
|
|
135
|
33.4
|
|
150
|
33.5
|
|
(tf) 165
|
(Of) 33.6
|
|
180
|
33.6
|
Fin combustion
|
|
195
|
33.6
|
Post combustion
|
|
210
|
33.6
|
|
<c Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
c) Calcul de la difference de temperature
AU.
AU = Uf -- Ui AU = 2.7°C
AN. AO = 33.6 - 30.9 = 2.7°C
d) Determination de la chaleur de combustion
(QE100) de la coupe E100
Q1 = Qfil brule = 4.3 x 2.3 = 9.89 cal
Q2 = QNaOH = 5.8 cal (chaleur de formation des acides,
titré par un volume VNaOH de soude)
Q3 = QE100 = ?
On sait que : QT = Q1 + Q2 + Q3 et que QT = W'cal X AO
==> Q1 + Q2 + Q3 = W'cal X AO
Q3 = W'cal %o AO - (Q1 + Q2)
AN. Q3 = 2340.076 x 2.7 - (5.8 + 9.89) ==>
QE100 = 6302.5152 cal Sachant que 1cal ==> 4.18 J on a :
Note: nous avons utilisé pour
brüler les autres coupes de carburant une masse de combustible
égale a 2.36. Ramenons le calcul de Q a cette quantité pour mieux
effectuer l'étude comparative plus tard.
1.16g ==> 6302.5152 cal
2.36g ==> x cal
x cal = 2.36 x 6302.5152 / 1.16
QE100 = 12822.3585 cal ou QE100 = 53597.4595 J
QE100 = 53597.4595 J
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
e) Détermination du pouvoir calorifique
(PE100) de la coupe E100
Sachant que : QE100 = mE100 × PE100 ==> PE100 = Q3 /
mE100 or 1cal ==> 4.18 J AN. PE100 = 1822.3585 / 2.36 =
5433.2027 cal/g
PE100 = 22710.7875 J/g
PE100 = 22710.7875 kJ.kg-1
III-3-6 Détermination du point éclair du
bioéthanol
PROSKOURIAKOU [2], définit le point
éclair d'un carburant comme étant la température minimale
à laquelle les vapeurs du combustible forme avec l'air un mélange
susceptible de donner une flamme de courte durée sous l'effet d'une
cause extérieur (étincelle électrique). L'éclair
est une faible explosion qui est possible dans le mélange
d'hydrocarbures et l'air dans les limites strictement définies de
concentration. Il va plus loin et propose une formule à cet
égard.
€ Formule de calcul
La détermination du point éclair peut
être obtenu de manière théorique par la formule suivante
:
Tecl = K Teb
Où :
Tecl = Température éclaire ;
K = 0.736 constante homologuée ; Teb = Température
d'ébullition.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
CHAPITRE IV : PRESENTATIONS ET
INTERPRETATION DES RESULTATS
INTRODUCTION
Après avoir élaboré un biocarburant et
effectué sa caractérisation chimico-phisique ainsi que
l'évaluation de ses performances calorifiques, voici venu le temps des
moissons. Cette partie de notre travail est réservée à la
présentation des divers résultats obtenus pendants les
manipulations. La présentation par le système de tableaux nous
semble la mieux adapté à notre étude. Ces résultats
concernent aussi bien l'élaboration que la caractérisation
chimicocalorifique.
IV-1 RESULTATS DE LA RECOLTE ET DU PARAGE
Nous avons récolté 14.74 kg de tubercules de
manioc. Les étapes de parage et d'équeutage ont fournie 1.333kg
de déchet et 13.41kg, soit une perte évaluée à 10%
environs. Les opération de broyage, de séchage, de
décantation et de mise en poudre on livrées finalement 4kg
d'amidon, soit un rendement en amidon évalué à 30%
environs.
IV-1-1 JUSTIFICATION DU CHOIX VARIETAL
Le choix à été porté sur le manioc de
type Manihot Esculenta Grantz du fait de :
> Sa capacité à avoir un bon rendement
même sur des sols peu fertiles. > Sa résistance aux attaques
phytosanitaires.
> Son rendement à l'hectare appréciable.
> Sa teneur élevée en amidon
Toute fois, il faut préciser qu'un chercheur
camerounais, en occurrence le Dr AGUIGNIA, chef de station de l'Institut de
recherche agricole pour le développement (IRAD) de Dschang, vient de
mettre au point une variété améliorée de manioc
dont le nom de code est 80/61. Fruit de quinze
années de recherches et d'expérimentations, cette nouvelle
variété présente de nombreux avantages. Notamment son
rendement : 30 tonnes à l'hectare, contre 7 ou 9 tonnes pour la
variété actuelle. En outre, le 80/61 est prêt à la
consommation après seulement 8 à 12 mois, alors qu'avant, le
cycle durait 36 mois. Cette recherche est déjà entrée en
phase de vulgarisation, dans
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
la plaine de Mbo, près de Dschang. Compte tenu
de ses nombreux atouts, cette nouvelle variété de manioc devrait
supplanter le manihot esculenta Grantz classique. La demande en amidon
de manioc pourrait ainsi être satisfaite et le Cameroun devenir
exportateur de cet amidon suffisamment demandé sur le marché
international. 224 hectares de 80/61 suffiraient pour relever ce
défi. Nous pensons que ce défi peut enfin être
relevé, à condition, que nous trouvions un financement pour
couvrir les charges de production et que nous modernisions nos conditions
techniques d'extraction et de séchage de l'amidon.
IV-1-2 Interprétation des résultats de la
cueillette et du parage du manioc
Compte tenu de la quantité de tubercules
désirée (environs 15kg) nous avons opté pour la
méthode traditionnelle de récolte. S'il est vrai que cette
méthode est laborieuse, il n'en demeure pas moins vrai qu'elle
présente l'avantage d'avoir moins de pertes pendant la récolte
contrairement à la méthode mécanisée qui certes est
moins pénible, mais présente l'inconvénient de
générer plus de pertes pendant la récolte.
IV-2 RESULTATS DE LA FERMENTATION ET DE LA DISTILLATION
PRIMAIRE
Les mélanges inhérents à la
préparation de l'amidon devant servir pour la fermentation ont
donné environs 100 litres de jus. La distillation primaire
effectuée nous a livré 10 litres de flegme après 5 heures
de distillation. Il faut préciser qu'il était encore possible
d'en recueillir 5 litres supplémentaire, mais avec une teneur en
éthanol très médiocre due à la présence
d'une quantité importante d'eau dans les queues de
distillation.
Ce résultat aurait pu être améliorer n'eu
été la précarité du matériel utilisé.
Dans la même logique la température de distillation oscillante due
à la nature de la source de chaleur (feu de bois) a
entraîné des sur-ébullitions. La
réfrigération approximative a été à
l'origine des pertes de vapeurs d'éthanol.
IV-2-1 difficultés liées au processus de
Fermentation
Certains facteurs ont eu une influence sur le processus de
fermentation diminuant ainsi le rendement escompté. On peut citer entre
autre :
> la fermentation à ciel ouvert à une
température non maîtrisée ;
<c Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
> l'utilisation d'un matériel précaire ;
> une étanchéité approximative des
l'ustensiles de fermentation
IV-3 RESULTATS DE LA DISTILLATION FRACTIONNEE
La distillation fractionnée donc le but était la
rectification du flegme, nous a livré un produit appelé
distillat. Le distillat se présente sous la forme d'un liquide clair,
incolore, d'odeur enivrante, caractéristique aux alcools. Son
arôme de banane est lié d'une part à la matière
première et d'autres part aux circonstances particulière de la
fermentation. C'est du bioéthanol hydraté. A l'issu de cette
distillation nous avons obtenu 3,73 litres de
bioéthanol.
IV-3-1 Analyses et commentaires
La distillation fractionnée ayant pour but la
rectification du flegme, nous a permis d'obtenir 3.73 litres de
bioéthanol. Avec un rythme d'écoulement de 40 gouttes par
seconde, pour un volume de 0.0425ml par goutte. Le temps de distillation peut
être évalué à une demie journée pour 1000 ml
de produit à rectifier. La distillation fractionnée nous a
donné entière satisfaction. Toute fois, pendant la distillation
du bioéthanol, la température d'ébullition
(Oeb) est restée constante à
77°C sous une pression Pat
évaluée à 0.98089
atm, Comme l'indique les lois de l'ébulliométrie
qui stipulent que, pendant la distillation d'un corps pur, la
température d'ébullition reste constante. GROSETETE [3].
Au delà de cette considération, il existe d'autres types
de distillation permettant d'améliorer la qualité du distillat,
on peut citer entre autres :
a) La distillation sous vide: Ces techniques
de distillation visent à abaisser les températures
d'ébullition des différents constituants du mélange
à distiller, et donc permettent ainsi d'éviter (ou de
réduire) les risques de dégradation thermique.
b) La distillations sous pression : Des
distillations peuvent être effectuées sous pression afin de
permettre la séparation des composés très volatils.
c) La distillation continue: Elle consiste
à introduire une partie du distillat en tête de colonne afin
d'améliorer la pureté de la phase vapeur.
[17]
Il faut noter que la distillation de l'éthanol
hydraté en présence du benzène permet de purifier encore
plus l'éthanol. Ne disposant pas de matériel adéquat ainsi
que les proportions des produits à utiliser. Nous nous sommes
trouvé dans l'impossibilité d'hydrater d'avantage le
bioéthanol.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
IV-4 RESULTATS DE LA PYCNOMETRIE
La pycnometrie consistait à déterminer la masse
volumique Cà l'aide d'un pycnomtitre) du bioéthanol
élaboré pour nous permettre de déterminer son degré
alcoolique.
Tableau 4-1: Résultats de l'étalonnage du
pycnomètre
|
Intitulée
|
Valeur (Essai 1)
|
Valeur (Essai 2)
|
Unités
|
|
Masse du pycnomtitre vide mpv
|
14.59
|
14.59
|
g
|
|
Masse du
pycnomtitre plein
d'eau distillée mp+eau
|
24.59
|
24.58
|
g
|
|
Masse de l'eau me
|
10
|
10.1
|
g
|
|
Masse volumique de l'eau f eau
|
0.99707
|
0.99707
|
g/ml
|
|
Volume exact du pycnomtitre
|
10.02
|
10.01
|
ml
|
|
Volume moyen du pycnomtitre
|
10.01
|
ml
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Tableau 4-2 : Données et résultats
pycnométriques
|
Intitulé
|
Essai 1
|
Essai 2
|
Unités
|
|
Masse du
pycnomtitre vide mpv
|
14.57
|
14.57
|
g
|
|
Masse du
pycnomtitre
vide + éthanol
mpv+eth
|
22.58
|
22.56
|
g
|
|
Masse de l'éthanol meth
|
08.01
|
7.99
|
g
|
|
Volume du pycnomtitre vide Vpv
|
10
|
10
|
m l
|
|
Masse
volumique de l'eau f eth
|
0.801
|
0.799
|
g .m l-1
|
|
Composition vraie
|
96.00
|
96.77
|
%vol
|
|
Masse
volumique
m oyenne du bioéthanol
|
0.8
|
g .m l-1
|
|
Composition vraie
m oyenne du bioéthanol
(%A)
|
96.33 9
|
% vol
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
IV-4-1 Analyse des résultats de la
pycnométrie
Le degré d'alcool évalué à 96.33%
vol par la méthode pycnométrique vient confirmer la satisfaction
à nous donner par l'étape de la distillation fractionnée.
Quand on sait que les valeurs limites de distillation d'un flegme se situes
à 96% vol. On peu considérer que ce résultat aux dessus
des attentes est dû :
> au matériel de distillation fractionnée ultra
moderne utilisé ;
> aux nombres de passages du flegme à la tour de
distillation fractionnée (3 passages).
IV-5 DILUTION DE L'ETHANOL (96.33%VOL.) Tableau 4-3 :
Résultats des dilutions
|
Coupes
|
Volume
d'éthanol (ml)
|
Volume
d'essence
(ml)
|
Volume total du
mélange (ml)
|
|
E10
|
5.19
|
44.80
|
50
|
|
E15
|
7.78
|
42.21
|
50
|
|
E20
|
10.38
|
39.61
|
50
|
|
E85
|
44.11
|
5.88
|
50
|
|
E95
|
49.30
|
0.69
|
50
|
|
E100
|
50
|
-
|
50
|
IV-5-1 Interprétation des données de dilution
des coupes de carburants
Nous avons tenu à rester conforme aux dilutions
pratiquées dans le secteur pétrolier. Pour cela nous avons
élaboré différentes coupes de carburant. La
conformité de ces coupes peut être vérifié par
l'intermédiaire d'un dosage de chaque coupe à l'aide d'une
solution acidifié de permanganate de potassium.
Il ressort de cette étude que, l'incorporation de
l'éthanol à l'essence pose certaines difficultés
techniques tel que :
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
a) La séparation de phases: Elle se
produit quant il y a de l'eau dans l'essence à laquelle on ajoute
l'alcool. Les alcools se mélange à l'essence mais il se
mélange encore plus facilement avec l'eau. Si il y'a de l'eau dans
l'essence, une partie de l`alcool se mélangera avec l'eau plutôt
qu'avec l'essence. On obtient alors un carburant divisé en deux phases :
alcool-essence et alcool-eau. Ce phénomène peut accroître
les problèmes de corrosion et nuire par conséquent au bon
fonctionnement du moteur. pour résorber ce problème il est
important d'assécher les cuves pour éliminer toute
présence d'eau dans l'essence. Une solution à ce problème
consiste à transformer le bioéthanol en ETBE.
b) Les vaporlocks ou percolations: Le
mélange éthanol/essence (5-10%), a une pression de vapeur
(volatilité) plus élevée et tolère mal les traces
d'eau. Les conséquences en sont une augmentation des émissions
par évaporation et un risque de formation des bouchons de vapeurs par
temps très chaud et en haute altitude (vaporlock).
IV-6 RESULTATS DE LA REFRACTROMÈTRIE DES COUPES DE
BIOCARBURANT
Tableau 4-4 : Résultats des valeurs des indices
de réfraction des coupes de
carburant
|
Coupes
|
Indice de réfraction à
la
température (t)
|
Température (t) en (°C)
|
Indice de réfraction corrigée
pour
(t=20°C)
|
|
E100
|
1.3590
|
32
|
1.3542
|
|
E10
|
1.4233
|
31.9
|
1.4281
|
|
E15
|
1.4382
|
31.8
|
1.4334
|
|
E20
|
1.4350
|
31.8
|
1.4302
|
|
E85
|
1.3695
|
28.00
|
1.3663
|
|
E95
|
1.364
|
27.9
|
1.3613
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
IV-6-1 Interprétation des résultats de la
réfractomètrie
La réfractomètrie est un élément
important voir même capitale dans le contrôle de qualité
d'un carburant, car celui ci permet de caractériser un carburant en lui
attribuant un indice d'identification appelé indice de
réfraction. Le constat global que l'on peut faire dans cette
étape de notre étude est que, l'ajout de l'essence dans de
l'éthanol contribue à l'augmentation de son indice de
réfraction. Ce ci peut très bien se justifier par le fait que
l'essence est une substance composée d'une kyrielle de produits.
IV-7 RESULTATS CALORIMETRIQUES DES COUPES DE
CARBURANTS
Ces résultats se regroupent en trois grands groupes non
distincts : l'étalonnage de la soude utilisé pendant les titrages
; l'étalonnage du calorimètre à la bombe ; et la
détermination des quantités de chaleur et du pouvoir calorifique
de chaque coupe de carburants.
> m1 est la masse d'eau utilisée au calibrage
du calorimètre.
> m2 représente la masse d'eau utilisée
pendant la mesure du pouvoir calorifique d'un échantillon
donnée.
Tableau 4-5 : Résultat du dosage de la
soude
|
Intitulés
|
Essai N°1
|
Essai N°2
|
Unités
|
|
mPAK
|
0.22
|
0.23
|
g
|
|
VNaOH
|
11.7
|
11.3
|
ml
|
|
CNaOH
(exacte)
|
0.0923
|
0.0955
|
mol/l
|
|
CNaOH(moyen)
|
0.0939
|
mol/l
|
<c Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
Tableau 4-6 : Résultat du calibrage du
calorimètre
|
Paramètres
|
Valeurs
|
Unites
|
|
Longueur di fil brülé (L fil brüle)
|
5.8
|
cm
|
|
Volume de soude final:
|
5.3
|
ml
|
|
Difference de temperature (AO)
|
2.6
|
°C
|
Tableau 4-7 : Récapitulatif des données
essentielles a retenir lors du calibrage du calorimètre
|
Données
|
Valeurs
|
Unites
|
|
Masse (réelle utilisée) d'eau m1
|
19998.9
|
g
|
|
Capacité calorifique du
calorimètre (Wcal)
|
2340.076
|
cal°C-1
|
Tableau 4-8 : Résultats de la combustion de la
coupes E100
|
Paramètres
|
Valeurs
|
Unites
|
|
0i
|
30.90
|
°C
|
|
Of
|
33.60
|
°C
|
|
AU
|
2.7
|
°C
|
|
VNaOH
|
5.80
|
ml
|
|
Lfil bràle
|
4.3
|
cm
|
|
mE100
|
1.16
|
g
|
|
m2
|
1997.86
|
g
|
|
QE100
|
53597.4595
|
kJ
|
|
PE100
|
22710.7875
|
kJ.kg-1
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
10m m =1*c
33.5
33.3
33.1
32.7
30.9
t (s)
60 90 105 120 135 150 165 180 195 210
tf
Tableau 4-9: Evolution des températures (combustion de la
coupe E100)
< Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>>
Mémoire DIPET II -- ENSET de Douala
2007
Tableau 4-9 : Evolution des temperatures (combustion de
la coupe E100)
|
Temps
|
Temperature en (°C)
|
Observation
|
|
ti
|
(Oi) 30.9
|
Précombustion
|
|
60
|
31.7
|
Combustion
|
|
90
|
32.7
|
|
105
|
33.1
|
|
120
|
33.3
|
|
135
|
33.4
|
|
150
|
33.5
|
|
(tf) 165
|
(Of) 33.6
|
|
180
|
33.6
|
Fin combustion
|
|
195
|
33.6
|
Post combustion
|
Tableau 4-10 : Résultats de la combustion du
E95
|
Paramètres
|
Valeurs
|
Unites
|
|
0i
|
28.24
|
°C
|
|
Of
|
34.5
|
°C
|
|
AU
|
6.10
|
°C
|
|
VNaOH
|
13.7
|
ml
|
|
Lfil bràle
|
7.3
|
cm
|
|
mE95
|
2.36
|
g
|
|
m2
|
1998.30
|
g
|
|
QE95
|
5952.4510
|
kJ
|
|
PE95
|
25222.250
|
kJ.kg-1
|
< Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>>
Mémoire DIPET II -- ENSET de Douala
2007
Tableau 4-11 : Evolutions des temperatures (combustion
coupe E95)
|
Temps
|
Temperature
s
|
Observations
|
|
ti
|
(Oi) 28.40
|
Precombustio
n
|
|
15
|
32.10
|
Debut combustion
|
|
30
|
32.55
|
Combustion
|
|
45
|
33.0
|
|
60
|
33.5
|
|
75
|
33.8
|
|
90
|
34.0
|
|
105
|
34.1
|
|
120
|
34.2
|
|
135
|
34.3
|
|
150
|
34.4
|
|
165
|
34.4
|
|
180
|
34.4
|
|
(ti) 195
|
(Of) 34.5
|
Fin combustion
|
|
210
|
34.5
|
Post combustion
|
10m m =rc
32.10
28.40
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

0
.5
34.2 34.3
34.0
34.434
34.1
33.8
33.5

33.0

32.55

15 30 45 60 75 90 105 120 135 150 165 180 195 210 225 240 255 270
285 300 t (s)
Tableau 4-11: Evolution des températures (combustion de la
coupe E95)
<c Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
Tableau 4-12 : Résultats de la combustion du
E85
|
Paramètres
|
Valeurs
|
Unites
|
|
0i
|
28.20
|
°C
|
|
Of
|
38.10
|
°C
|
|
AU
|
9.9
|
°C
|
|
VNaOH
|
12.70
|
ml
|
|
Lfil brûlé
|
6.10
|
cm
|
|
mE85
|
2.36
|
g
|
|
m2
|
1998.41
|
g
|
|
QE85
|
96.8055
|
kJ
|
|
PE85
|
410193.1131
|
kJ.kg-1
|
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Tableau 4-13 : Evolutions des températures
(combustion coupe E85)
|
Temps
|
Température
s
|
Observations
|
|
ti
|
(Oi) 28.20
|
Precombustio
n
|
|
15
|
29.70
|
Debut combustion
|
|
30
|
32.7
|
Combustion
|
|
45
|
33.50
|
|
60
|
34.30
|
|
75
|
35.10
|
|
90
|
36.0
|
|
105
|
36.50
|
|
120
|
37.0
|
|
135
|
37.3
|
|
150
|
37.7
|
|
165
|
37.8
|
|
180
|
38.0
|
|
(ti) 195
|
(0f) 38.1
|
Fin
combustion
|
|
210
|
38.1
|
Post combustion
|
«Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»

Tableau 4-13: Evolution des températures (combustion coupe
E85)
12mm=15s
36.00
38.0 38.1
37.7 3708
15 30 45 60 75 90 105 120 135 150 165 180 195 210 225 240 255 270
285 300
t (s)
0
10m m =rc
37.3
37.0
36.50
36.00
35.10
34.30
33.50
32.70
29.70
28.20
Mémoire DIPET II - ENSET de Douala
2007
< Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala 2007 4-14 :
Tableau Résultats de la combustion du E20
|
Paramètres
|
Valeurs
|
Unites
|
|
0i
|
28.60
|
°C
|
|
Of
|
39.70
|
°C
|
|
A0
|
11.10
|
°C
|
|
VNaOH
|
4.70
|
ml
|
|
Lfil bràle
|
7.50
|
cm
|
|
mE20
|
2.36
|
g
|
|
m2
|
1999.08
|
g
|
|
QE20
|
108.49144
|
kJ
|
|
PE20
|
45970.9520
|
kJ.kg-1
|
Tableau 4-15 : Evolutions des temperatures (combustion
coupe E20)
|
Temps
|
Temperatures
|
Observations
|
|
ti
|
(Oi) 28.20
|
Precombustion
|
|
15
|
29.70
|
Debut combustion
|
|
30
|
32.7
|
Combustion
|
|
45
|
33.50
|
|
60
|
34.30
|
|
75
|
35.10
|
|
90
|
36.0
|
|
105
|
36.50
|
|
120
|
37.0
|
|
135
|
37.3
|
|
150
|
37.7
|
|
165
|
37.8
|
|
180
|
38.0
|
|
(ti) 195
|
(Of) 38.1
|
Fin combustion
|
|
210
|
38.1
|
Post combustion
|
«Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
36.00

0
10m m =1:c
38.1
3708
12mm=15S
38.0
37.7
37.3
37.0
36.50
36.00
35.10
34.30
33.50
32.70
29.70
28.20
15 30 45 60 75 90 105 120 135 150 165 180 195 210 225 240 255 270
285 300 t (s)
Tableau 4-15: Evolution des températures (combustion coupe
E20)
<c Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
Tableau 4-16 : Résultats de la combustion du
E15
|
Paramètres
|
Valeurs
|
Unites
|
|
Of
|
41.40
|
°C
|
|
AU
|
14.80
|
°C
|
|
VNaOH
|
10.40
|
ml
|
|
Lfil brûlé
|
8.90
|
cm
|
|
mE15
|
2.36
|
g
|
|
m2
|
1998.96
|
g
|
|
QE15
|
144.6411
|
kJ
|
|
PE15
|
61288.6173
|
kJ.kg-1
|
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Tableau 17 : Evolutions des températures
(combustion coupe E15)
|
Temps
|
Température
s
|
Observations
|
|
ti
|
(Oi) 26.30
|
Precombustio
n
|
|
15
|
27.70
|
Debut combustion
|
|
30
|
30.40
|
Combustion
|
|
45
|
33.10
|
|
60
|
35.0
|
|
75
|
36.40
|
|
90
|
37.80
|
|
105
|
38.60
|
|
120
|
39.10
|
|
135
|
39.70
|
|
150
|
40.20
|
|
165
|
40.50
|
|
180
|
40.60
|
|
195
|
40.90
|
|
210
|
41.00
|
|
(ti) 225
|
(Or) 41.10
|
Fin combustion
|
|
240
|
41.10
|
Post combustion
|
|
255
|
41.10
|
|
270
|
41.10
|
|
«Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
0


41.00
41.10
40.90
40.50 40.60

40.20

10m m =1:c
39.70

39.10






38.60
37.80
36.40 35.0 33.10 30.40
15 30 45 60 75 90 105 120 135 150 165 180 195 210 225 240 255 270
285 300 t (s)
Tableau 17: Evolution des températures (combustions coupe
E15)
<c Essai d'élaboration et analyse
chimico-calorifiaue d'un biocarburant a base de manioc>
Mémoire DIPET II -- ENSET de Douala
2007
Tableau 4-18 : résultats de la combustion du
E10
|
Paramètres
|
Valeurs
|
Unites
|
|
0i
|
28.60
|
°C
|
|
Of
|
43.60
|
°C
|
|
AU
|
15.00
|
°C
|
|
VNaOH
|
16.10
|
ml
|
|
Lfil brûlé
|
9.40
|
cm
|
|
mE10
|
2.36
|
g
|
|
m2
|
1998.25
|
g
|
|
QE10
|
146.5224
|
kJ
|
|
PE10
|
62085.77
|
kJ.kg-1
|
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Tableau 4-19 : Evolutions des températures
(combustion de la coupe E10)
|
Temps
|
Températures
|
Observations
|
|
ti
|
(Oi) 31.40
|
Precombustion
|
|
15
|
35.80
|
Debut combustion
|
|
30
|
37.30
|
Combustion
|
|
45
|
38.90
|
|
60
|
39.90
|
|
75
|
41.50
|
|
90
|
42.00
|
|
105
|
42.40
|
|
120
|
42.70
|
|
135
|
42.09
|
|
150
|
43.0
|
|
165
|
43.20
|
|
180
|
43.30
|
|
195
|
43.40
|
|
210
|
43.50
|
|
225
|
43.50
|
|
240
|
43.50
|
|
255
|
43.50
|
|
(ti) 270
|
(0f) 43.60
|
Fin combustion
|
|
285
|
43.60
|
Post combustion
|
|
300
|
43.60
|
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007

O
12mm=15S
10m m =Vc
43.50 .4 43.30 43.20 43.0
42.09
42.70
42.40
42.00
41.50
39.90
38.90
37.30
35.80
31.40
t (S)
15 30 45 60 75 90 105 120 135 150 165 180 195 210 225 240 255 270
285 300
Tableau 4-19: Evolution des températures (combustion de
la coupe E10)
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
IV-7-1 Analyse des résultats de la
calorimétrie à la bombe
Sachant que le pouvoir calorifique de l'éthanol anhydre
est de 21300 kJ.kg-1 on voit bien que notre bioéthanol
(22710,785kJ.kg-1), a un pouvoir calorifique
légèrement supérieur à celui de l'éthanol
anhydre. Ce ci peu s'expliquer par la présence d'eau donc
l'énergie calorifique s'est ajouté à celle de notre
bioéthanol.
Ce ci confirme les travaux menés par : ASADJEU
et al [16], qui a montré que la présence d'eau en des
proportions bien définie peu contribuer à l'augmentation le
pouvoir calorifique : l'éthanol. L'essence ayant un pouvoir calorifique
de 42500 kJ/kg selon les études menées
par DURUPHY et al [9], on remarque tout de suite que notre
bioéthanol de pouvoir calorifique de 22710.7875
kJ.kg-1 est inférieur à celui de
l'essence. Ceci confirme une fois de plus les travaux menés par
GNANSOUMOU et DAURIAT. [13] sur les potentialités
calorifiques du bioéthanol. Avec un tel pouvoir calorifique il est
important d'augmenter le taux de compression des véhicules classiques si
l'on veut utiliser l'éthanol pur dans les moteurs à combustion
interne. Un taux de compression de 15 suffirait à satisfaire un tel
moteur.
IV-9 POINT ECLAIR DU BIOETHANOL
Le calcul du point éclair de notre bioéthanol
nous a donné : Tecl = 56.672 °C. Suivant les
travaux menés par BIOLO BESSALA et al [29], il ressort
que les températures d'ébullitions des carburants varient en
fonction de la qualité du carburant le tableau ci-dessous nous donne les
températures d'ébullitions des carburants issue respectivement de
la SONARA ; MOBILE OIL. TOTAL CAMEROUN.
Tableaux 4 - 20 Température d'ébullition de
quelques carburant locaux
|
Origine du carburant
|
Températures d'ébullitions
|
Unité
|
|
Carburant SONARA
|
41
|
oC
|
|
Carburant MOBILE
|
29
|
oC
|
|
Carburant TOTAL
|
30
|
oC
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
A partir des températures d'ébullitions des
différents carburants inscrits dans le tableau ci-dessus on peut en
déduire leurs différents points éclair
PROSKOURIAKOU [2].
- Carburant SONARA : Tecl = 30.176°C ; -
Carburant MOBILE : Tecl = 21.344°C ; - Carburant TOTAL : Tecl =
22.08°C.
Il s'avère que le point éclair de notre
éthanol est largement supérieur à celui de ces carburants.
Ce ci prédispose notre éthanol à un indice d'octane
élevé et voudrait dire qu'il ne présente pas de
problème d'auto inflammation ni d'ajout d'aditif comme l'exige les
essences ordinaires. De part la valeur de son point éclair
élevé, l'éthanol est moins volatil que les essences
à basse température. C'est pourquoi les véhicules
fonctionnant à l'éthanol pur auront un démarrage à
froid difficile.
Ce problème peut être endigué en installant
un dispositif de pulvérisation d'essence ou un système de
préchauffage des vapeurs d'éthanol au démarrage.
CONCLUSION
Eu égard aux résultats obtenus après
élaboration et analyse, on peut affirmer sans ambages que le
bioéthanol, par nous produit, respecte les normes liées à
la production d'un biocarburant et peut par conséquent être
utilisé dans les moteurs à allumage commandé comme additif
(E5) ou substitue à l'essence (dans ce cas le moteur nécessite
des modifications).
CHAPITREV: SUGGESTIONS ET PERSPECTIVES
Le développement de la filière bio carburant a
fait ses preuves ailleurs, notamment au Brésil, aux Etats-Unis et en
Indonésie. Compte tenu de ses nombreux atouts, le Cameroun gagnerait
à suivre l'exemple de ces pays sus cités pour faire de la
filière sucre le fer de lance de son économie.
V-1 ATOUTS DU CAMEROUN EN MATIERE DE PRODUCTION DE
BIOCARBURANTS
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
Le Cameroun est un pays qui possède d'énorme
potentialité agro climatique de part sa situation géographique au
dessus de l'équateur. Il possède également de vastes
étendues de forêts encore inexploitées pouvant permettre le
développement d'une agriculture intensive. De grande écoles et
organisme de recherche ont été crée pour promouvoir le
développement des techniques agricoles (CRA, ETA, IRAD...).Toutes ses
potentialités peuvent contribuer au développement de la
filière des biocarburant au Cameroun à travers la production de
masse des cultures traditionnelles à l'instar du manioc.
V-2 SUGGESTIONS ADRESSEES AUX POUVOIRS PUBLICS
La réussite de la filière biocarburant au
Cameroun passe par le développement des nouvelles cultures de rente
à l'instar du maïs et du manioc. C'est pour quoi les pouvoirs
publics devraient revoir leur stratégie en matière de politique
agricole.
En effet, jusqu'à une date récente, l'aide
à la recherche et l'assistance financière au Cameroun ont
longtemps été dirigées vers le secteur des cultures
d'exportation (café, cacao) au dépend de la production
vivrière. La chute des cours des matières premières sur
les marchés mondiaux a porté préjudice à
l'économie nationale et au secteur agricole en particulier. Eu
égard à cela, et compte tenu des enjeux actuels liés
à la production de biocarburant à base des
végétaux, la politique agricole du Cameroun devrait se tourner
désormais vers un accroissement de la production vivrière
à l'instar du manioc ou du maïs destinés à la fois
à l'alimentation et à la transformation
énergétique. Le Cameroun devrait donc :
+ Mettre à la disposition des agriculteurs des semences,
bouture et plantes améliorer en vue de relever considérablement
le niveau de production ;
+ Encourager la population des zones rurales à
exploiter les terres agricoles et celles mise en jachère au profit des
plantes destinées à la transformation énergétique,
à travers des campagnes de sensibilisation ;
+ Subventionner la culture des plantes destinées à
la production des biocarburants et
aussi mettre à la disposition des agriculteurs, des
experts et des organismes spécialisés
dans l'étude des plantes à l'instar du PNDRT, de
l'IRAD ou du PNVRA ;
+ Susciter l'intérêt des grands groupe
internationaux à travers l'organisation des
séminaires et des rencontres pour favoriser une
éventuelle délocalisation des
entreprises productrices de biocarburant.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
+ Faire connaître au agriculteurs le bien fonder des
biocarburant en leurs faisant par exemples conduire des véhicules
consommant du bioéthanol.
+ Faire intervenir les medias de masse dans la vulgarisation
et la promotion des biocarburants
Toutes ces dispositions prises par les pouvoirs publics
Camerounais auront pour conséquence de réduire l'exode rural, la
création d'emplois qui par voie de conséquence contribuerons
à « booster » l'économie nationale.
V-3 IMPACT ENVIRONNEMENTAL DES BIOCARBURANTS AU
CAMEROUN
Le secteur des transports en particulier celui du Cameroun
où les deux tiers du parc automobile sont constitués de
véhicule d'occasion est celui dont la contribution à
l'augmentation des émissions de GES est le plus rapide. Les
biocarburants contribueront à réduire ces GES.
V-4 BIOCARBURANTS ET DEVELOPPEMENT DE L'ECONOMIE DU
CAMEROUN
V-4-1 Le Secteur agricole
Le développement de la production des biocarburants
constitue une alternative intéressante pour l'agriculture, car ; elle
offre des opportunités de mises en culture de nouvelles terres. Mais, il
n'aura d'impact réel surtout dans la lutte contre la pauvreté que
si les programmes de production des cultures de rentes sont conduits par les
producteurs ruraux. Il est vrai que l'Etat camerounais s'est engagé
depuis déjà plusieurs années à faire de
l'agriculture le fer de lance du développement économique du
Cameroun à travers des projets tels que : le PNVRA ; les comis
agro-pastoraux et autres. Mais très souvent ces projets ne sont toujours
pas suivis jusqu'à la base c'est-à-dire jusqu'aux GIC et
agriculteurs.
V-4-2 L'emploi
Le développement de la production des biocarburants
pourra générer des emplois et des revenus soutenus en milieux
rurals, ce qui aura un impact certain sur l'exode rural et sur
l'économie.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
V-4-3 Indépendance énergétique
Avec les biocarburants produits à partir des plantes,
une contribution importante peut être attendue dans le but de
réduire notre dépendance énergétique vis à
vis des pays producteur de pétrole et résorber le déficit
énergétique observé ces dernières années.
V-5 DILEMME ENERGIE CONTRE SECURITE ALIMENTAIRE
L'inquiétude des populations quant à
l'utilisation des plantes alimentaires à l'usage
énergétiques peut être fondé. En effet on est
confronté à un problème majeur : ce sont les mêmes
plantes qui alimentent les hommes leurs bêtes et les moteurs de leurs
machines. On n'assiste à une espèce de compétition entre
les sources de biocarburants et les sources d'alimentation. Ceci pose le
dilemme énergie contre sécurité alimentaire qui peut
conduire à surclasser les productions alimentaire au profit de
l'énergie. La conséquence immédiate pourra être la
compromission de l'autosuffisance alimentaire si importante pour notre pays.
Il convient donc de veiller très sérieusement
à cette question en mettant en place une politique et un cadre
réglementaire adéquat.
CONCLUSION
Compte tenu des potentialités de l'agriculture
camerounaise, il y a lieu de s'attendre à un essor de la filière
biocarburant, ce qui ne serait pas sans conséquences positives sur le
développement de l'économie nationale. Mais, il serait judicieux
de s'intéresser à de nouvelles voies de production de
biocarburant à base de plantes non comestibles tels que : le jatropha,
les algues marines (à l'exemple des expérimentations faites en
Australie), afin d'éviter un éventuel conflit entre les plantes
alimentaires et les plantes à destination énergétique.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
CONCLUSION GENERALE
Le développement de la filière biocarburant au
Cameroun revêt une grande actualité, dans le contexte actuel de la
flambé des prix du pétrole, l'augmentation des effets
néfastes du réchauffement climatique lié à
l'utilisation des carburants fossiles et la non valorisation des terres
cultivables. Il constitue aussi une voie d'avenir crédible, riche en
retombés technologiques et financières surtout dans le domaine
agricole.
Notre étude axée sur l'élaboration d'un
biocarburant à base de manioc avait pour principal objectif, la
transformation de l'amidon de manioc en éthanol, destiné à
être utilisé dans les moteurs à combustion interne, comme
carburant. Au sortir de cette étude, corroboré par les analyses
chimico-calorifiques, on peut affirmer que cet objectif a été
atteint.
L'essentiel de notre travail a consisté à
extraire l'amidon du manioc, le fermenter, puis le distiller et rectifier. Les
analyses chimico-calorifiques effectuées nous ont permis de
caractériser et de vérifier les performances calorifiques de ce
bioéthanol.
L'atteinte des objectifs par nous fixer ne s'est pas faites
sans contraintes : L'identification du manioc de type Manihot Esculenta
Grantz s'est avérée difficile. Il a fallu l'expertise des
Ingénieurs agronomes de l'IRAD et du PNDRT. Par manque de
matériel adéquat, la distillation primaire, étape
importante de l'élaboration du bioéthanol s'est faite de
manière artisanale à AYENE à quelques encablures
de Yaoundé, influençant sur le rendement en terme de
quantité et de qualité. De même, la détermination du
pouvoir calorifique des différentes coupes de carburant a
été laborieuse, du fait des exigences de précision et
méthodologique de la manipulation.
Nous avons ainsi obtenue un bioéthanol hydraté
à 96.33%vol. Nous aurions souhaité obtenir un bioéthanol
anhydre à 100%vol. Mais, faute de matériel approprié pour
une distillation en présence de Benzène, ce
résultat escompté n'a pas été atteint. Nous aurions
également souhaité effectuer les mesures du pH et de
viscosité du bioéthanol par nous réaliser.
C'est ainsi que nous lançons un vibrant appel à
tous ceux qui, de par leur expertise, pourrons contribuer à combler ce
manquement. Aussi, les critiques et les suggestions pouvant contribuer à
l'amélioration de ce travail seront reçus avec grand
intérêt.
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
REFERENCES BIBLIOGRAPHIQUES
[1] TALOR, C.F. The internal combustion engine in the theory
and practice, CRC press, Tome 2, Colombia 1998
[2] PROSKOURIAKOU, V. Chimie du pétrole et des
gaz, Edition Mir. Moscou, 1983
[3] GROSSETETE, C. ; GENEVIEVE, B. et GUY, B. Physiques
Chimie 2e, Edition Belin, Paris 1996
[4] NDJOCK BAYOCK, F.M. Vulgarisation des méthodes de
réduction des émission de NOx, CO, HC imbrûlés et
proposition d'une corrélation analico-empirique entre les NOx, et CO
dans les chambres de combustion des turbines à gaz Mémoire de
fin de second cycle, ENSET de Douala, GME5, juin 2006
[5] EBENGUE NDJIMA, A. et al. Réhabilitation des
détecteurs de fumée de l'atelier de mécanique automobile
de l'ENSET et analyse des gaz d'échappement des moteurs à
combustion interne, Mémoire de fin de second cycle, ENSET de Douala,
juin 2005
[6] File//f : bio carburant.html, mise à jour 10
Avril 2007.
[7] BARTHELEMIE DE TEUX : Utilisation de l'huile de palme
comme combustible dans le moteur Diesel, INC Paris, 2003-2004
[8] DIKONGUE, C.B. Transformation de l'huile de palmiste en
carburant par reformage catalytique, Mémoire de maîtrise en
physiques, Faculté des sciences de l'université de Douala,
2005-2006
[9] DURUPHTY, A.; DURUPHTY, O. et GIACINO, M. Chimie
1re S, Edition Hachette Education, Paris 1994
[10] ROBERT, C. Chimistry and physics CRC press. Inc.,
7th Edition, page D1, Bocaranton Florida, 1989-1990.
[11] ROBERT, P. Chimie industrielle, Madison,
2ème édition Paris 1997.
[12] ROBERTS, J.D. Chimie organique moderne. Belin,
paris, 2001
[13] WWW.Eners.ch, mise à jour le 2 mars 2007.
[14] CABURET, A ; LEBOT, V. et RAFAILLAC, J.P. Mémento
de l'agronome Hachette, Paris 2002.
[15]TONNEAU, J. Un mémento pour le
laboratoire, Edition universitaire. Paris 2002
«Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
[16] ASADJEU, L. ;ENNYEGUE ONDOBO, S. et TEDJO, J.S.
Préparation d'un combustible économique à base d'alcool
éthylique, Projet de fin de cycle secondaires en Chimie
Industrielle, Lycée Technique de Nkolbisson, Mai 2003.
[17]
http://fr.Wikipedia.org/wiki/Distillation,
date de mise à jour 2 Mars 2007 à 14h58
[18] NDJANA, M. et MEBENGA,D., Analyse de la bière de
maïs traditionnelle Projet de fin de cycle secondaires en Chimie
Industrielle, Lycée Technique de Nkolbisson, Mai 2000, p 7.
[19] ROBERT, C.W. Hand book of chemistry and physics, CRC
press, Inc, 7th edition, Bocaranton Florida, 1989-1990.
[20]
http://réa.decclic.qc.ca/dec_virtuel
chimie/202-NYA05/Chimie_générale/Laboratoire/Distillation_fractionnée/prelabo.htm
date de mise à jour 4 avril 2007.
[21] PARR INSTRUMENT COMPANY, Bomb calorimetric
System bulletin 1200/1-87, IMOLINE USA. 1987.
[22] http:/
fr.Wikipédia.org/wiki/€
éthanol, mise à jour 01 avril 2007
[23]
http://fr.Wikipédia.org/wiki/polycarburant,
mise à jour 29 avril 2007
[24] www.La farine, la levée, la fermentation.htm,
mise à jour 15 mai 2007
[25] http ://fr.PhotoTP.grain d'amidon de manioc.htm,
mise à jour 2 avril 2007
[26] Le jatropha, arbre à pétrole, journal
libération N° 6061 du 07et08 avril 2007 France.
[27]
WWW.IFP.fr, mise à jour le
04 mars 2007
[28]
www.Cedcameroun.Org date de
mise à jour 06 avril 2007-06-2007
[29] BIOLO BESSALA, M. J. et BISSECK THAKOUNTE, M. R. Analyse
comparative des carburants « super » Projet de fin de cycle
secondaires en Chimie Industrielle, Lycée Technique de
Nkolbisson, Mai 2005, p 27.
cc Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
ANNEXES
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
ANNEXE I: PROBLEMES ECOLOGIQUES ET PHYTOSANITAIRES DU
MANIOC A- Principaux problèmes phytosanitaires du manioc
[14]
|
Principaux problèmes phytosanitaires
|
Lieux
|
Note(1 )
|
|
Mosaïque africaine du manioc
(gémini-virus
transmis par la mouche blanche
Bemisia tabaci)
|
Afrique
|
***
|
|
Bactériose vasculaire (Xanthomonas campestris
pv.
Manihotis, ou X. axonopodis en Amérique Latine)
|
Afrique, Amérique latine
|
***
|
|
Bactériose de tiges (Erwinia carotovora)
|
Amérique latine
|
*
|
|
Anthracnose (Colletrotrichum glocosporiodes f.Sp
manihotis
Henn.)
|
Zones humides
|
*
|
|
Superélongation (Sphaceloma manihoticola)
|
Amérique latine
|
*
*
|
|
Cercosporioses (Cercospora henningsii, C. caribaea)
|
Inde, Afrique
|
|
Pouriture des tiges et des racines (Sclerotium,
Fusarium,
Phytophtora, Collectotrichum
|
Zones humides, Afrique,
Amérique latine
|
*
|
|
Cochenille farineuse du manioc (Phenacoccus
manihoti
Mat-Ferr. Ou Ph. Herren en Amerique
Latine)
|
Afrique Amérique latine
|
***
|
|
Acariens verts (Mononychellus tanajoa ou M.
progresivus,
oligonichus gossypii)
|
Afrique, Amérique latine
|
**
|
|
Mouches blanches (Aleurotrachelus sociali,
Trialeurodes
variabillis)
|
Amérique latine
|
*
|
|
Criquets (zonocerus variegatus L)
|
Afrique
|
*
*
|
|
Termites
|
Afrique Amérique latine
|
(1) Importance: * = faible, ** = moyenne, *** =
forte
A- Effet des facteurs du milieu sur la production du
manioc[14]
|
Facteurs
|
Effets
|
conséquences
|
|
Rayonnement faible
|
Diminution du nombre de tiges
et de racines par plant
|
Faible couverture du sol
|
|
Sol caillouteux
|
Enracinement sinueux
|
Tubercules irréguliers et fragiles
|
|
Sol pauvre chimiquement
|
Racine tubérisées plus longues et
plus
fines
|
Repousse des aériennes pertes de
poids et de
qualité (faible % MS)
|
|
Vent fort
|
Verse des tiges
|
Pertes limitées à l'arrachage,
temps des
travaux diminués,
mauvaise qualité de la
production (faible
% MS)
|
|
Forte pluviométrie avant
arrachage
|
Reprise de croissance et
réhydratation des racines
|
Mauvaise qualité de la
production
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007
ANNEXE 2 : COMPARAISON DES CHANGEMENTS D'ETAT DES
SUBSTANCES [9]
A- Propriétés physiques des alcools et
hydrocarbures correspondants
|
Alcools
|
Hydrocarbures
(HC)
|
Masse molaire
(M)
|
Température
d'ébullition
en
°C
|
Température de
fusion en °C
|
|
CH3 OH
|
|
32
|
65
|
- 98
|
|
CH3 CH3
|
30
|
- 89
|
- 172
|
|
CH3CH2OH
|
|
46
|
78.5
|
- 117.3
|
|
CH3 CH2 CH3
|
44
|
- 42.2
|
-189.9
|
|
CH3 CH2 CH2 OH
|
|
60
|
97.2
|
- 127
|
|
CH3 CH2 CH2CH3
|
58
|
- 0.6
|
- 135
|
|
CH3 (CH2)3 CH3 OH
|
|
88
|
138
|
- 79
|
|
CH3 (CH2)4CH3
|
86
|
69
|
- 95
|
|
CH3 (CH2)8 CH2 OH
|
|
158
|
228
|
6
|
|
CH3 (CH2)9CH3
|
156
|
196
|
- 26
|
B- Chaleur molaire latente des changements
d'états de quelques corps purs
|
Composé
|
tfus
|
Qfus
(KJ.mol -1)
|
Téb
(°C)
|
Qéb
-1)
(KJ.mol
|
|
Eau
|
0.0
|
6.0
|
100.0
|
41.0
|
|
Hexane
|
- 95.3
|
13.0
|
68.7
|
31.5
|
|
Heptane
|
- 90.6
|
14.0
|
98.4
|
36.6
|
|
Cyclohexane
|
6.5
|
2.7
|
80.7
|
33.1
|
|
Benzène
|
5.5
|
9.8
|
80.1
|
33.8
|
|
Méthanol
|
- 97.7
|
3.2
|
64.5
|
37.4
|
|
Ethanol
|
- 117
|
5.0
|
78.5
|
42.6
|
|
acétone
|
- 95.4
|
5.7
|
56.2
|
30.8
|
Chaleur molaire latente des changements d'états
correspondantes sous 1.013 bars
< Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant a base de manioc>>
Mémoire DIPET II - ENSET de Douala
2007
ANNEXE 3 : Valeurs de Référence et déductives des
propriétés physico-chimique de l'éthanol [ ]
Molecular weight = 46.07 0.00% by wt. data are the same for all
coumpounds.
Relative specific Refractivity = 1.363 For values of 0.000 wt. %
solution see Table 1. Acetic Acid
|
A% By wt.
|
r
D20
4
|
D20
20
|
Cs
g / l
|
M g.mol/l
|
Cw
g/l
|
(Co - Cw) g/l
|
(n - no) x 104
|
n
|
A °C
|
O Os/kg
|
S g.mol/l
|
ii / io
|
il / à cS
|
' rhe
|
|
0.50
|
0.9973
|
0.9991
|
5.0
|
0.108
|
992.3
|
5.9
|
3
|
1.3333
|
0.20
|
0.11
|
0.057
|
1.021
|
1.026
|
9671
|
|
1.00
|
0.9963
|
0.9981
|
10.0
|
0.216
|
986.4
|
11.8
|
6
|
1.3336
|
0.40
|
0.22
|
0.116
|
1.044
|
1.050
|
95.59
|
|
1.50
|
0.9954
|
0.9972
|
14.9
|
0.324
|
980.5
|
17.8
|
9
|
1.3339
|
0.60
|
0.32
|
0.175
|
1.068
|
1.075
|
93.42
|
|
2.00
|
0.9945
|
0.9962
|
19.9
|
0.432
|
974.6
|
23.6
|
12
|
1.3342
|
0.81
|
0.44
|
0.236
|
1.093
|
1.101
|
91.31
|
|
2.50
|
0.9936
|
0.9953
|
24.8
|
0.539
|
968.7
|
29.5
|
15
|
1.3345
|
1.02
|
0.55
|
0.297
|
1.116
|
1.126
|
89.42
|
|
3.00
|
0.9927
|
0.9945
|
29.8
|
0.646
|
962.9
|
35.3
|
18
|
1.3348
|
1.23
|
0.66
|
0.359
|
1.138
|
1.149
|
87.70
|
|
3.50
|
0.9918
|
0.9936
|
34.7
|
0.754
|
957.1
|
41.1
|
21
|
1.3351
|
1.44
|
0.77
|
0.421
|
1.159
|
1.171
|
86.08
|
|
4.00
|
0.9910
|
0.9927
|
39.6
|
0.860
|
951.4
|
46.9
|
24
|
1.3354
|
1.65
|
0.89
|
0.484
|
1.181
|
1.194
|
84.52
|
|
4.50
|
0.9902
|
0.9919
|
44.6
|
0.967
|
945.6
|
52.6
|
27
|
1.3357
|
1.87
|
1.01
|
0.547
|
1.203
|
1.217
|
82.98
|
|
5.00
|
0.9893
|
0.9911
|
49.5
|
1.074
|
936.9
|
58.4
|
31
|
1.3360
|
2.09
|
1.12
|
0.611
|
1.226
|
1.242
|
81.40
|
|
5.50
|
0.9885
|
0.9903
|
54.4
|
1.180
|
934.2
|
64.1
|
34
|
1.3364
|
231
|
1.24
|
0.675
|
1.250
|
1.267
|
79.81
|
|
6.00
|
0.9878
|
0.9895
|
59.3
|
1.286
|
928.5
|
69.7
|
37
|
1.3367
|
2.54
|
1.36
|
0.739
|
1.276
|
1.294
|
78.24
|
|
6.50
|
0.9870
|
0.9887
|
64.2
|
1.393
|
922.8
|
75.4
|
41
|
1.3370
|
2.76
|
1.49
|
0.804
|
1.301
|
1.321
|
76.69
|
|
7.00
|
0.9862
|
0.9880
|
69.0
|
1.498
|
917.2
|
81.0
|
44
|
1.3374
|
2.99
|
1.61
|
0.870
|
1.328
|
1.349
|
75.16
|
|
7.50
|
0.9855
|
0.9872
|
73.9
|
1.604
|
911.6
|
86.7
|
48
|
1.3377
|
3.23
|
1.74
|
0.936
|
1.355
|
1.378
|
73.66
|
|
8.00
|
0.9847
|
0.9865
|
78.8
|
1.710
|
906.4
|
92.3
|
51
|
1.3381
|
3.47
|
1.86
|
1.003
|
1.382
|
1.407
|
72.19
|
|
8.50
|
0.9840
|
0.9857
|
83.6
|
1.816
|
900.4
|
97.9
|
55
|
1.3384
|
3.71
|
2.00
|
1.071
|
1.411
|
1.436
|
70.75
|
|
9.00
|
0.9833
|
0.9850
|
88.5
|
1.921
|
894.8
|
103.4
|
58
|
1.3388
|
3.96
|
2.13
|
1.140
|
1.439
|
1.467
|
69.34
|
|
9.50
|
0.9826
|
0.9843
|
93.3
|
2.026
|
889.2
|
109.0
|
62
|
1.3392
|
4.21
|
2.27
|
1.210
|
1.468
|
1.497
|
67.97
|
|
10.00
|
0.9819
|
0.9836
|
98.2
|
2.131
|
883.7
|
114.5
|
65
|
1.3395
|
4.47
|
2.40
|
1.282
|
1.498
|
1.529
|
66.62
|
|
11.00
|
0.9805
|
0.9822
|
107.9
|
2.341
|
872.6
|
125.6
|
73
|
1.3403
|
5.00
|
2.69
|
1.426
|
1.560
|
1.594
|
63.99
|
|
12.00
|
0.9792
|
0.9809
|
117.5
|
2.550
|
861.7
|
136.6
|
80
|
1.3410
|
5.56
|
2.99
|
1.572
|
1.624
|
1.662
|
61.44
|
|
13.00
|
0.9778
|
0.9796
|
127.1
|
2.759
|
850.7
|
147.5
|
87
|
1.3417
|
6.13
|
3.30
|
1.722
|
1.691
|
1.732
|
59.03
|
|
14.00
|
0.9765
|
0.97.82
|
136.7
|
2.967
|
839.8
|
158.4
|
95
|
1.3425
|
6.73
|
3.62
|
1.874
|
1.757
|
1.803
|
56.80
|
|
15.00
|
0.9752
|
0.9769
|
146.3
|
3.175
|
828.9
|
169.3
|
102
|
1.3432
|
17.36
|
3.96
|
2.030
|
1.822
|
1.872
|
54.78
|
|
16.00
|
0.9739
|
0.9756
|
155.8
|
3.382
|
818.1
|
180.2
|
110
|
1.34.47
|
8.69
|
4.67
|
2.351
|
1.951
|
2.010
|
51.16
|
|
17.00
|
0.9726
|
0.9743
|
165.3
|
3.589
|
807.3
|
191.0
|
117
|
1.3447
|
8.69
|
4.67
|
2.351
|
1.951
|
2.010
|
51.16
|
|
18.00
|
0.9713
|
0.9730
|
174.8
|
3.795
|
796.5
|
201.8
|
125
|
1.3455
|
9.40
|
5.05
|
2.516
|
2.015
|
2.078
|
49.54
|
|
19.00
|
0.9700
|
0.9717
|
184.3
|
4.000
|
785.7
|
212.5
|
132
|
1.3462
|
10.14
|
5.45
|
2.683
|
2.077
|
2.146
|
48.03
|
|
20.00
|
0.9687
|
0.9704
|
193.7
|
4.205
|
774.9
|
223.3
|
140
|
1.3469
|
10.92
|
5.87
|
2.853
|
2.138
|
2.212
|
46.68
|
|
22.00
|
0.9660
|
0.9677
|
212.5
|
4.613
|
753.5
|
244.8
|
154
|
1..3484
|
12.60
|
6.78
|
3.203
|
2.254
|
2.338
|
44.27
|
|
24.00
|
0.9632
|
0.9649
|
231.2
|
5.018
|
732.0
|
266.2
|
168
|
1.3498
|
14.47
|
7.78
|
3.568
|
2.365
|
2.460
|
42.20
|
|
26.00
|
0.9602
|
0.9619
|
249.7
|
5.419
|
710.6
|
287.7
|
181
|
1.3511
|
16.41
|
8.82
|
3.920
|
2.471
|
2.579
|
40.39
|
|
28.00
|
0.9571
|
0.9588
|
268.0
|
5.817
|
689.1
|
309.1
|
194
|
1.35.24
|
18.43
|
9.91
|
4.262
|
2.576
|
2.696
|
38.75
|
|
30.00
|
0.9539
|
0.9556
|
286.2
|
6.211
|
667.7
|
330.5
|
205
|
1.3535
|
20.47
|
11.01
|
4.583
|
2.662
|
2.796
|
37.49
|
|
32.00
|
0.9504
|
0.9521
|
304.1
|
6.601
|
646.3
|
352.0
|
216
|
1.3546
|
22.44
|
12.07
|
|
2.721
|
2.869
|
36.68
|
|
34.00
|
0.9468
|
0.9485
|
321.9
|
6.988
|
624.9
|
373.3
|
227
|
1.3557
|
24.27
|
13.05
|
|
2.762
|
2.923
|
36.13
|
|
36.00
|
0.9331
|
0.9447
|
339.5
|
7.369
|
603.6
|
394.7
|
236
|
1.3566
|
25.98
|
13.97
|
|
2.797
|
2.971
|
35.69
|
|
38.00
|
0.9392
|
0.9408
|
356.9
|
7.747
|
582.3
|
415.9
|
245
|
1.3575
|
27.62
|
14.85
|
|
2.823
|
3.012
|
35.35
|
|
40.00
|
0.9352
|
0.9369
|
374.1
|
8.120
|
561.1
|
437.1
|
253
|
1.3583
|
29.26
|
15.73
|
|
2.840
|
3.043
|
35.14
|
|
42.00
|
0.9311
|
0.9328
|
391.1
|
8.488
|
540.0
|
458.2
|
260
|
1.3590
|
3098
|
16.66
|
|
2.846
|
3.063
|
35.06
|
|
44.00
|
0.9269
|
0.9286
|
407.8
|
8.853
|
519.1
|
479.2
|
268
|
1.3598
|
32.68
|
17.57
|
|
2.844
|
3.074
|
35.09
|
|
46.00
|
0.9227
|
0.9243
|
424.4
|
9.213
|
498.2
|
500.0
|
274
|
1.3604
|
34.36
|
18.47
|
|
2.837
|
3.081
|
35.18
|
|
48.00
|
0.9193
|
0.9199
|
440.8
|
9.568
|
477.5
|
520.7
|
280
|
1.3610
|
36.04
|
19.38
|
|
2.826
|
3.083
|
35.32
|
|
50.00
|
0.9139
|
0.9155
|
457.0
|
9.919
|
457.0
|
541.3
|
286
|
1.3616
|
37.67
|
20.25
|
|
2.807
|
3.078
|
35.55
|
|
52.00
|
0.9095
|
0.9111
|
472.9
|
10.265
|
436.5
|
561.7
|
291
|
1.3621
|
39.20
|
21.08
|
|
2.783
|
3.066
|
35.87
|
|
54.00
|
0.9049
|
0.9065
|
488.7
|
10.607
|
416.3
|
582.0
|
296
|
1.3626
|
40.65
|
21.85
|
|
2.749
|
3.044
|
36.31
|
|
56.00
|
0.9004
|
0.9020
|
504.2
|
10.944
|
396.2
|
602.1
|
300
|
1.3630
|
42.06
|
22.61
|
|
2.696
|
3.000
|
37.02
|
|
58.00
|
0.8958
|
0.8974
|
519.5
|
11.277
|
376.2
|
622.0
|
304
|
1.3634
|
43.49
|
23.38
|
|
2.627
|
2.938
|
38.00
|
|
60.00
|
0.8911
|
0.8927
|
534.7
|
11.606
|
356.5
|
641.8
|
308
|
1.3638
|
44.93
|
24.15
|
|
2.542
|
2.858
|
39.26
|
|
62.00
|
0.8865
|
0.8880
|
549.6
|
11.930
|
336.9
|
661.4
|
311
|
1.3641
|
46.28
|
24.88
|
|
2.474
|
2.796
|
40.34
|
|
64.00
|
0.8818
|
0.8833
|
564.3
|
12.250
|
317.4
|
680.8
|
315
|
1.3644
|
47.52
|
25.55
|
|
2.410
|
2.739
|
41.41
|
|
66.00
|
0.8771
|
0.8786
|
578.9
|
12.565
|
298.2
|
700.0
|
317
|
1.3647
|
48.64
|
26.15
|
|
2.342
|
2.676
|
42.61
|
|
68.00
|
0.8724
|
0.8739
|
593.2
|
12.876
|
276.2
|
719.1
|
320
|
1.3650
|
49.52
|
26.62
|
|
2.276
|
2.614
|
43.85
|
|
70.00
|
0.8676
|
0.8692
|
607.3
|
13.183
|
260.3
|
737.9
|
322
|
1.3652
|
|
|
|
2.210
|
2.552
|
45.17
|
|
72.00
|
0.8629
|
0.8644
|
621.3
|
13.486
|
241.6
|
756.6
|
324
|
1.3654
|
|
|
|
2.144
|
2.490
|
46.55
|
|
74.00
|
0.8581
|
0.8596
|
635.0
|
13.784
|
223.1
|
775.1
|
325
|
1.3655
|
|
|
|
2.078
|
2.426
|
48.03
|
|
76.00
|
0.8533
|
0.8549
|
648.5
|
14.077
|
204.8
|
793.4
|
327
|
1.3657
|
|
|
|
2.011
|
2.361
|
49.63
|
|
78.00
|
0.8485
|
0.8500
|
661.8
|
14.366
|
186.7
|
811.6
|
327
|
1.3657
|
|
|
|
1.944
|
2.296
|
51.33
|
|
80.00
|
0.8436
|
0.8451
|
674.9
|
14.650
|
168.7
|
829.5
|
328
|
1.3658
|
|
|
|
1.877
|
2.229
|
53.15
|
|
82.00
|
0.8387
|
0.8401
|
687.7
|
14.927
|
151.0
|
847.3
|
328
|
1.3657
|
|
|
|
1.804
|
2.155
|
55.31
|
|
84.00
|
0.8335
|
0.8350
|
700.2
|
15.198
|
133.4
|
864.9
|
326
|
1.3656
|
|
|
|
1.738
|
2.089
|
57.42
|
|
86.00
|
0.8284
|
0.8299
|
712.4
|
15.464
|
116.0
|
882.3
|
325
|
1.3655
|
|
|
|
1.671
|
2.021
|
59.74
|
|
88.00
|
0.8232
|
0.8247
|
124.4
|
15.725
|
98.8
|
899.4
|
323
|
1.3653
|
|
|
|
1.603
|
1.951
|
62.26
|
|
90.00
|
0.8180
|
0.8194
|
736.2
|
15.979
|
81.8
|
916.4
|
320
|
1.3650
|
|
|
|
1.539
|
1.885
|
64.85
|
|
92.00
|
0.8125
|
0.8140
|
747.5
|
16.226
|
65.0
|
933.2
|
316
|
1.3646
|
|
|
|
1.472
|
1.815
|
67.80
|
|
94.00
|
0.8070
|
0.8084
|
758.6
|
16.466
|
48.4
|
949.8
|
312
|
1.3642
|
|
|
|
1.404
|
1.743
|
71.07
|
|
96.00
|
0.8013
|
0.8027
|
769.2
|
16.697
|
32.1
|
966.2
|
306
|
1.3636
|
|
|
|
1.339
|
1.674
|
74.53
|
|
98.00
|
0.7954
|
0.7968
|
779.5
|
16.920
|
15.9
|
982.3
|
300
|
1.3630
|
|
|
|
1.270
|
1.600
|
78.59
|
|
100.00
|
0.7893
|
0.7907
|
789.3
|
17.133
|
0.0
|
998.2
|
284
|
1.3614
|
|
|
|
1.201
|
1.525
|
8310
|
« Essai d'élaboration et analyse
chimico-calorifique d'un biocarburant à base de manioc
»
Mémoire DIPET II - ENSET de Douala
2007



