|
UNIVERSITE KASDI MERBAH - OUARGLA -
FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET
SCIENCES DE
LA TERRE ET DE L'UNIVERS
|
Département des Sciences de la Nature et de la
Vie
|
|
|
MEMOIRE DE FIN D'ETUDES
En Vue De L'obtention Du Diplôme d'Etudes
Supérieures en Biologie
Option Biochimie
A THEME

Extraction de certains composés
dümiel naturel ayant effet antimicrobien
Présenté par :
Me ADOUANI Ali
Me REZZAG MOHCEN Oussama
Le 24/06/2010
Encadreur : Mr MERAH Mostefa M.C.B Univ.
Ouargla
Co-Promotrice : Melle HAMMOUDI Rokaia (magister
en biochimie). Univ.
Ouargla
Remerciements
Nous remercions DIEU tout puissant, maître des cieux et de
terre, qui nous a permis de mener à bien ce travail.
Tout d'abord on tient surtout à adresser nos plus vifs
remerciements au Dr MERAH Mostefa et Melle
HAMMOUDI Rokaia, qui nous ont permis de réaliser ce travail
sous leur direction. Nous ne saurons jamais oublier leur disponibilité,
leur assistance, leurs conseils judicieux et leur soutien moral pour nous.
Nous reme rcions vivement nos collègues
Amel, khadidja et Maliana
qui nous ont aidé pour terminer ce mémoire.
Nous remercions également tous les techniciens du
laboratoire, Mr AICHE et Melle Saadia qui
nous ont faciliter la tache et tous ceux qui ont participé de
près ou de loin pour réaliser ce travail.
A mademoiselle BOUDERHEM Amel, Mr BESSAS
Ahmed, BENMOUSSA Larbi et
KERARMA Mohamed nous adressons nos sincères
remerciements, pour leur générosité scientifique par leurs
mémoires.


Dédicaces
Au nom du DIEU clément et
miséricordieux et que le salut de DIEU, soit sur son
prophète MOHAMED

A ceux qui m'ont encouragé pour continuer mon
chemin
universitaire
Et ceux à qui je dois tant
A mes parents Ahmed et Fadjra
pour leur amour et leur support
continu
A toute ma famille mes frêres et soeurs surtout
Ezzou
A tout leur enfants : Mona ,
Doha, Dhia, Ilyas,
Marya, Israa, Mohamed,
Essam , Ritadj et surtout
Belgassem pour leur reussissement continu
A toute mes collègues de 4ème année
biochimie et microbiologie surtout Mohamed,
Otman, Khaled, Elaid,
Sihem et Meriem
Que ce travail soit le témoignage sincère et
affectueux de ma
profonde reconnaissance pour tout ce que vous avez fait pour
moi.
Ali
A ceux qui m'ont tout donné sans rien en retour


Dédicaces
Aux être qui me sont les plus chers au monde et mon amour
:
A l'amé A mes parents Med Djamel et
Fatma qui ceux donnent l'énergie et la
résistance pour termine cette étape dans ma vie.
A mes soeurs " Nassiba, Oum salama, Oum alfadle, Aicha,
Salem, Asma et Marya " et ma frères " Salem
"
A ma famille maternelle " Rezzag Mohcen "
surtout mon cousin " Belgassem "
A mes élèves de cours de ma classe
4ème année Biochimie sourtout "
Khaola, Mohamed, El aid,
Zahra ".
A ma deuxième famille organisatrice Union
Générale Estudiantine Libre " UGEL " et tous mes
frères et frangins qui groupe par la Fraternité a DIEU dans mon
organisatrice.
A tous mes amis surtout " Abderraouf,
Abdelgafour, Khaled, Otman,
Amoura, Sayaf, Hamza " et
touts mes amies dans mon cité.
A tout qui me aide peu être petite ou grand, merci à
votre gentillesse.
A vous par touts
Vos frère
Oussama
Au nom du DIEU clément et
miséricordieux qui termine par leur
aubaine tout les travaux
et
que le salut de DIEU soit sur son prophète
MOHAMED
Nous dédions ce Modeste travail :
Résumé
Le miel naturel est une substance gélatineuse,
élaboré par les abeilles, il contient de nombreux composés
tels que : les sucres, les protides, les enzymes et les composés
phénoliques (exemple : flavonoïdes).... Grace aux composés
phénoliques et la nature acide, le miel joue un rôle d'inhibition
sur les microbes.
Dans notre travail, nous avons testé l'effet
antimicrobien de ces composés phénoliques extrait de trois
échantillons différents de miel naturel : deux
échantillons sont récoltés de deux sites du territoire
algérien (miel poly floraux) ; il s'agit de Batna et de El' Oued et un
échantillon du miel importé de Soudan.
L'extraction est effectué par deux méthodes
différentes : l'extraction liquideliquide et la macération avec
méthanol/eau (80%).
Le pouvoir antimicrobien des extraits obtenus est testé
sur trois souches bactériennes ; il s'agit de Staphylococcus aureus,
Escherichia coli et Clostridium vulgaris.
Ces extraits sont classés selon de leur
efficacité dans l'ordre : hydroalcoolique, chloroformique et
acétate d'éthyle et de phase aqueuse.
Les extraits du miel de Batna montrent la meilleure
efficacité contre les souches testées que les deux autres, les
souches E. coli et Staphylococcus aureus sont les plus
sensibles à l'effet des extraits des trois échantillons de miel
que la souche Clostridium vulgaris.
Mots dles : effet antimicrobien, miel naturel,
Staphylococcus aureus, Escherichia coli et Clostridium vulgaris,
composés phénoliques.
4Î~ã
|
ã~~ ÎÇË~Òãä~
å- ÐñÐÚ ìåÚ
íõÑ~ñ õñ ó
Íå-ìä~ Çò~ÑìÐ
ðìòÐ~òÌ ÉSÒA åÚ
ÌÑÇËÚ õñ
ð2òË1ä1 ã"2ä1
.Íòäõìò~ä1
ÎÇËß~ãä~ ó
ÎÇãñÒæáÇ~
ÎÇìòÐóÒËä~
ÎÇñÒß.äl
.Íòäõìò~ä1
ÎÇË6Òãä1 ìåÚ
ðÆ~õÑÍÅ ó
ðÑÖõãÍ ã~~Ê
ÎÇÊóÒßòãä~
ìåÚ ð1òË1Ñä1
ÒòËÑä~ ÍòÕÇ~
ð~òËLäl ã.,ä1
ßåÑãñ
: ð.òË1ä1
ãA.ä1 å. ÎÇìòÚ
Ò~Ë å, Í~åÎÑ~ãä~
Íòäõìò~ä1
ÎÇËSÒãåä
ð1òËuÑä1
ÒòËÑä~ ÇæÒËÑ~1
ãã2ä1 1Ðñ ð
åA ÎÏÑõÑÓ1
Í~äÇ~ä~ Íìò~ä~ ó
íÏ~õä1 Í.1ì4 åA
ÍòÐÇ.ä1 ó
ÍìÐÇÊ Í11ìL å.
ÇãñlÐÍÅ
íÒÆ1Ò~ä1 ÈlÒÑä1
å~ ÇÑ~ãÌ
äÇÑìòÚ
ä1Ïõ.ä1
ÁÇ~ áõæÇ-ò4
áõå--
áÇã2ÑÓÇÊ
Ú~ìä~ ÍiñÒØ ó
ãÆÇÓ ãÆÇÓ
Í~ñÒØ :
åòÑ~åÑÎ~
åòÑ1ñÒ1Ê ÏãÐ
Õ~ÎÑÓáÅ~
ÍòåãÚ
|
|
Staphylococcus
|
~ :
|
ðñ
ÇñÒòÑßÊ
ÎáÇNÓ Ò~Ë ìåÚ
ÇòÑòäÇ~
ÑÇËÑ1&Å ãÐ
ÇòòåÚ áõ._ä1 ãÐ
ðÑä1
ÎÇ.åÎÑ,ãä1
|
. %80
|
) Clostridium vulgaris) ó
)Escherichia coli) ó ) aureus
ðåò~ñáÇ1
ÎÇÑòÓá1
ÕåÎÑ~~
ð~ÑõóÑõåßä~
ðÆÇ~ áõ~ßä~ : ðåñ
ÇãS ÇòÑòäÇ~
É~Í Ïã~Þ
ÎÇ.åÎÑ,ãä1
íÐñ
ðÆÇãä1 ã.1ä1
ó Staphylococcus äÇÑä~.ä1
ÎÇÊóÒßòãä1
ÐÖ ÍòäÇ~ Ò~~á~ ðñ
ÍìÐÇÊ ã.Ú
ÎÇaåÎÑu~ äÊ Í~ÐÅ
Ð~ä
) Clostridium vulgaris) ÍäN.ä1
å~ ÍòÓÇ~Í Ò~6ál
ðñ )Escherichia coli) ó )
aureus
|
)Escherichia coli ) ) Staphylococcus
aureus
|
~ ð~òËØ ã~Ú
ð~òË~Ñä~ ÒòËÑä~
|
::
|
ÉáÇÏáÇ
Ê1~~~áÇ
|
Íòäõìò
ÎÇË~Ò4 )Clostridium vulgaris)
Abstract
The honey is a gelatinous substance, produced by bees, and
contains many compounds (sugar, proteins, enzymes and compounds phenolic...).
Thanks to the latest and the acidic nature, honey plays a very effective
against microbes.
In our work now, we have demonstrated the effectiveness of this
meaningful phenolic compounds (flavonoids) studied the different honeys: honey
polyfloral (Batna), honey Sudan and honey El oued, using extracts obtained by
two types of extraction: liquid-liquid extraction and maceration with methanol
/ water (80%), against bacterial strains used.
These extracts are classified according to their very low
efficiency as follows: - Hydroalcoholic
- Chloroform
- From ethyl acetate and aqueous phase
Knowing that extracts honey Batna give the best efficacy against
the strains tested as Sudan and Merrara who gave a bad result:
- Strong antibacterial effect: against Staphylococcus
aureus, Escherichia coli - Poor antibacterial effect: against
Clostridium vulgaris
Key words: antimicrobien effect, naturel honey,
Staphylococcus aureus, Escherichia coli, Clostridium vulgaris, compounds
phenolics.
Liste des tableaux
Tableau N°1 : Activités biologiques
des composés polyphénoliques.......... 26
Tableau N°2 : Les résultats des
tests chimiques préliminaires 42
Tableau N°3 : Les extraits
obtenus......... 45
Tableau N°4 : Résultats de
l'activité antibactérienne de l'extrait
chloroformique de l'échantillon E2 étudié
avec la bactérie 46
Clostridium vulgarus
Tableau N°5 : Résultats de
l'activité antibactérienne de l'extrait chloroformique pour
l'échantillon E1 étudié avec la bactérie
Clostridium vulgarus
................................................... 46
Tableau N°6 : Résultats de
l'activité antibactérienne de l'extrait
hydroalcoolique des trois échantillons
étudiés avec la bactérie Staphylococcus aureus
................................................. 46
Tableau N°7 : Résultats de
l'activité antibactérienne des extraits
chloroformiques des trois échantillons testés sur
la bactérie Staphylococcus aureus
............................................... .... 46
Tableau N°8 : Résultats de
l'activité antibactérienne de l'extrait de phase
aqueuse de E1 et d'acétate d'éthyle de E 3 :
étudiés avec 47
la bactérie Staphylococcus
aureus....................................
Tableau N°9 : Résultats de
l'activité antibactérienne des extraits chloroformiqu des
échantillons E1 et E2 : étudiés avec la bactérie
E. 47
coli..................................................................................
Tableau N°10 : Résultats de
l'activité antibactérienne des extraits
hydroalcooliques des trois échantillons
étudiés avec la bactérie 47
E.coli...................................................................
Tableau N°11 : Résultats de
l'activité antibactérienne de l'extrait de phase aqueu
de E1 et d'acétate d'éthyle de E3 :
étudiés avec la bactérie 47
E.coli................................................
Tableau N°12 : Résultats de
l'activité antibactérienne de l'extrait chloroformiqu
des échantillons étudiés avec les 2
bactéries Staphylococcus 48
aureus et
E.coli............................................. ...
..........
Liste des figures
Figure N°1 Les différentes classes
des composés phénoliques.....................
16
Figure N°2 Structures chimiques de quelques
dérivés de l'ester
hydroxycinnamiques.........................................................
17
Figure N°3 Structure chimique de quelques
coumarines............................ 18
Figure N°4 Squelette de base des
flavonoïdes.................................. ... 19
Figure N°5 Biosynthèse des
flavonoïdes............................................... 19
Figure N°6 Structures chimiques de quelques
flavonols............................~21
Figure N°7 Structure de quelques
anthocyanidinitreze..............................~. 22
Liste des photos
Photo N°1 : Antibiogramme des trois types
de miel étudié avec 1 = E.coli et
2 = Staphylococcus aureus
..................................................... 48
Photo N°2 : Antibiogramme des 4 dilutions
de l'extrait hydroalcoolique
de miel de Soudan avec Staphylococcus
aureus........................ 48
Photo N°3 : Antibiogramme des 4 dilutions
de l'extrait hydroalcoolique de miel d
Batna avec E.coli ................... ....................
49
Photo N°4 : Antibiogramme des 4 dilutions
de l'extrait de la phase aqueuse de
miel de Batna. 1 = Staphylococcus aureus ; 2 =
E.coli.......... 49
Sommaire
Introduction 01
|
Partie I : Etude bibliographique
|
1- Historique 02
2- Définition de miel~~~~~~~~~~~~~~~~~~~~~~~.~~
03
3- Fabrication du miel~~~~~~~~~~~~~~~~~~~~~~~~~.. 03
4- Conservation 05
5- Les caractéristiques du
miel~~~~~~~~~~~~~~~~~~~~~~ 06
5.1- Le poids spécifique~~~~~~~~~~~~~~~~~~~~~~~~~
06
5.2- La viscosité 06
5.3- La coloration de miel~~~~~~~~~~~~~~~~~~~~~~~~ 07
5.4- La cristallisation de miel~~~~~~~~~~~~~~~~~~~~~~~ 07
5.5- La chaleur spécifique~~~~~~~~~~~~~~~~~~~~~~~~
08
5.6- La conductibilité
thermique~~~~~~~~~~~~~~~~~~~~~ 09
5.7- L'abaissement du point de
congélation~~~~~~~~~~~~~~~~~. 09
5.8- La conductibilité
électrique~~~~~~~~~~~~~~~~~~~~~~ 09
5.9- L'indice de réfraction~~~~~~~~~~~~~~~~~~~~~~~~
09
5.10- La fluorescence~~~~~~~~~~~~~~~~~~~~~~~~~~ 09
5.11- L'hygroscopicité du
miel~~~~~~~~~~~~~~~~~~~~~~ 10
6- Les différents types de
miel~~~~~~~~~~~~~~~~~~~~~~ 10
6.1- L'origine
florale~~~~~~~~~~~~~~~~~~~~~~~~~~. 10 6.2- L'origine
géographique~~~~~~~~~~~~~~~~~~~~~~~ 11
6.3- Les
différences au niveau chimique~~~~~~~~~~~~~~~~~~ 11 6.4- Le miel
est un produit vivant~~~~~~~~~~~~~~~~~~~~~ 11
7- La composition du miel~~~~~~~~~~~~~~~~~~~~~~~~ 12
8- les composes
phénoliques~~~~~~~~~~~~~~.~~~~~~~~~ 15 8.1- Les
polyphénols~~~~~~~~~~~~~~~~~~~~~~~~~~ 15
8.2- Classification des composés
phénoliques~~~~~~~~~~~~~~~..~ 15
8.2.1- Les acides phénols et les
coumarines~~~~~~~~~~~~~~~~~ 17
8.2.2- Les acides benzoïques~~~~~~~~~~~~~~~~~~~~~~~
17
8.2.3- Les acides cinnamiques~~~~~~~~~~~~~~~~~~~~~~ 17
8.3- Les coumarines~~~~~~~~~~~~~~~~~~~~~~~~~~ 18
8.4- flavonoïdes 18
8.4.1- Structure~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 18
8.4.2- Biosynthése des
flavonoïdes~~~~~~~~~~..~~~~~~~~~~ 19
8.4.3- Propriétés des
flavonoïdes~~~~~~~~~~~~~~~~~~~~~ 20
A- Les flavonols~~~~~~~~~~~~~~~~~~..~~~~~~~~~. 20
B- Les flavanones .21
C- Les anthocyanes~~~~~~~~~~~~~..~~~~~~~~~~~~~ 21
C.1- Présentation 21
C.2- Structures ~22
C.3- Propriétés des anthocyanes 22
9- Propriétés antimicrobiennes du
miel~~~~~~~~~~~~.~~~~~~~. 23
9.1- L'osmolarité~~~~~~~~~~~~~~~~~~~~~~~~~~~. 24
9.2- L'effet du pH~~~~~~~~~~~~~~~~~~~~~~~~~~~ 24
9.3- Le peroxyde d'hydrogène H2O2 .. 25
9.4- propriétés anti-inflammatoires et
diabéte~~~~~~~~~~~~~~~~ 27
9.5- Anti-radicalaire~~~~~~~~~~~~~~~~~~~~~~~~~~ 27
9.6-
Antiangiogénique~~~~~~~~~~~~~~~~~~.~~~~~~~ 27
10- Le miel et les flavonoides (les derniers
études)~~~~~~~~~~~~~~ 27
11- Le miel et Islam~~~~~~~~~~~~~~~~~~~~~~~~~~ 31
12- Utilisation du miel et consommation~~~~~~~~~~~~~~~~~~
35
|
Partie II : Etude expérimentale
|
1- Matériels et méthodes~~~~~~~~~~~~~~~~~~~~~~~~
37
1.1- Matériel biologique 37
1.1.1- Le miel~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 37
1.1.2- Les Micro-organismes
testés~~~~~~~~~~~~~~~~~~~~ 37
1.2- méthode d'étude~~~~~~~~~~~~~~~~~~~~~~~~~~
37
1.2.1- Vérification de la pureté du
miel~~~~~~~~~~~~~~~~~~. 37
1.2.1.1- Test de dissolution~~~~~~~~~~~~~~~~~~~~~~~ 37
1.2.1.2- L'essai a la flamme. ~~~~~~~~~~~~~~~~~~~~~~~
38
1.2.2- Tests chimiques
préliminaires~~~~~~~~~~~~~~~~~~~~ 38
1.2.2.1- Saponosides~~~~~~~~~~~~~~~~~~~~~~~~~~ 38
1.2.2.2- Détection des
polyphénoles~~~~~~~~~~~~~~~~~ ~~ 38
A- Les flavonoïdes~~~~~~~~~~~~~~~~~~~~~.~~~~~~ 38
B- Les tanins~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 38
1.2.2.3- Les alcaloïdes~~~~~~~~~~~~~~~~~~~~~~~~~
38
1.2.2.4- Cardénolides~~~~~~~~~~~~~~~~~~~~~~~~~~ 39
1.2.2.5-
Stéroïde~~~~~~~~~~~~~~~~~~~~~~~~~~~.. 39
1.2.3- L'extraction des
flavonoïdes~~~~~~~~~~~~~~~~~~~~ 39 1.2.3.1- L'extraction
Liquide-Liquide~~~~~~~~~~~~~~~~~~~ 39 1.2.3.2- L'extraction
Méthanol-Eau~~~~~~~~~~~~~~~~~~~~ 40 1.2.4- Etude du pouvoir
antibactérien du miel~~~~~~~~~~~~~~~~. 40
2- Résultats et discussions~~~~~~~~~~~~~~~~~~~~~~~~
42
2.1- Resultats~~~~~~~~~~~~~~~~~~~..~~~~~~~~. 42
2.2-
Discussion 50
2.2.1- La pureté du miel~~~~~~~~~~~~~~~~~~~~~~~~~
50
2.2.2- Tests chimiques
préliminaires~~~~~~~~~~~~~~~~~~~~ 50
2.2.3- Extraction de
flavonoïdes~~~~~~~~~~~~~~~~~~~~~ 50
2.2.4- Activité
antibactérienne~~~~~~~~~~~~~~~~~~~~~~ 51

(Sourate Al-Nahl) : 68-69

Introduction
Introduction :
De nombreuses études sont consacrés à la
propolis, source importante de composés phénoliques, notamment de
flavonoïdes (Ghisalberti., 1979. Walker et Crane.,
1987.). Une trentaine de composés ont été
identifiés, dont des acides phénols, des flavonones, des
flavonols et des flavonones (Vanhalen et Vanhalen-fastre.,
1979).
Ces substances phénoliques existant dans les
sécrétions des bourgeons et exsudats de divers organes des plants
(Villanueva et al., 1970. Scogin 1979), pourraient se
retrouver dans les miels (Bogdanov., 1984).
Elles peuvent être considérés comme des
marqueurs de l'origine florale (Alix et al., 1985. Tomas-Lorente et
al., 1986).
En fin, les substances phénoliques interviennent, plus
ou moins directement, sur la couleur par l'intermédiaire des
flavonoïdes susceptibles de contribuer à la coloration jaune
(Harbone et Smith., 1978) et d'une manière
générale, les composés phénoliques sont
impliqués dans les phénomènes de brunissements
enzymatiques ou non.
Ce présent travail repose essentiellement sur
l'évaluation de l'activité antibactérienne des
flavonoïdes extraits de trois échantillons différents de
miel naturel sur trois souches microbiennes. L'expérimentation s'est
déroulée au niveau du laboratoire de biochimie de
l'Université Kasdi Merbah Ouargla.

1- Historique
Les produits de la ruche ont toujours fasciné les
hommes. Le miel d'abord, qui a constitué pendant des millénaires
en Occident la seule source abondante de matières sucrées dont on
pouvait disposer. Mais aussi la cire, première matière plastique
connue, dont le principal emploi était l'éclairage. Sans oublier
l'hydromel, une des plus anciennes boissons alcooliques de l'humanité,
dont on faisait jadis une consommation impressionnante. Quant à la
propolis, cette résine que les abeilles récoltent sur les
bourgeons des arbres, elle était mal distinguée de la cire, mais
on l'utilisait dans le folklore médical pour le pansement des
blessures.
Le miel est donc un aliment que l'humanité
connaît depuis la nuit des temps. Les usages qu'en faisaient les Anciens
étaient très variés, que ce soit en Egypte où,
considéré comme source d'immortalité, il servait à
conserver la dépouille du pharaon, à Babylone où il
était employé en ophtalmologie et pour les maladies de l'oreille
et en Afrique où il joue un grand rôle dans l'alimentation et la
pharmacopée pour soigner brûlures, morsures de serpent ou plaies
infectées.
L'origine du mot miel est à rechercher dans le mot
sanskrit medhu. Connu sous le nom de melikraton durant toute
l'Antiquité, il a eu une valeur religieuse très importante. Chez
les Scandinaves, il donnait l'hydromel, la boisson des dieux, à Babylone
on l'offrait en sacrifice aux divinités à l'occasion de la
construction d'un temple, en Afrique, il avait une grande importance dans le
rituel de la naissance et de la mort, comme en Inde ou chez les Germains.
Enfin, les Livres Saints comme la Bible et le Coran ne
manquent pas de louer les vertus du miel. Il est le symbole de la
prospérité et de l'abondance lorsqu'il est question de la Terre
Promise, pays ruisselant de lait et de miel. Aujourd'hui, le miel est un
aliment qui est aussi apprécié qu'autrefois (les
constituants chimiques du Miel, EMMANUELLE HUCHET, JULIE COUSTEL ET LAURENT
GUINOT, 1996).
2-Définition de miel
Il existe de nombreuses définitions du miel mais on peut
en retenir trois.
La première, établie par Moreaux, définit
le miel comme étant "la matière sucrée recueillie par
l'abeille sur les plantes vivantes et qu'en la modifiant, elle emmagasine dans
ses rayons de cire". La seconde correspond à celle du législateur
qui définit le miel comme étant "la denrée produite par
les abeilles mellifiques à partir du nectar des fleurs ou de
sécrétions provenant de parties vivantes de plantes ou se
trouvant sur elles, qu'elles butinent, transforment, combinent avec des
matières spécifiques propres, emmagasinent et laissent
mûrir dans les rayons de la ruche. Cette denrée peut être
fluide, liquide ou cristallisée".
Nous allons nous intéresser plus
particulièrement à la composition chimique du miel. Pour
commencer, nous rappellerons quelles sont les étapes importantes de la
fabrication du miel et la composition finale de ce produit. Ensuite, nous
verrons les principales caractéristiques des miels, notamment leurs
propriétés physico-chimiques et leur diversité. Enfin,
nous donnerons plus détails sur les sucres, principaux constituants du
miel, en précisant les méthodes utilisées pour leur dosage
(Les constituants chimiques du Miel, EMMANUELLE HUCHET., JULIE COUSTEL
ET LAURENT GUINOT., 1996).
Le Codex alimentarius définit le miel comme suit :
<Le miel est la substance naturelle sucrée produite
par les abeilles « Apis mellifera
» à partir du nectar des plantes ou à partir des
sécrétions provenant de parties vivantes de plantes ou à
partir d'excrétions d'insectes butineurs laissées sur les parties
vivantes de plantes, que les abeilles butinent, transforment en les combinant
avec des substances spécifiques qu'elles sécrètent
elles-mêmes, déposent, déshydratent, emmagasinent
et laissent affiner et mûrir dans les rayons de la ruche
> (Codex., 2001).
3- Fabrication du miel
Les abeilles appartiennent à l'ordre des
Hyménoptères qui regroupent 20000 espèces d'abeilles.
Toutes collectent du nectar et du pollen, s'en nourrissent et participent sans
relâche à la pollinisation des plantes et au maintien des
équilibres naturels. Toutes les abeilles productrices de miel ne font
pas l'objet d'un élevage. C'est l'abeille mellifère et ses races
que l'on retrouve un peu partout à travers le monde, car c'est la plus
intéressante à élever, c'est elle qui assure les meilleurs
rendements. De nombreux rôles sont définis à
l'intérieur de la ruche comme gardiennes, ouvrières,
butineuses... Chaque abeille
accomplira au cours de sa vie toutes ces fonctions.
Une butineuse effectue entre 20 et 50 voyages par jour, chacun
demandant environ
15 minutes. Le rayon d'action moyen se situe entre 500
mètres et 2 kilomètres, d'oül'importance, en plus
des conditions climatiques et de la nature du sol, de la
végétation des
alentours du rucher. Elle prélève
sur les fleurs le nectar, liquide sucré, sécrété
puis excrété par des glandes dites nectarifères,
présentes sur de nombreuses plantes.
Le changement de la solution sucrée en miel commence
déjà lors du voyage, au cours duquel elle est accumulée
dans le jabot de l'abeille. C'est dans son tube digestif que s'amorce la longue
transformation : des enzymes agissent sur le nectar. Le saccharose, sous
l'action de l'invertase, se transforme en glucose, fructose, maltose et autres
sucres. Les modifications physico-chimiques se poursuivent dès
l'arrivée à la ruche. A son retour, la butineuse régurgite
sa charge, la passe aux ouvrières, qui elles-mêmes la communiquent
à d'autres et ainsi de suite.
D'individu en individu, la teneur en eau s'abaisse en
même temps que le liquide s'enrichit de sucs gastriques et de substances
salivaires : invertase, diastase, et glucooxydase. Simultanément,
d'autres sucres sont synthétisés, qui n'existent pas au
départ. La goutte épaissie est déversée ensuite
dans une alvéole qui sera, après évaporation,
obturée par un opercule de cire. A ce moment, la solution sucrée
transformée, qui contient encore 50% d'eau environ, va subir une
nouvelle concentration par évaporation, qui se fait sous la double
influence :
1. d'abord de la chaleur régnant dans la ruche et qui est
d'environ 36°C
2. ensuite de la ventilation assurée par le travail
des ventileuses qui entretiennent un puissant courant d'air ascendant par un
mouvement très rapide de leurs ailes. On arrive ainsi à une
proportion d'environ 20% d'eau et de 80% de sucres, correspondant aux
pourcentages normaux du miel.
Evaporation de l'excès d'eau et concentration en sucres
sont donc les deux objectifs principaux. Grâce à cela, la colonie
dispose en réserve d'un aliment hautement énergétique,
stable, de longue conservation et peu sensible aux fermentations. Les
bâtisseuses l'utilisent pour fabriquer la cire servant à la
construction des cellules de la ruche.
Heureusement pour l'homme, la quantité
emmagasinée dans la ruche est largement supérieure aux besoins
immédiats de la colonie (l'abeille possède un fort instinct de
stockage).
La récolte du miel peut se pratiquer dès la fin
de la miellée quand la ruche est devenue très lourde (mi-avril,
mi-mai). L'apiculteur retire les cadres de miel, mais en laissant aux abeilles
les provisions nécessaires pour qu'elles puissent nourrir les jeunes
larves et éventuellement passer l'hiver, si la saison est
avancée. C'est pourquoi la ruche est divisée en deux parties :
une partie inférieure, le corps, qui contient de hauts rayons garnis non
seulement de miel, mais aussi de pollen et de couvain : il ne faut pas y
toucher. Audessus est placée la hausse garnie de cadres moitié
moins hauts, qui ne contient en général que du miel : c'est
d'elle que l'apiculteur va obtenir sa récolte. Après avoir
chassé les abeilles par enfumage, il transporte les hausses dans la
miellerie, et enlève les opercules à l'aide d'un couteau à
désoperculer. (Les constituants chimiques du
Miel, EMMANUELLE HUCHET, JULIE COUSTEL ET LAURENT GUINOT., 1996).
4- Conservation
Le miel est un produit périssable qui subit au cours du
temps un certain nombre de modifications aboutissant inévitablement
à la perte de ses qualités essentielles. La rapidité de la
dégradation dépend de la composition du produit ainsi que des
conditions de sa conservation. Ainsi, étant très hygroscopique,
le miel confiné en atmosphère humide absorbe l'eau rapidement. Ce
phénomène gagne rapidement en profondeur et le miel
hydraté acquiert une structure très fragile. Dans la mesure du
possible, les bocaux de conservation du miel seront secs et aérés
et les emballages se feront en containers pleins et fermés
hermétiquement.
Si le produit s'échauffe, on observe alors une
dégradation plus ou moins rapide des sucres, dégradation qui
s'effectue essentiellement aux dépends du fructose et s'accompagne de la
formation d'hydroxyméthylfurfural. La gravité de cette
altération, à laquelle est associée une augmentation du
taux de l'acidité et une disparition rapide des enzymes, est directement
liée à de mauvaises conditions de stockage. Certains miels sont
plus fragiles que d'autres en fonction de leur acidité naturelle. En
effet, tous les miels dont le pH est inférieur à 4 se
dégradent plus vite que ceux de caractéristique inverse. Il
convient donc de garder le miel dans des locaux frais où la
température ne dépasse pas 20°C. Si le miel à stocker
présente un risque de fermentation, il faudra impérativement le
pasteuriser ou le conserver à une température de 4 à
5°C. (Les constituants chimiques du Miel,
EMMANUELLE HUCHET., JULIE COUSTEL ET LAURENT GUINOT., 1996).
5- Les caractéristiques du miel
Le miel présente selon l'origine de la plante, la
composition de ses sucres et la température une couleur allant du blanc
au brun foncé, et une consistance plus ou moins liquide. On distingue
comme propriétés physico-chimiques du miel :
Les propriétés mécaniques, thermiques,
électriques, optiques du miel ont été
étudiées en vue d'applications technologiques. On possède
de bonnes informations sur des propriétés comme la
viscosité, la conductibilité thermique, la chaleur
spécifique, ce qui facilite le travail de l'ingénieur devant
réaliser des installations industrielles de conditionnement du miel.
5.1- Le poids spécifique
Il s'apprécie avec un densimètre. C'est une
donnée très utile pouvant être utilisée pour mesurer
la teneur en eau des miels. On peut admettre une moyenne de 1.4225 à
20°C. (DESCOTTES, 2004).
5.2- La viscosité
La viscosité du miel dépend de sa teneur en eau, de
sa composition chimique et de sa température. (DESCOTTES .,
2004)
La plupart des miels se comportent comme des liquides
newtoniens; certains d'entre eux ont, du fait de leur composition
particulière, des propriétés particulières.
* Exemple : Les miels de Callune (Calluna
vulgaris, bruyère) sont thixotropes. Au repos, le miel de Callune se
présente comme une substance gélatineuse suffisamment rigide pour
qu'on ne puisse pas la faire couler. Il suffit de le remuer pour que cet
état disparaisse; il devient aussi fluide que n'importe quel miel, mais
au bout d'un temps assez court, il reprend sa rigidité.
Cette thixotropie est due à la présence d'une
protéine que l'on peut extraire et doser. Un miel de Callune pur peut en
contenir près de 2%.
Les miels d'Eucalyptus sont dilatants, ils présentent
une viscosité très élevée lorsqu'ils sont soumis
à une agitation; ceci explique pourquoi ils peuvent arriver à
bloquer l'extracteur en fonctionnement, alors qu'au repos ils coulent sans
difficulté. Cette propriété est due à la
présence d'une dextrine de formule (C6H12O5)n ou n = (8000).
Pour 30 à 35°C, la viscosité est minimale. (PROST,
1987); c'est d'ailleurs la température de la ruche. C'est
pourquoi les apiculteurs sont contraints, au cours des opérations de
centrifugation, d'extraction et de mise en pots, d'opérer à
température suffisamment élevée.
5.3- La coloration de miel
La teinte a été étudiée dans un
but pratique : elle constitue un facteur de classement important au plan
commercial. Les travaux à caractères fondamentaux sont rares et
on connaît mal les substances qui sont responsables de la coloration des
miels.
Coloration
* miel clair = incolores.
* miel foncé = presque noir
La mesure de la couleur des miels est assez difficile
dès que l'on recherche la précision. Le classement par simple
appréciation visuelle est subjectif et erroné. C'est pourquoi
Aubert et Gonnet ont entrepris d'étudier la couleur des miels à
l'aide de la méthodologie très similaire d'analyse
spectrophométrique adoptée par la convention internationale de
l'éclairage. Cette méthode permet d'effectuer le classement
précis des miels très clairs ou très foncés,
difficiles à différencier par les comparateurs visuels.
La couleur des miels est due aux matières
minérales qu'il contient. La teneur en cendres des miels est
inférieure à 1%, la moyenne étant 0.1%.
La variabilité est grande puisque les miels les plus
pauvres en matières minérales contiennent 0.02% de cendres. Il
s'agit de miels très clairs; les plus foncés étant les
plus minéralisés. (BONIMOND., 1983).
Selon (PROST., 1987), le vieillissement et le
chauffage accentuent la coloration du produit.
La couleur des miels va du blanc au noir. Elle
s'apprécie au moyen de colorimètre et varie. Selon
l'espèce butinée et la rapidité de la
sécrétion. (Miel clair si sécrétion rapide)
(PROST., 1979).
5.4- La cristallisation de miel
La cristallisation des miels est un phénomène
très important car c'est de lui que dépend en partie la
qualité du miel.
S'ils sont parfaitement fluides au moment de leur extraction,
ils ne restent cependant pas dans cet état de façon
indéfinie. Ils constituent des solutions sursaturées de
différents sucres et de ce fait sont instables; ils sont rapidement le
siège de cristallisations fractionnées qui intéressent
surtout le glucose, moins soluble que le lévulose.
La vitesse de cristallisation des miels est très
variable. Elle est en fonction de la composition en sucres, de la teneur en
eau, et de la température de conservation. (CHAUVIN.,
1986).
Certains miels cristallisent dans les jours qui suivent la
récolte; d'autres restent à l'état liquide pendant des
années à la température ordinaire.
La cristallisation se fait à partir de cristaux
primaires de glucose qui sont présents dès la récolte et
faciles à mettre en évidence en lumière polarisée
sous le microscope. La croissance de ces cristaux aboutit à la formation
de 2 phases : une phase solide constituée de glucose cristallisé
et une phase liquide enrichie en eau, les deux phases ne se séparent pas
et le miel cristallisé forme un feutrage dont la phase liquide occupe
les interstices. Par contre, si le miel avait au départ une teneur en
eau supérieure à 18%, la phase solide se sépare de la
phase liquide et forme une épaisse couche au fond du vase.
L'aptitude à cristalliser d'un miel est fonction du
rapport D/W (glucose/eau) selon White et al.
(1962). Pour un indice inférieur à 1.6,
la cristallisation est nulle ou très lente. Elle est très rapide
et complète pour les indices supérieurs à 2.
La cristallisation est la plus rapide à la
température de 14°C. Les basses températures retardent la
croissance des cristaux. Les hautes températures entraînent la
dissolution des cristaux qui disparaissent totalement à 78°C.
Dès 25°C, la croissance des cristaux est arrêtée.
(HUCHET ET Col., 1996).
La cristallisation du miel est un phénomène
naturel et général et doit être considérée
comme une première étape du vieillissement (DESCOTTES,
2004).
5.5- La chaleur spécifique
Elle a été étudiée par Helvey
à l'aide de dilutions de miel de plus en plus fortes. La courbe obtenue
varie très peu d'un miel à l'autre, et correspond à 0.54
pour 17% d'eau.La chaleur de dilution apparaît lorsqu'on ajoute de l'eau
au miel : il y a alors production de chaleur. Par exemple, si un miel normal
est dilué jusqu'à la concentration de 3%, chaque gramme aura
produit 5.5 calories. En revanche, un miel déshydraté que l'on
dissout dans l'eau absorbe de la chaleur, soit 673 frigories par gramme.
(LOUVEAUX., 1985 et PROST., 1987). LOUVEAUX (1968).
5.6- La conductibilité thermique
Elle s'exprime en calories par cm3 par seconde et par
degré centigrade. Le miel est mauvais conducteur de la chaleur, sauf
quand il est tout-à-fait déshydraté. La formule qui
l'exprime est (l = la conductibilité) : L = 1.29*10-4 à
20°C, pour un miel à 20% d'eau et finement cristallisé
(formule d'Helvey). (BOGDANOV et al. 2004).
Selon, (GONNET., 1985), le miel est mauvais
conducteur de la chaleur, donc bon isolant thermique.
5.7- L'abaissement du point de congélation
Il dépend de la proportion en sucres : Il serait de
1.42°C à 1.53°C en solution aqueuse à 15%., et
2.75°C à 3.15°C en solution aqueuse à 25%. (Les
constituants chimiques du Miel, EMMANUELLE HUCHET, JULIE COUSTEL ET LAURENT
GUINOT., 1996).
5.8- La conductibilité électrique
C'est la propriété du miel à conduire le
courant électrique (BONIMOND., 1983). D'après
(PROST., 1987) la conductibilité électrique est
liée à la teneur du miel en matières minérales.
Elle est intéressante, car elle permet de distinguer
aisément des miellats des miels de fleurs, les premiers ayant une
conductibilité bien plus élevé que les seconds. Mais il
existe des variations importantes. On l'évalue à l'aide d'une
unité particulière, le Siemens. Pour une solution à 20% de
matière sèche et à la température de 20°C, la
conductibilité va de 1 à plus de 10-4 S.cm-1.
5.9- L'indice de réfraction
Il est couramment utilisé par les techniciens qui se
servent de réfractomètres de petite taille, très
pratiques. L'indice permet de calculer une variable très importante, la
teneur en eau, bien plus rapidement que pour les autres méthodes. Il
oscille entre 1.47 et 1.50 selon sa teneur en eau à la
température de 20 C° (DONADIEU., 1978).
5.10- La fluorescence
Beaucoup de miels présentent une fluorescence plus ou
moins marquée, mais on ne sait rien de précis sur cette
caractéristique. (DESCOTTES., 2004).
5.11- L'hygroscopicité du miel
Le miel tend à absorber l'humidité de l'air et, si
on le laisse trop longtemps dans une atmosphère humide, cette absorption
peut être considérable.
Un miel "normal", contenant 18% d'eau, peut atteindre, au bout de
trois mois,
une hygrométrie de 55% : son poids a alors
augmenté de 84%, se trouve en équilibre dans une
atmosphère dont l'humidité relative est de 60% (PROST
,1979). D'autre part, lorsqu'on veut dessécher le miel, il est
nuisible de le maintenir en atmosphère rigoureusement sèche,
parce qu'il se forme en surface une pellicule dure qui empêche.
le reste d'eau de s'évaporer.
6- Les différents types de miel
La variété des types de miel est très
grande, mais il est cependant possible d'opérer des classements
simplificateurs en utilisant divers critères. (Les constituants
chimiques du Miel, EMMANUELLE HUCHET, JULIE COUSTEL ET LAURENT GUINOT.,
1996).
6.1- L'origine florale
(DONADIEU., 1984), signale que selon cette
origine nous avons les miels mono floraux et les miels multi floraux.
La majorité des miels proviennent d'une flore bien
diversifiée. Il est courant que les abeilles visitent à la fois
une dizaine ou une vingtaine d'espèces végétales
fleurissant en même temps dans leur secteur de butinage. Chaque abeille
ne va s'intéresser qu'à une espèce, mais nous devons
considérer l'ensemble de la population d'une ruche, qui comporte des
milliers de butineuses. Le nectar rapporté à la ruche dans une
courte période de temps n'est homogène que pendant une grande
miellée, telle que celle du colza ou de la lavande. Le reste du temps,
les apports de nectar proviennent de sources multiples. Il en résulte
que les miels récoltés par l'apiculteur sont le plus souvent
polyfloraux.
Les miels unifloraux naturels proviennent principalement d'une
espèce végétale déterminée, mais non
exclusivement, car il impossible d'empêcher tout mélange avec le
miel provenant d'une fleur secondaire. Dans la mesure où ils sont
suffisamment purs, les miels unifloraux répondent à un certain
nombre de critères physico-chimiques et organoleptiques; la composition
du nectar ou du miellat d'une espèce végétale
donnée est relativement constante. Sur la France, on peut
récolter des quantités importantes : 15 à 20 miels
unifloraux caractéristiques sur la base de critères bien
établis.
Les miels poly floraux ne sont pas susceptibles d'avoir une
appellation florale ,ce qui ne les empêche pas de pouvoir
prétendre à une excellente qualité.
6.2- L'origine géographique
La détermination de l'origine géographique du miel
repose sur l'analyse pollinique. (CHAUVIN, 1968)
Certains miels poly floraux ont acquis une réputation
particulière qui est liée à leur origine
géographique, qu'il s'agisse d'une petite région, d'une province
d'un continent. Cette réputation n'est pas forcément
fondée sur des critères analysables, elle est souvent
subjective!
Par contre, il n'est pas impossible qu'une origine florale soit
associée avec une région.
6.3- Les différences au niveau chimique
La teneur en saccharose : considérable pour le miel de
luzerne et bruyère, absence pour le miel de colza.
Le miellat : présence de mélézitose (qui
tire son nom du miellat de mélèze où on le
découvrit); il manque totalement dans les miels de fleurs.
Les substances aromatiques: On a isolé plus de 50
substances aromatiques qui peuvent permettre l'identification de l'origine des
miels, car elles paraissent provenir presque exclusivement de la plante.
6.4- Le miel est un produit vivant
Le miel, comme le vin, vieillit avec le temps, mais sa
qualité ne s'améliore pas avec le temps.
Sa couleur fonce rapidement, puis lentement.
Sa teneur relative en sucre se modifie, car les sucres simples
comme le fructose et le glucose ont tendance à se regrouper pour donner
du saccharose, du maltose ou des produits complexes.
L'acidité augmente.
L'activité des diastases diminue nettement. L'amylase
baisse en moyenne de 3% par mois, mais moins vite à température
plus basse. L'invertase est plus fragile et diminue de moitié à
peu près en un an.
Le miel contient des levures, qui lorsque le miel se
sépare en partie liquide/solide, se développent dans la partie
liquide : la fermentation. Ces levures proviennent du nectar
des fleurs.
7- La composition du miel
Comme nous l'avons vu, le miel est un produit dont la
fabrication demande plusieurs étapes et chacune d'entre elles a une
influence sur sa composition chimique. En schématisant à
l'extrême, on pourrait dire que la composition moyenne est la suivante
:
+ hydrates de Carbone : 79.5% +
eau : 17%
+ divers : 3.5%
Il est évident qu'en réalité cette
composition est beaucoup plus complexe et d'ailleurs on est loin d'en
connaître tous les constituants. En 1962, White, Riethoff, Subers et
Kushnir ont tenté de donner la composition moyenne du miel en analysant
490 échantillons en provenance de tous les Etats-Unis. Ils ont pu
déterminer la proportion des principaux constituants du miel.
* L'eau : Est présente en
quantité non-négligeable puisque sa teneur moyenne est de 17.2%,
mais comme le miel est un produit biologique, cette valeur peut varier. En
fait, les abeilles operculent les alvéoles lorsque la teneur en eau
avoisine les 18%. De plus, certains aspects de l'eau contenue dans le miel
restent un mystère puisque Helvey a montré que la proportion en
deutérium de l'eau du miel est sensiblement plus élevée
que celle de l'eau ordinaire. On ne sait pas d'où provient cet
enrichissement en deutérium.
* Les hydrates de carbone : Constituent la
partie la plus importante du miel, mais c'est aussi la plus difficile à
analyser. Il s'agit essentiellement de sucres dont le dosage se fait, comme
nous le verrons plus loin, par chromatographie. On trouve des monosaccharides
(glucose et lévulose) qui représentent 85% à 95% des
sucres du miel mais c'est le lévulose qui est presque toujours dominant,
avec une teneur de 38% du poids du miel, tandis que la teneur en glucose est de
31%.
On y trouve également du saccharose (1.5%) et du
maltose (7.5%) ainsi que d'autres sucres présents à l'état
de traces : isomaltose, nigérose, turanose, maltulose, isomaltulose,
leucrose, kojibiose, néotréhalose, gentiobiose, laminaribiose,
mélézitose, erlose, 1-kertose, dextrantriose, raffinose,
isopanose, isomaltotétraose, 6-aglucosylsaccharose, arabogalactomannane,
maltotriose, isomaltopentaose, panose, isomaltotriose, 3-a-isomaltosylglucose,
centose (E. Crane, 1980). La présence de lévulose
et de glucose provient en grande partie de l'action de
l'invertase sur le saccharose. En effet, le saccharose est dextrogyre.
Lorsqu'il est hydrolysé, soit par les acides, soit par
l'invertase intestinale, on obtient un mélange de quantités
équimolaires de D (+) GLUCOSE et de D (-) FRUCTOSE : la
lévorotation du fructose est donc plus importante que la dextrorotation
du glucose, de sorte que le mélange obtenu est lévogyre, ce qui
lui a valu le nom de sucre interverti..
saccharose + eau glucose + fructose
Quant à l'origine de la présence des autres
sucres, elle est peu connue. Il semblerait que la nature et la quantité
des sucres additionnels dépendent de la plante sur laquelle le miel a
été récolté.
* Le miel contient aussi des acides : Le plus
important est l'acide gluconique dont l'origine serait une bactérie,
appelée gluconobacterie, qui, lors de la maturation du miel,
transformerait le glucose en acide gluconique. On y trouve également une
vingtaine d'acides organiques comme l'acide acétique, l'acide citrique,
l'acide lactique, l'acide malique, l'acide oxalique, l'acide butyrique, l'acide
pyroglutamique et l'acide succinique. On y trouve des traces d'acide formique
(un des constituants du venin), d'acide chlorhydrique et d'acide phosphorique.
D'autres composés, les lactones, dont la présence est constante,
ont également une fonction acide. Le pH, qui peut varier de 3.2 à
4.5, est égal, en moyenne, à 3.9.
* Les matières minérales ou cendres :
Ont une teneur inférieure à 1% (elle est en
général de l'ordre de 0.1%). On y trouve, dans l'ordre
d'importance, du potassium, du calcium, du sodium, du magnésium, du
cuivre, du manganèse, du chlore, du phosphore, du soufre et du silicium
ainsi que plus de trente oligo-éléments. Leur teneur
dépend des plantes visitées par les abeilles ainsi que du type de
sol sur lequel elles poussent.
* Les protides : Sont présents en
faible quantité (1.7 gramme par kilogramme de miel soit une teneur de
0.26%) et la teneur en azote est négligeable (de l'ordre de 0.041%). Il
s'agit essentiellement de peptones, d'albumines, de globulines et de
nucléo-protéines qui proviennent soit de la plante, soit de
l'abeille. Il y a également des acides aminés libres dont la
proline, qui provient des sécrétions salivaires de l'abeille.
* Les lipides : Le miel est pauvre en lipides
: ceux qu'on y trouve sont probablement des
microparticules de cire qui
échappent à la filtration (HUCHET et
al.1996).
(LOUVEAUX., 1985), identifie cependant, des
glycérides et des acides gras tels que l'acide
palmitique, les acides oléïques et linoléïques.
* De nombreuses enzymes : Se retrouvent dans
le miel : l'invertase, l'a-amylase, la b-amylase, l'a-glucosidase et la
glucose-oxydase capable de transformer le glucose en acide gluconique. Le miel
contient aussi une catalase et une phosphatase. Ces diastases sont
détruites par un chauffage exagéré du miel, qu'il y a donc
lieu d'éviter si on veut bénéficier de leur action. Ainsi,
leur dosage permet de détecter les fraudes liées au chauffage du
miel.
* D'autres constituants interviennent :
A- Les vitamines : Le miel en est très
pauvre. Il s'agit essentiellement de vitamines B (B1, B2, B3, B5, B6, B8, B9)
qui seraient apportées par le pollen.
Le miel est également pauvre en
lipides : ceux qu'on y trouve sont probablement des
microparticules de cire qui échappent à la filtration.
B- Les substances aromatiques : Ne sont pas
importantes quant à leur poids. Les composés sont isolés
par les méthodes de chromatographie en phase gazeuse. On dénombre
plus de cinquante substances aromatiques qui peuvent permettre l'identification
de l'origine des miels, car elles paraissent provenir presque exclusivement de
la plante (HUCHET et al., 1996).
DONADIEU (1984), ajoute que
ces substances donnent l'arôme et le goût
spécifique d'un miel déterminé, mais qui
ont par ailleurs des vertus thérapeutiques.
* Matières pigmentaires : Le miel
contient des produits pigmentaires qui donnent la couleur au miel et qui
n'ont pas encore fait l'objet
d'études approfondies (DONADIEU.,
1984).
LOUVEAUX (1985), ajoute
qu'elles sont probables qu'elles
appartiennent aux groupes des caroténoïdes et des
flavonoïdes.
La coloration est une caractéristique physique
très importante des miels car elle est en relation avec
l'origine florale et la composition, elle va de
l'incolore au noir en passant par le blanc, le jaune, le brun
ambré et le brun vert, en général les miels
d'agrumes sont plus clairs que ceux des forêts.
(LOUVEAUX., 1985. WEISS., 1985 et PROST., 1987 in DJERD.,
2008).
Le miel est considéré comme un produit pur. Mais
il n'est pas exempt de produits polluants, présents en
très faible quantité, comme le plomb et le
cadmium. Le dosage de ces polluants dans le miel est
particulièrement intéressant puisqu'il constitue un bon
indicateur de pollution de l'environnement.
Les importants composes qu'ayant les majorités effets
biologiques qui contiennent le miel appelant : Les composes phénoliques
(généralement les tanins et les flavonoïdes).
8- Les composes phénoliques
8.1- Les polyphénols
Sont des métabolites secondaires présents chez
toutes les plantes vasculaires [LEBHAM., 2005]. Ils
constituent un des groupes le plus nombreux et largement distribué des
substances dans le royaume des végétaux avec plus de 8000
structures phénoliques présents dans tous les organes de la
plante. Ils résultent biogénétiquement de deux voies
synthétiques principales : la voie shikimate et acétate
[LUGASI et al, 2003].
Les composés phénoliques (acides
phénoliques, flavonoïdes simples et proanthocyanidines) forment le
groupe des composes phytochimiques le plus important des plantes [Beta
et al., 2005].
L'élément structural de base est un noyau
benzoïque auquel sont directement liés un ou plusieurs groupes
hydroxyles, libres ou engagés dans une autre fonction chimique
(éther, méthylique, ester, sucre...) [BRUNETON.,
1993].
Les fonctions principales attribuées à ces
composés chez les végétaux sont la protection contre les
pathogènes et les herbivores ainsi que la limitation des dommages dus
aux radiations UV. Dans ce cas, ils agissent par effet d'écran et par
effet antioxydant [LEBHAM., 2005].
8.2- Classification des composés
phénoliques
Les composés phénoliques regroupent un vaste
ensemble de substances chimiques comprenant au moins un noyau aromatique, et un
ou plusieurs groupes hydroxyle, en plus d'autres constituants
[SALUNKHE, 1990]. Les polyphénols naturels vont de
molécules simples, comme les acides phénoliques, à des
composés hautement polymérisés comme les tanins.
Il existe différentes classes de polyphénols,
notamment : les acides phénoliques, les flavonoïdes, les tanins,
les stilbènes, les lignanes, les saponines, les phytostérols ou
bien phytostanols. Les plus importants sont: les acides phénols, les
flavonoïdes et les tanins.
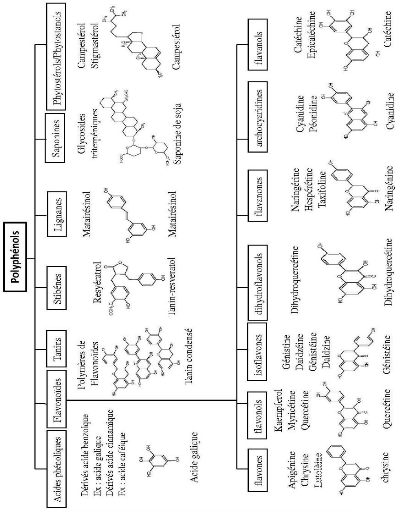
Figure. 01 : Les différentes classes des
composés phénoliques
8.2.1- Les acides phénols et les coumarines
Les acides phénoliques sont contenus dans un certains
nombre de plantes agricoles et médicinales [Psotovà et
al., 2005]. Les acides phénoliques sont formés d'un
squelette à sept atomes de carbone. Ils sont principalement
représentés dans la variété de datte Deglet Nour
par la présence de l'acide gallique, qui est généralement
lié par une liaison ester à
l'épicatéchine [Singleton et Timbreuse,
1978].
8.2.2- Les acides benzoïques
Les acides benzoïques sont formés d'un squelette
à sept atomes de carbones. Ils sont principalement
représentés par les acides p-hydroxybenzoïques,
protocatéchiques, vanilliques, galliques, cyringiques, salicyliques,
o-hydroxybenzoïques et gentisiques.
Les acides protocatéchiques et galliques ont
probablement une origine et des fonctions différentes dans la plante. Le
premier est très largement répandu, le second est plus rare, on
le rencontre dans la nature surtout sous forme de dimère
[RIBEREAU, 1968].
8.2.3- Les acides cinnamiques
Ces acides possèdent une structure du type C6-C3. Les
composés les plus fréquents sont l'acide p-coumarique, l'acide
caféique, l'acide fertarique et l'acide sinapique (Fig. 6)
[Ribereau., 1968. Goetz et al., 1999].
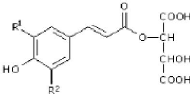
Esters
hydroxycinnamiques
|
R1
|
R2
|
|
Acide t-caféique
|
OH
|
H
|
|
Acide p-coumarique
|
H
|
H
|
|
Acide t-fertarique
|
OCH3
|
H
|
Figure. 02 : Structures chimiques de quelques
dérivés de l'ester
hydroxycinnamiques.
On rencontre au moins un de ces quatre acides dans
pratiquement tous les végétaux supérieurs. Ces acides
existent dans les tissus sous formes de différentes combinaisons
[RIBEREAU., 1968].
8.3- Les coumarines
On peut considérer que les différentes
coumarines dérivent des acides cinnamiques ortho-hydroxylés, de
même que la coumarine elle-même dérive de l'acide
o-coumarique. Les coumarines les plus fréquentes sont
l'umbelliférone ou ombelliférone, l'aesculétine, la
scopolétine, dont les substitutions correspondent, respectivement, aux
acides : p-
coumarique, caféique et férulique. Signalons
également la fraxétine et la daphnétine (voir Fig.
7) [Dean., 1963].
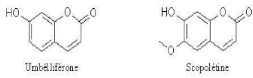
Figure. 03 : Structure chimique de quelques
coumarines [Dean., 1963].
8.4- Flavonoïdes
Les flavonoïdes (du latin flavus, jaune) sont des
substances généralement colorées répondues chez les
végétaux ; on les trouve dissoutes dans la vacuole à
l'état d'hétérosides ou comme constituants de plastes
particuliers, les chromoplastes [Guigniard, 1996].
Le terme flavonoïdes rassemble une très large
gamme de composés naturels appartenant à la famille des
polyphénols. Sont présents dans toutes les parties des
végétaux supérieurs: racines, tiges, feuilles, fleurs,
pollens, fruits, graines, bois. Leur fonction principale semble être la
coloration des plantes (au-delà de la chlorophylle, des
caroténoïdes et des bétalaïnes), même si leur
présence est parfois masquée par leur présence sous forme
"leuco", ce qui explique leur intérêt commercial dans l'industrie
alimentaire [Gabor ,1988].
8.4.1- Structure
Les flavonoïdes ont une origine biosynthétique
commune et ils possèdent tous un même squelette de base à
quinze atomes de carbone constitué de deux unités aromatiques, de
cycle en C6 (A et B), reliés par une chaine en C3 (Fig.
08) [Bruneton, 1999].
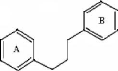
Figure. 04 : Squelette de base des
flavonoïdes [Dean, 1963].
8.4.2- Biosynthèse des flavonoïdes
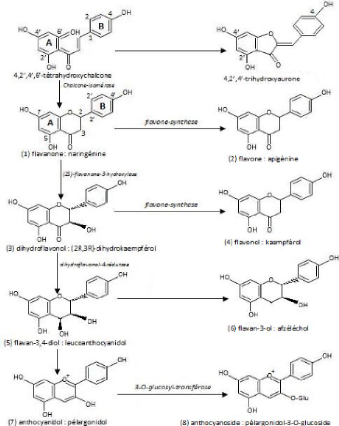
Figure. 05 : Biosynthèse des
flavonoïdes [Bruneton., 1999].
Elle se fait à partir d'un précurseur commun, la
4, 2', 4', 6'-tétrahydroxychalcone (Fig. 05). Cette
chalcone métabolisée sous l'action d'enzyme, la chalcone
isomérase, en naringenine (1). Sur cette dernière agit la flavone
synthase pour donner : apigénine (2) ou le dihydroflavonol (3). Le
dihydroflavonol, en présence de la flavonol synthase, se
métabolise en kaempférol (4) ou en le leucoanthocyanidol. Ce
dernier semble etre le précurseur des flavan-3,4-ols (6) et
anthocyanidols (7), ce dernier sous l'action de la
3-Oglycosyltransférase, se transforme en anthocyanoside (8)
[Marfek., 2003].
8.4.3- Propriétés des
flavonoïdes
Comme on a cité les flavonoïdes sont
présents en toutes les parties des végétaux
supérieurs. Certains, sont plus spécifiques de certains tissus,
comme par exemple les anthocyanes sont plutôt localisés dans les
parties externes des fruits, fleurs et feuilles. Les chalcones se retrouvent
plus fréquemment dans les pétales des fleurs. Se sont des
pigments naturels au même titre que les chlorophylles (couleur verte) et
les caroténoïdes (nuance jaunes et orangées).
De nos jours, les propriétés les
flavonoïdes sont largement étudiées dans le domaine
médical où on leur reconnaît des activités
antivirales, anti-tumorales, anti-inflammatoires, anti-allergiques et
anti-cancéreuses [Middleton et Kardasnami., 1993]. La
famille des flavonoides peut se diviser en six classes qui diffèrent par
leurs structures chimiques: flavanols, flavones, flavonols, flavanones,
isoflavones et anthocyanidines [Medic et al., 2004].
Parmi les nombreux pigments dérivants de cette structure,
il convient de citer notamment: A- Les flavonols
Les flavonols (hydroxy-3 flavone) sont largement
répondus et incolores, ils sont caractérisés par la
présence carbonylme en position 4 et d'un groupement hydroxyle en
position 3. Les flavonols qui possèdent en plus des hydroxydes en 6 ou 8
colorent certaines fleurs au jaune primevère [Guignard, 1996 ;
Alais et Linden, 1997].
Parmi les flavonols les plus répondus, on trouve le
kaempférol (OH en 4', 5, 7), le quercétol (OH en 3', 4', 5, 7)
ces deux flavonols sont incolores; le myricétol est l'isorhamétol
(Fig. 6).
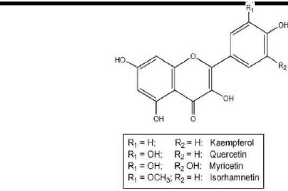
Figure. 06 : Structures chimiques de quelques
flavonols [GNU., 2007].
B- Les flavanones
Ces composés ne comportent pas des groupements OH en
position 3, et présentent de fortes similitudes de structures avec les
flavonols. Dans cette catégorie, il faut ranger les flavonoides
responsables de la saveur amère de certaines pamplemousses, citrons,
orange: la naringine (naringénol lié à du glucose et du
rhamnose), l'hespéridine. [Alais et Linden, 1997].
C- Les anthocyanes
C.1- Présentation
Les anthocyanes (du grec anthos, fleur et Kuanos, bleu violet)
terme général qui regroupe les anthocyanidols et leurs
dérivés glycosylés [Guignard, 1996]. Ces
molécules faisant partie de la famille des flavonoïdes et capables
d'absorber la lumière visible, sont des pigments qui colorent les
plantes en bleu, rouge, mauve, rose ou orange [Harborne., 1967.
Brouillard., 1986].
Leur présence dans les plantes est donc
détectable à l'oeil nu. A l'origine de la couleur des fleurs, des
fruits et des bais rouges ou bleues, elles sont généralement
localisées dans les vacuoles des cellules épidermiques, qui sont
de véritables poches remplis d'eau [Mclure, 1979; Harbone et
Grayer, 1988; Merlin et al., 1985].
Si la coloration des fleurs et des fruits est leur rôle
le plus connu, on trouve également les anthocynes dans les racines,
tiges, feuilles et graines. En automne, les couleurs caractéristiques
des feuilles des arbres sont du aux anthocyanes et aux carotènes qui ne
sont plus masqués par la chlorophylle.
C.2- Structures
Leur structure de base est caractérisée par un
noyau "flavon" généralement glucosylé en position C3
[Ribereau, 1968]. Les anthocyanes se différencient par
leur degré d'hydroxylation et de méthylation, par la nature, le
nombre et la position des oses liés à la molécule.
L'aglycone ou anthocyanidine constitue le groupement chromophore du pigment
(Fig. 07).
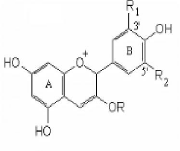
|
Anthocyanidines
R=H
|
R1
|
R2
|
|
Malvidine
|
OCH3
|
OCH3
|
|
Péonidine
|
OCH3
|
H
|
|
Delphinidine
|
OH
|
OH
|
|
Pétunidine
|
OCH3
|
OH
|
Si la forme est monoglucoside: R= glucose
Figure. 07: Structure de quelques anthocyanidine
[Ribereau., 1968].
C.3- Propriétés des anthocyanes
+ Le spectre d'absorption : Comme tous les
flavonoides, les anthocyanidines présentent une absorption
caractéristique dans le domaine UV [Markham, 1982]. La forme cationique
de l'anthocyanidine est caractérisée par deux bandes
d'absorption, dont une bande intense dans le domaine du visible,
caractéristique pour chacune d'ente elles [Harbone, 1967]. Ce maximum
d'absorption subi un effet bathochrome quand la polarité des solvants
diminue (solvatochromie négative), par contre on observe un effet
hypsochrome quand les positions 3' et 5' sont méthoxylées ou
glycosylées. Les sucres augmentent la solubilité et la
stabilité des anthocyanes.
+ Modification de la structure en fonction de
l'acidité : Le pH est un facteur important dans le changement
de couleur des anthocyanes. La variation de structure de l'anthocyane en
fonction du pH est une particularité de ces molécules. Les
observations visuelles d'une solution aqueuse d'anthocyane montrent la forte
coloration rouge d'une solution à pH très acide, la coloration
décroît quand le pH augmente vers la neutralité. Une
solution neutre d'anthocyane fraîchement préparée est bleue
mais se décolore rapidement.
Ces changement de couleurs sont dus à des
équilibres chimiques entre différentes formes que peut prendre
l'anthocyane [Brouillard et Delaporte, 1977; Brouillard,
1982].
+ Décoloration par le Bisulfite de Sodium
: La décoloration des anthocyanes par l'acide sulfureux et les
bisulfites alcalins est une réaction connue depuis longtemps. Cette
réaction se fait mieux à pH 3 qu'à pH 1. D'autre part la
réaction est réversible mais uniquement dans le cas des
anthocyanines. La difficulté de la réaction en milieux acide
s'explique par le passage du bisulfite sous forme d'acide sulfureux moins
dissocié, avec diminution de la concentration en ions HSO3
[Ribéreau, 1968].
9- Propriétés antimicrobiennes du
miel
Quelles sont les substances contenues dans le miel mure qui
sont responsables de l'activité antibactérienne ? On a
déjà décelé différentes `'inhibines dites
non peroxydes» telles que des lysozymes, flavonoïdes, acminés
du miel. Il s'est révélé que des substances volatiles et
aromatiques du miel possédaient également une
propriété antibactérienne (les publications de
Molan, 1992 et 1997 offrent un aperçu complet des substances
antibactériennes et des effets du miel).
Bien que l'efficacité antibacterienne de quelque
composants ait été identifiée, une analyse
systématique de la nature chimique des substance non-peroxydes n'a pas
encore été effectuée.
Quelle importance revetent les inhibines non peroxydes pour
l'activité antibactérien du miel ? Outre cette question,
l'origine des inibines non peroxydes est également l'objet de vives
discussions. Selon certaines études, certaines substances ont une
origine végétale et d'autres sont ajoutées par les
abeilles lors de l'élaboration du miel. ides aromatiques et autres
composants indéte.
Les propriétés antimicrobiennes du miel ont
été exploitées par les hommes, on sait aujourd'hui que le
miel provenant d'une ruche saine ne contient pas de bactéries, sous
forme végétative. Comme explication de l'activité anti
bactériostatique et bactéricide du miel, on avait donne sa teneur
en sucre ou bien, la présence de pollen transformé ou encore son
pH (LIBIS., 1971). Selon le même auteur la valeur
antibiotique du miel est attribuée à l'inhibée, qui est
une enzyme très fragile à la chaleur et à la
lumière ; il affirme que pour conserver l'activité de cette
enzyme il ne faut pas dépasser 80°C pendant de 30 minutes Selon
DESCOTTES (2004), quatre facteurs sont mis en
avant à savoir :
9.1- L'osmolaritéL'effet
osmotique est la conséquence de la forte teneur en sucre 84%
étant un
mélange de fructose et glucose dans le miel. Ce dernier
agit comme une solution hypertonique et l'eau contenue représente
habituellement 15 à 21% du poids
La forte interaction de ces molécules de sucres avec
les molécules d'eau laisse très peu de molécules d'eau
disponible pour les micro-organismes et conduit à une
déshydratation qui absorbe l'eau vitale de ces derniers.
Teneur en eau du miel Effet de la richesse en levure. Le nombre
de germes de fermentation est exprimé par gramme de miel.
Moins de 17,1 % Pas de fermentation quelle que soit la richesse
en l levures. 17.1 à 18,0 % Pas de fermentation si le nombre de levures
ne dépasse pas 1000. 18,1 à 19.0 % Pas de fermentation si le
nombre de levures ne dépasse pas 10. 19,1 à 20.0 % Pas de
fermentation si le nombre de levures ne dépasse pas 1.
Plus de 20 % Danger de fermentation dans tous les cas.
L'effet osmotique joue un rôle fondamental dans l'action
anti bactérienne du miel, toutefois un certain nombre de
bactéries n'étant pas inhibées dans des milieux à
faible coefficient hydrique, il est clair que d'autres mécanismes
interviennent.
9.2- L'effet du pH
Le pH du miel est relativement acide, il varie entre 3,2 et 4,5.
Cette acidité est principalement du à sa teneur en acide
gluconique et en gluconolactone.
D'autres études retrouvent la persistance d'une
activité antibactérienne marquée lorsque le miel a
été neutralisé. Malgré ces observations cela ne
signifie pas que l'acidité ne contribue pas à l'activité
antibactérienne du miel.
Le pH du miel semble être suffisamment bas pour ralentir ou
éviter la croissance de nombreuses espèces
pathogènes.
9.3- Le peroxyde d'hydrogène H2O2
L'activité antimicrobienne de certains miels dépend
de leur contenu en peroxyde d'hydrogène endogène
(BRUDZYNSKI., 2006).
L'eau oxygénée aussi appelée peroxyde
d'hydrogène est considérée comme la principale inhibitive
du miel. Elle est produite par réaction enzymatique ; c'est la
glucoseoxydase, sécrétée par les glandes hypopharyngiennes
de l'abeille lors de la transformation du nectar en miel qui permet la
réaction suivante :
Glucose +O2 Glucose-oxydase Gluconolactone
+H2O2 CatalaseAcide gluconique.
La réaction montre que la production d'eau
oxygénée et d'acide gluconique résulte de l'oxydation de
l'eau et du glucose. La catalase réduit l'eau oxygénée,
ainsi la concentration en peroxyde dépend donc de l'activité de
ces deux enzymes.
L'eau est indispensable au processus d'oxydation, c'est ainsi que
le peroxyde d'hydrogène se forme uniquement dans le miel non-mur ou
dilué, dans le miel mur, leProcessus est bloqué, avec
possibilité de réactivation par dilution (BOGDANOV et
BLUMER., 2001).
Tableau01: Activités biologiques des
composés polyphénoliques
[Frankel et al.,
1995].
|
Polyphénols
|
Activités
|
Auteurs
|
|
Acides phénols (cinnamique
et
benzoïque)
|
Antibactériens
Antifongiques
Antioxydants
|
[Didry et al., 1982]
[Ravn et al., 1984]
[Hayase et Kato,
1984]
|
|
Coumarines
|
Vasoprotectrices et
antioedémateuses
|
[Mabry et Ulubelen, 1980]
|
|
Flavonoides
|
Antitumorales
Anticarcinogènes
Anti-inflammatoires
Hypotenseurs
et diurétiques
Antioxydants
|
[Stavric et Matula, 1992]
[Das et al., 1994]
[Bidet et
al., 1987]
[Bruneton., 1993]
[Aruoma et al., 1995]
|
|
Anthocyanes
|
Protection des veines et
capillaires
|
[Bruneton., 1993]
|
|
Proanthocyanidines
|
Effets stabilisants sur le
collagène
Antioxydants
Antitumorfales
Antifongiques
Anti-inflammatoires
|
[Masquelier et al., 1979]
[Bahorun et al., 1996]
[DE Oliveira et al., 1972]
[Brownlee et al., 1992]
[Kreofsky et al., 1992]
|
Des recherche ont décelé différents
inhibiteurs dites peroxydes tel que lysozymes, flavonoïdes, les acides
aromatiques et d'autres composants indéterminés du miel.
Certaines Substances ont une origine végétale et
d'autres sont ajoutées par abeilles
lors de l'élaboration. du miel (BOGDANOV ET
BLUMER., 2001).
Prenons le cas des flavonoïdes ; des recherches sur le miel
ont permis de mettre en évidence des substances qui sont d'origine
botanique et qui contribuent à défense de l'organisme en
renforçant lez système immunitaire (LAFFONT.,
2000).
9.4- Propriétés anti-inflammatoires et
diabète
Des recherches récentes nous démontrent que les
flavonoïdes, notamment les flavonols du cacao, peuvent aussi
prévenir la douleur musculaire, en accélérant la
réparation des tissus au niveau moléculaire.
Spécifiquement, ils éliminent la synthèse de l'oxyde
nitrique, déclencheur chimique de l'inflammation.
On a également démontré que d'autres
flavonoïdes inhibaient la sécrétion des mastocytes
impliqués dans les phénomènes inflammatoires. C'est
également de même processus de synthèse de l'oxyde nitrique
qui renverserait la dysfonction endothéliale responsable des pathologies
diabétiques. Des polyphénols issus du miel et de la cannelle
potentialiseraient l'action de l'insuline dans les cellules. (Journal
of agriculture and food chemistry, vol.55, no, 11, May 30 2007
:4366-4370).
9.5- Anti-radicalaire
Les flavonoïdes ont la capacité de piéger
les radicaux libres (hydroxy, anion superoxyde et des radicaux peroxy
lipidiques), générés par notre organisme en réponse
aux agressions de notre environnement (cigarette, polluants, infections, etc.)
et qui favorisent le vieillissement cellulaire. Ces composés renforcent
nos défenses naturelles en protégeant les constituants
tissulaires. Les études in vivo du Dr Blumberg suggèrent que les
flavonoïdes interrompent le passage du stress oxydatif et interceptent le
"message" de l'apoptose (mort cellulaire programmée). (Journal
of nutrition, november 2002).
9.6- Antiangiogénique
La delphinidine et l'acide éllagique sont capables de
bloquer la formation des nouveaux vaisseaux sanguins dan les tumeurs (ce
processus appelé angiogenèse) qui sont essentiel à la
progression du cancer, car il permet aux cellules cancéreuses
d'être alimentées en oxygène et nutriment. On peut donc
considérer la delphinidine et l'acide éllagique comme des agents
de prévention extrêmement importants, capables de freiner le
développement d'un large éventail de cancer.
10- Le miel et les flavonoïdes : les derniers
études
Le miel, cette substance on ne peut plus naturelle,
guérit en quelques semaines les plaies infectées et
récalcitrantes, qu'il s'agisse de brûlures, d'ulcères
variqueux, d'incisions chirurgicales ou de lésions consécutives
à un diabète.
Ce remède, qui figurait dans la pharmacopée des
anciens Égyptiens il y a des milliers d'années, est aujourd'hui
redécouvert par le corps médical, aux prises avec des microbes
qui résistent à la plupart des antibiotiques courants. Outre son
effet antibactérien, le miel a plusieurs autres vertus qui concourent
à accroître son utilisation en médecine moderne. C'est le
cas en Australie, en Nouvelle-Zélande et en Europe notamment, où
une préparation stérile destinée aux soins des plaies,
baptisée Medihoney, vient d'être homologuée par l'Union
européenne.
L'équipe du Dr Arne Simon, pédiatre-oncologue
à l'Université de Bonn, en Allemagne, a appliqué la
substance dorée pour la première fois en 2002 sur la plaie
postopératoire d'un enfant de 12 ans à qui on avait retiré
une tumeur maligne (un lymphome) dans l'abdomen. Comme chez tous les jeunes
patients recevant une chimiothérapie, la plaie tardait à
guérir et était même infectées par le staphylococcus
aureus résistant à la méticilline (SARM), qui
menaçait de se répandre dans la circulation sanguine et de
provoquer la mort de l'enfant compte tenu de l'affaiblissement du
système immunitaire des personnes qui subissent une
chimiothérapie. «Avec le miel, la plaie a guéri en l'espace
de 48 heures et le garçon a alors pu sortir de l'hôpital", raconte
le Dr Simon au bout du fil depuis Bonn. «À partir de ce
moment-là, nous avons décidé d'étudier plus
systématiquement l'effet de Medihoney ".
Impressionnés par les résultats qu'ils ont
obtenus en diverses circonstances avec Medihoney, les chercheurs allemands ont
cru bon de les confirmer dans une vaste étude multicentrique qu'ils
mettent actuellement en branle. Ils sollicitent donc la participation de
professionnels de la santé spécialisés dans le soin des
plaies et travaillant dans divers hôpitaux de la planète, à
qui ils enverront un logiciel permettant de colliger leurs observations
cliniques sur l'emploi de Medihoney comparativement aux traitements plus
conventionnels.
L'activité antimicrobienne du miel que louent les
chercheurs allemands s'exerce d'abord par osmose en raison de la très
forte concentration en sucre de la substance sirupeuse, qui dépasse de
beaucoup celle des tissus environnants et des bactéries, qui se vident
alors de leur contenu en liquide. En induisant la migration de l'exsudat -- le
liquide
qui suinte à travers les parois des vaisseaux -- vers
la surface de la plaie, l'effet osmotique crée une interface humide et
peu adhérente entre le pansement et la plaie, ce qui facilite le
changement des pansements. Cette intervention devient ainsi moins douloureuse
pour le patient et n'endommage pas les couches de peau nouvellement
formées.
Par ailleurs, une enzyme, le glucose oxydase, introduite par
les abeilles dans le miel au moment de sa production, synthétise du
peroxyde d'hydrogène de façon continue et en petites
quantités, néanmoins suffisantes pour tuer les germes sans
toutefois détruire les cellules de la peau, contrairement à
l'application ponctuelle d'un antiseptique qui, de plus, perdra son pouvoir
antimicrobien au fil du temps.
Les composés phytochimiques présents dans le
nectar de certaines fleurs que butinent les abeilles contribuent aussi à
l'action bactéricide du miel, qui se manifeste jusque dans les tissus
infectés situés en profondeur. C'est pourquoi la source florale
du miel est d'une grande importance car certains miels, notamment ceux issus du
nectar de deux espèces de Leptospermum (manuka et jellybush), des
arbrisseaux de Nouvelle-Zélande et d'Australie, peuvent être
jusqu'à 100 fois plus actifs contre les micro-organismes que les autres
miels en raison de leur contenu particulièrement élevé de
ces composés phytochimiques, souligne le Dr Simon.
L'effet antibactérien des miels de Leptospermum
s'avère efficace pour combattre diverses bactéries, par exemple
le SARM, les entérocoques résistants à la vancomycine et
Pseudomonas sp contre lesquelles les antibiotiques sont
inopérants. Jusqu'à maintenant, on ne rapporte aucune
résistance de la part des bactéries d'intérêt
clinique au miel, «probablement en raison de la nature peu
spécifique de son action bactéricide, ce qui en fait une solution
de rechange intéressante aux antibiotiques», souligne le Dr
Simon.
En plus de tuer les micro-organismes, le miel a divers autres
effets intéressants. Il diminue l'dème et l'inflammation des
tissus. Il déloge et repousse les tissus morts. Il agit à la
manière d'un désodorisant puisqu'il chasse cette odeur
désagréable qui émane de certaines plaies infectées
et qui handicape énormément les patients, au point où ils
n'osent plus quitter leur domicile.
De plus, son coût est loin d'être prohibitif,
contrairement à celui des pansements à base d'argent, qui font
partie des nouveaux traitements employés dans le soin des plaies. Un
tube de Medihoney peut servir à faire plusieurs pansements et se vend
pour aussi peu que dix euros .
Malgré ces multiples effets bénéfiques, le
Dr Simon déconseille d'utiliser du miel
acheté dans les magasins d'alimentation pour soigner
les blessures, les brûlures ou les plaies vives car ce miel contient
à l'occasion des spores de la bactérie Clostridium botulinum,
responsable du botulisme. C'est aussi pour cette raison qu'on doit
éviter de donner du miel aux très jeunes enfants, car une fois
dans leur appareil digestif immature, les spores pourront se réactiver
et sécréter des toxines susceptibles de provoquer de graves
malaises, souligne le médecin.
Les préparations de miel de Leptospermum comme
Medihoney ont quant à elles subi une stérilisation par
irradiation aux rayons gamma. Cette irradiation n'entame pas leur
activité antimicrobienne et rend leur utilisation plus
sécuritaire en clinique. Ces préparations sont également
soumises à un contrôle de qualité qui assure
l'uniformité de leur pouvoir antibactérien.
Même si l'effet curatif des mixtures de miel comme
Medihoney est incontestable et puissant, le Dr Simon ne recommande pas qu'on
l'emploie en premier lieu pour soigner une plaie ouverte et infectée
puisque la libération de peroxyde d'hydrogène qu'il induit n'est
pas immédiate. «Pendant les premières 48 heures, il faut
traiter les plaies infectées avec un véritable antiseptique.
Ensuite, on poursuit le traitement avec le miel [Medihoney], dont l'effet
soutenu s'avère très bénéfique. Lors du changement
de pansement, on ne fait que rincer la plaie avec une solution de Ringer
stérile [une solution d'eau distillée contenant divers sels
à une concentration semblable à celle des liquides
corporels]», prévient le spécialiste allemand.
Dans le milieu médical québécois, les
propriétés curatives du miel, et particulièrement des
préparations conçues spécifiquement pour le soin des
plaies, semblent être plutôt méconnues, et ce, en partie
parce que ces mixtures ne sont pas disponibles au Canada. Certains
spécialistes l'ont néanmoins déjà employé
avec succès. Lincoln D'Souza, infirmier clinicien au Centre
Universitaire de santé McGill, affirme y avoir recours pour quatre
à cinq patients par année, le plus souvent à la demande de
ces mêmes patients qui ont réussi à se procurer une
préparation à l'étranger. A chaque occasion, il a obtenu
d'excellents résultats. «Nous ne l'utilisons pas
régulièrement car il n'est pas disponible. S'il le devient, il
aura sa place dans notre pharmacopée, peut-être pas comme premier
traitement à suivre mais en combinaison avec d'autres technologies de
pointe», dit-il.
Le Medihoney est actuellement disponible dans la plupart des
pharmacies de France, d'Allemagne, d'Autriche et de Grande-Bretagne ainsi qu'en
Australie, d'où vient ce produit.
Isabelle Reeves, professeur à l'École des
sciences infirmières de l'Université de Sherbrooke, connaît
le mécanisme par lequel le miel entraîne la guérison des
plaies. Elle hésite toutefois à le substituer aux nouveaux
pansements à base de nanocristaux d'argent qui, à ses yeux,
représentent en ce moment le traitement par excellence.
Comme une nouvelle etude Le miel pourrait réussir
là où les antibiotiques échouent dans le traitement de
sinusites chroniques, croient des chercheurs canadiens de l'Hôpital
d'Ottawa.
Lors d'essais in vitro, les chercheurs ont
démontré que certains miels étaient non seulement
efficaces contre deux bactéries résistantes aux antibiotiques,
mais qu'en plus ils pouvaient traverser la pellicule biologique qui les isole.
Cette pellicule est formée par un regroupement de micro-organismes,
protégeant la colonie de bactéries contre l'action des
antibiotiques.
11- Le miel et Islam
Le miel était depuis l'antiquité un bon
remède pour un ensemble de maladies, et ses effets sur la
longévité et la bonne santé étaient très
connus. Ne serai-ce comme preuve que l'état de santé quasi
parfait des élévateurs d'abeilles. L'histoire elle-même
nous rapporte un certains nombre de personnes, célèbres, d'une
longévité remarquable, et qui avaient, pour secret, un
régime alimentaire à base de miel. Vitagor à titre
d'exemple, mangeait le pain et le miel régulièrement. Son
âge dépassait 90 ans.
Le grand maître de la médecine Hypochrate, dont
l'age était de plus de 108ans, avait pour repas quotidien le miel. Les
exemples sont nombreux.
Mais, on est en droit de se demander : les musulmans avancent
que le Coran parles des remèdes contenus dans le miel, tout en sachant
que de nombreuse nations, tels les Pharaoniens, les Grecs, les Romans.
L'utilisaient autant que remède, et qu'il fut déjà
cité dans les autres Livres Saints ; en quoi donc consiste la
nouveauté dans le Coran et où ce miracle résides t-il donc
? La réponse s'éclaircit dans les 3 points suivants :
1- Dieu ne cite pas le miel explicitement, mais parle de ce
qui sort du ventre des abeilles. Toute le liberté donc, est à
l'homme d'étudier les excrétions des abeilles, à savoir,
le miel, l'alimentation royale, la cire, voire le poison.., de connaître
leur caractéristiques et d'analyser leurs compositions. C'est
l'étape de connaissance.
2- Toutes ces substances, citées si-dessus, sont des
remèdes. Sans une analyse de près, l'homme serait incapable
d'attribuer chaque maladie à son remède. Le Coran l'invite, de ce
fait, à faire des recherches et des expériences sur ces
substances pour en raffiner les connaissances et en tirer profit. C'est
l'étape de l'expérimentation.
3- Le Coran annonce textuellement « une guérison
pour les gens. Il n'a pas dit : remède pour tout le monde. Ce qui
signifie que pas toutes les maladies vont être traitées par du
miel, seulement certaines.
Ces trois petites remarques ont, pour point commun,
l'invitation à méditer, à réfléchir et
rechercher, qu'ouvre le Coran. C'est ici que réside le miracle. Car
à la fin du verset, Dieu dit : « Il y a vraiment là une
preuve pour des gens qui réfléchissent ».
Voici à présent quelques extraits des
publications faites au sujet du miel exposant différentes recherches
réalisées et leurs résultats.
v' Les microbes ne résistent pas au
miel
Tel est le titre d'un article publié dans la revue
Lancet infect Dis, en Février 2003. dans cet article, le Dr Dixon
confirme la grande efficacité du miel à contrôler,
irrésistiblement, un grand nombre de microbes. Il finit par recommander
le miel comme traitement des brûlures et des plaies. « tous les
types de miel - rapporte le Pr Molan - ont un pouvoir anti-microbe,
malgré que certains sont plus efficaces que d'autres. Le miel inhibe la
croissance microbienne et désinfecte ainsi les plaies ».
De nombreuses autres recherches ont démontré les
propriétés antimircobiennes du mile in vitro. Au même
titre, un grand nombre de recherche in vivo, on confirmé que
l'utilisation du miel dans les plaies très inflammées, a permis
le nettoyage des suppurations et la réduction du temps de cicatrisation.
« le miel était - précise le Pr Molan, de
l'Université de waikato en Newzeland - un élément de base
dans le traitement des plaies, quelques siècles auparavant. Mais avec
l'apparition des antibiotiques, il est devenu une «
mode dépassée ». Malheureusement, la
résistance aux antibiotiques ne cesse de se développer et demeure
un grand problème médical. Ce qui a fait ré-surgir le miel
dans le traitement de ces cas ».
ü Le miel inhibe la bactérie : Pseudomonas
aeruginosae
Ceci est rapporté par le Dr Cooperen guise
d'introduction à son étude, publiée dans la revue J Bur
Care Rehabil, en Décembre 2002 : « En l'absence d'un traitement
parfait des brûlures suppurées dont l'agent est Pseudomonas
aeruinosea, la recherche d'autres moyens thérapeutiques plus efficace
s'imposes ».
Certaines études récentes parlent du miel,
connu d'ailleurs pour son utilisation ancienne, autant qu'agent
anti-pseudomonas. C'est ainsi que le Dr Cooper et ses collaborateurs, de
l'Université de Kardief, en Angleterre, ont évalué la
sensibilté de 17 sous-types de Pseudomonas, prélevées au
niveau de brûlures suppurées, à deux types de miel : le
miel « pasture » et « manuka ». tous les sous-types lui
étaient sensibles à une concentration inférieure à
10% (g/ml). En plus, les 2 types de miel ont gardé la même
efficacité, même après dilution à une concentration
dix fois moins. Conclusion : le miel, par ses effets anti-microbes, est apte
à ~tre l'un des traitements efficaces des suppurations des
brûlures dues à Pseudomonas aeruginosea.
ü Le miel et la santé buccale
Le Pr Molan a insisté, dans un article dans la revue
Gent Dent, en Décembre 2001, sur le rôle que jouerait le miel dans
le traitement des maladies de la gencive, ainsi que les ulcérations
buccales et autres pathologies ; et ce, grâce à ses
propriétés anti-bactériennes.
ü Le miel dans le traitement des muscites post
radiques
La revue Support Care Cancer a publié, en Avril 2003,
une étude effectuée sur 40 patients, atteints de cancers dans la
région cervicale et la tête, et nécessitant une
radiothérapie. Les patients ont été partagés en 2
groupes. Le 1er groupe a reçu la cure de radiothérapie
directement après diagnostic. Le 2ème groupe, a
bénéficié, avant la cure de radiothérapie, d'une
application locale du miel au niveau buccal. Les patients ont pris 20g de miel
15 minutes avant et après la cure, puis 6heures après la cure.
L'étude a montré une baisse importante du taux de survenue de
muscite chez les patients ayant utilisé du miel, (75% dans le
1er groupe, versus 20% dans le 2ème groupe).
La conclusion des chercheurs souligne que l'application du
miel localement, au cours des séances de radiothérapie, est une
méthode efficace et peu coûteuse, de prévenir les miscites
postradiques au niveau buccal. Une conclusion qui mérite, d'être
confirmée par d'autres études multicentriques pour soutenir ces
résultats.
v' Le miel dans les affections de l'estomac et des
intestins
Dans une étude publiée dans la revue Pharmacol
Res en 2001, les chercheurs ont prouvé que le miel a bien, une place
dans le traitement des gastrites (inflammation de l'estomac). Des
lésions et des ulcérations ont été
provoquées chez des rats, par l'administration d'alcool alors qu'un
2ème groupe de rats ont reçu du miel, avant de leur
administrer l'alcool. Il a été noté que le miel a
protégé l'estomac des lésions que peut provoquer l'alcool.
Une autre étude similaire a été publiée, en 1991,
par la revue scandinave des maladies gastrologiques.
Aussi, les chercheurs ont-ils procédé à
tester l'efficacité du miel naturel sur la bactérie la plus
communément connue pour son incrimination dans la pathogénie de
l'ulcère gastrique, et les gastrites, appelée Helicobacter
Pylori. Ils ont montré que l'administration d'une solution de miel
concentrée à 20% a inhibé cette bactérie in vitro.
Cette étude est publiée dans la revue Trop Gastroent en 1991.
D'autres expériences sont nécessaires pour étudier cet
effet chez l'homme.
En lisant les hadiths du Prophètes, on
s'aperçoit que le Prophète a parlé de cette
propriété du miel. Dans un Hadith rapporté par Boukhari et
Mouslim, un homme venant chez le Prophète et lui dit : Mon
frère a une diarrhée. Le Prophète lui répondit :
« donne-lui du miel ». Il lui en donna. Puis il revenu chez le
Prophète et lui dit : je lui en ai donné, mais il n'a fait que
aggraver sa diarrhée. Il répéta la scene à trois
reprises. En venant une 4ème fois, le Prophète lui
répondit encore : « donne lui du miel », il
contesta : je lui en avais donné, il s'aggrave toujours. Le
Prophète lui donc précisa : « Dieu a raison, alors que le
ventre de ton frère lui, ment ». Il lui en donna, et il
guérit.
En effet, le fameux BM J a publié en 1985 une
étude réalisée au près de 169 enfant atteints de
gastro-entérite. 80 parmi eux, ont reçu le sérum
glucosé associé à 50 ml de miel au lieu du glucose. Les
chercheurs ont noté que la diarrhée, due à la
gastro-entérite, a duré
93 heurs chez les enfants n'ayant pas reçu le miel ; alors
que les bénéficiers de la cure du miel ont eu une durée
moins (58heurs).
Le miel et le cuir chevelu
En se basant sur les effets antimicrobiens, antifongiques et
antioxydants du miel, un chercheur, le Dr Al Willis, a étudié
l'effet du miel en traitement de la dermatite séborrhéique. Il a
étudié 30 patients, 10 hommes et 20 femmes, atteints de cette
maladie qui touche le scalpe, le visage et la partie antérieure du
thorax ; avec un âge entre 15 et 60 ans.
Les lésions dermatologiques, chez ces patients,
étaient des squames blanches sur une surface
érythémateuse. Les patients appliquaient une solution à
base de miel (90% de miel dans de l'eau tiède) une fois tous les deux
jours, sur les zones atteintes, notamment, le scalpe, le visage et le thorax,
avec un massage de 2 à 3 minute, pour une durée de 3 heure avant
de se rincer par de l'eau tiède. Un suivi quotidien de ces patients
était établi, sur les critères de prurit, squames et chute
de cheveux. Le traitement a duré 4 semaines, avec une bonne
réponse ; les patients ne se plaignent plus de prurit ni de squames
à partir de la 1ère semaine de traitement. Les autres
lésions ont complètement disparu au bout de 2 semaines.
Puis, la surveillance de ces patients a continué
pendant 6 mois, avec une application une fois par semaine du miel sur les zones
atteintes. Aucune rechute n'a été signalée chez les 15
patients qui n'ont pas arr~té le traitement. Tandis que les
lésions ont réapparu chez 12 patients parmi les 15 qui ont
arrêté le traitement.
Le Dr Willis a conclu, en fin de son étude, que le
miel, en traitement local, peut très bien, améliorer les
symptômes de la dermatite séborrhéique, et empêche la
survenue de rechute s'il est utilisé une fois par semaine.
12- Utilisation du miel et consommation
Le miel, un des premiers aliments de l'homme,
déjà connu à l'ère néolithique, a toujours
été considéré comme un produit à part :
aliment de douceur, médicament à tout faire, édulcorant
noble, produit de beauté, sans parler de l'hydromel, miel
fermenté, nectar des dieux.
Au début du siècle, il était encore
très employé, mais son prix n'a fait que croître, et les
matières sucrantes concurrentes telles que le sucre inverti et le
glucose l'ont progressivement remplacé.
Actuellement le miel est surtout utilisé comme fourrage
(sucre cuit par exemple) ou comme substance d'aromatisation. En effet, il est
très difficile à un arôme artificiel de remplacer le
goût et l'arôme que le miel apporte.
Le miel est également un bon édulcorant, de
goût spécial, pour diversifier les préparations.
Il peut tout édulcorer, et s'utilise dans les boissons
ou comme la confiture : en tartine, en pâtisserie.
Dans tous les pays, chez tous les peuples, les
préparations à base de miel sont légion; elles jouent
même, pour beaucoup, un rôle nutritionnel de premier ordre. Des
centaines de milliers de tonnes sont, chaque année, utilisées.
Pâtisserie, biscuiterie et confiserie se trouvent bien sûr en bonne
place : pains d'épice, gâteaux (comme le mouqueron) et nougats y
dominent largement.
La fabrication d'hydromel, si elle en utilise de modestes
quantités chez nous, en absorbe des volumes considérables en
Afrique et en Amérique du Sud. Il constitue la base du pain
d'épice, celles des pâtisseries d'Afrique du Nord, de Turquie, des
marinades de volaille de Chine. Le miel n'a pas en France la place qu'il
mériterait, avec une consommation de 600 g par personne et par an
(Allemagne : 1600 g).
D'autres usages, secondaires mais économiquement non
négligeables, concernent les préparations industrielles pour
petit déjeuner, aliments pour sportif ...etc
Le meilleur est sans doute le miel de serpolet ou de thym;
celui de romarin, d'oranger, de rose, d'acacia ou de lavande sont
également très recherchés. Néanmoins, le miel de
sapin, fort prisé car cher, a un arrière-goût de
résine très désagréable. Certaines plantes
vénéneuses (belladone) donnent un miel toxique, les abeilles
n'étant pas sensibles au venin. Si l'énorme majorité des
miels vendus dans le commerce sont de bonne qualité - seul le goût
est déterminant- quelques rares autres miels peuvent renfermer du sirop
de glucose additionné, de la fécule ou de la craie : ajouts
interdits qui donnent de la tenue à certains miels ternes.

1- Matériel et méthode
1.1- Matériel biologique
1.1.1-Le miel
Les miels peuvent être classés selon la nutrition
(multi floraux, ou miel toutes fleurs), ou selon les lieux de récolte
(miel de montagne, de forêt, etc.), ou encore suivant les saisons (miel
de printemps ou d'été). (DONADIEU,
1984).
Les échantillons de miel utilisés sont
caractérisés par :
E1 : miel poly floraux de la zone de Batna a
odeur caractérisé et couleur foncé
E2 : miel de la zone de Soudan a odeur
très fort et couleur très foncé
E3 : miel de cèdre et feuilles
d'eucalyptus de la zone d'el Oued a couleur claire
1.1.2- Les micro-organismes testés
Les souches bactériennes testées nous ont
été fournies par le laboratoire de l'établissement Mohamed
Boudiaf.
Il s'agit d'isolats cliniques responsables d'infections
nosocomiales : Staphylococcus aureus, Escherichia coli et Clostridium
vulgaris
1.2- Méthode d'étude
1.2.1- Vérification de la pureté du
miel
La pureté de miel dépend de la dissolution
totale de miel lorsqu'il n'y a pas des additifs artificiels (surtout les
sucres). La pureté dépend de la teneur limitée en sucre
lorsqu'il y a une oxydation partielle au cours d'une exposition au feu
(Site 1).
Il existe quelques tests simples qui permettent de
vérifier de la pureté du miel :
1.2.1.1- Test de dissolution
· Obtenir un verre d'eau et une cuillère à
soupe de miel sont tout le nécessaire pour le premier test.
· Vider le miel dans l'eau. Si le miel est impur, il se
dissoudra dans l'eau, si il est pur, le miel se coller ensemble et évier
comme une masse solide au fond du verre.
· Ce test peut aussi être accomplir par le
mélange de parties égales de miel et d'alcool à
brûler (alcool dénaturé). Si le miel est pur, il se
dépose au fond du verre, s'il est impur il est plus susceptible de
rester dissous et rendre la solution laiteuse.
1.2.1.2- L'essai à la flamme
Ce test est meilleur, si vous n'avez pas beaucoup de miel
à revendre.
· Obtenir un briquet et une bougie avec une mèche de
coton.
· Trempez la mèche de coton dans un peu de miel, et
secouer l'excédent.
· Allumer la mèche. Si le miel est
brûlé, il est pur. S'il refuse de brûler, alors il est moins
pur.
1.2.2- Tests chimiques préliminaires
Nos trois échantillons de miel ont subi des tests
chimiques pour confirmer la présence ou l'absence de certains
métabolites secondaires.
1.2.2.1- Saponosides
On utilise la propriété qu'ont les solutions
aqueuses de saponosïdes de donner par agitation une mousse persistante
après une macération de (2g) de chaque miel étudies dans
trois bichers différents contenant (80 ml) d'eaux distillée.
1.2.2.2- Détection des
polyphénoles
A - Les flavonoïdes
La méthode utilisée est celle dite
(réaction de SHIBATA)
- Mettre 2 ml d'extrait aqueux à 10% dans un tube
à essai
- Ajouter 5 ml d'alcool chlorhydrique (4 ml et OH + 1 ml HCl
concentré) et 2 ou 3 copeaux de magnésium. Une coloration rose
orangé ou violacée apparaissant lorsqu'il y a des
flavonoïdes.
B - Les tanins
La réaction effectuée est l'action de chlorure
ferrique (FeCl3) 5% sur l'extrait aqueux à 10%, l'apparition d'une
coloration bleu noire ou verte dénotant la présence de tanins.
(HARBORNE, 1968 ; RIBEREAU- GAYON, 1968)
1.2.2.3- Les alcaloïdes
2 ml d'une solution d'extrait à 10% dans l'eau
additionnée d'une goutte de HCl concentré et 3 gouttes de
réactif de Mayer. Pas de formation d'une précipitation jaune
blanche signifie l'absence d'alcaloïdes.
1.2.2.4- Cardénolides
5 g de miel sont macérés avec 20 ml d'eau
distillée dans trois bicher différents, 10 ml de filtrats est
mélangé avec 10 ml de (CHCl3, et éthanol). La phase
organique est évaporée, et est dissous dans 3 ml d'acide
acétique, simultanément alors a déplacé à
une éprouvette.on ajoute quelques gouttes de FeCl3, et a suivi en
ajoutant 1 ml d'acide sulfurique concentré. Les solutions ne sont pas
colorées par une couleur verte bleu indique l'absence de
cardénolide.
1.2.2.5- Stéroïde
5 g de miel étudie sont extrait avec 70%
d'éthanol, l'extrait de l'alcool s'est évaporé et est
dissous dans CHCl3. Le filtrat est divisé en deux tubes :
- dans la première, 1 ml de solution acétique
est ajouté suivi par 1 ml de H2SO4 concentré. Si la
solution ne donne aucune couleur verte ceci prouve la présence de
stéroïdes, non saturés. - dans le deuxième tube, le
même volume de H2SO4 est ajouté. La couleur jaune n'est
pas transformée à la couleur rouge, ceci indique l'absence de
dérivés des stéroïdes.
1.2.3- L'extraction des flavonoïdes
La procédure suivie est celle appliquée dans le
laboratoire Biochimie des milieux désertiques, selon les données
de la littérature.
1.2.3.1- L'extraction Liquide-Liquide
L'extraction liquide-liquide est un procédé
physique permettant la récupération ou la purification d'un
composé en utilisant les différences de solubilités
mutuelles de certains liquides.
D'abord, on prépare une solution (1) contient 100 mg de
l'échantillon (E1) avec 300 ml d'eau distillée. Laisser
macérer à 24 heures. On fait la filtration de l'extrait
obtenu.
On extraire le filtrat trois fois par 100 ml de chloroforme.
On obtient une phase organique (On sèche les phases organiques par
l'appareil évaporotateur rotatif pour obtenir des extraits bruts pour
lesquelles on fait l'activité antibactérien.) et une phase
aqueuse.
On extraire la dernière phase trois fois par 100 ml
d'acétate d'éthyle. On répète ces étapes
pour les deux autres échantillons de miel (E2.E3). 1.2.3.2-
L'extraction Méthanol-Eau
Parallèlement à l'extrait (1), on
prépare un autre extrait (2) qui contient 100 mg de (E1) avec 300 ml de
méthanol a une dilution 80% (c'est à dire : 80 ml de
méthanol dans 20 ml d'eau distillé).
On répète toujours cette étape pour les
autres échantillons E2E3.
On met les extraits obtenus dans trois boites de Pétri
différentes pour laisser évaporer attentivement par l'air
libre.
1.2.4- Etude du pouvoir antibactérien du
miel
La méthode d'évaluation du pouvoir
antimicrobien de miel a porté sur une technique standard simple, rapide,
économique et faible.
La méthode des aromatogrammes est la technique choisie
pour déterminer l'activité antibactérienne a
été réalisée au niveau de laboratoire de biochimie
et de microbiologie du département des Sciences de la Nature et de la
Vie. Cette méthode repose sur le pouvoir migratoire des extraits
à l'intérieur d'une boite de Pétri, dans un milieu
nutritif solide.
Le milieu de culture utilisé est la gélose
Muller-Hinton (4mm d'épaisseur) en
surfusion est coulé dans des boites de Pétri.
L'ensemencement de l'inoculum de 1ml est réalisé
en surface (ensemencement en nappe) après la solidification du milieu.
Le surplus d'eau est évaporé dans l'hotte jusqu'à ce que
la gélose soit sèche. Les disques d'aromatogrammes dont le
diamètre est de 0.5 cm sont imprégnés dans des dilutions
(A, B, C, et D) des extraits étudiés et disposés à
la surface des boites en appuyant légèrement à l'aide
d'une pince stérile. Chaque disque est imprégné d'une
quantité variable (25 ul à 100 ul) de l'extrait
sélectionné. Les dilutions (A, B, C, et D) sont respectivement
(25%, 50%, 75% et 100%).
25% = (25 d'extrait et 75 de solvant) 50% = (50 d'extrait et
50 de solvant) 75% = (75 d'extrait et 25 de solvant) 100% = extrait pur
La boite est ensuite fermée et incubée dans
l'étuve à 37° 12 à 18 heures. Après
l'incubation, l'absence de la croissance bactérienne se traduit par un
halo translucide autour du disque, identique à celui de la gélose
stérile. On a utilisé 4 dilutions, 4 extraits, avec 2
répétitions.
On a fait les mêmes étapes pour chaque souche
bactérienne et chaque échantillon de miel
étudié.
Les dilutions de l'extrait se font comme suivant :
· Méthanol pour l'extrait chloroformique et
l'extrait d'acétate d'éthyle.
· L'eau distillée pour l'extrait aqueuse et hydro
alcoolique.
* Lecture
Elle consiste à mesurer avec précision les
diamètres des zones d'inhibition qui apparaissent autour des disques
d'aromatogramme à l'aide d'une règle graduée. Une
bactérie est considérée sensible si le diamètre de
la zone d'inhibition est supérieur à 0.5 cm (Hamoudi,
2008). Cette sensibilité augmente en fonction du
diamètre de cette zone d'inhibition.
2- Résultats et discussion
2.1- Résultats
Les résultats des tests chimiques préliminaires
sont résumés dans le tableau 2.
|
p
Tableau 2 : Résultats des tests chimiques
préliminaires.
100
|
|
Les composés
recherchés
|
Les critères
d'identification
|
E1
(Batna)
|
E2
(Soudan)
|
E3
(El'Oued)
|
|
Saponoside
|
Mousse
|
_
|
_
|
_
|
|
Tanins
|
Vert
|
+++
|
++
|
+
|
|
Flavonoïdes
|
Rose oranger
|
+++
|
++
|
+
|
|
Alcaloïdes
|
Précipite jaune blanche
|
_
|
_
|
_
|
|
Cardenolides
|
Vert bleu
|
_
|
_
|
_
|
|
Stéroïdes
|
Jaune puis rouge
|
_
|
_
|
_
|
Les extraits obtenus par la méthode liquide-liquide
sont de 6 pour un échantillon : 3 par le chloroforme et 3 par
l'acétate d'éthyle. Donc : on a 18 extraits pour les trois
échantillons.
A - Calculer le rendement des extraits de chaque
échantillon de miel
Pour calculer le rendement des extraits des échantillons
de miel, nous avons utilisé les équations suivantes
(Hamoudi., 2008)
. Avant séchage :
P0 E1 : Le poids initial de l'extrait de E1 : 90,632g P0E2 :
Le poids initial de l'extrait de E2 : 61 ,852g P0E3 : Le poids initial de
l'extrait de E3 : 65,472g
v' Calculer le rendement des extraits hydroalcoolique
. Après séchage :
Pm E1 : Le poids mesuré de l'extrait de E1 68 ,51g
Pm E2 : Le poids mesuré de l'extrait de E2 :53,310g 10 Pm E3
: Le poids mesuré de l'extrait de E3 :50,80g Rn : Le rendement de
l'extrait hydroalcoolique En
ü Calculer le rendement des extraits
chloroformiques Pm' E1 : Le poids mesuré de l'extrait de E1 :
72 ,632g Pm' E2 : Le poids mesuré de l'extrait de E2 :55,852g Pm' E3 :
Le poids mesuré de l'extrait de E3 :52,172g R'n : Le
rendement de l'extrait chloroformique En
ü Calculer le rendement des extraits de
l'acétate d'éthyle Pm» E1 : Le poids mesuré
de l'extrait de E1 : 78 ,632g
Pm» E2 : Le poids mesuré de l'extrait de E2
:58,352g Pm» E3 : Le poids mesuré de l'extrait de E3 :61,252g
R»n : Le rendement de l'extrait chloroformique En
1' Calculer le rendement des extraits de la phase
aqueuse
Pm''' E1 : Le poids mesuré de l'extrait de E1 : 87,332g
Pm''' E2 : Le poids mesuré de l'extrait de E2 :61,182g
Pm''' E3 : Le poids mesuré de l'extrait de E3 :64,732g R'''n
: Le rendement de l'extrait chloroformique En
L'ensemble de ces calculs est résumé dans le
tableau 3
Tableau 3 : Les extraits obtenus
|
Extraits
|
Coloration
|
Aspect
|
Rendement
|
|
Hydroalcoolique
|
E1
|
Jaune foncée
|
Visqueux
|
22%
|
|
E2
|
Jaune claire
|
Visqueux
|
8%
|
|
E3
|
Jaune claire
|
Visqueux
|
14%
|
|
Chloroformique
|
E1
|
Jaune foncée
|
Liquide
|
18%
|
|
E2
|
Jaune claire
|
Liquide
|
6%
|
|
E3
|
Jaune claire
|
Liquide
|
13.3%
|
|
Extrait d'AE
|
E1
|
Transparent
|
Liquide
|
12%
|
|
E2
|
Transparent
|
Liquide
|
3.5%
|
|
E3
|
Transparent
|
Liquide
|
4.22%
|
|
Phase aqueuse
|
E1
|
Transparent
|
Liquide
|
3.3%
|
|
E2
|
Transparent
|
Liquide
|
0.67%
|
|
E3
|
Transparent
|
Liquide
|
0.74%
|
B - Activité antibactérienne des
extraits
La détermination de la zone d'inhibition permet une
estimation de degré de la
sensibilité de la souche bactérienne contre les
extraits testés. Si aucune colonie n'est observée dans la zone
d'inhibition, l'effet de l'extrait utilisé est considéré
comme bactéricide. L'apparition tardive d'un tapis
léger de nouvelles colonies indique que de cette extrait est
considéré comme bactériostatique.
Les résultats des tests d'activité
antibactérienne des différents extraits sont illustrés
dans les tableaux (4 - 12) et les photos (1 -
3).
Tableau 5 : Résultats de
l'activité antibactérienne
de l'extrait chloroformique pour
l'échantillon E1
|
Les dilutions
|
Le diamètre de disque observé (cm)
|
|
A
|
0,8
|
0,9
|
|
B
|
0,8
|
0,8
|
|
C
|
0,8
|
0,8
|
|
D
|
1
|
1
|
Tableau 6 : Résultats de
l'activité antibactérienne de l'extrait
hydroalcoolique des
trois échantillons étudiés avec la bactérie
|
Les dilutions (%)
|
Le diamètre de disque observé (cm)
|
|
A
|
1
|
1
|
|
B
|
0,6
|
0,6
|
|
C
|
0,6
|
0,6
|
|
D
|
1
|
1
|
Tableau 7 : Résultats de
l'activité antibactérienne des extraits
chloroformiques des
trois échantillons testés sur la bactérie
|
Les dilutions (%)
|
p
Le diamètre de disque observé
(cm)
|
|
E1
|
E2
|
E3
|
|
D
|
1
|
0,7
|
1
|
|
C
|
1
|
0,75
|
0 ,8
|
|
B
|
0,7
|
1
|
0,7
|
|
A
|
0,6
|
1
|
1
|
Tableau 8 : Résultats de
l'activité antibactérienne de l'extrait de
phase aqueuse de E1
et d'acétate d'éthyle de E 3 : étudiés avec la
|
Les dilutions (%)
|
Le diamètre de disque observé
(cm)
|
|
E1
|
E2
|
E3
|
|
D
|
0,9
|
0,6
|
0,9
|
|
C
|
0,85
|
1
|
0,7
|
|
B
|
0,7
|
|
0,75
|
|
A
|
0,9
|
|
|
Tableau 9 : Résultats de
l'activité antibactérienne des extraits
chloroformiques des
échantillons E1 et E2 : étudiés avec la
|
Les dilutions
(%)
|
Le diamètre de disque observé
(cm)
|
|
Phase aqueuse E1
|
Acétate d'éthyle E3
|
|
D
|
|
0,7
|
|
C
|
0,7
|
1
|
|
B
|
0,8
|
0,6
|
|
A
|
|
1,1
|
Tableau 10 : Résultats de
l'activité antibactérienne des
extraits hydroalcooliques des
trois échantillons étudiés
avec la bactérie 7?coli
|
Les dilutions
(%)
|
Le diamètre de disque observé
(cm)
|
|
E1
|
E2
|
|
D
|
0,6
|
1
|
|
C
|
0,7
|
0,75
|
|
B
|
0,65
|
1,1
|
|
A
|
|
1,1
|
Tableau 11 : Résultats de
l'activité antibactérienne de
l'extrait de phase aqueuse de E1
et d'acétate d'éthyle de E3 :
Le diamètre de disque observé
(cm)
Les dilutions
(%)
|
s ec bari E
|
|
E1
|
E2
|
E3
|
|
D
|
0,7
|
0,7
|
1
|
|
C
|
0,9
|
0,6
|
0,7
|
|
B
|
|
0,6
|
0,6
|
|
A
|
|
0 ,7
|
0,55
|
Tableau 12 : Résultats de
l'activité antibactérienne de l'extrait
chloroformique des
échantillons étudiés avec les 2 bactéries
|
Les dilutions
(%)
|
Le diamètre de disque observé
(cm)
|
|
Phase aqueuse E1
|
Acétate d'éthyle E2
|
|
D
|
0,6
|
0,7
|
|
C
|
|
0,6
|
|
B
|
|
|
|
A
|
0,8
|
0,9
|
|
Les souches étudiées
|
Le diamètre de disque observé
(cm)
|
|
E1
|
E2
|
E3
|
|
Staphylococcus aureus
|
1,1
|
1,1
|
1,2
|
|
E.coli
|
1,2
|
1
|
0,9
|
2

1
E2
3
1
E3
E2
E1
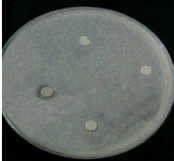
B
C
A
D
Photo N° 1 : Antibiogramme des trois
types de miel étudié avec
1 = E.coli et 2 =
Staphylococcus aureus
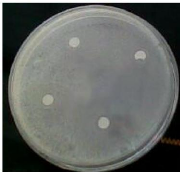
C
B
tn
D
A
Photo N° 2 : Antibiogramme des 4 dilutions
de l'extrait hydroalcoolique
Photo N° 3 : Antibiogramme des 4
dilutions de l'extrait
hydroalcoolique de miel de Batna avec
E.coli
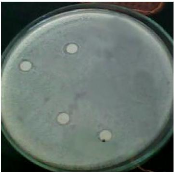
C
B
D
A
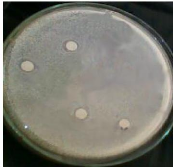
C
B
D
A
1 2
Photo N° 4 : Antibiogramme des 4
dilutions de l'extrait de la phase
aqueuse de miel de Batna. 1 =
Staphylococcus aureus ; 2 = E.coli
2.2- Discussion
2.2.1- La pureté du miel
La pureté des échantillons de miel
étudiés est confirmée par leur précipitation au
fond des bichers et par le test de flamme à essai, l'inflammation
incontinue est un point commun entre tous les échantillons (Site
1).
2.2.2- Tests chimiques préliminaires
Au vu des résultats de tableau N°2
nous déduisons que les différents types de miel
étudiés sont riches en quelques métabolites secondaires
(tanins, flavonoïdes).
La coloration positive observée au cours de test
préliminaire indique que le miel de Batna est plus riche en tanins et
flavonoïdes suivi de miel importé et celui d'El oued.
2.2.3- Extraction des flavonoïdes
D'après les résultats représentés
dans le tableau N°3 on peut conclure ce qui suit :
*- Pour l'extrait hydro alcoolique
La coloration correspondante au miel de Batna est plus
foncée que celui d'El Oued. L'échantillon importé
présente un rendement faible que les deux autres.
Pour tous les miels étudiés on remarque la
meilleure viscosité *- Pour l'extrait chloroformique
C'est un extrait qui a un aspect liquide qui a
caractérisé tout nos échantillons, mais leur coloration
diffère d'un type à un autre. Le miel de Batna présente
une coloration foncée que les deux autres. On a constaté un grand
rendement pour l'extrait de miel de Batna.
*- Pour l'extrait d'acétate d'éthyle et
phase aqueuse
Il n'existe aucune coloration pour les trois
échantillons.
Par une comparaison générale entre les
différents extraits on peut conclure :
- L'extrait hydro alcoolique du miel de Batna représente
le meilleur rendement par rapport aux autres extraits et aux autres
échantillons de miel.
- L'extrait hydro alcoolique de miel de Batna a une coloration
bien caractérisé que les autres extraits différents de
miel.
- L'extrait chloroformique des trois échantillons a un
degré de coloration avancé que l'extrait d'acétate
d'éthyle et celui de la phase aqueuse suivant leur rendement. Donc : on
peut classer les extraits obtenus selon le rendement et la coloration :
*- Extrait hydro alcoolique.
*- Extrait chloroformique.
*- Extrait d'acétate d'éthyle et phase aqueuse.
Enfin, le miel de Batna a une bonne qualité car leur
richesse en composé phénolique (flavonoïde).
La comparaison de nos résultats avec les
résultats de Wolf et Nagel, 1980. A noter que
Wolf et Nagel, 1980 a effectué la méthode de
malaxage de miel et il a pu extraire à partir de 250g un autre
composés phénolique qui sont les pigments
caroténoïdes jaunes et il utilisa le bisulfite de sodium qui permet
un meilleur relargage de substance polaire extractible.
Par contre, dans notre étude nous avons isolé des
flavonoïdes par une extraction liquide-liquide et extraction
méthanol-eau.
Les extrait organique de cette étude sont réunis
et sèches sur sulfate de sodium anhydre, notre travail sèche les
extrait organique par l'appareil rotavapeur qui donne une bonne extrait
brut.
Ainsi, la nature des composés phénoliques extraits
dépend de la méthode d'extraction utilisée.
2.2.4- Activité antibactérienne
*- D'après les résultats
illustrés sur les tableaux 6, 7, 8, 9, 10 et 11, on
peut constater que les trois souches bactériennes sont sensibles aux
trois types d'extraits de miel étudiés (E1, E2, E3) avec des
différences d'un type à un autre.
*- D'après le tableau 12
les extraits chloroformiques et les extraits d'acétate
d'éthyle des trois types des miels (E1, E2, E3) ont la même
efficacité.
*- L'effet de tous l'extraits sur
Staphylococcus aureus et E.coli est uniquement
bactéricide.
*- L'effet des différents extraits de
miels sont sensibles aux Staphylococcus aureus et E.coli
alors que la souche Clostridium vulgarus est faiblement sensible.
*- Il y a une efficacité remarquable des
extraits de miel E1 et E3 (locale) que ceux de l'échantillon
importé E2.
*- On constate aussi que l'effet
antibactérien des différents extraits du miel
étudiés n'augmente pas régulièrement avec la
concentration de l'extrait, ceci peut s'expliquer par des raisons
différentes :
- la charge irrégulière des bactéries sur
les boites
- La complexité des : concentration maximale
bactéricide (CMB) et concentration minimale inhibitrice (CMI)
*- Par une comparaison générale,
on marque les meilleurs résultats de l'activité
antibactérienne des les extraits obtenues pour E1 qui sont miel poly
floraux.

Conclusion
Conclusion
Dans le but de l'extraction de certains composés de
miel, parmi de ce composés, il y a flavonoïdes, nous avons
effectué un travail permettant pour essayer l'efficacité
antibactérien de ce métabolite secondaire.
L'étude bibliographique a montré que le miel a
été reconnue de puis longtemps, par exemple dans le Coran et
Sounna et en médicine populaire dans le traitement de physiopathologique
telles que les diarrhées et les inflammation de
gorge.il serait donc très
intéressant de l'exploiter pour la recherche de ce compose
phénoliques, qui interviennent dans le domaine pharmacologique.
Le screening chimique avait mis en évidence divers
métabolites secondaires : tanins, flavonoïdes.
Les différents types de miel ont été
soumise à deux types d'extraction de composés phénolique,
la première s'est farte par macération avec un mélange
méthanol/eau (80/20), et la seconde de type d'extraction liquide-liquide
par l'utilisation de chloroforme et l'acétate d'éthyle. Chaque
extrait a été caractérise par sa couleur et son
rendement.
D'après l'étude expérimentale (invitro)
des différentes extraits (surtout chloroformique et hydroalcoolique) de
miel étudiés et exclusivement pour la première chose, on
prend ces extrait contient les composés phénoliques
(flavonoïde) a quantité variable selon l'origine de miel. Cette
composé présente une pouvoir antibactérienne sur :
- Pouvoir fort : staphylococcus aureus et
E.coli. - pouvoir faible : clostridium vulgarus.
Cette étude a confirme la propriété
antibactérienne de flavonoïde
C'est résultat pouvait trouver une application possible
dans le traitement des différentes maladies causés par les germes
pathogènes.
En fin, dans ce temps, il y a une nouvelle étude sur le
miel chargée par Mme Halimi pour répondre de question
suivant :
Est ce que la quantité de sucre surtout le fructose
responsable de l'effet biologique du miel?

> Les ouvrages
· Alais C, Linden G., 1997. Biochimie
alimentaire. Masson, Paris, 120-125 p.
· Beta T, Nam S, Dexter J E et Sapirstein H D.,
2005. Phenolic content and antioxidant activity of pearled wheat and
roller-milled fractions, Cereal chem, 390-393 p.
· BOGDANOV. S, BIERI. K, GREMAUD. G., 2004.
Produits apicoles, Miel, Agroscope Liebefeld-Posieux, Station
fédérale de recherches en production animale et laitière
(ALP), Centre de recherches apicoles, Liebefeld-Berne, 37p.
· BOGDANOV. S, LULLMANN. C, MARTIN. P., 2001.
Qualité du miel et norme international relative au miel.
Rapport de la commission international du miel. Abeille Cie
N° 71-4.1 2p.
· BONIMOND JP., La fleur et l'abeille,
Union Nationale de l'Apiculture Française. Paris-1983. p76-7.
· Brouillard et Delaporte., 1977.
· Brouillard R., 1982. Anthocyanins as
food colors. Marcaris P. Academic press. New York. 1-40 p.
· BRUDZYNSKI K., Effect of hydrogen
peroxide on antibacterial activities of Canadian honeys.Canadian Journal of
Microbiology, Volume 52. Number 12. 1 Decembcr 2006. pp. 1228-1237(10).
· Bruneton J., 1993. Pharmacognosie et
phytochimie plantes médicinales, Paris, France: Lavoisier. 278-279p.
· Bruneton J., 1999. Pharmacognosie,
phytochimie, plantes médicinales, 3ème éd.
Lavoisier, Paris. 1120 p.
S CHAUVIN R., L'abeille et la fleur in traite
de biologie de l'abeille (T3).Edition Masson et Cie,Pans-.1968 :
p95,286-7,293-4-9,304-6-7.
· CODEX ALIMKNATRIUS., Commission du Codex
Alimentarius, 2001. Edition FAO.O.M.S.
? Crane. E., 1980.
· Dean F M., 1963. Naturall occuring
Oxygen Ring Compounds, Buttrworths. Londres
· DESCOTTCS B., Le miel comme agent
cicatrisant, Thèse de doctorat en médecine, université
Toulouse III-Paul SABAT1ER, Limoges- 2004. p 24-6-7-8-9, 32-3, 42- 8 ,52.
· DJERD. A., 2008. Contrôle de
qualité des miels de la région de Djelfa, comparaison avec des
miels nationaux et des miels importés. Thèse
d'Ingéniorat en biologie, Université de
Djelfa.
· Donadieu Yves., 1978. Les
thérapeutiques naturelles in le miel. Ed Maloine S.A. Paris, 12-16 p.
· Dr Hassane Chamsi Bacha., La revue
Al-iajaz Alimlmi N° : 15, page 6-11.
· Emmanuelle H., Julie C et Laurent G.,
1996. Les constituants chimiques du Miel.
· Frankel E N. Water house A L, Teissedre P L.,
1995. Agric. Food. Chem., 43,221- 235 p.
· Gàbor M, Cody V, Middleton E J, Harborne J
B, Beretz A, Liss A R., 1988. Plants Flavonoids in biology and
Medecine II; Biochemical, Cellular and Medecinal properties. New York, 1-15
p.
· GONNET. M, VACHE. G., 1985. Le gout
de miel. Ed. UNAF, Paris. 150p.
· Guingard J., 1996. Biochimie
végétale. Lavoisier, Paris, 175-192 p
· Guingard J., 1996. Biochimie
végétale. Lavoisier, Paris, 175-192 p.
· HAMOUDI R., 2008.Contribution
à la mis en évidence de principes actifs de plantes Teuriumpolium
geryrii provonant de la région Tamanrasset. Magister universite Kasdi
Merbah Ouargla, P..
· Harbone J B., 1967. Comparative
biochimitry of the flavonoides. Academic press. New York, 1-130 p.
· Harbone J B., 1967. Comparative
biochimitry of the flavonoides. Academic press. New York, 1-130 p.
· ` HUCHET E., COUSTEL J, GUINOT L., Les
constituants chimiques du miel :
méthodes d'analyses chimiques ;
département science de l'aliment-1996. p5.
· HUCHET. E, COUSTEL. J, GUINOT. L., 1996.
Les constituants chimiques du miel. Méthode d'analyse
chimique. Département de science et l'aliment. Ecole Nationale
Supérieure des Industries Agricoles et Alimentaire. France. 16p.
· Journal of agriculture and food
chemistry., vol.55, no. 11,may 30 2007. 4366-4370.
· Journal of nutrition., november.
2002.
· Lebham., 2005. Thèse au
Laboratoire d'Ecophysiologie et de Biotechnologie des Halophytes et des Algues
au sein de l'Institut Universitaire Européen de la Mer
(IUEM)-Université de Bretagne Occidentale (UBO).
· les publications de Molan., 1992 et
1997.
· LIBIS E., L'apiculture pour tous. Paris.
Edition Flammarion.-.1971. pl20-l-7,130- 3,141.
· LOUVEAUX J., Les abeilles et leur
élevage .2cme Edition OPIDA-1985. p237
· LOUVEAUX. J., 1968. Composition
propriété et technologie du miel. Les produits de la ruche,
in Traité de biologie de l'abeille. Tome 03. Ed Masson et Cie. 389p.
· LOUVEAUX. J., 1985. Les abeilles et
leur élevage. Edition Opida. Pp : 165-181.
· Lugasi A, Hovari J, Sagi, K V et Biro L., 2003.
The role of antioxidant phytonutrients in the prevention of diseases,
Acta Biologica Szegedientsis,1-4, 119- 125 p.
· Marfak A., 2003. Radiolyse gamma des
flavonoides, Etude de leur reactive avec les radicaux issus des alcools :
formation de depsides. Thèse pour obtenir le grade de docteur de
l'université de Limoges. Spécialité : biphysique. 187
p.
· Markham k R., 1982. Techniques of
flavonoides identification. Academic press, London, 36-53 p.
· Mclure J W., 1979. Biochemistry of plant
phenolics. Swain T, Harbone J B. Van Sumere C F, plenum press, New York, 525
p.
· Meddleton E, Kardasnami J C., 1993. The
flavonoids Advances. In: research since 1986. J B Harborne, Chapman and Hall,
London, 617-652 p.
· Medic Sanic M, jasprica I, Smolcic Bubalo A et
Mornar A., 2004. Optimization of chromatographic conditions in thin
layer chromatography of flavonoides and phenolic acids. Croatica chemica acta.
361-366 p.
· PROST P., Apiculture. Paris .Edition
J-B.Baillière-1979. P140-1,270-2-3,303-15.
· PROST P., Connaître l'abeille,
conduire le rucher. Paris Edition J.P.Baillière -1987. pl46,
310-1-4-5-6-, 356.
· Psotova J, Lasovsky J et Vicar J., 2003.
Metal chelating properties, electrochemical behavior, scavenging and
cytoprotective activities of six natural phenolic. Biomed. Papers 174-153 p.
· Ribereau G P., 1968. Les composés
phénoliques des végétaux. Dunod, Paris, 254 p.
· Salunkhe, DK., 1990. Dietary tannins:
consequences and remedies. Boca Raton, Florida: CRC press.
· Singleton V L, Timberlake C F, Lea A G H., 1978.
The phenolic cinnamates of grapes and wine, Journal of Sciences and
Food Agriculture. 29, 403-410 p.
> Les sites et pages Web :
Site 1 :
http://wiki-fr.blogspot.com/2010/01/verifier-la-purete-du-miel.html
Page
consultée le 23/05/2010

Extraction de certains composés du miel naturel
ayant effet antimicrobien Résumé :
Le miel naturel est une substance gelatineuse, elabore par les
abeilles, il contient de nombreux composes tels que : les sucres, les protides,
les enzymes et les composes phenoliques (exemple : flavonoïdes)~. Grkce
aux composés phénoliques et la nature acide, le miel joue un
rôle d'inhibition sur les microbes.
Dans notre travail, nous avons testé l'effet
antimicrobien de ces composés phénoliques extrait de trois
échantillons differents de miel naturel : deux echantillons sont
recoltes de deux sites du territoire algerien (miel poly floraux) ; il s'agit
de Batna et de El' Oued et un échantillon du miel importé de
Soudan.
L'extraction est effectué par deux méthodes
différentes : l'extraction liquide-liquide et la maceration avec
methanol/eau (80%).
Le pouvoir antimicrobien des extraits obtenus est teste sur trois
souches bacteriennes ; il s'agit de Staphylococcus aureus, Escherichia coli
et Clostridium vulgaris.
Ces extraits sont classés selon de leur
efficacité dans l'ordre : hydroalcoolique, chloroformique et
acétate d'éthyle et de phase aqueuse.
Les extraits du miel de Batna montrent la meilleure efficacite
contre les souches testees que les deux autres, les souches E. coli et
Staphylococcus aureus sont les plus sensibles à l'effet des
extraits des trois echantillons de miel que la souche Clostridium
vulgaris.
Mots cles : effet antimicrobien,
miel naturel, Staphylococcus aureus, Escherichia coli et Clostridium
vulgaris, composes phenoliques.
Î1~áÇ
TIDIáÇ
å~ Çãñ~ÐÍÅ
íÒÆ~ÒTä~ È ÒÑä~
å~ ÇÑ~ãÌ
äÇÑìòÚ
ä~Ïõ5ä~ å~
ÎÏÑõÑÓ~ Í~äÇ~ä~
ÍìòTä~ ó íÏ~õä~
Í~~ì~ å~ ÍòÐÇ~ä~ ó
ÍìÐÇÊ ÍUì~
ÇòòåÚ áõLTäE
ãÐ ðÑä~
ÎÇ4åÎÑ~ãä~ . %80 ÁÇ~
áõæÇ~ò~ áõå~~
áÇã~ÑÓÇÊ
Ú~ìä~ Í~ñÒØ ó
ãÆÇÓ ãÆÇÓ
Í~ñÒØ
:åòÑEåÑÎP
åòÑEñÒtÊ ÏãÐ
ÕÎÑÓáÅ~
ÍòåãÚ
ÒNá~ ðñ )Escherichia coli
ó )Staphylococcus aureus äÇÑä~ZäL
ÎÇÊóÒßòãä~
ÐÖ ÍòäÇ~ Ò~2á~ ðñ
ÍìÐÇÊ ã5Ú
ÎÇ4åÎÑ3~ äÊ ÍIÐÅ
Ð~ä
ÎÇËß~ãä~ ó
ÎÇãñÒæáÇ~
ÎÇìòÐóÒËä~
ÎÇñÒß~ä~ ã~~
ÎÇË~Òãä~ å~
ÐñÐÚ ìåÚ
íõÑ~ñ õñ ó
ÍåTìä~ Çò~ÑìÐ
ðìòÐEòÌ É Ò~ åÚ
ÌÑÇËÚ õñ
ð~òË~ä~ ã6~äE
Íòäõìò
ÎÇË~Ò~ )Clostridium vulgaris~
)Escherichia coli~ )Staphylococcus aureus
ð~òËØ ã5Ú ð1
) Clostridium vulgaris
ÊIÈæÑ~í~~á
íØí~~ÊáÇ
ÑíËÊáÇ ÊÇÐ
á8ÚáÇ äã
Ê~TßÑ~áÇ ÖÚÈ
ÕáÇÎÊÓ
ðÆÇãä~ ã5 ä~ ó
ðåò~ñáÇ~
ÎÇÑòÓá~
ÕåÎÑ~r
ðrÑõóÑõåßä~
ðÆÇ~ áõrß
.Íòäõìò~ä~
.Íòäõìò~ä~
ÎÇË~Òãä~ ìåÚ
ðÆ~õÑÍÅ ó
ðÑÖõãÍ ãx~Ê
ÎÇÊóÒßòãä~
ìåÚ
ð1òË~Ñä~
ÒòËÑä~ ÍòÕÇ~
ð~òË~ä~ ã6~ä~
ßåÑãñ
:ð~òË~ä~ ã6~ä~ å~
ÎÇìòÚ ÒË å~
ÍgåÎÑ3ãä~
Íòäõìò~ä~
ÎÇËFÒãåä
ðaòË~Ñä~
ÒòËÑä~ ÇæÒËÑ~~
ãã~ä~ ~Ðñ ð
scherichia coli~ ó )Staphylococcus
aureus~ :ðñ
ÇñÒòÑßÊ
ÎáÇ~Ó ÒEË ìåÚ
ÇòÑòäÇ~
ÑÇËÑBÅ ãÐ
ä~ :ðåñ Çã~
ÇòÑòäÇ~ ÉSÍ
Ïã5Þ ÎÇ4åÎÑ~ãä~
íÐñ
lostridium vulgaris ~Íä~~ä~ å~
ÍòÓÇSÍ
Summary:
The honey is a gelatinous substance, produced by bees, and
contains many compounds (sugar, proteins, enzymes and compounds phenolic...).
Thanks to the latest and the acidic nature, honey plays a very effective
against microbes.
In our work now, we have demonstrated the effectiveness of this
meaningful phenolic compounds (flavonoids) studied the different honeys: honey
polyfloral (Batna), honey Sudan and honey Merrara (El oued), using extracts
obtained by two types of extraction: liquid-liquid extraction and maceration
with methanol / water (80%), against bacterial strains used.
These extracts are classified according to their very low
efficiency as follows:
- Hydroalcoholic
- Chloroform
- From ethyl acetate and aqueous phase
Knowing that extracts honey Batna give the best efficacy against
the strains tested as Sudan and Merrara who gave a bad result:
- Strong antibacterial effect: against Staphylococcus aureus,
Escherichia coli.
- Poor antibacterial effect: against Clostridium vulgaris.
Key words : antimicrobien effect, naturel
honey, Staphylococcus aureus, Escherichia coli, Clostridium vulgaris, compounds
phenolics.
| 











