II. Physiopathologie de la réaction
inflammatoire
Les facteurs qui déclenchent une
réponse inflammatoire sont très variés :
ï Infection par des micro-organismes (ex :
bactéries, virus, parasites, champignons) ;
ï Agents physiques : traumatisme( ex : plaie)
ou nécrose tissulaire( ex : infarctus), chaleur( ex :
brûlure) ou froid( ex : gelure), radiations par des UV :
ultra-violets( ex : coup de soleil) ou des rayons X, corps
étranger( ex : prothèse, poussières de
silice,...) ;
ï Agents chimiques (ex : caustiques, toxiques,
venins).


251655680
Figure 1 : Exemple de facteurs
déclenchant l'inflammation
Source : (Ketty Schwartz, 2011)
Quelle que soit la nature du stimulus, les manifestations de
la réponse inflammatoire se ressemblent. Néanmoins, la nature des
cytokines produites, l'intensité et la durée de ces
manifestations pourront changer en fonction du stimulus (Ketty
Schwartz, 2011) p 16.
Trois séquences d'événements
complexes et intriqués composent la réponse
inflammatoire :
1. Une phase d'initiation (phase vasculaire) qui fait suite
à un signal de danger d'origine soit extérieur (exogène)
soit intérieure (endogène) et qui met en jeu une première
série d'acteurs. Cette première phase varie en fonction du type
d'agression (endogène, exogène) qu'a subi l'organisme ;
2. Une phase d'amplification avec la mobilisation et
l'activation d'autres acteurs ;
3. Une phase de résolution et de réparation qui
tend à restaurer l'intégrité du tissu agressé. Pour
mieux comprendre ces différences séquences, nous prendrons
l'exemple d'une plaie avec coupure (brèche vasculaire). Ceci va
entrainer une réaction locale qui vise dans un premier temps à
stopper l'hémorragie puis à recruter les cellules inflammatoires
au niveau du tissu lésé, pour finir par réparer le
tissu. (Ketty Schwartz, 2011) p 16.
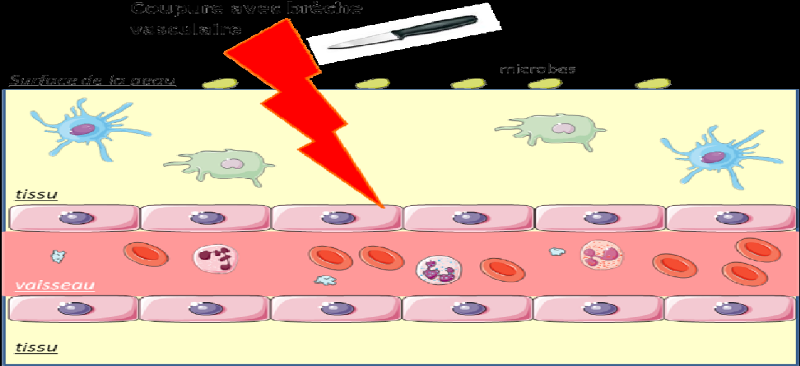
Figure 2 : Cas d'une plaie
avec coupure
Légende :

Ø La phase d'initiation : phase vasculaire
et activation des cellules résidentes
Source : (Ketty Schwartz,
2011)
Activation des plaquettes et des premiers
médiateurs
Les plaquettes sont activées très
rapidement : elles interviennent, avec l'aide de facteurs pro-coagulants
présents dans le plasma, pour colmater la brèche et limiter
l'accès des pathogènes à l'organisme. Les plaquettes
activées libèrent aussi des protéines aux
propriétés agrégantes et vasoconstrictrices (=
rétrécissement du diamètre des vaisseaux) puissantes.
L'activité de vasoconstriction est extrêmement brève et
sert à limiter les « fuites » de sang.
(Ketty Schwartz, 2011) p 17.
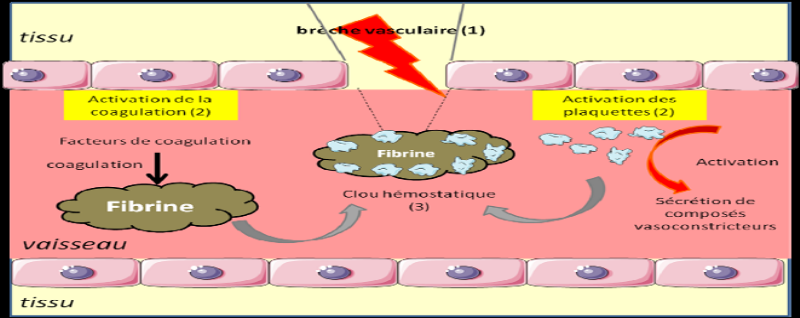
Figure 3 : Activation plaquettaire au
cours des premières étapes de la phase vasculaire
Source : (Ketty Schwartz,
2011)
Très rapidement, un grand nombre de
médiateurs solubles présents dans le sang sont activés
(système du complément, système des kinines,...). Leur but
est de « donner l'alerte » rapidement et de recruter les
cellules de l'immunité innée sur le lieu de l'inflammation.
Le système du complément joue un rôle
important dans :
ï La vasodilatation ;
ï L'augmentation de la perméabilité
vasculaire ;
ï L'attraction des cellules circulantes vers le site
lésé (chimiotactisme). Le système des kinines est
responsable entre autre :
ï De la perméabilité des vaisseaux ce qui
va permettre aux cellules de l'immunité d'arriver au niveau du
tissu ;
ï Mais aussi de la sensation de douleur grâce
à leur interaction avec les neurones sensoriels qui sont des cellules
jouant le rôle de « capteur de douleur ».
En somme :
L'inflammation se déroule dans les tissus
vascularisés, préférentiellement dans le tissu conjonctif.
Les tissus dépourvus de vaisseaux, comme le cartilage ou la
cornée, sont incapables de développer une réaction
inflammatoire complète.
Activation des cellules résidentes au niveau du tissu
lésé pour recruter des patrouilles circulantes.
Il existe un peu partout dans les tissus, des cellules du
système immunitaire inné
appelées « cellules résidentes ». Il
s'agit des macrophages et des cellules dendritiques. Ces cellules proviennent
de la moelle osseuse et ont colonisé ensuite les différents
tissus de l'organisme. Au niveau du tissu, elles sont les première
à être activées suite à la reconnaissance du microbe
(voir encarta sur « comment les cellules résidentes
reconnaissent-elles le microbe ? ») et à donner
l'alerte. Suite à leur activation, les cellules résidentes
sécrètent des messagers solubles (chimiokines, cytokines
pro-inflammatoires comme le TNF-á, l'IL-1 et l'IL-6) qui vont avoir
plusieurs effets, notamment en local :
ï Attirer des cellules du système immunitaire
inné circulant dans le sang, en particulier les neutrophiles ;
Perméabiliser les vaisseaux, ce qui permet le passage
des cellules circulantes (neutrophiles, monocytes) du sang vers le tissu
lésé. (Ketty Schwartz, 2011) p 18.
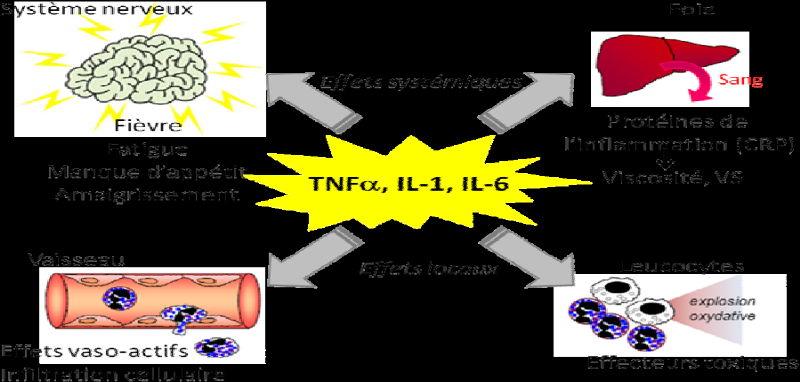
Figure 4 : Effets
locaux et systémiques des cytokines par les macrophages (CRP :
protéine C-réactive)
Source : (Ketty Schwartz, 2011)
Un autre type cellulaire joue un rôle important dans
la phase d'initiation : les mastocytes. Ils sont souvent situés
près des vaisseaux sanguins et, certains de leurs médiateurs,
l'histamine notamment, agissent sur les cellules des parois vasculaires. Il en
résulte une vasodilatation et la formation d'un oedème local.
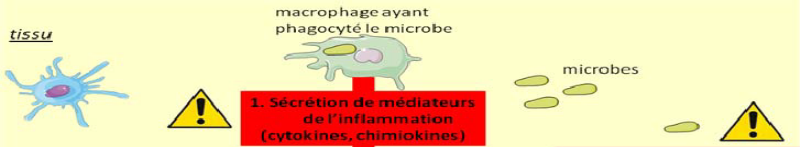




Figure 5 : Vasodilatation et
chimiotactisme induit par les messagers sécrétés par le
mastocyte et macrophage activé
Source : (Ketty Schwartz,
2011)
Schématiquement les signes de l'inflammation sont
agencés selon Schwartz, 2011comme
suit :
ü Perméabilisation et dilatation des
vaisseaux ROUGEUR/ CHALEUR
Exsudation plasmatique oedème par distension des
tissus GONFLEMENT forte pression sur les terminaisons nerveuses locales
DOULEUR activation du système des kinines DOULEUR.
(Ketty Schwartz ; 2011) p 19.
La reconnaissance de l'agent
pathogène :
Les cellules phagocytaires reconnaissent
des « motifs » très conservés,
appelés PAMP (pour Pathogen-associated Molecular Pattern, en bleu sur le
schéma ci-après) chez bon nombre de microbes (bactéries,
champignons, virus) mais qui sont absents des cellules de l'hôte. Cette
reconnaissance se fait via des récepteurs(en marron sur le
schéma) appelés PRR (pour Pathogen Recognition Receptors),
présents à la surface des cellules phagocytaires.
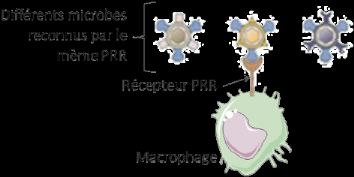
Figure 6 : Reconnaissance des
pathogènes par les cellules phagocytaires
Source :(Ketty Schwartz, 2011)
Les macrophages et les cellules dendritiques expriment des
récepteurs reconnaissant des motifs présents à la surface
de nombreuses bactéries mais absents des cellules de
mammifères.
Il existe de nombreux récepteurs PRR à la
surface d'une même cellule et chaque récepteur est capable de
fixer de nombreux microbes porteurs d'un même motif (exemples :
motif spécifique des parasites ou motif spécifique des virus).
Ainsi avec un nombre restreint de récepteurs de
spécificité large, chacun capable de reconnaître une classe
de pathogènes, ces cellules peuvent reconnaître le monde microbien
très varié.

Figure 7 : Diversité des
récepteurs des cellules du système immunitaire
inné
Source : (Ketty
Schwartz, 2011)
Légende : récepteurs de l'immunité
innée multiples mais invariants :

Ø La phase d'amplification :
arrivée des patrouilles circulantes et activation des cellules au niveau
du tissu lésé
Les neutrophiles sont les premières cellules
circulantes à arriver au niveau du tissu lésé. Si les
neutrophiles ne suffisent pas pour détruire les microbes, des
monocytes/macrophages circulants, attirés par les chimiokines, vont
venir en renfort sur le site lésé pour phagocyter les microbes et
les débris cellulaires. Dès leur arrivée sur le site
lésé, les cellules du système inné sont
activées soit par contact direct avec le pathogène, soit par la
présence des cytokines sécrétées par les cellules
résidentes. La reconnaissance des motifs microbiens par les neutrophiles
et les macrophages conduit à la destruction d'une partie des
microbes.
Les neutrophiles, après ingestion du microbe,
produisent et déversent, au niveau du tissu lésé, des
composés hautement réactifs (un peu comme de l'eau
oxygénée !), contenus dans leurs granules : il s'agit
de formes réactives de l'oxygène, de monoxyde d'azote et de
peptides antimicrobiens.

Figure 8 : Contenu des granules
libérés par le neutrophile
Source :(Ketty Schwartz, 2011)
Pour
Ketty Schwartz, 2011 les composés n'ont pas la
capacité de discriminer entre le microbe et les propres cellules de
l'individu. Des dégâts collatéraux au niveau du tissu de
l'individu sont donc, lors de cette étape, inévitables. Ces
tissus lésés, ainsi que des bactéries, des neutrophiles et
des macrophages ayant phagocyté les bactéries, composent le pus
qui signe une réaction inflammatoire efficace. Les macrophages
sécrètent aussi des facteurs de croissance et d'autres
protéines à remodeler le tissu lésé.
Parallèlement, des macrophages ayant phagocyté
des microbes migrent vers les ganglions lymphatiques ou ils présenteront
ultérieurement des fragments de ces microbes aux lymphocytes T (et
notamment aux lymphocytes T4), pour initier une réponse plus
ciblée et spécifique contre ce microbe. Cette réponse
adaptative, qui s'installe en 2 à 5 jours, prendra la suite de la
réponse innée si nécessaire. (Ketty Schwartz,
2011) p 21.
Ø La phase de réparation
tissulaire
La réaction inflammatoire doit être
limitée dans le temps. Cette dernière phase de réparation
dépend du degré de lésion au niveau du tissu et peut
prendre 10 à 15 jours.
Dans le meilleur des cas, les microbes ont été
éliminés par les neutrophiles, et éventuellement les
macrophages. Les produits de dégradation et les débris
cellulaires sont phagocytés par les macrophages qui vont
sécréter des cytokines induisant la phase de cicatrisation et de
régénération tissulaire. Le retour à l'état
normal nécessite une réparation des tissus lésés
qui peut se faire :
ï Par les cellules endothéliales elles-mêmes
(production de collagène, laminine,...) en cas de faibles
dégâts ;
ï Par d'autres cellules, si l'atteinte est plus grave et
des tissus détruits : les macrophages vont participer à la
réparation des vaisseaux (angiogénèse) et les fibroblastes
vont produire les protéines de la matrice extracellulaire
(collagène, fibronectine, laminine) pour permettre la reconstruction du
tissu. Cette réparation tissulaire met l'angiogénèse au
repos.
Après une blessure, l'angiogénèse
(création de nouveaux vaisseaux sanguins) permet de restaurer le flux
sanguin après réparation des tissus lésés. Cette
néo-vascularisation normale est strictement régulée par
des facteurs qui stimulent (tels que le VEGF) ou inhibent (par exemple
l'angiostatine) l'angiogénèse en fonction de l'état des
vaisseaux.
La production de nouveaux vaisseaux sanguins constitue un
processus essentiel durant le développement d'un embryon et pendant le
renouvellement de tissu lors de la grossesse ou de la cicatrisation d'une
blessure. Une angiogénèse anormale peut être mise en
rapport avec bon nombre de maladies : une angiogénèse
insuffisante entraîne une adduction sanguine réduite vers les
tissus (sclérose) alors qu'une angiogénèse
exagérée peut faciliter une infection, ou la progression de
tumeurs. (Ketty Schwartz, 2011) p 22.
Ces trois phases mettent en action différents
systèmes d'adaptations et impliquant de multiples médiateurs. La
nature des différents effecteurs et le développement de chacune
de ces trois phases conditionnent le profil d'expression clinique et biologique
de la réponse inflammatoire (aigue ou chronique, local ou
systémique) (MIOSSEC, 2003)
En somme, l'inflammation fait intervenir des cellules, des
vaisseaux, des modifications de la matrice extracellulaire et de nombreux
médiateurs chimiques qui peuvent être pro ou anti-inflammatoires
et qui peuvent modifier ou entretenir la réponse inflammatoire. Quelle
que soit son siège et la nature de l'agent pathogène, le
déroulement d'une réaction inflammatoire présente des
caractères morphologiques généraux et des
mécanismes communs. Néanmoins, les différentes
étapes présentent des variations liées à la nature
de l'agent pathogène, l'organe ou se déroule la réaction,
le terrain physiologique de l'hôte : tous ces éléments
conditionnent l'intensité, la durée de la réaction
inflammatoire et l'aspect lésionnel. Notons qu'une inflammation trop
importante ou trop prolongée peut avoir des conséquences
préjudiciables (Galanaud, 2001).
| 


