CONCLUSION..........................................................................................50
RÉFÉRENCES
BIBLIOGRAPHIQUES...........................................................53
Listes des tableaux
Tableau 1. Distribution de fréquences de
tailles de S. aurita de la région centre de la côte
algérienne (Bouaziz,
2007)................................................................................9
Tableau 2. Clé âge-longueur de
sardinelle de la région centre de la côte algérienne (FISAT
II, Gayanilo et al.,
2005).......................................................................................25
Tableau 3. Clés âge-longueur de
Sardinella aurita obtenues par différents auteurs dans la
méditerranée...............................................................................................26
Tableau 4. Paramètres de
croissance linéaire de von Bertalanffy (FISAT II, Gayanilo et
al. ,
2005)........................................................................................................27
Tableau 5. Paramètres de
l'équation de van Bertalanffy de Sardinella aurita
d'après la
littérature...................................................................................................28
Tableau 6. Relation d'allométrie entre
le poids total et la longueur totale de S. aurita (Bouaziz,
2007)...........................................................................................29
Tableau 7. Poids moyens (grammes) à
divers âges de S. aurita exploitée dans da région
centre de la côte
algérienne..............................................................................30
Tableau 8. Poids asymptotiques (W
8) de Sardinella aurita d'après la
littérature.............31
Tableau 9. Coefficient de mortalité
totale (Z) estimé avec la méthode de la courbe de capture a
l'aide de FISAT II (Gayanilo et al. , 2005) pour S.
aurita exploitées dans la région centre de la côte
algérienne............................................................................................32
Tableau 10. Mortalités totale
estimées par d'autres auteurs dans différentes
régions..........33
Tableau 11. Coefficients de mortalité
naturelle (M) estimé par la méthode de Pauly pour chaque groupe
d'âge.....................................................................................34
Tableau 12. Mortalité naturelle de
Sardinella aurita estimée par quelques auteurs............35
Tableau 13. Captures en nombre d'individus et en
poids en fonction de la taille de Sardinella aurita de la
région centre de la côte algérienne, en fonction de M.
(VIT, Lleonart et Salat,
2000)........................................................................................................37
Tableau 14. Résultats de la biomasse
obtenus par la VPA en fonction de M de la population de S. aurita de
la région centre de la côte algérienne. (VIT, Lleonart et
Salat, 2000)..............40
Tableau 15. Résultats de la VPA, obtenus
par le VIT (Lleonart et Salat, 2000) de S. aurita de la région
centre de la côte algérienne, en fonction de
M............................................41
Tableau 16. Mortalités par pêche en
fonction de la taille obtenues par la VPA de S. aurita de la
région centre de la côte algérienne, en fonction de M (VIT,
Lleonart et Salat, 2000)..........43
Tableau 17. Etat du stock de S.
aurita à l'équilibre, pour M constante et variable
(VIT, Lleonart et Salat,
2000)..............................................................................44
Tableau 18. Résultats de
l'analyse du rendement et de la biomasse par recrue de S. aurita
exploitée dans la région centre de la côte
algérienne, en fonction de M..........................46
Tableau 19. Rendements et biomasses par recrue
en fonction de (F) de S. aurita de la région centre de la
côte algérienne, pour M constante et
variable..........................................47
Tableau 20. Analyse de l'impact de
changement de M par âge sur les paramètres d'exploitations de
S. aurita de la région centre de la côte
algérienne..............................48
Listes des figures
Figure 1. Sardinella aurita
(Valenciennes, 1847) (FAO, 1987)....................................5
Figure 2. Sardinella aurita
(Valenciennes, 1847)....................................................5
Figure 3. Distribution géographique de
(S. aurita Valenciennes, 1847) (D'après Smith, 1997
in Bouaziz
2007)...........................................................................................6
Figure 4. Cycle de vie d'une cohorte (Cadima.
2002)..............................................12
Figure 5. Schéma simplifié de
l'analyse des cohortes des populations marines exploitées
(Sidibé,
2003).............................................................................................20
Figure 6. Diagramme de la VPA (Lleonart et
Salat,1992)..........................................21
Figure 7. Estimation de l'âge par la
méthode de Bhattacharya (1967) (FISAT II, Gayanilo et al.,
2005)...................................................................................................25
Figure 8. Décomposition de la
distribution de fréquences de tailles de S. aurita tous sexes
confondus par la méthode de Bhattacharya (1967) (FISAT II, Gayanilo et
al., 2005).............26
Figure 9. Courbe de croissance linéaire
obtenue par l'équation de von Bertalanffy de la sardinelle de la
région centre de la côte algérienne (FISAT II,
Gayanilo et al., 2005)................27
Figure 10. Relation taille-poids pour la
sardinelle de la région centre de la côte
algérienne..................................................................................................30
Figure 11. Courbe théorique de croissance
pondérale de Sardinella aurita (sexes
confondus).................................................................................................31
Figure 12. Courbe de capture pour l'estimation
de Z de S. aurita exploitée dans la région centre de la
côte algérienne (FISAT II, Gayanilo et al.,
2005).......................................32
Figure 13. Variation de la mortalité
naturelle (M) en fonction de l'âge..........................34
Figure 14. Captures en nombre d'individus en
fonction de la taille de S. aurita de la région centre de la
côte algérienne, en fonction de
M........................................................38
Figure 15. Captures en poids en fonction de la
taille de S. aurita de la région centre de la côte
algérienne, en fonction de
M............................................................................38
Figure 16. Variation du poids moyen virtuel en
fonction de la taille de la population de S. aurita dans la
région centre de la côte algérienne, en fonction de
M..............................43
Figure 17. Mortalités par pêche en
fonction de la taille, obtenues par l'analyse de la VPA, de S. aurita
de la région centre de la côte algérienne, en fonction
de M..............................44
Figure 18. Diagramme des entrées et des
sorties de la biomasse totale équilibrée de S. aurita de
la région centre de la côte algérienne. Pour M
constante........................................45
Figure 19. Diagramme des entrées et des
sorties de la biomasse totale équilibrée de S. aurita de
la région centre de la côte algérienne. Pour M
variable..........................................45
Figure 20. Rendements et biomasses par recrue de
Sardinella aurita de la région centre de la côte
algérienne, en fonction de
M......................................................................47
INTRODUCTION
Une population monospécifique possède, à
tout instant, une structure qui peut être définie par des valeurs
particulières d'un certain nombre de paramètres tels que le taux
de croissance, le sex-ratio, la fécondité, la
mortalité, etc. Or cette structure et ses
paramètres ne sont pas fixés une fois
pour toute. Ils peuvent changer au cours du temps et la dynamique des
populations a précisément pour but d'étudier ces
changements d'une façon descriptive et si possible explicative, et
même prédictive en évaluant l'influence de ces
changements, qui sont difficilement mesurables, sur les divers
paramètres démographiques (Daget, 1976).
La dynamique des populations « classique »
néglige l'effet des variations de la mortalité naturelle sur les
stocks exploités. Lorsque l'on applique les modèles de dynamique
(modèles globaux, modèles analytiques), le fait que les
changement dans la valeur de M au cour du temps ne sont pas pris en
considération, explique souvent les nombreux échecs
observés dans l'analyse de l'évolution des stocks
pélagiques côtiers qui, par nature, sont instables car très
sensibles aux fluctuations climatiques (Brêthes et O'Boyle, 1993).
En général, les travaux sont rares sur l'impact
de la mortalité naturelle sur les variations de l'abondance des
espèces marines exploitées, surtout la relation entre M et la
biomasse exploitable de l'espèce étudiée. En effet, les
études d'évaluation de stocks négligent le plus souvent
l'impact de la variation de la mortalité naturelle (M) dans leur
diagnostic final sur l'état du stock.
L'objectif principal de ce mémoire est d'étudier
les variations de la biomasse exploitable de la sardinelle (Sardinella
aurita, Valenciennes, 1847) de la région centre de la côte
algérienne en fonction des variations de M par âge. Et donc
d'acquérir des connaissances scientifiques sur l'impact de variation de
la mortalité naturelle sur la dynamique des populations et
l'évaluation des stocks marins exploités. Les données de
pêche sur cette espèce ont été
sélectionnées à partir de la base de données de
Bouaziz (2007).
Le présent mémoire s'articule autour de trois
chapitres à savoir :
le premier concerne les généralités
portant sur la sardinelle. Toujours dans cette partie, on parlera sur les
facteurs physiques du milieu de la région centre de la côte
algérienne ;
la seconde partie, porte sur l'analyse de matériel et
les méthodes d'étude ; et
le dernier chapitre se consacre aux principaux
résultats portant sur la variation de la biomasse exploitable en
fonction de la variation de la mortalité naturelle par âge du
S. aurita, avant de les discuter et de dégager des perspectives
futures de recherche sur l'impact de cette variation sur la biomasse
exploitable des poissons.
GENERALITES
1 - Présentation de l'espèce
1 - 1. Position systématique
Sardinella aurita est définie par la place
qu'elle occupe dans la classification zoologique comme suit :
(Ficher et al., 1987) :
Embranchement Vertébrés
Sous embranchement Gnathostomes
Super classe Poissons
Classe Osteichtyens
Sous classe Actinoptérygiens
Super ordre Téléostéens
Ordre Clupéïformes
Sous ordre Clupéoïdés
Famille Clupéïdés
Genre Sardinella
Espèce (S. aurita, Valenciennes, 1847)
1 - 2. Morphologie
Corps allongé, généralement de section
subcylindrique, parfois plus comprimé; ventre arrondi, mais avec un
alignement de scutelles formant une carène faible sur le profil ventral.
Opercule lisse; bord postérieur de la fente operculaire avec 2
excroissances charnues; oeil moyen; sommet du crâne avec de nombreuses
stries (7-14) sur les frontopariétaux; bouche terminale; mâchoire
supérieure arrondie, sans échancrure médiane; second
supramaxillaire à bords supérieur et inférieur
subégaux; branchiospines fines et nombreuses, plus de 80 sur la partie
inférieure du premier arc branchial. Origine de la nageoire dorsale un
peu en avant du milieu du corps; anale insérée bien en
arrière de la base de la dorsale, ses 2 derniers rayons
prolongés, nettement plus longs que ceux qui les
précèdent; pelviennes insérées sous la dorsale et
à 9 rayons (Figure 1).
Dos bleu-vert, flancs argentés, avec à
mi-hauteur une ligne dorée pâle précédée
d'une tache dorée en arrière de l'opercule; une tache noire
distincte sur le bord postérieur de l'opercule (absence de pigments
argentés sous-jacent); dorsale jaune plus ou moins foncé,
ombrée sur le bord distal, à rayons antérieurs noirs, mais
pas de tache noire à l'origine de la dorsale; pectorales jaune
pâle mouchetée de brun; caudale jaune très clair
près de la base, le reste sombre avec les pointes très
foncées ou noires (Figure 2), (Ficher et al., 1987).
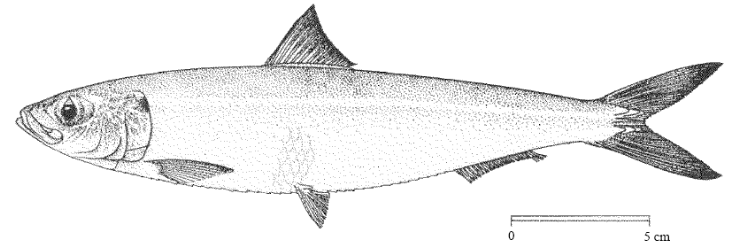
Figure 1. Sardinella aurita
(Valenciennes, 1847) (Ficher et al., 1987).

Figure 2. Sardinella aurita
(Valenciennes, 1847) (Eli, 2006)
1 - 3. Répartition géographique et
bathymétrique
D'après (Bouaziz, 2007), la sardinelle est une
espèce pélagique côtière, rencontrée
près de la surface des eaux littorales jusqu'à 350 m de
profondeur au-delà du plateau continental. Évite les eaux
dessalées (S > 35 psu). Elle préfère les eaux non
turbides de 18 à 24 °C (Ben Tuvia, 1960 ; Fréon, 1986 ;
Marchal, 1991). C'est donc un poisson vulnérable aux eaux froides ou
trop chaudes et se rencontre principalement au niveau des eaux tropicales.
La sardinelle peuple toutes les côtes de la
Méditerranée et celles de la mer Noire. Dans l'Atlantique
Oriental elle peuple toutes les côtes ouest-africaines, et à
l'ouest elle se trouve du Cap Code à l'Argentine. Dans le Pacifique
ouest, la sardinelle se rencontre du Japon aux Philippines (Figure 3).
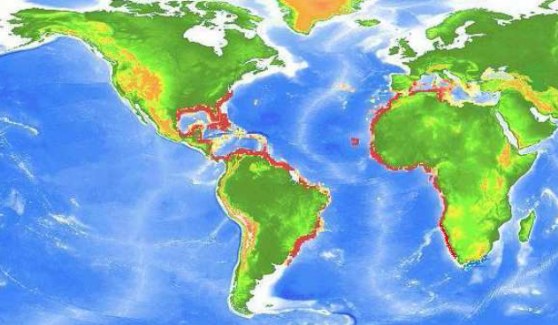
Figure 3. Distribution géographique de
S. aurita (Valenciennes, 1847)
(D'après Smith, 1997 in Bouaziz 2007).
1 - 4. Écologie et biologie
1-4-1. Régime alimentaire
L'allache se nourrit essentiellement de zooplancton (surtout
de Copépodes), de larves et alevins de poissons mais aussi de
phytoplancton. Sa nourriture est assez variée. Des contenus stomacaux
examinés par Poll (1953) lui ont surtout révélé des
fragments amorphes constitués par du phytoplancton avec parfois des
larves de Mollusques et de petits Crustacés. Cadenat (1953) travaillant
sur des spécimens capturés au delà d'une centaine de
mètres de profondeur dans l'Atlantique Africain, a signalé dans
leur estomac une bouillie de microplancton à base de Copépodes,
d'Euphausiacés et de larves de Crustacés divers au stade Nauplius
(Postel, 1960).
1-4-2. Déplacements et
migration
Poisson grégaire, se déplace en bancs qui
effectuent des migrations saisonnières liées à la
température de l'eau et à la richesse en plancton. Remonte en
surface pendant la nuit (Ficher et al., 1987).
1-4-3. Période de reproduction et
maturité sexuelle
Se reproduit pendant toute l'année dans les eaux
superficielles mais surtout de mi-juin à fin septembre en
Méditerranée (Ficher et al., 1987).
Les sardinelles ont un taux de mortalité naturelle
élevée (Bouaziz, 2007) et une faible longévité,
pouvant atteindre 5 ans selon les individus. Il s'ensuit qu'ils atteignent
aussi leur maturité à un âge jeune, ce qui contribue
à un taux de renouvellement des populations aussi
élevé.
Dans la région centre de la côte
algérienne, les individus âgés à sexes confondus,
dont la taille est = 19 cm, se reproduisent en juillet. Les plus jeunes
émettent leurs produits sexuels en août (Bouaziz, 2007).
D'après Bouaziz (2007), l'examen du pourcentage des
femelles matures en fonction de la taille, permet de fixer à 14.14 cm la
taille à laquelle, dans la région centre de la côte
algérienne, 50 % des sardinelles femelles sont aptes à se
reproduire et toutes le sont à partir de 16.5 cm. En ce qui concerne les
mâles, 13.64 cm représente la taille à laquelle 50 % de la
population a atteindre la maturité. Au-delà de 16.5 cm, tous les
mâles rencontrés sont adultes.
Enfin, la population de Sardinella aurita sexes
confondus atteint sa taille de première maturité (L50) à
13.93 cm dans la baie de Bou-Ismail.
2 - Facteurs physiques du milieu
Selon Zeghdoudi (2006), les principaux facteurs physiques du
milieu sont primordiaux dans la distribution et le comportement des petits
pélagiques. Ces facteurs se résument comme suit :
· la température de l'eau est un facteur
prépondérant dans la vie des organismes marins, elle contribue de
façon importante à la distribution géographique des
espèces marines. Elle détermine les périodes de migrations
et de reproduction et bien d'autres facteurs physiologiques, surtout chez les
espèces pélagiques. La température des eaux superficielles
de la région centre fluctue en fonction des échanges
atmosphère-mer.
· la salinité dans la baie de Bou Ismaïl est
de 36.85 (p.s.u) en été et 36.47 (p.s.u) en hiver (M.E.T.A.P,
1994). Ces fluctuations sont liées selon Kadari (1994) à
l'importance des précipitations en hiver (700 mm/an) et à
l'évaporation en été ; et
· le vent est une des forces physiques régissant
les courants et les houles. La baie de Bou Ismaïl est
caractérisée par une périodicité des vents qui se
traduit par une prédominance des vents d'Ouest en hiver et au printemps
induisant aussi des houles de grandes amplitudes et des vents de l'Est en
été et début automne avec de faibles amplitudes (Asso,
1982).
MATERIEL ET METHODES
1 - Matériel
Les données de Bouaziz (2007) nous ont permis d'avoir
l'échantillonnage de la sardinelle de la région centre de la
côte algerienne.
L'échantillon de la sardinelle de la région
centre de la côte algérienne présente 7176 individus.
Repartie entre 6.5 et 30.5 cm. Les classes les plus vulnérables à
l'engin de pêche sont comprises entre 9.5 et 17.5 cm (Tableau 1).
Tableau 1. Distribution de fréquences de
tailles de S. aurita de la région centre de la côte
algérienne (Bouaziz, 2007).
|
C.C (cm)
|
Nt
|
C.C (cm)
|
Nt
|
|
6.5
|
1
|
19.5
|
284
|
|
7.5
|
14
|
20.5
|
294
|
|
8.5
|
155
|
21.5
|
99
|
|
9.5
|
417
|
22.5
|
531
|
|
10.5
|
557
|
23.5
|
455
|
|
11.5
|
629
|
24.5
|
372
|
|
12.5
|
522
|
25.5
|
206
|
|
13.5
|
425
|
26.5
|
50
|
|
14.5
|
380
|
27.5
|
14
|
|
15.5
|
438
|
28.5
|
3
|
|
16.5
|
485
|
29.5
|
1
|
|
17.5
|
461
|
30.5
|
2
|
|
18.5
|
381
|
|
|
2 - Méthodes
2 - 1. Choix des logiciels
Pour l'étude de la dynamique du stock de Sardinella
aurita, nous avons utilisé deux logiciels recommandés par la
FAO à savoir :
- FISAT II version 1.2.0 (Gayanilo et
al., 2005) : nous l'avons introduit pour la détermination
des paramètres indispensables pour l'étude de la dynamique
(clé âge-longueur, paramètres de croissances,
mortalités) ; et
- VIT (Lleonart et Salat, 2000) : ce
programme constitue un outil d'évaluation de la biomasse, de la
production virtuelle, et du rendement et de la biomasse par recrue.
Le choix s'est porté sur ce logiciel du fait qu'il soit
conçu pour la pêcherie méditerranéenne d'une part et
présente l'avantage de fonctionner avec des pseudo cohortes, c'est
à dire il exige uniquement la connaissance des captures sur un an au
lieu d'une série historique d'une dizaine d'années (Lleonart et
Salat, 2000 in Bouaziz, 2006).
2 - 2. Age et croissance
La croissance moyenne individuelle des espèces
exploitées est une donnée de base pour l'étude de la
dynamique de ces populations. Sa connaissance, même approximative, permet
une meilleure compréhension de l'évolution des stocks en fonction
des modifications apportées dans leur exploitation. Les fonctions de
croissance peuvent différer d'une espèce à une autre, mais
également entre deux stocks à l'intérieur de la même
espèce et avoir des valeurs différentes selon les zones de
répartition biogéographique (Sidibé, 2003).
Nous étudions donc ici la croissance de la sardinelle
de la région centre de la côte algérienne qui, il faut le
rappeler vive dans un écosystème particulier, soumis
essentiellement aux apports terrigènes par rapport à d'autres
types d'écosystèmes de l'Atlantique ouest africain, soumis au
phénomène d'upwelling.
2-2-1. Clé âge-longueur
Selon Sidibé (2003), trois approches sont
généralement utilisées pour obtenir la clé
âge-longueur à savoir :
- la détermination directe de l'âge : le
principe général est la lecture des marques qui se forment sur
les structures dures (écailles, otolithes, épines et autres
pièces squelettiques). Ces marques se repartissent en deux
catégories : à période longue, de l'ordre de plusieurs
mois, de la saison ou de l'année, et à période courte, de
l'ordre de la journée. Dans tous les cas, chez les poissons tropicaux,
la lecture et, plus encore, l'interprétation de ces marques est
malaisée ;
- le marquages : ils peuvent donner de bons
résultats lorsque l'espèce et son environnement s'y
prêtent. Toutefois, il existe toujours une incertitude qui subsiste sur
la croissance et qui est liée à l'effet du stress provoqué
par la pose de la marque ; et
- l'analyse des structures des tailles : elle est
toujours délicate. Même avec l'aide des techniques statistiques
les plus élaborées, l'analyse visant à la
séparation des différentes composantes d'une distribution de
tailles est souvent faite avec une interprétation plus ou moins
subjective. Pour cette raison, l'emploi des méthodes d'analyse des
tailles a été souvent discuté. Cependant, ces
méthodes restent, malgré tout, les plus employées sur les
poissons tropicaux, d'une part parce qu'elles constituent souvent le seul
recours, d'autre part parce qu'elles sont les plus faciles à mettre en
oeuvre.
? log Z = log Z (x+h) - log Z(x)
La méthode préconisée dans ce
présent travail pour la détermination de l'âge, est celle
de Bhattacharya (1968). Cette méthode se base sur les distributions de
fréquences de tailles. On regroupe les données de
fréquences en classes de tailles d'égale amplitude « h
» et de point milieu « X ». On construit un graphique portant en
ordonnée, pour chaque abscisse X, la quantité:
Z(x+h) et Z (x) étant les effectifs de classe de point
milieu « X + h » et « X ».
Sur le graphe, on recherche des points de droite à
pente négative. Le nombre de droites obtenu, correspond au nombre de
composantes autrement dites aux âges. Les moyennes de ces composantes,
c'est à dire les tailles moyennes des différents âges, sont
ensuite estimés par la formule suivante :
Lmoy = ë + (h/2)
Avec :
h : intervalle de classe (amplitude) ;
ë : abscisse du point d'intersection de
chaque composante avec l'axe des abscisses ; et
Lmoy : taille moyenne de la
composante (groupe d'âge).
D'après Hemida (2005), les conditions qui doivent
être vérifiées afin de pouvoir appliquer cette
méthode, sont :
- la distribution ne doit pas comporter d
e classes vides ; et
- l'intervalle « h » doit être petit par
rapport à chacun des écarts-types.
2-2-1-1. Calcul de précision
(P)
Comme Sparre et Venema (1996), dans le cas d'un stock de
poissons dans le milieu marin il est impossible de mesurer la valeur
réelle de quelques paramètres que ce soit les tailles moyennes
des âges (Lmoy). Nous ne nous occuperons que de la
fidélité de l'estimation de la taille moyenne,
c'est-à-dire de l'écart probable (la précision P) entre
l'estimation et la moyenne réelle. On exprime l'incertitude autour de la
moyenne réelle par les limites de confiance. Les limites de
confiance inférieures et supérieures sont respectivement obtenues
au moyen des expressions suivantes : Lmoy - P et Lmoy
+ P.
P = ( t* s.d. ) / vN
Avec : s.d :
écart type ; N : effectifs, t
= 1.96 pour á = 5%.
2-2-2. Croissance linéaire
D'après Sidibé (2003), il existe plusieurs
modèles mathématiques pour exprimer la croissance au niveau des
poissons. Une revue détaillée en a été faite par
Beverton et Holt (1957), Ursin (1967), Ricker (1980), Gulland (1983), Pauly
(1984), Sparre et Venema (1996) et Pauly et Moreau (1997). Le modèle le
plus utilisé reste celui de von Bertalanffy (1938). D'après cet
auteur, la croissance est considérée comme étant l'action
simultanée de facteurs anaboliques (processus de synthèse, dont
le taux, proportionnel aux surfaces absorbantes, tend à augmenter le
poids), et de facteurs cataboliques (processus de dégradation, dont le
taux, proportionnel au poids, tend à diminuer ce dernier). Ces deux
facteurs interviennent continuellement et simultanément pendant toute
l'existence de l'animal.
Lt = L8 . [1 - e
-k(t-to)]
Ce modèle mathématique, exprime la longueur du
poisson (L), en fonction de son âge (t) par la relation
suivante :
Avec :
L8 : la longueur
asymptotique. Théoriquement, c'est la taille moyenne qu'atteindrait un
poisson qui pourrait vivre et grandir indéfiniment
;
K : le coefficient de croissance (ou
paramètre de courbure). Il caractérise la rapidité avec
laquelle le poisson croît vers la longueur asymptotique ; et
to : l' âge
théorique pour lequel le poisson a une longueur nulle.
2-2-3. Estimation de L8 pour chaque groupe
d'âge
Selon Bouaziz (2004), une population halieutique, est
l'ensemble des individus vivant dans un écosystème
déterminé et possédant des caractères communs
transmissibles par hérédité, constitue les
différents âges (cohortes) d'un stock qui à son tour
représente la fraction exploitable de la population d'une espèce
donnée.
La population comporte en général à tout
moment des animaux d'âges différents. Il apparaît ainsi une
double exigence d'isolement et d'homogénéité. Ce terme
d'homogénéité peut avoir deux sens :
uniformité des caractéristiques individuelles ou brassage totale
à l'intérieur de l'ensemble de la population. Si le second sens
qui est ici évoqué, mais certains modèles font
également appel au premier. Le brassage correspond a la notion de
population panmictique (Calaprice, 1980). Ces conditions ne sont jamais
remplies intégralement, notamment en ce qui concerne
l'homogénéité. Souvent, il existe à
l'intérieur de la population des compartiments entre lesquels les
échanges sont faibles, voire très épisodiques, on parle
alors de sous-population. La distinction comporte toujours une part
d'arbitraire. Une sous-population suffisamment isolée peut être
considérées en pratique comme une population (Laurec et Le Guen,
1981).
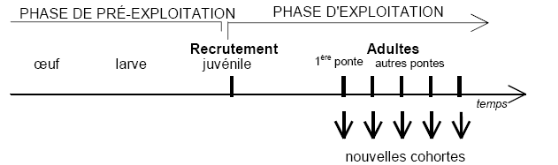
Figure 4. Cycle de vie d'une cohorte (Cadima,
2002).
Nous pouvons supposer qu'une cohorte (groupe d'âge)
représente une sous-population, de ce fait, L8
qui lui correspond est calculé à partir de la
formule de Taylor (1962) in Pauly (1997) :
L8 = Lmax / 0.95
Avec
Lmax : dernière valeur de
(Lt) incluse dans le calcul de la droite de régression (pente
négative) dans le modèle de Bhattacharya (1968).
2-2-4. Croissance relative
L'étude de la relation taille-poids répond
généralement en halieutique à deux objectifs : la
détermination du poids des individus dont on connaît la taille ou
inversement, et la description des formes de l'embonpoint et de ses variations
au cours de la croissance. Ces buts présentent un intérêt
pratique dans les problèmes d'exploitation des populations animales
où il importe, pour obtenir un rendement maximum, de savoir traduire la
taille en poids ou le poids en taille et de disposer d'un paramètre
aisément calculable qui caractérise l'embonpoint des
spécimens et son évolution au cours de l'année ou de leur
vie (Sidibé, 2003)
Dans les travaux de biologie des pêches, les relations
entre la longueur et le poids sont généralement exprimées
sous la forme suivante :
W = a . Lb
Où, W désigne le poids,
L la longueur, a le facteur de condition
moyen et b un coefficient proche de 3.
Si b est égal à 3 la croissance
est isométrique, c'est à dire que la forme du corps et la
densité ne varient pas avec l'âge. En revanche si b
est significativement différent de 3 la croissance est dite
allométrique ; dans ce cas les proportions des différentes
parties du corps et la densité ne sont pas les mêmes à tous
les âges (Ricker, 1980 in Sidibé, 2003).
Par ailleurs, les relations taille-poids individuelles peuvent
varier en fonction de multiples facteurs :
le sexe ; le stade de maturité sexuelle ; les
conditions alimentaires ; et de l'échantillonnage.
2-2-5. Croissance pondérale
L'équation de croissance linéaire de von
Bertalanffy et la relation taille-poids permettent d'établir
l'équation de croissance pondérale. En utilisant l'âge
conventionnel (to), cette équation pondérale pourrait
s'écrire de la façon suivante :
Wt = W8 . (1 -
e-k(t-to))b
Où Wt est le poids à l'âge t, W le poids
asymptotique correspondant à la longueur L et b l'exposant de la
relation taille-poids.
2 - 3. Etude des mortalités
D'après Sidibé (2003), l'étude de la
mortalité est basée sur le principe qu'à chaque instant t,
le nombre de survivants d'une cohorte décroît sous l'effet des
phénomènes de mortalités et que le nombre d'individus qui
disparaît est proportionnel à l'effectif initial de telle sorte
que :
dN/dt = -Z . N
(1)
Où Z est défini comme le coefficient
instantané de mortalité totale.
Nt = No . e-Z.(t-to)
L'intégration de cette équation permet d'avoir
le nombre d'individus survivant Nt atteignant l'âge t, soit :
(2)
Où No est le nombre initial d'individus au temps to
pris comme origine.
La diminution d'effectif d'une population exploitée de
poissons est due à deux causes qui sont la mortalité naturelle et
la mortalité par pêche dont les coefficients instantanés
respectifs, M et
F peuvent être additionnés. Ainsi, on peut
démontrer que :
F + M = Z
(3)
En réalité, les mortalités varient
généralement avec l'âge de la cohorte. Les petits (jeunes)
poissons sont exposés à une plus grande mortalité
naturelle parce que d'avantage de prédateurs sont capables de les
manger. En revanche, les petits poissons seront sans doute moins exposés
à la mortalité par pêche que des grands poissons
(âgés) parce que, soit ils n'ont pas encore gagné les zones
de pêche soit ils s'échappent par les mailles des engins de
pêche (Sparre et Venema, 1996).
2-3-1. Mortalité totale (Z)
Le coefficient de mortalité totale Z est estimé
par la méthode de la courbe des captures par classes de tailles. Les
différentes méthodes d'estimation de Z qui font appel à la
courbe de capture linéarisée selon les longueurs sont
dérivées de la méthode des courbes de captures
basées sur les âges (Ricker, 1980 in Sidibé,
2003).
Selon Sidibé (2003), cette méthode repose sur
l'hypothèse d'un système à paramètres constants
selon lequel :
- la croissance suit le modèle de von Bertalanffy ;
- la mortalité totale Z est constante pour toutes les
classes d'âge exploitées ;
- le recrutement est supposé constant, autrement dit,
toutes les classes d'âge ont été recrutées en
quantités égales (à défaut, les variations du
recrutement sont faibles et aléatoires) ;
- l'échantillon concerné est supposé
couvrir toutes les classes d'âge pour représenter la structure
moyenne de la population étudiée pendant l'intervalle de temps
considéré (Beverton et Holt, 1956 ; Ricker, 1980) ; et
- l'effort de pêche doit être constant pendant
toute la durée de vie des cohortes prises en compte dans la population
étudiée.
L'hypothèse de la constante de Z durant toute la vie de
la cohorte permet de calculer à tout âge le nombre de survivant
par le modèle dit de décroissance exponentielle (équation
2) qui constitue avec l'équation de croissance, la base de la dynamique
des populations marines exploitées [Thompson et Bell (1934) ; Fry (1949)
; Beverton et Holt (1957) ; Laurec et Le Guen (1981) ; Sparre (1987)
in Sparre et Venema (1996)].
Selon Sidibé (2003), si l'on considère deux
âges t1 et t2 avec t1 inférieur à t2, le nombre total
d'individus morts durant l'intervalle de temps t séparant t1 et t2 est
donné par la différence Nt1-Nt2, et le nombre d'individus morts
par pêche est défini par l'équation de capture de Thompson
et Bell (1934) :
Ct1, t2 = (F/Z) . (Nt1 -
Nt2)
(4)
Où F/Z est le taux d'exploitation qui
représente la fraction des décès due à la
pêche. En mettant Nt2 sous la forme de l'équation (2),
l'équation de capture devient :
Ct1, t2 = Nt1 . [(F/Z) . (1 -
e-Z(t1-t2))]
(5)
En remplaçant Nt1 par l'équation (2), la
linéarisation de l'équation (5) par transformation logarithmique
conduit à la forme de l'équation de capture suivante :
LnCt1, t2 = d - Z . t1 + Ln(1 -
e-Z(t1-t2))
(6)
Avec la constante d = Ln Nt1 + Ln (F/Z) + Z.t
Si le terme t2-t1 demeure constant (par exemple t2-t1 = t3-t2
= t4-t3 =...= 1 an), le terme non linéaire de l'équation (6)
devient une constante (g), laquelle peut être incluse dans le terme
correspondant à l'ordonnée à l'origine.
LnC(t1-t2) = g - Z.t
Ainsi, si la constante (g) sera définie : g = d + Ln
[1-exp (-Z.(t2-t1))] et alors l'équation (6) devient :
(7)
L'équation (7) est appelée "équation de
la courbe de capture linéarisée avec intervalles de temps
constants", où la pente est -Z. La courbe de
capture ainsi linéarisée est l'une des méthodes couramment
utilisées pour l'estimation de la mortalité totale Z des poissons
dans les eaux tempérées lorsque l'on dispose de captures par
âge (âge absolu).
Cette méthode a été
particulièrement appliquée par Beverton et Holt (1956), Robson et
Chapman (1961) et Ricker (1980) dans les mers du nord (Sidibé, 2003).
Pour les espèces tropicales chez lesquelles la lecture
d'âge est difficile à partir des pièces dures, plusieurs
auteurs ont proposé des méthodes d'approches permettant
d'utiliser les fréquences de taille (Sparre et Venema, 1996).
La méthode qui sera utilisée fait appel à
l'équation de croissance de von Bertalanffy "inverse" pour convertir les
données de longueur en données d'âge. Ce modèle est
présenté et discuté chez Pauly (1983b, 1984b et c). On
l'appelle souvent courbe de capture convertie en longueur ou "courbe de capture
linéarisée convertie en longueur" (Sparre et Venema, 1996).
En faisant correspondre un âge t à la taille L1
et un âge t+t à la taille L2 on obtient l'égalité
suivante :
Ct, t+?t = CL1,L2
Après transformation, l'équation de capture (6)
prend la forme ci-après :
Ln (CL1, L2 / ?t) = a - Z.t
(8)
Où : CL1, L2 est le nombre d'
individus de la classe L1, L2
t représente le temps
nécessaire qu'il faut à un poisson moyen pour passer de la
longueur L1 à la longueur L2 ; sa valeur est donnée par
l'équation suivante :
?t = 1/K . Ln [(L8 -
L1)/(L8 - L2)]
Les variations Ln (CL1, L2 / t) de l'équation (8) en
fonction de l'âge conventionnel t donnent la courbe de capture qui montre
une partie ascendante et une partie descendante. C'est cette
dernière qui est utilisée pour l'estimation de la
mortalité totale Z .
Les calculs sont effectués par le programme FISAT II
(Gayanilo et al. , 2005).
2-3-2. Mortalité naturelle (M) par
âge
La mortalité naturelle est la mortalité
occasionnée par l'ensemble des causes autres que la pêche. Parmi
ces causes on peut citer : la prédation, les maladies, le stress, le
manque de nourriture, la vieillesse, ainsi que d'autres causes peuvent
être liées à l'écosystème ( Korichi,
1988 ; Hemida, 1987 ; Mouhoub, 1986).
La même espèce pourra présenter des taux
de mortalité naturelle différents dans différentes zones
selon la densité des prédateurs et/ou des compétiteurs
dont l'abondance est au demeurant influencée par les activités de
pêche (Sparre et Venema, 1996).
L'estimation du taux de mortalité naturelle (M) n'est
pas aisée, et il est souvent impossible d'obtenir des mesures directes
et exactes de M. Fritsch (2005), La mortalité naturelle M d'un
stock exploité est une variable difficile à estimer, sauf quand
il n' y a pas de pêche. Ce qui n'est pas le cas dans le présent
travail.
En réalité, les mortalités varient
généralement avec l'âge de la cohorte. Les petits (jeunes)
poissons sont exposés à une plus grande mortalité
naturelle parce que davantage de prédateurs sont capables de les manger.
En fin il est convient de souligner que l'hypothèse
habituelle, selon laquelle la mortalité naturelle demeure constante pour
toute les classes d'age (taille) d'une espèce et loin d'être vrai
pour certaines d'entre elles. Il est évident qu'un petit poisson est
exposé à une plus forte mortalité par prédation
qu'un gros poisson. Cette différence de mortalité par
prédation (qui pourrait bien être la cause principale de la
mortalité naturelle chez les petits poissons) pourrait être
tout à fait considérable (Sparre et Venema, 1996).
2-3-2-1. Méthodes d'estimation de M en fonction
de l'âge
Un certain nombre de méthodes peuvent être
utilisées pour estimer la mortalité naturelle. Parmi celles-ci,
citons les méthodes empiriques fondées sur des
caractéristiques liées à la longévité,
à la croissance, à la maturation, et les conditions du milieu
(T°).
Dans le présent travail, en utilise la méthode
de Pauly (1980, 1984a) qui est recommandé pour les poissons
pélagiques, puisque elle s'adapte mieux par apport aux autres
méthodes.
2-3-2-2. Estimation de M par la méthode de
Pauly
Comme Sparre et Venema (1996), il n'est pas nécessaire
de supposer que M demeura constante durant toute l'existence de la cohorte. La
durée de vie de la cohorte peut être divisée en un certain
nombre de périodes plus courtes à l'intérieur desquelles
les mortalités sont supposées demeurer constantes alors qu'elles
peuvent varier d'une période à l'autre.
En estimant la mortalité naturelle au âge par
l'équation empirique de Pauly (1980), qui lie la mortalité
naturelle aux paramètres de croissance L8 et
K, et à la température moyenne annuelle du milieu par
l'expression suivante:
Log10(M) = - 0.0066 - 0.279
Log10(L8) + 0.6543 log10(K) + 0.4634
Log10(T°)
D'après Bouaziz et al. (2004), (K= [-Ln
(L8 -Lt)/ L8] / (t-to) ce coefficient de croissance est
une constante quelque soit l'âge du poisson.
Enfin, connaissant K, et L8
calculé pour chaque cohorte, alors on peut
déterminer M pour chaque âge par l'équation de Pauly
(1980).
Etant donnée que ce qui nous intéresse par la
suite, c'est de connaître l'effet de variation de M sur les stocks de
poisson, nous devons faire une distinction bien nette entre la mortalité
M constante et M variable.
2-3-3. Mortalité par pêche
(F)
Après avoir calculé les coefficients Z et M, la
détermination de la mortalité par pêche (F) et le
taux d'exploitation (E : la proportion des décès
due à la pêche) se fait à partir des relations suivantes
:
E = F / Z
F = Z - M
2 - 4. Exploitation (approche
analytique)
Selon Fonteneau (1989), l'approche analytique consistera
à estimer et à intégrer les différentes composantes
biologiques moyennes des stocks :
- nombre d'individus présents à chaque âge
dans le stock
- croissance pondérale de ceux-ci en fonction de
l'âge
- mortalité naturelle et par pêche en fonction de
l'âge
2-4-1. Analyse de populations virtuelles
(VPA)
L'expression '' population virtuelle '' fut
employée pour la première fois par Fry (1957) in Jones
(1984). Par population virtuelle, il entendait la somme des individus d'une
cohorte donnée qui, présente dans l'eau à n'importe quel
instant, était appelée à être capturée par
pêche pendant l'année en cour.
L'analyse des populations virtuelles fait partie des
modèles analytiques qui, selon Mtimet et al. (1995) in
Sidibé (2003), sont les mieux adaptés aux stocks
pélagiques méditerranéens. Ce modèle est
très utilisé dans les pêcheries Nord Atlantiques et est
conseillé pour les pays du Sud pour la relative aisance de son
utilisation.
Le principe général de l'analyse de cohortes
consiste à analyser ce que l'on peut observer, c'est-à-dire la
capture, de manière à estimer la population qui devait se trouver
en mer pour produire cette capture (Sparre et Venema, 1996).
L'objectif majeur de l'analyse des populations virtuelles est
la détermination de l'effectif d'un cohorte (Ni) et les coefficients de
mortalité par pêche (Fi) pour les différentes classes
(tailles ou groupes d'âge), tout en tenant compte aussi bien des captures
par classes, que des pertes occasionnées par différentes causes
naturelles (Jones, 1984).
Par analogie, la VPA peut être considérée
comme une sorte d'analyse de pseudocohortes. Cette dernière constitue
l'ensemble des individus observés à des âges successifs,
non pas d'année en année au fil de la vie d'une cohorte vraie,
mais d'une année donnée (Mesnil, 1988 in Sidibé,
2003).
Au cours d'une analyse de cohorte, l'estimation des effectifs
du stock à chaque taille ou à chaque âge ainsi que celle
des coefficients instantanés de mortalité par pêche
correspondant, se font par la résolution d'un système à
deux équations (équation de survie et équation de
capture). Ces deux équations ont été largement
utilisées par plusieurs auteurs. Dans le cas d'une analyse par classes
de tailles, elles se présentent sous la forme suivante :
Ni+1 = Ni .
e-Zi (t)
(9)
Ci = Ni ( Fi / Zi
)( 1-e-Zi (t) )
(10)
Où :
i : indice de la classe de longueur ;
Ni : nombre d'individus dans le stock ayant atteint la longueur
Li ;
Ci : nombre d'individus décédés suite
à la pêche dont la taille est comprise entre Li et Li+1 ;
t : temps moyen qu'il faut à un poisson pour passer de la
longueur Li à la longueur Li+1 ;
Fi : coefficient instantané de mortalité par
pêche de la classe i ;
Zi : coefficient instantané de mortalité totale ;
Zi = Fi + M ; et
M : est le coefficient de mortalité naturelle.
Pour n classes de taille, l'analyse s'appuie donc sur un
système de 2n équations comportant 2n+1 inconnus (Les Ni, pour i
= 1, n+1 et les Fi pour i = 1 à n).
Les données, les inconnues et les équations des
calculs sont cosignées dans la figure 5 (les flèches
représentent les équations).
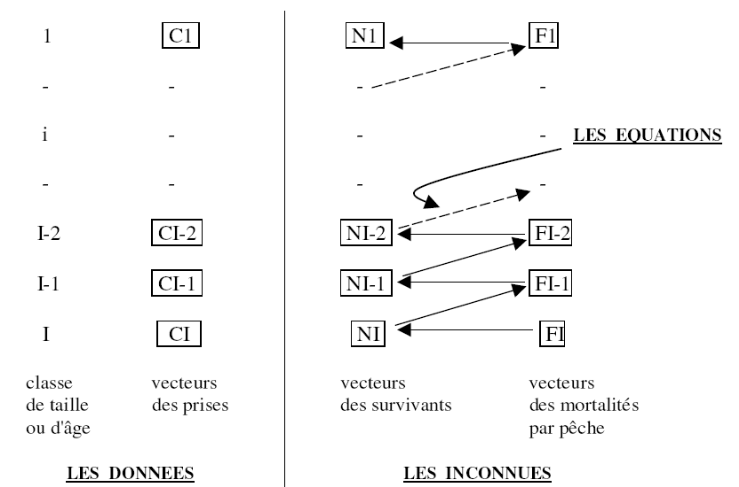
Figure 5. Schéma simplifié de
l'analyse des cohortes des populations marines exploitées
(Sidibé, 2003)
On dispose ainsi d'un système d'équations liant
les valeurs successives des Ni et Fi. Pour résoudre ce système,
l'une des inconnues doit être fixée. Il s'agit
généralement du coefficient de mortalité par pêche
de la dernière classe d'âge ou de taille (Ft : terminal). Les
effectifs de la cohorte étant particulièrement difficile à
évaluer directement, le coefficient de mortalité par pêche
est le plus souvent estimé. C'est le processus d'initialisation de
l'analyse de cohortes (Mesnil, 1988 in Sidibé, 2003).
Dans la pratique cette initialisation s'effectue sur la classe
de tailles (ou d'âges) la plus grande de la cohorte et la
résolution séquentielle du système se fait en remontant
vers les classes de tailles les plus petites. Jones (1983), a montré que
si on procède de cette façon, l'erreur relative
éventuellement commise en estimant le paramètre d'initialisation
(Ft : terminal) tend à s'estomper au fur et mesure que l'on atteint
les classes les plus petites ; et que les résultats obtenus sur les
coefficients F de ces classes convergent rapidement vers les vraies valeurs.
C'est la propriété dite de "convergence" de la
méthode. Cette convergence est d' autant plus forte que le stock est
fortement exploité.
Le choix de la valeur d'initialisation modifie donc
très peu le diagnostic final par le fait de cette
propriété de convergence des mortalités par pêche
lors de l'analyse ascendante. Le choix du Ft terminal dépendrait donc de
critères logiques et de connaissances générales de la
pêcherie.
2-4-1-1. Paramètres requis pour l'application
de la VPA
L'application de la VPA (Figure 6) nécessite
l'introduction des paramètres suivants dans le programme VIT (Lleonart
et Salat, 2000) :
- paramètres de croissance de von Bertalanffy
(L8, K, to) ;
- paramètres de la relation taille-poids (a et
b) ;
- mortalité naturelle (M) ;
- mortalité par pêche (F terminal) ;
- proportion des matures de chaque classe de tailles ;
- l'effectif de captures pour chaque classe de taille
calculé à partir de l'effectif total des captures ; et
- la production annuelle.
Chauvet (1986) in Bouaziz (2007), considère
que d'une façon générale, les modèles
employés par la dynamique des populations sont très sensibles aux
changements des valeurs des paramètres retenus.
Afin d'appliquer `'l'Analyse de Populations Virtuelles'', un
programme informatique a été élaboré: VIT (Lleonart
et Salat, 1992). Toutes les données biologiques relatifs au S.
aurita ont été compilées à l'aide du logiciel
VIT récemment amélioré (Lleonart et Salat, 2000) dans le
cadre du projet FAO/COPEMED et fonctionnant sous Windows.
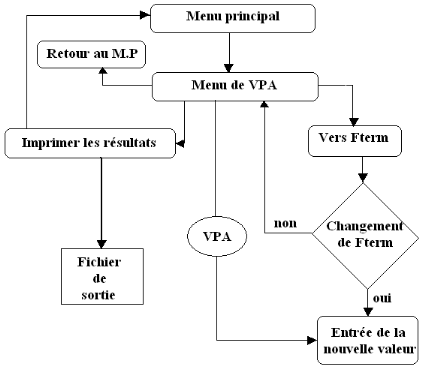
Figure 6. Diagramme de la VPA (Lleonart et
Salat, 2000)
2-4-2. Modèle de rendement par
recrue
Nous avons étudié pour la sardinelle de la
région centre de la côte algérienne, les différents
paramètres nécessaires à l'élaboration d'un
modèle structural (rendement par recrue) à partir duquel on
pourra mieux comprendre comment le stock réagit à la pêche.
Ainsi, les résultats de l'analyse de pseudo-cohortes sont
utilisés pour établir des diagnostics en terme de rendement par
recrue et de biomasse par recrue.
Le principe de base d'un diagnostic de rendement par recrue
est de permettre la quantification du potentiel de production d'un diagramme
d'exploitation quelque soit le niveau du recrutement. En d'autres termes, et
d'après Sidibé (2003) les rendements par recrue permettent de
savoir si le régime d'exploitation permet de tirer un bon parti de
chaque poisson entrant dans la pêcherie et si le recrutement est
utilisé de façon satisfaisante.
En considérant une cohorte hypothétique entrant
dans la pêcherie avec un recrutement quelconque R, on peut suivre,
grâce à l'équation de survie (équation 9), les
effectifs d'une cohorte tout au long de sa vie. En connaissant en plus un
vecteur de poids aux tailles (ou aux âges), l'équation de capture
(équation 10) permet de calculer chaque année les captures
pondérales et donc le poids total Y des captures que le diagramme
d'exploitation aura permis de tirer du recrutement R. On peut alors calculer le
rendement par recrue Y/R (en grammes par recrue) en divisant la production
totale Y par le recrutement R.
En faisant varier le vecteur de mortalité par
pêche F (en utilisant par exemple des multiplicateurs m.f du vecteur de
référence), on peut tracer la courbe de rendement par recrue et
prévoir quels effets sur la production par recrue aurait une
modification du niveau global de l'effort de pêche. La courbe de
rendement par recrue permet ainsi de définir le multiplicateur du
vecteur de mortalité par pêche qui permettrait une maximisation de
la production pour un diagramme d'exploitation donné.
L'équation de base utilisée dans tous les calculs
de production ou rendement par recrue est celle de la fonction
dérivée exprimant le taux instantané de production d'une
cohorte :
dYt /dt = Ft .
Nt . Wt
Où : Yt : est la
production totale d'une cohorte entre le moment de son recrutement et le
temps t ;
Ft : le taux
instantané de mortalité par pêche au temps t ; et
Nt et
Wt sont l'effectif et le poids moyen des
survivants au temps t.
En fin, les calculs de biomasse, de biomasse féconde et
de rendement par recrue à l'aide de programme VIT (Lleonart et Salat,
2000), sont menés à partir :
- les paramètres de croissance de l'équation de
Van Bertalanffy ;
- du vecteur de mortalité par pêche F par classe
de taille issu de l'analyse de pseudo-cohorte (analyse de VPA) ;
- les valeurs de mortalité naturelle estimée par
la méthode de Pauly ;
- les fréquences de tailles de S. aurita;
- la relation taille/poids ;
- pourcentage des individus matures S. aurita
(données de Bouaziz, 2007) ; et
- la production annuelle de la sardinelle dans la
région centre de la côte algérienne pour l'année
2004 qui est de l'ordre de 17850 tonnes (Bouaziz, 2007).
RESULTATS ET DISCUSSION
1 - Clé âge-longueur
L'application de la méthode de Bhattacharya (1968) par
le FISAT II 1.2.0 (Gayanilo et al., 2005), nous a permis d'obtenir les
résultats consignés dans le tableau 2 et les figures 7 et 8.
Tableau 2. Clé âge-longueur de
sardinelle de la région centre de la côte algérienne (FISAT
II, Gayanilo et al., 2005)
|
Age (an)
|
Intervalle de confiance de la taille (cm)
(pour á =5%)
|
Ni
|
r 2
|
s.d.
|
S.I.
|
|
1
|
11.18 #177; 0.52
|
2295
|
0.915
|
1.27
|
n.a.
|
|
2
|
16.67 #177; 0.088
|
3376
|
0.860
|
2.61
|
2.83
|
|
3
|
20.28 #177; 0.04
|
1058
|
0.755
|
0.65
|
2.22
|
|
4
|
24.03 #177; 0.05
|
1713
|
0.789
|
1.1
|
4.29
|
|
5
|
26.54 #177; 0.25
|
67
|
0.990
|
1.04
|
2.35
|
Ni : effectif de la cohorte ; r 2 :
coefficient de corrélation ; s.d. : écart type ;
S.I. : indice de séparation qui doit être > 2.
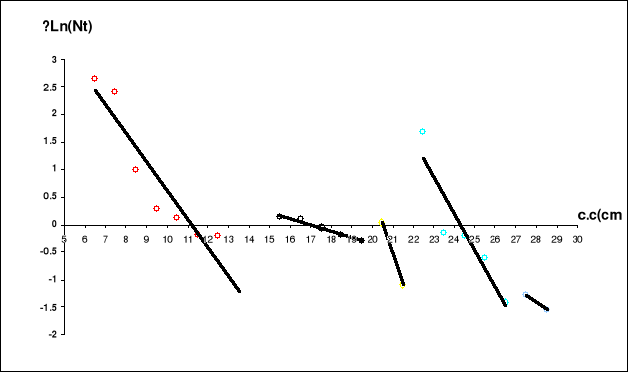
Figure 7. Estimation de l'âge par la
méthode de Bhattacharya (1967)
(FISAT II, Gayanilo et al., 2005)
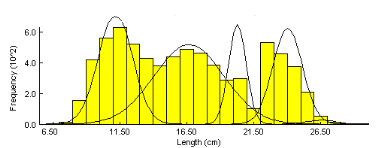
Figure 8. Décomposition de la
distribution de fréquences de tailles de S. aurita tous sexes
confondus par la méthode de Bhattacharya (1967) (FISAT II, Gayanilo et
al., 2005)
Tableau 3. Clés âge-longueur de
Sardinella aurita obtenues par différents auteurs dans la
Méditerranée.
|
Clé âge-longueur (an-cm)
|
|
Auteurs
|
Zone d'étude
|
Sexe
|
I
|
II
|
III
|
IV
|
V
|
VI
|
|
Tsikliras et al (2005)
|
Grèce
|
M, F
|
15.32
|
19.12
|
21.41
|
22.79
|
23.61
|
-
|
|
Bebars (1981)
|
Egypte
|
M, F
|
12.35
|
17.01
|
19.44
|
21.9
|
23.62
|
25.5
|
|
Ben Tuvia (1956)
|
Palestine
|
M, F
|
11.2
|
15.8
|
19.2
|
21.7
|
23.4
|
25.7
|
|
Bouaziz et al. (1998)
|
Algérie
|
M
|
8.8
|
15
|
17.3
|
19.5
|
19.9
|
-
|
|
F
|
8.8
|
15.1
|
19
|
21.4
|
22.3
|
-
|
|
Présent travail
|
Région centre de la côte algérienne
|
M, F
|
11.18
|
16.67
|
20.28
|
24.03
|
26.54
|
-
|
L'analyse du Tableau 3 montre que les résultats obtenus
dans cette étude concordent avec ceux de Ben Tuvia (1956) et Bebars
(1981) ayant travaillé respectivement en Palestine et en Egypte.
Il est évident que la sardinelle (Sardinelle
aurita, Valenciennes 1847) présente une faible
longévité (maximum 6 ans), ce fait est une caractéristique
des petits pélagiques en général et des
clupéidés en particulier (Pauly et Moreau, 1997).
2 - Etude de la croissance
2- 1. Paramètres de croissance
linéaire
Les couples de données âge-longueur obtenus par
la méthode indirecte de Bhattacharya (1967), ont été
introduits dans le programme FISAT II (Gayanilo et al., 2005), pour le
calcul des paramètres de l'équation de croissance de von
Bertalanffy (1938).
Les paramètres de croissance linéaire
estimés sont donnés dans le tableau 4.
Tableau 4. Paramètres de
croissance linéaire de von Bertalanffy (FISAT II, Gayanilo et
al. , 2005).
|
Paramètres
|
|
Espèce
|
L8 (cm)
|
K / an
|
to (an)
|
|
S. aurita
|
29.85
|
0.41
|
0
|
Lt = 29.85 . (1 - e -0.41 t
)
Les paramètres de croissance conduisent à
l'expression de l'équation de von Bertalanffy suivante :
La longueur asymptotique (L8) de Sardinella
aurita, estimée à 29.85 cm (Figure 9), demeure
inférieure à celle obtenue par l'équation classique de von
Bertalanffy (1938) pour la même espèce et la même zone
d'étude (L8 = 34.96 cm, Bouaziz et al., 2001).
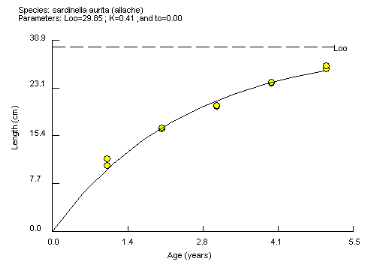
Figure 9. Courbe de croissance linéaire
obtenue par l'équation de von Bertalanffy de la sardinelle de la
région centre de la côte algérienne (FISAT II,
Gayanilo et al., 2005).
Tableau 5. Paramètres de
l'équation de von Bertalanffy de Sardinella aurita
d'après la littérature.
|
Auteur
|
Zone d'étude
|
Méthode utiliser
|
Sexe
|
Tmax (an)
|
Lmax (cm)
|
L8 (cm)
|
K /an
|
to
|
|
Navarro (1932)
|
Iles Baléares
|
-
|
M, F
|
4
|
23.8
|
27.54
|
0.458
|
-0.382
|
|
Ananiades (1952)
|
Mer Egée
|
S
|
M, F
|
5
|
26.00
|
32.57
|
0.288
|
-0.579
|
|
Ben Tuvia (1956)
|
Palestine
|
-
|
M, F
|
6
|
25.7
|
31.10
|
0.250
|
-1.800
|
|
Bebars (1981)
|
Egypte
|
LF
|
M, F
|
6
|
25.5
|
33.11
|
0.1356
|
- 1.377
|
|
Gaamour et al (2001)
|
Tunisie
|
O
|
M
|
7
|
26.78
|
26.42
|
0.265
|
-1.920
|
|
F
|
7
|
27.35
|
29.73
|
0.239
|
-2.100
|
|
Gaamour et al (2004)
|
Tunisie
|
O
|
M
|
-
|
-
|
23.4
|
0.295
|
-1.9
|
|
F
|
-
|
-
|
26.3
|
0.231
|
-2.1
|
|
Gaamour et al (2001)
|
Tunisie
|
O
|
M, F
|
7
|
27.35
|
31.32
|
0.240
|
-2.580
|
|
Bouaziz et al (1998)
|
Algérie
|
LF
|
M
|
5
|
23.50
|
20.70
|
0.691
|
-0.194
|
|
F
|
5
|
25.50
|
24.24
|
0.540
|
-0.170
|
|
Bouaziz et al (2001)
|
Algérie
|
LF
|
M, F
|
4
|
25.50
|
34.96
|
0.236
|
-0.707
|
|
Tsikliras et al (2005)
|
Grèce
|
LF
|
M, F
|
5
|
25.00
|
24.87
|
0.509
|
-0.881
|
|
Sennai Cheniti (2003)
|
Algérie
|
LF
|
M, F
|
-
|
-
|
25.48
|
0.502
|
-
|
|
Présent travail
|
Région centre de la côte algérienne
|
LF
|
M, F
|
5
|
30.5
|
29.85
|
0.41
|
0
|
L'analyse du Tableau 5 permet de conclure :
- un rapprochement entre les résultats de la
présente étude et ceux trouvés en
Méditerranée et notamment avec ceux de Navarro (1932) dans les
Iles Baléares et de Ben Tuvia (1956) en Palestine ; et
- une divergence avec les autres résultats. Ceci peut
être attribué à la différence des méthodes
utilisées pour la détermination de l'âge. Cette même
divergence peut aussi être causée par les conditions de milieux
qui varient d'un secteur à l'autre et notamment la température et
la richesse des eaux (Curry et Fontana, 1988).
2 - 2. Relation taille-poids
Selon Bouaziz (2007), le test de t basé sur la
comparaison de deux pentes, fournit des valeurs supérieures à
1.96 pour á = 5 %. Ce résultat permet de conclure que
Sardinella aurita, capturée dans la zone d'étude, se
caractérise par une allométrie, entre le poids (Wt) et la
longueur totale (Lt), de type majorante.
Tableau 6. Relation d'allométrie entre
le poids total et la longueur totale de S. aurita (Bouaziz, 2007).
|
Relation d'allométrie
|
Effectif
|
r
|
| t | cal (á = 5%)
|
|
Sexes confondus
|
Wt = 0.00321. Lt3.28
|
330
|
0.999
|
38.14
|
La pente (b) = 3.28, L'ordonnée à l'origine (a)
= 0.00321
La valeur du coefficient de corrélation (r) est
très proche de 1, ce qui traduit la forte corrélation positive
entre les deux variables.
W8 = a * L8b W8 =
0.00321 * 29.85 (3.28) (équation de la relation
taille - poids).
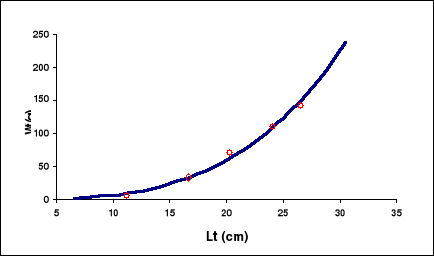
Figure 10. Relation taille-poids pour la
sardinelle de la région centre de la côte algérienne.
2 - 3. Croissance pondérale
La combinaison de l'équation de croissance
linéaire de von Bertalanffy (1938) avec la relation d'allométrie
de type : W = a (L)b conduit à l'expression de
croissance pondérale suivante :
Wt = 220.96 * (1-
e-0.41t)3.28
Les résultats de la courbe de croissance
pondérale regroupés sont donnés dans le tableau 7 et la
figure 11.
Tableau 7. Poids moyen (grammes) à
divers âges de S. aurita exploitée dans la région
centre de la côte algérienne.
|
Age (ans)
|
Wt (g)
|
|
1
|
6.2
|
|
2
|
32.91
|
|
3
|
71.09
|
|
4
|
108.93
|
|
5
|
140.61
|
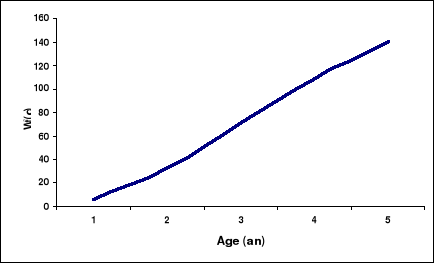
Figure 11. Courbe théorique de
croissance pondérale de Sardinella aurita (sexes confondus).
Tableau 8. Poids asymptotiques (W
8) de Sardinella aurita d'après la
littérature.
|
Auteurs
|
Zone d'étude
|
Sexe
|
W8 (g)
|
|
Bebars (1981)
|
Egypte
|
M, F
|
311.35
|
|
Kartas (1981)
|
Tunis
|
M, F
|
198.18
|
|
Bouaziz et al. (1998)
|
Région algéroise
|
M
|
61.12
|
|
F
|
102.39
|
|
Présent travail
|
Région centre de la côte algérienne
|
M, F
|
220.96
|
Le tableau 8 montre que le poids asymptotique trouvé
dans la présente étude est différent de ceux
trouvés par Bebars (1981) en Egypte et de Bouaziz et al. (1998)
en Algérie, et proche de celui de Kartas (1981) en Tunis. Ceci est
dû sans doute à la divergence des résultats obtenus pour
L8 et les paramètres de la relation taille-poids (a et b).
3 - Etude des
mortalités
3 - 1. Mortalité totale (Z)
La valeur estimée du coefficient de mortalité
totale (Z) est donnée dans le Tableau 9. La figure 12 présente la
courbe de capture obtenue pour la sardinelle de la région centre de la
côte algérienne.
D'après Sparre et Venema (1996), des observations sont
exclues de la régression de la courbe de captures
linéarisée. Ce sont les premières classes de tailles qui
forment la partie ascendante de la courbe. Ces poissons ne sont pas encore
pleinement recrutés pour la pêche. Les classes de tailles les plus
grandes sont également exclues, pour les raisons suivantes :
· faibles effectifs des échantillons ; et
· à mesure qu'on approche de L8 la
relation entre l'âge et la longueur devient incertaine.
Tableau 9. Coefficient de mortalité
totale (Z) estimé avec la méthode de la courbe de capture a
l'aide de FISAT II (Gayanilo et al. , 2005) pour S.
aurita exploitées dans la région centre de la côte
algérienne.
|
Espèces
|
Coefficient de mortalité totale (Z)
|
|
Sardinella aurita
|
2.11 /ans
|
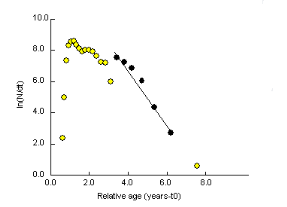
Figure 12. Courbe de capture pour l'estimation
de Z de S. aurita exploitée dans la région centre de la
côte algérienne (FISAT II, Gayanilo et al., 2005).
(· points inclus dans le calcul de la régression
; points non inclus). points non inclus).
Toutefois, il est admis que l'objectif recherché n'est
cependant pas d'obtenir de valeur exacte mais d'ordres de grandeur et de valeur
relative qui nous permettront par la suite d'apprécier le sens de
l'évolution des captures si des changements notables interviennent dans
la pêcherie.
Tableau 10. Mortalités totale
estimées par d'autres auteurs dans différentes régions.
|
Auteurs
|
Zone d'étude
|
Sexe
|
Z /an
|
|
Bouaziz et al. (2001)
|
Région centre de la côte algérienne
|
M, F
|
2.22
|
|
Chavance et al. (1985)
|
Oran
|
M
|
1.79
|
|
F
|
1.47
|
|
Bebars (1981)
|
Egypte
|
M, F
|
0.993
|
|
Sennai Cheniti (2003)
|
Ghazaouet
|
M, F
|
0.69
|
|
Présent travail
|
Région centre de la côte algérienne
|
M, F
|
2.11
|
La mortalité totale (Z) diffère d'un auteur
à un autre et d'une région à une autre (Tableau 10).
Korichi (1988), indique que les variations extrêmes de
la mortalité totale Z sont dues soit à la migration de poissons
liée aux facteurs du milieu d'environnement, soit aux fluctuations de
recrutement qui sont des paramètres difficiles à cerner.
La divergence entre nos résultats et ceux de Bebars
(1981) et de Sennai Cheniti (2003), peut être dûe aux choix des
méthodes de calcul, et des conditions d'exploitations des stocks.
3 - 2. Mortalité naturelle
(M)
3-2-1. Estimation de M par la méthode de Pauly
pour chaque groupe d'âge
La mortalité naturelle (M) est une composante
importante de toute évaluation d'un stock de poisson selon l'âge.
Habituellement, la valeur de M est fixe (valeur constante) dans les
évaluations analytiques des stocks de poissons, cette valeur
étant établie selon les caractéristiques naturelles du
cycle biologique de ces stocks.
La mortalité naturelle est une variable avec
l'âge du poisson et avec les années. Nous présentons dans
le Tableau 11 et la figure 13, les valeurs de M estimées par
l'équation empirique de Pauly (1980, 1984a) pour la sardinelle de la
région centre de la côte algérienne.
Les mortalités naturelles les plus
élevées sont observées chez les premiers groupes
d'âges, alors que la plus faible valeur de M, se rencontre chez les
derniers groupes d'âges.
Tableau 11. Coefficients de mortalité
naturelle (M) estimé par la méthode de Pauly pour chaque groupe
d'âge.
|
Avec : T° = 18 °C (Bouaziz,
2007)
|
Méthode de Pauly
|
|
Âge (an)
|
Lt' (cm)
|
N moy
|
Lmax
|
L8 (cm)
|
Log10(M)
|
M /an
|
|
1
|
11.18
|
2295
|
12.5
|
13.1579
|
0.00948475
|
1.022
|
|
2
|
16.67
|
3376
|
19.5
|
20.5263
|
-0.044397
|
0.903
|
|
3
|
20.28
|
1058
|
21.5
|
22.6316
|
-0.0562277
|
0.879
|
|
4
|
24.03
|
1713
|
26.5
|
27.8947
|
-0.081563
|
0.829
|
|
5
|
26.54
|
67
|
30.5
|
32.1053
|
-0.098597
|
0.797
|
/an
(an)
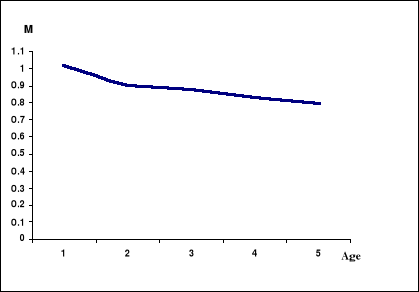
Figure 13. Variation de la
mortalité naturelle (M) en fonction de l'âge.
L'analyse de la figure 13 montre que la mortalité M
diminue rapidement jusqu'à l'âge 2 ensuite lentement jusqu'au
dernier âge. Comme Bouaziz et al. (2004), ceci confirme le fait
que les jeunes recrues sont très vulnérables aux changements
éventuels des conditions du milieu d'une part, et surtout
exposées à une forte prédation d'autre part.
Caddy (1996), montre que la mortalité naturelle diminue
rapidement de très hautes valeurs dans l'oeuf et les stades larvaires
à un niveau relativement constant autour de l'âge de la
maturité. Les taux de mortalité de très fortes valeurs de
la première année de vie baissent vers une faible valeur pour les
adultes, qui peuvent raisonnablement être considérés comme
constants.
Les phases de la vie de chaque cohorte qui
précèdent le recrutement à la zone de pêche (oeuf,
larve, pré-recrues), sont des phases importantes de leur cycle de vie,
mais, généralement, elles ne sont pas sujettées à
l'exploitation, les variations d'abondance étant dues essentiellement
à la prédation et aux facteurs de l'environnement (vents,
courants, température, salinité...). La mortalité dans ces
phases de non-exploitation est normalement très élevée
surtout pendant la dernière phase larvaire (Cushing, 1996 in
Cadima, 2002) résultant, ainsi, en une survie très réduite
jusqu'au recrutement.
D'après Moreau et al. (1984),
chez les jeunes individus, existe deux causes de mortalité
naturelle : la prédation dont l'influence diminue avec l'âge de
la proie et l'ensemble des stress physiologiques (maladies, pénuries
alimentaire, stress écologiques) dont l'impact sur la démographie
peut être en première approximation admis constant, au moins dans
la tranche d'âge étudiée.
Pour le stock de la sardinelle de la région centre de
la côte algérienne, la valeur de M doit être
estimée pour chaque sous-population (groupe d'âge), avant
l'analyse de cohortes (VPA) et l'ajustement des modèles structuraux
d'évaluation, afin de se rapprocher le mieux de la
réalité.
3-2-2. Estimation de M par la méthode de Pauly
pour toute la population
A l'aide de programme FISAT II (Gayanilo et al.,
2005), on a constaté que la mortalité naturelle
estimée par l'équation empirique de Pauly (1980, 1984a), pour
toute la population (0.81 an -1), est presque égale ou
relativement proche de la moyenne des mortalités naturelles des cinq
groupes d'âges (0.88 an -1), de la sardinelle de la
région centre de la côte algérienne.
Tableau 12. Mortalité naturelle de
Sardinella aurita estimée par quelques auteurs.
|
Auteur
|
Région
|
Sexe
|
M /an
|
|
Bebars (1981)
|
Egypte
|
M, F
|
0.993
|
|
CGPM (1988)
|
Tunis
|
M, F
|
0.76
|
|
Chavance et al. (1985)
|
Algérie
|
M
|
0.703
|
|
F
|
0.593
|
|
Présent travail
|
Région centre de la côte algérienne
|
M, F
|
0.81
|
La mortalité naturelle (M) diffère d'un auteur
à un autre et d'une région à une autre ; ceci revient
à la divergence des paramètres utilisés pour sa
détermination.
Selon Korichi (1988), la température du milieu et les
paramètres de l'équation de von Bartalanffy sont les principales
sources de variations des valeurs de la mortalité naturelle (Tableau
12).
Ursin (1967) in Pauly(1985), montre que la
mortalité naturelle dépend à la fois de facteurs
physiologiques (maladies, vieillesse), de facteurs environnementaux
(température, courants...) et de facteurs dus aux hasards (rencontre
avec d'éventuels prédateurs).
Laurec et le Guen (1981) décrivent la réforme
comme le processus inverse du recrutement, qui conduit les individus à
quitter définitivement les lieux de pêche au-delà d'un
certain âge.
3-2-3. Mortalité par pêche
(F)
Le coefficient de mortalité par pêche (F) est
estimé à 1.3 an -1, à partir des valeurs de Z
et M calculées ci-dessus.
Le coefficient de mortalité par pêche est
relativement élevé après le plein recrutement et est
généralement supérieur a celui de la mortalité
naturelle.
4 - Exploitation
4 - 1. Analyse du stock de S. aurita en
fonction de M
L'étude de l'analyse de la pseudo-cohortes à
l'aide du programme VIT (Lleonart et Salat, 2000) nous a permis d'obtenir des
résultats relatifs à l'exploitation de S. aurita de la
région centre de la côte algérienne.
4-1-1. Captures en nombre d'individus et en
poids
Le tableau 13 et les figures 14 et 15 représentent les
captures subies par le stock de Sardinella aurita de la région
centre de la côte algérienne, et ceci en nombre et en poids en
fonction de M.
Soit M constante ou variable, l'exploitation de Sardinella
aurita se fait essentiellement sur l'âge 4. Ce sont les individus
appartenant à la classe de tailles 22.5 cm. Leur poids total moyen est
de 2666.6 tonnes correspondant à une capture de 30.6 millions
d'individus environ.
La taille moyenne et l'âge moyen de capture de
Sardinella aurita sont respectivement de 16.52 cm et de 2.19 ans.
Tableau 13. Captures en nombre d'individus et en
poids en fonction de la taille de Sardinella aurita de la
région centre de la côte algérienne, en fonction de M.
(VIT, Lleonart et Salat, 2000)
|
Les captures en nombre
|
Les captures en poids (g)
|
|
C.C. (cm)
|
M constante
|
M variable
|
M constante
|
M variable
|
|
6.5
|
57634.78
|
57643.19
|
86293.32
|
86225.92
|
|
7.5
|
806886.94
|
807004.61
|
1928518.6
|
1927184.87
|
|
8.5
|
8933391.14
|
8934693.86
|
32150479.7
|
32131201.9
|
|
9.5
|
24033703.9
|
24037208.6
|
124450442
|
124387445
|
|
10.5
|
32102573.3
|
32107254.7
|
230665584
|
230561211
|
|
11.5
|
36252277.6
|
36257564.1
|
350869836
|
350721885
|
|
12.5
|
30085356
|
30089743.2
|
382676692
|
382513139
|
|
13.5
|
24494782.2
|
24498354.1
|
400955341
|
400925479
|
|
14.5
|
21901217
|
21904410.7
|
453101383
|
453065771
|
|
15.5
|
25244034.3
|
25247715.5
|
649764845
|
649719186
|
|
16.5
|
27952869.1
|
27956945.3
|
882986225
|
882928552
|
|
17.5
|
26569634.3
|
26573508.8
|
1017742477
|
1017668001
|
|
18.5
|
21958851.8
|
21962053.9
|
1009178869
|
1009084420
|
|
19.5
|
16368278
|
16370664.9
|
893973296
|
893864095
|
|
20.5
|
16944625.8
|
16947096.7
|
1090067345
|
1090004422
|
|
21.5
|
5705843.37
|
5706675.43
|
429261364
|
429218121
|
|
22.5
|
30604069
|
30608531.9
|
2666343253
|
2666640190
|
|
23.5
|
26223825.6
|
26227649.7
|
2631692054
|
2631981935
|
|
24.5
|
21440138.7
|
21443265.3
|
2460553362
|
2460831055
|
|
25.5
|
11872765
|
11874496.4
|
1548418963
|
1548572142
|
|
26.5
|
2881739.08
|
2882159.31
|
426594755
|
426595243
|
|
27.5
|
806886.94
|
807004.61
|
134508600
|
134534012
|
|
28.5
|
172904.34
|
172929.56
|
32030022.8
|
32039083.3
|
|
total
|
413414288
|
413474574
|
17850000000
|
17850000000
|
|
Age moyen (an)
|
2.19
|
|
Taille moy (cm)
|
16.52
|
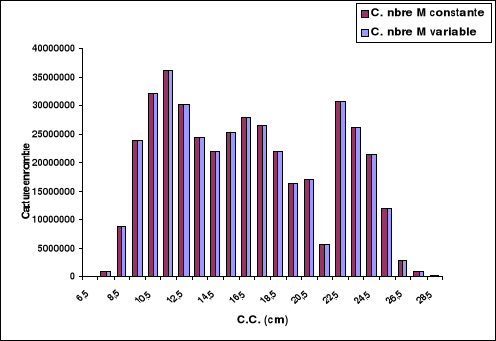
Figure 14. Captures en nombre d'individus en
fonction de la taille de S. aurita de la région centre de la
côte algérienne, en fonction de M.
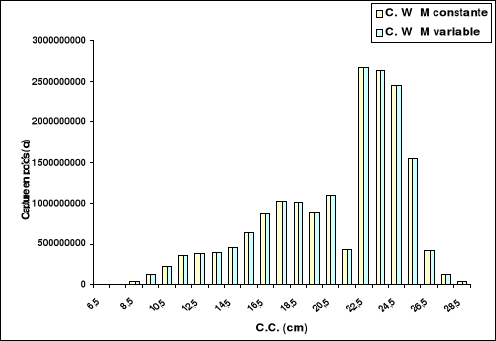
Figure 15. Captures en poids en fonction de la
taille de S. aurita de la région centre de la côte
algérienne, en fonction de M.
4-1-2. Analyse de la VPA
4-1-2-1. Analyse de la biomasse
La biomasse exploitable du stock de Sardinella aurita
de la région centre de la côte algérienne
estimée pour M constante et M variable, est respectivement de l'ordre de
55799 tonnes et de 61179 tonnes (Tableau 14). Ce stock est composé de 23
classes de tailles allant de 6.5 à 28.5 cm. Toutefois, nous avons
remarqué que la majorité de cette biomasse est comprise entre
11.5 et 24.5 cm (Figure 16).
La taille moyenne du stock est de 12.67 cm pour M constante,
et de 12.28 cm pour M variable à qui correspond respectivement des
âges moyens de 1.47 et de 1.402 ans. Son poids maximum virtuel,
correspond à 61899916 individus pour M constante, et à 63681742
individus pour M variable.
La taille critique du stock actuel
c'est-à-dire la taille pour laquelle la biomasse est maximale
est de 17.5 cm pour M constante ; et de 16.5 cm pour M variable (Tableau
15 et Figure 16).
Quand ce stock ne fait pas l'objet d'une exploitation
halieutique cette taille (taille critique du stock vierge) est de 18
cm pour M constante ; et de 17 cm pour M variable.
A ces deux dernières tailles (actuel et vierge)
correspondent respectivement des âges de 2.056 et 2.253 ans pour M
constante ; et de 1.873 et 2.056 ans pour M variable.
En outre, l'analyse des cohortes permet de calculer les
effectifs des populations par classes de tailles. La classe la plus petite est
considérée comme "recrutement".Abella et al. (1996),
signalent que dans les pêcheries méditerranéennes, pour la
majorité des espèces, le recrutement commence dans la
première année de vie. Sa valeur est de l'ordre de 2564326421
individus pour M constante, et de 3511848426 individus pour M variable.
Tableau 14. Résultats de la biomasse
obtenue par la VPA en fonction de M de la population de S. aurita de
la région centre de la côte algérienne. (VIT, Lleonart et
Salat, 2000).
|
M constante
|
M variable
|
|
C.C. (cm)
|
poids moy virtuel (g)
|
nombre moy d'individu
|
poids moy virtuel (g)
|
nombre moy d'individu
|
|
6,5
|
384601286,1
|
256872840
|
520522091,8
|
347976023
|
|
7,5
|
588168578
|
246088135
|
778327825,4
|
325923137
|
|
8,5
|
845004350
|
234794455
|
1092738110
|
303856685
|
|
9,5
|
1150301117
|
222144623
|
1453927855
|
280963783
|
|
10,5
|
1495269461
|
208102126
|
1845389416
|
257261845
|
|
11,5
|
1870664061
|
193279176
|
2257744849
|
233405248
|
|
12,5
|
2271745255
|
178600542
|
2664031235
|
210348104
|
|
13,5
|
2696425419
|
164727456
|
3116032744
|
190403648
|
|
14,5
|
3132943904
|
151434727
|
3579502616
|
173058528
|
|
15,5
|
3552968151
|
138036477
|
4010745327
|
155855267
|
|
16,5
|
3920141524
|
124100693
|
4370366538
|
138382769
|
|
17,5
|
4215045189
|
110039830
|
4636780105
|
121076340
|
|
18,5
|
4437995361
|
96566907,3
|
4808934094
|
104663265
|
|
19,5
|
4597247149
|
84173676,8
|
4894439796
|
89639167,9
|
|
20,5
|
4650245739
|
72286060,3
|
4866488052
|
75662852,5
|
|
21,5
|
4656847523
|
61899916,4
|
4789724079
|
63681742,3
|
|
22,5
|
4258931759
|
48883669,2
|
4331412190
|
49717306,6
|
|
23,5
|
3306443097
|
32947467
|
3352855197
|
33411138
|
|
24,5
|
2144728225
|
18688182,7
|
2168305202
|
18894244,5
|
|
25,5
|
1041603172
|
7986668,97
|
1049266291
|
8045804,52
|
|
26,5
|
412815606,3
|
2788657,97
|
412212935,6
|
2784989,68
|
|
27,5
|
144252589
|
865338,95
|
143002695,8
|
857804,16
|
|
28,5
|
24638479,08
|
133003,34
|
24645448,71
|
133022,74
|
|
Biomasse en poids (tonnes)
|
55799
|
61167
|
|
biomasse en nombre (individus)
|
2655440629
|
3186002715
|
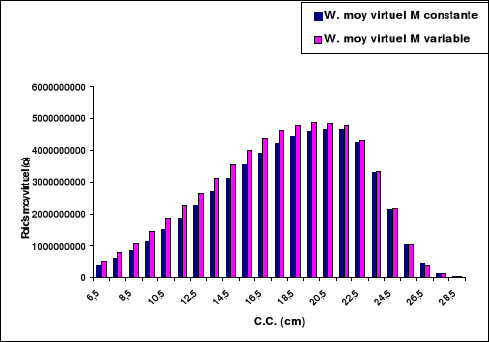
Figure 16. Variation du poids moyen virtuel en
fonction de la taille de la population de S. aurita dans la
région centre de la côte algérienne, en fonction de M.
Tableau 15. Résultats de la VPA, obtenus
par le VIT (Lleonart et Salat, 2000) de S. aurita de la région
centre de la côte algérienne, en fonction de M.
|
M constante
|
M variable
|
|
Age moyen du stock actuel (ans)
|
1.467
|
1.402
|
|
Age critique du stock actuel (ans)
|
2.056
|
1.873
|
|
Age critique du stock vierge (ans)
|
2.253
|
2.056
|
|
Longueur moyenne du stock (cm)
|
12.672
|
12.278
|
|
Longueur critique du stock actuel (cm)
|
17.500
|
16.500
|
|
Longueur critique du stock vierge (cm)
|
18.000
|
17.000
|
|
Recrutement (en nombre, R)
|
2564326421
|
3511848426
|
|
Biomasse moyenne (Bmoy) (g)
|
55799027022.63
|
61179394705.26
|
|
Biomasse du stock mature (SSB) (g)
|
46408378746.52
|
49711078910.81
|
|
Biomasse à l'équilibre (D) (g)
|
63047211888.33
|
73272570875.61
|
|
Mortalité naturelle/D
|
71.69
|
75.64
|
|
Biomasse du stock vierge (g)
|
97085398299.06
|
99560902877.1
|
|
Turnover, D/Bmoy
|
112.99
|
119.77
|
4-1-2-2. Analyse des mortalités par pêche
(F)
Les mortalités par pêche sont pratiquement nulles
pour les classes de tailles comprises entre 6.5 et 8.5 cm alors que par la
suite elles sont toutes supérieures à 0,13 an -1
(Figure 17).
Les poissons les plus vulnérables aux engins de
pêche ont des tailles supérieures à 23.5 cm. La
majorité des poissons capturés ont des tailles comprises entre 12
et 29 cm si nous nous référons à la courbe de la
mortalité par pêche (Figure 17).
Ensuite, des fluctuations importantes de F s'observent avec
deux pics de 1.48 et 1.3 an-1 en moyenne, qui correspondent aux
classes de tailles de 25.5 et de 28.5 cm, se traduisant ainsi par des captures
pondérales beaucoup plus importantes (Figures 17)
Les valeurs de la mortalité moyenne par pêche
(soit M constante ou variable) , estimée à 0.80 an-1,
demeure largement supérieure à la valeur globale de la
mortalité par pêche (F global) qui est de 0.156 an-1
pour M constante et de 0.13 an -1 pour M variable (Tableau 16).
Comme Bouaziz (2007), ceci s'expliquerait par le fait que
Fglobal relie la capture annuelle totale au nombre moyen d'individus de la
population
Tableau 16. Mortalités par pêche en
fonction de la taille obtenues par la VPA de S. aurita de la
région centre de la côte algérienne, en fonction de M (VIT,
Lleonart et Salat, 2000).
|
M constante
|
M variable
|
|
C.C. (cm)
|
F /an
|
F /an
|
|
6,5
|
0
|
0
|
|
7,5
|
0,003
|
0,002
|
|
8,5
|
0,038
|
0,029
|
|
9,5
|
0,108
|
0,086
|
|
10,5
|
0,154
|
0,125
|
|
11,5
|
0,188
|
0,155
|
|
12,5
|
0,168
|
0,143
|
|
13,5
|
0,149
|
0,129
|
|
14,5
|
0,145
|
0,127
|
|
15,5
|
0,183
|
0,162
|
|
16,5
|
0,225
|
0,202
|
|
17,5
|
0,241
|
0,219
|
|
18,5
|
0,227
|
0,11
|
|
19,5
|
0,194
|
0,183
|
|
20,5
|
0,234
|
0,224
|
|
21,5
|
0,092
|
0,09
|
|
22,5
|
0,626
|
0,616
|
|
23,5
|
0,796
|
0,785
|
|
24,5
|
1,147
|
1,135
|
|
25,5
|
1,487
|
1,476
|
|
26,5
|
1,033
|
1,035
|
|
27,5
|
0,932
|
0,941
|
|
28,5
|
1,3
|
1,3
|
|
Age moyen à la capture (an)
|
2.188
|
2.187
|
|
Longueur moyenne à la capture (cm)
|
16.524
|
16.523
|
|
F moyen /an
|
0.801
|
0.795
|
|
F global /an
|
0.156
|
0.13
|
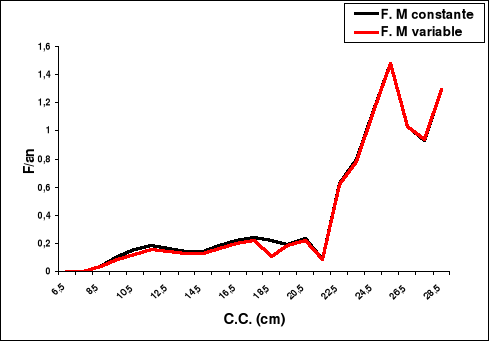
Figure 17. Mortalités par pêche en
fonction de la taille, obtenues par l'analyse de la VPA, de S. aurita
de la région centre de la côte algérienne, en fonction
de M.
4-1-3. Biomasse totale équilibrée
(D)
Considérons l'ensemble des animaux recrutés,
regroupant un nombre limité de classes d'âges. On entend
généralement par situation d'équilibre des situations
où toutes les cohortes présentes étaient de même
effectif à l'âge de recrutement et ont toutes subi le même
régime d'exploitation. Dans ce cas, les captures de chaque année
sont égales aux captures que permet une cohorte au long de son existence
exploitée (Laurec et Le Guen, 1981).
Tableau 17. Etat du stock de S.
aurita à l'équilibre, pour M constante et variable
(VIT, Lleonart et Salat, 2000)
|
Equation générale de la
biomasse
|
M constante
|
M variable
|
|
Biomasse (g)
|
Pourcentage (%)
|
Biomasse (g)
|
Pourcentage (%)
|
|
Recrutement
|
2936394762.31
|
4.66
|
4021396511.82
|
5.49
|
|
Croissance
|
60110817126.02
|
95.34
|
69251174363.79
|
94.51
|
|
mortalité naturelle
|
45197211888.33
|
71.69
|
55422570875.61
|
75.64
|
|
Capture total
|
1785. 107
|
28.31
|
1785. 107
|
24.36
|
Pour M constante, la biomasse
régénérée annuellement par le recrutement et la
croissance est perdue à 71.69 % qui représente 45197 tonnes par
la mortalité naturelle alors que le reste 28.31 % est capturé par
la pêche. La biomasse totale équilibrée est estimée
à 63047 tonnes avec 95.34 %, soit 60110 tonnes, correspondant à
la croissance. Et 4.66 % correspondant au recrutement soit 2936 tonnes (Tableau
17. Figure 18).
Mortalité par pêche
17850 tonnes
(28.31%)
Croissance
60110 tonnes
(95.34 %)
Biomasse totale équilibrée
63047 tonnes
Recrutement
2936 tonnes
(4.66 %)
Gains
Pertes
Mortalité naturelle
45197 tonnes (71.69 %)
Figure 18. Diagramme des entrées et des
sorties de la biomasse totale équilibrée de S. aurita de
la région centre de la côte algérienne. Pour M
constante.
La biomasse totale à l'équilibre est
estimée à 73273 tonnes dont 94.51 %, soit 69251 tonnes provient
de la croissance qui devance le recrutement qui ne représente qu'une
fine partie des entrée qui est de l'ordre de 5.49 % soit 4021 tonnes
(Tableau 17. Figure 19).
Croissance
69251 tonnes
(94.51 %)
Mortalité par pêche
17850 tonnes
(24.36 %)
Biomasse totale équilibrée 73273
tonnes
Pertes
Gains
Recrutement
4021 tonnes
(5.49 %)
Mortalité naturelle
55422.6 tonnes (75.64 %)
Figure 19. Diagramme des entrées et
des sorties de la biomasse totale équilibrée de S. aurita
de la région centre de la côte algérienne. Pour M
variable.
Le turnover (le taux de renouvellement) de la sardinelle est
très satisfaisant car il est de l'ordre de 112.99 % pour M constante et
de 119.77 % pour M variable (Tableau 15).
4-1-4. Rendements (productions) et biomasses par
recrue
La `'VPA'' a également permis de déterminer les
rendements par recrue ainsi que la biomasse totale moyenne par recrue. La
figure 20, représente le rendement et la biomasse par recrue (Y/R et
B/R) en fonction d'un multiplicateur de l'effort de pêche pour M
constante et variable. Ainsi un facteur `'d'effort de pêche'' de 1.3
correspond à l'effort de pêche qui s'exerce actuellement sur le
stock.
L'examen de l'évolution du rendement et de la biomasse
par recrue en fonction de la mortalité par pêche (F) (Tableau 18.
Figure 20) révèle un état de sous-exploitation soit M
constante ou variable. Le rendement par recrue actuel (Y/R) est de l'ordre de
6.961 g pour M constante et de 5.083 g pour M variable, demeure
inférieur au seuil de la production maximale équilibrée
(MSY=8.16 g de M constante et MSY = 6.456 g de M variable).
En revanche, la biomasse par recrue actuel (B/R) est de 21.76
g pour M constante et de 17.42 g pour M variable, qui exprime la biomasse
moyenne annuelle des survivants en fonction de la mortalité par
pêche, est largement supérieure à la biomasse maximale
équilibrée (Bmax / R) qui est de l'ordre de 12.17 g pour M
constante et de 8.44 g pour M variable. (Tableau 19).
Tableau 18. Résultats de
l'analyse du rendement et de la biomasse par recrue de S. aurita
exploitée dans la région centre de la côte
algérienne, en fonction de M.
|
M constante
|
M variable
|
|
Bmax (g)
|
12.174
|
8.446
|
|
MSY (g)
|
8.167
|
6.456
|
|
FMSY
|
3.165
|
4.53
|
|
B/R actuel (g)
|
21.760
|
17.421
|
|
Y/R actuel (g)
|
6.961
|
5.083
|
|
SSB/R actuel (g)
|
18.098
|
11.654
|
|
F actuel
|
1.3
|
Le stock vierge (B0) de l'allache de la
région centre de la côte algérienne est estimé
à 97085 tonnes environ pour M constante et à 99560 tonnes pour M
variable.
Il est considéré comme un point de
référence biologique (P.R.B.). Ce stock correspond à la
valeur moyenne à long terme de la biomasse escomptée en l'absence
de mortalité par pêche. Dans les modèles de production,
B0 est aussi connue comme la capacité de pêche (Caddy,
1994 in Bouaziz, 2007).
Tableau 19. Rendements et biomasses par recrue
en fonction de (F) de S. aurita de la région centre de la
côte algérienne, pour M constante et variable.
|
M constante
|
M variable
|
|
Type de F
|
F /an
|
Y/R (g)
|
B/R (g)
|
F /an
|
Y/R (g)
|
B/R (g)
|
|
Fo
|
0
|
0
|
37.86
|
0
|
0
|
28.35
|
|
F actuel
|
1.3
|
7.463
|
19.5
|
1.3
|
5.518
|
15.847
|
|
FMSY
|
3.165
|
8.167
|
11.688
|
4.53
|
6.456
|
8.562
|
|
|
|
|
|
|
|
Yactuel : 5.
518
Bmax : 12.174
FMSY: 3.165
Factuel : 1.
3
Bactuel :
19.5
FMSY: 4.53
Bmax : 8.446
MSY: 6.456
MSY: 8.167
Bactuel :
15.847
actuel
Yactuel :
7.463
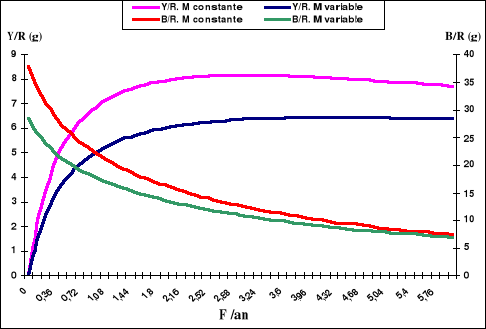
Figure 20. Rendements et biomasses par recrue
de Sardinella aurita de la région centre de la côte
algérienne, en fonction de M.
4 - 2. Discussion
Dans ce travail on met en oeuvre les deux méthodes
classiques de l'approche structurale appliquées à S. aurita
pour les deux hypothèses de M. Ces deux méthodes
sont :
- l'analyse des cohortes (ou VPA).
- le rendement par recrue.
Etant donnée que ce qui nous intéresse c'est de
connaître l'impact de la variation de la mortalité naturelle (M)
par âge sur la biomasse exploitable de la sardinelle exploitée
dans la région centre de la côte algérienne, nous devons
faire une distinction bien nette entre la mortalité M constante et M
variable. Pour étayer nos hypothèses, on construit le tableau 20,
qui montre l'effet de cette variation de M par âge sur les
paramètres d'exploitations de cette espèce.
Tableau 20. Analyse de l'impact de
changement de M par âge sur les paramètres d'exploitations de
S. aurita de la région centre de la côte
algérienne
|
Paramètres d'exploitations
|
M constante
|
M variable
|
Différence
|
|
Bmax (g)
|
12.174
|
8.446
|
3.728
|
|
MSY (g)
|
8.167
|
6.456
|
1.711
|
|
FMSY / an
|
3.165
|
4.53
|
1.365
|
|
B/R actuel (g)
|
21.760
|
17.421
|
4.339
|
|
Y/R actuel (g)
|
6.961
|
5.083
|
1.878
|
|
SSB/R actuel (g)
|
18.098
|
11.654
|
6.444
|
|
Nombre de recrus (millions)
|
2564
|
3511
|
947
|
|
Biomasse de stock mature (tonnes)
|
46408
|
49711
|
3303
|
|
Biomasse moyenne (tonnes)
|
55799
|
61179
|
5380
|
|
Biomasse équilibrée (tonnes)
|
63047
|
73272
|
10225
|
|
Pertes causées par M (tonnes)
|
45197
|
55422
|
10225
|
|
Gains causés par R (tonnes)
|
2936
|
4021
|
1085
|
|
Gains par la croissance (tonnes)
|
60110
|
69251
|
9141
|
|
F global /an
|
0.156
|
0.130
|
0.026
|
Les résultats de l'étude du rendement et de la
biomasse par recrue, notamment les valeurs maximales de Y/R et B/R sont donc
sensibles aux variation de la mortalité naturelle.
On observe que les changements dans les valeurs de M, ont des
impacts très nets sur la biomasse (moyenne et équilibrée)
de cette espèce (Tableau 20).
Les conclusions que l'on peut tirer des différences
entre les deux courbes de rendements par recrue (M constante et variable)
sont :
1. si M est constante, FMSY est plus faible
(3.165/an), et MSY plus élevé (8.167 g), les poissons atteindront
rapidement l'âge auquel les pertes dues à la mortalité
naturelle excédent le gain de biomasse dû à la croissance.
En conséquence, il faut que F soit élevé pour que l'on
puisse capturer les poissons avant qu'ils ne meurent de causes
naturelles ; et
2. si M est variable, une valeur de FMSY
plus élevée (4.53/an) et une valeur de MSY plus faible (6.456 g).
qui est difficile à estimer par rapport à celle de M constante
qui présente un MSY nette. Le gain de biomasse dû à la
croissance excédera les pertes causées par la mortalité
naturelle pendant une grande partie de l'existence de la cohorte. Dans ce cas,
on a intérêt à laisser les poissons atteindre une grande
taille, ce qui signifié que l'exploitation soit optimale d'un point
de vue halieutique.
La longueur moyenne de capture, estimée à 16.52
cm pour un âge de 2.19 ans, soit M constante ou variable, demeure
largement supérieure à la taille de première
maturité sexuelle (L50) tous sexes confondus qui est de l'ordre de 13.9
cm.
Comme Bouaziz (2007), il ressort de cette analyse que les
jeunes individus sont épargnés d'une surexploitation par le
recrutement « recruitment overfishing ». De plus, les
individus matures ne présentent pas le risque d'une surpêche par
la croissance « growth overfishing » du fait qu'ils ont
déjà pondu au moins une fois dans leur vie, assurant ainsi la
pérennité du stock.
La biomasse par recrue (B/R) et la biomasse du stock
reproducteur par recrue (SSB/R) sont respectivement de 21.76 g et 18,09 g pour
M constante, et de 17.42 g et 11.65 g pour M variable (Tableau 18).
La biomasse du stock reproducteur, « SSB,
Spawning Stock
Biomass » estimée à 46408 tonnes en
moyenne, soit 83.17 % de la biomasse moyenne qui est de l'ordre de 55799 tonnes
pour M constante, et à 49711 tonnes, soit 81.26 % de la biomasse
moyenne qui est de l'ordre de 61179 tonnes pour M variable.
En conclusion et malgré ces différentes
incertitudes qui pèsent sur ce diagnostic il s'avère, au vu des
résultats obtenus par ces deux approches structurales, qu'il soit
possible d'établir un diagnostic relativement fiable de l'état du
stock de S. aurita exploitée dans la région centre de la
côte algérienne avec les données existantes. Ainsi il
ressort de ce travail que l'état du stock de la sardinelle est
satisfaisant et que celui-ci ne présenterait actuellement pas de risque
d'une surexploitation de la croissance, et ce, pour les deux hypothèses
de M.
CONCLUSION
Au terme, de cette étude, qui a comme objectif
principal d'étudier l'impact de la variation de la mortalité
naturelle (M) par âge sur l'estimation de la biomasse exploitable de la
sardinelle (Sardinella aurita, valenciennes 1847) de la région
centre de la côte algérienne, plusieurs remarques importants ont
été retenue.
Nous avons réalisé notre travail à l'a
ide du programme informatique FISAT II version 1.2.0 (Gayanilo et al.,
2005) sous Windows, qui permet la restructuration des fréquences de
tailles. Pour établir la clé âge-longeur, les
équations de croissance, et les mortalités (Z, M, F).
La clé âge - longueur trouvée est
caractérisée par 5 âges. Dans la région centre de
nos côtes, la sardinelle atteint un âge maximum de 5 ans, et ce,
pour la population à sexes confondus. La longueur asymptotique
(L8) de la sardinelle, tous sexes confondus, fournie par
l'équation de la croissance linéaire de von Bertalanffy, est de
29.85 cm. Le paramètre de courbure (K), qui détermine la
rapidité du poisson d'approcher la longueur asymptotique, est de 0.41
/an cette valeur élevée signifie que la sardinelle atteint
rapidement son L8.
Les coefficients de mortalité ont été
estimés en utilisant les paramètres de croissance que nous avons
calculé. La mortalité naturelle (M) a été obtenue
par âge par la méthode de Bouaziz et al. (2004) et pour
toute la population, avec la méthode de Pauly (1980, 1984a) qui nous
parait moins empirique par rapport aux autres méthode pour un poisson
pélagique comme la sardinelle.
Pour ce qui est de la mortalité totale (Z), la valeur
de 2.11 /an a été retenue. Le résultat est trouvé
par la méthode des courbes de capture. Le coefficient de
mortalité naturelle (M) a été estimé à 0.81
/an pour toute la population et à 1.022 ; 0.903 ; 0.879 ;
0.829 ; et 0.797 /an, respectivement pour les âges I ;
II ; III ; IV ; et V. La mortalité par pêche (F) a
été estimée à 1.3 /an pour toute la population.
Concernant l'étude de l'exploitation, les structures
démographiques n'étant pas disponibles année par
année sur une longue série temporelle, l'analyse des cohortes
à l'aide de programme informatique VIT (Lleonart et Salat, 2000),
à été effectuée sur les captures moyennes d'une
pseudo-cohorte, considérée comme reflétant
l'état d'une cohorte réelle, sous l'hypothèse que le
recrutement annuel dans la pêcherie est constant (c'est à dire il
exige uniquement la connaissance des captures sur un an au lieu d'une
série historique). Ce logiciel, vivement recommandé par la FAO
pour la pêcherie méditerranéenne, il a été
introduit pour évaluer la biomasse exploitable et le rendement par
recrue en fonction des valeurs de M obtenues (constante et variable), de S.
aurita de la région centre de la côte algérienne.
Les résultats de cette application
révèlent que la biomasse moyenne exploitable du stock de
Sardinella aurita, composé de 23 classes de tailles allant de
6.5 à 28.5 cm, est de 55799 tonnes environ dont 46408
tonnes (83.17 %) appartiennent au stock reproducteur "Spawning
Stock Biomass" pour M constante. Ce
mère stock a été évalué à 61179
tonnes environs dont 49711 tonnes (81.26 %) appartiennent au stock reproducteur
pour M variable.
La longueur moyenne de capture, estimée à 16.5
cm (pour un âge de 2.2 ans), soit M constante ou variable, demeure
largement supérieure à la taille de première
maturité sexuelle (L50) tous sexes confondus qui est de l'ordre de 13.9
cm.
Le rendement par recrue actuel (Y/R) qui est de l'ordre de
6.961 g pour M constante et de 5.083 g pour M variable, demeure
inférieur au seuil de la production maximale équilibrée
(MSY=8.16 g pour M constante et MSY = 6.456 g pour M variable). De ce
diagnostic, il ressort un état de sous-exploitation.
De ces résultats, nous concluons que la variation de M
influe d'une manière profonde sur l'estimation de la biomasse moyenne et
du rendement par recrue
La variation de M avec l'âge doit être
incorporée dans les évaluations des stocks de poissons
surtout les pélagiques. Pour le stock de la sardinelle de la
région centre de la côte algérienne, la valeur de M
doit être estimée pour chaque sous-population (groupe
d'âge), avant l'analyse de cohorte (VPA) et l'ajustement des
modèles structuraux d'évaluation, afin de se rapprocher le
mieux de la réalité.
En fin, nous soulignons la nécessité actuelle de
rendre compte, dans les études basées sur la modélisation
de l'exploitation des stocks halieutiques, du degré d'incertitude des
estimations, et de tenir compte du risque d'erreurs et d'utiliser le principe
de précaution pour les recommandations sur la gestion des
pêches.
BIBLIOGRAPHIE
Abella A., Caddy J-F., et Serena F., 1996.
Estimation of the parameters of the Caddy reciprocal M-at-age model for the
construction of natural mortality vectors. (POPDYN proceedings): p
191-200.
Ananiades C.I., 1952. Quelques
considérations biométriques sur l'allache (Sardinella
aurita C.V.). Prakt. Hell. Hydrobiol. Inst. 5 (1) : p 1-45.
Bebars M.I., 1981. Exploitation rationnelle
des pêcheries égyptiennes : Application aux pêcheries des
sardinelles (Sardinella aurita Valenciennes, 1847) de la baie de
Selloum, Egypte. Thèse Doctorale, Univ. Sci. Tech. Languedoc,
Montpellier : p 1-326.
Ben-Tuvia A., 1956. The biology of
Sardinella aurita with a systematic account of the family Clupeidae of
the Mediterranean coast of Israel. Fish. Bull., Haifa (7) : 20-24; (8) : p
14-25.
Bouaziz A., 2006. Estimation du point de
référence biologique, F0.1, de Sardinella aurita de la
région centre de la côte algérienne. Bull. Soc. Zool.
Fr., 131 (2) : p 97-106.
Bouaziz A., 2007. La sardinelle
(Sardinella aurita Valenciennes, 1847) des côtes
algériennes : distribution, biologie et estimation des biomasses.
Thèse Doctorat. USTHB :135p.
Bouaziz A., Bennoui A., Belaidi M., et Brahmi B.,
2004. Sur l'estimation de la mortalité naturelle M par
âge et par sexe chez deux espèces de la côte
algéroise : le merlu Merluccius merluccius (L. 1758) et la
sardinelle Sardinella aurita (V. 1847). Rapp. Con int. Mer
Médit., 37 : p 317.
Bouaziz A., Bennoui A., Brahmi B., et Semroud R.,
2001. Sur l'estimation de l'état d'exploitation de la
sardinelle (Sardinella aurita, Valenciennes, 1847) de la
région centre de la côte algérienne. Rapp. Comm. Int.
Mer Médit., (36) : p 244.
BOUAZIZ A, SEMROUD R, BRAHMI B, Chenitis S., 1998.
Estimation de la croissance de Sardinelle (Sardinella aurita,
Valenciennes, 1847) dans la région algéroise par analyse de
fréquences de taille. ISMAL, Alger : p 43-49.
Brêthes J-C., et O'Boyle R-N., 1993.
Méthodes d'évaluation des stocks halieutiques. (Volume I).
Centre international d'exploitation des océans (Canada) :
p 213-231.
Caddy J-F., 1996. Modelling Natural Mortality
with Age in short-lived invertebrate populations: definition of a strategy of
gnomonic time division. Aquat. Living Resour, 9:
p 197-207.
Cadima E-L., 2002. Manuel d'évaluation
des ressources halieutiques. FAO Document technique sur les pêches.
N° 393. Rome :160 p.
CGPM., 1988. Rapport du groupe de travail
adhoc sur l'aménagement des stocks dans la Méditerranée
occidentale. FAO. Fish. Rep : 386 p.
Chavance P., Chabane F., Hemida F., Korichi H-S.,
Sanchez M-P., Bouchereau G.L., Tomasini G-A., et Djabali F., 1985.
Evaluation du rendement par recrue relatif à partir
de fréquences de tailles : application à quelques stocks
d'anchois, de sardinelles et de chinchards de la
Méditerranée occidentale. FAO Rapp. Pêches. (347) : p
186-220.
Cury P., et Fontana A., 1988.
Compétition et stratégies démographiques
comparées de deux espèces de sardinelles (Sardinella
aurita et Sardinella maderensis) des côtes ouest
africaines. Aquat. Living Ressour., 1 : p 165 - 180.
Daget J., 1976. Dynamique des populations de
poissons. Rev. Tvav. Inst. Pèches, marit, 40 (3 et 4) : p
425-437.
Eli A., 2006. FishBase. En ligne : http//www.
FishBase.net.
Fischer W., Bauchot M-L., et Schneider M.,
1987. Fiches FAO d'identification des espèces pour les besoins
de la pêche. (Révision 1). Méditerranée et mer
Noire. Zone de pêche 37. Volume II. Vertébrés. Publication
préparée par la FAO, résultat d'un accord entre la FAO et
la Commission des Communautés Européennes (Projet
GCP/INT/422/EEC) financée conjointement par ces deux organisations.
Rome, FAO, Vo1.2: P 1061.
Fonteneau A., 1989. Modélisation de
pêcheries thonières. Doc. Scient. ICCAT : p
91-100.
Fritsch M., 2005. Traits
biologiques et exploitation du bar commun dicentrachus labrax (l.)
dans les pêcheries françaises de la manche et du golfe de
Gascogne. Thèse de doctorat, option océanologie
biologique : p 216-220.
Gaamour A., Ben Abdallah L., Khemiri S., et Mili S.,
2004. Etudes de la biologie et de l'exploitation des petits
pélagiques en Tunisie. MedSudMed Technical Documents No.5 : 64
p.
Gaamour A., Missaoui H., Ben-Abdallah L., et El Ahmed
A., 2001. Paramètres biologiques de la sardinelle ronde
(Sardinella aurita Valenciennes, 1847) dans la région du Cap
Bon (canal siculo-tunisien). GFCM : p 26-30.
Gayanilo F-C., Sparre P., et Pauly D., 2005.
FAO-ICLARM Outils d'évaluation des stocks II (FiSAT
II). Version révisée. Guide
d'utilisation. FAO Série informatique. Pêche.
No. 8, Version révisée. Rome, FAO : 190
p.
Hemida F., 1987. Contribution à
l'étude de l'anchois Engraulis encrasicolus (L. 1758) dans la
région d'Alger : Biologie et Exploitation. Thèse de
Magister, USTHB (Alger) : 208p.
Hemida F., 2005. Les Sélaciens de la
côte algérienne, Biosystématique des Requins et des
Raies : Ecologie, Reproduction et Exploitation de quelques population
capturées. Thèse Doctorat .USTHB : 106 p.
Jones R., 1983. The use of length composition
data in fish stock assessments (with notes on VPA and cohort analysis). FAO
Fish. Circ., 734: 60 p.
Jones R., 1984. Assessing the effects of changes
in exploitation pattern using length composition data (with notes on VPA
and cohort analysis). FAO Fish. Tech. Pap., 256: 118 p.
Korichi H-S., 1988. Contribution a
l'étude biologique de deux espèces de saurels Trachurus
trachurus (Linne, 1758) et Trachurus mediterraneus (Stindachner,
1868) et la dynamique de Trachurus trachurus (Linné, 1758) en
baie de Bou Ismail (Alger). Thèse de Magister, ISMAL, Alger: 260
p.
Laurec A., et Le Guen J-C., 1981. Dynamique
des populations marines exploitées. Tome I. Concepts et modèles.
Rapp. Scient. et tech., Éditions CNEXO, n° 45 : 118
p.
Lleonart J., et Salat J., 2000. VIT (version 1. 1).
Software for fishery analysis. User's manual. En ligne :
http//www.faocopemed.org/es/activ/infodif/vit.htm [cité en 2000].
Moreau J., Bayle C., et Brière C.,
1984. Emploi du modèle de Beverton et Holt : cas d'une
mortalité naturelle variable et d'une croissance décrite par une
équation de Gomperts. Laboratoire de Biologie Quantitative et
Laboratoire d'lchfyologie Appliquée, (ENSA), Toulouse, France :
p 163-170.
Mouhoub R., 1986. Contribution à
l'étude de la biologie et de la dynamique de la population
exploitée de la sardine Sardina pilchardus (WALBAUM, 1792) des
côtes algéroises. Thèse de Magister. USTHB :
163p.
Navarro F-P., 1932. Nuevos estudios sobre la
alacha (Sardinella aurita C.V.) de Baleares y de Canarias. Notas
Inst. Esp. Oceanogr., 58 : p 1-35.
Paully D., 1985. Quelques méthodes
simples pour l'estimation des stocks de poissons tropicaux. FAO, Doc. Tec
pêches (234) : 65 p.
Pauly D., et Moreau J., 1997. Méthodes
pour l'évaluation des ressources halieutiques. Collection POLYTECH
de l'I.N.P. de Toulouse, Cépaduès-Editions, France : 288
p.
Postel E., 1960. Rapport sur la sardinelle
Sardinella aurita (Valenciennes, 1847) (Atlantique africain). FAO
Fisheries Biology Synopsis No. 6 (Distribution restricted). FB/ 60CS6
SAST-Sardine: p 59-95.
Sidibé A., 2003. Les ressources
halieutiques démersales côtières de la guinée :
exploitation, biologie et dynamique des principales espèces de la
communauté à Sciaenidés. Thèse Doctorat
(ENSAR), France : 320 p.
Sennai Cheniti S., 2003. Les petits
pélagiques de l'extrême ouest algérien. Centre National
d'Etudes et de Documentation pour la Pêche et l'Aquaculture, mise en
place d'un réseau d'échantillonnage : p 9-15.
Sparre P., et Venema S.C., 1996. Introduction
à l'évaluation des stocks des poissons tropicaux. Première
partie : Manuel. FAO Doc. Tech. sur les Pêches, 306 (1), Rome :
401 p.
Tsikliras A-C., Koutrakis E-T., et Stergiou K-I.,
2005. Age and growth of round sardinelle (Sardinelle aurita)
in the northeastern Mediterranean. SCI. MAR, 69(2) : p
231-240.
Zeghdoudi E., 2006. Modélisation
bioéconomique des pêcheries méditerranéennes -
application aux petits pélagiques de la baie de Bou-Ismail -
(Algérie). Diplôme de master (master of science en
economía y gestión de la actividad pesquera) : p
3-26.
ANNEXES
| 
