PARTIE BIBLIOGRAPHIQUE
Page | 4
CHAPITRE I GENERALITES
I.1 Introduction
Le raffinage du cuivre implique une génération
d'importantes quantités des boues anodiques. L'intérêt
économique que présentent ces boues réside en leur
richesse en métaux valorisables. Ces métaux (Cu, Ag, Au...) sont
plus concentrés dans ces résidus que dans le minerai
d'origine.
Afin de mieux connaître l'origine, la composition, la
production, etc, des boues anodiques, il est nécessaire de suivre le
cheminement de leurs constituants depuis le minerai de départ jusqu'au
produit fini. Les méthodes métallurgiques sont différentes
selon le type de minerai de cuivre (oxydé, sulfuré, ou mixte), et
selon la teneur en cuivre dans le minerai. Les minerais sulfurés sont
ainsi traités par voie pyrométallurgique, les minerais
oxydés ou pauvres en cuivre sont, par contre, traités par voie
hydrométallurgique. (K. Elamari, 1993)
I.2 Minerais de cuivre
La minéralogie des espèces cuprifères est
très variable et dépend de leur genèse et des associations
minérales. Les minerais peuvent toutefois être classés en
deux groupes : les minerais sulfurés et les minerais oxydés et
mixtes. (K. Elamari, 1993)
I.1.1 Les minerais sulfurés
Les minerais sulfurés constituent la principale source
économique de cuivre. Les minéraux les plus importants sont : la
chalcopyrite (CuFeS2), la bornite
(Cu5FeS4), la chalcosine (Cu2S), la covelline
(CuS). Il existe également des minéraux complexes de
cuivre et de fer associés à l'arsenic et l'antimoine, tels que la
tétraédrite (3Cu2S. Sb2S3) et l'énargite
(Cu3AsS4). Dans certains minerais on peut constater la présence
de molybdène, d'or, d'argent et de platinoïdes.
I.1.2 Les minerais oxydés et mixtes
Les minerais oxydés et mixtes se forment dans les zones
superficielles des gîtes par altération des minerais
sulfurés. Les principaux minéraux de ce groupe sont : la
malachite (CuCO3. Cu(OH)2), l'azurite
(2CuCO3. Cu(OH)2), la cuprite
(Cu2O), la ténorite (CuO), la chrysocolle
(CuO. SiO2. 2H2O).
Page | 5
I.3 Métallurgie du cuivre
Ce paragraphe concerne uniquement le traitement des
concentrés de cuivre et ne traite pas des techniques
minéralurgiques utilisées pour les obtenir.
L'obtention du cuivre relativement pur à partir des
concentrés peut être réalisée par deux voies
classiques : la pyrométallurgie et l'hydrométallurgie.
I.3.1 Pyrométallurgie du cuivre
La voie thermique classique a pour but d'extraire le cuivre
contenu dans les concentrés issus des opérations
minéralurgiques. Elle comprend plusieurs étapes qui conduisent
à l'obtention d'un cuivre non raffiné. (P. Blazy et El., 2001)
La première étape consiste à
opérer par grillage une désulfuration, partielle ou totale, ou
une production de sulfate de cuivre ou encore une élimination des
éléments indésirables.
La deuxième étape consiste à fondre dans
un four tous les composants de la charge à une température
suffisante pour atteindre l'état liquide. Il se dégage suivant le
procédé mis en oeuvre des gaz de combustion et des gaz de
réaction qui doivent être traités. Le type de fusion
opéré avec les minerais de cuivre est une fusion pour matte,
mélange de sulfures fondus, qui a pour but de rassembler le cuivre et
tous les éléments chalcophiles (Ni, Co, Pb, Zn, métaux
précieux, As, Sb, Se, Bi, Te...), en rejetant le fer et les
éléments de gangue sous forme d'une scorie et en abaissant la
teneur en soufre initiale par oxydation partielle en SO2.
La troisième étape consiste à convertir
la matte en cuivre métal, ou blister, par oxydation du soufre restant
par de l'air atmosphérique ou enrichi à l'oxygène. Le
soufre est oxydé en SO2, qui est
entraîné hors du convertisseur, et les métaux plus
oxydables que le cuivre passent dans la scorie. Le blister ainsi obtenu titre
98 à 99,5 % de cuivre, et contient un peu d'oxygène et les
éléments chalcophiles signalés précédemment.
Il est coulé dans un four à anodes sous forme de plaques d'anodes
ou de lingots devant être ensuite raffinés.
I.1.3.1 Grillage oxydant
Le grillage oxydant s'effectue à une température
de 500-550°C, afin d'éviter la formation de ferrites de cuivre dont
le point de fusion est très élevé. Il permet d'ajuster la
teneur en
Page | 6
cuivre du concentré, en oxydant partiellement le soufre
et le fer, et en éliminant certaines impuretés volatiles
notamment le dioxyde de soufre. Les principales réactions mises en jeu
lors du grillage oxydant, décrivant l'oxydation du cuivre et des
sulfures de fer en sulfates et oxydes, sont (Biswas et al. 1976) :
CuFeS2 + 4O2(9) = CuSO4 +
FeSO4 (1)
2CuFeS2 + 132 O2(9) = 2CuO
+ Fe2O3 + 4 SO2(9) (2)
|
2CuS + 7
2
|
O2(9) = CuO. CuSO4 + SO2(9) (3)
|
I.1.3.2 Fusion pour matte
La fusion pour matte s'effectue sur le produit grillé,
au-delà de 1100-1200°C. Elle permet de séparer deux phases
:
- une scorie constituée d'éléments de la
gangue ainsi que des oxydes. Elle se compose de 30-40% FeO +
Fe3O4, 35-40% SiO2, 10%
Al2O3, 10% CaO (Biswas et al. 1976),
- une matte contenant le cuivre combiné au soufre
résiduel sous forme de Cu2S, les sulfures de nickel, de cobalt,
de plomb et de zinc, les métaux précieux (or, argent,
platinoïdes), et enfin des impuretés telles que l'arsenic, le
bismuth, le sélénium, le tellure et l'antimoine.
Le premier objectif de la fusion pour matte est d'augmenter le
degré de sulfuration de tout le cuivre présent dans la charge qui
passe ensuite dans la matte et d'éliminer partiellement le fer. Ceci est
accéléré par la présence de FeS dans la
matte et qui tend à sulfurer tout le cuivre qui ne se trouve pas sous
forme de sulfure, suivant la réaction 4 (Biswas et al. 1976)
FeS(I) + Cu2O(I+scorie) = FeO(I+scorie)
+ Cu2S(I) (4)
Malheureusement, la fusion pour matte donne des gaz trop
dilués en SO2 (2%) pour permettre une production aisée
d'acide sulfurique. C'est la raison pour laquelle le procédé
Noranda opère une fusion pour matte avec injection d'air. Il permet
ainsi d'obtenir des gaz à 5% en volume de SO2.
Page | 7
I.1.3.3 Conversion
La conversion ou convertissage de la matte qui consiste en une
oxydation par insufflation d'air à 1150-1250°C, permet
d'éliminer le soufre et le fer restants, et d'assurer l'obtention du
cuivre métal non raffiné (cuivre blister, 99,8% Cu)
réactions 5, 6 et 7 (Blazy, 1979).
3FeS + 502 = Fe304 +
3S02 (5)
Cu2S + 2 02 = Cu20
+ S02 (6)
Cu20 + Cu2S = 6Cu + S02
(7)
Le fer est traditionnellement complexé par ajout de
Si02 lors de l'étape d'oxydation. La quantité de
Fei04 est soigneusement controlée pour éviter
d'avoir des scories trop visqueuses. Cette étape est le point sensible
du convertissage, ce qui explique que l'oxyde de cuivre n'est souvent pas
réduit.
Remarque : La métallurgie classique ayant
été la cible des lois antipollution, il existe des
procédés de fusion éclair (procédé
Outokumpu) combinant le grillage, la fusion pour matte et en partie le
convertissage en une seule opération. L'air peut être enrichi
à l'oxygène. Les gaz obtenus sont riches en
S02 (5-10% en volume).
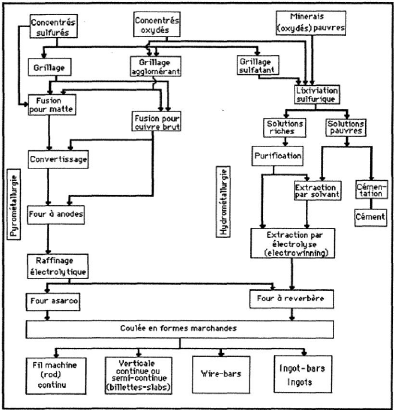
Page | 8
Figure 1 Les grandes voies de la métallurgie du cuivre
(Thiriart et al., 1988) I.3.2 Hydrométallurgie du cuivre
L'hydrométallurgie du cuivre consiste en une succession
d'opérations chimiques caractérisées par la mise en
solution du cuivre et son élaboration à partir de cette
solution.
Le procédé LIX/SX/EW est le plus utilisé et
les étapes essentielles de ce procédé sont
séparées par des opérations de séparation
solide/liquide
I.3.2.1 Lixiviation
La lixiviation est une opération qui consiste en une
mise solution sélective des minéraux valorisables contenus dans
un minerai à l'aide solvant approprié, notamment les
minéraux de cuivre mis en solution par l'acide sulfurique pour le cas
ci-présent.
Page | 9
Elle est l'opération la plus importante de
l'hydrométallurgie du cuivre. (N. Mukota, 2019)
Il existe plusieurs techniques de lixiviation dont celle qui
nous intéresse est la lixiviation en réacteur agité. Le
solide sous forme pulvérulente est mis en suspension dans la solution de
lixiviation.
Pour obtenir une liqueur claire après lixiviation, une
séparation solide/liquide est appliquée et c'est cette liqueur
qui sera soumise à l'extraction par solvant. (N. Mukota, 2019)
I.3.2.2 Extraction par solvant
Le terme « extraction par solvant » se rapporte
à la distribution d'un corps dissous entre deux phases liquides
non-miscibles en contact mutuel, c'est- à- dire une distribution
biphasée d'un corps dissous. L'extraction par solvant permet donc de
réaliser le transfert d'un soluté initialement contenu dans une
phase liquide, vers une autre phase non-miscible avec la première. Le
principe est fondé sur la distribution du soluté entre les deux
phases en fonction de son affinité pour chacune d'elles. (Rydberg,
2004)
La méthode est basée sur l'utilisation d'un
extractant dilué dans un solvant organique mis en solution avec la phase
aqueuse qui contient le métal à extraire, qui est le cuivre.
Lors de la lixiviation d'un minerai de cuivre par l'acide
sulfurique, le cuivre est mis en solution. La solution contient entre autres
les ions Cu2+ et
S042- : c'est la phase aqueuse. Elle sera
mise en contact avec une phase organique du type RH
et le cuivre va se complexer avec le radical R
selon l'équation ci-après :
Cu2+ +
S042- + RH
= R2Cu +
2H+ +
S042- (8)
Où RH est la molécule de
l'extractant dissoute dans la phase organique ; R2Cu
est le complexe métal/extractant dissout dans la phase
organique. Les deux phases sont ensuite séparées par
décantation.
Le métal est ensuite réextrait dans une nouvelle
phase aqueuse sous une forme raffinée et concentrée. Cette
deuxième opération est nommée stripage. L'extraction et le
stripage utilisent la même réaction chimique dont
l'équilibre est contrôlé principalement par le pH du
milieu. L'extraction est réalisée à pH un plus
élevé qu'au stripage. (M. Koji, 2010)
Les extractants les plus utilisés pour l'extraction du
cuivre sont pour la plupart des agents chélatants, notamment les oximes
dont les aldoximes et les cetoximes. (Cognis, 2009)
Page | 10
Les solvants les plus couramment employés sont
généralement les hydrocarbures aliphatiques aromatiques et les
solvants chlorés. (Ghebgoub, 2012)
L'extraction par solvant est utilisée en
hydrométallurgie pour la purification et/ou la concentration des
solutions. Combinée à l'électrolyse d'extraction, elle est
largement utilisée pour la production du cuivre cathodique de haute
pureté.
I.3.2.3 Electroextraction
L'électroextraction ou l'électrolyse
d'extraction du cuivre permet d'élaborer le cuivre de haute
pureté par décomposition de CuSO4 par passage du courant
continu dans le bain de telle sorte les anions SO42- se
dirigent vers l'électrode positive appelée anode tandis que les
cations Cu2+ vont vers l'électrode négative
appelée cathode.
A Shituru, les anodes sont constituées de plaques en
plomb antimonieux : elles sont donc insolubles. De sorte que dans ce cas, le
cuivre déposé provient de la solution de sulfate de cuivre
alimentée, et non d'une anode de cuivre brut, comme c'est le cas dans
l'opération du raffinage électrolytique. (E. Roger, 1946)
Les plaques de cathodes sur lesquelles se fait le
dépôt de cuivre sont de minces feuilles appelées feuilles
de départ ou feuilles mères.
Des bonnes feuilles mères ont été
couramment obtenues en employant, au lieu d'anodes coulées, les grosses
cathodes retirées des cuves de production commerciale. (E. Roger,
1946)
Aujourd'hui encore les feuilles mères sont produites de
cette même façon aux US.
L'avantage majeur de l'électroextraction est que le
cuivre est libéré sous forme métallique à la
cathode, tandis que les ions SO42- provenant de la
dissociation du sulfate de cuivre régénèrent à
l'anode une quantité d'acide équivalente.
I.4 Electroaffinage du cuivre
C'est le procédé de base de production du cuivre
raffiné. Il consiste à dissoudre électrochimiquement le
« blister » coulé sous forme d'anodes, par le
procédé d'anode soluble. Le cuivre se dépose sur les
cathodes alors que la plupart des impuretés Zn, Fe, Ni, Co, Sn, Pb
restent dans le bain sans se déposer. Au, Ag et Pt, insolubles dans
l'électrolyte CuSO4, s'accumulent dans les boues
appelées boues anodiques.
Page | 11
Kitamura et al., (1976), Palacios et al. (1976), Blazy (1979);
Fouletier (1980) et Chen et Dutrizac (1987) donnent des valeurs,
légèrement différentes les unes des autres, concernant les
caractéristiques de chaque paramètre agissant sur
l'électroaffinage du cuivre, (composition de l'électrolyte,
conditions opératoires, densité de courant, etc.). Ces variations
s'expliquent par les différences entre les raffineries
considérées. Toutefois, d'une manière
générale, le cuivre blister est fondu puis coulé dans des
moules pour former des anodes solubles, sous forme de plaques d'environ 13
à 50 mm d'épaisseur, 1m2 de surface et pesant 300 à 350
kg. (K. Elamari, 1993)
Les cathodes utilisées pour le dépôt du
cuivre, appelées feuilles de départ, sont préparées
dans un circuit annexe. Ce sont des feuilles de titane ou de cuivre, d'environ
1 m2 de surface et 0,6 mm d'épaisseur. (K. Elamari, 1993)
L'électrolyte CuSO4 maintenu
à une température de 50 à 60°C contient environ 40
g/1 de cuivre et 100 à 200 g/1 d'acide sulfurique. L'ajout de certains
additifs dans l'électrolyte est nécessaire pour produire un
dépôt à la cathode relativement lisse et
régulièrement épais. Parmi ces additifs, certaines
raffineries ajoutent HCI ou NaCI pour maintenir la
concentration d'ions chlorure, entre 0,02 et 0,035 g/1. Le rôle des ions
chlorures dans l'électrolyte permettent la précipitation de
l'argent en solution. D'autres additifs tels que la colle animale (animal
glue), qui est une protéine complexe, permet d'inhiber le
dépôt nodulaire et dendritique du cuivre. Chaque raffinerie
détermine par l'expérience la quantité optimale de glue.
Habituellement, on utilise 45 g de glue par tonne de cuivre
déposé, (Bertocci et Turner, 1974).
La consommation des anodes dure 21 à 28 jours, alors
que les cathodes atteignent leur masse normale deux fois durant cette
période. La dissolution des anodes est interrompue avant que celles-ci
ne soient complètement consommées pour ne pas affecter la
qualité de la cathode. A Inco's Copper Cliff Copper Refinery par
exemple, (Chen et Dutrizac 1987), l'électrolyse est stoppée quand
le taux de dissolution des anodes atteint 80%. En effet, si l'on poursuivait
l'électrolyse au-delà, Sb, Bi, etc ... viendraient polluer les
cathodes. (K. Elamari, 1993)
L'électroaffinage aboutit alors à des cathodes
de cuivre très pures (99,99% Cu) ; à un électrolyte
contenant certains éléments en solution tels que Ni, Sb, As, et
à des boues anodiques de cuivre composées
d'éléments aux potentiels normaux supérieurs à
celui du cuivre, donc théoriquement non réduits au niveau de la
cathode.
Aux US, ce sont les cathodes commerciales qui sont
utilisées comme anodes solubles. La solubilisation des anodes dure 40
jours avec un taux de dissolution de 80%.
L'électroraffinage a pour rôle la fabrication des
feuilles de départ.
D'après un rapport de la Gécamines intitulé
« Qualité cathodes commerciales mois de Janvier-Février-Mars
2021 », les analyses effectuées sur 82 cathodes ont donné
les teneurs moyennes des éléments ci-après.
Tableau 1 Teneurs moyennes des éléments dans
les cathodes commerciales des US
|
|
Co
|
Fe
|
Ni
|
Zn
|
Se
|
S
|
Mn
|
Ag
|
As
|
Sn
|
Sb
|
Pb
|
|
ELEMENTS
|
Cu %
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
ppm
|
|
TENEURS
|
99.98
|
|
|
0.25
|
<0.3
|
<0.40
|
21.1
|
<0.10
|
0.90
|
<0.3
|
<0.60
|
|
97.9
|
|
|
2.21
|
7.81
|
|
|
|
|
|
|
|
|
7.88
|
|
|
MOYENNES
|
4
|
|
|
1
|
00
|
0
|
9
|
00
|
8
|
00
|
0
|
|
9
|
Page | 12
Page | 13
| 


