|

CARACTÉRISATION DES
COMMUNAUTÉS
VÉGÉTALES D'UNE RÉSERVE DE MIOMBO
EN
RELATION AVEC LA FAUNE (LUBUMBASHI,
RDC)
MARGAUX MUYLE
TRAVAIL DE FIN D'ÉTUDES PRÉSENTÉ
EN VUE DE L'OBTENTION DU DIPLÔME DE
MASTER BIOINGÉNIEUR EN
GESTION DES FORÊTS ET DES ESPACES NATURELS
ANNÉE ACADÉMIQUE 2011-2012
PROMOTEUR: MAHY G.
Le présent document n'engage que son auteur.
(c) Toute reproduction du présent document, par
quelque procédé que ce soit, ne peut être
réalisée qu'avec l'autorisation de l'auteur et de
l'autorité académique de Gembloux
Agro-Bio Tech.

CARACTÉRISATION DES
COMMUNAUTÉS
VÉGÉTALES D'UNE RÉSERVE DE MIOMBO
EN
RELATION AVEC LA FAUNE (LUBUMBASHI,
RDC)
MARGAUX MUYLE
TRAVAIL DE FIN D'ÉTUDES PRÉSENTÉ
EN VUE DE L'OBTENTION DU DIPLÔME DE
MASTER BIOINGÉNIEUR EN
GESTION DES FORÊTS ET DES ESPACES NATURELS
ANNÉE ACADÉMIQUE 2011-2012
PROMOTEUR: MAHY G.
Remerciements
J'aimerais remercier ici toutes les personnes qui, de
près ou de loin, ont participé à la réalisation de
ce travail :
· Le Professeur Grégory Mahy, promoteur de ce
travail, pour sa disponibilité, son aide, ses conseils et ses multiples
relectures ;
· Pacifique Kizila, de l'Université de Lubumbashi,
sans qui ce travail n'aurait probablement jamais vu le jour (Mungu wa ba
kambo haku kumbuke) ;
· Aurélie Hick, doctorante, pour sa
disponibilité, ses conseils, son soutien et son amitié ;
· Julie Linchant et Denis Maekelbergh, pour le partage
réciproque de données ;
· Michel Anastassiou, propriétaire de Mikembo, et
Michel Hasson, administrateur de BAK, pour leur accueil au sein de ce
magnifique sanctuaire ;
· Vanessa Anastassiou, gestionnaire des asbl Mikembo et BAK
pour sa disponibilité et sa gentillesse aux cours des trois mois
passés à Lubumbashi ;
· François Kyakaba, gestionnaire de la
réserve, pour sa gentillesse et son aimable contribution à ce
travail ;
· Maxime Seleck, pour son cours sur la complexité
des analyses multivariées ;
· Cynthia Thomas, pour sa gentillesse et son aide lors du
broyage de la biomasse ;
· Marianne Flahaux et Anne Mouteau, du CRAW, pour la
réalisation des analyses SPIR ;
· Yves Brostaux, pour ses conseils statistiques
avisés ;
· François Lehaire, pour le partage de son
expérience des relations faune-flore ;
· Et pour finir, toutes les personnes qui ont
accepté de relire ce travail : mes parents, Romain et Valérie.
J'aimerais également remercier toutes les personnes qui
ont rendu la vie à Lubumbashi extrêmement agréable : les
papas de Mikembo, Augustin et Joseph, ainsi que Maman Claude. Merci
également à tous les étudiants, doctorants et autres qui
sont passés par cette maison à côté de Manoah et
à tous les expat' qui nous ont fait découvrir la vie lushoise.
Dans ce travail, marquant la fin de cinq ans d'étude,
simplement merci à nos professeurs, qui tout au long de ces
années, nous ont supporté et finalement, nous ont faits devenir
ingénieur.
Plus personnellement, j'aimerais remercier tous ceux qui ont
fait que ces cinq merveilleuses années au sein de la faculté de
Gembloux furent ce qu'elles fussent. Merci à cette fabuleuse famille
gembloutoise, nous ne nous oublierons pas. Plus particulièrement, merci
à Marie, Nicolas, Romain, Hélène, Hada, et tant d'autres,
vous vous reconnaitrez, j'en suis sûre.
Le dernier mais non le moindre, un grand merci à mes
parents, ma soeur et mes grands-parents qui m'ont soutenu durant ces
études, m'ont encouragé et ont supporté mes
jérémiades.
Sachez que tous, chacun à votre échelle, avez rendu
ce travail possible. Merci.
Résumé
La présente étude se déroule dans une
réserve de miombo, créée en 2006 en
périphérie de Lubumbashi, avec présence de grands
herbivores. Le miombo est un type de forêt claire
caractérisée par les genres Brachystegia et
Julbernardia. Actuellement, cet écosystème subit
d'énormes pressions anthropiques. L'abattage de ses arbres, en vue de la
production de makala ou pour la conversion des terres pour l'agriculture, a
été accéléré ces dernières
années, principalement à cause de l'ouverture des routes et de la
croissance démographique. Cette dégradation impacte non seulement
la faune et la flore de cet écosystème mais également les
populations locales dépendant de cet écosystème.
L'écologie des communautés du miombo katangais n'avait plus
été étudiée depuis longtemps : son étude a
repris depuis une dizaine d'années. L'objectif de ce travail est de
déterminer les dynamiques des communautés végétales
d'une réserve de miombo en régénération en
présence de la grande faune. Cette étude a identifié une
communauté de forêt ancienne, trois communautés de
forêts hétérogènes de type
Brachystegia-Julbernardia (avec zones anciennes mais
également zones de régénération), un fourré
à Uapaca spp., une communauté de savanes boisées
et des savanes arborées, principalement en zone humide.
Déterminer la dynamique entre ces différentes communautés
s'avère difficile au vu de la zone d'étude. Néanmoins, il
a été possible de constater que les espèces en
régénération correspondaient généralement
aux espèces en place dans le peuplement. Les sols gris contiennent
principalement les savanes arborées. Les sols de faible profondeur ont
comme espèce caractéristique Marquesia macroura, alors
que les sols les plus profonds sont caractérisés par les
Uapaca spp. Les ongulés marquent une préférence
pour les zones de savanes boisées et les principaux impacts de cette
faune sont une diminution de la richesse spécifique, de l'importance de
la régénération et du poids en matière sèche
de la strate herbacée.
Mots-clés : miombo, relations flore-herbivore,
communauté végétale, régénération,
Katanga
Abstract
This study takes place in a miombo reserve, founded in 2006 in
the vicinity of Lubumbashi, with presence of large herbivores. This ecosystem
is a type of woodland characterized by species of the genus Brachystegia and
Julbernardia. Currently, the miombo is under anthropogenic pressure.
Land-felling, for the production of makala or for a land conversion for
agriculture, has been accelerated those past years, mainly due to the opening
of roads and population growth. This degradation impacts on the flora and fauna
of this ecosystem but also on local people who depends on this ecosystem. The
communities' ecology of miombo Katanga had not been studied since the
seventies. The subject regained interest those past ten years. The objective of
this study is to determine the dynamics of plant communities in a young reserve
in presence of large animals. This study identified a community of old growth
forest, three communities of heterogeneous forests such as
Brachystegia-Julbernardia woodland (with of old spots but also
regeneration areas), a thicket of Uapaca spp., wooded savannah and open wooded
grassland mainly in wetlands. Given the size of our studied area, determining
the dynamics between these communities was difficult. Nevertheless, it was
possible to notice that the regeneration species corresponded principally with
species in the forest stand. The gray soils contain mainly savannahs. Shallow
soils have as characteristic species Marquesia macroura, while the deeper soils
are characterized by Uapaca spp. Ungulates express a preference for wooded
savannah areas and the main impacts of this fauna are a decrease in species
richness, the importance of regeneration and dry matter weight of the
herbaceous layer.
Keywords: miombo, flora-herbivore interactions, plant
communities, regeneration, Katanga
Table des matières
1. Introduction 1
2. Contexte de l'étude 2
2.1. La forêt claire et le miombo dans la région
zambézienne 2
2.1.1. Définitions et répartition
géographique 2
2.1.2. La végétation et les formations
végétales du miombo 4
2.1.3. Le gibier, le bétail et leurs relations avec la
flore 4
2.1.4. Les conditions édaphiques 7
2.1.5. L'importance du feu 7
2.1.6. L'importance socio-économique du miombo 9
2.2. Le Katanga, province de la RDC 10
2.2.1. Géographie et climat 10
2.2.2. Contexte socio-économique 11
2.2.3. Le miombo au Katanga et aux alentours de Lubumbashi 12
2.2.4. Le contexte actuel du miombo en RDC et à
Lubumbashi 13
2.2.5. Le potentiel de régénération du
miombo 15
2.3. Le sanctuaire de Mikembo 16
2.3.1. Le projet 16
2.3.2. Les espèces végétales et animales
16
3. Objectifs 19
4. Matériel et Méthodes 20
4.1. Site d'étude 20
4.1.1. Description générale 20
4.1.2. Historique d'utilisation des terres 20
4.1.3. Gestion actuelle 20
4.2. Inventaire 22
4.2.1. Carte de végétation 22
4.2.2. Sélection des placettes d'inventaire 22
4.2.3. Le prélèvement de la biomasse 24
4.2.4. Les données environnementales 25
4.2.5. Les circuits d'observation de la grande faune 25
4.3. Analyse des données 26
4.3.1. Caractérisation des communautés
floristiques 26
4.3.2. Structure des communautés 29
4.3.3. Influence des paramètres édaphiques 30
4.3.4. Caractérisation des dégâts
effectués par la grande faune 30
5. Résultats 32
5.1. Résultat de l'inventaire 32
5.2. Caractérisation des communautés 34
5.2.1. Caractérisation floristique 34
5.2.2. Structure des communautés 42
5.2.3. Facteurs édaphiques 53
5.3. Caractérisation des dégâts
effectués par la grande faune 59
5.3.1. Placettes et espèces impactées 59
|
5.3.2. Lien entre le niveau de dégâts et la
structure et composition des placettes
60
5.3.3. Lien avec un inventaire de faune effectué à
la même période 64
|
|
6.
|
|
Discussion
|
65
|
|
6.1.
|
La stratégie d'inventaire
|
65
|
|
6.2.
|
La dynamique des différentes communautés
végétales
|
65
|
|
6.3.
|
L'influence du sol et du feu
|
67
|
|
6.4.
|
L'impact de la faune sur la flore arborescente
|
68
|
|
7.
|
|
Conclusion et perspectives
|
69
|
|
8.
|
|
Références bibliographiques
|
|
|
9.
|
|
Annexes
|
|
Table des figures
Figure 1 : Les territoires phytogéographiques d'Afrique
- le centre d'endémisme zambézien
est en vert (II) (Malaisse 1997) 2
Figure 2: Répartition géographique du miombo en
Afrique (Smith and Allen 2004) 3
Figure 3: Séparation des espèces d'herbivores de
la forêt claire de par leur régime alimentaire
(Gambiza, Chidumayo et al. 2010) 5
Figure 4: Niches écologiques d'herbivores sauvages et
domestiques en Afrique (Fritz 2005) 6
Figure 5: Diagramme simplifié des relations
sol-végétation (Bell 1984) 7
Figure 6: Consommation des différents types de bois de
feu et de chauffe par pays en Afrique
sub-saharienne (Malimbwi, Chidumayo et al. 2010) 9
Figure 7 : Carte politique de la République
démocratique du Congo (Maurel 2006) 10
Figure 8 : Carte de période des feux dans la
réserve de Mikembo 21
Figure 9 : Carte des formations végétales dans
la réserve de Mikembo et localisation des
placettes d'échantillonnage pour la
caractérisation des peuplements. 33
Figure 10: résultat de
l'analyse multivariée de type NMDS dans R sur les 69 placettes de
l'étude 34
Figure 11 : Résultat de l'analyse
multivariée de type NMDS dans R sur les 44 placettes de
forêts 35
Figure 12 : Distribution des pieds par
classe de grosseur de la communauté "forêt
hétérogène
à Brachystegia boehmii" 46
Figure 13 : Distribution
des pieds de Brachystegia boehmii dans les communautés de la zone
d'étude 46
Figure 14 : Distribution des pieds par
classe de grosseur de la communauté "forêt
hétérogène
à Julbernardia globiflora" 47
Figure 15 :
Distribution des pieds de Julbernardia globiflora dans les communautés
de la zone
d'étude 47
Figure 16 : Distribution des pieds par
classe de grosseur de la communauté "forêt
hétérogène
à Julbernardia paniculata" 48
Figure 17 :
Distribution des pieds de Julbernardia paniculata dans les communautés
de la zone
d'étude 48
Figure 18 : Distribution des pieds par
classe de grosseur de la communauté "fourré à Uapaca
spp." 49
Figure 19 : Distribution des pieds de Uapaca spp.
dans les communautés de la zone d'étude 49 Figure 20 :
Distribution des pieds par classe de grosseur de la communauté
"forêt ancienne à
Pterocarpus tinctorius" 50
Figure 21 : Distribution des pieds de Marquesia macroura dans
les communautés de la zone
d'étude 50
Figure 22 : Distribution des pieds par
classe de grosseur de la communauté « savanes boisées
à Combretum acutifoliosum et Terminalia sp. »
51
Figure 23 : Distribution des pieds par classe de grosseur de la
communauté "savanes arborée à
Acacia spp." 51
Figure 24 : Distribution des pieds par
classe de grosseur de la communauté "savanes boisées à
Acacia polyacantha" 52
Figure 25 : Carte des paramètres édaphiques de
la zone d'étude 53
Figure 26 : Carte de répartition de l'intensité
des dégâts effectués par la grande faune sur la
végétation dans le site de Mikembo 59
Figure
27 : Régressions des facteurs explicatifs du pourcentage de
dégâts (p-value
significative) 61
Figure 28 : Régressions des
facteurs dépendants du pourcentage de dégâts (p-value
significative) 62
Figure 29 : Régressions entre les
constituants de la biomasse herbacée et le pourcentage de
dégâts (p-value significative) 63
Figure 30 :
Répartition des observations de faune sur la carte d'intensité
des impacts dans le
site de Mikembo 64
Table des équations
Équation 1 : Equation de la méthode K-means 27
Équation 2 : Equations utilisées par le logiciel
IndVal 28
Table des tableaux
Tableau 1 : Effets des différents types de feux sur les
strates de végétation d'une forêt claire
aux alentours de Lubumbashi (Katanga, RDC) (Sène (1976)
8
Tableau 2 : Données climatiques annuelles de différentes
zones administratives du Katanga 11 Tableau 3 : Effectifs des espèces de
faune réinsérées dans le sanctuaire de Mikembo et leurs
régimes alimentaires (Planton and Chardonnet 1995;
Delvingt and Vermeulen 2007;
IUCN 2012) 17
Tableau 4 : Stratégie d'échantillonnage
stratifié à fraction sondée variable de Mikembo 22
Tableau 5 : Données relevées sur les
différentes parcelles mises en place sur le site d'étude 23
Tableau 6 : Paramètres utilisés pour les
équations lors de l'analyse SPIR [N : nombre d'échantillons, Min.
: minimum, Max. : maximum, SEC : standard error of calibration,
R2 : coefficient de détermination, SECV :
standard error of cross validation] 25
Tableau 7 : Format du jeu de données en vue d'une
utilisation du logiciel R 26
Tableau 8 : Paramètres dendrométriques
mesurés en vue de la caractérisation des
communautés végétales arborées de la
réserve de Mikembo 29
Tableau 9 : Paramètres caractérisant les
communautés 30
Tableau 10 : Parcelles inventoriées par formation
végétale dans la réserve de Mikembo 32
Tableau 11 : Répartition des 69 placettes en 6 groupes
résultant de l'analyse NMDS réalisée
dans R 35
Tableau 12 : Répartition des placettes en 5 groupes,
résultant de la seconde analyse NMS 36
Tableau 13 : Répartition finale des placettes en 9
groupes, à la suite des analyses NMDS 36
Tableau 14 : Abondance relative des espèces dans les 8
groupes déterminés à la suite de
l'analyse NMDS 37
Tableau 15 : Espèces indicatrices de chaque groupe
déterminé à la suite de l'analyse NMDS
38
Tableau 16 : Classification des groupes d'après leur
structure et leur composition 42
Tableau 17 : Moyennes et coefficient de variation des
paramètres dendrométriques de chaque
communauté (les coefficients de variation sont
indiqués en italique) 43
Tableau 18 : Moyennes et coefficients
de variation des caractéristiques de chaque
communauté (les coefficients de variation sont
indiqués en italique) 44
Tableau 19 : Répartition des placettes du site
d'étude selon les différentes couleurs de sol 54
Tableau 20 : Répartition des placettes du groupe
"forêt claire à Julbernardia globiflora" selon
la couleur du sol 54
Tableau 21 : Les espèces indicatrices des sols gris sur le
site de Mikembo 55
Tableau 22 : Répartition des placettes de l'étude
selon les différentes profondeurs de sol 55
Tableau 23 : Répartition des placettes du groupe
"forêt claire à J. globiflora" selon la
profondeur du sol 56
Tableau 24 : Les espèces
indicatrices des différentes profondeurs de sol sur le site de
Mikembo 57
Tableau 25 : Pourcentage des espèces les plus
impactées par la faune 60
Tableau 26 : Valeurs des p-value et des coefficients
R2 pour les régressions linéaires et les
régressions logarithmiques entre les facteurs explicatifs du pourcentage
de dégâts et ce
dernier 60
Tableau 27 : Valeurs des p-value et des
coefficients R2 pour les régressions linéaires et les
régressions logarithmiques entre les facteurs expliqués par le
pourcentage de dégâts et
ce dernier 62
Tableau 28 : Valeurs des p-value et des
coefficients R2 pour les régressions linéaires et les
régressions logarithmiques entre les constituants de la biomasse de la
strate herbacée et
le pourcentage de dégâts par placette 63
Acronymes
ACP Analyse à composantes principales
Amor. Nombre de pieds morts par placette
ASBL Association sans but lucratif
BAK Biodiversité au Katanga
CD Couvert de la strate arborée dominante
Cd Couvert de la strate arborée dominée
Ch Couvert de la strate herbacée
CRAW Centre de recherche agronomique de Wallonie
CV Coefficient de variation
Dmoy Diamètre moyen du peuplement
FAO Food and Agriculture Organisation
GHA Surface terrière à l'hectare
Hdom Hauteur dominante du peuplement
Hmoy Hauteur moyenne du peuplement
IV Indicator Value
MS Matière sèche
N.S. Non significatif
NHA Nombre de tiges par hectare
NMDS Non-metric dimensional scaling
NT Nombre moyen de tiges par pied
ONG Organisation non gouvernementale
Pdeg. Pourcentage de pieds avec dégâts
PFNL Produits forestiers non ligneux
Pgr. Pourcentage de pieds régénérant par
graine
Pso. Pourcentage de pieds régénérant sur
souche
Ptr. Pourcentage de pieds régénérant sur
tronc
RDC République démocratique du Congo
SPIR Spectroscopie proche infrarouge
UE Unité d'échantillonnage
UNILU Université de Lubumbashi
ó Écart-type
1
1. Introduction
La dégradation et la déforestation des
forêts partout dans le monde est un problème récurrent. En
Afrique sub-saharienne, celle-ci est plus connue quand elle se déroule
dans les forêts denses humides. Cependant, la dégradation des
zones de forêts claires est également de plus en plus importante.
La croissance démographique et le développement des axes routiers
accélèrent cette dernière.
En République démocratique du Congo, dans la
province du Katanga, les populations ont toujours été
dépendantes du miombo, une des variantes de la forêt claire, pour
les biens et les services qu'il procure. Cependant, la tendance actuelle est
d'abattre les arbres afin de produire du makala (charbon de bois) en vue de
fournir de quoi se chauffer et cuisiner.
Ces abattages impactent bien évidemment la
végétation de cet écosystème, mais également
sa faune ainsi que les populations qui en dépendent.
La présente étude se déroule dans une
réserve créée en 2006. Cette étude
s'intéressera aux communautés végétales, ainsi
qu'à leurs relations avec les paramètres édaphiques, les
périodes de feux et les dégâts créés par la
faune. Le projet a été mis en place par l'asbl Mikembo, en
collaboration avec l'ONG BAK. Cette première asbl a pour missions
globales la promotion du développement socio-économique des
populations rurales du Sud-Katanga et la protection de l'environnement naturel
de cette région. La création de la réserve, en 2006,
s'inscrit dans leur volet faune-flore. Cette réserve de miombo a
été mise en défens des activités anthropiques et de
la grande faune y a été réintroduite.
Cette étude est présentée en six volets.
La première partie est une synthèse bibliographique sur le
contexte actuel de la forêt claire et plus particulièrement du
miombo dans la province katangaise, ainsi qu'une description du projet en
cours. La seconde partie explicite les objectifs du travail. La
méthodologie est ensuite décrite dans la troisième partie.
Les résultats sont développés dans la quatrième
partie. Ce travail finira par une discussion sur l'étude et pour
conclure, des perspectives en vue d'une future étude seront
énoncées.
2
2. Contexte de l'étude
2.1. La forêt claire et le miombo dans la
région zambézienne
2.1.1. Définitions et répartition
géographique
La région zambézienne, ainsi que son centre
d'endémisme, ont été décrits par White (1983). Elle
recouvre plusieurs pays du plateau central africain tels que l'Angola, la
Zambie, la République démocratique du Congo (RDC), le Mozambique,
la Tanzanie et le Burundi (figure 1).
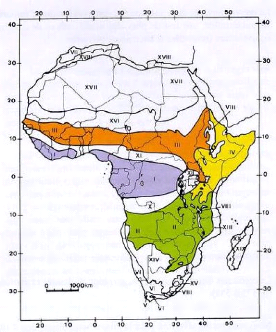
Figure 1 : Les territoires phytogéographiques
d'Afrique - le centre d'endémisme zambézien est en vert (II)
(Malaisse
1997)
Selon les spécialistes, le centre d'endémisme
zambézien a la plus grande diversité floristique parmi les
différents centres d'endémisme africains (White 1983; Malaisse
1997; Mittermeier, Mittermeier et al. 2003). En effet, la
région zambézienne possède 8 genres endémiques.
Elle est également un centre de diversité pour les genres
Brachystegia et Monotes (Shumba, Chidumayo et al.
2010). White (1983) a inventorié les espèces des principales
formations de l'Afrique sub-saharienne, inventaire revu ensuite par Linder
et al. (2005). Au vu de la grande différence de nombre
d'espèces (exemple : de 8.500 selon White à 1.725 selon Linder et
al. pour les espèces de flore dans le centre
d'endémisme), les différences de taxonomie entre les deux
périodes peuvent également influencer cette différence.
Néanmoins, une diminution d'espèces est visible, que ce soit en
général, ou
3
uniquement pour les espèces endémiques. Le
maintien de la faune et de la flore de cette région est donc primordial
pour conserver sa biodiversité.
Selon la FAO (Bellefontaine, Gaston et al. 1997), les
forêts claires (woodlands) sont « des peuplements ouverts avec des
arbres de petite et moyenne taille, dont les cimes sont plus ou moins
jointives, l'ensemble du couvert laissant largement filtrer la lumière.
Ils sont pourvus d'un tapis graminéen couvrant plus ou moins
partiellement le sol et d'une strate arborescente pratiquement continue (10-20
m et 40 à 60 % de couvert). Les essences sont très
grégaires, ce qui différencie ces forêts des savanes
arborées.»
La zone de répartition de la forêt claire va de
l'Afrique de l'Est et du Sud, de 4°Nord à 22°Sud, et du niveau
de la mer jusqu'à une altitude de 1.600 mètres. Cette zone de
répartition correspondrait aux limites de résistance de
Brachystegia spiciformis : 48°C pour ses feuilles et bourgeons et
-2°C pour les tiges (Ernst 1971). La pluviosité y est de 600 mm
à 1.200 mm par an, réparties en une seule saison des pluies et la
température varie entre les valeurs 17,2 et 26,4°C (Malaisse 1979;
Bellefontaine, Gaston et al. 1997).
Figure 2: Répartition géographique du
miombo en Afrique (Smith and Allen 2004)
Le miombo est un type de forêt claire constitué
d'arbres à larges feuilles caduques et caractérisé par la
prédominance des espèces du genre Brachystegia,
Julbernardia et Isoberlinia (Timberlake, Chidumayo et al.
2010). Sa répartition géographique est
représentée à la figure 2.
Malaisse (1987) considère que le miombo
représente plus de 50 % des forêts claires de la région
zambézienne. L'appellation vient du terme « muombo » qui
désigne les arbres du genre Brachystegia dans plusieurs langues
du plateau central d'Afrique australe (Smith and Allen 2004).
Au vu de sa grande distribution, le miombo est
subdivisé en deux types : le miombo sec (dry miombo) et le miombo humide
(wet miombo). Le miombo sec se trouve dans les
4
régions où la précipitation annuelle ne
dépasse pas les 1.000 mm, la canopée est
généralement d'une hauteur inférieure à 15 m et les
espèces dominantes sont B. spiciformis, B. boehmii et
J. globiflora. Le miombo humide, quant à lui, se situe dans des
zones où la précipitation annuelle est supérieure à
1.000 mm/an, la canopée supérieure à 15 m et les
espèces dominantes sont B. floribunda, B. longiflora,
J. paniculata et Isoberlinia (Timberlake, Chidumayo et
al. 2010).
2.1.2. La végétation et les formations
végétales du miombo
Comme cité plus haut, le miombo est un type de
forêt claire caractérisé par la dominance des genres
Brachystegia, Julbernardia et Isoberlinia,
appartenant tous à la famille des Fabaceae. La
végétation est majoritairement comprise dans cette famille et
dans les sous-familles Caesalpinoïdeae et
Mimosoïdeae (Timberlake, Chidumayo et al. 2010).
Le miombo n'est pas le climax de la région. En effet,
il est plutôt défini comme un pyroclimax : une formation
végétale entretenue par le feu (Freson, Goffinet et al.
1974; Malaisse 1979). Les stades, liés à une série
régressive due à l'action du feu seraient les suivants (Freson,
Goffinet et al. 1974):
? Le « muhulu » ou la forêt dense sèche
(dry evergreen forest)
? Le « miombo » ou forêt claire
(woodland)
? Les zones forestières plus ouvertes (open
woodland) : ce sont des anciens miombos, dégradés par le feu
et d'autres actions anthropiques. Ces zones se
situent plus généralement aux alentours des
villages et des routes.
? Les savanes et savanes arborées (savannah)
Ces différents stades créent des
mésoclimats de par leur différent couvert : la canopée a
un effet sur la température, l'humidité,
etc. et donc au final sur le sol et ses
composantes. En ce qui concerne la richesse spécifique, que ce soit dans
la strate arbustive et arborée ou dans la strate herbacée, elle
est plus riche dans le miombo et plus pauvre dans le muhulu, les savanes
occupant une position intermédiaire (Freson, Goffinet et al.
1974).
2.1.3. Le gibier, le bétail et leurs relations
avec la flore
La diversité faunique en Afrique varie selon les
ouvrages. Le nombre total d'ongulés sauvages dans les forêts
claires et sèches d'Afrique est estimé à 98
espèces, dont 10 espèces de grands herbivores selon Prins et
al. (1998). Schouteden (1946) a énuméré 665
espèces de mammifères en RDC, ce qui comprend donc
également les mammfidères des forêts denses humides du
bassin du Congo. Ansell (1978) compte 222 mammifères pour la Zambie.
Toutefois, tous affirment que la région zambézienne est la plus
riche au niveau des ongulés dans le monde (Olff, Ritchie et al.
2002).
Les principales espèces de bétail dans la
région zambézienne sont les vaches, les boeufs, les taureaux, les
moutons et les chèvres (Gambiza, Chidumayo et al. 2010).
Il existe trois types de régimes chez les herbivores :
les brouteurs (browsers), les paisseurs (grazers) ou les régimes mixtes,
à la fois brouteurs et paisseurs. Les paisseurs sont définis
comme ceux mangeant l'herbe (grass), et les brouteurs sont définis comme
ceux se nourrissant de plantes dicotylédones ligneuses et non-ligneuses
(Janis 2008). Ces régimes
5
alimentaires peuvent encore être dissociés en
consommateurs sélectifs, intermédiaires et non-sélectifs
(Fritz 2005).
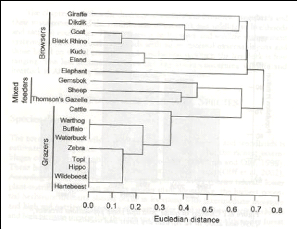
Figure 3: Séparation des espèces
d'herbivores de la forêt claire de par leur régime alimentaire
(Gambiza, Chidumayo
et al. 2010)
[giraffe = girafe, dikdik =
dik-dik, goat = chèvre, black rhino = rhinocéros noir, kudu =
koudou, eland = éland,
elephant = éléphant, gemsbok =
oryx, sheep = mouton, Thomson's gazelle = gazelle de Thomson, cattle =
bétail,
warthog = phacochère, buffalo = buffle, waterbuck =
cobe à croissant, zebra = zèbre, topi = topi, hippo
=
hippopotame, wildebeest = gnou, hartebeest = bubale]
Les différents régimes sont
représentés à la figure 3. Il faut noter que les
régimes peuvent changer selon la saison et la zone géographique
pour une espèce (Gambiza, Chidumayo et al. 2010). De nombreuses
études sur les comportements alimentaires des ongulés sauvages de
ces régions, ainsi que leur sélection d'habitats, montrent que,
selon l'espèce, l'impact de l'animal sur la végétation
varie (Ben-Shahar 1992; Prins and van der Jeugd 1993; Murray and Illius
2000).
La biomasse végétale accessible pour les animaux
dépend de l'espèce animale, de l'espèce
végétale, de la hauteur de la plante, de la saison et de la
région géographique. Pour ce qui est de la biomasse digestible,
cette dernière varie avec la teneur en composés chimiques de la
plante et principalement avec la teneur en tanins (Gambiza, Chidumayo et
al. 2010).
Une notion est très régulièrement
utilisée pour connaître la capacité du milieu à
héberger des herbivores : la capacité de charge. Celle-ci est
définie comme étant le nombre d'individus que «
l'environnement peut supporter » (Ricklefs and Miller 2005) et, dans ce
cas-ci, dépend de différents facteurs environnementaux (exemple :
la quantité de biomasse sèche disponible ou encore la
disponibilité en eau).
L'herbivorie peut avoir différents effets sur la
structure et la composition du miombo. De Knegt et al. (2008), lors
d'une étude sur la modification sur la structure spatiale des savanes,
informent de deux types d'interaction entre la faune et la
végétation : la « self-facilitation » et la «
spatial dependency of foraging ». Ils définissent la
première comme étant la situation où l'ongulé va
augmenter son attractivité à un site lors de sa recherche de
nourriture et la seconde comme étant la situation où
l'interaction entre l'herbivore et la végétation dans un site est
influencée par les environs du site. Ils considèrent
également trois
6
composantes pouvant faire varier ces deux interactions : la
disponibilité de la ressource, le dynamisme de la
végétation et le comportement alimentaire de l'animal.
Une conséquence non négligeable de la
présence d'ongulés est l'influence de l'herbivorie sur la
régénération. Goheen et al. (2007) ont
mené une expérience sur 10 ans. Ils ont exclu les ongulés
sauvages d'une partie de leur zone d'étude, dans une réserve
composée de mosaïque forêt-savane au Kenya. A la fin de
l'expérimentation, il apparaissait que la longueur des tiges
était inférieure dans la zone d'exclusion et le taux de
régénération y était deux fois plus important. Ils
expliquent cela par le fait que, dans les zones avec gibier, l'arbre est soumis
à une pression et consacre son énergie à croître le
plus rapidement possible afin d'être hors de portée des herbivores
plutôt qu'à sa reproduction. Cette étude montre donc que la
régénération est plus faible dans les zones de faune.
De nos jours, il faut compter également sur les
facteurs anthropiques, en plus des facteurs environnementaux et des facteurs
relatifs à la végétation, pour prédire la
distribution des ongulés et leurs interactions avec la
végétation. En effet, certaines espèces
préfèrent les zones ayant été brûlées.
Un autre facteur anthropique est la pression de chasse (ou de braconnage) ;
certaines espèces supportent mieux cette dernière que d'autre,
les petites espèces de gibier étant plus affectées.
Certaines espèces, telles que le guib harnaché1 ou le
céphalophe commun, ont typiquement été trouvées
dans des zones fortement impactées par l'homme (Averbeck, Apio et
al. 2009).
Les espèces de bétail ont également un
impact sur la végétation, ce dernier est cependant
différent de l'impact par le gibier. Les niches écologiques de
différentes espèces d'ongulés africains sont reprises
à la figure 4.
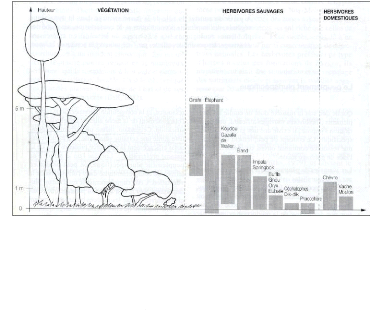
Figure 4: Niches écologiques d'herbivores sauvages
et domestiques en Afrique (Fritz 2005)
1 Voir annexe A.3.
7
2.1.4. Les conditions édaphiques
Les sols de forêts claires sont
généralement peu profonds et peu riche en nutriments (azote,
phosphore et matière organique). Dans la région
zambézienne, le pH est généralement acide, aux environ de
4-5 (Timberlake, Chidumayo et al. 2010).
Selon Freson et al. (1974), en relation avec la
densité de la canopée, l'épaisseur de la couche
supérieure de matière organique diffère selon les
différentes successions de végétation : 5-10 cm pour le
muhulu, 2-3 cm pour le miombo et 0-1 cm pour les savanes. Le pH a quant
à lui tendance à s'acidifier au plus le couvert est important.
Bell (1984) a démontré qu'en fonction de
l'infiltration de l'eau dans le sol et de la charge en éléments
minéraux nutritifs, la biomasse végétale, sa
qualité et du coup la structure de la formation variaient (figure 5).
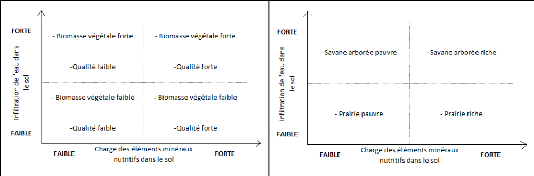
Figure 5: Diagramme simplifié des relations
sol-végétation (Bell 1984)
2.1.5. L'importance du feu
Comme dit précédemment, le miombo est un
pyroclimax, ce qui signifie que le feu est une des ses principales
composantes.
Même si des feux naturels peuvent survenir, l'origine
des feux est principalement anthropique : soit des feux se propageant suite
à la préparation des terres, lors de la confection de «
makala »2ou pour la collecte de miel, soit des feux
sont volontairement répandus pour la chasse (mammifères ou
oiseaux) ou pour la production de pâturage pour le bétail (Frost
1996). Il existe deux types de feux : les précoces et les tardifs. Les
feux précoces ont lieu au début de la saison sèche, saison
la plus propice à la propagation des feux. Les feux tardifs ont lieu,
quant à eux, à la fin de cette même saison. Les
différentes composantes du feu, telles que son comportement, son
intensité, sa fréquence et son timing affectent l'impact de
celui-ci sur la structure et la composition de la végétation
(Frost 1996; Bellefontaine, Gaston et al. 1997; Smith and Allen 2004;
Timberlake, Chidumayo et al. 2010).
2 Charbon de bois
8
Pour exemple, une expérience a été
menée par Sène (1976) dans une forêt homogène aux
alentours de Lubumbashi. Les résultats obtenus sont
présentés au tableau 1.
Tableau 1 : Effets des différents types de feux
sur les strates de végétation d'une forêt claire aux
alentours de
Lubumbashi (Katanga, RDC) (Sène (1976
|
Feux précoces
|
Feux tardifs
|
Absence de feux
|
|
Matière végétale
|
HERBACEE
|
partiellement détruite
|
totalement détruite; stock des semences très
entamé
|
s'amoncelle dangereusement perpétuant les risques toute la
saison sèche. Inflammabilité extrême en avril-mai
|
|
ARBUSTIVE
|
chute des feuilles et nécrose des ramures et bourgeons
terminaux.
|
détruite jusqu'à la base qui peut rejeter
|
évolution vers flore riche et relativement bien fournie
mais sérieux risques de feux tardifs.
|
|
ARBORESCENTRE
|
léchée par les flammes. Ecorce noircie.
Reconstitution fréquente du couvert si le feu précoce a
été pratique au moment opportun (avant arrêt de la
végétation)
|
gravement brûlée, blessures au tronc, coulée
de résine. Inflorescences détruites chez des fruitiers forestiers
ayant un important rôle alimentaire en période de soudure. Mort
d'un pourcentage important d'arbres de petits diamètres.
|
évolution identique que ci-dessus et mêmes risques
sérieux de feux tardifs.
|
|
Sol
|
Encore partiellement Couvert. Plages totalement couvertes.
|
Absolument dénudé, quasi- cuisson des horizons
superficiels.
|
Sol couvert protégé mais au total plus
vulnérable que lors des feux précoces.
|
9
2.1.6. L'importance socio-économique du
miombo
Le miombo fournit de nombreux services et biens aux habitants.
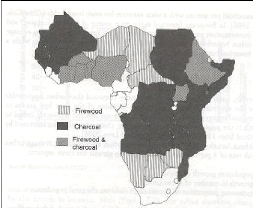
Figure 6: Consommation des différents types de
bois de feu et de chauffe par pays en Afrique sub-saharienne
(Malimbwi,
Chidumayo et al. 2010)
[firewood : bois de feu, charcoal : charbon de
bois]
Le miombo procure du charbon de bois et du bois combustible
pour les populations locales. Le charbon de bois est une ressource essentielle
pour les populations car elles s'en servent pour cuire leurs aliments et le
bois de feu est la principale source d'énergie pour les habitants
(Syampungani 2008). La figure 6 montre les combustibles (bois de feu ou charbon
de bois) utilisés par pays en Afrique sub-saharienne. Selon Malimbwi
(2010), le stock de biomasse potentiellement disponible pour l'énergie
dans la région zambézienne serait de 136,3 t/ha (ó =
19,52). De plus, la production de charbon de bois est une source de revenus et
d'emplois pour les habitants à la fois ruraux et urbains (Malambo and
Syampungani 1998).
Les produits forestiers non ligneux (PFNL) sont abondants dans
le miombo. Par exemple, le miombo procure aux villageois les PFNL suivants :
des fruits, des légumes, des champignons, des insectes, du miel ou
encore des plantes médicinales. (Bellefontaine, Gaston et al.
1997; Malaisse 1997; Shackleton and Gumbo 2010). Traditionnellement, les
produits du miombo composent une bonne partie de l'alimentation des personnes.
De manière générale, dans les forêts claires et
sèches de l'Afrique sub-saharienne, le prélèvement
soutenable des PFNL contribue à diminuer la pauvreté
principalement pour les populations rurales (Shackleton and Gumbo 2010).
Le miombo fournit du fourrage et des aires de pâturages
pour le bétail. Il fournit également des terres disponibles et
convertibles pour l'agriculture. Comme dit plus haut, le miombo se situe sur
des sols pauvres. L'agriculture dans les régions du miombo se fait alors
selon la technique de l'abattis-brûlis, qui consiste à abattre les
arbres (land-clearing) et les brûler afin que les nutriments retournent
au sol. Lorsque les nutriments sont épuisés, les villageois
changent de parcelles et recommencent (shifting cultivation) (Timberlake,
Chidumayo et al. 2010). Selon Mayaux et al. (2004), la
surface des forêts claires est de 4.483.380 km2
(4,48*1010 ha) dans la région zambézienne et
l'extension de l'agriculture occupe 679.700 km2 (6,79*109
ha) de cette dernière, ce qui représente 15,16 % de la surface
des forêts claires.
10
Le commerce du bois n'est pas très
développé dans le miombo mais est néanmoins
présent. Les essences les plus prisées pour ce commerce sont
Pterocarpus angolensis, Brachystegia floribunda, Afzelia
quanzensis, Erythrophleum africanum, Pterocarpus
rotundifolius, Dalbergia melanoxylon et Isoberlinia
angolensis. Cependant, cela n'empêche pas l'abattage de ces arbres
pour la production de charbon de bois dans certaines régions (Malambo
and Syampungani 1998).
2.2. Le Katanga, province de la RDC 2.2.1.
Géographie et climat
La province du Katanga est une des 11 provinces de la
République démocratique du Congo (figure 7). Elle s'y situe au
Sud-est et est comprise entre 5° et 13° degrés de latitude Sud
et entre 22° et 31° degrés de longitude Est. Sa superficie est
de 496.877 km2 (Anonymous 2005; PNUD-RDC 2009).
Figure 7 : Carte politique de la République
démocratique du Congo (Maurel 2006)
Le Katanga comprend trois bassins hydrographiques : celui du
Lualaba, de la Lufira et du Luapula (Freson, Goffinet et al. 1974). De
plus, la province abrite de très nombreux lacs, ce qui en fait « la
cuvette du Congo » (Anonymous 2005).
Le relief du Katanga se distingue en deux différentes
régions, séparées l'une de l'autre par une altitude de
1.000 mètres : celle qui nous intéresse est le Katanga des hauts
plateaux, qui occupe le Sud, le Sud-est et l'Est de la Province.
11
Les différents sols des forêts claires de
Lubumbashi et ses environs sont des latosols zonaux. Ceux-ci sont
divisés en trois séries, suivant leurs teneurs en oxydes de fer :
les sols rouges, les sols ocre-rouges et les sols jaunes. Il faut noter que la
nappe phréatique est peu profonde sous les sols jaunes (Malaisse
1979).
Les principales données climatiques du Katanga sont
reprises au tableau 2, la région de Lubumbashi étant la zone de
cette étude. Le climat (type Köppen) de cette région est Aw,
c'est-à-dire un climat tropical avec la saison sèche en hiver
(Anonymous 2005; PNUD-RDC 2009).
Tableau 2 : Données climatiques annuelles de
différentes zones administratives du Katanga
|
Stations/Paramètres
|
Kongolo
|
Kaniama
|
Manono
|
Kolwezi
|
Lubumbashi
|
|
Altitude (m)
|
561
|
949
|
633
|
1526
|
1187
|
|
Jours de pluie
|
194
|
216
|
162
|
160
|
149
|
|
Pluie (mm/an)
|
1220
|
1560
|
1138
|
1122
|
1285
|
|
Saison sèche - début - fin
- jours
|
|
|
1-mai
|
30-avr
|
13-avr
|
10-avr
|
3-avr
|
|
17-oct
|
24-sept
|
30-oct
|
30-oct
|
3-nov
|
|
129
|
117
|
167
|
172
|
197
|
|
Température (°C) - minimale - maximale - moyenne
|
|
|
19
|
17.2
|
19.3
|
13.7
|
11.6
|
|
31.5
|
29.3
|
32.3
|
26.6
|
28.1
|
|
24.2
|
22.4
|
25
|
19.4
|
19.1
|
|
Mois déficitaires
|
6
|
5
|
7
|
7
|
7
|
|
Classe Köppen
|
AW3-4
|
AW4-5
|
AW5
|
CW
|
CW
|
Selon les définitions faites au point 1 et
Timberlake et al. (2010), le sud de la RDC se situe dans la zone du
« wet miombo ».
2.2.2. Contexte socio-économique
La population du Katanga a un effectif de 8.167.240 habitants
en 2003, dont 1.113.352 à Lubumbashi, ce qui représente presque
14 % de cette population katangaise. La densité est de 10,89
hab./km2 pour la province en 1994. En 2003, le taux de croissance
démographique annuel était de 3,9 % (Anonymous 2005).
En 2007, la population de la province atteint les 8,7
millions, avec une densité de 18 hab./km2. Cette rapide
augmentation traduit donc bien la croissance démographique importante du
Katanga (PNUD-RDC 2009).
L'économie de la province est principalement
rythmée par son activité minière. Les gisements les plus
présents sont ceux de cuivre et ceux des minerais associés tels
que le cobalt ou le zinc. Les autres industries « dominantes » sont
les industries de transformation, les unités agro-industrielles et les
pêcheries industrielles (Anonymous 2005; PNUD-RDC 2009).
Les produits agricoles les plus produits en 1995 au Katanga
sont en première position le manioc, suivi par le maïs, les
poissons, les légumes (principalement des haricots) et les
12
arachides. Cependant, la majeure partie de l'agriculture est
une production d'autosuffisance, le reste étant occupé par de
grosses exploitations (Anonymous 2005; PNUD-RDC 2009).
Les forêts ne sont pas réellement
exploitées au sens strict du terme au Katanga ; les seuls
prélèvements exercés sont le bois de feu, le charbon de
bois et les PFNL (champignons, fruits, etc.) (Anonymous 2005). En effet, la
production de bois de feu en RDC a été estimée à
54,7 millions de tonnes (75,4 millions de m3) de bois énergie
en 2009, ce qui correspond à 94 % de l'exploitation totale de bois du
pays (FAO 2012).
2.2.3. Le miombo au Katanga et aux alentours de Lubumbashi
Le miombo est l'écosystème majoritaire du Katanga
(Kabulu, Bamba et al. 2008).
Sys et al. (1959) classent la
végétation de Lubumbashi selon plusieurs grands groupes : la
végétation aquatique, la végétation des
dembos3, les brousses ou savanes arbustives, les forêts
claires à Brachystegia, les savanes à Acacia,
les galeries forestières4, les forêts climaciques et la
végétation des mines de cuivre. Au sein de ces groupes se
distinguent des groupements d'espèces.
Schmitz (1971) a déterminé différentes
alliances et associations d'espèces pour le miombo dans la région
de Lubumbashi. Selon la position topographique et les sols (principalement
couleur et zonalité), il a défini trois alliances : l'alliance
Berlinio-Marquesion se divisant en l'alliance Xerobrachystegion (les sols
jaunes associés à l'association à Marquesia macroura
et Brachystegia taxifolia et/ou l'association à
Brachystegia microphyllea) et l'alliance Mesobrachystegion (les sols
rouges associés à l'association à Marquesia macroura
et Brachystegia taxifolia). Au sein de ces alliances, il a
défini des associations et des sous-associations d'espèces selon
les qualités/propriétés chimiques et physiques des sols.
Dans l'alliance Xerobrachystegion, les associations à Brachystegia
spiciformis et Monotes katangensis se retrouvent sur les sols
biens drainés, graveleux mais meubles, les associations à
Uapaca divers et Brachystegia boehmii sont sur sols pauvres
et mal drainés et pour finir, les associations à Bulbostylis
mucronata et Brachystegia stipulata sur les plateaux graveleux et
latéritiques, également mal drainés. Dans l'alliance
Mesobrachystegion, deux associations se distinguent. L'association à
Combretum-Annemonetum senegalensis se retrouve sur les sols frais,
profonds et fertiles du plateau de Lubumbashi, alors que l'association à
Boscieto-Fagaretum regroupe la flore des termitières.
Une étude sur les sols de la région de
Lubumbashi et les relations entre la végétation et ceux-ci a
été menée par Sys et Schmitz (1959). Il en ressort une
forte corrélation entre le sol et la végétation en place.
Même si le climax, c'est-à-dire le muhulu, varie peu en fonction
du sol, il apparaît que la « forêt claire à
Brachystegia » varie fortement d'un sol à l'autre. Les
paramètres édaphiques les plus influents semblent être la
texture et le bilan en eau.
Malaisse (1997) quant à lui classe la
végétation du miombo du Katanga selon des critères
physionomiques et floristiques sans, a priori, tenir compte du sol. Il
en ressort des
3 Dembo = vallées à faibles pentes avec
des sols gorgés d'eau et une végétation herbacée
typique (Sys et al. 1959)
4 Forêt galerie = étroite bande de
terrain sur les rives immédiates (Sys et al. 1959)
13
savanes arbustives à espèces typiques et des
forêts claires à Brachystegia
spp. et espèces
associées.
Depuis, peu d'études ont été
menées sur les dynamiques du miombo au Katanga. Cependant, une
étude menée en Zambie s'est préoccupée de cette
dynamique (Lawton 1978). Selon lui, la forêt claire, après avoir
été abattue, commence par un stade appelé « chipya
», avec des espèces de petite taille, une strate herbeuse
élevée, un couvert très ouvert et une prédominance
des espèces résistantes aux feux de saison sèche. Ces
espèces caractéristiques sont Diplorhynchus
condylocarpon, Hymenocardia acida et Syzygium guineense
et y ont leurs couronnes fortes développées. Ensuite, il
décrit un stade à Uapaca spp. qui évoluerait vers
une forêt claire typique à Brachystegia-Julbernerdia. Il
explique que le stade à Uapaca spp. pourrait également
évoluer en une forêt « sempervirente » à
Marquesia macroura.
2.2.4. Le contexte actuel du miombo en RDC et à
Lubumbashi
Le miombo couvrait 12 % de l'Afrique dans les années 70
(Freson, Goffinet et al. 1974). Ces zones forestières sont
restées longtemps très peu peuplées en raison de la
présence de la mouche tsé-tsé, vectrice de la maladie du
sommeil (Bellefontaine, Gaston et al. 1997). Depuis, l'hygiène
de vie s'est améliorée, la médecine a progressé, et
les populations ont commencé à croître.
Le miombo couvrait environ 90 % de la région de
Lubumbashi dans les années 19701980 (Malaisse 1979). Aujourd'hui, le
miombo disparaît de plus en plus le long des routes et autour des villes.
Comme dans le reste de la RDC, la déforestation ou du moins la
dégradation du miombo s'amplifie de jour en jour. Déjà en
1974, Freson et al. (1974) indiquaient que l'essentiel du muhulu avait
été transformé en miombo de par les feux anthropiques et
que les zones forestières évoluaient progressivement en savanes.
Des études plus récentes ont confirmé cette perte du
couvert forestier (Kabulu, Bamba et al. 2008).
Afin de chiffrer cette déforestation en RDC, une
étude a été menée tout le long de la
décennie 2000-2010, à l'aide d'analyse d'images Landsat. Trois
types de forêts ont été pris en compte : la forêt
primaire (forêt mature avec un couvert de plus de 60%), la forêt
secondaire (couvert entre 30 et 60 %) et les formations forestières
(couvert inférieure à 30 %), dans lesquelles se trouvent le
miombo. Cette étude, faisant partie du programme FACET (Forêts
d'Afrique centrale évaluées par
télédétection) réalisé par l'OSFAC
(Observatoire satellital des forêts d'Afrique centrale), a estimé
la perte brute du couvert sur la décennie à 2,3 % de la surface
forestière totale. Le taux annuel de déforestation brut entre
2000 et 2005 a été estimé à 0,323 %. L'importance
de cette perte a été corrélée avec les
densités de populations et l'importance des activités
minières (Ernst, Verhegghen et al. 2010).
Actuellement, la croissance démographique, l'ouverture
des routes ou du moins leur macadamisation et la demande croissante en makala
accentuent cette dégradation. Une étude a montré l'impact
de l'ouverture des routes sur la déforestation ; autour de certaines
routes, celle-ci pouvait atteindre 60 % entre 1984 et 2009 (Vranken, Djibu
et al. 2011). De plus, avec l'ouverture des importations, les gens
dépendent de moins en moins des PFNL fournit par le miombo et perdent
donc leurs traditions liées à ce milieu.
Au niveau du Katanga, Kabula et al. (2008) montrent
dans leur étude une fragmentation globale du couvert forestier katangais
et surtout une fragmentation très
14
importante des taches de forêts claires. Vranken et
al. (2011) ont mis en relation la déforestation aux alentours de
Lubumbashi avec le développement des axes routiers. De 1985 à
2009, les directions suivants deux axes routiers ont perdu 60 et 40 % de leur
couvert forestier, contre moins de 10 % pour d'autres directions.
Les principales menaces ressortant de l'étude d'Ernst
et al. (2010) sont le bois de feu, l'agriculture, les mines et
l'exploitation forestière. Certains diront que le
prélèvement de bois de feu et l'agriculture ont toujours
existé dans ces régions. Cependant, la croissance
démographique est telle que la périurbanisation est de plus en
plus importante et les villages se multiplient autour des grandes villes et des
grands axes. Cette pression engendre une intensification de
prélèvement du bois de feu. Pour ce qui est de l'agriculture, le
manque de technologie privilégie le système de l'agriculture
itinérante sur brûlis. Néanmoins, au vu de la croissance
démographique, les temps de jachère sont réduits,
entrainant un appauvrissement du sol sur le long terme (Ernst, Verhegghen
et al. 2010).
Ce déboisement affecte également le climat ; en
effet, une baisse des précipitations et d'autres perturbations
climatiques sont consécutives à ce déboisement autour des
villes de la province. De nombreux mètres-cubes de bois sont
coupés pour des raisons de chauffage ou de construction. Cela cause non
seulement l'appauvrissement et la dégradation des sols mais
également une disparition des espèces végétales et
animales (Anonymous 2005).
Le Katanga était excessivement riche en grande faune.
Chardonnet et al. (1995) décrivait le « Zaïre »
comme étant un pays à très fort potentiel faunique, avec
des espèces rares et menacées et une forte importance de la
chasse traditionnelle. Les villageois prélevaient ce qu'il leur fallait
pour se nourrir et subvenir à leurs besoins en protéines.
Cependant, ce prélèvement insistant et l'arrivée des
coloniaux et de leur chasse pour les trophées a appauvri cette richesse
faunique. Cette diminution se remarqua dès le début des
années 50 (Malaisse 1997). Actuellement, le gibier a totalement disparu
dans un rayon de 150 km autour de Lubumbashi et le rayon de dégradation
forestière autour de cette ville augmente d'environ 1 km par an
(Malaisse and Binzangi 1985). Cette affirmation datant de 1985, on peut deviner
qu'aujourd'hui, avec l'ouverture des routes due au développement des
mines, celui-ci est plus important. Un recensement des grands mammifères
et des impacts humains dans les parcs nationaux du Katanga a été
effectué durant l'année 2008 (Vanleeuwe 2009). À la fin de
l'inventaire aérien, dans les deux parcs, 165 observations directes de
11 espèces ont pu être faites. Les traces indirectes
étaient peu nombreuses dans le cas des espèces animales mais
abondantes pour les traces humaines. Le recensement terrestre (900 km) a
révélé 32 espèces animales avec un total de 4701
observations.
Toutes ces informations peuvent être
résumées en une problématique : la disparition du miombo
tout autour du périmètre du Lubumbashi s'accentue d'année
en année. Les principaux acteurs identifiés sont l'agriculture et
les activités minières (Kabulu, Bamba et al. 2008). La
production de charbon de bois joue également un rôle important.
Tout cela affecte bien évidemment la flore et la faune, cette
dernière ayant en plus subi une pression de chasse importante durant
plusieurs décennies. Un autre effet est l'impact sur les populations
villageoises : celles-ci sont dépendantes du miombo pour tous ses biens
et services. Une restauration de cet écosystème autour de la
ville de Lubumbashi est donc d'une importance capitale.
15
2.2.5. Le potentiel de
régénération du miombo
La dynamique de la végétation du miombo
katangais n'a pas été étudiée depuis plusieurs
décennies et son étude actuelle devient de plus en plus difficile
suite à l'abattage des arbres pour produire du makala.
Il existe deux grands types de reproduction : la reproduction
végétative et la reproduction sexuée. Cette
dernière s'effectue par graine, alors que la première
représente une régénération sur du matériel
végétal déjà existant. Il existe quatre types de
reproduction végétative : à partir d'une tige ou souche,
à partir de tiges souterraines (rhizomes), à partir de racines ou
reproduction opportuniste sur des branches (Timberlake, Chidumayo et al.
2010).
Selon Hosier (1993) et Ribot (1993), le taux de reproduction
dépend du type de forêt claire, des précipitations, de la
gestion du feu et de la pression de l'herbivorie. Selon Timberlake et
al. (2010), la capacité pour une espèce de se reproduire
végétativement dépend des perturbations endurées :
l'herbivorie, le passage du feu, les inondations, l'abattage des arbres ou
encore la sécheresse. Cette capacité dépend aussi de
l'âge et de la taille de l'arbre, ainsi que du type et de la
sévérité de la perturbation. Le feu semble être le
facteur le plus influent : en effet, l'importance de
régénération d'une espèce va varier en fonction de
cette espèce mais également de la fréquence de passage du
feu (Timberlake, Chidumayo et al. 2010).
Concernant la capacité de reproduction après
production de makala, la période de retour des « charbonniers
» sur un site entre deux abattages varie selon la région. En Zambie
par exemple, cette dernière varie entre 20 et 30 ans. Globalement, cette
période de temps est estimée entre 8 et 23 ans (Malimbwi,
Chidumayo et al. 2010).
Une étude a été menée sur la
capacité de développement des forêts claires à
Brachystegia-Julbernardia après abattage en Zambie (Chidumayo
2004). Cette dernière a démontré qu'il y avait des
recépages sur souche dans tous les sites. Le taux de survie des souches
et/ou troncs était supérieur dans les sites où une
dégradation avait déjà eu lieu que dans les forêts
anciennes. Cette étude a également montré que le passage
du feu réduisait la richesse spécifique de ces forêts. Plus
particulièrement, les Uapaca spp. tolèrent moins le
passage du feu que les espèces caractéristiques de la forêt
claire. Cette constatation remet en cause le statut de stade précurseur
des fourrés à Uapaca spp. Selon cette étude,
l'idéal, pour une production « durable » de charbon de bois,
est de procéder à l'abattage des espèces propices au
recépage sur souche.
Peu d'études phénologiques ont été
menées sur les espèces de cet écosystème et leur
capacité de reproduction, sans doute à cause de l'importante
variabilité de celles-ci en fonction des lieux, du climat, des passages
de feux et de tous les autres facteurs pouvant influencer cette reproduction
(Bellefontaine, Gaston et al. 1997).
16
2.3. Le sanctuaire de Mikembo 2.3.1. Le
projet
Dans un projet beaucoup plus large que la problématique
de la disparition de la faune et de la flore, l'asbl Mikembo, en association
avec BAK5, portant ce projet a débuté en 2002. Les
objectifs globaux sont la promotion du développement
socio-économique des populations rurales du Sud-Katanga et la protection
de l'environnement naturel de cette région, tant en ce qui concerne la
faune que la flore et se construit selon six axes, dont un axe «
faune-flore » (Mikembo 2002).
Le sanctuaire de Mikembo s'inscrit dans le volet faune-flore.
Il se situe à une trentaine de kilomètres au nord-est de
Lubumbashi. Sa superficie totale est de 442 ha. Il comprend trois villages, un
camp et un lac. Le projet en place est un projet pilote unique dans les
forêts claires du Katanga. Dans un terrain avec des zones
dégradées par l'agriculture ou par la production de makala et
avec des zones forestières, plusieurs espèces de la grande faune
native ont été réintroduites afin de recréer
l'écosystème originellement présent au Katanga. Les
responsables de l'asbl ont comme projet d'ensuite recréer ce projet sur
une zone plus grande et peut-être ainsi développer un tourisme de
vision et/ou de chasse.
Ce projet unique est une bonne base pour cette étude.
En effet, tous les éléments (faune et flore) sont réunis
et toute la zone a été mise en défens des activités
anthropiques (agriculture et makala) depuis la création de la
réserve.
2.3.2. Les espèces végétales et
animales
Pour ce qui est de la flore, aucune plantation n'a
été réalisée. La régénération,
par souche, graine ou rejet de tronc, s'est faite naturellement.
Treize espèces d'ongulés ont été
réintroduites dans le sanctuaire (tableau 3). Ce sont toutes des
espèces originellement présentes dans la zone, à
l'exception des girafes. De nombreuses études sur la sélection
d'habitats et le régime alimentaire de ces espèces ont
déjà été menées. Des photos de ces
espèces sont présentées à l'annexe A.3.
Du bétail, appartenant aux villages, se trouve
également dans la zone d'étude. Les animaux domestiques
présents sont les suivants : vaches et boeufs, moutons, chèvres,
ânes et porcs.
5 ONG Biodiversité au Katanga
17
Tableau 3 : Effectifs des espèces de faune
réinsérées dans le sanctuaire de Mikembo et leurs
régimes alimentaires lanton and Chardonnet 1995; Delvingt and Vermeulen
2007; IUCN 2012
|
Nom français
|
Nom scientifique
|
Estimation de
l'effectif actuel
|
Régime alimentaire
|
|
Bubales
|
Alcephalus buselaphus
|
20-25
|
paisseurs peu sélectifs
|
|
Céphalophes de Grimm
|
Sylvicapra grimmia
|
2
|
essentiellement brouteurs
|
|
Cobes à croissant
|
Kobus ellipsiprymnus
|
+/- 30
|
paisseurs
|
|
Cobes de Vardon
|
Kobus vardonii
|
7
|
uniquement paisseurs
|
|
Elands du Cap
|
Tragelaphus oryx
|
25-30
|
mixte
|
|
Girafes
|
Giraffa camelopardalis
|
3
|
brouteurs sélectifs
|
|
Grands koudous
|
Tragelaphus strepsiceros
|
15-20
|
brouteurs
|
|
Guibs harnachés
|
Tragelaphus scriptus
|
3-4
|
brouteurs sélectifs
|
|
Hippotragues
|
Hippotragus niger
|
13
|
mixte
|
|
Impalas
|
Aepyceros melampus
|
+/- 70
|
mixte
|
|
Phacochères
|
Phacochoerus aethiopicus
|
12
|
omnivores
|
|
Raphicères
|
Raphicerus campestris
|
1
|
essentiellement paisseurs
|
|
Zèbres de Burchell
|
Equus burchelli
|
20
|
paisseurs peu sélectifs
|
Parmi les espèces à régime mixte, les
hippotragues adaptent leur régime selon la saison et évitent la
compétition avec d'autres herbivores. Cependant, en l'absence de
compétition, ils émettent une préférence pour les
savanes peu boisées et mosaïques composées d'ilots
forestiers ou de lisières forestières (Delvingt and Vermeulen
2007). Le régime alimentaire des élands est principalement mixte,
même si une préférence pour le broutage existe. Ils se
trouvent généralement dans tous les types de savanes (Planton and
Chardonnet 1995). Les impalas, une espèce grégaire à
troupeau généralement de grande taille, ont également un
régime mixte, à la fois brouteurs et paisseurs. Ils
privilégient les savanes arbustives, arborées et boisées
ainsi que les forêts claires et les points d'eau (Planton and Chardonnet
1995).
En ce qui concerne les espèces de type paisseurs, les
bubales sont peu sélectifs. L'habitat de cette espèce va des
plaines herbeuses aux formations arbustives ou boisées. Elle affectionne
particulièrement les points d'eau (Delvingt and Vermeulen 2007). Les
zèbres sont également peu sélectifs. Ils se retrouvent
dans les steppes herbeuses ainsi que dans les savanes arbustives et
arborées (Planton and Chardonnet 1995). Les raphicères quant
à eux se retrouvent dans les savanes et encore dans des zones avec une
strate arbustive importante. Ils préfèrent les plaines avec une
grande production herbeuse (IUCN 2012). Cependant, ici, un seul individu de
cette espèce a été recensé, son influence risque
d'être insignifiante. Les cobes à croissant sont principalement
paisseurs. Ils sont inféodés aux zones où l'eau est
permanente. Ils affectionnent les savanes, les formations boisées et les
mosaïques forêts-savanes (Delvingt and Vermeulen 2007). Le cobe de
vardon, de par son régime uniquement paisseur, se trouve dans les
savanes et les plaines inondées. Cependant, ils évitent les
plaines où l'eau est stagnante (IUCN 2012).
Parmi les espèces de brouteurs, le céphalophe de
Grimm est une petite antilope. Il est essentiellement brouteur, parfois
paisseur et plus rarement carnivore. Il a une préférence pour les
formations végétales mixtes et s'accommode bien de la
présence humaine et des activités de celui-ci (Planton and
Chardonnet 1995). Ici, sa présence est très faible : seuls deux
individus ont été recensés. La girafe, de par sa taille,
peut se permettre un régime alimentaire de brouteur sélectif.
Elle se localise, comme l'éland, dans tous les types de savanes
(Planton
18
and Chardonnet 1995). Le guib harnaché est
l'espèce d'antilope qui s'adapte le mieux à la présence
humaine. Ce sont des brouteurs sélectifs qui préfèrent des
couverts végétaux denses (Planton and Chardonnet 1995). Les
grands koudous sont également des brouteurs. Ils se retrouvent dans les
forêts claires et fourrés possédant des champs
abandonnés et des pâtures « dégradées »
(IUCN 2012).
Les phacochères sont les suidés les plus
répandus en Afrique et en dehors des déserts et des forêts
denses humides, ils sont susceptibles de se retrouver dans toutes autres
formations végétales. Ils sont omnivores (Planton and Chardonnet
1995).
19
3. Objectifs
L'objectif global de cette étude est de
déterminer les dynamiques des communautés végétales
d'une réserve de forêt claire en régénération
avec présence de grands herbivores, en vue d'évaluer son
potentiel de régénération.
La première étape de cette étude sera de
caractériser les différentes communautés
végétales de la réserve.
Les communautés seront déterminées à
l'aide de :
? leurs espèces abondantes et indicatrices de la strate
arborescente
? leur structure (paramètres dendrométriques et
répartition des pieds par classe de grosseur) ;
? des paramètres caractéristiques (entre autres :
couverts et hauteur de strate herbacée).
Toutes ces caractéristiques seront ensuite mises en
relation avec les paramètres édaphiques et les périodes de
feux pour voir l'effet des uns sur les autres.
La seconde étape sera de mettre en parallèle les
dégâts sur la strate arborescente, par placette, avec les
paramètres de la végétation afin de voir si des facteurs
peuvent expliquer l'intensité des dégâts. Le but de cette
étape serait de voir quels facteurs pourraient prédire une
intensité des dégâts et ainsi prévoir
l'évolution de la végétation en relation avec le grand
gibier.
Le but final est de pouvoir prédire l'évolution
probable de la végétation à l'aide de la dynamique de ces
communautés, le sol et les feux, et ce en présence de faune.
20
4. Matériel et Méthodes
4.1. Site d'étude
4.1.1. Description générale
La zone d'étude correspond au sanctuaire de Mikembo,
qui se situe à une trentaine de kilomètres au nord-est de
Lubumbashi et dont la surface totale est de 442 ha. L'altitude de la zone varie
entre 1.140 et 1.220 mètres. Les précipitations annuelles
correspondent à celles de la ville de Lubumbashi, c'est-à-dire
1.200 mm/an et les températures varient entre 11 et 28 °C. Les
latitudes de la zone d'étude varient de 11,466°S à
11,489°S et les longitudes varient de 27,653°E à
27,682°E. Son image satellite est présentée à
l'annexe A.1. Une rivière traverse le Nord-ouest de la zone : il s'agit
de la rivière Kiswishi.
4.1.2. Historique d'utilisation des terres
Il n'existe pas vraiment de parcellaires dans la région
de Lubumbashi. Les terres appartiennent par tradition aux chefs coutumiers, qui
décident ensuite de la répartition de ces hectares aux
différents habitants de leur village.
Le sanctuaire se situant le long de la route de Kasenga,
récemment asphaltée, on peut supposer que les villages ne s'y
sont installés qu'à ce moment-là et qu'avant la zone
était principalement forestière. La route a été
construite en 1961 (communication personnelle de Vanessa Anastassiou).
Selon le gestionnaire de la réserve, François
Kyakaba, la réserve comprend des terres qui appartenaient à
différentes familles. Des abattages, que ce soit pour le makala ou la
conversion des terres pour l'agriculture, ont donc eu lieu sur la zone.
Toutes les terres furent rachetées en 2003 et 2004 et
la réserve fut officiellement créée en 2006.
4.1.3. Gestion actuelle
Les deux principales activités de gestion de la
réserve sont la gestion des populations d'ongulés et la gestion
du calendrier des feux. Lors d'un entretien avec le gestionnaire de la
réserve, les informations suivantes ont été
récoltées.
Au niveau de la gestion de la faune, la principale action est
le nourrissage, une fois par semaine, dans des enclos prévus à
cet effet. Celui-ci est d'autant plus important en saison sèche, car la
nourriture vient à manquer au sein de la réserve. Les
différents employés nourrissent également les animaux en
saison des pluies. En effet, ils profitent de ces points de nourrissage pour y
installer un couloir muni d'un détecteur injectant un produit
anti-tiques lors du passage de chaque animal. Les lieux de nourrissage sont
aussi des bons postes d'observation. Les instants de nourrissage permettent
donc un monitoring hebdomadaire assez rapide et facile, même si toutes
les espèces ne vont pas à ces lieux de nourrissage.
En ce qui concerne les feux, ceux-ci sont mis en place
essentiellement pour la production de fourrage pour le gibier La carte
présentée à la figure 8 montre les différentes
zones brûlées et à quelle période
elles le sont. Aucun feu n'est conduit en août ou septembre car les vents
empêchent le contrôle de ces derniers. Les zones non
brûlées correspondent aux zones proches des infrastructures ou aux
zones consacrées à la mise en place de dispositifs de suivi de
l'UNILU6.
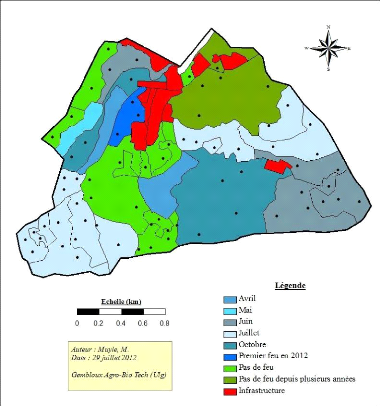
Figure 8 : Carte de période des feux dans la
réserve de Mikembo
21
6 Université de Lubumbashi
22
4.2. Inventaire
4.2.1. Carte de végétation
Pour établir une première carte de
végétation, nous avons utilisé l'image satellitaire
Worldview-2 à 8 bandes spectrales, projetée en UTM-35S dans le
référentiel WGS84, d'une résolution de 2 mètres et
d'une zone de 25 km2 comprenant la réserve (en annexe A.1.).
Cette image a été prise le 11 mai 2011, ce qui correspond au
début de la saison sèche. Les systèmes de classification
supervisée de l'image satellite dans ArcGis n'ayant rien donné de
satisfaisant, une première version de la carte de
végétation a été établie, à partir de
cette image et à l'aide d'une vérification de terrain sur
certaines zones. Elle a été basée sur des critères
principalement physionomiques. Sur base de la structure globale et des
espèces dominantes de la strate arborée, nous avons défini
différentes formations végétales. De cette carte dont nous
allons nous servir pour baser notre inventaire, nous avons exclu certaines
zones anthropisées : les villages, le camp et d'autres zones telles que
le verger, etc.
4.2.2. Sélection des placettes d'inventaire
Sur base de la carte de végétation, un premier
échantillonnage stratifié aléatoire à fraction
sondée variable a été réalisé, en faisant 3
points d'échantillonnage par formations. Les parcelles ont
été décidées aléatoirement dans chaque
formation avec l'outil « Create Random XY Points » d'ArcGis,
après avoir effectué un buffer d'exclusion autour des pistes et
autour des zones exclues.
Cependant, vu le nombre de placettes
généré par cette stratégie, trop important pour le
temps de terrain disponible, une autre stratégie
d'échantillonnage a été adoptée : un
échantillonnage stratifié aléatoire à fraction
sondée variable, mais tenant compte tout de même de
catégorie de surface. Cette stratégie est expliquée au
tableau 4.
Tableau 4 : Stratégie d'échantillonnage
stratifié à fraction sondée variable de
Mikembo
|
Surface de la formation
|
Nombre de placettes
|
|
=25 ha
|
4
|
|
< 25 ha et = 12 ha
|
3
|
|
< 12 ha et = 5 ha
|
2
|
|
< 5 ha
|
1
|
Les placettes sont circulaires et d'un rayon de 18
mètres. Les études menées dans le miombo présentent
de nombreuses variantes à ce niveau-là. Certains prônent
les placettes circulaires, d'autres les rectangulaires. La raison principale du
choix d'une placette circulaire est son utilisation de plus en plus
fréquente dans les relevés dendrométriques, cette
technique étant plus facile à mettre en place. Dans cette
étude-ci, un avantage supplémentaire des placettes circulaires
concerne l'inventaire de dégâts de gibier. En effet, en
forêt tempérée, la mise en place de piquets pour
matérialiser les placettes introduit un biais, dû au fait que les
animaux aiment se frotter aux piquets. Les dégâts dans ces
placettes sont donc plus importants (François Lehaire7,
communication personnelle). Pour éviter cette erreur, nous avons mis
en
7 Gembloux Agro-Bio Tech, Unité de Gestion des
Forêts et des Espaces naturels
23
place des placettes circulaires. Le choix du rayon est
dû à la surface concernée : 10 ares est la surface la plus
répandue dans les recensements forestiers. De plus, des placettes ont
déjà été mises en place dans le sanctuaire de
Mikembo et celles-ci étaient d'une surface de 20x50 mètres (= 10
ares). Un rayon de 18 mètres correspond donc à des placettes de
même superficie.
Données floristiques, dendrométriques
et dégâts de gibier dans les placettes
Sur chaque placette, différentes données ont
été mesurées au niveau de la placette, au niveau du
peuplement, ensuite pour la régénération. Ces
différentes données sont reprises au tableau 5. Dans les savanes
herbeuses, seules les données caractérisant la placette ont
été prises. Les trois fiches d'inventaire sont
présentées à l'annexe A.2.
Tableau 5 : Données relevées sur les
différentes parcelles mises en place sur le site
d'étude
Données Unité Description
|
Données caractérisant la
placette
|
|
Strate herbacée
|
cm
|
Prises en 4 endroits (même procédé que le
prélèvement de la biomasse)
|
|
Biomasse
|
kg/m2
|
Prélèvement d'un mètre carré de la
strate herbacée
|
|
Couverts
|
% rec.
|
Estimation du recouvrement des différentes strates
(dominante, dominée et herbacée)
|
|
Termitière
|
% rec.
|
Estimation du recouvrement de la termitière si
présence d'une
|
|
Arbres morts
|
Nombre de pieds
|
Comptage de tous les pieds morts
|
|
Données caractérisant le
peuplement
|
|
Essence
|
/
|
Genre et espèce de chaque pied
|
|
Diamètre
|
cm
|
Mesuré à 1m30 pour chaque tige du pied,
mesuré à l'aide d'un mètre-ruban forestier
|
|
Hauteur
|
m
|
Hauteur maximale du pied, mesurée à l'aide du
Vertex
|
|
Type de croissance
|
/
|
Graine, Souche ou Tronc
|
|
Dégâts et Hauteur
|
Nombre et m
|
Nombre de branches cassées par pied et la hauteur de
chaque cassure
|
|
Données caractérisant la
régénération
|
|
Essence
|
/
|
Genre et espèce de chaque pied
|
|
Nombre de pieds
|
Nombre de pieds
|
Comptage de tous les pieds de
régénération présents dans la placette
|
|
Hauteur minimale
|
cm
|
La hauteur du plus petit pied de
régénération
|
|
Hauteur maximale
|
cm
|
La hauteur du plus grand pied de
régénération
|
|
Dégâts
|
/
|
Nombre de pieds cassés par essence
|
Ici, une tige est considérée comme un des axes
de croissance de l'arbre ou de l'arbuste alors que le pied est la base de
l'arbre. Le pied d'un arbre ou arbuste peut donc contenir plusieurs tiges.
Le type de régénération peut être
végétatif ou sexué. Afin d'analyser et de quantifier ces
deux dynamiques de régénération, nous avons établi
trois types de croissance. Les croissances sur souche et tronc reflètent
une dynamique végétative de régénération,
les
24
croissances sur troncs résultant souvent d'arbres
abattus en vue de produire du makala. Par défaut, les pieds qui ne sont
pas issus de souches ou de troncs sont considérés comme issus de
régénération par graines. Il est possible que ce mode
d'estimation surestime l'importance de ce type de
régénération en cas de drageonnement non
détecté.
Le seuil d'inventaire, pour différencier le peuplement
de la régénération, a été arbitrairement
fixé à 2 cm de diamètre, ce qui est inférieur aux
seuils généralement utilisés. La raison de ce choix est le
jeune âge de la réserve et des différentes
communautés. Afin d'avoir une représentation la plus exacte
possible, nous avons préféré un seuil faible. Pour les
relevés de régénération, nous n'avons
considéré que les pieds supérieurs à 20 cm de
hauteur, pour des raisons de possibilité de détection.
4.2.3. Le prélèvement de la biomasse
Sur chaque placette mise en place, la biomasse de la strate
herbacée fut échantillonnée. A partir du centre de
placette, nous avons effectué un prélèvement dans la
direction des quatre points cardinaux à une distance de 5 mètres
du centre. Sur chacun de ces quatre points, un carré de 50x50 cm a
été prélevé, ce qui représente donc, par
placette, une surface totale échantillonnée de 1
m2.
Cependant, étant donné que les savanes herbeuses
n'étaient pas comprises dans les placettes de peuplement, elles ont
été rajoutées dans l'inventaire du
prélèvement de la biomasse. En effet, chacune des savanes est
fauchée et brûlée chaque année. Quelques arbres y
subsistent, et ce, généralement sur des hautes
termitières. Les points de prélèvement de biomasse ont
été arbitrairement décidés afin d'avoir, par
savane, un prélèvement dans :
? une zone non fauchée et non brûlée ;
? une zone fauchée non brûlée ;
? une zone fauchée et brûlée.
Une surface de 1 m2 était ensuite
échantillonnée sur chacune de ces zones.
La biomasse récoltée va être
comparée également aux dégâts présents. Cette
dernière a tout d'abord été séchée en
étuve à 60 °C pendant 72 heures. Elle a ensuite
été pesée afin d'obtenir sa teneur en MS. Les
échantillons ont été broyés à 1 mm afin
d'être soumis à une analyse SPIR (spectroscopie proche infrarouge,
en anglais : NIRS). L'analyse SPIR a été réalisée
au CRAW. C'est une technique d'analyse révélant la composition
chimique des aliments et des matières ; elle est
régulièrement utilisée dans les analyses de fourrages ou
de matières fécales en élevage (Bertrand 2002). Nous
l'utiliserons pour les paramètres suivants : les matières
protéiques totales, les cendres totales, la matière sèche,
les teneurs en cellulose, hémicellulose et lignine et la
digestibilité. Le taux d'azote et la teneur en matière organique
seront déduits respectivement des protéines et des cendres
totales.
Ces valeurs ont été calculées à
partir d'une base de données pour les herbes tropicales. Les
caractéristiques des bases de données mobilisées sont
données dans le tableau 7. Seule la digestibilité selon la
méthode Aufrère a été calculée sur la base
de données fourrages tempérés.
25
Tableau 6 : Caractéristiques de la base de
donnée SPIR mobilisée IN : nombre d'échantillons, Min. :
minimum, Max.
: maximum, SEC : standard error of calibration, R2
: coefficient de détermination, SECV : standard error of
cross
validation]
|
Constituant
|
N
|
Moyenne
|
Ecart-
type
|
Min
|
Max
|
SEC
|
R2
|
SECV
|
|
MPT
|
Matières protéiques totales
|
721
|
9.9
|
5.4
|
0.0
|
26.1
|
0.6
|
1.0
|
0.7
|
|
CB
|
Cellulose brute
|
502
|
30.4
|
7.5
|
7.9
|
53.0
|
1.3
|
1.0
|
1.4
|
|
CT
|
Cendres totale
|
721
|
8.8
|
3.3
|
0.0
|
18.6
|
0.9
|
0.9
|
1.0
|
|
MS
|
Matière sèche
|
498
|
87.5
|
18.8
|
31.1
|
143.8
|
6.9
|
0.9
|
7.6
|
|
ADF
|
Acid Detergent
Fiber
(Cellulose+lignine)
|
408
|
35.8
|
6.5
|
16.5
|
55.2
|
1.4
|
1.0
|
1.6
|
|
NDF
|
Neutral Detergent
Fiber (Cellulose +
hémicellulose
+
lignine)
|
400
|
65.3
|
11.7
|
30.3
|
100.2
|
2.1
|
1.0
|
2.3
|
|
ADL
|
Lignine
|
350
|
5.9
|
2.9
|
0.0
|
14.4
|
0.7
|
0.9
|
0.8
|
|
DMSauf
|
Digestibilité
enzymatique de la
MS selon
la
méthode de M.
Aufrère
|
1772
|
73.6
|
10.2
|
43.0
|
104.1
|
2.3
|
0.9
|
2.4
|
4.2.4. Les données environnementales
Les données édaphiques ont été
inventoriées par Denis Maekelbergh (étudiant en 2ème
master à Gembloux Agro-Bio Tech), en vue de son travail de fin
d'études. Il a effectué un échantillonnage
systématique sur des transects mis en place au sein de la
réserve. Ces transects sont parties du point culminant de la zone et se
composaient de 5 transects radiaux. D'autres transects ont été
rajoutés afin de combler les manques visuels. Le long de ces transects,
un sondage à la tarière était effectué tous les 240
mètres, ce qui nous a donné un nombre total de 53 points
d'échantillonnage. Pour chacun de ces sondages, pouvant aller
jusqu'à 1,20 mètres de profondeur, les paramètres suivants
étaient relevés : texture, humidité, charge caillouteuse,
couleur et profondeur. A partir de ces données, un classement des points
a été effectué et leur extrapolation a conduit à
une carte des paramètres physiques des sols sur l'ensemble de la zone
d'étude.
Les différentes périodes de feux dans la
réserve n'ont pu être observées sur le terrain. Les
périodes indiquées dans ce travail résultent d'un
entretien avec le gestionnaire de la réserve.
4.2.5. Les circuits d'observation de la grande
faune
Les circuits d'observation de la grande faune ont
été effectués par Julie Linchant, étudiante en
2ème master à Gembloux Agro-Bio Tech, en vue de son
travail de fin d'études. Les inventaires ont été
divisés en deux parties. La partie principale concerne la zone
située au sud de la rivière Kiswishi qui traverse le sanctuaire.
Cette rivière rend l'accès à la zone nord difficile
à la majorité des espèces et celle-ci est beaucoup plus
petite. Cette zone n'a donc pas subi le même effort
d'échantillonnage.
26
La création des circuits s'est basée sur la
même carte de végétation que celle utilisée pour ce
travail. Deux circuits ont été créés pour la zone
principale de manière à traverser la plupart des types de
végétation dans une proportion la plus égale possible. Ces
deux circuits ont été parcourus chacun pour 5 périodes de
la journée avec 4 répétitions. A chaque observation, les
données suivantes étaient relevées : espèce
animale, nombre d'individus, coordonnées géographiques de
l'observateur, distance et angle de la position de l'observateur par rapport
à celle de l'observation et activité. La petite zone nord, elle,
n'a pas fait l'objet d'autant d'observation. Pour chacune des 2 saisons, un
seul circuit a été parcouru à l'aube et à trois
reprises. Les mêmes informations ont été notées
ainsi que l'observation des traces, peu de présence directe étant
observée.
Chaque observation a ensuite été replacée
sur la carte de végétation. Ces observations seront
comparées avec les dégâts sur la flore relevés dans
l'inventaire de la végétation
4.3. Analyse des données
4.3.1. Caractérisation des communautés
floristiques Classification en communautés floristiques
Afin de réaliser la classification en
communautés floristiques, une ordination a été
effectuée avec le logiciel R. Selon le type de facteurs et le maintien
de la distance souhaitée, les méthodes d'ordination vont
être différentes. Il existe des cas où le maintien des
distances exactes entre objets n'est pas la priorité. L'objectif est de
représenter les objets dans un espace à peu de dimensions (2-3
par exemple). Le but dans ce cas est de placer les objets dissemblables les
plus éloignés possible et les semblables le plus proche possible
les uns des autres ; cette méthode est appelée «
nonmetric multidimensional scaling » (NMDS). Les axes
résultant de cette méthode sont donc arbitraires, il ne
représente rien de concret (Legendre and Legendre 1998). C'est cette
méthode NMDS que nous allons utiliser. L'ACP n'est pas réalisable
pour notre jeu de données car le nombre de 0 dans nos données
d'abondance est trop important.
Tableau 7 : Format du jeu de données en vue
d'une utilisation du logiciel R
|
sp.A sp.A sp.A sp.B sp.B sp.B
arbustive arborée dominante arbustive arborée
dominante
|
|
Placette_1
Placette_2
Placette_3
|
Contribution spécifique
|
Chaque espèce est traitée différemment
selon les strates : l'espèce A sera considérée
séparément selon la strate arbustive (inférieure à
7 m de hauteur), la strate arborée dominée (entre 7 et 14 m de
hauteur) et la strate arborée dominante (supérieure à 14 m
de hauteur). Les hauteurs choisies sont un mètre inférieures
à ce qui est reporté dans la majorité de la
27
littérature à ce sujet (Smith and Allen 2004) :
ce choix est dû au jeune âge de la zone d'étude. Ensuite, le
nombre de pieds de chaque espèce par placette sera divisé par le
nombre total de pieds présents dans la placette afin de se baser sur la
contribution spécifique de chaque espèce dans chaque placette.
Ces données d'abondance subiront pour finir une transformation
logarithmique [log(x+1)] afin de prendre en compte la contribution des
espèces peu abondantes à la variation floristique des
communautés. Le format des données est présenté au
tableau 7.
Dans cette analyse, le « coefficient de
dissimilarité Bray-Curtis » sera utilisé (Legendre and
Legendre 1998). L'avantage de ce coefficient est que les dissimilarités
entre les espèces abondantes contribuent de la même manière
que celles entre les espèces rares, ce qui est particulièrement
intéressant lorsqu'on travaille avec des données
normalisées d'abondance spécifique (pour des informations
complémentaires, voir Bray and Curtis 1957; Legendre and Legendre 1998;
Clarke, Somerfield et al. 2006).
La fonction utilisée dans R pour l'ordination est la
suivante (database = le jeu de données ; k = le nombre
de dimension de l'espace, dist = le coefficient de distance
utilisé, trymax = le nombre maximal de runs que le logiciel
doit exécuter, x et y sont décidés par
l'opérateur) :
metaMDS (database, k=x, dist= "bray", trymax=y)
Cette fonction va nous donner une répartition des
parcelles dans un espace à 2 dimensions, ainsi que si souhaité,
les coordonnées (scores) de chaque point dans cet espace.
A partir de ces coordonnées, un regroupement de
placettes (clustering) va être effectué à l'aide
de la méthode K-means dans le logiciel R. La fonction que cette
méthode tente de minimiser est présentée à
l'équation 1 : la somme du carré des écarts
(EK2). Elle calcule la distance de chaque objet d'un groupe
au centroïde de ce même groupe ; le centroïde d'un groupe
d'objets peut être défini comme l' « objet-type » du
groupe (Legendre and Legendre 1998).
Équation 1 : Equation de la méthode
K-means
? ek2 = la somme au carré des distances
séparant chaque objet d'un groupe k du centroïde de ce même
groupe
? yij (k) = descripteur (axe) yj pour l'objet i du groupe k
? mj(k) = valeur moyenne du descripteur j parmi tous
les membres du groupe k
La formule que nous allons utiliser dans R est la suivante
(x et y = respectivement nombre minimal et nombre maximal de
groupes, iter = nombre d'itérations, criterion =
critère pour déterminer la meilleure option8) :
cascadeKM(scores, x, y, iter = 100, criterion =
'calinski')
8 Par défaut, le critère utilisé
dans R est le critère de Calinski-Harabasz (`calinski'). Il est possible
d'utiliser le « simple structure index » (`ssi').
28
Espèces indicatrices et espèce
abondantes des communautés floristiques
La détermination des espèces abondantes est un
indicateur asymétrique : leur présence ne peut pas être
prédite dans tous les sites du groupe mais elles contribuent à la
spécificité de ce dernier. Les espèces indicatrices quant
à elles sont un indicateur symétrique : leur présence
contribue à la spécificité de la communauté et
celle-ci peut prédire la présence de ces espèces
(Dufrêne 2004). Un bonne espèce indicatrice devrait être
trouvée principalement dans une communauté d'une typologie
particulière et être présente sur toutes les parcelles de
celle-ci (Legendre and Legendre 1998).
Pour définir les espèces indicatrices, nous
allons calculer l'indice IndVal (indicator value index) via le
logiciel IndVal9. Cet indice se base uniquement sur la comparaison
des fréquences et des abondances au sein d'une espèce ; sa valeur
n'est donc pas influencée par l'abondance des autres espèces
(Legendre and Legendre 1998). L'indice combine l'abondance relative de
l'espèce avec sa fréquence relative d'occurrence dans les
différents groupes. Sa formule est présentée à
l'équation 2 (Dufrêne 2004).
Équation 2 : Equations utilisées par le
logiciel IndVal
? Nij = nombre moyen d'individus de l'espèce i dans le
groupe j
? Ni = somme des nombres moyens d'individus de l'espèce i
parmi tous les
groupes
? Nij = nombre de sites du groupe j où l'espèce i
est présente
? Ni = nombre total de sites dans le groupe j
? IndValij = indice IndVal pour l'espèce i du groupe j
Dans ces équations (équation 2), Aij
représente donc en réalité une mesure de
spécificité, alors que Bij est une mesure de
fidélité10.
L'indice est maximal (100 %) lorsque tous les spécimens
d'une même espèce se situent dans un seul groupe de parcelles et
quand cette espèce est présente dans toutes les parcelles d'un
même groupe (Legendre and Legendre 1998; Dufrêne 2004).
Afin d'avoir également les espèces abondantes de
chaque communauté, un simple calcul d'abondance relative du nombre de
pieds de l'espèce i pour communauté sera effectué.
Les espèces indicatrices et les espèces
abondantes seront donc déterminées pour chaque communauté
et pour les trois modalités suivantes : le peuplement par strate, le
peuplement global et la régénération.
9 Disponible sur le site
http://old.biodiversite.wallonie.be/outils/indval/
10 Affinité d'une espèce de plante pour
une association végétale
29
4.3.2. Structure des communautés
Pour caractériser la structure des différentes
communautés, plusieurs paramètres dendrométriques vont
être calculés (tableau 8). Ces paramètres vont être
calculés pour chaque placette et leurs moyennes, ainsi que leurs
coefficients de variation vont être calculés par
communauté. Les formules de chacun de ces paramètres, ainsi que
les modalités de mesures, sont reprises dans Rondeux (1999).
Tableau 8 : Paramètres dendrométriques
mesurés en vue de la caractérisation des communautés
végétales arborées
de la réserve de
Mikembo
|
Paramètre
|
Acronyme
|
Définition
|
|
Surface terrière par hectare
|
GHA
|
Somme des surfaces terrières de chaque tige de la
placette, extrapolée sur un hectare
|
|
Nombre de pieds par hectare
|
NHA
|
Nombre de pieds de la placette, extrapolé sur un
hectare
|
|
Nombre moyen de tiges par pied
|
NT
|
Moyenne du nombre de tiges par pieds de la placette
|
|
Hauteur moyenne
|
Hmoy
|
Moyenne arithmétique des hauteurs triées par
classes de grosseur (et tenant compte de la fréquence de pieds par
classe)
|
|
Hauteur dominante
|
Hdom
|
Hauteur moyenne de 20% des arbres les plus gros
|
|
Tige de diamètre moyen
|
Dmoy
|
Moyenne des diamètres, triés par classes de
grosseur (et tenant compte de la fréquence de pieds par classe)
|
|
Nombre de pieds de régénération par
hectare
|
NHA
(régé)
|
Nombre de pieds de régénération de la
placette, extrapolé sur un hectare
|
|
Hauteur moyenne de la régénération
|
Hmoy
(régé)
|
Hauteur moyenne d'un pied de régénération
|
Il existe plusieurs écoles pour calculer la hauteur
dominante d'un peuplement (Rondeux 1999). Vu
l'hétérogénéité des communautés dans
ce cas-ci, la hauteur dominante sera calculée à partir de la
hauteur moyenne de 20 % des arbres les plus gros.
D'autres paramètres vont également être
calculés pour caractériser au mieux les communautés
(tableau 9).
Par communauté, les graphiques correspondant aux
distributions des pieds par classes de diamètre vont être
établis, toutes espèces confondues. Ceux-ci vont être
également appliqués par espèce au sein de chaque
communauté, uniquement pour les espèces des genres connus pour
présenter un intérêt dans la dynamique du miombo : les
Brachystegia spp., les Julbernardia spp., les Uapaca
spp. et Marquesia
macroura.
30
Tableau 9 : Paramètres caractérisant les
communautés
|
Paramètre
|
Acronyme
|
Définition
|
|
Pourcentage de
régénération par graine
|
Pgr.
|
Pourcentage du nombre de pied régénérant par
graine par rapport au nombre de pieds total de la placette
|
|
Pourcentage de
régénération sur souche
|
Pso.
|
Pourcentage du nombre de pied régénérant
par souche par rapport au nombre de pieds total de la placette
|
|
Pourcentage de régénération sur tronc
|
Ptr.
|
Pourcentage du nombre de pied régénérant par
tronc par rapport au nombre de pieds total de la placette
|
|
Pourcentage de dégâts
|
Pdeg.
|
Pourcentage du nombre de pied présentant un
dégât par rapport au nombre de pieds total de la placette
|
|
Couvert de la strate dominante
|
CD
|
Estimation en % de la placette
|
|
Couvert de la strate dominée
|
Cd
|
Estimation en % de la placette
|
|
Couvert de la strate herbacée
|
Ch
|
Estimation en % de la placette
|
|
Nombres d'arbres morts
|
Amor.
|
Comptage des arbres morts de la placette
|
|
Hauteur moyenne de la strate herbacée
|
Ht.herb.
|
Moyenne des 4 mesures prises par placette
|
Pour finir, nous allons évaluer l' « effet de la
communauté » sur les différents paramètres des
placettes en exécutant une analyse de la variance à 1 facteur, le
facteur dépendant ici est la communauté. Si les moyennes
résultant de cette analyse sont significativement différentes,
nous ferons une structuration de moyenne en utilisant la méthode de
Newman-Keuls avec le logiciel Statistica.
4.3.3. Influence des paramètres
édaphiques
Les paramètres environnementaux qui vont être
pris en compte sont la couleur, la profondeur et la présence d'une
charge caillouteuse du sol. Ces paramètres ont été
décrits par Denis Maekelbergh (étudiant en 2ème
master à Gembloux Agro-Bio Tech) en vue de son travail de fin
d'études. Les espèces indicatrices vont être
déterminées pour chaque couleur, chaque profondeur et en cas de
présence de charge caillouteuse ou non.
4.3.4. Caractérisation des dégâts
effectués par la grande faune
Placettes et espèces
impactées
Sur chaque placette, le nombre de tiges impactées par
pied a été répertorié. Le pourcentage de pieds
impactés par rapport au nombre de pieds total par placette va être
calculé. La carte de répartition des dégâts a
été réalisée en attribuant une valeur à
chaque placette. Cette valeur correspond au pourcentage de dégâts
inventoriés au sein de chaque placette. L'outil « kriging (sa)
» du logiciel Arcgis 9.3 a été utilisé pour la
réalisation de cette carte. Cet outil extrapole ces valeurs à
l'ensemble de la zone et produit un raster.
Toutes placettes confondues, le pourcentage de pieds
impactés d'une espèce par rapport au nombre de pieds total de
cette espèce à travers toute la zone d'étude va être
calculé. Cependant, pour éviter que certaines espèces
n'apparaissant qu'une fois dans l'inventaire et
31
étant impactées, comptabilisent 100 % de
dégâts, nous allons limiter cette analyse aux espèces
possédant plus de 5 pieds et étant présentes au minimum
dans quatre placettes.
Lien avec les paramètres des
placettes
Nous allons diviser cette analyse en deux parties : les
facteurs « explicatifs » et les facteurs « expliqués
» (ou « dépendants »). Les paramètres ayant
été considérés comme facteurs pouvant expliquer
l'importance des dégâts sont les suivants : le GHA, le NHA, les
recouvrements des différents couverts, la hauteur moyenne de la strate
herbacée, les hauteurs moyenne et dominante et le diamètre moyen.
Les paramètres pouvant être expliqués par l'importance des
dégâts sont : la richesse spécifique du peuplement, le
nombre de tige par pied, la richesse spécifique de la
régénération, le NHA de la
régénération, la hauteur moyenne de la
régénération et à nouveau, la hauteur de la strate
herbacée. Cependant, celle-ci ne sera analysée qu'une fois, en
tant que facteur expliqué.
Les paramètres résultants de l'analyse SPIR vont
également être analysés. Ils seront
considérés comme facteurs explicatifs, sauf le poids en
matières sèches, qui sera considéré comme facteur
expliqué. Le taux d'azote n'y est pas indiqué mais il est
corrélé avec le taux de protéine (N = MPT/6.25). Il en est
de même pour la teneur en matières organiques, celle-ci est
corrélée avec les cendres totales (MO = 1-CT).
Sur base de ces hypothèses, entre ces facteurs et le
pourcentage de dégâts, des régressions, soit
linéaires soit exponentielles, seront calculées, et ce, pour
toutes les p-valeur significatives (p>0.05).
Lien avec un inventaire pédestre de la
grande faune effectué à la même
période
Les observations faites lors des circuits, ainsi que le nombre
d'animaux lors de chaque observation, ont été rassemblés
et replacés sur la carte de répartition des impacts
établie sur base des dégâts.
32
5. Résultats
5.1. Résultat de l'inventaire
Dix-neuf formations végétales ont
été identifiées a priori sur la zone
d'étude (figure 9), couvrant ensemble 413 ha sur 442 ha. Sur ces 413 ha,
69 parcelles de 18 mètres de rayon ont été mises en place,
ce qui signifie que l'effort d'échantillonnage est de 1.7 %.
Tableau 10 : Parcelles inventoriées par
formation végétale dans la réserve de Mikembo
|
Formations végétales
|
Acronymes
|
Surface
(ha)
|
Nombre de placettes
|
|
Forêt à Brachystegia spp.
|
F-B
|
16.5
|
6
|
|
Forêt à Brachystegia boehmii
|
F-Bb
|
46.9
|
4
|
|
Forêt à Julbernardia spp.
|
F-J
|
30.8
|
6
|
|
Forêt à Julbernardia paniculata
|
F-Jp
|
26.2
|
4
|
|
Forêt à Marquesia - Brachystegia
|
F-MB
|
8.1
|
4
|
|
Forêt à Marquesia - Julbernardia
|
F-MJ
|
62.8
|
4
|
|
Forêt à Uapaca - Julbernardia
|
F-UJ
|
12.8
|
3
|
|
Forêt à Uapaca en mélange
|
F-U
|
33.7
|
4
|
|
Forêt à Marquesia
|
F-M
|
11.8
|
4
|
|
Forêt de transition
|
Ft
|
19.7
|
3
|
|
Forêt mélangée
|
Fm
|
1.5
|
1
|
|
Savane à Uapaca spp.
|
S-U
|
5.9
|
3
|
|
Savane arborée (ancien champs d'arachides)
|
SA-chps
|
1.6
|
0
|
|
Savane arborée (en zone humide)
|
SA-zh
|
30.2
|
6
|
|
Savane arborée (pénéplaine)
|
SA-pp
|
18
|
3
|
|
Savane arborée (sur argile)
|
SA-arg
|
1.4
|
2
|
|
Savane arborée à Acacia polyacantha
|
SA-Ap
|
3.3
|
1
|
|
Savane boisée à Terminalia sp.
|
SB-T
|
43.3
|
9
|
|
Savane herbeuse
|
SH
|
39.1
|
1
|
|
TOTAL
|
413.6
|
69
|
Certains changements sont apparus au fur et à mesure du
terrain. Les savanes herbeuses étant, comme précisé
précédemment, annuellement fauchées et
brûlées, celles-ci n'étaient pas initialement
prévues dans les inventaires. Cependant, l'une d'entre elles a tout de
même été inventoriée, car elle était plus une
savane arbustive qu'une savane herbeuse. Le champ d'arachides, étant
plus une savane herbeuse avec une végétation particulière
mais sans ligneux n'a finalement pas été inventorié.
Certaines zones ont également eu plus d'UE inventoriées, soit
dû à la première stratégie mise en place, soit
dû au fait que, sur le terrain, les placettes aléatoirement
placées ne correspondaient pas à la communauté ; nous
avons donc du mettre en place des placettes exemplatives de la
communauté visée (cas de F-M et F-MB). Le nombre de parcelles
inventoriées par formations est repris au tableau 10.
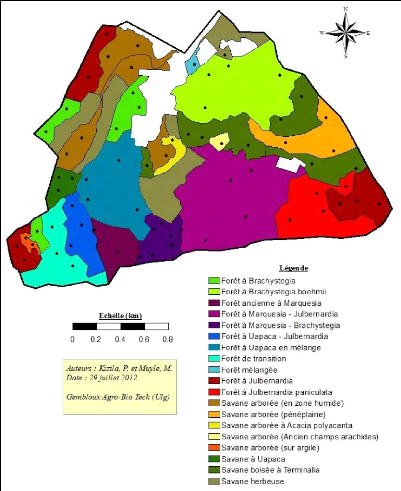
33
Figure 9 : Carte des formations végétales
dans la réserve de Mikembo et localisation des placettes
d'échantillonnage pour la caractérisation des
peuplements.
La liste complète des espèces inventoriées
est reprise aux annexes A.4. et A.5.
34
5.2. Caractérisation des communautés
5.2.1. Caractérisation floristique
L'analyse NMDS dans R a tout d'abord
révélé 6 groupes de placettes (figure 10).
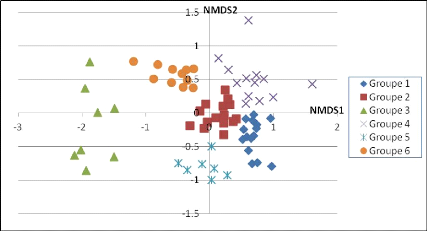
Figure 10: résultat de l'analyse
multivariée de type NMDS dans R sur les 69 placettes de
l'étude
La répartition des différentes placettes dans
les groupes est reprise au tableau 11. Nous constatons que les savanes
boisées sont reprises dans le groupe 6, les savanes arborées dans
le groupe 3 et les peuplements à Brachystegia boehmii dans le
groupe 5. Par rapport aux formations végétales que nous avons
établies au départ, les groupes 3 et 5 restent cohérents,
sauf la zone humide SA-zh qui finalement se retrouve en groupe 6 et la zone que
nous pensions être une savane à Terminalia (SB-T6 et
SB-T7) qui est en réalité une zone de
régénération à Brachystegia boehmii.
Celui-ci réunit de nombreuses savanes arborées, principalement
à Terminalia. Dans le groupe 4, nous retrouvons beaucoup de
formations à Julbernardia, mais également les
Marquesia-Brachystegia, ce qui est plus étonnant. Les groupes
1,2 et 4 restant peu différenciés, nous allons effectuer une
analyse NMDS ne portant que sur ces trois groupes.
35
Tableau 11 : Répartition des 69 placettes en 6
groupes résultant de l'analyse NMDS réalisée dans
R
|
Groupe 1
|
Groupe 2
|
Groupe 3
|
Groupe 4
|
Groupe 5
|
Groupe 6
|
|
F-B6
|
F-B1
|
SA-pp1
|
F-J1
|
F-Bb1
|
SA-Ap1
|
|
F-J4
|
F-B2
|
SA-pp2
|
F-J2
|
F-Bb2
|
SA-arg1
|
|
F-J7
|
F-B3
|
SA-pp3
|
F-J3
|
F-Bb3
|
SA-arg2
|
|
F-M2
|
F-B6
|
SB-T4
|
F-Jp1
|
F-Bb4
|
Fm1
|
|
F-MB4
|
F-M1
|
SA-zh1
|
F-Jp2
|
F-B4
|
SB-T1
|
|
F-MJ1
|
F-M3
|
SA-zh4
|
F-Jp3
|
SB-T6
|
SB-T2
|
|
F-MJ2
|
F-M4
|
SA-zh5
|
F-Jp4
|
SB-T7
|
SB-T3
|
|
F-MJ3
|
S-U1
|
SA-zh6
|
F-J5
|
|
SH1
|
|
F-UJ1
|
S-U2
|
|
F-J6
|
|
SB-T1
|
|
F-UJ2
|
S-U3
|
|
F-MB1
|
|
SB-T8
|
|
F-UM3
|
SB-T9
|
|
F-MB2
|
|
SA-zh2
|
|
F-UM4
|
F-UJ3
|
|
F-MB3
|
|
|
|
Ft1
|
F-U1
|
|
F-MJ4
|
|
|
|
Ft2
|
F-U2
|
|
|
|
|
|
Ft3
|
SA-zh3
|
|
|
|
|
L'analyse NMDS a donc été reconduite avec les
placettes des groupes 1, 2 et 4, c'est-à-dire 44 placettes. Le
résultat a été une répartition en 4 groupes et une
placette isolée (figure 11).
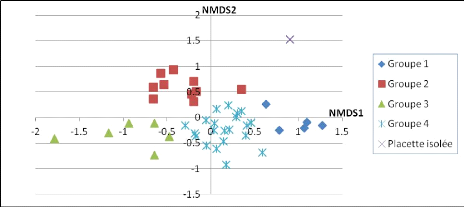
Figure 11 : Résultat de l'analyse
multivariée de type NMDS dans R sur les 44 placettes de
forêts
La répartition des placettes dans les
différentes classes est reprise au tableau 12. La placette F-J3 ayant un
peuplement totalement atypique, voire proche du muhulu, nous l'avons
retiré de l'étude pour la suite des analyses. Dans le groupe 2,
nous observons clairement un groupe à Julbernardia. Le groupe 1
comprend toute la formation « forêt de transition » (Ft) ainsi
qu'une placette de forêt mélangée à Uapaca
spp. (F-U) ; nous pouvons donc nous douter que ce groupe comprend des
forêts mélangées. Dans le groupe 3, nous avons 4 placettes
de formations à Marquesia, nous sommes sans doute en
présence d'un groupe de forêts plus anciennes. Le groupe 4 reprend
le reste des forêts. Nous constatons que certaines formations y
retrouvent la quasi-intégralité de leurs placettes : des zones
à Brachystegia, les zones à Marquesia
(même si nous nous sommes rendus compte sur le terrain que F-M1 et
F-M2
36
étaient plus proches d'une forêt
mélangée que d'une forêt ancienne), les savanes à
Uapaca, plus denses que prévues et les forêts à
Uapaca-Julbernardia. La composition en espèces va nous aider
pour une caractérisation plus précise.
Tableau 12 : Répartition des placettes en 5
groupes, résultant de la seconde analyse NMS
|
Groupe 1
|
Groupe 2
|
Groupe 3
|
Groupe 4
|
Placette
isolée
|
|
F-B6
|
F-J1
|
F-B2
|
F-B1
|
S-U1
|
F-J3
|
|
F-U4
|
F-J2
|
F-M3
|
F-B2
|
S-U2
|
|
|
Ft1
|
F-Jp1
|
F-MB1
|
F-B3
|
S-U3
|
|
|
Ft2
|
F-Jp2
|
F-MB2
|
F-J4
|
SB-T9
|
|
|
Ft3
|
F-Jp3
|
F-MB3
|
F-J7
|
F-UJ1
|
|
|
F-Jp4
|
F-U1
|
F-M1
|
F-UJ2
|
|
|
F-J5
|
|
F-M2
|
F-UJ3
|
|
|
F-J6
|
|
F-M4
|
F-U2
|
|
|
F-MJ3
|
|
F-MB4
|
F-U3
|
|
|
F-MJ4
|
|
F-MJ1
|
SA-zh3
|
|
|
|
|
F-MJ2
|
|
|
Les groupes 1,3 et 6 de la première analyse, ainsi que
le groupe 4 de la seconde analyse ont été remis, groupe par
groupe, pour une dernière analyse NMDS. Il en est ressorti que, à
part pour le groupe 3 de la première analyse (les savanes
arborées des zones humides), séparer ces placettes étaient
inutiles et/ou non pertinent. La répartition définitive des
groupes est reprise au tableau 13.
Tableau 13 : Répartition finale des placettes en
9 groupes, à la suite des analyses NMDS
|
Groupe
1
|
Groupe
2
|
Groupe
3
|
Groupe
4
|
Groupe
5
|
Groupe
6
|
Groupe
7
|
Groupe
8
|
Groupe
9
|
|
F-B6
|
F-J1
|
F-B2
|
SA-Ap1
|
F-B1
|
S-U1
|
SA-pp1
|
SA-zh1
|
F-Bb1
|
F-J3
|
|
F-U4
|
F-J2
|
F-M3
|
SA-arg1
|
F-B2
|
S-U2
|
SA-pp2
|
SA-zh4
|
F-Bb2
|
|
|
Ft1
|
F-Jp1
|
F-MB1
|
SA-arg2
|
F-B3
|
S-U3
|
SA-pp3
|
SA-zh5
|
F-Bb3
|
|
|
Ft2
|
F-Jp2
|
F-MB2
|
Fm1
|
F-J4
|
SB-T9
|
SB-T4
|
SA-zh6
|
F-Bb4
|
|
|
Ft3
|
F-Jp3
|
F-MB3
|
SB-T1
|
F-J7
|
F-UJ1
|
|
|
F-B4
|
|
|
F-Jp4
|
F-U1
|
SB-T2
|
F-M1
|
F-UJ2
|
|
|
SB-T6
|
|
|
F-J5
|
|
SB-T3
|
F-M2
|
F-UJ3
|
|
|
SB-T7
|
|
|
F-J6
|
|
SH1
|
F-M4
|
F-U2
|
|
|
F-Bb1
|
|
|
F-MJ3
|
|
SB-T1
|
F-MB4
|
F-U3
|
|
|
|
|
|
F-MJ4
|
|
SB-T8
|
F-MJ1
|
SA-zh3
|
|
|
|
|
|
|
|
SA-zh2
|
F-MJ2
|
|
|
|
|
|
Avant de caractériser les différentes
communautés, nous allons procéder à la
détermination des espèces abondantes et des espèces
indicatrices pour chaque groupe. L'analyse va être effectuée trois
fois par groupe : le peuplement classé en strates, le peuplement entier
et la régénération. Les résultats sont repris aux
tableaux 14 et 15. Le tableau 14 reprend les trois espèces les plus
abondantes par groupe. Le tableau 15 reprend les espèces
significativement indicatrices des groupes (selon Indval).
37
Tableau 14 : Abondance relative des espèces dans
les 8 groupes déterminés à la suite de l'analyse
NMDS
|
Groupe
|
Peuplement par strate
|
Peuplement
|
Régénération
|
|
Espèce
|
Abondance
(%)
|
Espèce
|
Abondance
(%)
|
Espèce
|
Abondance
(%)
|
|
1
|
Uapaca nitida arbu.
|
36.09
|
Uapaca nitida
|
39.64
|
Uapaca nitida
|
30.46
|
|
Uapaca pilosa arbu.
|
9.17
|
Uapaca sansibarica
|
11.54
|
Julbernardia globiflora
|
19.76
|
|
Uapaca sansibarica arbu.
|
8.28
|
Uapaca pilosa
|
9.47
|
Uapaca pilosa
|
9.06
|
|
2
|
Julbernardia paniculata arbu.
|
20.10
|
Julbernardia paniculata
|
43.13
|
Julbernardia globiflora
|
28.66
|
|
Julbernardia paniculata arbo.
|
17.22
|
Diplorhynchus condylocarpon
|
6.97
|
Julbernardia paniculata
|
15.67
|
|
Julbernardia paniculata dom.
|
5.81
|
Julbernardia globiflora
|
5.95
|
Diplorhynchus condylocarpon
|
5.52
|
|
3
|
Pterocarpus tinctorius arbu.
|
11.40
|
Pterocarpus tinctorius
|
13.54
|
Dalbergia boehmii
|
34.97
|
|
Pseudolachnostylis maprouneifolia arbu.
|
6.89
|
Diplorhynchus condylocarpon
|
12.35
|
Brachystegia boehmii
|
22.31
|
|
Dalbergia boehmii arbu.
|
6.18
|
Pseudolachnostylis maprouneifolia
|
9.98
|
Brachystegia spiciformis
|
5.06
|
|
4
|
Combretum acutifoliosum arbu.
|
34.44
|
Combretum acutifolium
|
36.94
|
Dalbergia boehmii
|
20.70
|
|
Terminalia sp. arbu.
|
12.36
|
Terminalia sp.
|
18.33
|
Combretum acutifolium
|
18.03
|
|
Dalbergia boehmii arbu.
|
8.47
|
Dalbergia boehmii
|
9.44
|
Terminalia sp.
|
11.27
|
|
5
|
Julbernardia globiflora arbu.
|
22.39
|
Julbernardia globiflora
|
26.26
|
Julbernardia globiflora
|
51.40
|
|
Dalbergia boehmii arbu.
|
6.67
|
Dalbergia boehmii
|
7.91
|
Dalbergia boehmii
|
6.79
|
|
Diplorhynchus condylocarpon arbu.
|
5.64
|
Diplorhynchus condylocarpon
|
7.63
|
Brachystegia spiciformis
|
4.59
|
|
6
|
Acacia sp. arbu.
|
28.26
|
Acacia sp.
|
36.96
|
Antidesma venosum
|
36.76
|
|
Piliostigma thonningii arbu.
|
21.74
|
Acacia polyacantha
|
23.91
|
Markhamia obtusifolia
|
26.47
|
|
Acacia polyacantha arbo.
|
13.04
|
Piliostigma thonningii
|
21.74
|
Terminalia sp.
|
25.00
|
|
7
|
Acacia polyacantha arbo.
|
41.38
|
Acacia polyacantha
|
89.66
|
Acacia polyacantha
|
54.55
|
|
Acacia polyacantha arbu.
|
36.21
|
Markhamia obtusifolia
|
3.45
|
Harungana madagascariensis
|
45.45
|
|
Acacia polyacantha dom.
|
12.07
|
Allophylus africanus
|
1.72
|
|
|
8
|
Brachystegia boehmii arbu.
|
36.76
|
Brachystegia boehmii
|
62.50
|
Brachystegia boehmii
|
57.25
|
|
Brachystegia boehmii arbo.
|
23.39
|
Brachystegia longifolia
|
7.30
|
Uapaca nitida
|
7.79
|
|
Brachystegia longifolia arbu.
|
4.08
|
Pseudolachnostylis maprouneifolia
|
4.08
|
Phyllocosmus lemerianus
|
6.76
|
38
Tableau 15 : Espèces indicatrices de chaque groupe
déterminé à la suite de l'analyse NMDS
|
Groupe
|
Peuplement par strate
|
Peuplement
|
Régénération
|
|
Espèce
|
IV (%)
|
Espèce
|
IV (%)
|
Espèce
|
IV (%)
|
|
1
|
Uapaca nitida arbu.
|
88.55
|
Uapaca nitida
|
86.71
|
Monotes katangensis
|
77.68
|
|
Uapaca sansibarica arbu.
|
80.38
|
Uapaca sansibarica
|
78.02
|
Uapaca nitida
|
73.32
|
|
Uapaca pilosa arbu.
|
73.68
|
Uapaca pilosa
|
74.09
|
Parinari curatellifolia
|
69.5
|
|
Monotes katangensis arbu.
|
71.04
|
Monotes katangensis
|
66.76
|
Uapaca pilosa
|
58.55
|
|
Uapaca sansibarica arbo.
|
57.32
|
|
|
|
Uapaca nitida arbo.
|
57.27
|
|
2
|
Julbernardia paniculata arbo.
|
88.99
|
Julbernardia paniculata
|
89.07
|
Julbernardia paniculata
|
77.45
|
|
Julbernardia paniculata arbu.
|
88.87
|
|
|
|
Julbernardia paniculata dom.
|
70
|
|
3
|
Annona senegalensis arbo.
|
54.43
|
|
Dalbergia boehmii
|
37.68
|
|
Diplorhynchus condylocarpon arbo.
|
40.62
|
|
|
4
|
Combretum acutifoliosum arbu.
|
94.79
|
Combretum acutifoliosum
|
93.08
|
Combretum acutifolium
|
69.03
|
|
Terminalia sp. arbu.
|
74.91
|
Terminalia sp.
|
74.72
|
|
|
5
|
Julbernardia globiflora arbu.
|
73.98
|
Julbernardia globiflora
|
65.37
|
Julbernardia globiflora
|
55.02
|
|
6
|
Piliostigma thonningii arbu.
|
62.45
|
|
Piliostigma thonningii
|
43.26
|
|
7
|
Acacia polyacantha arbu.
|
78.19
|
Acacia polyacantha
|
72.08
|
|
|
Acacia polyacantha arbo.
|
53.24
|
|
|
8
|
Brachystegia boehmii arbo.
|
94.86
|
Brachystegia boehmii
|
91.67
|
Brachystegia boehmii
|
84.8
|
|
Brachystegia boehmii arbu.
|
89.55
|
Brachystegia longifolia
|
49.51
|
Pseudolachnostylis maprouneifolia
|
59.76
|
|
Brachystegia longifolia arbo.
|
53.17
|
|
Phyllocosmus lemaireanus
|
50.55
|
39
Nous allons premièrement analyser les résultats
des tableaux 14 et 15 groupe par groupe.
Groupe 1 :
Le genre abondant est celui des Uapaca spp.. En
effet, dans le peuplement considéré par strate ou en entier, les
Uapaca à eux seuls représentent plus de 50 %
d'abondance. Dans la régénération, nous constatons que
l'espèce la plus abondante (30.46 %) est Uapaca nitida, suivies
par Julbernardia globiflora (19.76 %) et Uapaca pilosa (9.06
%). Les Uapaca représentent donc 40 % de la
régénération du groupe 1.
Pour ce qui est des espèces indicatrices du groupe 1,
nous retrouvons les trois principales espèces de Uapaca
(Uapaca nitida, Uapaca pilosa, Uapaca sansibarica) en tant
qu'espèces indicatrices du peuplement (par strate ou non). Cependant,
une espèce possède une valeur indicatrice importante, que ce soit
dans le peuplement ou dans la régénération : Monotes
katangensis. Concernant la régénération, il est
intéressant de noter l'apparition d'une autre espèce :
Parinari curatellifolia. Uapaca nitida et Uapaca pilosa
complètent ces espèces indicatrices.
Groupe 2 :
L'espèce Julbernardia paniculata est la plus
abondante de ce groupe. Elle représente 43.13 % du peuplement.
Diplorhynchus condylocarpon et Julbernardia globiflora
représente à eux deux une douzaine de pourcents de ce
dernier. Cependant, dans la régénération, l'espèce
la plus abondante est Julbernardia globiflora (28.66), suivie de
Julbernardia paniculata et Diplorhynchus condylocarpon.
Du côté des espèces indicatrices, seule
Julbernardia paniculata ressort, que ce soit pour le peuplement ou la
régénération.
Groupe 3 :
L'espèce la plus abondante est Pterocarpus
tinctorius. Cependant, elle ne représente que 13.54 % du
peuplement, dont 11.4 % dans la strate arbustive, c'est-à-dire d'une
hauteur inférieure à 7 mètres. Au niveau de l'abondance
par strate, les trois espèces les plus présentes sont toutes de
la strate arbustive et à elles trois, ne représentent qu'environ
24 % du peuplement. Si on considère le peuplement global, les trois
espèces les plus abondantes sont Pterocarpus tinctorius,
Diplorhynchus condylocarpon (alors qu'il n'était pas
présent dans les abondances par strate) et Pseudolachnostylis
maprouneifolia. En ce qui concerne l'abondance dans la
régénération, les espèces sont fort
différentes du peuplement. En effet, ces espèces composent
respectivement 4 %, 2.2 % et 0.6 % de la régénération. Au
contraire, Dalbergia boehmii y est présent à 34.97 %,
alors que sa présence (pour la strate arbustive) ne composait que 6.18 %
du peuplement. Les deux autres espèces les plus abondantes de la
régénération sont Brachystegia boehmii (22.31 %)
et Brachystegia spiciformis (5.06 %). Il faut noter que
Brachystegia boehmii représente 5.46 % du peuplement, et
Brachystegia spiciformis en représente 1.43 %.
Les espèces indicatrices de ce groupe sont totalement
différentes des espèces abondantes. Pour le peuplement par
strate, nous n'avons que deux espèces de la strate arborescente,
c'est-à-dire d'une hauteur comprise entre 7 et 14 mètres :
Annona senegalensis
40
et Diplorhynchus condylocarpon. Les abondances de ces
espèces sont respectivement 0.07 % et 1.71 %. Aucune espèce ne
ressort globalement au niveau du peuplement, alors que pour la
régénération, seule Dalbergia boehmii
apparaît comme indicatrice. Le groupe est donc peu
spécifique.
Groupe 4 :
Les trois espèces les plus abondantes de ce groupe sont
les mêmes pour le peuplement par strate, le peuplement global ou la
régénération, seul l'ordre décroissant change pour
cette dernière. Pour le peuplement par strate, seule la strate arbustive
ressort (inférieure à 7 mètres de hauteur). Ces trois
espèces sont Combretum acutifoliosum, Terminalia
sp. et Dalbergia boehmii. A
elles trois, elles représentent plus de 55 % du peuplement et 50 % de la
régénération.
Selon IndVal, deux de ces trois espèces sont
indicatrices pour ce groupe et ce, pour le peuplement et la
régénération. Il s'agit de Combretum acutifoliosum
et Terminalia sp.
Groupe 5 :
Les espèces abondantes du peuplement par strate ou du
peuplement global sont les trois mêmes. Pour le premier, elles se situent
toutes dans la strate arbustive. Il s'agit, dans l'ordre, de Julbernardia
globiflora, Dalbergia boehmii et Diplorhynchus
condylocarpon. Elles représentent à elles trois environ 38 %
du peuplement, alors que Julbernardia globiflora seul en
représente plus de 25 %. Pour ce qui est de la
régénération, on retrouve Julbernardia globiflora
(51.4 %) et Dalbergia boehmii (6.8 %). La troisième
espèce est Brachystegia spiciformis (4.6 %) alors que cette
même espèce compose 2.6 % du peuplement. Les jeunes pieds de
Diplorhynchys condylocarpon compose 3.5 % de la
régénération.
Une seule espèce est indicatrice pour ce groupe, dans
les trois catégories : Julbernardia globiflora.
Groupe 6 :
Les espèces abondantes de ce groupe sont respectivement
Acacia sp. (28.26 % dans la strate arbustive, 36.96 % dans le
peuplement), Piliostigma thonningii (21.74 % dans la strate arbustive
et dans le peuplement) et Acacia polyacantha (13.04 % dans la strate
arborée, 23.91 % dans le peuplement. Cependant, pour la
régénération, nous ne retrouvons pas les mêmes
espèces : seule Piliostigma thonningii
régénère (10 %). Les espèces abondantes en
régénération sont Antidesma venosum (36.76 % dans
la régénération, non présent dans le peuplement),
Markhamia obtusifolia (26.47 % dans la
régénération, 6.52 % du peuplement) et Terminalia sp.
(25 % de la régénération, non présent dans le
peuplement).
Seule Piliostigma thonningii a une valeur
d'espèce indicatrice pour ce groupe, pour le peuplement par strate et
pour la régénération.
41
Groupe 7 :
Le groupe 7 est majoritairement représenté par
une seule espèce : Acacia polyacantha. En effet, elle
représente presque 90 % du peuplement, et est présente dans les
trois strates. Cinq espèces se partagent les 10 % restants. Acacia
polyacantha est également une des deux espèces
régénérant dans ce groupe, l'autre étant
Harungana madagascariensis (45.45 % de la
régénération, non présent dans le peuplement).
Cette espèce est aussi la seule espèce indicatrice
du peuplement de ce groupe. Groupe 8 :
L'espèce la plus abondante du groupe 8 est
Brachystegia boehmii. Elle représente 62.50 % du peuplement,
dont 36.76 % en strate arbustive et 23.39 % en strate arborée.
Brachystegia longifolia arrive en seconde position, avec une
majorité de pied dans la strate arbustive. En
régénération, nous retrouvons Brachystegia
boehmii, présent à 57.25 %, suivi par Uapaca nitida
(7.79 % ; 1.61 % du peuplement) et Phyllocosmus lemaireanus (6.76
% ; 1.11 % du peuplement). Malgré son abondance dans le peuplement,
Brachystegia longifolia représente moins d'1 % de la
régénération du groupe.
Pour les espèces indicatrices du peuplement de ce
dernier groupe, nous retrouvons Brachystegia boehmii et
Brachystegia longifolia. En régénération,
Brachystegia boehmii et Phyllocosmus lemaireanus ont
également une valeur indicatrice, ainsi que Pseudolachnostylis
maprouneifolia.
Suite à cette première analyse, les groupes vont
être renommés de la façon suivante :
· Groupe 1 = Communauté à Uapaca spp.
;
· Groupe 2 = Communauté à Julbernardia
paniculata ;
· Groupe 3 = Communauté à Pterocarpus
tinctorius ;
· Groupe 4 = Communauté à Combretum
acutifoliosum et Terminalia sp. ;
· Groupe 5 = Communauté à Julbernardia
globiflora ;
· Groupe 6 = Communauté à Acacia spp.
;
· Groupe 7 = Communauté à Acacia
polyacantha ;
· Groupe 8 = Communauté à Brachystegia
boehmii.
42
5.2.2. Structure des communautés
Afin de faciliter la lecture du tableau de résultats,
nous allons tout d'abord classer les différents groupes par structure.
Les valeurs des différentes variables évoquées sont
reprises aux tableaux 17 et 18. Celles-ci résultent de la moyenne des
ces mêmes variables calculées pour chaque placette du groupe. Le
coefficient de variation de ces valeurs entre placettes y est également
indiqué.
Une première variable observée est le NHA. Les
groupes à Acacia
spp. et à Acacia
polyacantha se différencient clairement, et cette observation va de
pair avec le GHA. Nous qualifierons donc ces groupes de savanes arborées
(en accord avec Bellefontaine, Gaston et al. 1997).
En considérant le NHA et les hauteurs moyennes et
dominantes, le groupe à C. acutifoliosum et Terminalia
sp. sort du lot de par ces faibles valeurs. Ce groupe sera donc
considéré savane boisée. Un autre groupe se
démarque par son NHA faible mais des hauteurs élevées,
ainsi qu'un diamètre moyen élevé. Le groupe à
Ptercocarpus tinctorius sera considéré comme
forêts anciennes.
Le groupe à Uapaca spp., malgré un NHA
très élevé, possède des variables
dendrométriques faibles. Ce groupe sera qualifié de
fourré.
Les 3 groupes restants seront qualifiés de forêts
hétérogènes car ils présentent, d'après les
variables calculées, des faciès de forêts anciennes ainsi
que des zones de régénération.
Le tableau 16 reprend donc les classifications des
différents groupes.
Tableau 16 : Classification des groupes d'après
leur structure et leur composition
|
Classification selon
la structure
|
Classification selon la
composition
|
Classification finale
|
|
1
|
Fourré
|
Uapaca spp.
|
Fourré à Uapaca spp.
|
|
2
|
Forêt hétérogène
|
Julbernardia paniculata
|
Forêt hétérogène à
Julbernardia paniculata
|
|
3
|
Forêt ancienne
|
Pterocarpus tinctorius
|
Forêt ancienne à Pterocarpus tinctorius
|
|
4
|
Savane boisée
|
Combretum acutifoliosum et Terminalia sp.
|
Savane boisée à Combretum acutifoliosum et
Terminalia sp.
|
|
5
|
Forêt hétérogène
|
Julbernardia globiflora
|
Forêt hétérogène à
Julbernardia globiflora
|
|
6
|
Savane arborée
|
Acacia spp.
|
Savane arborée à Acacia spp.a
|
|
7
|
Savane arborée
|
Acacia polyacantha
|
Savane arborée à Acacia polyacantha
|
|
8
|
Forêt hétérogène
|
Brachystegia boehmii
|
Forêt hétérogène à
Brachystegia boehmii
|
Des photos-types de chaque communauté sont
présentées à l'annexe A.6.
43
Tableau 17 : Moyennes et coefficient de variation des
paramètres dendrométriques de chaque communauté (les
coefficients de variation sont indiqués en italique)
Les
moyennes avec des lettres différentes sont significativement
différentes.
|
Communauté
|
Nombre de
placettes
|
GHA
|
NHA
|
NT
|
Hmoy
|
Hdom
|
Dmoy
|
NHA
(régé)
|
Hmoy
(régé) (m)
|
|
Forêt hétérogène à B.
boehmii
|
7
|
13.1 abcd
|
1134 ab
|
1.3 ab
|
6.3 a
|
10.3 ab
|
8.6 ab
|
2105 c
|
1.1 a
|
|
24.4
|
46.4
|
12.3
|
31.5
|
25.4
|
30.8
|
51.6
|
11.3
|
|
Forêt hétérogène à J.
globiflora
|
21
|
13.5 abcd
|
1319 a
|
1.3 ab
|
5.8 a
|
10.7 ab
|
7.2 ab
|
2019 bc
|
1.2 a
|
|
46.2
|
54.4
|
11.2
|
24.0
|
28.1
|
26.3
|
59.8
|
22.9
|
|
Forêt hétérogène à J.
paniculata
|
10
|
16.1 cd
|
1437 a
|
1.3 ab
|
7.9 ab
|
13.4 ab
|
8.2 ab
|
1655 abc
|
1.1 a
|
|
39.8
|
34.1
|
14.8
|
22.2
|
27.5
|
36.0
|
47.2
|
15.2
|
|
Fourré à Uapaca spp.
|
5
|
11.5 abc
|
1328 a
|
1.3 ab
|
5.5 a
|
9.0 a
|
6.9 ab
|
1800 abc
|
0.8 ab
|
|
45.0
|
25.9
|
4.8
|
16.2
|
30.3
|
21.5
|
36.8
|
16.3
|
|
Forêt ancienne à P. tinctorius
|
6
|
15.0 bcd
|
689 ab
|
1.4 ab
|
7.7 ab
|
13.7 ab
|
11.1 ab
|
1035 abc
|
1.0 ab
|
|
39.6
|
53.7
|
14.8
|
30.7
|
25.7
|
47.7
|
67.0
|
22.1
|
|
Savane arborée à Acacia spp.
|
4
|
3.2 a
|
113 b
|
1.6 a
|
5.8 ab
|
10.6 ab
|
10.1 b
|
167 a
|
0.6 bc
|
|
73.4
|
57.5
|
12.3
|
17.6
|
37.0
|
12.4
|
65.7
|
41.7
|
|
Savane arborée à A. polyacantha
|
4
|
3.2 a
|
142 b
|
1.1 b
|
7.4 a
|
11.7 ab
|
12.6 ab
|
27 ab
|
0.3 c
|
|
64.7
|
68.6
|
8.6
|
23.5
|
31.5
|
22.6
|
200.0
|
200.0
|
|
Savane boisée à C. acutifoliosum
et
Terminalia sp.
|
11
|
5.3 ab
|
642 ab
|
1.5 a
|
4.4 a
|
7.7 a
|
6.4 a
|
436 ab
|
1.0 ab
|
|
57.1
|
63.4
|
20.9
|
19.3
|
18.9
|
24.6
|
88.1
|
14.6
|
44
Tableau 18 : Moyennes et coefficients de variation des
caractéristiques de chaque communauté (les coefficients de
variation sont indiqués en italique)
Les moyennes avec des
lettres différentes sont significativement
différentes.
|
Communauté
|
Nombre
de
placettes
|
Pgr.
|
Pso.
|
Ptr.
|
Pdeg.
|
CD
|
Cd
|
Ch
|
Amor.
|
Ht.herb.
|
|
Forêt hétérogène à B.
boehmii
|
7
|
30.6 a
|
49.7 ab
|
19.6 b
|
5.9 ab
|
55 b
|
20 ab
|
83 a
|
6.2 ab
|
69.2 a
|
|
55.9
|
42.1
|
76.4
|
45.4
|
24.5
|
107.3
|
16.1
|
77.2
|
26.5
|
|
Forêt hétérogène à J.
globiflora
|
21
|
35.7 a
|
60.1 a
|
4.1 a
|
7.6 ab
|
39 abc
|
35 ab
|
85 a
|
8.8 ab
|
73.9 a
|
|
52.3
|
32.9
|
73.0
|
105.1
|
54.6
|
47.1
|
18.8
|
47.7
|
36.3
|
|
Forêt hétérogène à J.
paniculata
|
10
|
31.7 a
|
62.1 ac
|
6.1 ab
|
3.8 ab
|
47 abc
|
39 ab
|
70 a
|
7.6 ab
|
53.6 a
|
|
68.0
|
35.7
|
81.7
|
75.0
|
45.5
|
42.2
|
32.5
|
87.1
|
47.6
|
|
Fourré à Uapaca spp.
|
5
|
44.7 ab
|
50.8 ab
|
4.3 a
|
3.0 ab
|
52 bc
|
43 b
|
81 a
|
8.1 ab
|
66.7 a
|
|
28.2
|
25.4
|
46.3
|
76.8
|
34.4
|
32.5
|
14.5
|
74.0
|
15.5
|
|
Forêt ancienne à P. tinctorius
|
6
|
43.2 ab
|
48.1 ab
|
8.7 ab
|
10.6 ab
|
41 abc
|
21 ab
|
86 a
|
10.4 ab
|
120.6 a
|
|
34.6
|
38.1
|
111.5
|
34.4
|
50.7
|
79.4
|
16.7
|
60.7
|
44.6
|
|
Savane arborée à Acacia spp.
|
4
|
24.7 a
|
75.3 a
|
0 a
|
22.5 b
|
11 a
|
12 ab
|
100 a
|
2.5 a
|
109.0 a
|
|
121.9
|
39.9
|
/
|
95.4
|
112.6
|
100.7
|
0.0
|
95.2
|
50.5
|
|
Savane arborée à A. polyacantha
|
4
|
80.7 c
|
17.8 ab
|
1.4 a
|
4.8 ab
|
11 a
|
5 a
|
100 a
|
2 a
|
128.1 a
|
|
24.3
|
115.2
|
200.0
|
151.4
|
62.9
|
91.3
|
0.0
|
200.0
|
41.6
|
|
Savane boisée à C. acutifoliosum et
Terminalia sp.
|
11
|
15.6 a
|
77.5 a
|
6.8 ab
|
21.1 ab
|
16 ac
|
22 ab
|
95 a
|
6.8 ab
|
101.6 a
|
|
57.1
|
8.6
|
104.5
|
67.3
|
79.7
|
63.5
|
7.9
|
76.4
|
25.6
|
45
Analyse globale des communautés
Globalement, les forêts hétérogènes
ont toutes un GHA de 12-15 m2/ha et un NHA entre 1000 et 1500
tiges/ha. Les forêts de régénération
possèdent un GHA plus faible pour une même gamme de NHA, tandis
que les forêts anciennes possèdent un NHA plus faible pour la
même gamme de GHA. Le groupe de « forêt
hétérogène à Julbernardia paniculata
» est plus proche des autres groupes de forêts
hétérogènes pour certains paramètres, tels que le
NHA ou le diamètre moyen, mais plus proche du groupe de forêts
anciennes pour d'autres comme le GHA ou la hauteur dominante. Il s'agit
probablement d'un état intermédiaire. Les savanes ont clairement
un NHA et un GHA plus faible que les forêts. Les savanes boisées
possèdent des hauteurs moins importantes et leur diamètre moyen
est plus faible, mais le NHA est plus important que les savanes
arborées. Les savanes arborées possèdent peu de pieds mais
ceux-ci sont de grande dimension. La régénération dans ces
zones est très faible et basse.
Le GHA est le paramètre le plus discriminant : mis
à part la communauté à Julbernardia globiflora
qui s'associe à Brachystegia boehmii et les savanes qui
forment également un groupe, toutes les communautés ont des
valeurs différentes. Pour les NHA, trois classes se sont formées
suite à la structuration : les savanes arborées, les savanes
boisées et les forêts anciennes, et enfin les forêts. Pour
la hauteur moyenne, seuls les peuplements à hauteur globalement plus
importante se sont distingués du reste alors que pour la hauteur
dominante, c'est l'inverse qui s'est produit : les peuplements à faible
hauteur dominante se démarquent. Pour le diamètre moyen, seuls
deux communautés sortent du lot : la savane à Acacia
spp. et les savanes boisées.
Pour les paramètres de la régénération, les
résultats sont fort différents et en tirer des conclusions est
donc risqué. Cependant, les forêts
hétérogènes à Brachystegia boehmii et
Julbernardia globiflora ont un NHA de
régénération important et à l'opposé, les
savanes arborées ont très peu de pieds de
régénération. Les forêts
hétérogènes à Julbernardia paniculata et
les fourrés à Uapaca spp. ont, contrairement à
leur NHA de peuplement, un NHA moins important que les forêts à
Brachystegia boehmii et Julbernardia globiflora.
Si nous observons les autres caractéristiques des
placettes (tableau 18), il est possible de constater que pour beaucoup de
variables, les savanes arborées se démarquent : leur pourcentage
de régénération sexuée est élevé, le
couvert dominant est presque inexistant et beaucoup moins d'arbres morts sont
retrouvés sur ces placettes (attention au CV qui est tout de même
élevé pour cette variable). Il est intéressant de noter
qu'il n'y a pas d'effet groupe sur les hauteurs de la strate herbacée ni
sur le couvert, quoique pour cette dernière le CV soit plus
élevé dans les communautés de forêt. Il est
également intéressant de constater que le couvert dominé
est, comme attendu, plus élevé dans les fourrés. Au niveau
de l'historique des communautés, nous constatons que les forêts
anciennes, les forêts à Julbernardia paniculata, les
savanes boisées et les forêts à Brachystegia boehmii
subissent un effet groupe par rapport à la variable «
Pourcentage de croissance sur tronc », effet plus marqué sur la
dernière communauté.
46
Forêt hétérogène à
Brachystegia boehmii :
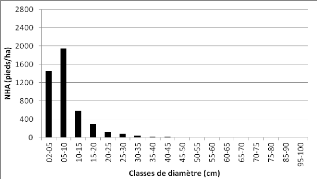
Figure 12 : Distribution des pieds par classe de grosseur
de la communauté "forêt hétérogène à
Brachystegia boehmii"
Si l'on observe la structure de la forêt claire à
Brachystegia boehmii (figure 12), nous constatons, une abondance de
tiges de petites dimensions et une prédominance de la classe de
diamètre 05-10 centimètres. Malgré cet aspect, ce groupe
n'a pas été classé en forêt de
régénération. Après observations placette par
placette, nous constatons en fait deux placettes de jeunes pieds de petite
dimension sur les sept placettes, ce qui pourrait expliquer cette
prédominance des classes de faible diamètre.
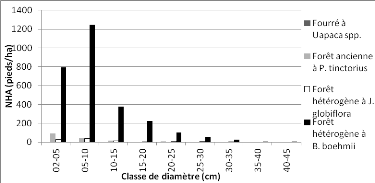
Figure 13 : Distribution des pieds de Brachystegia
boehmii dans les communautés de la zone d'étude
En observant la distribution de Brachystegia boehmii
au sein de ce groupe et même au sein du site d'étude (figure
13), il est possible de constater que l'espèce est très peu
présente en dehors de ce groupe-ci. Au sein même du groupe, elle
représente en moyenne 50 % des pieds de chaque classe.
47
Forêt hétérogène à
Julbernardia globiflora :
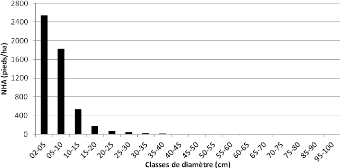
Figure 14 : Distribution des pieds par classe de
grosseur de la communauté "forêt hétérogène
à Julbernardia
globiflora"
À nouveau, la distribution de ce groupe montre de
nombreux pieds de faible dimension (figure 14). Cependant, la
répartition des pieds de Julbernardia globiflora au sein des
différentes communautés (figure 15) montre que, s'il y a une
majorité des pieds de cette espèce qui se trouve dans ce groupe,
des pieds de faible diamètre sont tout de même présents
dans deux autres communautés.
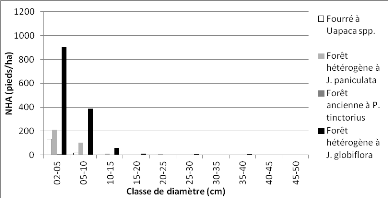
Figure 15 : Distribution des pieds de Julbernardia
globiflora dans les communautés de la zone
d'étude
48
Forêt hétérogène à
Julbernardia paniculata :
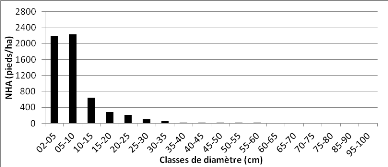
Figure 16 : Distribution des pieds par classe de
grosseur de la communauté "forêt hétérogène
à Julbernardia
paniculata"
La distribution des pieds de ce groupe montre une forte
présence des pieds de diamètre compris entre 2 et 10
centimètres (figure 16). Concernant la répartition de
l'espèce au sein des communautés (figure 17), il est possible de
constater, comme pour les Brachystegia boehmii, que cette
espèce est peu présente dans d'autres communautés et
trouvent la quasi-intégralité de ces pieds dans ce groupe-ci. En
comparant la distribution des pieds de faible diamètre de
Julbernardia paniculata et celle de toutes les espèces de la
communauté, nous constatons que, dans la classe 02-05
centimètres, des pieds d'autres espèces composent plus de 50 % de
cette classe, contrairement à la classe 05-10. Deux hypothèses
peuvent être émises : soit Julbernardia paniculata finit
par dominer ces autres espèces en régénération,
soit la communauté commence une transition vers une autre composition en
espèces.
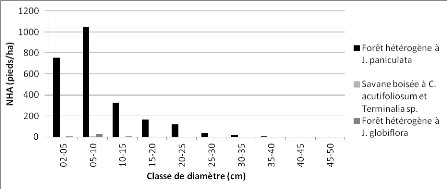
Figure 17 : Distribution des pieds de Julbernardia
paniculata dans les communautés de la zone
d'étude
49
Fourré à Uapaca spp. :
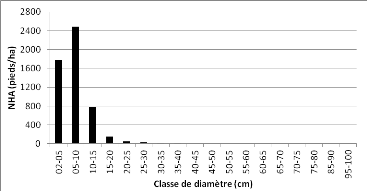
Figure 18 : Distribution des pieds par classe de grosseur
de la communauté "fourré à Uapaca
spp."
Comme attendu, cette communauté présente de
nombreux jeunes pieds et très peu de pieds de grande dimension (figure
18). Etant donné l'abondance de Uapaca spp. dans cette
communauté, la distribution de trois espèces de Uapaca
va être observée: Uapaca nitida, Uapaca pilosa
et Uapaca sansibarica. Les deux autres espèces
présentes sur le site d'étude (Uapaca kirkiana et
Uapaca sp.) ont un nombre très faible de pieds comparé
à ces trois premières espèces. Seules les distributions de
ces espèces vont être présentées, et ce, uniquement
pour ce groupe-ci (figure 19), sachant que les espèces y
possèdent leurs plus grands nombres de pieds (annexe A.7.).
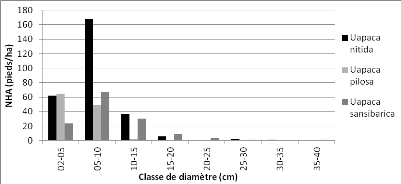
Figure 19 : Distribution des pieds de Uapaca spp.
dans les communautés de la zone d'étude
L'espèce prédominante est Uapaca
nitida, particulièrement dans la classe de diamètre 05-10
centimètres. Peu de pieds de grande dimension sont présents. En
observant les deux graphiques, les Uapaca spp. semblent effectivement
composer une majorité des pieds de petite dimension.
50
Forêt ancienne à Pterocarpus tinctorius
:
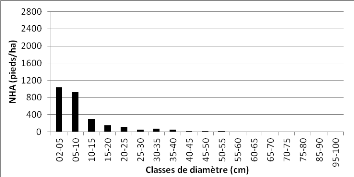
Figure 20 : Distribution des pieds par classe de grosseur
de la communauté "forêt ancienne à Pterocarpus
tinctorius"
Dans cette communauté, il y a clairement moins de pieds
de petite dimension que dans les communautés qualifiées de «
forêt hétérogène » et de « fourré
» (figure 20). Cependant, nous remarquons une présence constante de
pieds de grande dimension, ce qui peut donc valoir la qualification de «
forêt ancienne ». L'arbre du miombo caractéristique des
forêts anciennes est Marquesia macroura (Lawton 1978). Sa
distribution dans ce groupe et dans les autres communautés est
présentée à la figure 21.
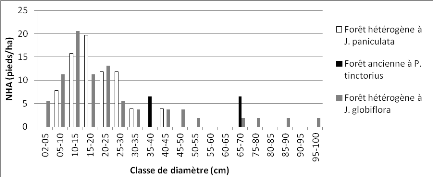
Figure 21 : Distribution des pieds de Marquesia
macroura dans les communautés de la zone d'étude
Contrairement à ce qui aurait pu être attendu,
cette communauté n'est pas celle ayant le plus grand nombre de pieds de
Marquesia macroura. Il faut néanmoins noter que, même si
cette espèce n'est pas présente dans beaucoup de classes de
diamètre, elle possède le plus grand nombre de pieds dans les
classes où elle est présente. Le grand nombre de pieds dans les
autres communautés peut être expliqué selon
différentes hypothèses. Comme ce sont des forêts
hétérogènes à Julbernardia spp., celles-ci
ont peut-être déjà un âge avancé et le nombre
de Marquesia macroura augmente donc progressivement, ce qui
expliquerait la présence de pieds de petite et moyenne dimension. Une
autre explication peut également être relié au nombre de
placettes échantillonnées par communauté, cette
communauté n'en comptabilisant que 4, et ce, malgré le fait que
les mesures ont été ramenées à l'hectare. De plus,
dans la communauté à Julbernardia globiflora se trouvent
des placettes qui avaient été initialement placées dans
une formation de forêt ancienne. Comme l'analyse multivariée se
base sur
51
l'abondance des différentes espèces par
placette, et que les pieds de Marquesia macroura, quoique de grandes
dimensions, sont peu nombreux, cet aspect-là a pu également
influencé.
Savane boisée à Combretum acutifoliosum
et Terminalia sp. :
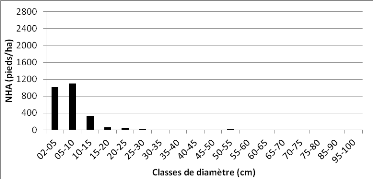
Figure 22 : Distribution des pieds par classe de
grosseur de la communauté « savanes boisées à
Combretum
acutifoliosum et Terminalia sp.
»
Comme attendu, les savanes boisées possèdent
globalement un NHA plus faible que les forêts (figure 22). Elles
possèdent également peu de pieds de grandes dimensions et les
pieds de faible dimension y sont nombreux.
Savane arborée à Acacia spp. :
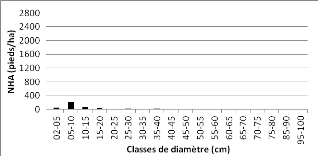
Figure 23 : Distribution des pieds par classe de
grosseur de la communauté "savanes arborée à Acacia
spp."
Le NHA des savanes arborées à Acacia spp.
est faible, même comparé à celui des savanes
boisées (figure 23). Dans cette communauté, il y a peu de pieds
de petite dimension et peu d'arbres de grande dimension, l'essentiel du
peuplement se trouvant dans la classe de diamètre 05-10
centimètres.
52
Savane arborée à Acacia polyacantha :
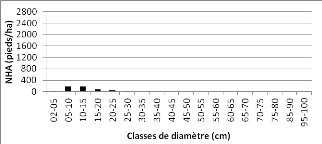
Figure 24 : Distribution des pieds par classe de grosseur
de la communauté "savanes boisées à Acacia
polyacantha"
Comme pour la communauté précédente, le
NHA est très faible (figure 26). Ici, la
régénération y est encore plus faible, ce qui est
probablement dû à la saturation en eau du sol. La majorité
des arbres du peuplement se situent dans les classes et 5 à 15
centimètres. Établir la distribution d'Acacia polyacantha
n'est pas nécessaire, étant donné que cette
espèce compose à elle seule 90 % du peuplement. Nous pouvons donc
considérer que la structure du peuplement correspond à la
structure de l'essence au sein de ce même peuplement.
5.2.3. Facteurs édaphiques
Les textures étant globalement les mêmes sur
l'ensemble de la zone d'étude (communication personnelle de D.
Maekelbergh), la carte des sols résultants des inventaires de D.
Maekelbergh (étudiant en 2ème master à Gembloux
Agro-Bio Tech) est présentée à la figure 25. Il est
possible de constater à première vue que la majorité des
sols sont de couleur ocre-rouge et que les zones humides sont comme attendus
toutes sur sol gris. Les profondeurs sont variables sur l'ensemble de la zone,
quoique les zones humides sont globalement toutes assez profondes. Les charges
n'y sont pas représentées, cependant une charge caillouteuse est
présente dans la partie Est de la zone d'étude (communication
personnelle de D. Maekelbergh). Cette carte nous servira de carte de base pour
catégoriser nos parcelles. Cependant, elle est à
considérer avec précaution car elle résulte d'une
extrapolation. Certaines placettes se trouvent proches d'une limite de sol et
elles pourraient appartenir à un autre type de sol.
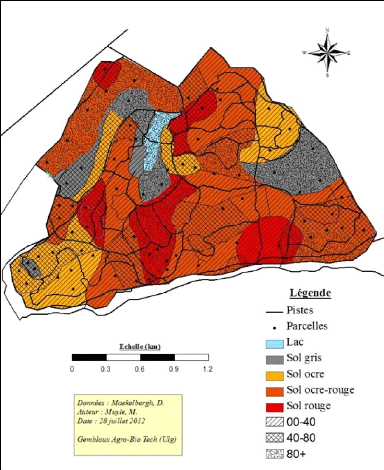
Figure 25 : Carte des paramètres
édaphiques de la zone d'étude
53
Influence de la couleur du sol
Le tableau 19 présente le nombre de placettes par groupe
selon les différentes couleurs
de sol.
Tableau 19 : Répartition des placettes du site
d'étude selon les différentes couleurs de sol
|
Nombre de placettes
|
Gris
|
Ocre
|
Ocre-
Rouge
|
Rouge
|
|
Forêt hétérogène
à
Brachystegia boehmii
|
7
|
|
3
|
3
|
1
|
|
Forêt hétérogène
à
Julbernardia globiflora
|
21
|
|
5
|
14
|
2
|
|
Forêt hétérogène
à
Julbernardia paniculata
|
10
|
|
2
|
7
|
1
|
|
Fourré à Uapaca spp.
|
5
|
|
3
|
2
|
|
|
Forêt ancienne à
Ptercocarpus
tinctorius
|
6
|
1
|
|
1
|
4
|
|
Savane arborée à
Acacia
polyacantha
|
4
|
4
|
|
|
|
|
Savane arborée à Acacia spp.
|
4
|
4
|
|
|
|
|
Savane boisée à Combretum
acutifoliosum
et Terminalia
sp.
|
11
|
3
|
3
|
4
|
1
|
Nous allons, et ce uniquement pour la communauté «
forêt hétérogène à Julbernardia
globiflora », nous intéresser à la répartition
des différents sols parmi les placettes d'inventaire. En effet, ce
groupe possède un grand nombre de placettes que nous n'avons pas su
séparer sur base de critère floristiques. Il est donc
intéressant de voir si le sol peut également influencer cette
classification. La communauté initialement qualifiée «
forêt à Uapaca - Julbernardia » (F-UJ) se trouve sur
sol ocre et celle nommée « forêt mélangée
à Uapaca » (F-U) possède ses placettes sur sol
rouge (tableau 20).
Tableau 20 : Répartitio
|
Ocre
|
Ocre-Rouge
|
Rouge
|
|
F-B1
|
F-B2
|
F-MJ1
|
F-U2
|
|
F-M1
|
F-B3
|
F-MJ2
|
F-U3
|
|
F-UJ1
|
F-J4
|
S-U1
|
|
|
F-UJ2
|
F-J7
|
S-U2
|
|
|
F-UJ3
|
F-M2
|
S-U3
|
|
|
F-M4
|
SB-T9
|
|
|
F-MB4
|
SA-zh3
|
|
54
Cependant, ces résultats sont à
considérer avec précaution. En effet, les analyses chimiques
réalisées par D. Maekelbergh ont démontré que les
couleurs ocre, ocre-rouge et rouge ne traduisaient aucune information sur le
sol (structure ou composition). En effet, les résultats donnés
par IndVal sur ces types de sol n'ont pas été très
concluants. Seul le sol gris, traduisant une présence abondante d'eau, a
donc été mis en relation avec la végétation
(tableau 21). Il en ressort que l'espèce Acacia polyacantha est
une espèce indicatrice des sols gorgés d'eau. La
régénération de Terminalia sp. semble
également montrer un excès d'eau.
55
Tableau 21 : Les espèces indicatrices des sols
gris sur le site de Mikembo
|
SOL GRIS
|
Espèce
|
IV (%)
|
|
Peuplement par strate
|
Acacia polyacantha arbo.
|
51.41
|
|
Acacia polyacantha arbu.
|
34.82
|
|
Acacia polyacantha dom.
|
34.3
|
|
Peuplement
|
Acacia polyacantha
|
56.98
|
|
Régénération
|
Terminalia sp.
|
32.15
|
Influence de la profondeur du sol
Tableau 22 : Répartition des placettes de
l'étude selon les différentes profondeurs de sol
Le tableau 23 présente le nombre de placettes par
groupe selon les différentes profondeurs de sol.
|
Nombre de placettes
|
00-40
cm
|
40-80
cm
|
80+
cm
|
|
Forêt hétérogène
à
Brachystegia boehmii
|
7
|
5
|
2
|
|
|
Forêt hétérogène
à
Julbernardia globiflora
|
21
|
7
|
8
|
6
|
|
Forêt hétérogène
à
Julbernardia paniculata
|
10
|
3
|
6
|
1
|
|
Fourré à Uapaca spp.
|
5
|
3
|
2
|
|
|
Forêt ancienne à
Ptercocarpus
tinctorius
|
6
|
1
|
2
|
3
|
|
Savane arborée à
Acacia
polyacantha
|
4
|
|
2
|
2
|
|
Savane arborée à Acacia
spp.
|
4
|
|
|
4
|
|
Savane boisée à
Combretum
acutifoliosum
et Terminalia sp.
|
11
|
1
|
6
|
4
|
La répartition par profondeur des placettes de la
forêt claire à Julbernardia globiflora est
présentée au tableau 24. Les « forêts à
Marquesia » (F-M) se retrouvent sur les sols peu profonds (tout
comme l'espèce). Sur les sols plus profonds se trouvent des zones
à Brachystegia (F-B), les « forêts
mélangées à Uapaca » (F-U) et une zone qui
paraissait humide.
Tableau 23 : Répartition de
|
00-40
|
40-80
|
80+
|
|
F-M1
|
F-B1
|
F-B2
|
|
F-M2
|
F-J7
|
F-B3
|
|
F-MB4
|
F-M4
|
F-J4
|
|
F-MJ2
|
F-MJ1
|
F-U2
|
|
SB-T9
|
S-U1
|
F-U3
|
|
F-UJ1
|
S-U2
|
SA-zh3
|
|
F-UJ2
|
S-U3
|
|
|
F-UJ3
|
|
56
Les espèces indicatrices des différentes
profondeurs de sol vont être déterminées. Pour ce faire,
nous avons éliminé les sols gris car leur capacité en eau
impacte de manière conséquente l'installation des espèces
sur ces types de sol.
57
Tableau 24 : Les espèces indicatrices des
différentes profondeurs de sol sur le site de Mikembo
|
Peuplement par strate
|
Peuplement
|
Régénération
|
|
Espèce
|
IV (%)
|
Espèce
|
IV (%)
|
Espèce
|
IV (%)
|
|
00-40
cm
|
Marquesia macroura dom.
|
34.11
|
Marquesia macroura
|
34.66
|
Marquesia macroura
|
40.56
|
|
Brachystegia spiciformis dom.
|
31.67
|
Albizia versicolor
|
24.31
|
Albizia adianthifolia
|
24.3
|
|
Marquesia macroura arbo.
|
29.78
|
|
|
|
Albizia antunesiana dom.
|
25
|
|
Brachystegia taxifolia dom.
|
18.75
|
|
40-80
cm
|
Combretum acutifoliosum arbu.
|
27.66
|
Combretum acutifoliosum
|
31.35
|
Pseudolachnostylis maprouneifolia
|
44.24
|
|
Combretum acutifoliosum arbo.
|
26.92
|
|
|
|
|
80+
cm
|
Uapaca sansibarica arbu.
|
75.67
|
Uapaca sansibarica
|
70.68
|
Monotes katangensis
|
55.6
|
|
Parinari curatellifolia arbu.
|
62.5
|
Uapaca nitida
|
62.49
|
Parinari curatellifolia
|
40.25
|
|
Julbernardia globiflora arbu.
|
57.71
|
Parinari curatellifolia
|
58.44
|
Uapaca nitida
|
39.03
|
|
Uapaca nitida arbu.
|
55.02
|
Julbernardia globiflora
|
52.56
|
|
|
Monotes katangensis arbu.
|
52.28
|
Monotes katangensis
|
52.55
|
|
Pseudolachnostylis maprouneifolia arbu.
|
51.44
|
Uapaca pilosa
|
49.41
|
|
Uapaca pilosa arbu.
|
49.4
|
Pseudolachnostylis maprouneifolia
|
47.04
|
|
Diplorhynchus condylocarpon arbu.
|
45.59
|
Pterocarpus tinctorius
|
35.56
|
|
Albizia antunesiana arbu.
|
38.34
|
Syzygium guineense
|
28.82
|
|
Monotes africana arbu.
|
27.05
|
Monotes africana
|
25.63
|
|
Pterocarpus tinctorius arbo.
|
24.74
|
|
|
Acacia polyacantha dom.
|
16.77
|
58
Pour les sols de profondeur inférieure à 40
centimètres, une des espèces caractéristiques est
Marquesia macroura (tableau 24). Pour cette profondeur, il est
également intéressant de constater que quelques arbres de la
strate dominante ont une valeur indicatrice.
Pour les profondeurs allant de 40 à 80
centimètres, Combretum acutifoliosum semble être une
espèce indicatrice. Ces sols semblent également propices à
la régénération de Pseudolachnostylis
maprouneifolia. Ces sols semblent donc favorables au développement
des espèces des savanes boisées.
Les sols les plus profonds, outre le fait qu'ils abritent
souvent les zones humides, semblent être propices à de nombreuses
espèces, dont les Uapaca
spp. et les Julbernardia
globiflora. Ces espèces se trouvant généralement
à des stades de petite dimension dans notre zone d'étude, il est
possible de supposer que ces sols sont propices à des espèces des
zones de régénération.
Influence de la présence de charge
caillouteuse
Les sols avec charge caillouteuse possèdent de
nombreuses espèces indicatrices, contrairement aux sols sans charge
(annexe A.8.). Les espèces suivantes y sont présentes :
Brachystegia boehmii, Brachystegia wangermeeana,
Julbernardia paniculata et Marquesia macroura. Une seule
espèce de Uapaca spp. semble être indicatrice de ces
types de sol.
59
5.3. Caractérisation des dégâts
effectués par la grande faune
5.3.1. Placettes et espèces impactées
Afin d'évaluer les placettes, le pourcentage de pieds
impactés par placette a été mesuré et une carte
d'extrapolation a pu être créée (figure 26). Les zones
impactées sont proches principalement de la pénéplaine. De
plus, cette concentration d'impact se situe entre la pénéplaine
(savane arborée) et trois savanes herbeuses, une au Nord et les deux
autres au centre de la zone d'étude.
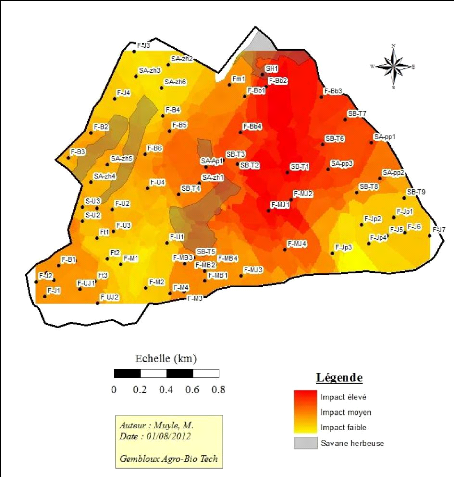
Figure 26 : Carte de répartition de
l'intensité des dégâts effectués par la grande faune
sur la végétation dans le site de
Mikembo
60
Les trois placettes avec le plus grand pourcentage d'impact sont
SA-pp1 (50%), SB-T8 (45.2%) et SB-T3 (39.5%) et se trouvent dans la zone
d'impact élevé. SA-pp1 est une savane arborée à
Acacia
spp. et les deux autres sont des
savanes boisées.
Si l'on observe les espèces impactées à plus
de 20 %, nous constatons que les quelques espèces avec les plus hauts
pourcentages sont principalement des espèces de savanes boisées
(tableau 25). Au total, 52 espèces ont subi un dégât de
gibier.
Tableau 25 : Pourcentage des espèces les plus
impactées par la faune
|
Espèce
|
% pieds
impactés
|
|
Combretum acutifolium
|
34.2
|
|
Phyllocosmus lemaireanus
|
33.9
|
|
Strychnos cocculoides
|
31.5
|
|
Bridelia duvigneaudii
|
29.6
|
|
Annona senegalensis
|
28.0
|
|
Piliostigma thonningii
|
21.7
|
|
Ekebergia benguelensis
|
21.4
|
|
Markhamia obtusifolia
|
21.1
|
|
Hymenocardia acida
|
20.6
|
|
Rothmannia engleriana
|
20.0
|
5.3.2. Lien entre le niveau de dégâts et la
structure et composition des placettes
Les facteurs explicatifs du pourcentage de
dégâts
Le tableau 26 nous indique que seuls les facteurs suivants ont
une p-value significative pour leur régression entre ceux-ci et le
pourcentage de dégâts par placette : le GHA, le NHA, la hauteur
moyenne du peuplement et les couverts des différentes strates.
Tableau 26 : Valeurs des p-value et des coefficients
R2 pour les régressions linéaires et les
régressions logarithmiques entre les facteurs explicatifs du pourcentage
de dégâts et ce dernier
|
P-value
|
R2 (%)
|
|
Régression
linéaire
|
Régression
logarithmique
|
|
GHA
|
0.0052
|
*
|
11.1
|
5.1
|
|
NHA
|
0.0047
|
*
|
11.2
|
9.1
|
|
Hauteur moyenne
|
0.0208
|
*
|
7.7
|
9.4
|
|
Hauteur dominante
|
0.2296
|
N.S.
|
2.2
|
3.3
|
|
Diamètre moyen
|
0.4077
|
N.S.
|
1.0
|
1.8
|
|
Couvert de la strate herbacée
|
0.0172
|
*
|
7.7
|
5.3
|
|
Couvert de la strate arborescente dominée
|
0.0088
|
*
|
9.8
|
21.3
|
|
Couvert de la strate arborescente dominante
|
0.0013
|
*
|
13.5
|
12.8
|
|
Hauteur moyenne de la strate herbacée
|
0.6568
|
N.S.
|
0.3
|
0.1
|
61
|
|
60 0
|
|
1 c
C
.
|
âts
|
R2 = 0.2133
|
|
n c
D C D
|
âts
|
R2 = 0.1351
|
|
|
g,u.0 é
d
40.0
|
|
|
te:7V.V
é
, 40.0
|
|
|
|
|
d
30.0
|
dge
|
|
te 30.0
a
20.0
|
|
|
a
20.0
|
|
|
i4 e
10.0
|
|
|
nt
e
10.0
|
|
|
urc
0.0
p:
|
|
|
urc
Po 0.0
|
|
|
0
|
20 40 60 80 100
Couvert de la strate arborée
dominante
(%)
|
|
0 20 40 60 80
Couvert de la strate arborée
dominée
(%)
|
|
60.0
|
|
60.0
|
|
|
C
C
.
|
s
|
R2 = 0.111
|
|
|
|
R2 = 0.1116
|
|
|
ee 50.0 g
40.0
|
|
|
s 50.0
ât
é 40.0
|
|
|
d 30.0
|
|
|
Il
30.0
|
|
|
ge
20.0
|
|
|
age
20.0
|
|
|
nta
10.0
rc
|
|
|
ce o
|
|
|
P 0.0
-10.0
|
oo 10.0
0 1000 2000 3000 4000
|
|
p.
0.0
|
|
|
0.0
10.0 20.0 30.0 40.0
GHA (m2/ha)
/ha)
|
|
NHA (pieds/ha)
|
|
|
60
|
|
|
60.0
ts
|
|
R2 = 0.0941
|
|
n 6
· 0.
·
0
|
ts
|
R2 = 0.0767
|
|
|
gâ 50.0 é
d
40.0
|
g ..,
|
|
Pc
40.0
|
|
|
e
|
|
|
30.0
ed
|
|
|
Ilee 30.0
g
20.0
|
|
|
g
20.0
nta
|
|
|
Il n
10.0
|
|
|
e
10.0
|
|
|
8
|
|
|
rc
Po 0.0
|
|
|
â 0.0
0
-10.0
|
50 100
|
|
2.0 7.0 12.0
Hauteur moyenne (m)
|
|
Couvert de la strate herbacée (%)
|
Figure 27 : Régressions des facteurs explicatifs
du pourcentage de dégâts (p-value significative)
Les régressions linéaires ou logarithmiques sont
illustrées à la figure 27, du facteur le plus explicatif (en haut
à droite) au facteur le moins explicatif (en bas à droite). Les
couverts des strates arborées sont donc les facteurs les plus
explicatifs du nombre de dégâts par placette.
62
Les facteurs dépendants du pourcentage de
dégâts
Le tableau 27 nous indique que seuls les facteurs suivants ont
une p-value significative pour leur régression entre ceux-ci et le
pourcentage de dégâts par placette : la richesse spécifique
du peuplement, la richesse spécifique de la
régénération, le NHA de la
régénération et le nombre moyen de tiges par pied.
Tableau 27 : Valeurs des p-value et des coefficients
R2 pour les régressions linéaires et les
régressions logarithmiques
entre les facteurs expliqués par le
pourcentage de dégâts et ce dernier
|
P-value
|
R2 (%)
|
|
Régression
linéaire
|
Régression
logarithmique
|
|
Richesse spécifique du peuplement
|
0.0002
|
*
|
20.4
|
18.9
|
|
Richesse spécifique de la
régénération
|
0.0009
|
*
|
0.1
|
12.7
|
|
NHA de la régénération
|
0.0189
|
*
|
1.9
|
9.2
|
|
Nombre de tiges
|
0.0031
|
*
|
0.3
|
14.0
|
|
Hauteur moyenne de la
régénération
|
0.6069
|
N.S.
|
60.7
|
0.2
|
La richesse spécifique du peuplement semble être
le paramètre le plus atteint par la présence de
dégâts (figure 28). Les autres relations ont des relations
logarithmiques avec le pourcentage de dégâts. Les richesses
spécifiques et le NHA de la régénération
décroissent avec le pourcentage de dégâts.
|
|
|
|
u 35
d
|
R2 = 0.2042
|
|
|
ges
|
|
R2 = 0.14
|
|
|
e 30
|
|
2.5
2
|
|
|
25deu
quC
|
|
n d
ey4144,1.5
|
|
|
eme20
|
|
o
1
|
|
spâ15
se al
|
|
|
eupa
|
|
|
|
|
0.5 ,r2
0
|
|
|
ch5 .
0
|
|
|
0.0 20.0 40.0 60.0
Pourcentage de dégâts
|
|
No
0.0 20.0 40.0 60.0
Pourcentage de dégâts
|
|
30
|
|
6000
|
|
R2 = 0.0923
|
|
|
de
J
ri C
|
|
R2 = 0.1266
|
|
|
5000
|
|
e n L,
20
fiq atio
|
|
|
|
. 4000
e
V 6
3000
|
|
pécn15 s é
10
|
|
2000
|
|
sse ég
|
|
~~
:r 1000
|
|
h la 5
c
i0
|
|
0
|
|
0.0 20.0 40.0 60.0
Pourcentage de dégâts
|
|
0.0 20.0 40.0 60.0
Pourcentage de dégâts
|
Figure 28 : Régressions des facteurs
dépendants du pourcentage de dégâts (p-value
significative)
63
Les constituants de la biomasse herbeuse
Le tableau 28 nous indique que les facteurs suivants ont une
p-value significative pour leur régression entre ceux-ci et le
pourcentage de dégâts par placette : le taux de protéines
(et le taux d'azote puisque ces deux paramètres sont
corrélés), la teneur en MS et la lignine (ADL). Ces
paramètres obtiennent les R2 les plus élevés de
toutes les régressions concernant le pourcentage de
dégâts.
Tableau 28 : Valeurs des p-value et des coefficients
R2 pour les régressions linéaires et les
régressions logarithmiques
entre les constituants de la biomasse de
la strate herbacée et le pourcentage de dégâts par
placette
|
P-value
|
R2 (%)
|
|
Régression
linéaire
|
Régression
logarithmique
|
|
Matières protéiques totales
|
0.0002
|
*
|
20.68
|
23.23
|
|
Taux d'azote
|
0.0002
|
*
|
20.68
|
23.23
|
|
Cellulose Brute
|
0.7346
|
N.S.
|
0.19
|
0.20
|
|
Cendres totales
|
0.585
|
N.S.
|
0.49
|
0.42
|
|
Matière organique
|
0.585
|
N.S.
|
0.49
|
0.42
|
|
Teneur en matière sèche
|
0.0001
|
*
|
27.15
|
36.74
|
|
Acid Detergent Fiber (Cellulose + Lignine)
|
0.1306
|
N.S.
|
3.71
|
3.46
|
|
Neutral Detergent Fiber (Cellulose + Hémicellulose
+ Lignine)
|
0.2849
|
N.S.
|
1.87
|
1.89
|
|
ADL (Lignine)
|
0.0005
|
*
|
18.32
|
18.97
|
|
Digestibilité de la matière sèche
(Aufrère)
|
0.2852
|
N.S.
|
1.87
|
1.83
|
La teneur en MS, qui peut être considérée
comme une variable dépendante, décroit fortement avec
l'importance des dégâts (figure 29). Les autres variables ont une
relation croissante en fonction du nombre de dégâts. Cela pourrait
indiquer une préférence de l'animal vers un certain type
d'aliments.
|
|
40.0
|
|
|
|
Il2)
oCC
|
|
R2 = 0.3674
|
|
|
gâta
i
|
|
R2 = 0.2323
|
|
|
dé 30.0
e
|
|
|
600
|
|
|
M
400
|
S(
|
|
d 20.0 g
10.0
|
|
|
n
e
200
|
|
|
w
|
|
|
ue
|
érc
nu
|
o 0.0 P
0.00 5.00 10.00 15.00
Matières
protéiques totales (% MS)
|
|
Té 0
0.0 20.0 40.0
Pourcentage de dégâts
|
|
40.0
|
|
|
|
|
de
iCc
|
|
R2 = 0.1897
|
|
|
e
i
|
|
R2 = 0.2323
|
|
|
30.0
a t tgâ
20.0
|
|
|
g s
a
20.0
nt gâ
|
e 30.0es
|
|
en é
ur 10.0
|
|
|
c d
10.0
|
d eéc
|
|
o
P
0.0
|
|
|
o
P
0.0
|
|
|
6.00 8.00 10.00 12.00 14.00 16.00
Lignine (% MS)
|
|
1 1.5 2
0 0.5 Azote (% MS)
|
Figure 29 : Régressions entre les constituants
de la biomasse herbacée et le pourcentage de dégâts
(p-value
significative)
64
5.3.3. Lien avec un inventaire de faune effectué à
la même
période
Chaque observation a été replacée sur la
carte de répartition de l'intensité des impacts (figure 30). Il
apparait qu'il y a un grand nombre d'observations dans la zone d'impact
élevé. D'autres zones comportent de nombreuses observations : il
s'agit des savanes herbeuses, qui ne ressortent pas dans la carte de
répartition des dégâts. En effet, les dégâts
ont été inventoriés sur les arbres, or il n'y a pas ou peu
d'arbres dans les savanes herbeuses.
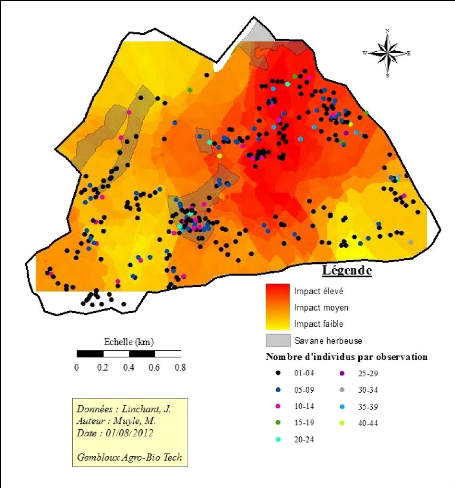
Figure 30 : Répartition des observations de
faune sur la carte d'intensité des impacts dans le site de
Mikembo
65
6. Discussion
6.1. La stratégie d'inventaire
Mikembo étant une zone d'étude de petite
superficie, les conclusions résultant de ces analyses sont à
considérer avec précaution.
Tout d'abord, la technique de notre inventaire peut être
discutée. La mise en place de la carte des formations
végétales fut difficile. Une option envisageable aurait
été de faire des formations plus grandes et de de supprimer les
zones d'une superficie trop faible. Cependant, la zone d'étude
étant très hétérogène sur des distances
très courtes, du moins du point-de-vue physionomique, une crainte
était de passer à côté d'une zone de
végétation. La tache de muhulu au nord de la
réserve n'aurait peut-être pas été
découverte. Le fait qu'aucune autre étude de cette ampleur n'ait
été menée dans cette zone d'étude n'a pas
aidé à la mise en place d'une stratégie d'inventaire.
Cette étude peut être considérée comme une
expérience préliminaire avant une possible
expérience principale (Dagnelie 2003).
6.2. La dynamique des différentes
communautés végétales
Notre analyse de la dynamique de communautés n'est pas
basée sur un suivi temporel de placettes permanentes, qui serait la
méthode idéale. Nous nous basons sur une approche indirecte
prenant en compte les comparaisons de composition floristique entres stades
« adultes » et stades de régénération au sein
des communautés et prenant en compte les ressemblances floristiques
entre communauté. De plus, les dynamiques du miombo sont souvent
reliées à l'historique d'utilisation des terres (Backeus,
Pettersson et al. 2006), dont nous n'avons pas beaucoup de traces dans
ce cas-ci.
Basons-nous uniquement sur l'abondance et la fréquence
des espèces végétales pour commencer. Les savanes
arborées à Acacia
spp. et à Acacia
polyacantha se différencient réellement des autres
communautés. Certains auteurs préconisent que les savanes sont
des stades antécédents à l'installation de la forêt
claire, surtout dû à un abattage des arbres, suivi d'une
jachère. Cependant, le travail de terrain a révélé
que ces savanes se trouvent sur sol inondé, et ce, encore en
début de saison sèche. Nous pouvons donc considérer que
ces savanes n'évolueront pas en forêts claires. La savane
boisée à Combretum acutifoliosum et Terminalia sp.
pourrait être considérée comme une transition vers la
forêt claire. Lawton (1978), dans le nord de la Zambie, décrit un
stade, appelé « chipya », caractérisé par des
espèces de petite taille, une strate herbeuse élevée, un
couvert très ouvert et une prédominance des espèces
résistantes aux feux de saison sèche. Ces espèces sont
Diplorhynchus condylocarpon, Hymenocardia acida et
Syzygium guineense et ont des couronnes fort développées
dans ces chypias. Cette description ne correspond pas à nos observations
: en effet, nous nous trouvons avec une abondance de Combretum
acutifoliosum et Terminalia sp.. Cette formation observée
a été décrite par Malaisse (1997) pour les forêts
claires africaines. Schmitz (1971) décrivait également des
associations à Combretum spp. dans les plaines de Lubumbashi.
Cependant, Backeus et al. (2006) ont identifié une courte
période de succession avec des espèces à croissance rapide
telles que Combretum spp. Dans notre cas, les savanes boisées
semblaient être bien en place et ni la structure ni la composition de
leur régénération ne semblaient montrer une
évolution probable de cette communauté en une communauté
à Brachystegia-Julbernardia.
66
Cinq communautés de forêts ont été
décrites lors de cette étude. Lawton (1978) décrit la
succession en trois stades : le « chipya », un stade à
Uapaca et la forêt claire typique à
Brachystegia-Julbernerdia. Il peut également arriver que le
stade à Uapaca évolue en une forêt «
sempervirente » à Marquesia macroura. Si nous
commençons par observer la formation qualifiée de «
fourré à Uapaca spp. », nous constatons
évidemment une abondance de Uapaca spp.. De nombreux auteurs
considèrent les Uapaca comme une espèce pionnière
des miombos (Lawton 1978). En considérant ce cas-ci, il y a cinq
espèces de Uapaca sur notre zone d'étude. Uapaca
nitida se retrouve dans cinq communautés différentes, les
quatre communautés de forêts et la communauté de
fourrés. Les autres se situent également dans ces
communautés, seule Uapaca pilosa peut se retrouver
également en savane boisée. Cependant, si les Uapaca
sont des espèces pionnières créant des conditions
favorables à la régénération des arbres
caractéristiques du miombo, ces espèces devraient se retrouver
dans la régénération. Or, la
régénération de la communauté de «
fourrés à Uapaca » est composée, certes,
à plus de 40 % de Uapaca spp., mais 20 % de cette
régénération est composé de Julbernardia
globiflora. Cela peut être dû au jeune âge de la zone
d'étude. En observant ce résultat avec les relations
peuplement-régénération de chaque groupe de forêts,
un même constat ressort : ce sont en général les
mêmes espèces que l'on retrouve en
régénération et dans le peuplement. Ces
communautés, mis à part peut-être les fourrés
à Uapaca spp., semblent bien en place et n'évolueraient
pas vers des stades « supérieurs ». Néanmoins, deux
petites exceptions dans la régénération ressortent :
Brachystegia spiciformis régénère dans la
communauté à Julbernardia globiflora ainsi que dans les
forêts anciennes à abondance de Pterocarpus tinctorius.
Dans ces dernières, des pieds de Brachystegia boehmii
régénèrent également, alors que cette
espèce n'est pas ou peu présente dans la strate arborée du
peuplement.
La théorie de Lawton (1978) n'est ni confirmée
ni contredite dans notre cas d'étude. Il existe bel et bien une
communauté à Uapaca qui possède une structure de
fourré, possédant donc de jeunes pieds pouvant être
considérés comme de la régénération (GHA
faible et NHA élevé). Cependant, les espèces
régénérant sont principalement celles qui étaient
déjà en place, et non les espèces caractéristiques
du miombo. De plus, les Uapaca spp. ont récemment
été qualifié d'espèce non tolérante au
passage du feu, ce qui est problématique dans un pyroclimax tel que le
miombo (Chidumayo 2004). Une présence de Julbernardia globiflora
apparait néanmoins, mais il serait risqué d'affirmer que ce
groupe va évoluer en forêt claire à Julbernardia
globiflora.
Il est également délicat d'établir des
liens dynamiques entre les autres communautés. Les forêts
hétérogènes à Julbernardia paniculata et
à Brachystegia boehmii sont des peuplements stables et la zone
de forêts anciennes l'est également. La communauté à
Julbernardia globiflora pourrait éventuellement être un
état de transition entre la zone à Uapaca et un stade de
forêt claire. Les raisons pouvant expliquer cette réflexion sont
:
? la présence de J. globiflora en
régénération dans le groupe à Uapaca ;
? la présence de B. spiciformis et B.
taxifolia, à plus de 5 % chacun, dans la
régénération du groupe à J. globiflora
;
? la faible présence en strate arbustive de U.
nitida, ce qui pourrait être une relique d'un stade à
Uapaca.
Au vu de la taille de la zone d'étude et de la
période d'inventaire, il serait risqué d'en tirer des conclusions
hâtives.
Néanmoins, une des hypothèses de Lawton (1978)
peut sembler inexacte dans notre inventaire. En effet, il a décrit
Diplorhynchus condylocarpon comme étant une espèce
67
pionnière des chypias, qui persiste par la suite dans
les stades postérieurs mais à des dimensions inférieures.
En observant sa distribution à travers les différentes
communautés dans notre cas (annexe A.9.), nous constatons que cette
espèce possède ses plus gros pieds en forêts anciennes. De
plus, au lieu d'avoir son NHA le plus important en savane boisée ou dans
la communauté de fourrés, elle a une majorité de pieds
dans les forêts hétérogènes à
Julbernardia paniculata, qui est une formation d'un certain âge,
avec des arbres de dimension importante.
6.3. L'influence du sol et du feu
Nous émettrons quelques réserves à propos
des résultats ressortant des analyses de ces paramètres. En
effet, pour les sols, 53 points de sondage ont été
effectué, les données du reste de la zone ont donc
été extrapolées. Ce faible taux d'échantillonnage
rend ces données, à une si petite échelle,
imprécises. Les données des périodes de feu ont quant
à elles été récoltées lors d'un entretien
avec le gestionnaire, mais aucune carte ou document de gestion n'existe
à ce jour. Les limites des zones sont donc assez difficiles à
visualiser et la carte présentée dans ce document contient sans
doute quelques erreurs de précision.
Néanmoins, quelques résultats ressortent de ces
analyses. La couleur du sol semble avoir peu d'influence sur les espèces
ou les groupements végétaux. Seul le sol gris se démarque.
Ces sols gorgés d'eau supportent principalement les savanes
arborées, voire boisée et sont caractérisés par la
présence des Acacia spp. En comparant avec la
littérature, nous constatons une influence de la couleur du sol sur la
végétation dans plusieurs études, ce qui n'a pas pu
être détecté dans cette étude (Lawton 1978; Backeus,
Pettersson et al. 2006).
La profondeur semble avoir des effets plus marqués sur
les espèces végétales. En effet, nous retrouvons les
espèces caractéristiques des savanes boisées sur des sols
d'une profondeur allant de 40 à 80 cm. Sur les sols moins profonds, nous
retrouvons des espèces caractéristiques des forêts
anciennes, tels que Marquesia macroura, Brachystegia spiciformis
ou Brachystegia taxifolia. Sur les sols d'une profondeur
supérieure à 80 cm, nous retrouvons entre autres les Uapaca
spp., Julbernardia globiflora, mais également
Pterocarpus tinctorius, espèce abondante des forêts
anciennes. Ces résultats sont en contradiction avec certaines
études. Smith et al. (2004) décrivent Marquesia
macroura comme une espèce aimant les sols profonds, mais Lawton
(1978) décrit un groupement avec extrêmement peu de Marquesia
macroura, justifiant cette faible présence par le sol profond. Les
Uapaca spp. quant à eux seraient habitués aux sols
chargés et de faible profondeur (Lawton 1978; Smith and Allen 2004). A
nouveau, notre étude n'a pas mené aux mêmes
observations.
La charge caillouteuse nous indique, comme pour les sols peu
profonds, une présence des espèces de forêts anciennes.
Cela correspond à l'habitat des grands Brachystegia
(Brachystegia spiciformis et Brachystegia taxifolia).
Cependant, il est dit du Marquesia macroura qu'il affectionne les sols
perméables. Dans ce cas-ci, son implantation dépendrait donc de
l'importance de la charge, donnée que nous n'avons pas (Smith and Allen
2004). L'absence de charge, au contraire, semble ne faire ressortir aucune
espèce.
Les effets du feu sur la végétation n'ont pu
être détectés ici, probablement dû au fait que cette
étude ne porte que sur une courte durée et/ou qu'ils sont
masqués par d'autres paramètres. Idéalement, des
expériences de mise à feu sur des parcelles similaires à
différentes périodes, permettrait d'estimer cet effet. Par
exemple, une mise à feu à divers
68
moments serait un bon moyen de comparer l'impact du feu sur la
production ou l'abondance de la strate herbacée. Selon Chidumayo (2004),
la fréquence du feu aurait un effet sur la surface terrière des
arbres. De tels effets n'ont pu être détectés suite
à notre étude.
Les études s'accordent généralement sur
le fait que l'historique des terres a un impact plus important sur la
végétation que la fréquence du feu ou même le type
de sol (Lawton 1978; Chidumayo 2004; Backeus, Pettersson et al. 2006;
Mwase, Bjornstad et al. 2006).
6.4. L'impact de la faune sur la flore arborescente
Les dégâts les plus importants se trouvent dans
les savanes boisées. L'espèce la plus impactée est
Combretum acutifoliosum, espèce indicatrice de ce type de
communauté. De plus, un pourcentage de dégâts
élevés semble être expliqués par :
? des couverts faibles des strates dominée et dominante
;
? une valeur faible de GHA ;
? une valeur faible de NHA ;
? des hauteurs moyenne et dominante faibles.
La structure semble donc avoir un effet sur les zones
impactées par la grande faune. Les taux d'azote (et donc de la
matière protéique totale) de la végétation
herbacée semble également avoir une influence sur la
présence de dégâts.
Les conséquences de cette présence importante
d'impacts sont une diminution des richesses spécifiques aussi bien au
niveau du peuplement que de la régénération, ainsi qu'une
diminution de la teneur en MS de la biomasse herbacée.
À nouveau, même s'il y a un effet entre ces
facteurs, ces paramètres ne sont peut-être pas les uniques causes
ou conséquences de ces dégâts. En effet, la
proximité d'un point d'eau ou encore l'absence de compétition par
d'autres herbivores peut faire qu'une zone sera plus fréquentée
et donc plus impactée. Tous les facteurs sont liés entre eux et
un paramètre ne pourrait pas à lui seul justifier la
présence ou non de dégâts. Une mise en défens d'une
savane boisée pendant un laps de temps déterminé
permettrait de définir réellement les conséquences par
exemple.
Vu la taille de la zone d'étude, ces résultats
ne correspondraient peut-être pas à ceux d'une étude de
même type sur une zone plus vaste. En effet, certains auteurs
considèrent que les ongulés ne répondent pas
forcément qu'aux types de végétation, mais
également à la disponibilité de ces derniers et à
la présence d'autres espèces d'herbivores. Dans ces
cas-là, la plasticité du mammifère en question jouerait
plus que la végétation elle-même (de Knegt, Groen et
al. 2008). Il est donc difficile ici de prédire des
résultats valables sur d'autres sites d'étude.
De plus, les espèces n'ont pas été
considérées séparément mais en tant qu'un ensemble
d'ongulés. Peu d'études se sont intéressées
à l'impact global de la grande faune sur le miombo. En effet, ces
dernières s'intéressent généralement aux
comportements de seulement une ou deux espèces, ce qui rend cette
étude difficilement comparable.
Pour finir, la comparaison avec les observations d'animaux
faites à la même période est probante. En effet, les zones
fortement impactées sont des zones où de nombreuses observations
avaient été faites, les savanes herbeuses mises à part.
69
7. Conclusion et perspectives
Le miombo à Lubumbashi est actuellement dans un
état critique. La production de charbon de bois et l'agriculture ont
certes toujours existé dans cette région, mais le
développement des routes et la croissance démographique aggravent
cette situation. Cette étude s'inscrit dans un but de conservation de
cet écosystème, et dans un but de maintien de ces populations
locales qui en dépendent.
Huit communautés végétales ont
été définies : des savanes arborées, des savanes
boisées, des fourrés, des forêts
hétérogènes et des forêts anciennes. Émettre
des hypothèses de dynamique des communautés s'avère
risqué, quoique nous identifions une zone de fourrés avec la
présence de Uapaca spp. Cependant, cette espèce est
considérée comme une espèce indicatrice des sols profonds
dans notre cas. Les forêts anciennes, ou du moins leurs arbres
exemplatifs, semblent se trouver sur les sols peu profonds et avec charge
caillouteuse. Il est risqué de formuler d'autres hypothèses dans
notre cas. La faune semble quant à elle marquer une
préférence pour les zones de savanes boisées, ce qui
influencerait la hauteur de régénération et la
quantité de fourrage.
Cette étude a permis de montrer la complexité de
cet écosystème. Les théories énoncées dans
les années 1970 ne se vérifient pas toutes ici. Les savanes
boisées ne semblent pas initier une évolution en forêts et
les relations sol-végétation ne sont pas toutes
vérifiées dans cette étude. Il serait
bénéfique pour une meilleure compréhension du miombo
katangais de poursuivre ce type d'étude.
Comme dit au début de ce travail, la dynamique de la
végétation du miombo katangais n'a pas été
étudiée depuis plusieurs décennies et son étude
actuelle devient de plus en plus difficile suite à l'abattage des arbres
pour produire du makala. Cette étude a tenté de
débroussailler ce vaste sujet. Cependant, la taille de la zone
d'étude peut influencer les résultats, autant pour la faune que
pour la flore. Pour une poursuite sur ce sujet et dans cette zone,
l'idéal serait de procéder à deux inventaires par an, un
en saison des pluies et un en saison sèche, sur les mêmes
placettes. Celles-ci seraient définies sur base d'une nouvelle carte de
végétation, répartissant nos 8 communautés à
travers la réserve. Cette nouvelle carte peut être
créée à l'aide d'une prospection de terrain, ou alors
à partir d'une classification supervisée, à condition que
l'image satellite ne soit pas trop précise. Un inventaire des
données édaphiques devra être ré-effectué
avec un taux d'échantillonnage plus important, ou même une
définition des points de sondage dans les placettes. Des enquêtes
auprès des villageois sur l'ancienne utilisation des terres ainsi que
des essais de feux pourraient également aider à la
compréhension de cet écosystème.
Ce projet-pilote a le mérite de tenter une reproduction
de l'écosystème dans son ensemble faune-flore. La zone
d'étude étant assez petite, il serait intéressant de
reporter ce projet dans une réserve de plus grande taille. Les asbl
Mikembo et BAK ont ce projet et des études pourraient donc être
poursuivies dans cette nouvelle zone.
Dufrêne, M. (2004). "IndVal or how to identify indicator
species of a sample typology ?" Retrieved 17/07/2012, from
http://old.biodiversite.wallonie.be/outils/indval/.
8. Références bibliographiques
Anonymous (2005). Monographie de la province du Katanga,
République Démocratique du Congo - Ministère du Plan:
Unité de Pilotage du Processus DSRP: 147.
Ansell, W. F. H. (1978). The Mammals of Zambia.
Chilanga, The National Parks and Wildlife Services.
Averbeck, C., A. Apio, et al. (2009). "Environmental
parameters and anthropogenic effects predicting the spatial distribution of
wild ungulates in the Akagera savannah ecosystem." African Journal of
Ecology 47: 756-766.
Backeus, I., B. Pettersson, et al. (2006). "Tree
communities and structural dynamics in miombo
(Brachystegia-Julbernardia) woodland, Tanzania." Forest Ecology and
Management 230: 171-178.
Bell, R. H. V. (1984). Soil-Plant-Herbivores interactions.
Conservation and Wildlife management in Africa - Proceedings of a workshop
organised at Kasungu. R. H. V. Bell and E. McShane-Caluzi, U.S. Peace
Corps: 101-130.
Bellefontaine, R., A. Gaston, et al. (1997).
Aménagement des forêts naturelles des zones tropicales
sèches. Rome, FAO.
Ben-Shahar, R. (1992). "The effects of bush clearance on
African ungulates in a semi-arid nature reserve." Ecological
Applications 2: 95-101.
Bertrand, D. (2002). "La spectroscopie proche infrarouge et
ses applications dans les industries de l'alimentation animale." INRA Prod.
Anim. 15 (3): 209-219.
Bray, R. J. and J. T. Curtis (1957). "An ordination of the
upland forest communities of southern Wisconsin." Ecological
Monographs 27: 325-349.
Chardonnet, P. and H. Fritz (1995). Etat de la faune sauvage:
Situations et tendances. Faune sauvage africaine: La ressource
oubliée. P. Chardonnet. Luxembourg, Commission
Européenne: 308-334.
Chidumayo, E. N. (2004). "Development of
Brachystegia-Julbernardia woodland after clear-felling in central
Zambia : Evidence for high resilience." Applied Vegetation Science
7: 237-242.
Clarke, K. R., P. J. Somerfield, et al. (2006). "On
resemblance measures for ecological studies, including taxonomic
dissimilarities and a zero-adjusted Bray-Curtis coefficient for denuded
assemblages." Journal of Experimental Marine Biology and Ecology
330: 55-80.
Dagnelie, P. (2003). Principes d'expérimentation :
planification des expériences et analyse de leurs résultats.
Gembloux, Les presses agronomiques de Gembloux.
de Knegt, H. J., T. A. Groen, et al. (2008).
"Herbivores as architects of savannas: inducing and modifying spatial
vegetation patterning." Oikos 117: 543-554.
Delvingt, W. and C. Vermeulen (2007). Nazinga.
Gembloux, Les Presses agronomiques de Gembloux.
Ernst, C., A. Verhegghen, et al. (2010). Cartographie
du couvert forestier et des changements du couvert forestier en Afrique
centrale. Les forêts du bassin du Congo - Etat des forêts
2010. COMIFAC: 23-42.
Ernst, C., A. Verhegghen, et al. (2010). Cartographie
du couvert forestier et des changements du couvert forestier en Afrique
centrale. Les forêts du bassin du Congo - Etats des forêts
2010. COMIFAC: 23-42.
Ernst, W. (1971). "Zur Okologie der Miombo-Wâlder."
Flora 160: 317-331.
FAO. (2012). "FaoStat." Retrieved 11/07/2012, from
http://faostat3.fao.org/home/index.html?#HOME.
Freson, R., G. Goffinet, et al. (1974). "Ecological
effects of the regressive succession muhulu-miombo-savannah in Upper-Shaba
(Zaïre)." Contribution à l'étude de
l'écosystème forêt claire (miombo) Note
14.
Fritz, H. (2005). Importance de la faune sauvage: rôle
écologique. Faune sauvage africaine: la ressource oubliée
(Tome 1). P. Chardonnet. Luxembourg, Commission Européenne:
50-75.
Frost, P. (1996). The ecology of miombo woodlands. The
Miombo in Transition: Woodlands and Welfare in Africa. B. Campbell. Bagor,
Center for International Forestry Research: 11-58.
Gambiza, J., E. Chidumayo, et al. (2010). Livestock
and Wildlife. The Dry Forests and Woodlands in Africa - Managing for
products and services. B. Campbell. London, Earthscan:
179-204.
Goheen, J. R., T. P. Young, et al. (2007).
"Consequences of herbivory by native ungulates for the reproduction of a
savanna tree." Journal of Ecology 98: 129-138.
Hosier, H. H. (1993). "Charcoal production and environmental
degradation." Energy Policy 21: 491-509.
IUCN. (2012). "IUCN Red List of Threatened Species." Retrieved
08/08/2012, from
http://www.iucnredlist.org.
Janis, C. (2008). An evolutionary history of browsing and
grazing ungulates. The Ecology of Browsing and Grazing. I. J. Gordon and
H. H. T. Prins. Heidelberg, Springer: 21-45.
Kabulu, D. J., I. Bamba, et al. (2008). "Analyse de
la structure spatiale des forêts au Katanga." Ann. Fac. Sc.
Agro. I.2: 12-18.
Lawton, R. M. (1978). "A study of the Dynamic Ecology of
Zambian Vegetation." Journal of Ecology 66: 175-198.
Legendre, P. and L. Legendre (1998). Numerical Ecology.
Amsterdam, Elsevier.
Linder, H. P., J. C. Lovett, et al. (2005). A
numerical re-evaluation of the Sub-Saharan phytochoria. Plant Diversity and
Complexity Patterns - Local, Regional and Global Dimensions. I. Friis and
H. Balslev. Copenhagen, Royal Danish Academy of Sciences and Letters.
Malaisse, F. (1979). "L'homme dans la forêt claire
zambézienne. Contribution à l'étude de
l'écosystème forêt claire (Miombo)." African Economic
History 7.
Malaisse, F. (1997). Se nourrir en forêt claire
africaine: Approche écologique et nutritionnelle. Gembloux, Les
presses agronomiques de Gembloux.
Malaisse, F. and K. Binzangi (1985). "Wood as a source of fuel
in Upper-Shaba (Zaïre)." Commonwealth Forestry Review
64: 227-239.
Malaisse, F. and I. Kapinga (1987). "The influence of
deforestation on the hydric balance of soils in the Lubumbashi environment
(Shaba, Zaïre)." Bulletin de la Société Royale Botanique
Belge 119: 116-178.
Malambo, F. M. and S. Syampungani (1998). "Opportunities and
challenges for sustainable management of miombo woodlands: the Zambian
perspective." Working Papers of the Finnish Forest Research
Institute 98: 125-130.
Malimbwi, R., E. Chidumayo, et al. (2010). Woodfuel.
The Dry Forests and Woodlands of Africa - Managing for products and
services. E. Chidumayo and D. Gumbo. London, Earthscan:
155-178.
Maurel, H. (2006). "République démocratique du
Congo - Violence, affairisme et politique au
Katanga." Retrieved 07/08/2012, from
http://www.rfi.fr/actufr/articles/073/article_40980.asp.
Mayaux, P., E. Bartholome, et al. (2004). "A new
land-cover map of Africa for the year 2000." Journal of
Biogeography 31: 861-877.
Mikembo. (2002). "Projets de l'ASBL Mikembo." Retrieved
30/07/2012, from
http://www.mikembo.org/fr_index.html.
Mittermeier, R. A., C. G. Mittermeier, et al. (2003).
"Wilderness and Biodiversity Conservation." Proceedings of the National
Academy of Sciences 100: 10309-10313.
Murray, M. G. and A. W. Illius (2000). "Vegetation
modification and resource competition in grazing ungulates "
Oikos 89(501-508).
Mwase, W. F., A. Bjornstad, et al. (2006). "The role
of land tenure in conservation of tree and shrub species diversity in miombo
woodlands of southern Malawi." New Forests 33:
297-307.
Olff, H., M. E. Ritchie, et al. (2002). "Global
environmental controls of diversity in large herbivores." Nature
415: 901-904.
Planton, H. and P. Chardonnet (1995). Etat de la faune
sauvage: Fiches techniques. Faune sauvage africaine: la ressource
oubliée (Tome 1). P. Chardonnet. Luxembourg, Commission
Européenne: 335-368.
PNUD-RDC (2009). Province du Katanga - Profil
résumé: Pauvreté et conditions de vie des ménages,
Programme des Nations Unies pour le Développement - Unité de
lutte contre la pauvreté: 20.
Prins, H. and H. Olff (1998). Species richness of African
grazer assemblages: Towards a functional explanation. Dynamics of Tropical
Communities. D. Newbery, H. Prins and N. Brown. Oxford, Blackwell
Scientific.
Prins, H. H. T. and H. P. van der Jeugd (1993). "Herbivore
population crashes and Woodland Structure in East Africa." Journal of
Ecology 81: 305-314.
Ribot, J. C. (1993). "Forestry policy and charcoal production
in Senegal." Global Ecology and Biogeography 8:
291-300.
Ricklefs, R. E. and G. L. Miller (2005). Ecologie.
Bruxelles, De Boeck Université.
Rondeux, J. (1999). La mesure des arbres et des peuplements
forestiers. Gembloux, Les presses agronomiques de Gembloux.
Schmitz, A. (1971). La végétation de la
plaine de Lubumbashi (Haut-Katanga). Bruxelles, Publications de l'Institut
national pour l'étude agronomique du Congo (I.N.E.A.C.).
Schouteden, H. (1946). "De zoogdieren van Belgish-Congo en van
Ruanda-Urundi." Ann. Mus. Belg. Congo 3: 333-576.
Sène, E. H. (1976). "Effets des feux précoces et
tardifs sur la végétation."
Shackleton, S. and D. Gumbo (2010). Contribution of Non-wood
Forest Products to Livelihoods and Poverty Alleviation. The Dry Forests and
Woodlands of Africa - Managing for products and services. E. Chidumayo and
D. J. Gumbo. London, Earthscan: 63-92.
Shumba, E., E. Chidumayo, et al. (2010). Biodiversity
of Plants. The Dry Forests and Woodlands of Africa - Managing for products
and services. E. Chidumayo and D. Gumbo. London, Earthscan:
43-62.
Smith, P. and Q. Allen (2004). Field guide to the Trees and
Shrubs of the Miombo Woodlands. Richmond, Royal Botanic Gardens, Kew.
Syampungani, S. (2008). Vegetation change analysis and
ecological recovery of the Copperbelt miombo woodland of Zambia. South Africa,
University of Stellenbosch.
Sys, C. and A. Schmitz (1959). Carte des sols et de la
végétation du Congo belge et du Ruanda-Urundi. 9-Région
d'Elisabethville (Haut-Katanga). Bruxelles, Publications de l'Institut
national pour l'étude agronomique du Congo belge (I.N.E.A.C.).
Timberlake, J., E. Chidumayo, et al. (2010).
Distribution and Characteristics of African Dry Forests and Woodlands. The
Dry Forests and Woodlands of Africa - Managing for
products and services. E. Chidumayo and D. Gumbo. London,
Earthscan: 11-42.
Vanleeuwe, H. (2009). Recensement des grands mammifères
et impacts humains - Parcs nationaux de l'Upemba et des Kundelungu, Wildlife
Conservation Society.
Vranken, I., K. J. Djibu, et al. (2011). "Ecological
impact of habitat loss on African landscapes and biodiversity." Advances in
Environmental Research 14: 365-388.
White, F. (1983). The Vegetation of Africa: A descriptive
Memoir to Accompany the UNESCO/AETFAT/UNSO Vegetation Map of Africa.
Paris, UNESCO.
9. Annexes
A. 1. Image satellite de la zone d'étude

A. 2. Fiches d'inventaire
(cm)
Sou-
che
Hauteur
(m)
Azi-
mut
min (cm)
Hauteur
Dégats
Hauteur
max (cm)
abrouties
Tiges
Espèce
Nombre
de tiges
|
|
|
|
|
|
|
|
|
|
|
|
|
Fiche placette
|
|
|
|
|
Nom site :
|
|
|
|
|
|
|
Communauté
:
|
|
|
|
ID placette :
|
|
|
|
X :
|
|
|
|
Y :
|
|
|
|
N° Waypoint :
|
|
|
|
N° Photos :
|
|
|
|
Récolteur dendro
:
|
|
|
Récolteur
herbacé :
|
|
|
|
Récolteur pédo
:
|
|
|
|
Date dendro :
|
|
|
|
Date herbacé
:
|
|
|
|
Date pédo
:
|
|
|
|
Sol
|
|
N° éch
:
|
|
|
|
Profondeur :
|
|
|
|
Charge :
|
|
|
|
pH :
|
|
|
|
Couleur :
|
|
|
|
Couvert strates
(%)
|
|
Dominante
|
|
|
|
Dominée
|
|
|
|
Herbacée
|
|
|
|
Total
|
|
|
|
Strate herbacée (cm)
|
|
Hauteur N
|
|
|
|
Hauteur E
|
|
|
|
Hauteur S
Hauteur O
|
|
|
|
Arbres références
|
|
Numéro arbre
|
|
Distance (m)
|
|
|
|
|
|
|
|
|
|
|
Azimut
|
Pourcentage de la surface occupée par un
termitière
Pourcentage
Nombre tiges mortes
Remarques
|
ID Placette :
Fiche d'inventaire du peuplement (>2 cm de
diamètre)
Espèce
Diamètre
ID Placette :
Fiche d'inventaire de la
régénération (< 2 cm de
diamètre).
Dénombrement
N°
Arbre
A. 3. Espèces de grande faune présentes
à Mikembo

Bubale Céphalophe de Grimm (Crédit :
Patrick
Dieudonné)
Cobes à croissant Cobes de Vardon (Crédit : ONG
BAR)
Elands du Cap Girafe
Grand koudou Guib harnaché
Crédit photographique : Margaux Muyle (sauf si
contraire indiqué)

Hippotragues Impalas
Phacochère (Crédit : WAZA) Zèbres
de Burchell
A. 4. Liste des espèces inventoriées
dans le peuplement
Référence : Flora of Zambia (
http://zambiaflora.com/)
*: National Botanic Garden of Belgium - The BR Herbarium
Catalogue (
http://www.br.fgov.be)
**: Flora Zambesiaca (
http://apps.kew.org/efloras/)
Famille Sous-famille Espèce
Anacardiaceae Lannea discolor (Sond.)
Engl.
Anisophylleaceae Anisophyllea boehmii
Engl.
Annonaceae Annona senegalensis Pers.
subsp. senegalensis
Hexalobus monopetalus (A. Rich.) Engl. & Diels
Uvariastrum hexaloboides (R.E.Fr.) R.E.Fr.
Apocynaceae Diplorhynchus condylocarpon
** (Muell. Arg.) Pichon
Bignoniaceae Markhamia obtusifolia
(Baker) Sprague
Celastraceae Gymnosporia sp. (Wight
& Arn.) Hook. f.
Chrysobalanaceae Parinari curatellifolia
Planch. ex Benth.
Clusiaceae Garcinia huillensis ** Welw.
ex Oliv.
Combretaceae Combretum acutifolium
Exell
Combretum collinum Fresen.
Combretum molle R.Br ex G. Don Combretum zeyheri
Sond.
Terminalia sp. L.
Connaraceae Rourea orientalis Baill.
Dipterocarpaceae Marquesia macroura
Gilg
Monotes africanus A. DC.
Monotes katangensis (De Wild.) De Wild.
Euphorbiaceae Maprounea africana
Müll. Arg.
Fabaceae Caesalpinioideae Afzelia
quanzensis Welw.
Brachystegia boehmii Taub. Brachystegia
longifolia Benth. Brachystegia spiciformis Benth.
Brachystegia stipulata De Wild. Brachystegia taxifolia Harms
Brachystegia wangermeeana De Wild.
Erythrophleum africanum (Welw. ex Benth.) Harms
Julbernardia globiflora (Benth.) Troupin
Julbernardia paniculata (Benth.) Troupin
Piliostigma thonningii (Schumach.) Milne-Redh.
Senna petersiana (Bolle) Lock
Mimosoideae Acacia polyacantha
Willd. subsp. campylacantha (Hochst. ex A. Rich.) Brenan
Acacia sp. Mill.
Albizia adianthifolia (Schumach.) W. Wight
Albizia antunesiana Harms
Albizia versicolor Welw. ex Oliv.
Dichrostachys cinerea (L.) Wight & Arn.
Fabaceae Papilionoideae Bobgunnia
madagascariensis (Desv.) J.H. Kirkbr. & Wiersama
Dalbergia boehmii Taub. subsp. boehmii Dalbergia
nitidula Welw. ex Baker Erythrina abyssinica Lam. ex DC.
Pericopsis angolensis (Baker) Meeuwen Philenoptera katangensis
* (De Wild.) Shrire Pterocarpus angolensis DC.
Pterocarpus tinctorius * Welw.
Hypericaceae Harungana madagascariensis
Lam. ex Poir.
Psorospermum febrifugum Spach
Irvingiaceae Phyllocosmus lemaireanus
(De Wild. & T. Durand) T. Durand & H. Durand
Lamiaceae Vitex madiensis Oliv. subsp.
madiensis
Loganiacee Strychnos cocculoides
Baker
Strychnos innocua Delile Strychnos spinosa
Lam.
Malvaceae Sterculia quinqueloba
(Garcke) K. Schum.
Thespesia garckeana F. Hoffm.
Melastomataceae Memecylon flavovirens
Baker
Meliaceae Ekebergia benguelensis Welw.
ex C.DC.
Moraceae Ficus ingens (Miq.) Miq.
Ficus sp. L. - Figs
Myrtaceae Sizigium guineense (Willd.)
DC.
Ochnaceae Ochna schweinfurthiana F.
Hoffm.
Phyllanthaceae Antidesma venosum E.
Mey. ex Tul.
Bridelia duvigneaudii J. Léonard
Hymenocardia acida Tul.
Phyllanthus muellerianus (Kuntze) Exell
Pseudolachnostylis maprouneifolia Pax
Uapaca kirkiana Müll. Arg.
Uapaca nitida Müll. Arg.
Uapaca pilosa Hutch.
Uapaca sansibarica Pax
Uapaca sp. Baill.
Polygalaceae Securidaca longipedunculata
Fresen.
Proteaceae Protea angolensis Welw.
Rhamnaceae Ziziphus abyssinica Hochst.
ex A. Rich.
Rubiaceae Canthium crassum ** Hiern
Gardenia ternifolia Schumach. & Thonn. subsp.
jovis-tonantis var. jovis-tonantis Rothmannia engleriana (K.
Schum.) Keay
Sapindaceae Allophylus africanus P.
Beauv.
Sterculiaceae Dombeya rotundifolia
(Hochst.) Planch.
A. 5. Liste des espèces inventoriées
dans la régénération
Référence : Flora of Zambia (
http://zambiaflora.com/)
*: National Botanic Garden of Belgium - The BR Herbarium
Catalogue (
http://www.br.fgov.be)
**: Flora Zambesiaca (
http://apps.kew.org/efloras/)
Famille Sous-famille Espèce
Anacardiaceae Lannea discolor (Sond.)
Engl.
Anisophylleaceae Anisophyllea boehmii
Engl.
Annonaceae Hexalobus monopetalus (A.
Rich.) Engl. & Diels
Uvariastrum hexaloboides (R.E.Fr.) R.E.Fr.
Apocynaceae Diplorhynchus condylocarpon
** (Muell. Arg.) Pichon
Bignoniaceae Markhamia obtusifolia
(Baker) Sprague
Celastraceae Gymnosporia sp. (Wight
& Arn.) Hook. f.
Chrysobalanaceae Parinari curatellifolia
Planch. ex Benth.
Clusiaceae Garcinia huillensis ** Welw.
ex Oliv.
Combretaceae Combretum acutifolium
Exell
Combretum collinum Fresen.
Combretum molle R.Br ex G. Don Combretum sp.
Loefl.
Combretum zeyheri Sond.
Terminalia sp. L.
Connaraceae Rourea orientalis Baill.
Dipterocarpaceae Marquesia macroura
Gilg
Monotes katangensis (De Wild.) De Wild.
Fabaceae Caesalpinioideae
Brachystegia boehmii Taub.
Brachystegia
longifolia Benth. Brachystegia spiciformis Benth.
Brachystegia stipulata De Wild. Brachystegia taxifolia Harms
Brachystegia wangermeeana De Wild. Erythrophleum africanum
(Welw. ex Benth.) Harms
Julbernardia globiflora (Benth.) Troupin
Julbernardia paniculata (Benth.) Troupin
Piliostigma thonningii (Schumach.) Milne-Redh.
Senna petersiana (Bolle) Lock
Mimosoideae Acacia polyacantha
Willd. subsp. campylacantha (Hochst. ex A. Rich.) Brenan
Acacia sp. Mill.
Albizia adianthifolia (Schumach.) W. Wight
Albizia antunesiana Harms
Albizia versicolor Welw. ex Oliv.
Dichrostachys cinerea (L.) Wight & Arn.
Fabaceae Papilionoideae Bobgunnia
madagascariensis (Desv.) J.H. Kirkbr. & Wiersama
Dalbergia boehmii Taub. subsp. boehmii Dalbergia
nitidula Welw. ex Baker Erythrina abyssinica Lam. ex DC.
Pericopsis angolensis (Baker) Meeuwen Pterocarpus
angolensis DC.
Pterocarpus tinctorius * Welw.
Hypericaceae Harungana madagascariensis
Lam. ex Poir.
Psorospermum febrifugum Spach
Irvingiaceae Phyllocosmus lemaireanus
(De Wild. & T. Durand) T. Durand & H. Durand
Lamiaceae Vitex madiensis Oliv. subsp.
madiensis
Loganiacee Strychnos cocculoides
Baker
Strychnos innocua Delile Strychnos spinosa
Lam.
Melastomataceae Memecylon flavovirens
Baker
Meliaceae Ekebergia benguelensis Welw.
ex C.DC.
Myrtaceae Sizigium guineense (Willd.)
DC.
Ochnaceae Ochna schweinfurthiana F.
Hoffm.
Phyllanthaceae Antidesma venosum E.
Mey. ex Tul.
Bridelia duvigneaudii J. Léonard
Hymenocardia acida Tul.
Phyllanthus muellerianus (Kuntze) Exell
Pseudolachnostylis maprouneifolia Pax
Uapaca nitida Müll. Arg. Uapaca pilosa
Hutch. Uapaca sansibarica Pax Uapaca sp. Baill.
Polygalaceae Securidaca longipedunculata
Fresen.
Proteaceae Protea angolensis Welw.
Rhamnaceae Ziziphus abyssinica Hochst.
ex A. Rich.
Rubiaceae Canthium crassum ** Hiern
Gardenia ternifolia Schumach. & Thonn. subsp.
jovis-tonantis var. jovis-tonantis
Rothmannia engleriana (K. Schum.) Keay
Sapindaceae Allophylus africanus P.
Beauv.
Sterculiaceae Dombeya rotundifolia
(Hochst.) Planch.

A. 6. Photos-types des communautés
présentes dans Mikembo
Crédits photographiques : Margaux Muyle
Fourré à Uapaca spp. Forêt
hétérogène à Brachystegia boehmii
Forêt hétérogène à
Julbernardia globiflora Forêt hétérogène
à Julbernardia paniculata

Forêt ancienne à Pterocarpus tinctorius
Savane boisée à Combretum acutifoliosum et
Terminalia sp.
Savane arborée à Acacia spp. Savane
arborée à Acacia polyacantha
A. 7. Distribution des pieds de Uapaca spp.
par classes de
grosseur (espèce par espèce)
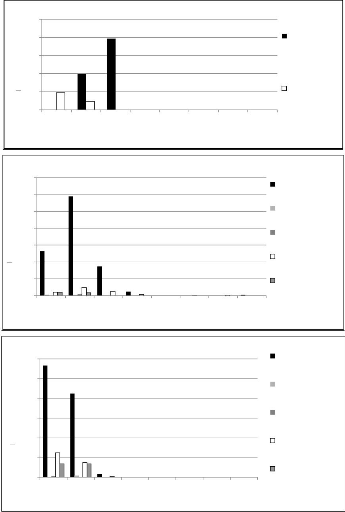
Distribution de Uapaca kirkiana
20
16
Fourré à Uapaca spp.
12
8
Forêt
hétérogène à J. globiflora
NHA (pieds/ha)
4
0
Classe de diamètre (cm)
35-40
15-20
10-15
25-30
30-35
20-25
02-05
05-10
2 0 - 2 5
1 5 - 2 0
1 0 - 1 5
3 5 - 40
3 0 - 3 5
2 5 - 3 0
0 2 -0 5
0 5 - 1 0
1400
Distribution de Uapaca nitida
Fourré à Uapaca spp.
Forêt hétérogène à J.
paniculata
Forêt ancienne à P. tinctorius
Forêt hétérogène à J.
globiflora
Forêt hétérogène à B.
boehmii
1200
1000
800
600
400
200
0
N H A (pieds/ha)
Classe de diamètre (cm)
Distribution de Uapaca pilosa
Fourré à Uapaca
Classe de diamètre (cm)
300
1 5 - 2 0
1 0 - 1 5
3 5 - 40
3 0 - 3 5
2 0 - 2 5
2 5 - 3 0
0 2 -0 5
0 5 - 1 0
spp.
250
Forêt hétérogène à J.
paniculata
200
Savane boisée à C. acutifoliosum et
Terminalia sp. Forêt hétérogène
à
J. globiflora
N H A (pieds/ha)
150
100
50
Forêt hétérogène à B.
boehmii
0
Pour une raison de lisibilité, les graphes n'ont pas
été mis à la même échelle.
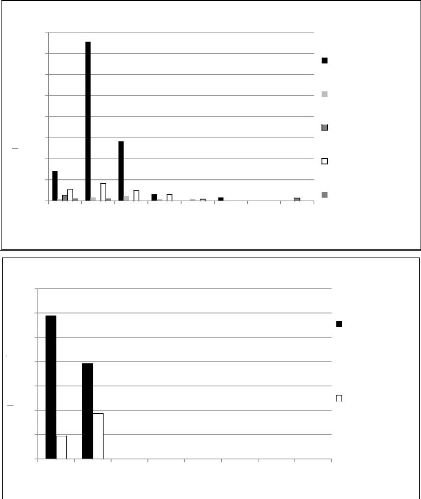
14
12
10
8
6
4
2
0
N H A (pieds/ha)
Forêt hétérogène à J.
paniculata
Forêt hétérogène à J.
globiflora
Distribution de Uapaca sp.
3 5 - 4 0
1 0 - 1 5
1 5 - 2 0
3 0 - 3 5
2 5 - 3 0
2 0 - 2 5
Distribution de Uapaca sansibarica
Classe de diamètre (cm)
Fourré à Uapaca spp.
Forêt hétérogène à J.
paniculata
Forêt ancienne à P. tinctorius
Forêt hétérogène à J.
globiflora
Forêt hétérogène à B.
boehmii
02-05
15-20
25-30
30-35
05-10
10-15
20-25
35-40
400
350
300
NHA (pieds/ha)
250
200
150
100
50
0
0 5 - 1 0
0 2 - 0 5
Classe de diamètre (cm)
A. 8. Influence de la charge caillouteuse du sol sur
les espèces
végétales
|
Charge caillouteuse
|
Pas de charge
|
|
Espèce
|
IV
(%)
|
Espèce
|
IV (%)
|
|
Peuplement par strate
|
Dalbergia boehmii arbo.
|
43.1
|
|
|
Albizia antunesiana arbo.
|
38.83
|
|
Pericopsis angolensis arbo.
|
35.44
|
|
Julbernardia paniculata arbo.
|
35.37
|
|
Julbernardia paniculata dom.
|
33.33
|
|
Strychnos innocua arbo.
|
26.59
|
|
Ekebergia benguelensis arbu.
|
25.34
|
|
Brachystegia boehmii arbu.
|
24
|
|
Brachystegia boehmii arbo.
|
22.47
|
|
Marquesia macroura dom.
|
19.9
|
|
Combretum collinum dom.
|
19.05
|
|
Marquesia macroura arbo.
|
17.29
|
|
Albizia adianthifolia dom.
|
14.29
|
|
Brachystegia wangermeeana arbo.
|
14.29
|
|
Uapaca sp. arbu.
|
14.29
|
|
Brachystegia wangermeeana arbu.
|
14.08
|
|
Anisophyllea boehmii arbo.
|
13.43
|
|
Peuplement
|
Albizia antunesiana
|
46.33
|
|
|
Phyllocosmus lemaireanus
|
40.92
|
|
Julbernardia paniculata
|
32.35
|
|
Strychnos innocua
|
31.34
|
|
Ekebergia benguelensis
|
24.97
|
|
Brachystegia boehmii
|
23.22
|
|
Marquesia macroura
|
20.51
|
|
Uapaca sp.
|
14.29
|
|
Brachystegia wangermeeana
|
14.17
|
|
Régénération
|
Phyllocosmus lemaireanus
|
61.23
|
Monotes katangensis
|
26.94
|
|
Pseudolachnostylis maprouneifolia
|
52.77
|
|
|
Ochna schweinfurthiana
|
47.18
|
|
Rothmannia engleriana
|
32.35
|
|
Anisophyllea boehmii
|
27.32
|
|
Julbernardia paniculata
|
26.27
|
|
Canthium crassum
|
25.75
|
|
Brachystegia boehmii
|
24.14
|
|
Dicrostachus cynerea
|
19.19
|
|
Ouvariastrum hexaloboides
|
16.93
|
|
Brachystegia wangermeeana
|
14.29
|
|
Erythrophleum africana
|
13.11
|
|
Uapaca sp.
|
12.56
|
A. 9. Distribution des pieds de Diplorhynchus
condylocarpon
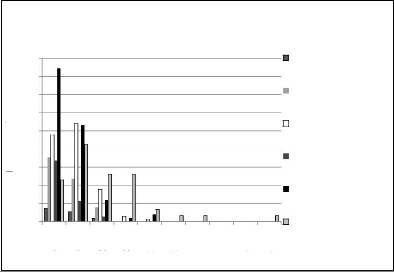
Distribution de Diplorhynchus
condylocarpon
Classe de diamètre (cm)
Savane boisée à C. acutifoliosum et
Terminalia sp. Fourré à Uapaca spp.
Forêt hétérogène à J.
globiflora
Forêt hétérogène à B.
boehmii
Forêt hétérogène à J.
paniculata
Forêt ancienne à P. tinctorius
10-15
15-20
25-30
30-35
40-45
45-50
02-05
05-10
20-25
35-40
180
160
140
NHA (pieds/ha)
120
100
80
60
40
20
0
par classe de grosseur
| 


