|
Troubles de la conduction auriculo-ventriculaire,
à propos de 64 cas colligés au service de Cardiologie de
l'Hôpital Aristide Le Dantec de Dakar

INTRODUCTION
La contraction du myocarde nécessite une impulsion
électrique qui se propage à l'intérieur du coeur. Cet
influx se propage dans les différentes cavités cardiaques des
oreillettes aux ventricules à travers les voies de conduction
auriculo-ventriculaire.
Les troubles de la conduction auriculo-ventriculaire consistent
donc en une perturbation (ralentissement ou interruption) de l'influx
électrique des oreillettes aux ventricules à travers le noeud
auriculo-ventriculaire, le tronc du faisceau de His, et ses branches de
division.
Il s'agit de troubles conductifs de siège, de degré
et d'étiologie variables. Ils peuvent être aigus et transitoires
ou chroniques et définitifs.
Leur diagnostic, orienté par les manifestations
fonctionnelles évocatrices, est essentiellement
électrocardiographique.
Le risque évolutif majeur est la syncope exposant aux
traumatismes, aux accidents domestiques, du travail ou de la circulation et
à la mort subite en cas de syncope prolongée ( par asystolie
ventriculaire longue ou par dégénérescence d'une torsade
de pointe en fibrillation ventriculaire ).
La stimulation cardiaque a radicalement transformé le
pronostic des blocs auriculo-ventriculaires en supprimant le risque de mort
subite et plus récemment en améliorant la qualité de vie
des patients grâce aux nouveaux modes de stimulation.
Le plein essor que connaît la stimulation cardiaque
actuellement au SENEGAL, particulièrement dans la prise en charge des
blocs auriculo-ventriculaires, nous a conduit à aborder ce sujet afin
d'en apprécier les aspects épidémiologiques,
diagnostiques, électrocardiographiques, thérapeutiques et
évolutifs, à la clinique cardiologique du CHU de l'hôpital
Aristide Le DANTEC de DAKAR durant la période allant de janvier 2002
à octobre 2003.


LA CONDUCTION INTRA-CARDIAQUE
La genèse et la conduction de l'ordre électrique de
contraction à l'ensemble des
cellules musculaires cardiaques résultent de
l'activité du tissu nodal fait de cellules myocardiques
spécialisées, ayant des propriétés
différenciées de la contractilité et de
l'excitabilité et organisées à l'intérieur de
diverses structures anatomiques. Ce tissu nodal comprend plusieurs
structures.
I - Le noeud sinusal de Keith et Flack
C'est une structure sous-épicardique de 15 mm de long sur
5 mm de large située au niveau de la jonction de la veine cave
supérieure sur la face antérieure de l'oreillette droite. Il est
formé de cellules nodales : cellules « P » (
pacemaker ), de cellules transitionnelles et de cellules auriculaires
myocardiques. Il génère des décharges spontanées
à la fréquence de 60 à 100 par minute, ce qui en fait le
centre d'automatisme primaire le plus haut situé du tissu nodal. Il est
régulé par le tonus sympathique ( qui augmente la
fréquence de dépolarisation ) et parasympathique (qui diminue la
fréquence de dépolarisation). La propagation de l'influx
né du noeud sinusal se fait de proche en proche au reste du myocarde
auriculaire. La vitesse de conduction y est lente de l'ordre 0,01 à 0,05
mètre par seconde ( m/s ).
II - Le noeud auriculo-ventriculaire ( NAV )
d'ASCHOFF-TAWARA
C'est une structure de 6 mm de long sur 5 mm de large
située à la base de l'oreillette droite au niveau du septum
inter-auriculaire. Il est formé de deux voies, l'une à conduction
lente (alfa), l'autre à conduction rapide ( bêta ). Il ralentit
l'influx d'un dixième de seconde (conduction
décrémentielle), protégeant ainsi les ventricules d'un
rythme primaire trop rapide. Ainsi tous les stimuli rapides parvenant au noeud
auriculo-ventriculaire, comme au cours d'une tachycardie atriale ne peuvent
être conduits aux ventricules. En l'absence de tachycardie atriale
pathologique, le rôle du NAV est de synchroniser les contractions
atriales et ventriculaires.
Il est vascularisé par l'artère du NAV et est sous
l'influence du système sympathique (accélérateur de la
conduction auriculo-ventriculaire) et du système nerveux parasympathique
( frénateur).
La conduction nodale peut être perturbée par
certains médicaments (digitalines, bêta-bloquants, amiodarone,
anticalciques bradycardisants qui sont ralentisseurs de la conduction nodale)
et par l'ischémie. Les facteurs métaboliques jouent
également un rôle : l'hypokaliémie déprime la
conduction dans le NAV.
III - Les voies inter nodales
Elles font la jonction entre le noeud sinusal, les oreillettes et
le NAV. Il s'agit :
- du faisceau inter nodal antérieur,
- du faisceau de Bachman,
- du faisceau inter nodal moyen de Wenckebah,
- du faisceau inter nodal postérieur de Thorel,
- des voies accéssoires de Mahaim, James et Kent.
IV - Le système His- Purkinje
Il est constitué par le faisceau de His et le
réseau de Purkinje.
A - Le faisceau de His
Il est long de 1 à 2 cm, situé sous l'angle
d'insertion des valves tricuspides et fait la jonction entre le NAV qu'il
prolonge et les ventricules par ses deux branches. La conduction s'y effectue
à haute vitesse ( 1 à 2 m/s ). Il se divise en deux
branches :
· Une branche droite, prolongement direct du faisceau de
His ; elle chemine le
long du sillon inter ventriculaire se dispersant dans le
ventricule droit.
· Une branche gauche qui se subdivise en deux faisceaux l'un
antérieur et
l'autre postérieur, avec quelquefois une ramification
septale.
Le faisceau de His est par ailleurs un centre d'automatisme
secondaire, car il propage, certes, l'influx de l'étage auriculaire
à l'étage ventriculaire, mais il est aussi capable de
décharger spontanément des impulsions à la
fréquence de 40 à 60/min. La conduction n'y est pas
influencée par le système neurovégétatif. La
transmission de l'influx peut être ralentie ou interrompue en cas
d'ischémie, d'hyperkaliémie importante ( supérieure
à 6,5 mEq/l) ou d'intoxication par les anti-arythmiques de classe Ia ou
Ic.
Du fait de cette faible sensibilité aux facteurs
extrinsèques, le système de His est plus souvent siège de
blocs auriculo-ventriculaires chroniques dégénératifs que
de blocs auriculo-ventriculaires transitoires.
B - Le réseau de Purkinje
Ce sont les ramifications terminales des branches droite et
gauche du faisceau de HIS qui s'étendent sur toute la musculature
ventriculaire pour propager l'influx. C'est aussi un centre d'automatisme
tertiaire capable de décharger spontanément des impulsions
à la fréquence de 20 à 40 par minute.
V - La conduction antérograde et
rétrograde
La conduction normale, allant des oreillettes aux ventricules est
dite antérograde. Cependant, la conduction peut aller dans le sens
inverse, à partir d'une extrasystole ventriculaire par exemple, elle est
appelée alors conduction rétrograde. Cette conduction
bidirectionnelle peut être source de troubles du rythme et d'un certain
nombre de complications en stimulation cardiaque.
VI - Les périodes réfractaires
La dépolarisation myocardique s'accompagne d'une
période réfractaire subdivisée en période
réfractaire absolue (PRA) et période réfractaire relative
(PRR). Pendant la PRA, un stimulus électrique n'entraîne aucune
réponse. La PRR suit immédiatement la PRA, le myocarde y est
stimulable, mais avec un niveau d'énergie supérieur (15 à
25 fois) au niveau d'énergie minimale nécessaire à la
dépolarisation, lorsque la stimulation est appliquée en dehors
des périodes réfractaires.
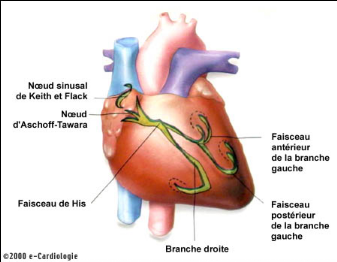
Figure 1 : Le tissu nodal

ELECTROCARDIOGRAMME DES BLOCS AV
I - Classification selon le degré
C'est la classification habituelle des BAV, basée sur les
données de l'ECG. Selon l'importance du trouble conductif, on distingue
trois degrés de bloc auriculo-ventriculaire ( bloc AV ).
A - Le bloc AV du premier degré
Il se définit par un allongement de l'espace PR
au-delà de 0,20 s chez l'adulte et 0,18 s chez l'enfant. Toutes les
impulsions atriales sont conduites aux ventricules mais avec un retard. Cela se
traduit par un simple ralentissement de la conduction AV avec conservation
d'une transmission des ondes d'excitation auriculaires aux ventricules sur le
mode 1/1.
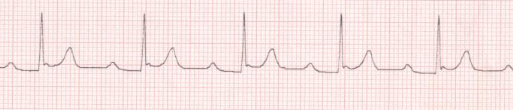
Figure 2 : BAV du 1er
degré avec un PR = 0,30 S.
B - Les BAV du deuxième degré
Certaines ondes P ne sont pas suivies de complexes QRS. Deux
types sont décrits.
1 - Le type I de Möbitz ou périodes de
Wenckebach :
Dans ce type, il se produit un allongement progressif de l'espace
PR jusqu'au blocage d'une onde P. Les PR varient par raccourcissement
progressif des intervalles RR.
L'espace PR le plus long est celui qui précède
l'onde P bloquée et le plus court est celui qui la suit. La durée
de la pause incluant l'onde P bloquée est inférieure à
deux fois la longueur du cycle PP.
Le rapport de conduction le plus fréquent est 3/2 ( trois
ondes P pour deux QRS ), les périodes les plus longues sont rarement
supérieures à dix battements sinusaux.
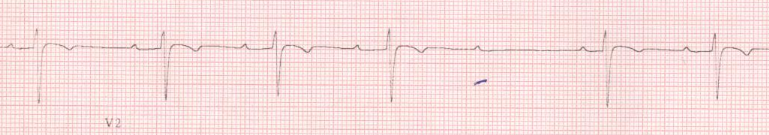
Figure 3 : BAV
2ème degré type I = phénomène de
Wenckebch
2 - Le type II de Möbitz
Il se caractérise par un blocage inopiné d'une onde
P non prématurée, sans allongement préalable des espaces
PR qui sont normaux ou allongés, mais fixes.
La pause incluant l'onde P bloquée est égale
à deux cycles PP. Les complexes QRS ont un aspect de bloc de branche
dans deux tiers des cas.
C - Blocs auriculo-ventriculaires à période
fixe
Ø Dans la forme habituelle 2/1, une onde P sur deux n'est
pas suivie de QRS;
l'anomalie est constante ou du moins se reproduit sur plusieurs
cycles.
L'intervalle PP comportant un QRS est plus court que celui qui
n'en comporte pas (arythmie sinusale ventriculophasique). Ces blocs peuvent
appartenir au type I ou au type II. La prolongation de l'espace PR et l'absence
de bloc de branche sont en faveur du bloc de type I, alors que la
présence d'un intervalle PR normal et d'un bloc de branche font
plutôt suspecter un bloc de type II.
Ø Dans les blocs de haut degré, le nombre d'ondes P
conduites est inférieur à celui
des ondes P bloquées avec une conduction de type 3/1, 4/1
ou plus.
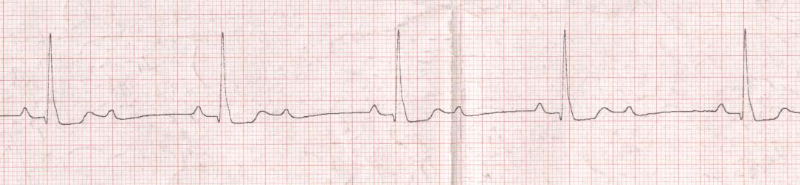 Figure 4 : BAV de haut degré 2/1 Figure 4 : BAV de haut degré 2/1
D - BAV du troisième degré ou bloc AV
complet
Il correspond à une dissociation complète de la
conduction AV, aucune onde P n'est conduite aux ventricules.
La fréquence et la morphologie des complexes QRS
d'échappement dépendent de la localisation du foyer de
suppléance. Plus ce foyer est bas, plus la fréquence
ventriculaire est basse et plus les QRS sont larges. Le rythme auriculaire est
le plus souvent sinusal avec comme dans les blocs 2/1 une arythmie
ventriculophasique, mais il peut être ectopique ( fibrillation
auriculaire, flutter auriculaire, tachycardie atriale ). En cas de fibrillation
auriculaire l'existence d'un rythme ventriculaire parfaitement régulier
et lent est le signe formel d'un BAV complet.
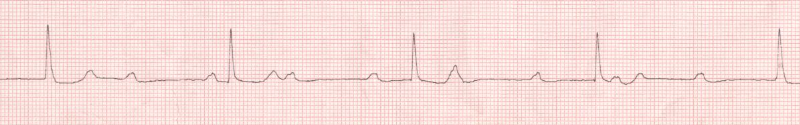
Figure 5 : BAV complet sur rythme
auriculaire sinusal
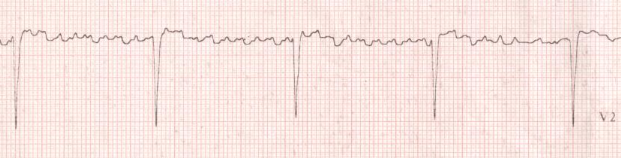
Figure 6 : BAV complet sur
fibrillation auriculaire
II - Diagnostic du siège
La classification classique en trois degrés
apparaît insuffisante car la sévérité du trouble
conductif qui conditionne le pronostic et guide la thérapeutique n'est
pas toujours corrélée au degré du bloc mais dépend
essentiellement de son siège.
En prenant pour référence le tronc du faisceau de
His, on distingue trois catégories:
Ø les blocs suprahissiens se situent en amont du tronc
commun et sont en général
dus à une atteinte du noeud AV ;
Ø les blocs intrahissiens ou tronculaires correspondent
à des lésions très localisées
sur le faisceau de His ;
Ø les blocs infrahissiens relèvent d'une atteinte
bilatérale des voies de conduction
auriculo-ventriculaire.
Les enregistrements endocavitaires permettent avec plus de
précision de différencier les blocs nodaux ou suprahissiens des
blocs sous-nodaux, intra- ou infra -hissiens. Mais dans bon nombre de cas,
l'ECG de surface peut situer le siège du bloc.
A - ECG de surface
Deux critères fondamentaux sont à prendre en
considération dans l'analyse de l'ECG : la largeur des QRS conduits
ou d'échappement et le degré du bloc AV.
1 - La largeur des QRS conduits ou
d'échappement
Ø L'existence de QRS fins (inférieurs à
0,12s), est une condition nécessaire pour
affirmer que le bloc siège au niveau du NAV ou dans le
faisceau de His.
Ø Lorsque les QRS sont larges (supérieurs à
0,12 s), aucune conclusion ne peut
être tirée car cette morphologie peut se rencontrer
en cas de bloc AV bas situé ou haut situé avec trouble de
conduction intra ventriculaire associé. Le type de bloc de branche est
alors à prendre en considération. L'atteinte sous-nodale,
fréquente dans le bloc de branche gauche, est beaucoup plus rare en cas
de bloc de branche droite isolé ou avec déviation axiale.
2 - Le degré du bloc
Ø Dans les blocs AV du premier degré, seuls les
allongements de PR au-delà de
0,30 s sont en faveur d'une atteinte nodale, en sachant que le
bloc peut quelquefois siéger à deux étages. Pour les
allongements moindres, la durée du PR n'a aucune valeur
prédictive et c'est la morphologie des QRS qui prime. Lorsqu'ils sont
fins, le bloc AV est nodal dans la majorité des cas et plus rarement
intrahissien. Lorsqu'ils sont élargis, le bloc siège le plus
souvent à l'étage infrahissien de façon isolée ou
en association avec des lésions plus haut situées, parfois
à l'étage nodal et rarement
dans le tronc du faisceau de His.
Ø Dans les blocs AV du deuxième degré, le
type I correspond souvent à une
atteinte nodale, parfois à un bloc infrahissien et
rarement à un bloc tronculaire. L'élargissement des QRS signe en
général l'association d'une atteinte bas située à
un trouble de conduction nodale.
Le type II traduit toujours une lésion sous-nodale
localisée parfois au tronc commun et le plus souvent aux branches. Le
bloc 2/1 siège une fois sur deux dans les branches, dans 27% des cas
dans le NAV et 23% des cas dans le tronc commun.
Ø Dans le bloc AV du troisième degré, les
localisations nodale et tronculaire se
rencontrent chacune avec la même fréquence (50%)
lorsque les QRS sont fins. L'aspect élargi des QRS témoigne
souvent d'un bloc infra-hissien.
La localisation d'un trouble conductif sur l'ECG de surface peut,
dans certains cas, être facilitée par les épreuves
dynamiques. Les manoeuvres vagales ont un effet dépendant du
siège du bloc : elles accentuent le degré du bloc
situé dans le noeud AV alors qu'elles l'améliorent en cas de
lésions sous-nodales par ralentissement de la fréquence
sinusale. L'injection d'atropine a un effet bénéfique sur les
blocs nodaux et est délétère sur les blocs plus bas
situés.
B - Enregistrement Holter
Il peut faciliter le diagnostic topographique, il aurait une
sensibilité au moins égale à celle de l'exploration
électro-physiologique pour les localisations nodales ou tronculaires.
Les variations de la fréquence cardiaque au cours du
nycthémère peuvent entraîner une variation du degré
du bloc.
C - Enregistrement du potentiel hissien
C'est la méthode de diagnostic topographique la plus
précise. Il permet, lorsque le rythme est sinusal de distinguer trois
types de bloc : bloc suprahissien ou nodal, bloc intrahissien ou
tronculaire et bloc infrahissien.
1 - Blocs suprahissiens
Ø En cas de bloc du premier degré, l'intervalle
auriculogramme (A) - potentiel
hissien (H) dépasse 110 ms. Pour les degrés
supérieurs la rupture intermittente ou permanente de la conduction entre
A et H les caractérise.
Ø Le bloc du deuxième degré type I
suprahissien se reconnaît par l'allongement
progressif de l'espace AH avant la rupture de conduction.
Ø Le bloc complet de siège nodal correspond
à une dissociation entre les ondes A
et les QRS d'échappement qui naissent dans le tronc du
faisceau de His, comme en témoigne le potentiel hissien qui les
précède toujours.
2 - Blocs intrahissiens
Ø En cas de bloc du premier degré, le potentiel
hissien est déformé et élargi
(supérieur à 30 ms) ou plus typiquement
dédoublé en deux composantes, l'une proximale H1 et
l'autre distale H2 qui restent toujours liées mais qui sont
écartées d'au moins de 20 ms.
Ø En cas de bloc AV du deuxième degré de
type II ou de bloc à periode fixe 2/1, les
ondes A bloquées de façon intermittente sont toutes
suivies d'un potentiel H1, cela suffit pour faire le diagnostic de
bloc tronculaire si les QRS sont fins. Si les QRS sont larges, ce diagnostic ne
peut être affirmé qu'à condition de retrouver un
dédoublement du potentiel hissien lorsque les auriculogrammes sont
conduits.
Ø Dans les rares cas de bloc AV du deuxième
degré type I, on assiste à un
allongement progressif de l'intervalle
H1-H2 avant l'auriculogramme bloqué qui est suivi
par un potentiel H1.
Ø En cas de bloc AV complet, il y a rupture de la
conduction entre le potentiel H1
qui reste lié à l'auriculogramme et le potentiel
H2 précédant les ventriculogrammes.
3 - Blocs infrahissiens
Ø Dans le bloc du premier degré, on note un
allongement de l'espace HV au-delà
55 ms qui s'accompagne rarement d'une prolongation de l'espace
PR.
Ø Dans les blocs de degrés supérieurs, les
auriculogrammes bloqués sont toujours
suivis d'un potentiel hissien. En cas de bloc AV de type II
Mobitz ou de type 2/1, les ventriculogrammes conduits peuvent être
précédés d'un espace HV normal ou allongé. Lorsque
le bloc AV est complet, on ne retrouve jamais de potentiel hissien devant les
ventriculogrammes d'échappement. Dans tous les cas,
l'élargissement des QRS est une condition nécessaire pour
affirmer le siège infrahissien.
Le diagnostic topographique est très souvent difficile en
cas de bloc AV complet sur arythmie atriale car la déflexion hissienne
peut être masquée par l'activité auriculaire ectopique. On
suspecte un bloc intra ou infrahissien lorsque le foyer d'échappement se
laisse facilement déprimer par une stimulation ventriculaire rapide.
III - Foyers de suppléance
En cas de BAV complet, la tolérance et le pronostic
dépendent essentiellement des propriétés du foyer de
suppléance. Plus ce foyer est bas situé, plus lente est sa
fréquence de décharge, et plus grande est son instabilité.
Lorsque le bloc est de siège nodal, les foyers de suppléance sont
nodohissiens hauts et assurent, de façon stable, une fréquence de
40 à 60 par minute pouvant s'accélérer à
l'effort ; ce qui contribue à la bonne tolérance de ce type
de bloc. A l'inverse, lorsque le trouble conductif est de siège
infranodal, les foyers de suppléance sont situés à la
partie basse du faisceau de His, dans ses branches ou dans le système de
Purkinje.
Ils ont alors une fréquence moindre (de 20 à 40 par
minute) pouvant se ralentir considérablement, avec à
l'extrême la survenue d'une asystolie prolongée.
IV - Conséquences des blocs
auriculo-ventriculaires
A - Syncopes
Elles sont liées à l'ischémie
cérébrale le plus souvent secondaire à une pause cardiaque
ou à une bradycardie extrême ( 5 à 10 par minute ).
Dans 10% des cas le mécanisme électrophysiologique
est une torsade de pointe sur fond de bradycardie majeure et durable. Une
dégénérescence en fibrillation ventriculaire est possible,
cause de mort subite avec l'asystolie prolongée chez les patients
atteints de BAV.
B - Perturbations hémodynamiques
Elles sont essentiellement liées à la bradycardie,
à la perte du synchronisme auriculo-ventriculaire et à la place
de la systole auriculaire.
La bradycardie entraîne la diminution du débit
cardiaque dont l'augmentation à l'effort est étroitement
dépendante de l'accélération de la fréquence
cardiaque.
La perte de la coordination des systoles auriculaires et
ventriculaires joue un rôle hémodynamiquement important : au
repos la systole auriculaire assure 20% du volume d'éjection systolique
et peut atteindre 50% en cas d'altération de la fonction pompe et
surtout de la fonction diastolique ventriculaire gauche.
La perturbation du synchronisme physiologique entraîne deux
phénomènes délétères sur le plan
hémodynamique :
- Élévation de la pression auriculaire droite et
capillaire pulmonaire.
- Absence de contribution de la systole auriculaire au
remplissage ventriculaire.
Si le foyer de suppléance est ventriculaire,
l'asynchronisme de contraction des ventricules entraîne des
conséquences hémodynamiques indépendantes de la
fréquence cardiaque et de la place de la systole auriculaire.

ASPECTS CLINIQUES
I - Type de description : Le Bloc AV complet
permanent dégénératif ou
« pouls
lent permanent »
A - Circonstances de découverte
Le bloc AV est souvent asymptomatique et est découvert
à l'occasion d'un examen clinique mettant en évidence une
bradycardie ou lors d'un ECG systématique.
Dans les autres cas, l'attention est attirée par des
manifestations fonctionnelles souvent caractéristiques que nous allons
décrire.
1 - Accidents d' Adams Stockes
L'accident typique est la syncope brève, à
l'emporte pièce, à début brutal, avec chute,
résolution musculaire complète, révulsion des globes
oculaires, pâleur, absence de pouls. La reprise de la conscience se fait
intégralement après reprise d'une activité ventriculaire,
avec une rapidité qui dépend de la durée de l'arrêt
circulatoire. Le plus souvent, la fin est rapide en 10 à 15
secondes ; dans quelques cas, la syncope dépasse 20 secondes et
s'accompagne alors de troubles respiratoires, de mouvements convulsifs
(accès pseudo comitiaux), d'incontinence sphinctérienne et de
mydriase.
Exceptionnellement, lorsque l'anoxie cérébrale est
longue, un coma plus ou moins profond est observé, soit après une
crise unique et longue, soit dans l'intervalle d'un état de mal syncopal
avec une grande bradycardie inter-critique.
Les équivalents mineurs de l'anoxie
cérébrale sont représentés par le faux vertige,
l'état lipothymique ou l'obnubilation transitoire.
2 - Autres manifestations cliniques
2-1- Manifestations d'insuffisance cardiaque gauche ou
globale
Elles surviennent surtout chez les patients porteurs d'une
cardiopathie organique. Elles sont fréquentes dans les blocs AV
chroniques avec bradycardie permanente, mais l'on peut également les
rencontrer dans les blocs AV du premier degré avec un intervalle PR
très long plaçant l'onde P à la fin du QRS
précédent.
2 - 2 - Manifestations d'effort
Certains blocs AV
« fréquence-dépendants », habituellement de
siège tronculaire ou infrahissien, sont absents au repos et se
démasquent préférentiellement à l'effort par une
dyspnée, des lipothymies, des douleurs angineuses ou le plus souvent une
« blockpnée ». L'ECG d'effort est alors très
utile pour le diagnostic qui peut être également apporté
par l'injection d'atropine ou la stimulation auriculaire à
fréquence croissante.
2 - 3 - Manifestations d'insuffisance circulatoire
cérébrale
Fréquentes chez le sujet âgé, elles se
traduisent par une altération des fonctions intellectuelles, des
troubles psychiques à type de confusion, et de désorientation et
dans certains cas par des états lacunaires chez des sujets devenus
progressivement grabataires. Ces manifestations sont en réalité
moins liées à la bradycardie qu'à un état
encéphalique très détérioré et s'observent
principalement en cas
d'athérosclérose cérébrale
importante. Avant d'envisager l'implantation d'un stimulateur cardiaque
définitif, il est utile de soumettre ces patients à une
stimulation provisoire pour s'assurer des possibilités
d'amélioration.
2 - 4 - Mort subite
Le risque d'arrêt circulatoire irréversible fait
planer sur tout malade non appareillé par un stimulateur cardiaque le
spectre de la mort subite.
Elle peut compliquer une asystolie ventriculaire longue ou
survenir à la suite d'un trouble du rythme majeur (dégradation
d'une torsade de pointe en fibrillation ventriculaire).
B - Examen physique
Les BAV de troisième degré ont comme expression
clinique un pouls lent permanent. Une fréquence cardiaque
inférieure à 40 /min, non influencée par l'effort,
les émotions ou la fièvre, témoigne d'un rythme de
substitution ventriculaire bas situé.
A l'auscultation cardiaque les contractions auriculaires
dissociées des contractions ventriculaires peuvent déterminer des
bruis sourds perçus lors des diastoles longues (systoles en écho)
ou un renforcement intermittent du premier bruit lorsque la systole auriculaire
coïncide avec la fermeture des valves auriculo-ventriculaire (bruit de
«canon »). Un souffle systolique, éjectionnel peut
être perçu au foyer mitral de même qu'un élargissent
de la différentielle. On constate parfois une dissociation entre les
battements jugulaires, reflet des contractions auriculaires à
fréquence normale, et les impulsions radiales rythmées par la
bradycardie. Des signes d'insuffisance cardiaque congestive peuvent être
observés en cas de cardiopathie sous-jacente ou non.
C - Électrocardiogramme
Le BAV du troisième degré est
caractérisé par une absence totale de conduction d'ondes P aux
ventricules. Il existe alors une dissociation complète entre
l'activité électrique des oreillettes et des ventricules. (voir
deuxième chapitre)
II - Formes cliniques
A - Le bloc AV paroxystique
Il s'agit d'un problème diagnostique difficile à
résoudre, se posant chez un patient qui présente une
symptomatologie le plus souvent à type de syncope ou de lipothymie.
1 - Aspects cliniques
La perte de connaissance revêt une grande valeur
diagnostique. Elle est très évocatrice lorsqu'il s'agit d'une
syncope à l'emporte-pièce (syncope d'Adams stokes). Son
début et sa fin sont brusques. Elle n'est ni
précédée de prodromes, ni suivie de signes post-critiques.
L'absence habituelle de signes annonciateurs explique la fréquence des
traumatismes liés à la chute.
Selon certains auteurs la syncope typique du BAV paroxystique est
spécifique dans 75% des cas, pour d'autres auteurs elle n'a pas de
caractère typique et qu'il faut évoquer son diagnostic devant
toute perte de connaissance inexpliquée.
Les troubles de conduction au niveau du tronc ou
à l'étage infra- hissien sont latents.
2 - Aspects électrocardiographiques
L'électrocardiogramme est le plus souvent normal en dehors
des malaises. Les seules anomalies possédant une valeur
diagnostique formelle sont les suivantes :
Ø Un bibloc alternant : un bloc de branche droite
alternant avec un bloc de branche
gauche.
Ø Un vrai bloc tri fasciculé : bloc de branche
droit alternant avec un hémibloc antérieur et un hémibloc
postérieur.
Ø L'association d'un bloc de branche droit et d'un
hémibloc postérieur.
Ø L'association d'un PR long à un bloc de branche
prend de la valeur lorsque le
bloc intéresse la branche gauche ou quand il y a une
association d'un bloc de branche droit et d'un hémibloc
postérieur.
Enfin il faut signaler l'intérêt de
l'évolutivité des troubles conductifs dans le temps.
3 - L'enregistrement Holter
La sensibilité du Holter est faible pour le diagnostic de
BAV paroxystique à l'étage soushissien. L'enregistrement d'un BAV
exclusivement en période nocturne, à la faveur d'une hypertonie
vagale est considérée comme physiologique.
Dans tous les cas, l'électrocardiogramme endocavitaire est
nécessaire montrant un trouble conductif significatif.
4 - L'exploration électrophysiologique
endocavitaire ( EE )
Le recours à l'EE est indispensable lorsque chez un
patient symptomatique les éléments cliniques et
électrocardiographiques sont insuffisants. Elle permet d'étudier
la qualité de la conduction au niveau de chaque composante de la
jonction auriculo-ventriculaire. Le diagnostic de BAV paroxystique reposera
notamment sur :
Ø l'existence à l'état basal d'un
allongement significatif de l'intervalle HV 70 ms
(distance entre les potentiels hissien et ventriculaire);
Ø un potentiel hissien déformé et
élargi ( 30 ms) ou plus typiquement dédoublé;
Ø l'obtention d'un bloc du deuxième degré
infra-nodal pour des fréquences de
stimulation relativement basses (150/min).
Le risque de manifestation paroxystique est lié au
degré du bloc auriculo-ventriculaire et à l'existence d'anomalies
de conduction intra-ventriculaires associées. Des épreuves de
stimulation à l'ajmaline permettent d'estimer ce risque.
B - Formes selon le degré du bloc AV
1 - Blocs AV du premier degré
Ils sont le plus souvent asymptomatiques sauf lorsque l'espace PR
est supérieur à 300 ms. Dans ce cas la contraction atriale se
fait sur des valves auriculo-ventriculaires partiellement fermées et
sera responsable de signes d'insuffisance cardiaque droite. On peut percevoir
à l'auscultation un galop de sommation.
2 - Blocs AV du deuxième degré
Ils peuvent être découverts à l'occasion de
dyspnée d'effort, d'asthénie ou de lipothymies. Cependant ils
n'entraînent des signes fonctionnels qu'en cas de bradycardie importante
( BAV de haut degré, bradycardie sinusale ) ou de cardiopathie
sous-jacente.
Les blocs AV de type I ou II sont responsables d'intermittences
ventriculaires qui se différencient des extrasystoles
prématurées par la constatation de « trous »
perçus simultanément à l'auscultation cardiaque et la
prise du pouls.
3 - Blocs AV du troisième degré
Ils sont rarement asymptomatiques. Même en l'absence de
signes fonctionnels, ils se traduisent par une sémiologie clinique qui
permet de suspecter le diagnostic avant la réalisation de
l'électrocardiogramme. Le pouls est lent en permanence, non
influencé par les manoeuvres vagales ou l'effort.

ETIOLOGIES DES BLOCS AV
Il convient de distinguer les BAV aigus, le plus souvent
transitoires, des BAV chroniques. Le diagnostic entre BAV aigu et BAV chronique
peut être difficile et il faut tenir compte de l'age, du contexte
clinique et des données électrocardiographiques, de la prise
éventuelle de médicaments et de l'évolution du trouble
conductif. Dans le doute, il est raisonnable de ne pas procéder trop
vite à un appareillage définitif et cela d'autant que le sujet
est jeune à coeur sain.
I - Blocs auriculo-ventriculaires aigus
Les causes de blocs auriculo-ventriculaires aigus sont
dominées par l'infarctus du myocarde
A - Blocs auriculo-ventriculaires dans l'infarctus du
myocarde
L'infarctus du myocarde récent représente la
principale cause de bloc AV aigu. La mortalité demeure
élevée chez les sujets présentant cette complication.
Il est classique d'opposer les blocs AV des infarctus
antérieurs à ceux des infarctus inférieurs en raison d'une
évolution et d'un pronostic différents.
1 - Blocs auriculo-ventriculaires de l'infarctus
inférieur du myocarde
Dans l'infarctus du myocarde postéro-inférieur ou
postérieur, le BAV est fréquent, de siège nodal. Ils sont
fréquents en cas d'extension au ventricule droit et seraient plus
fréquents si l'infarctus inférieur est associé à un
sous-décalage de ST de V1 à V6. Quand ils
surviennent précocement, ils sont liés à l'hypervagotonie
(réflexe de Bezold-Jarisch) et sont donc sensibles à l'atropine.
Lorsqu'ils surviennent tardivement (quatrième ou cinquième jour)
ils sont dus à l'ischémie du NAV. L'installation du bloc est
progressive du premier au troisième degré. Les complexes QRS sont
habituellement fins avec une fréquence ventriculaire qui dépasse
généralement 40 / min et reste stable. Ils sont presque toujours
localisés au NAV.
Il n'existe aucun risque de pause ventriculaire et la
régression est habituelle au bout de quelques jours. Le risque
d'asystolie est très faible.
Sur le plan hémodynamique, ils sont habituellement bien
tolérés mais peuvent s'accompagner d'hypotension en rapport avec
une dysfonction droite ou une augmentation du tonus vagal qu'à une
défaillance du ventricule gauche.
Le retour à une conduction auriculo-ventriculaire normale
a habituellement lieu par palier dans un délai variant de quelques
heures à plusieurs jours.
La mortalité hospitalière est de l'ordre de 15% en
cas de bloc AV complet et atteint 41% lorsqu'une dysfonction ventriculaire
droite lui est associée.
2 - Blocs auriculo-ventriculaires de l'infarctus
antérieur du myocarde
Le bloc auriculo-ventriculaire est plus rare et lié
à un bibloc de branche ou un bloc tri-fasciculé. Ces blocs sont
toujours associés à des nécroses étendues
intéressant massivement le septum. L'apparition est brutale ( 12- 24
heures après le début de l'infarctus ), mais toujours
précédée des troubles de la conduction intra
ventriculaire
et le risque de pause est important. Ce peut être un bloc
auriculo-ventriculaire de 2ème degré type II ou
à période fixe ou plus souvent un bloc auriculo-ventriculaire de
3ème degré avec rythme d'échappement lent et
instable: les QRS sont toujours larges. Le pronostic est très
sévère avec une mortalité hospitalière lourde,
voisine de 70 à 80 %, plus en rapport avec l'étendue de la
nécrose qu'au trouble de la conduction. La guérison se fait sur
un mode incomplet avec risque de récidive.
B - Les blocs auriculo-ventriculaires
infectieux
1 - L'endocardite bactérienne
Elle peut léser le tissu conductif à partir d'un
abcès septal. Un bloc AV est observé plus fréquemment en
cas de localisation aortique que mitrale et les blocs du deuxième ou du
troisième degré ne sont présents que dans les abcès
aortiques.
2 - Le rhumatisme articulaire aigu et la
diphtérie
La myocardite compliquant une poussée de rhumatisme
articulaire aigu ou une diphtérie reste classique.
Le bloc rhumatismal est habituellement nodal et se limite
généralement à un simple allongement de PR mais peut
atteindre le deuxième ou le troisième degré.
Le bloc diphtérique est plus grave car il est dû
à des lésions plus diffuses de siège sous-nodal
3 - Autres causes infectieuses
Des troubles conductifs peuvent être observés lors
de nombreuses maladies infectieuses : rougeole, mononucléose
infectieuse, hépatite, oreillons rickettioses...
Au cours de la maladie de Lyme ( spirochétose due à
Borrelia burgdorferi), un BAV de degré variable peut survenir.
Le diagnostic suspecté en présence de
manifestations cutanées, articulaires ou méningées dans un
contexte fébrile, est confirmé par les résultats de la
sérologie. L'évolution de la maladie est favorable sous
traitement antibiotique avec régression de la plupart des blocs en une
à deux semaines et disparition totale pratiquement de tous les blocs en
6 semaines; passé ce délai il faut discuter l'indication d'une
stimulation cardiaque définitive.
C - Les blocs auriculo-ventriculaires
iatrogènes
1 - Les blocs auriculo-ventriculaires
médicamenteux
Ø L'intoxication digitalique occupe la première
place. Le bloc est toujours nodal,
régresse progressivement et disparaît sans laisser
de séquelles.
Ø Les bêtabloquants, les anticalciques
bradycardisants ( vérapamil, diltiazem ) et
l'amiodarone dépriment la conduction nodale et
déterminent un bloc AV en cas de surdosage ou d'atteinte
préalable du noeud AV.
Ø Les anti-arythmiques de classe Ia et Ic ralentissent la
conduction sous nodale et
peuvent pour certaines concentrations sériques
élevées, être responsables de BAV transitoires, surtout si
la conduction dans le système His - Purkinje est déjà
pathologique.
2 - Blocs auriculo-ventriculaires et chirurgie
cardiaque
Ils s'observent surtout dans les interventions visant à
corriger certaines cardiopathies congénitales (communication
interventriculaire, communication auriculo-ventriculaire, transposition des
gros vaisseaux) et après chirurgie valvulaire.
Leur régression est possible lorsqu'ils sont de
siège nodal. Passé un délai de trois semaines, on peut les
considérer comme définitifs.
3 - Bloc AV traumatique lors du
cathétérisme cardiaque droit
Ils surviennent chez des patients déjà porteurs
d'un bloc de branche gauche complet.
4 - Le bloc auriculo-ventriculaire compliquant une
procédure d'ablation
Le traitement curatif des tachycardies jonctionnelles par
ablation du circuit de réentrée intra nodale peut se compliquer
de bloc AV complet. Le bloc peut être immédiat ou retardé
jusqu'à trois jours après l'ablation
II - Les blocs auriculo-ventriculaires
chroniques
A - Les blocs auriculo-ventriculaires
congénitaux
Le bloc auriculo-ventriculaire congénital est
défini ( Yater ) comme un trouble de conduction documenté,
découvert chez un sujet jeune présentant une bradycardie
indiscutable et précoce, en l'absence d'histoire infectieuse qui aurait
pu le provoquer après la naissance. C'est une affection rare ( 1 cas sur
20000 naissances ), le bloc est soit associé à une malformation
congénitale soit isolé. Les lésions anatomiques des blocs
auriculo-ventriculaires congénitaux à QRS fins sont
représentées soit par l'absence de connexion entre les fibres
musculaires du septum auriculaire et le NAV, isolé dans du tissu, soit
par une lésion du tronc commun du faisceau de His, interrompu
partiellement ou totalement par une expansion du trigone fibreux ou par
l'insuffisance de développement du faisceau de His, rudimentaire et
agénésique.
La découverte est parfois foetale grâce à
l'échographie anténatale. Après la naissance le diagnostic
est électrocardiographique, le bloc n'est pas toujours complet et fixe,
son degré pouvant se majorer au fil des années. Chez le foetus,
le bloc auriculo-ventriculaire isolé s'accompagne habituellement d'un
rythme d'échappement supérieur à 60/ min et autorise un
accouchement par les voies naturelles
1 - Le bloc auriculo-ventriculaire congénital
isolé
C'est une maladie immunologique de la mère qui en est la
cause, expliquant le caractère parfois familial de l'affection. Son
origine congénitale n'est indiscutable que s'il a été
diagnostiqué dès la naissance ou même in utero. Les blocs
isolés apparaissent alors qu'une maladie de système est
présente chez la mère à la naissance ou est
découverte assez longtemps après.
Les anticorps maternels sont capables, en traversant le placenta
de passer dans la circulation foetale, d'induire une inflammation myocardique
spécifique qui altère de façon permanente le tissu de
conduction du coeur foetal en développement.
Des anticorps anti-Ro ( SSA ) sont retrouvés chez 85% des
mères et un anticorps de type Ig G à la
ribonucléoprotéine soluble peut être présent dans
le sérum des nouveau-nés et de leur mère, qu'elle ait ou
non des symptômes.
Pendant longtemps, le BAV congénital a été
considéré comme relativement bénin et bien
toléré, mais les études récentes montrent qu'il
peut être responsable d'asthénie, d'intolérance à
l'effort, de lipothymies, de syncopes ou de mort subite non
prévisible.
Quelques observations de BAV familial ont été
rapportées. Il serait transmis sur le mode autosomique dominant. Il se
rencontre dans la même famille ou sur plusieurs
générations.
2 - Le bloc AV congénital associé à
une cardiopathie congénitale
Cette association se rencontre dans environ un tiers des cas.
Quatre types de malformations cardiaques sont classiques :
Ø La fibrose endomyocardique
Ø Les anomalies morphologiques à proximité
du système conductif ( transposition
des gros vaisseaux, isomérisme gauche )
Ø Le canal artériel
Ø La communication inter auriculaire type ostium primum.
B - Les blocs auriculo-ventriculaires acquis
dégénératifs
Ils représentent la cause la plus fréquente des BAV
chroniques (38 % d'après Davies) et s'observent dans plus de 75% des cas
chez les sujets âgés de plus 65 ans. Le dénominateur commun
est la présence d'une fibrose sévère, image histologique
d'un processus ancien, cicatriciel, sans caractère spécifique.
Le processus sclérodégénératif
atteint dans trois quarts des cas, uniquement la partie moyenne ou distale des
branches sans lésions du myocarde adjacent, comme on l'observe dans la
maladie de Lenègre qui prédomine chez l'homme.
Dans 15 à 20 % des cas, les lésions siègent
préférentiellement sur la partie proximale et gauche du
système His - Purkinje au niveau de la bifurcation du faisceau de His et
de la partie toute initiale de la branche gauche ( maladie de Lev ).
Les lésions dégénératives ne touchent
le noeud auriculo-ventriculaire que dans
5 -10 % des cas.
L'évolution du processus est lente et le BAV complet est
précédé pendant des années par des témoins
électriques de lésions latentes localisées à un ou
plusieurs segments des voies de conduction et par des phases de bloc AV
paroxystique
C - Les blocs auriculo-ventriculaires acquis
d'étiologie définie
1 - Les valvulopathies aortiques
Les voies de conduction AV sont altérées dans la
partie haute du septum par des mouvements de tiraillement et de torsion, par la
pénétration de spécules calcaires en cas de sténose
aortique calcifiée et par les microtraumatismes du faisceau de His dus
au jet régurgitant en cas d'insuffisance aortique importante. Des BAV de
tous degrés ont été décrits, mais les blocs
complets sont exceptionnels; il s'agit le plus souvent d'un bloc du premier
degré.
2 - Les myocardiopathies
Le bloc AV est rare dans les variétés
dilatées, il est exceptionnel dans les variétés
hypertrophiques.
3 - Le bloc auriculo-ventriculaire par infiltration
septale
L'atteinte du tissu conductif est due à la présence
de dépôts amyloïdes (amylose cardiaque), ferriques
(hémochromatose) et exceptionnellement topacés (goutte) ou
oxaliques (oxalose).
Une infiltration septale peut s'observer également au
cours des leucémies ou de la maladie de Hodgkin.
4 - Bloc auriculo-ventriculaire et tumeurs
cardiaques
Le mésothéliome, tumeur bénigne
localisée au NAV, provoque la dégénérescence
kystique de cette structure et est responsable d'un BAV à QRS fins.
Les sarcomes primitifs du coeur se développent dans la
partie haute du septum, atteignent les branches du faisceau de His .
Les autres tumeurs intéressent volontiers le NAV ou la
portion initiale du tronc du faisceau de His.
Au cours du SIDA, la localisation cardiaque de lymphomes malins
peut être
responsable de trouble de la conduction AV de haut degré
5 - Bloc auriculo-ventriculaire et maladies
systémiques
Un trouble conductif peut s'observer au cours du lupus
érythémateux disséminé, de la dermatomyosite, de la
sclérodermie, de la spondylarthrite ankylosante, de la polyarthrite
rhumatoïde, de la poly-chondrite atrophiante, et de la sarcoïdose
6 - Bloc auriculo-ventriculaire et myopathies
Dans la maladie de Steinert, un allongement de PR n'est pas rare
et BAV pourrait être responsable de mort subite.
Le syndrome de Kearns et Sayre, associe une ophtalmoplégie
externe bilatérale, une rétinite pigmentaire et des troubles
conductifs par atteinte des voies infrahissiennes compliqués de syncopes
dans 45 % des cas .
D - Les blocs auriculo-ventriculaires chroniques
iatrogènes
1 - Interruption volontaire de la jonction
auriculo-ventriculaire
C'est une indication posée en cas d'arythmies auriculaires
rebelles au traitement médical. Les lésions induites par la
radiofréquence sont très localisées au NAV et
évoluent vers la fibrose homogène. Le pourcentage de patients
stimulo-dépendants
serait de l'ordre de 30 %.
2 - Les blocs auriculo-ventriculaires
radiques
Ils sont rares et la radiothérapie ne peut être
incriminée qu'après avoir éliminé les autres causes
de BAV.
Ils apparaissent après une irradiation médiastinale
supérieure à 35 Gray, avec un temps de latence très long
pouvant atteindre 20 ans. Leur survenue est précédée d'une
atteinte péricardique, voire de bloc de branche.
III - Bloc auriculo-ventriculaire et hypertonie vagale
Le bloc auriculo-ventriculaire vagal siège toujours au
niveau du NAV et est ainsi associé à des QRS fins. La clé
du diagnostic du BAV vagal est la présence d'un ralentissement sinusal
plus ou moins marqué. Il peut être reproduit par les manoeuvres
vagales et le test d'inclinaison ou apparaître lors de la phase de
récupération d'une épreuve d'effort.
L'hypertonie vagale peut être aiguë et se traduire par
des malaises ou des syncopes en rapport avec une brusque stimulation
parasympathique réflexe. Elle peut aussi être chronique, notamment
chez des sujets jeunes et sportifs, et entraîner sur un fond de
bradycardie un bloc du premier degré ou du deuxième degré
de type I qui s'observe au repos chez 9 % des athlètes soumis à
un entraînement intensif. Ces blocs asymptomatiques disparaissant
à l'effort doivent être considérés comme
physiologiques au même titre que ceux observés par enregistrement
Holter en période nocturne chez des patients jeunes.

TRAITEMENT DES BLOCS AV
I - Buts
Le risque majeur que court tout malade porteur d'un trouble de la
conduction auriculo-ventriculaire est la mort subite. L'on comprend
aisément que pour traiter un tel malade il faut se fixer au moins les
objectifs suivants :
- Restaurer un rythme ventriculaire et / ou atrial permettant
d'assurer les besoins métaboliques de l'organisme.
- Éviter et / ou traiter les complications.
- Améliorer le confort de vie du malade.
- Prolonger la survie.
II - Moyens
A - Moyens médicamenteux
· Le chlohydrate d'isoprénaline (Isuprel )
possède des propriétés bêta-1-mimé-
tiques et constitue la drogue la plus utilisée par voie
intraveineuse. Il accélère transitoirement la fréquence du
foyer de remplacement, plus rarement il diminue le degré du bloc ou
même rétablit une conduction auriculo-ventriculaire 1/1.
Habituellement 5 ampoules à 0,2 mg sont diluées dans 250 ml de
sérum glucosé isotonique et le débit de perfusion est
adapté afin de maintenir une fréquence cardiaque entre 40 et 60
par minute. L'hyperexcitabilité ventriculaire induite par la drogue
impose une surveillance continue de l'ECG et peut rendre plus difficile la mise
en place de sondes intracardiaques.
· L'atropine, par ses effets anti-muscariniques, trouve ses
indications dans le
traitement de la bradycardie des BAV par hypertonie vagale.
La voie intraveineuse est la plus utilisée, à la
posologie initiale de 0,5 mg, puis la dose est augmentée par paliers de
0,5 mg sans dépasser 2 mg, jusqu'à obtenir une
amélioration de la conduction auriculo-ventriculaire.
La répétition des injections est limitée par
ses effets secondaires, principalement neurologiques
B - La stimulation cardiaque
1 - Généralités
Les cellules myocardiques sont polarisées au repos et se
dépolarisent quand elles sont excitées quelque soit la nature du
stimulus. Elles sont assimilées à un condensateur
électrique qui déclenche un potentiel d'action si un stimulus
électrique y est appliqué. Pour stimuler le coeur, il faut
créer un champ électrique localisé et temporaire qui
dépolarise quelques cellules cardiaques au voisinage de
l'électrode. Ce rôle est dévolu au système de
stimulation comportant une pile couplée à une sonde munie d'une
électrode en contact avec l'endocarde ou l'épicarde.
Dans le cadre de la stimulation cardiaque définitive, le
site de stimulation est l'électrode négative, celle au contact du
myocarde. Le pôle positif est soit l'électrode proximale d'une
sonde bipolaire, soit le boîtier du stimulateur lui-même en cas de
stimulation unipolaire
2 - Le code international
Les différents modes de stimulation sont classés
selon un code international qui permet de comprendre immédiatement le
fonctionnement d'un stimulateur.
Auparavant, on utilisait un code à trois lettres. Les
progrès de la technique ont obligé à une quatrième
puis une cinquième lettre.
Ø La première lettre désigne toujours le
site de stimulation, soit le ventricule (V),
soit l'oreillette (A), soit les deux (D), soit aucun (0).
S = single ( mono chambre ), désigne
encore le ventricule ou l'oreillette ).
Ø La deuxième lettre désigne le site de
détection selon le même code.
Ø La troisième lettre désigne le mode de
fonctionnement :
· (I) = inhibé;
· (T) = triggered (déclenché
);
· (D) = les deux (inhibé et
déclenché);
· (0) = rien ( ni déclenché,
ni inhibé ).
Ø La quatrième lettre désigne la
programmabilité, la possibilité de
télémétrie ou d'asservissement de
fréquence :
· (0) = non programmable ;
· (P) = jusqu'à deux fonctions
programmables, habituellement la fréquence de base et la durée ou
l'amplitude d'impulsion.
· (M) = Multiprogrammable, avec trois
fonctions ou plus ;
· (C) = Communication : la
possibilité de télémétrie rend le pacemaker
interactif, avec échange bidirectionnel de paramètres. Il peut
être interrogé.
· (R) = Asservissement de fréquence
( augmentation de fréquence à partir des informations fournies
par un capteur mesurant un paramètre lié à l'effort ).
Ø Une cinquième lettre est utilisée pour les
fonctions antitachycardiques :
· (0) = aucune ;
· (P) = Pacing
(antitachyarythmie) ;
· (S) = choc
· (D) = double ( P + S )
3 - Les différents types de stimulateurs et leurs
paramètres programmables
3 - 1 - Les stimulateurs de type mono-chambre
3 - 1 - 1. Le système SSI sans asservissement de
fréquence
Ce mode désigne un fonctionnement sentinelle mono-chambre.
Quand le pacemaker détecte une activité spontanée dans la
cavité implantée, il est inhibé.
Si aucune activité n'a été
détectée, le pacemaker stimule la chambre
considérée. Ce système s'applique aussi bien dans le
ventricule ( VVI ) que dans l'oreillette ( AAI ).
a - Le mode VVI
Stimulation ventriculaire, détection ventriculaire, mode
inhibé sur détection d'une activité ventriculaire.
La stimulation et la détection sont
réalisées par une sonde implantée dans le ventricule
droit. Sur l'ECG de surface, un spike de stimulation est suivi d'un complexe
ventriculaire large, déformé avec un aspect de retard gauche
lié au fait que la stimulation est délivrée dans le
ventricule droit. Les ondes P, ne sont pas détectables par ce
stimulateur. L'activité auriculaire, indépendante de celle des
ventricules, est donc désynchronisée si le patient est en bloc
auriculo-ventriculaire complet.
b - Le mode AAI
Stimulation atriale, détection atriale, mode inhibé
sur détection d'une activité atriale.
Ce mode fonctionne comme le mode VVI, mais il détecte et
stimule grâce à une sonde implantée dans l'oreillette
droite habituellement par voie endocavitaire .
c - Les paramètres programmables dans le
SSI
L'énergie de stimulation
Le contrôle de l'énergie de stimulation repose sur
la programmation d'une amplitude et d'une largeur d'impulsion.
La sensibilité
Pour les systèmes unipolaires, la fourchette de
programmation de la sensibilité se situe, pour l'oreillette, entre 0,25
et 4 mV, et pour le ventricule, entre 1 et 7 mV. En pratique, il est volontiers
programmé une sensibilité de 4 ou 5 mV dans le ventricule et 1,5
à 2 mV dans l'oreillette en configuration unipolaire.
La période réfractaire
C'est l'intervalle de temps qui suit une stimulation ou une
détection dans la chambre implantée, et pendant lequel le
stimulateur, fonctionnant en mode inhibé (ou déclenché) ne
se recycle pas.
Elle se comporte comme la période réfractaire du
tissu de conduction myocardique, mais elle peut être modifiée par
programmation. En mode VVI, la période réfractaire est souvent
programmée entre 220 et 350 ms.
La fréquence de base
La fonction sentinelle d'un stimulateur implique que le pacemaker
n'induit une stimulation que si le rythme cardiaque spontané descend en
dessous d'une certaine fréquence programmée ou calculée.
Pour les pacemakers VVI simples, une fréquence de 70 / min est
habituellement proposée en cas de bloc AV complet.
L'hystérésis de
fréquence
C'est un intervalle de temps ajouté à l'intervalle
de stimulation déclenchée sur tout événement
spontané. IL est programmable soit en fréquence, soit en
intervalle, soit en pourcentage de la fréquence de base.
3 - 1 - 2 - Le système SST
a - En mode VVT
Stimulation ventriculaire, détection ventriculaire,
déclenchement de la stimulation ventriculaire sur détection d'une
activité ventriculaire.
Sur chaque activité spontanée, le stimulateur
déclenche une impulsion qui apparaît dans le complexe QRS et qui
n'aura donc aucun effet car tombant dans la période réfractaire
absolue ventriculaire naturelle. Il y a donc dépense inutile
d'énergie. Ce pendant ce mode est indiqué chez les patients
exposés à de multiples interférences extérieures.
b - Le mode AAT
Stimulation atriale, détection atriale,
déclenchement de la stimulation sur détection d'une
activité atriale.
Ce mode de fonctionnement est identique au mode VVT,
appliqué à l'oreillette.
3 - 1 - 3 - Le système asynchrone S00
Stimulation dans la cavité implantée, pas de
détection, stimulation asynchrone.
Ce mode ne permet pas la détection des
événements spontanés. En conséquence, si le patient
n'est pas totalement dépendant de son stimulateur, une parasystolie peut
être repérée sur l'ECG de surface (compétition).
Cela est potentiellement dangereux, si un stimulus est émis pendant la
période vulnérable après un complexe spontané.
3 - 2 - Les stimulateurs double-chambre
Les stimulateurs double-chambre, surtout en mode DDD ont
été qualifiés de physiologiques. En effet, une
synchronisation harmonieuse entre oreillette et ventricule est assurée
grâce à une sonde atriale et une sonde ventriculaire. Ils offrent
un grand nombre de modes différents qui possèdent leurs
indications propres.
3 - 2 - 1 - Le mode DDD
Stimulation atrio-ventriculaire, détection
atrio-ventriculaire, mode inhibé et déclenché.
Le principe du mode DDD est de synchroniser la stimulation
ventriculaire sur la détection atriale. De plus s'il existe une
activité atiale spontanée, elle inhibera la stimulation
atiale ; il en est de même dans le ventricule.
3 - 2 - 1 - 1 - Les paramètres programmables en
standard
Comme pour les modèles mono-chambre, amplitude de
stimulation, largeur d'impulsion et sensibilité sont
indépendamment programmables dans les oreillettes et dans les
ventricules, selon les mêmes modalités. En fonction du
modèle, on peut programmer la polarité et / ou la
détection, soit de façon conjointe dans les deux chambres, soit
de façon totalement indépendante.
3 - 2 - 1 - 2 - L'intervalle
atrio-ventriculaire
Le délai atrio-ventriculaire ( DAV ) est
l'équivalent électronique de l'intervalle PR physiologique. Dans
la plupart des stimulateurs, il désigne l'intervalle entre les deux
spikes de stimulation atriale et ventriculaire. Le DAV est une période
réfractaire
atriale. Si un QRS spontané est détecté
pendant le DAV, celui-ci est interrompu. Des valeurs de 0 à 300 ms
peuvent être programmées.
3 - 2 - 2 - Le mode DDI
Stimulation atriale et ventriculaire, détection atriale et
ventriculaire, inhibition par les événements atriaux et
ventriculaires.
Ce mode représente une forme particulière de
stimulation double-chambre. La stimulation et la détection sont
possibles dans les deux chambres. Le stimulateur assure la synchronisation AV,
uniquement quand les fréquences atriale et ventriculaire sont
inférieures à la fréquence de base programmée,
c'est à dire uniquement pendant les périodes de bradycardie
sinusale.
Quand le stimulateur détecte des signaux spontanés
auriculaires ou ventriculaires, qui sont à une fréquence
supérieure à la fréquence de base programmée, la
stimulation est inhibée.
3 - 2 - 3 - Les autres modes de stimulation double
chambre
Il s'agit des modes D00, VDD, VAT, DAT, DDT, DVI, VDD(R)
3 - 3 - Les stimulateurs à fréquence
asservie
Ils peuvent être considérés comme des
stimulateurs physiologiques au sens large, car ils adaptent la fréquence
de stimulation aux diverses formes d'exercice. Plusieurs types de capteurs ont
été développés et intégrés aux
stimulateurs disponibles.
3 - 4 - La stimulation antitachycarde
Elle a été utilisée d'abord dans les
troubles du rythme ventriculaires bradycardie-dépendants depuis les
années 60, puis dans la dysfonction sinusale.
4 - Matériel de stimulation
4 - 1 - Le stimulateur
Il comporte un circuit électronique des microprocesseurs
et des moyens de connexion.
4 - 1 - 1 - La source d'énergie ou pile
La source d'énergie utilisée jusque vers les
années 1975 était une pile au zinc-mercure dont les plus gros
défauts sont le dégagement gazeux lors de la décharge et
une courte longévité.
De nos jours, la pile iode-lithium n'induit pas de
dégagement gazeux, ce qui permet la fermeture hermétique de la
pile, et donc son isolement des structures électroniques.
L'inconvénient est une résistance interne
élevée.
4 - 1 - 2 - Les circuits électroniques
La source d'énergie alimente un certain nombre
éléments électroniques :
- le microprocesseur qui comporte une ROM (Read Only Memory)
détentrice
de fonctions et mémoires figées, et une RAM (Random
Access Memory) qui permet le stockage et la lecture d'informations diverses
(programmes, données...) ;
- les circuits électroniques, véritables
effecteurs des microprocesseurs, et bâtis
en couches minces.
4 - 2 - Les sondes
La sonde se compose des éléments suivants :
4 - 2 - 1 - Le conducteur
Le conducteur, maintenant hélicoïdal et multifilaire,
assure une plus grande flexibilité et une plus grande résistance
mécanique. Le conducteur peut être préformé en J
à son extrémité distale pour un emploi auriculaire. Le
matériel isolant doit être biocompatible, d'une parfaite tenue
mécanique et chimique à long terme, et ne pas favoriser la
thrombogénicité
4 - 2 - 2 - Le connecteur
Le conducteur est muni d'un connecteur permettant le contact avec
le stimulateur. Il est parfaitement indispensable de respecter une concordance
entre les deux systèmes. Le connecteur VS1 et IS1, représente le
standard international actuel.
4 - 2 - 3 - L'électrode
C'est l'élément en contact avec l'endocarde.
Certaines électrodes sont munies d'un réservoir central d'un
milligramme de dexaméthasone sodium phosphate fixé sur silicone
à diffusion passive et continue par gradient de concentration. Ceci
permet une réduction considérable et un raccourcissement de la
durée de la réaction inflammatoire initiale
postopératoire ; une stabilisation du seuil chronique à un
niveau plus faible que celui obtenu avec une sonde du même type mais sans
stéroïde.
4 - 2 - 4 - Le système de fixation
La sonde est fixée par différents moyens.
Aujourd'hui, on distingue deux types de sondes :
- Les sondes à barbes avec une fixation passive
grâce à des excroissances du
matériau isolant auprès de l'électrode
distale ;
- Les sondes à vis avec une fixation active à
l'aide d'une vis rétractable ou non,
électriquement active ou non.
Grâce à ces dispositifs, le taux de
déplacement des sondes est devenu très faible.
4 - 3 - Unipolarité ou
bipolarité
Les sondes sont de type unipolaire ou bipolaire.
Dans le type unipolaire, l'électrode de la sonde agit
comme un pôle négatif (cathode) et le boîtier de stimulation
comme un pôle positif (anode) ou un pôle indifférent. Le
champ électrique s'étend de l'électrode distale de la
sonde jusqu'au pôle indifférent du boîtier de stimulation
à travers le thorax et la musculature pectorale.
En configuration bipolaire, le pôle négatif se situe
à l'extrémité de la sonde; le pôle positif est un
anneau situé entre 10 et 25 mm en amont de l'électrode distale.
Les deux pôles de la sonde de stimulation bipolaire sont donc en
position intracardiaque, le champ électrique est seulement
intracardiaque ne traversant pas le thorax.
Ceci permet d'éviter la détection des signaux
d'origine musculaire. Sur l'ECG de surface, le spike de stimulation a une
amplitude plus faible qu'en stimulation unipolaire.
5 - Modes de stimulation
5 - 1 - La stimulation cardiaque temporaire
Plusieurs techniques sont utilisables pour la stimulation
cardiaque temporaire.
5 - 1 - 1 - La stimulation mécanique
Deux méthodes peuvent être utilisées :
le coup de poing sternal et la toux, capable de provoquer une stimulation
mécanique puissante.
5 - 1 - 2 - La stimulation électrique
transcutanée
Un stimulateur externe est connecté à des
électrodes -patchs appliquées sur la cage thoracique après
décapage de la peau. En moyenne, l'intensité appliquée est
de 20 à 80 mA pour obtenir une efficacité de stimulation en 1/1.
Le mode de stimulation est V00 ou VVI. Les effets hémodynamiques sont
proches de ceux de la stimulation
endocavitaire.
5 - 1 - 3 - La stimulation oesophagienne
Elle a été décrite par certains auteurs dans
le cadre de l'urgence.
5 - 1 - 4 - La stimulation endocavitaire
La technique de choix de stimulation cardiaque temporaire reste
la mise en place de sonde temporaire par voie veineuse, connectée
à un stimulateur externe. La mise en place s'effectue sous
anesthésie locale et à l'aide de la fluoroscopie, selon la
méthode de Seldinger. Les voies d'abord veineux sont la
voie basilique, jugulaire externe, jugulaire interne, sous-clavière
et fémorale.
5 - 1 - 5 - La stimulation trans-thoracique
La dernière possibilité technique reste la
stimulation épicardique par mise en place d'électrodes
trans-thoraciques. Elle semble dépassée mais garde ses
indications après chirurgie cardiaque avec la mise en place des
électrodes en per-opératoire.
5 - 2 - La stimulation cardiaque
définitive
Grâce aux progrès technologiques, les stimulateurs
actuellement disponibles sont de petite taille, fiables et dotés de
multiples fonctions destinées à améliorer la
qualité de la stimulation et à en prévenir les
complications.
La technique d'implantation utilise la voie endocavitaire dans 95
% des cas. Les sondes sont introduites dans les cavités cardiaques
droites par la veine céphalique ou la sous-clavière dans la
plupart des cas. Le boîtier est logé en position
sous-cutanée dans la région pectorale. L'abord
épigastrique est utilisé lorsque la voie endocavitaire est
contre-indiquée. La mise en place des sondes par thoracoscopie est
également possible. Les modes de stimulation utilisés sont les
modes mono-chambre et les modes double-chambre.
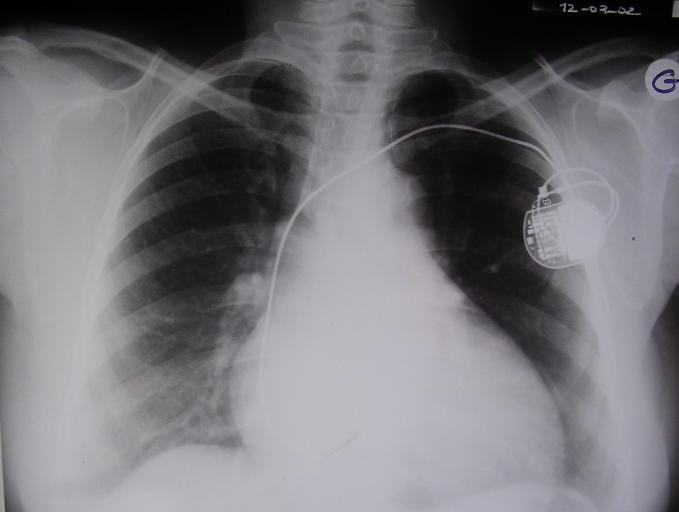
Figure 7 : Radiographie du thorax
après implantation d'un pacemaker
6 - les modalités de l'implantation d'un
stimulateur cardiaque définitive
6 - 1 - La préparation à
l'implantation
Le patient doit être informé des étapes de
l'intervention et des suites opératoires. Il comprendra ainsi le
déroulement de l'intervention ce qui minimisera son
anxiété.
Un opérateur entraîné réalisera
l'intervention. Un seul opérateur suffit, aidé d'un
instrumentiste ; mais la sécurité est pleinement
assurée si un anesthésiste ou un aide-anesthésiste est
présent pour veiller aux constantes vitales, au scope, effectuer la
sédation ou une anesthésie générale s'il le faut.
L'implantation doit s'effectuer dans des conditions d'asepsie
chirurgicale au bloc opératoire ou dans une salle
d'électrophysiologie. Un matériel de réanimation doit
être disponible, prêt a l'emploi.
Un bilan préopératoire comprendra une radiographie
du thorax et des contrôles biologiques de routine.
Une perfusion est mise en place du côté
opposé à l'implantation. Une injection d'antibiotique est
effectuée juste avant l'intervention et répétée une
heure plus-tard.
Pour la primo-implantation d'un stimulateur, l'anesthésie
locale à la lidocaïne non adrénalinée est suffisante
dans la zone d'incision et de la loge du stimulateur. L'anesthésie
générale est rarement utilisée et s'adresse aux patients
psychiatriques. Une prémédication par neuroleptanalgésie
est souvent utilisée si le patient est agité.
6 - 2 - L'implantation proprement dite
La voie veineuse d'introduction est obtenue par dénudation
chirurgicale ou par ponction directe à l'aide d'un désilet dans
la veine céphalique ou dans la veine sous-clavière. Cette voie
permet l'introduction des sondes et leur progression sous amplificateur de
brillance vers les cavités droites.
Le boîtier est logé en position sous-cutanée
dans la région pectorale.
Il faut vérifier que les sondes ont une réserve de
longueur endo-vasculaire suffisante pour répondre à leur
étirement parfois considérable si le patient change de position
ou inspire profondément. Il convient de ne jamais serrer fortement les
noeuds de fixation sous peine de rompre l'isolant des sondes ou de les
fracturer. A l'inverse, une fixation insuffisante peut expliquer un
« twiddler syndrome » ou enroulement progressif de la sonde
sur elle-même ou autour du pacemaker. La loge du stimulateur sera alors
préparée, et les sondes connectées au boîtier de
stimulation.
6 - 3 - Les suites postopératoires
Après l'implantation le malade est placé sous
monitoring cardiaque pendant
quelques heures ( 24 heures s'il est dépendant de son
stimulateur ), afin de ne pas manquer une circonstance conduisant à une
inefficacité de la stimulation cardiaque.
Une radiographie du thorax est faite à 24 heures. Le
pansement n'est refait que toutes les 48 heures. Il est conseiller au patient
de bouger, de ne pas « geler » son épaule, la
douleur étant soulagée par des antalgiques simples. Le fil de
suture cutanée est retiré après 8 à 10 jours.
6 - 4 - L'implantation d'un stimulateur cardiaque chez
l'enfant
La stimulation cardiaque pédiatrique pose des
problèmes spécifiques en relation avec la taille du
matériel par rapport à la taille de l'enfant, la croissance et la
tolérance au long cours du matériel implanté.
Il faut économiser le plus possible le capital veineux
chez un sujet qui sera stimulé à vie. La croissance impose
l'utilisation une grande longueur de sonde endovasculaire.
Le modèle implanté doit être de petit volume
et d'une durée de vie acceptable.
6 - 5 - L'implantation du stimulateur cardiaque dans
quelques cas particuliers
6 - 5 -1 - Dilatation des cavités cardiaques
droites
Il est impératif d'utiliser des sondes à vis. Pour
l'oreillette droite, il n'y a pas de difficulté particulière si
l'on prend garde de préformer les guides avec de grandes courbures pour
atteindre la paroi atriale. Pour le ventricule, les difficultés peuvent
être beaucoup plus grandes du fait d'une fréquente insuffisance
tricuspidienne associée qui rejette violemment la sonde non encore
fixée. Dans ce cas la manoeuvre consistera à préformer le
guide droit en J comme s'il s'agissait d'implanter une sonde atriale
6 - 5 - 2 - Annuloplastie ou valve biologique en position
tricuspidienne
La difficulté est encore plus grande car l'orifice
tricuspidien est beaucoup plus petit que les cavités droites, et la cage
d'une valve biologique restreint encore le passage d'une sonde à
destinée ventriculaire.
7 - Surveillance
7-1 - Principes et éléments de
surveillance
La surveillance des stimulateurs nécessite l'utilisation
de programmeurs dédiés pour s'assurer du fonctionnement optimal
de toutes les fonctions et ainsi minimiser les complications. La surveillance
du patient stimulé a pour but de vérifier sa tolérance vis
à vis du stimulateur et de la stimulation, de dépister
d'éventuelles complications et de repérer la survenue des
indicateurs de fin de vie de la pile. Elle est à la fois clinique et
électrocardiographique.
Il peut être utile de compléter cet examen par
d'autres investigations telles que l'enregistrement Holter, l'épreuve
d'effort et l'échographie. La fréquence des contrôles
dépend du modèle implanté. Il est recommandé de
contrôler les stimulateurs double-chambre et ceux à
fréquence asservie le plus fréquemment pour profiter au mieux des
possibilités de programmation optimale pour le patient.
Le premier contrôle et la programmation se feront
immédiatement après l'intervention et le lendemain.
Le contrôle suivant sera effectué après
cicatrisation complète entre le premier et le troisième mois. A
ce moment, le système de stimulation est programmé à ses
valeurs définitives, avec optimisation des valeurs de sensibilité
et d'asservissement.
Les contrôles ultérieurs devraient être
effectués deux fois par an avec un électrocardiogramme
intermédiaire
7 - 2 - Les complications
7 - 2 - 1 - les complications per- et / ou
postopératoires
Elles seront au mieux diagnostiquées ou
évitées par une surveillance initiale très étroite,
clinique, électrocardiographique, radiographique...etc.
Elles peuvent être locales ou générales.
7 - 2 - 1 - 1 - Les complications locales au site
d'implantation
L'hématome
Il survient dans les heures ou jours qui suivent une implantation
longue et difficile dont l'hémostase n'a pas été parfaite.
Une tuméfaction progressivement croissante de la loge, parfois de
caractère inflammatoire doit évoquer l'hématome. La
ponction évacuatrice peut s'imposer ou même l'évacuation
chirurgicale. Chez le patient sous anticoagulant antérieurement il faut
attendre 48 heures pour reprendre le traitement.
· La stimulation pectorale
Elle résulte d'une fuite de courant au niveau de la loge
du pacemaker et est souvent favorisée par la présence de liquide
dans la loge, l'implantation rétropectorale du boîtier ou sa
mauvaise position (face électrique tournée vers le muscle).
Parfois il existe une fuite de courant sur une rupture
traumatique peropératoire de l'isolant d'une sonde ou sur ses
connecteurs.
· L'infection
Souvent annoncée par des douleurs locales ou de voisinage
(scapulaire), l'infection peut prendre deux masques principaux :
- Soit les signes locaux sont au premier plan, un
prélèvement bactériologique par
ponction à l'aiguille est nécessaire.
- Soit un syndrome infectieux est au premier plan, les signes
locaux restent
discrets, voire absents avec à l'extrême un tableau
de septicémie qui doit faire rechercher une endocardite sur sonde,
propagée ou non à la valve tricuspide. Un bilan
échographique complet incluant la voie trans-oesophagienne est
indispensable. En présence d'une infection, l'explantation de l'ensemble
du matériel est la règle, associée à une
antibiothérapie générale à visée
anti-staphylococcique ( puis guidée par l'antibiogramme sur un germe
isolé à partir d'un prélèvement local ou
d'hémoculture positive) et d'une mise à plat de la loge. La sonde
infectée doit être extraite par traction directe.
L'extrémité distale de la sonde est mise en culture.
7 - 2 - 1 - 2 - Les complications liées à
la voie d'abord
Il peut s'agir de l'implantation d'une sonde dans les
cavités gauches, d'un pneumothorax, d'un
hémothorax, d'un hémomédiastin, d'une embolie gazeuse ou
d'une thrombose veineuse.
7 - 2 - 1 - 3 - Les complications cardiaques
On peut noter des troubles du rythme ventriculaire, une
asystolie ou une perforation myocardique avec tamponnade
7 - 2 - 1 - 4 - Les complications liées au
système de stimulation
Dans la phase postopératoire immédiate, ces
complications sont essentiellement en rapport avec les sondes.
On peut observer une stimulation diaphragmatique, un
déplacement de sonde, une élévation des seuils de
stimulation et de détection ou une perturbation de la régulation
végétative.
7 - 2 - 2 - Les complications tardives
7- 2 - 2 - 1 - Les complications locales et
loco-régionales au site d'implantation
Il peut s'agir d'une infection, d'un déplacement de
boîtier et / ou son extériorisation ou enfin de thromboses
veineuses.
7 - 2 - 2 - 2 - Les complications liées à
la sonde de stimulation
Parmi ces complications on peut noter les déplacements
secondaires de sonde, les modifications des seuils de stimulation et de
détection, la rupture d'isolant ou de continuité
électrique.
7 - 2 - 2 - 3 - Les complications liées au
stimulateur ou au mode programmé
Il s'agit des interférences
endogènes ou exogènes, de la mutité (
absence de fonctionnement total de l'appareil par panne des circuits
électroniques ) et de la déplétion de la pile.
Certaines situations à risque d'interférence sont
retrouvées dans l'environnement domestique ( téléphone
portable ) et dans l'environnement professionnel
Dans l'environnement médical certains matériaux
peuvent être responsables d'interférence, il s'agit du bistouri
électrique, de l'imagerie par résonance magnétique, de la
lithotripsie, des chocs électriques et de la radiothérapie.
III - Indications
Le traitement des blocs AV chroniques symptomatiques se
résume actuellement à la stimulation cardiaque définitive
qui en a transformé le pronostic.
Le traitement médicamenteux et la stimulation cardiaque
temporaire ont des indications limitées et ne représentent la
plupart du temps qu'une solution d'attente avant l'implantation d'un
stimulateur intra corporel.
A - A la phase aiguë de l'infarctus du
myocarde
1 - Dans l'infarctus du myocarde
inférieur
Les indications de la stimulation temporaire sont
réservées aux patients chez lesquels la bradycardie, mal
tolérée hémodynamiquement, ne répond pas à
l'atropine.
Lorsque l'infarctus est étendu au ventricule droit, il
convient de souligner l'importance du maintien d'un bon synchronisme
auriculo-ventriculaire par une stimulation double-chambre.
2 - Dans l'infarctus du myocarde
antérieur
La localisation infranodale des bloc auriculo-ventriculaires
impose toujours une stimulation temporaire. Lorsqu'un bloc bifasciculaire est
constaté, on peut discuter, pour éviter les effets
arythmogènes de la stimulation endocavitaire prophylactique, la mise en
place sur le thorax d'électrodes de stimulation cutanée. Ainsi en
cas de survenue d'un bloc auriculo-ventriculaire complet, un entraînement
électro-systolique peut être assuré sans délai, une
stimulation endocavitaire prenant ensuite le relais. L'apparition d'un bloc
monofasciculaire nécessite seulement une surveillance accrue des
patients.
B - Autres situations aiguës
1 - Après chirurgie cardiaque
Le bloc auriculo-ventriculaire est souvent régressif, la
stimulation temporaire par électrodes épicardiques est alors
maintenue une dizaine de jours avant que ne soit envisagée une
stimulation définitive au besoin.
2 - Lors d'une anesthésie
Les patients présentant un bloc auriculo-ventriculaire
symptomatique et chez lesquels l'implantation d'un stimulateur définitif
n'est pas réalisable avant l'intervention , en raison de son urgence,
relèvent d'une stimulation temporaire.
Cette indication peut être discutée également
chez les patients porteurs d'un bloc tri-fasciculaire et présentant des
antécédents de syncopes d'étiologie inconnue.
3 - Dans les intoxications
médicamenteuses
Le bloc auriculo-ventriculaire dû aux intoxications par des
médicaments déprimant la conduction auriculo-ventriculaire peut
relever d'une stimulation temporaire, lorsqu'il est mal toléré.
Dans tous les cas l'arrêt de l'intoxication est la première
règle.
4 - En cas de myocardite ou d'endocardite
Le bloc auriculo-ventriculaire compliquant une myocardite
aiguë ou une endocardite infectieuse fait appel également à
une stimulation temporaire.
C - Les blocs auriculo-ventriculaires acquis chroniques
de l'adulte
En l'absence symptômes, la seule indication formelle de la
stimulation définitive demeure les BAV du troisième degré
avec un rythme d'échappement très lent.
Il est aussi de pratique courante d'envisager l'implantation
définitive chez les patients asymptomatiques présentant un BAV du
troisième degré avec un échappement supérieur
à 40 / min, un BAV de haut degré ou du deuxième
degré type II.
Le BAV du premier degré ne fait pas partie jusqu'à
présent des indications reconnues de stimulation. Cependant, il est
actuellement admis que chez les patients avec un espace PR supérieur
à 0,30 s et qui présentent des signes d'insuffisance cardiaque ou
de pseudo « syndrome du pacemaker » l'implantation d'un
stimulateur peut être discutée. Elle est d'autant plus
justifiée qu'une amélioration est observée lors d'une
stimulation provisoire sur le mode double chambre.
D - Les blocs de branche bi- ou
tri-fasciculés
En dehors des cas ou un bloc du troisième
degré ou du deuxième degré type II a pu être
documenté, les indications d'implantation sont à réserver
aux patients symptomatiques ou non avec une anomalie franche lors de
l'exploration électrophysiologique ( allongement de l'intervalle HV au
delà de 100 ms ou bloc infrahissien lors de la stimulation atriale
à une fréquence inférieure à 150/ min).
E - Chez l'enfant et l'adolescent
Deux situations se rencontrent plus spécifiquement chez
les patients jeunes : le BAV congénital et le BAV faisant suite
à une intervention de chirurgie cardiaque pour correction d'une
cardiopathie congénitale.
1 - Le bloc auriculo-ventriculaire
congénital
Il est le plus souvent bien toléré mais une
meilleure analyse de son histoire naturelle a montré qu'il expose
à un risque accru d'insuffisance cardiaque et que la fréquence du
foyer de suppléance se ralentit au fil des années.
Ø Dans la période postnatale immédiate, les
indications d'implantation d'un
stimulateur cardiaque sont les suivantes :
- La survenue de syncope
- La présence d'une insuffisance cardiaque
- Une fréquence cardiaque inférieure à 55 /
min en l'absence de cardiopathie ou inférieure à 65 / min en
présence d'une cardiopathie
- Un allongement de l'intervalle QT
- La présence d'extrasystoles ventriculaires
fréquentes et l'existence d'un foyer de suppléance variable.
Ø Par la suite, jusqu'à l'âge de 15 ans, les
indications doivent se discuter selon la
présence ou non de signes fonctionnels.
Ø Après l'âge de 15 ans l'indication de la
stimulation cardiaque définitive doit être
systématique. On préfère un mode double
chambre au mode VVI et une stimulation VDD mono-sonde paraît
particulièrement adaptée à cette indication car elle
permet de respecter le capital veineux dans la perspective d'une survie
prolongée après l'implantation.
2 - Après intervention de chirurgie
cardiaque
Les patients qui présentent un BAV persistant ont un
pronostic plus sombre que les autres. De ce fait, si un bloc AV de haut
degré est toujours présent 7 à 14 jours après
l'intervention, une implantation d'un stimulateur cardiaque définitif
doit être discutée.
Tableau 1 : Indications de la
stimulation cardiaque définitive dans le traitement des
blocs auriculo-ventriculaires acquis de
l'adulte.
|
Type de BAV
|
Classe I : Implantation
nécessaire
|
Classe II : Implantation probablement
utile
|
Classe III : Implantation inutile
|
|
BAV du
3ème degré
|
- Symptomatique
- Asymptomatique 40 / min
- Après ablation des voies normales
- Persistant après chirurgie cardiaque
- Maladies neuromusculaires
|
Asymptomatique 40 / min
|
|
|
BAV du
2ème degré
|
Symptomatique
|
Type II asymptomatique
Type I asymptomatique intra- ou infrahissien
|
Type I asymptomatique suprahissien
|
|
BAV du
1er degré
|
|
PR 0,30 s et IC ou pseudo « syndrome du
pacemaker » avec amélioration documentée par la
stimulation AV temporaire
|
Asymptomatique
|
|
Tous degrés
|
|
|
Cause réversible
|
NB : IC = Insuffisance cardiaque


METHODOLOGIE
I- Le cadre de l'étude
Ce travail a été réalisé à la
clinique cardiologique de l'hôpital Aristide Le Dantec de Dakar au
Sénégal.
II- Patients et méthode
Il s'agit d'une étude prospective et descriptive portant
sur 64 cas de malades atteints d'un trouble de la conduction
auriculo-ventriculaire de tout type, colligés au service de cardiologie
de l'hôpital Aristide Le Dantec de Dakar sur une période de 22
mois (janvier 2002 à octobre 2003).
Le diagnostic du trouble de la conduction auriculo-ventriculaire
était basé uniquement sur l'électrocardiogramme de surface
des douze dérivations avec un tracé long.
Tous les malades ont bénéficié d'un examen
clinique complet et pour la quasi-totalité d'une radiographie du thorax
de face, d'un écho Doppler cardiaque et d'un ensemble d'examens
biologiques de routine. Certains malades ont bénéficié
d'autres explorations en particulier l'épreuve d'effort.
Une conduite thérapeutique est proposée selon le
degré du trouble de la conduction auriculo-ventriculaire et la
disponibilité des moyens thérapeutiques.
Les malades qui ont été traités par
stimulation cardiaque définitive n'ont été suivis que
pendant la procédure d'implantation du pacemaker jusqu'à leur
sortie de l'hôpital tandisque les malades non stimulés ont
bénéficié d'un suivi durant toute la période de
l'étude.
A- Critères d'inclusion
Pour analyser ces dossiers, nous avons retenu tout patient
présentant un trouble de la conduction auriculo-ventriculaire
reçu dans le service de cardiologie de l'hôpital Aristide Le
Dantec.
B- Critères d'exclusion
Nous avons exclu de cette étude tous les malades porteurs
d'un trouble de la conduction auriculo-ventriculaire déjà
traité par stimulation cardiaque définitive et ceux dont les
informations recueillies sont jugées insuffisantes pour être
analysées.
III- Les paramètres étudiés
Nous avons essayé d'étudier tous les
paramètres des les données de l'interrogatoire à la
thérapeutique et à l'évolution immédiate chez les
malades ayant bénéficié d'une stimulation cardiaque.
A- Données de l'interrogatoire
1- État civil
Les paramètres étudiés sont :
l'âge, le sexe et l'origine géographique
2- La profession et le niveau
socio-économique
Nous avons recensé la profession chez tous les malades et
avons essayé d'apprécier le niveau socio-économique sur
des critères basés sur le revenue du malade, de sa famille ou de
la structure qui le prend en charge.
3- Antécédents
Nous avons recherché surtout les antécédents
personnels et familiaux de trouble de la conduction ou du rythme; l'existence
ou non d'une pathologie sous jacente (cardio-vasculaire et extra-cardiaque),
une prise de médicaments et/ou d'autres toxiques.
4- Symptômes
L'étude des signes fonctionnels a permis de rechercher les
symptômes suivants:
· Une dyspnée d'effort cotée selon la
classification de la New York Heart
Association (NYHA).
· Une syncope et équivalents mineurs (lipothymies et
vertiges).
· Des palpitations et précordialgies.
· Une asthénie ou une fatigabilité à
l'effort.
B- Données de l'examen physique
Tous les malades ont bénéficié d'un examen
clinique complet, cependant nous nous sommes surtout appesantis sur les
données de l'examen cardio-vasculaire notamment la tension
artérielle, la fréquence cardiaque, les données
palpatoires et auscultatoires de l'examen cardiaque; mais aussi les signes
intéressant d'autres appareils.
C- Données paracliniques
1- Biologie
Nous avons étudié l'hémogramme, la
glycémie, la fonction rénale, la protidémie, l'ionogramme
sanguin, le bilan de la crase sanguine et de la coagulation.
2- Radiographie du thorax
Elle nous a permis d'étudier :
· l'index cardio-thoracique
· la morphologie de la silhouette cardiovasculaire
· la transparence pulmonaire
3- Électrocardiogramme standard de surface des
douze dérivations
Nous avons étudié les paramètres
suivants :
· Rythme et fréquence auriculaires
· Durée de l'espace PR
· Fréquence ventriculaire
· Durée des complexes QRS
· Conduction auriculo-ventriculaire
· Degré du bloc auriculo-ventriculaire
· Autres anomalies associées
4 - Écho Doppler cardiaque
L'étude de l'écho Doppler cardiaque a
précisé les données suivantes :
· Les paramètres mesurables
échographiques :
- les diamètres télé-diastolique et
télé-systolique ventriculaires gauches, l'épaisseur du
septum inter-ventriculaire et de la paroi postérieure
- les paramètres de la fonction systolique ventriculaire
gauche : pourcentage de raccourcissement et fraction d'éjection du
ventricule gauche.
· La structure des valves et le péricarde
· L'étude Doppler
D- Terrain sous jacent
C'est la recherche de pathologies associées qu'elles
soient cardio-vasculaires ou extra-cardiaques.
F- Recherche d'une étiologie
Elle est basée sur un faisceau d'arguments permettant
d'orienter vers une étiologie donnée (âge, affection
intercurrente, intoxication...etc).
G- Aspects thérapeutiques
Les indications thérapeutiques tenaient compte des
données actuelles sur le traitement des blocs auriculo-ventriculaires.
Ainsi en fonction du degré du bloc, de l'étiologie, des
symptômes et parfois surtout des moyens du malade il pouvait être
proposé un traitement médical, une stimulation cardiaque
définitive, l'arrêt d'un toxique ou l'abstention
thérapeutique pure et simple.
H- Données de l'évolution
Nous avons étudié l'évolution en
post-implantation immédiate des BAV traités par pacemaker et de
celle des autres malades pendant toute la durée de l'étude.
IV- Analyse statistique
Une base de données a été
réalisée grâce au logiciel Microsoft - Excel. Le traitement
statistique a été effectué à l'aide du logiciel
SPSS 11.5 (Statistical Package for Sciences).
La distribution statistique uni-variée des variables
(tableau de fréquence, moyenne, écart - type) a été
établie puis nous avons procédé à une analyse
bivariée en effectuant des croisements entre les différentes
variables pour rechercher des corrélations existantes.
Le test de Khi-deux a été utilisé pour la
comparaison des proportions. Ce test est statistiquement
considéré comme significatif si la valeur de p est
inférieure à 0,05.

RESULTATS
Durant une période de 22 mois allant de janvier 2002
à octobre 2003 nous avons recensé, dans le service de
cardiologie de l'hôpital Aristide Le Dantec de Dakar, 67 cas de BAV dont
3 cas ont été exclus de notre étude : 2 cas pour
dossier incomplet et un cas pour doute sur le diagnostic. Nous avons retenu
finalement pour ce travail 64 cas de BAV documentés par un ECG de
surface.
I- Données épidémiologiques
A- Prévalence
Durant la période couvrant notre étude,
64 cas de BAV ont été retenus pour être analysés sur
un total de 1252 malades hospitalisés dans notre service soit une
prévalence de 4,9%. Nous avons noté 3 cas de BAV du premier
degré ; 2 cas de BAV du deuxième degré ; 6 cas
de BAV de haut degré ; 2 cas de bloc tri-fasciculé et
51 cas de BAV complet.
B- Le sexe des malades
Figure 8: Répartition en fonction
du sexe
Les effectifs d'hommes et de femmes s'équivalent presque,
toutefois il existe une légère prédominance
féminine 51,56 % de femmes contre 48,34% d'hommes.
La différence n'est pas statistiquement significative. Le
sexe ratio est de 0,94.
C- L'âge des malades
L'âge moyen de nos malades est de 63,81 ans avec des
extrêmes de 16ans et 90 ans. Près de 80% de nos malades ont plus
de 50 ans. Plus de la moitié des malades (34 cas soit 53%) ont entre 61
et 80 ans. Parmi les malades de moins de 50 ans, nous n'avons pas eu de malade
dans la tranche d'âge de 0 à 10 ans, seul 1 malade (1,6%) a moins
de 20 ans, 2 malades (3,2%) entre 21 et 30 ans, 1 malade (1,6%) entre 31 et 40
ans et 9 malades (14%) entre 41 et 50 ans.
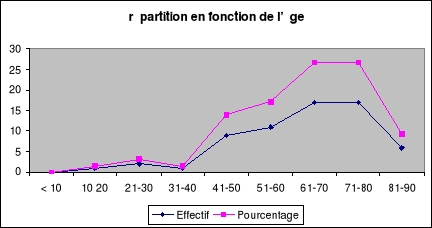
Figure 9 : Répartition en fonction de
l'âge
D- L'origine géographique des malades
La majorité de nos malades (96,87%) étaient des
sénégalais. Seuls 2 malades (3,12%) étaient de
nationalité étrangère dont un mauritanien et une
congolaise.
Dans la population de malades sénégalais, 38,7%
étaient originaires de Dakar contre 61,3% pour toutes les autres
régions avec 41,9% pour les régions du centre ouest
non loin de Dakar ; 6,5% pour les régions du sud et
du sud-est et 12,9% pour les régions du nord.
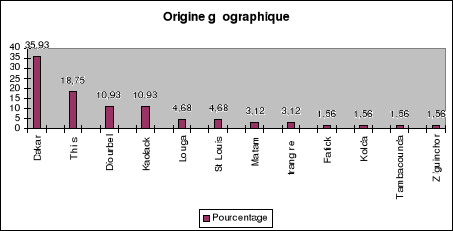
Figure 10 : Répartition en fonction de
l'origine géographique
E- Profession et niveau
socio-économique
Tableau 2 : répartition en
fonction de la profession
|
Profession
|
Nombre
|
Pourcentage
|
|
Infirmier
|
1
|
1,56
|
|
Administrateur
|
1
|
1,56
|
|
Enseignant arabe
|
2
|
3,12
|
|
Etudiant
|
2
|
3,12
|
|
Ouvrier
|
1
|
1,56
|
|
Employé d'entreprise
|
2
|
3,12
|
|
Eleveur
|
3
|
4,68
|
|
Commerçant
|
4
|
6,25
|
|
Cultivateur
|
4
|
6,25
|
|
Femme au foyer
|
9
|
14,09
|
|
Retraité
|
9
|
14,09
|
|
Sans profession
|
26
|
40,62
|
|
Total
|
64
|
100
|
Le niveau socio-économique de nos malades,
évalué sur la base des revenues du malade, de sa famille et sur
les autres possibilités de prise en charge est, dans la majorité
des cas, faible à moyen. Il est faible dans 50,75% des cas, moyen dans
43% des cas et élevé dans 6,25% des cas.
Concernant la profession, nous avons noté 40,62% de
malades sans profession, 14,09% de retraités et autant de femmes au
foyer.
Le tableau 2 ci-dessus résume les professions
rencontrées.
II- Les données cliniques
A- Antécédents et terrain
Tableau 3 : Antécédents
|
Antécédents
|
Nombre
|
Pourcentage
|
|
HTA
|
35
|
56,68
|
|
Diabète
|
5
|
7,81
|
|
Asthme
|
1
|
1,56
|
|
Trouble du rythme
|
2
|
3,12
|
|
Syncopes
|
8
|
12,5
|
|
Myocardiopathie
|
9
|
14,06
|
|
Pneumopathie
|
7
|
10,93
|
|
Néphropathie
|
2
|
3,12
|
|
Insuffisance cardiaque
|
4
|
6,24
|
|
Intoxication médicamenteuse
|
2
|
3,12
|
|
Sans particularité
|
14
|
21,87
|
Une notion d'HTA a été retrouvée
dans 35 cas (54,68%) avec instauration d'un traitement hypotenseur chez la plus
part de ces malades.
Une myocardiopathie a été notée dans 9 cas
(14,6%) dont 8 cas chroniques avec présence de signes d'insuffisance
cardiaque chez 4 malades et 1 cas aigu fébrile.
5 malades (7,8%) avaient un diabète de type 2 dont un
associé à un asthme.
7 cas (10,9%) de pneumopathie aiguë et 2 cas de
néphropathie ont été notés.
Une intoxication médicamenteuse a été
observée dans 2 cas (3,12%) dont l'un par un bêta-bloquant et
l'autre par un digitalique.8 cas de syncope (12,5%) ont été
signalés. Dans 14 cas (21,87%) nous n'avons pas retrouvé
d'antécédent particulier.
B- Les symptômes
Les principaux symptômes que nous avons retrouvés
sont les suivants :
· La dyspnée
Elle constitue le symptôme le plus fréquemment
retrouvé. Ainsi plus de la moitié des malades (36 cas soit
56,25%) présentaient une dyspnée d'effort au moins de stade II
(20,31%) à III (31,25%) pour la majorité et de stade IV pour 2
cas.
· Syncope et équivalents mineurs
La syncope à l'emporte pièce a été
notée dans 27 cas (42,18%) ; ses équivalents mineurs dans
56,25% dont 17,18% de lipothymie et 39,06% de vertige.
· Palpitations et précordialgie
Ces symptômes non spécifiques ont été
signalés dans près 20% des cas dont 10,9% de précordialgie
et 9,4% de palpitations.
· Patients asymptomatiques
Dans 12,5% des cas aucun symptôme n'a été
signalé et la maladie fut découverte de façon fortuite au
cours d'un bilan. 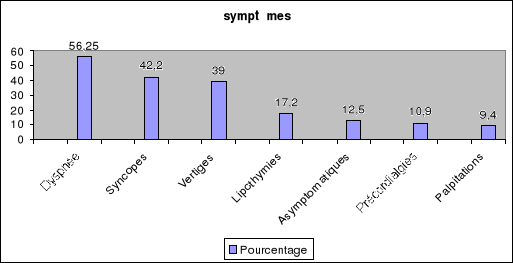 Figure 10 : symptômes ou
circonstances de découverte Figure 10 : symptômes ou
circonstances de découverte
C- Les données de l'examen physique
1- La pression artérielle
· La pression artérielle systolique
(PAS)
Tableau 4 : Pression
artérielle systolique (PAS)
|
Pression artérielle systolique
|
Nombre
|
Pourcentage
|
|
< 120
|
5
|
7,81
|
|
120 - 140
|
14
|
21,87
|
|
141 - 180
|
25
|
39,06
|
|
181 - 200
|
7
|
10,93
|
|
> 200
|
13
|
20,31
|
|
Total
|
64
|
100
|
La pression artérielle systolique moyenne est
de 166,72 mm Hg avec des extrêmes à 50 mm Hg et 270 mm Hg .
Nous avons noté 45 cas d'HTA systolique (70,31%) contre 18
cas de pression artérielle systolique normale (28,12%) et un cas
collapsus (1,56%).
· La pression artérielle
diastolique
La pression artérielle diastolique moyenne est 80,39
mm Hg ( 0 - 120).
Tableau 5 : Pression artérielle
diastolique (PAD)
|
PAD (mm Hg)
|
Nombre
|
Pourcentage
|
|
90
|
52
|
81,25
|
|
91 - 100
|
9
|
14,06
|
|
101 - 110
|
2
|
3,12
|
|
111 - 120
|
1
|
1,56
|
|
Total
|
64
|
100
|
· Le profil tensionnel
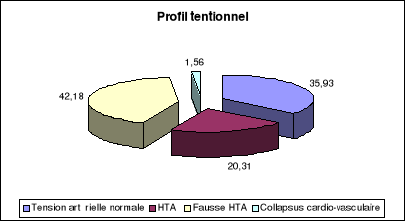
Figure 11: Profil tensionnel
2- La fréquence cardiaque (FC)
La fréquence cardiaque moyenne mesurée à
l'auscultation est de 43,06 bpm
(14 - 110). Plus de la moitié des malades (56,25%) avaient
une fréquence cardiaque 40 bpm dont 8 cas (12,5%) de fréquence
cardiaque 30 bpm. Dans 34,37% la fréquence cardiaque était
comprise entre 41 et 60 bpm.
Seuls 6 malades (9,37%) avaient une fréquence cardiaque
supérieure à 60 bpm
Tableau 6 : Fréquence cardiaque
|
Fréquence cardiaque
|
Nombre
|
Pourcentage
|
|
30
|
8
|
12,5
|
|
31 - 40
|
28
|
43,75
|
|
41 - 50
|
15
|
23,43
|
|
51 - 60
|
7
|
10,93
|
|
> 60
|
6
|
9,37
|
|
Total
|
64
|
100
|
3- Les signes physiques de l'examen des
appareils
a- L'examen cardio-vasculaire
· La bradycardie
Elle a été retrouvée dans 55 cas (85,93%) de
l'ensemble des malades.
Dans le groupe des BAV complets et des BAV de haut degré,
la bradycardie était quasi-constamment notée (55 cas sur 57 soit
96,49%).
· La systole en écho
Elle a été notée dans 16 cas (25%) dont la
presque quasi-totalité dans le groupe des BAV complets (23,4%) et un cas
(1,6%) de BAV de haut degré.
· Assourdissement des bruits du coeur
Il a été noté dans 73,4% des cas. C'est le
signe physique le plus fréquent.
· Souffle systolique apexien
Un souffle systolique apexien a été retrouvé
chez 18 malades (28,1%) associé dans 6 cas à un souffle
systolique xiphoïdien.
· Arythmie cardiaque
Elle a été notée dans 4 cas (7,8%) dont 1
cas de BAV complet sur une fibrillation auriculaire ; 1cas de BAV
deuxième degré type 1 ; 1cas de BAV deuxième
degré type 2 et 1cas de bloc tri-fasciculé.
· Les vaisseaux
Une diminution des pouls pédieux et tibial
postérieur était retrouvée chez un malade
présentant une artériopathie oblitérante des membres
inférieurs sur terrain de diabète de type 2.
b- L'examen pleuro-pulmonaire
Des signes de surcharge pulmonaire en rapport avec un
oedème pulmonaire ont été notés chez 5 malades
(7,81%) associés dans 3 cas (4,68%) à un épanchement
pleural de petite abondance.
Chez 4 malades (6,25%) l'auscultation pulmonaire a
retrouvé un syndrome de condensation pulmonaire unilatéral.
c- L'examen du foie
Nous avons noté 5 cas d'hépatomégalie de
stase associée à des signes périphériques
d'insuffisance cardiaque.
d- L'insuffisance cardiaque congestive
Nous avons retrouvé chez 5 malades des signes
d'insuffisance cardiaque congestive avec tableau d'insuffisance cardiaque
globale.
e- L'examen des autres appareils
Une hémiplégie séquellaire a
été notée dans 3 cas (4,68%).
Une splénomégalie a été
retrouvée chez une malade qui présentait par ailleurs un syndrome
d'hypertension portale.
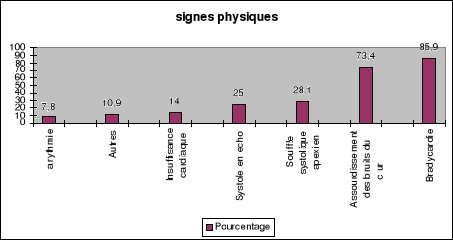
Figure 12 : Signes physiques
III- Données para cliniques
A- Biologie
Les anomalies suivantes ont été
notées :
- 3 cas d'hyperglycémie (4,68%);
- 7 cas de perturbation de la fonction rénale (10,93%)
dont 2 malades en insuffisance rénale chronique en phase terminale;
- 8 cas d'anémie (12,50%);
- 22 cas de trouble ionique mineur (29,68%) dont 9 cas
d'hyponatrémie modérée,
1 cas d'hyperkaliémie légère, 4 cas
d'hypokaliémie légère, 4 cas d'hyperuricémie,
1 cas d'hypocalcémie et 2 cas
d'hypomagnésémie.
- 10 cas de syndrome inflammatoire biologique (15,62%);
- 2 cas de test d'Emmel positif (3,12%);
- un cas d'hyperthyroïdie fonctionnelle sur maladie de
Basedow;
- un cas d'élévation de la troponine I dans un
contexte d'infarctus aigu du myocarde.
Aucune anomalie biologique n'a été retrouvée
dans 30 cas (46,87%).
Tableau 8 : Données
biologiques
|
Données biologiques
|
Nombre
|
pourcentage
|
|
Hyperglycémie
|
3
|
4,68
|
|
Perturbation fonction rénale
|
7
|
10,93
|
|
Trouble ionique
|
19
|
29,68
|
|
Anémie
|
8
|
12,5
|
|
Syndrome inflammatoire
|
10
|
15,62
|
|
Test d`Emmel positif
|
2
|
3,12
|
|
Autres
|
2
|
3,12
|
|
Biologie normale
|
30
|
46,87
|
B- Radiographie du thorax
L'index cardio-thoracique (ICT) moyen est de 0,53 avec des
extrêmes de 0,42 et 0,7.
La cardiomégalie définie par un ICT > 0,50 est
retrouvée dans 51,56%. Elle est globale dans 31,25% et
développée aux dépens des cavités gauches dans
20,31%.
Une pneumopathie a été observée dans 10,93%
des cas et une pleurésie de petite abondance dans 4,68%.
Tableau 9 : Signes radiologiques
|
Signes radiologiques
|
Nombre
|
Pourcentage
|
|
Cardiomégalie
|
33
|
51,56
|
|
OEdème interstitiel
|
16
|
25
|
|
pneumopathie
|
7
|
10,93
|
|
pleurésie
|
3
|
4,68
|
|
Déroulement aortique
|
20
|
31,15
|
|
Radiographie normale
|
16
|
25
|
|
Radiographie non faite
|
2
|
3,12
|
C- Électrocardiogramme (ECG) de surface des douze
dérivations
· Fréquence auriculaire
électrique
La fréquence auriculaire moyenne est égale à
84,22 cycles par minute avec des extrêmes à 34 et 125 cycles par
minute et un écart type de 17,36.
Tableau 10 : Fréquence auriculaire
électrique
|
Fréquence auriculaire
|
Nombre
|
Pourcentage
|
|
< 100
|
46
|
71,9
|
|
100
|
18
|
28,1
|
|
Total
|
64
|
100
|
· Fréquence ventriculaire
électrique
La fréquence ventriculaire moyenne est de 41,86 cycles par
minute avec des extrêmes de 14 et 110 cycles par minute et un
écart type de 15,99.
Tableau 11 : Fréquence ventriculaire
électrique
|
Fréquence ventriculaire
|
Nombre
|
Pourcentage
|
|
30
|
13
|
20,3
|
|
31 - 40
|
29
|
45,3
|
|
41 - 50
|
10
|
15,56
|
|
51 - 60
|
3
|
4,7
|
|
> 60
|
9
|
14,1
|
|
Total
|
64
|
100
|
·
Conduction auriculo-ventriculaire
La conduction auriculo-ventriculaire est de type 1/1 dans 7,81%
dont 3 cas de BAV du premier degré (4,68%) et 2 cas de bloc
tri-fasciculé (3,12%).
Elle est de type 2/1 dans 5 cas (7,81%) et de type 3/1 pour un
cas (1,56).
Elle est variable dans les 2 cas de BAV du 2ème
degré type 1 et type 2 (3,12%) .
Dans la majorité des cas (79,68%) il y avait une
dissociation totale de la conduction auriculo-ventriculaire correspondant aux
51 cas de BAV complet.
Tableau 12 : la conduction
auriculo-ventriculaire
|
Conduction auriculo-ventriculaire
|
Nombre
|
Pourcentage
|
|
1/1
|
5
|
7,81
|
|
2/1
|
5
|
7,81
|
|
3/1
|
1
|
1,56
|
|
Variable
|
2
|
3,12
|
|
Dissociation totale
|
51
|
79,68
|
|
Total
|
63
|
100
|
·
Degré du bloc auriculo-ventriculaire
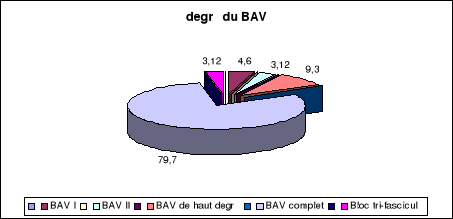
Figure 12 : Répartition en fonction du
degré de BAV
· Durée de QRS
La durée moyenne du QRS est de 0,11S avec des
extrêmes de 0,06 S et 0,20 S.
Elle est élargie dans 33 cas (51,57% de l'effectif total)
dont 28 cas pour des BAV complets. En rapportant ce chiffre aux cas de BAV
complet on trouve 54,90% des BAV complets sont à durée de QRS
élargie .
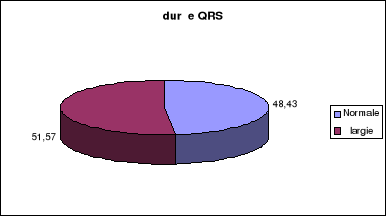
Figure 13 : Répartition en
fonction de la durée du QRS
· Rythme
auriculaire
Il est sinusal dans 62 cas (96,87%), ectopique dans 2 cas (3,12%)
de fibrillation auriculaire sur BAV complet.
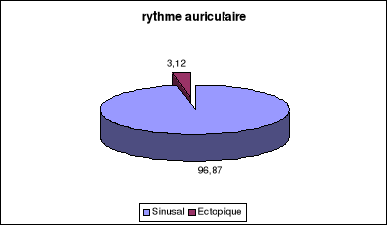
Figure 14 :répartition en
fonction du rythme auriculaire
D- Écho-Doppler cardiaque
Les données suivantes ont été
retrouvées à l'écho Doppler cardiaque :
· L'évaluation de la fonction systolique
ventriculaire gauche par la mesure des
diamètres diastolique et systolique ventriculaires gauches
en mode TM a donné :
- 49 cas de fonction systolique ventriculaire gauche
conservée (76,56%);
- 5 cas de fonction systolique ventriculaire gauche
altérée (7,81%);
- Dans 10 cas (14,62%) la fonction systolique ventriculaire
gauche n'était pas étudiée.
· Autres anomalies de l'écho Doppler cardiaque
LA dilatation des cavités cardiaques était
notée dans 24 cas (37,5%)I Il s'agissait dans 17 cas d'une dilatation
des cavités gauches (26,56%) dont 7 cas de cardiomyopathie
dilatée (10,93%), dans 1 cas d'une dilatation isolée du
ventricule droit sur insuffisance tricuspide importante et dans 6 cas d'une
dilatation des cavités cardiaques droites et gauches (9,37%).
L'hypertension artérielle pulmonaire était
retrouvée dans 14 cas 21,87%). Elle est modérée dans 8 cas
(12,5%), importante dans 2 cas (3,12%) et sévère dans
4 cas (6,25%).
L'insuffisance mitrale était retrouvée dans 32 cas
(50%); de grade II dans 12 cas (12,75%) de grade III dans 4 cas (6,25%) et de
grade I dans 16 cas (25%).
L'insuffisance tricuspide était retrouvée dans 28
cas (43,75%); de grade II dans 6 cas (9,37%), de grade III dans 5 cas (7,81%),
grade IV dans 1 cas (1,56%) et de garde I dans 16 cas (25%).
L'insuffisance aortique était retrouvée dans 10 cas
(15,62%); de grade II dans
6 cas (9,37%) contre 4 cas de grade I (6,25%).
Une insuffisance pulmonaire de grade II a été
signalée dans 1 cas 1,56%).
Une hypertrophie pariétale a été
notée chez 8 malades. Il s'agissait de 5 cas d'hypertrophie septale
asymétrique (7,81%) contre 3 cas d'hypertrophie concentrique du
ventricule gauche (4,68%).
Nous avons observé 15 cas de trouble de la relaxation du
ventricule gauche (23,43%) et 1cas de trouble de la compliance du ventricule
gauche (1,56%).
Un septum paradoxal a été noté dans 2 cas
(3,12%) et une hypocinésie pariétale dans 3 cas (4,68%).
Tableau 13 : anomalies de l'écho
Doppler cardiaque
|
Anomalies
|
Nombre
|
Pourcentage
|
|
Dilatation cavités cardiaques
|
24
|
37,5
|
|
Trouble de la remplissage VG
|
16
|
25
|
|
HTAP
|
14
|
21,87
|
|
Hypertrophie pariétale
|
8
|
12,5
|
|
Dyskinésie pariétale
|
4
|
6,25
|
|
Insuffisance mitrale
|
32
|
50
|
|
Insuffisance tricuspide
|
28
|
43,75
|
|
Insuffisance aortique
|
10
|
15,62
|
|
Insuffisance pulmonaire
|
1
|
1,56
|
IV- Terrain sous jacent
· Une pathologie cardio-vasculaire associée au
trouble de la conduction auriculo-
ventriculaire a été observée dans 18 cas
(28,12%) dont 7 cas de myocardiopathie dilatée (10,93%), 1 cas de
myocardite aiguë, 4 cas d'HTA permanente (6,25%), 6 cas d'HTAP importante
à sévère (9,37%) et 1 cas d'insuffisance tricuspide
importante avec HTAP sévère.
· Les pathologies non cardiaques associées
étaient dominées par le diabète de
type 2 retrouvé dans 7,81% et l'atteinte infectieuse
pulmonaire dans 10,93%. Il s'agissait de diabète équilibré
sur le plan glycémique par le régime associé aux
anti-diabétiques oraux chez 2 malades, 2 cas étaient
compliqués d'atteinte rénale et un cas d'artériopathie
oblitérante des membres inférieurs.
La pneumopathie était cliniquement patente chez 2 malades,
associée à des signes d'infection biologiques et confirmée
par la radiographie du thorax dans tous les
7 cas observés. Chez 2 malades une néphropathie
chronique a été notée en stade d'insuffisance
rénale terminale avec anémie et troubles ioniques
sévères. Une patiente suivie depuis plusieurs années pour
une maladie de Basedow non équilibrée, compliquée de
fibrillation auriculaire et traitée par antithyroïdiens de
synthèse et bêta-bloquant. Deux patients étaient des
sportifs.
V- étiologies
L'étiologie dégénérative était
dominante chez nos malades (53 cas soit 82,81%). Pour les autres causes nous
avons noté 3 cas de BAV d'origine ischémique (4,68%); 4 cas
d'hypertonie vagale probable (6,25); 2 cas de BAV d'origine iatrogène
(3,12%); une cause infectieuse par myocardite aiguë probable chez une
patiente de 33 ans (1,56%) et un cas de cause indéterminée
(1,56).
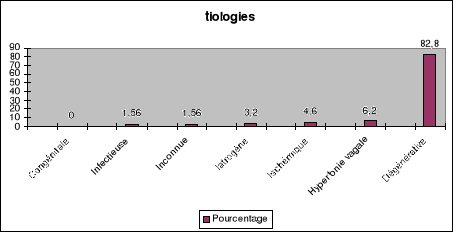
Figure 15 : répartition en fonction de
l'étiologie des BAV
VI- Aspects thérapeutiques
A- moyens thérapeutiques utilisés
Tableau 14 : répartition en fonction des
moyens thérapeutiques utilisés
|
Traitement
|
Nombre
|
Pourcentage
|
|
Abstention thérapeutique
|
11
|
17,18
|
|
Arrêt intoxication médicamenteuse
|
2
|
3,12
|
|
Traitement médical
|
2
|
3,12
|
|
Stimulation cardiaque définitive
|
48
|
75
|
|
Stimulation cardiaque temporaire
|
1
|
1,56
|
|
Total
|
64
|
100
|
· La
majorité de nos malades a bénéficié de stimulation
cardiaque ; 48 cas de
stimulation cardiaque définitive (75%) et 1 cas
de stimulation cardiaque temporaire (1,56%). Il s'agissait dans tous ces cas
d'une primo-implantation. La stimulation cardiaque était suivie d'une
antibiothérapie par une céphalosporine de troisième
génération et associée au traitement d'une
éventuelle pathologie associée.
· Les
autres malades ont bénéficié des modalités
thérapeutiques suivantes :
- Une corticothérapie (1,56%) par voie orale
pour un cas de BAV complet sur une myocardite aiguë probable;
- Une thrombolyse (1,56%) pour un cas d'infarctus
aigu du myocarde;
- L'arrêt d'une intoxication médicamenteuse pour 2
cas (3,12%) dont un bêta-bloquant ( propranolol) et un digitalique (
digoxine);
- l'abstention thérapeutique dans 11 cas (17,18%).
B- Les indications thérapeutiques
Les indications thérapeutiques dans le traitement des
blocs auriculo-ventriculaires sont essentiellement liées au degré
du bloc, à l'étiologie du bloc et à la symptomatologie
clinique.
1- les indications de la stimulation
cardiaque
Dans notre série, les indications de la stimulation
cardiaque se résumaient aux cas de BAV complets, de BAV de haut
degré et de blocs tri-fasciculés.
Ainsi chez 57 malades (92,18%), l'indication de la stimulation
cardiaque était posée et ainsi répartie :
- 49 cas de BAV complets (76,56%);
- 6 cas de BAV de haut degré (9,37%);
- 2 cas de bloc tri-fasciculé (3,12%).
Cependant le nombre effectif de malades stimulés
était de 48 cas soit 75%.
2- Les autres indications
En dehors de la stimulation cardiaque, nos autres indications
thérapeutiques sont d'ordre médical dans 2 cas (3,12%),
l'arrêt d'une intoxication médicamenteuse dans 1cas (1,56%) et
l'abstention thérapeutique dans 4 cas (6,25%).
C- Modes de stimulation cardiaque
La stimulation mono-chambre a été le mode le plus
utilisé avec 45 cas (93,75%) dont 40 cas en mode VVI (83,33%) et 5 cas
en mode VVIR (10,41%).
LA stimulation double chambre a été utilisée
dans 3 cas (6,25%) dont 1 cas en mode VDDR (2,08%) et 2 cas en mode DDD
(4,16%).
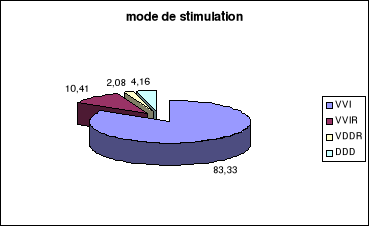
Figure 16 : répartition en
fonction du mode de stimulation
D- Conséquences du niveau socio-économique
sur la prise en charge
Les possibilités de prise en charge, surtout pour la
stimulation cardiaque définitive dépendaient en grande partie des
moyens du malade. En effet les malades ont la charge du coût financier du
stimulateur et des frais d'hospitalisation. Le coût d'un stimulateur neuf
étant estimé à plus d'un million de francs CFA, souvent la
famille est sollicitée pour aider à acquérir le
matériel, vu l'absence de revenue pour beaucoup de nos malades. Certains
malades n'ont pu bénéficié de la stimulation cardiaque
définitive que grâce aux missions d'implantation de pacemaker
organisées dans le service avec la collaboration d'équipes
françaises ; le matériel leur étant offert
gratuitement. D'autres malades chez qui l'indication d'une stimulation
cardiaque était posée et qui étaient dans
l'incapacité de se procurer un pacemaker sont restés sans
être stimulés faute de moyens. C'est le cas de 6 malades dans
notre série (10,52% des indications de stimulation cardiaque). L'une
d'eux était décédée après 18 jours de
stimulation cardiaque temporaire suite au déplacement de la sonde de
stimulation.
VII- Évolution
A- Évolution des BAV n'ayant pas
bénéficié de pacemaker définitif
Tableau 15: Évolution des BAV non
stimulés
|
Évolution
|
Nombre
|
Pourcentage
|
|
Normalisation
|
1
|
6,66
|
|
Stationnaire
|
7
|
46,66
|
|
Décès
|
4
|
26,66
|
|
Perdus de vue
|
3
|
20
|
|
Total
|
15
|
100
|
Dans ce groupe nous avons eu 15 cas soit 23,43% de l'effectif
total.
Nous avons noté une régression d'un BAV du
2ème degré type 1 (7,14%).
L'évolution est restée stationnaire dans 7 cas
(50%) dont 2 BAV du 1er degré; 1cas de BAV de haut
degré; 1cas de bloc tri-fasciculé et 3 cas de BAV complet.
Il a été constaté 4 décès
(26,66%) et 3 malades étaient perdus de vue (20%).
B- Évolution immédiate des BAV après
stimulation cardiaque définitive
Notre travail a porté essentiellement dans ce groupe de
malades sur l'évolution durant la procédure de stimulation
jusqu'à la sortie de l'hôpital.
· Pendant la procédure de stimulation nous avons
recherché l'existence ou
d'accidents et/ou d'incidents per-opératoires.
Il a été noté 9 cas de syncope à
répétition ; un cas de bradycardie sévère et un cas
d'inefficacité du boîtier ayant nécessité son
remplacement immédiat.
· Durant la période post-stimulation les
événements enregistrés durant cette
période sont consignés dans le tableau suivant.
La mortalité après stimulation cardiaque
définitive était de 2,08% (1 cas de décès);
tandisque l'évolution immédiate était favorable dans
81,25%. Seules 4 complications ont été enregistrées.
Tableau 16 : Évolution immédiate
après stimulation cardiaque
|
événements
|
Nombre
|
Pourcentage
|
|
Évolution simple
|
39
|
81,25
|
|
Défaut de stimulation
|
2
|
4,16
|
|
Déplacement de sonde
|
1
|
2,08
|
|
AVCI
|
1
|
2,08
|
|
Persistance HTA
|
4
|
8,33
|
|
Décès
|
1
|
2,08
|
|
Total
|
48
|
100
|
· A part
nous avons noté un cas de BAV complet syncopal traité par
entraînement électrosystolique temporaire.
Son évolution a été fatale après 18 jours
d'entraînement électrosystolique temporaire.
C- Évolution globale
La mortalité globale était de 9,37% ( 6cas de
décès) dont 1 cas (1,56%) après pacemaker
définitif; 1 cas (1,56%) après stimulation cardiaque temporaire
et 4 cas de BAV non stimulés qui seraient décédés
de pathologies associées.
Tableau 17 : évolution globale des
BAV stimulés et des BAV non stimulés
|
Événements
|
Nombre
|
Pourcentage
|
|
évolution favorable
|
40
|
62,5
|
|
Évolution stationnaire
|
7
|
10,93
|
|
Déplacement de sonde
|
1
|
1,56
|
|
Défaut de stimulation
|
2
|
3,12
|
|
AVC
|
1
|
1,56
|
|
Persistance HTA
|
4
|
6,24
|
|
Décès
|
6
|
9,37
|
|
Perdus de vue
|
3
|
4,68
|
|
Total
|
64
|
100
|

DISCUSSION
Notre étude a porté sur 64 cas de BAV qui
répondaient aux critères de sélection définis.
Nous commentons ici les données recueillies chez les
malades dans cette étude prospective descriptive.
I- LES DONNEES EPIDEMIOLOGIQUES
A- La prévalence
Durant la période couvrant notre étude, nous avons
retenu 64 cas de BAV de tout type sur un total de 1252 malades
hospitalisés dans le service pendant la même période, ce
qui correspond à une prévalence de 4,86%.
Cette prévalence pourrait cependant être
sous-estimée par rapport au nombre effectif de BAV vus dans le service
durant la période que couvrait notre étude.
En effet certains malades seraient disparus avant l'inclusion
dans l'étude car ce sentant dans l'incapacité de faire face aux
exigences financières de la prise en charge de leur maladie.
Toutefois cette prévalence est légèrement
supérieure à celle qui a été observée par
DIOP et al [30] au cours d'une étude
réalisée dans le même service quelques années
auparavant sur une période de 7 ans (1990 - 1997).
Cette légère élévation de la
prévalence pourrait être expliquée par
l'amélioration des moyens diagnostiques dans les autres structures car
plus de 60% de nos malades, contre 50% dans l'étude citée
précédemment, provenaient d'autres centres
référents où le diagnostic a pour la plupart du temps
été déjà posé ; les malades nous
étant référés pour stimulation cardiaque.
B- Age des malades
Le BAV semble être dans notre série une maladie du
sujet âgé. En effet, nous avons trouvé une moyenne
d'âge de 63,81 ans avec des extrêmes de 16 et 90 ans.
Cette moyenne d'âge est supérieure à celle
observée au Sénégal [16, 21, 30] dans les
séries suivantes : 53,8 ans pour DIOP; 57,95 ans pour DAMOROU et
61,8 ans pour Charles. En Côte d'Ivoire les moyennes d'âge
retrouvées sont également plus petites : 55 ans dans la
série de NDORI [69] de même qu'au Nigeria
avec une moyenne d'âge de 43 ans pour Ihénacho
[51].
Elle est presque identique à celle qu' a retrouvée
KOLOGO [54] au Sénégal en 1993 avec une moyenne
d'âge de 64ans et à celle de THIOYE [81] qui est
de 64,93 ans.
Elle reste en de-ça de la moyenne d'âge notée
dans la série de THIAM [80] avec
70 ans.
Elle se rapproche de la moyenne d'âge retrouvée en
Europe, notamment en France avec 66,7 ans dans la série de Muciga
[67].
Il est toutefois à noter que notre série a
intéressé les BAV de tout type contrairement aux autres
études où il était le plus souvent question de BAV du
troisième degré.
Ainsi dans notre groupe des BAV de troisième degré
et des BAV de haut degré nous avons noté une moyenne d'âge
de 65,73 ans.
Tableau 18 : moyennes d'âge
notés dans différentes études
|
ETUDES
|
PAYS et ANNEES
|
MOYENNES D'AGE
|
|
MUCIGA
|
France 1979
|
66,7
|
|
IHENACHO
|
Nigeria 1980
|
43
|
|
NDORI
|
Côte d'Ivoire 1980
|
55
|
|
KOLOGO
|
Sénégal 1992
|
64
|
|
CHARLES
|
Sénégal 1997
|
61,8
|
|
DIOP
|
Sénégal 2000
|
53,8
|
|
DAMOUROU
|
Sénégal 2001
|
57,95
|
|
THIOYE
|
Sénégal 2003
|
64,93
|
|
THIAM
|
Sénégal 2003
|
70
|
|
Notre étude
|
Sénégal 2004
|
63,81
|
C- Le sexe
Le sexe féminin est légèrement dominant dans
notre série (51,56%).
Le sexe ratio est de 0,94 ; cette différence n'ait
pas statistiquement significative. La même tendance est notée dans
la série de THIOYE [81] avec un sexe ratio de 0,94.
Cependant d'autres auteurs [16, 21, 51, 66, 69,
80] ont retrouvé une prédominance masculine. C'est le
cas notamment de MOREAU (64 % d'hommes), Ihénacho (62,5%) ; NDORI
(76,47%) Charles (54,28), THIAM (51%) et Damorou (56%).
D- Origine géographique
La majorité de nos malades (78,12%) sont originaires de
Dakar (37,5%) et des villes du centre ouest du Sénégal (40,62)
donc non loin de Dakar. Ce fait pourrait être expliqué non pas
uniquement par une plus forte prévalence de la maladie dans ces
régions, mais plutôt par une accessibilité plus facile aux
services de cardiologie.
En effet ces différentes villes sont
caractérisées sur le plan de la pratique médicale par
l'existence d'une activité de cardiologie notamment à Dakar qui
concentre l'essentiel des spécialistes de cette discipline. Ainsi la
disponibilité des méthodes d'explorations diagnostiques
cardiologiques aidant la reconnaissance des BAV devient plus aisée.
Par ailleurs nous avons eu 2 malades de nationalité
étrangère dont l'un est originaire d'un pays limitrophe du
Sénégal et l'autre d'un pays d'Afrique centrale mais ayant des
enfants au Sénégal.
E- Niveau socio-économique et la
profession
Selon des critères basés sur la profession du
malade ou de celui qui le prend en charge, sur le confort matériel
personnel et /ou familial, nous avons pu dégager trois niveaux
socio-économiques (faible, moyen et élevé).
La faiblesse du niveau socio-économique est une
caractéristique remarquable chez nos malades (43,7%) tandisque le niveau
socio-économique élevé est exceptionnel (6,25%). Un niveau
intermédiaire moyen caractérise la moitié des malades
(50%).
Toutefois cette classification trouve ses limites dans la
difficultés qu'il y a à apprécier les revenues d'un ou de
sa famille malade car il s'agit le plus souvent d'une affaire tabou.
Dans d'autres séries, le niveau socio-économique
est le plus souvent faible.
Ainsi KOLOGO [54] a retrouvé dans sa
série 73,68% de retraités et ménagères; DAMOUROU
[21] a en retrouvé presque autant avec 71,88% de
retraités et sans profession de même que THIOYE [81]
qui a noté 92,3% de retraités et sans profession.
Dans la série rapportée par DIOP
[30] 83% des malades avaient un niveau socio-économique
bas.
Les mêmes difficultés d'ordre
socio-économique ont été signalées par NDORI
[69] et IHENACHO [53].
Ce faible niveau socio-économique explique la
difficulté pour certains de nos malades à se procurer le
matériel nécessaire à la stimulation d'autant plus que
tous les ne bénéficient pas de système de
sécurité sociale pour la prise en charge de leur besoins
sanitaires.
II- Étude clinique
A- La Symptomatologie
Dans notre étude la symptomatologie était
dominée chez l'ensemble des malades par la dyspnée (56,25%) la
syncope (42,18%) et les équivalents mineurs de la syncope (54,24%).
Comparativement à d'autres séries de la
littérature [21, 30, 52, 81, 82] nous avons
retrouvé moins de syncope que Ihénacho (86,66%) , DIOP
(83%), TOURE (46,61%), THIOYE (50%) et DAMOROU (71,87%) ; mais plus que
Millan au Mexique en 1999 (31%).
Toutefois les équivalents mineurs de la syncope sont plus
fréquents dans notre série (56,24%) que dans celles de DAMOROU
(39%) et de TOURE (41,91%).
Quant à la dyspnée, elle est le symptôme le
plus souvent rencontré dans notre étude (56,25%) contre 13,33%
pour Ihénacho et 20% pour TOURE.
Par contre DAMOROU l'a retrouvée plus que dans notre
étude avec 68,75%.
THIOYE a retrouvé un pourcentage de dyspnée
similaire au nôtre avec 54,8%.
Ces symptôme sont dans la majorité des cas
associés chez un même malade.
Nous avons noté 12,5% de BAV asymptomatiques contre 0%
dans toutes les autres séries [16, 21, 30, 52, 54,
69,82].
Cependant dans le groupe des BAV complets et des BAV de haut
degré nous avons eu 10% de patients asymptomatiques.
Tableau 19 : symptômes
observés dans différentes études
|
symptômes
études
|
Syncope %
|
Lipothymie %
|
Vertige %
|
Dyspnée %
|
Précordialgie %
|
Palpitation %
|
Asymp %% %
|
|
DIOP
|
83
|
42
|
50
|
-
|
8
|
33
|
-
|
|
IHENACHO
|
86,66
|
-
|
6,6
|
13,33
|
26,66
|
26,66
|
-
|
|
TOURE
|
46,65
|
15,25
|
-
|
20
|
1,11
|
6,6
|
-
|
|
KOLOGO
|
55,15
|
2,63
|
7,89
|
23,67
|
-
|
-
|
-
|
|
DAMOROU
|
71,87
|
21
|
28,18
|
68,75
|
9,37
|
28,12
|
-
|
|
THIOYE
|
50
|
19,4
|
58,1
|
54,8
|
14,5
|
19,4
|
6,5
|
|
Notre étude
|
42,18
|
17,18
|
39,06
|
56,25
|
9,37
|
10,93
|
12,5
|
B- Les signes physiques
La bradycardie (85,93%) et l' assourdissement des bruits du coeur
(73,43%) constituent les signes physiques les plus fréquemment
retrouver chez l'ensemble de nos malades. La fréquence cardiaque moyenne
est de 43,06 bpm.
Nous avons noté une corrélation entre la
fréquence cardiaque et le profil tensionnel de nos malades dans
l'analyse statistique bivariée par le test de Khi deux ( p = 0,01).
Rapportée aux BAV complets et aux BAV de haut degré
la bradycardie est observée dans 96,49% avec une fréquence
cardiaque moyenne de 39,14 bpm.
La même proportion est retrouvée dans la
série de TOURE (91,1%) et dans celle de DAMOROU (90%). Quant à
THIOYE, il n'a retrouvé que 37% de bradycardie
Nous n'avons trouvé que 20,31% de fausse HTA, moins que
TOUTRE qui en avait trouvée 31,11%. Quant à l'HTA vraie, nous
avons trouvé un pourcentage (42,18%) à peu près
égal à celui de TOURE (44,44%). Nous avons trouvé quatre
fois moins de systole en écho (25%) que TOURE (60%).
En ce qui concerne les signes d'insuffisance cardiaque, KOLOGO a
en trouvé plus que nous.
Des signes associés manifestement en rapport avec une
affection intercurrente sont notés dans 6,25%.
III- étude para-clinique
A- LA biologie
Les signes biologiques retrouvés dans troubles de la
conduction auriculo-ventriculaire sont généralement en rapport
avec des pathologies associées ou en rapport avec la cause du trouble
conductif. Ainsi les paramètres biologiques que nous avons
mesurés sont normaux chez 46,87% de nos malades.
Certaines anomalies observées dans notre série sont
liées au terrain : hyperglycémie (4,68%) chez des
diabétiques; perturbation de la fonction rénale dans 10,93%. Un
syndrome inflammatoire biologique est rencontré dans 15,62%
essentiellement chez des malades ayant présenté une pneumopathie
infectieuse et chez d'autres dans un contexte de myocardite aiguë
probable. Un malade a présenté une élévation de la
troponine I en phase aiguë d'infarctus circonférentiel du myocarde.
Des troubles ioniques mineurs sont rencontrés dans 28,12% dont une
hyponatrémie dans 14%. Une anémie a été dans 12,5%
et une hyperuricémie dans 6,25%.
B- La radiographie du thorax
La cardiomégalie est le signe radiologique le plus
constant dans notre série (51,56%) avec un index cardio-thoracique moyen
de 0,53.
Damorou avait trouvé plus de cardiomégalie que nous
avec 70% des cas et un index cardio-thoracique moyen de 0,56. La
cardiomégalie serait liée dans la majorité de nos cas
à une myocardiopathie confirmée par l'écho Doppler
cardiaque.
Des signes de surcharge pulmonaires sont associés dans
20,31% et la radiographie du thorax était normale dans 25% des cas dans
notre série.
Une pneumopathie d'origine infectieuse a été
observée dans 10,9% et une pleurésie dans 4,68%.
C- L'électrocardiogramme de surface
· La fréquence auriculaire moyenne était de
84,82 cycles par minute, peu différente
de celle retrouvée par THIOYE [81], qui
est de 83,08 c/min. La fréquence auriculaire était
inférieure à 100 c/min dans 71% des cas de notre série
contre 91,4% dans la série de THIOYE et 93,23% dans celle de DAMOROU.
· La fréquence ventriculaire moyenne était de
41,86 c/min dans notre série,
supérieure à celle que THIOYE
[81] a trouvée (36,09 c/min) et 65,6% de nos malades
avaient une fréquence ventriculaire inférieure à 40 c/min
contre 45,2% pour THIOYE et 56,9% pour DAMOROU.
La fréquence ventriculaire que nous avons retrouvée
n'est pas très différente de la fréquence cardiaque
moyenne auscultatoire (43,06 bpm).
· Un peu plus de la moitié de nos malades (51,57%)
avaient un complexe QRS
élargi. La durée moyenne du QRS était de
0,1166 S.
D'autres auteurs [16, 21, 81] ont noté un
pourcentage plus élevé avec respectivement 65,71% pour Charles;
79,31% pour DAMOROU et 60,4% pour THIOYE.
· La majorité de nos malades avaient un BAV du
troisième degré avec 79,68% des
cas contre 9,37% de haut degré; 3,12% de deuxième
degré et 4,68% de premier degré. Nous avons noté un bloc
tri-fasciculé dans 3,12% des cas.
Des proportions similaires ont été signalées
dans d'autres séries [16, 21, 54, 69]. IHENACHO
[52] par contre n'avait noté que 46,66% de cas de BAV
complet avec 53,33% de BAV du deuxième degré.
Dans ces différentes séries [16, 21, 52,
54, 69] qui portaient pour l'essentiel sur la stimulation cardiaque,
aucun cas de BAV du premier degré n'a été
signalé.
· Nous n'avons cependant pas retrouvé de
corrélation entre les données de
l'électrocardiogramme ni avec les différents
symptômes observés, ni avec les signes physiques retrouvés.
Le test du Khi deux n'étant statistiquement significatif dans aucun
cas.
D- L'écho Doppler cardiaque
Il a été réalisé chez 90% de nos
malades.
· Seuls 7,81% des malades avaient une fonction systolique
ventriculaire gauche
altérée contre 81,25% de fonction systolique
ventriculaire gauche conservée.
· Les autres anomalies de l'écho Doppler cardiaque
étaient dominées par la
dilatation des cavités cardiaques (26,5%) qui
intéressait dans 15,56% les cavités gauches de façon
isolée. Dans 9,37% des cas il s'agissait d'une dilatation des
cavités cardiaques gauches et droites avec tableau de myocardiopathie
dilatée. Une dilatation isolée du ventricule droit n'a
été observée que dans 1,56% des cas dans un contexte
d'insuffisance tricuspidienne sévère avec HTAP importante.
Nous avons noté 39% d'atteinte valvulaire contre 69,9%
dans la série de THIOYE et 71,77% dans celle de DAMOROU.
L'HTAP a été observée dans 26,56%. Elle
était modérée dans la moitié des cas.
Un trouble de la relaxation du ventricule gauche a
été retrouvé chez 23,43% de nos malades avec un rapport
E/A inférieur à 1.
Ces anomalies étaient expliquées le plus souvent
par une pathologie associée : une HTA, une cardiopathie
ischémique, une atteinte valvulaire primitive ... etc.
IV- L'étude du terrain sous-jacent
Notre échantillon présentait des pathologies
associées au trouble conductif dans certains cas notamment une
myocardiopathie, une HTA ou une atteinte valvulaire importante à
sévère avec HTAP.
Une pathologie extra-cardiaque était notée dans
d'autres cas de pneumopathie, de diabète et d'insuffisance
rénale chronique.
V- Les étiologies
L'étiologie était supposée d'origine
dégénérative dans 82,81% des cas de notre série.
Nos critères diagnostiques étiologiques étaient
basés sur l'existence d'une cause secondaire (pathologie
associée) et sur l'étude du terrain (âge et
antécédents).
En l'absence d'une cause secondaire évidente chez le sujet
âgé, nous avions retenu la cause
dégénérative.
Nous n'avions cependant pas noté de cause
congénitale.
Dans 4,68% une cause ischémique a été
évoquée dont un cas d'infarctus circonférentiel aigu du
myocarde et deux cas de myocardiopathie chronique d'origine ischémique.
Une cause infectieuse (1,56%) a été
évoquée devant un tableau suspect de myocardite aiguë chez
une patiente âgée de 33 ans sans antécédents
cardio-vasculaires connus. Cependant nous n'avions pas d'arguments
décisifs pour la confirmation du diagnostic ( sérologie non
faite).
Deux cas de BAV (3,12%) ont été
étiquetés d'origine iatrogène suite à un traitement
par un digitalique d'une part et par un bêta-bloquant d'autre part.
L'arrêt du digitalique était suivi de la disparition du trouble
conductif chez un malade présentant un BAV du deuxième
degré type 2; par contre l'arrêt du bêta-bloquant n'avait
fait disparaître le trouble conductif dans `autre cas de BAV complet sur
fibrillation auriculaire chez une patiente traitée pour une maladie de
Basedow.
Chez quatre malades (7,81%), nous avions retenu le diagnostic
d'hypertonie vagale chez des sujets jeunes sportifs présentant pour les
3 cas un BAV du premier degré et pour le dernier un BAV du
deuxième degré type 2. L'épreuve d'effort a
été caractérisée chez les trois patients par une
accélération de la fréquence cardiaque avec
régression du trouble conductif à l'effort.
Dans la littérature plusieurs causes de BAV sont
décrites [8, 31, 44, 46, 47, 48, 65, 72].
Le BAV secondaire à l'infarctus du myocarde est
décrit avec des prévalences variables de 12 à 25% selon
Djiane P [31]; 7,6% dans la série de HANNACHI
[47] et 21,7% dans la série de Ben Ameur
[8].
L'étiologie dégénérative reste
fréquente 38% d'après Davies [31] et 75% des cas
chez les sujets de plus de 65 ans [31].
Le BAV congénital est aussi largement rapporté
[ 17, 31, 44, 48, 65, 72]. Les BAV congénitaux
isolés sont fréquemment associés à une maladie
auto-immune de la mère.
L'étiologie virale est décrite [31,
62] et serait secondaire à une infiltration cellulaire et/ou
une fibrose myocardique touchant les voies de conduction. Nous avons
observé un cas de BAV du troisième degré sur myocardite
aiguë probable.
D'autres causes décrites [31] : BAV
iatrogène médicamenteux ou après chirurgie cardiaque ou
lors d'un cathétérisme cardiaque droit [31]; BAV des
valvulopathies, des myocardiopathies, des tumeurs cardiaques, des maladies du
système et les BAV par infiltration septale.
VI- Aspects thérapeutiques
A- Les moyens thérapeutiques utilisés
· La majorité de nos malades ont
bénéficié de la stimulation cardiaque définitive
(75% de l'effectif total). Une patiente a
bénéficié d'une stimulation cardiaque temporaire pendant
18 jours. Une stimulation cardiaque définitive n'a pu être
réalisée faute de moyens financiers permettant à la
patiente de se procurer un pacemaker, le service social de l'hôpital
était aussi dans l'incapacité de faire face aux frais
nécessaires.
Les indications de la stimulation cardiaque définitive
sont dominées chez nos malades par le BAV du troisième
degré (91,66%) contre 6,25% de BAV du haut degré et 2% de bloc
tri-fasciculé.
Dans la série de IHENACHO il a été
noté 50% de pacemaker définitif pour BAV complet, DAMOROU avait
retrouvé 87,37%, NDORI 80%, TOURE 100% et THIOYE 94,9%.
· Les autres modalités thérapeutiques
utilisées sont généralement en rapport
avec une étiologie retrouvée ou dans le cadre du
traitement d'une pathologie associée. C'est ainsi chez deux malades
(3,12%) l'indication de l'arrêt d'un médicament a
été posée; chez deux autres le traitement médical
de la cause supposée du trouble conductif a été
instauré : corticothérapie dans un cas de myocardite
aiguë et thrombolyse dans un autre cas d'infarctus circonférentiel
du myocarde en phase aiguë.
La correction de tout autre trouble était
systématique en fonction des indications thérapeutiques en
vigueur.
Il faut noter que pour tous les cas de stimulation cardiaque
définitive l'antibio-prophylaxie était systématiquement
utilisée par voie intraveineuse en pré-opératoire
immédiat avec un relais per os par une céphalosporine de
troisième génération durant une dizaine de jours.
Cette attitude reste contre-versée dans la
littérature [20, 42].
Ainsi à l'issue d'une étude prospective sur la
prévention poly-factorielle des endocardites et stimulateurs cardiaques,
GRAUX P et al [42] ont préconisé
l'antibioprophylaxie pré opératoire systématique par voie
intra-veineuse répétée en fonction de la durée de
l'intervention. Ce protocole a été validé en 1992 lors de
la conférence de consensus de la société française
d'anesthésie et de réanimation [42]. Toutefois
d'autres auteurs ne trouvent pas de différence significative entre les
groupes traités et les groupes non traités. C'est le cas
notamment de Harstein [42]. Pour certains, elle ne serait
utile que lors des remplacements de boîtiers ou lors de stimulation
à risque [42].
Pour d'autres enfin elle permettrait de réduire le risque
infectieux [42].
La méta-analyse réalisée par Da Costa et al
à partir de 7 études prospectives randomisées,
[20] suggère un effet préventif du traitement
antibiotique prophylactique sur la survenue des complications infectieuses
après pose de pacemaker (p= 0,0046).
· Dans notre étude un groupe de 11 malades (17,18%)
n'ont bénéficié d'aucun
traitement.
Cette abstention thérapeutique était fondée
pour les 4 cas (6,25%) sur l'absence d'indication. Il s'agit de trois cas de
BAV du premier degré et d'un cas BAV du deuxième degré
type II chez un sportif.
Dans 3 autres cas (4,68%) de BAV du troisième l'abstention
était liée d'une part à un défaut de moyens
financiers et d'autre part au refus de la stimulation pour l'un et à un
état clinique ne permettant pas la stimulation ( pneumopathie
infectieuse sévère sur une insuffisance rénale terminale)
pour le dernier.
Dans un cas de bloc tri-fasciculé sur un terrain de
diabète de type II, l'abstention était justifiée par une
décompensation aiguë en acido-cétose .
Les 3 derniers cas d'abstention sont des BAV de haut degré
qui n'ont pas été stimulés faute de moyens financiers.
B- Les indications thérapeutiques chez nos
malades
· L'indication d'une stimulation cardiaque définitive
était posée dans 57 cas
(89,06%) dont 49 cas de BAV complet (76,56%), 6 cas de BAV de
haut degré (9,37%) et 2 cas de bloc tri-fasciculé (3,12%).
Cependant seuls 48 malades de ce groupe (84,21%) ont pu
bénéficié de la stimulation cardiaque.
Dans les 9 cas restants (15,78%), la stimulation cardiaque n'a pu
être réalisée pour les raisons suivantes :
- défaut de moyens financiers dans 6 cas (10,52%);
- pathologie associée dans 2 cas (3,5%);
- refus du malade dans 1 cas (1,75%).
Le pourcentage de stimulation retrouvé dans d'autres
séries est variable.
Ainsi Damourou [21] avait noté 100% de
stimulation cardiaque dont 87,5% pour BAV complet.
DIOP [30] en avait noté moins que dans
notre série avec 55% de stimulation, de même que IHENCHO
[52] qui avait retrouvé 60% dont 20% pour BAV complet
et 33,33% pour BAV du deuxième degré type II.
· Les autres indications thérapeutiques, dans notre
étude, sont essentiellement
liées à l'étiologie et au degré du
BAV.
Ainsi le traitement médical a été
proposé dans 2 cas (3,12%) dont un cas de BAV complet sur une
myocardite aiguë probable traitée par corticoïdes et un autre
cas de BAV complet sur infarctus du myocarde circonférentiel.
L'abstention thérapeutique a été retenue
dans 4 cas (6,25%) dont 3 cas de BAV du premier degré et un cas de BAV
du deuxième degré type II alors dans 2 cas l'arrêt d'une
intoxication médicamenteuse a été proconisée.
C- Les modalités de la stimulation
cardiaque
1- La technique de stimulation
L'ensemble de nos malades stimulés ont été
abordés par voie sous-clavière gauche par ponction veineuse
directe selon la technique de Seldinger.
Le site d'implantation était pré-pectoral et le
côté gauche chez tous nos malades.
La stimulation était endocavitaire dans tous les cas de
notre série.
Le côté de l'implantation importe peu et la
préférence devrait rester celle du malade. Pour certains, le
côté opéré doit être contre-latéral
à la main dominante [73].
Les préférences de l'implanteur interviennent aussi
dans le choix du côté.
Le côté droit pose le problème du passage des
sondes au niveau du confluant jugulo-sous-clavier de Progoff et le
côté gauche celui du passage de la jonction tronc
brachio-céphalique - veine cave supérieure
[73].
2- Le mode stimulation cardiaque
La stimulation mon-chambre a été le mode
stimulation majoritairement utilisé dans notre série avec 93,75%
des cas dont 83,33% en mode VVI et 10,41% en mode VVIR. La stimulation
double-chambre n'a été utilisée que chez trois patients
dans notre série (6,24%) dont deux cas (4,16%) en mode DDD et un cas
(2,08%) en mode VDDR.
Ces caractéristiques de stimulation sont
généralement retrouvées dans les pays
économiquement faibles. Ainsi dans les séries africaines
[52, 54, 69, 80, 81] le mode VVI était respectivement
retrouvé dans les proportions suivantes : 75%, 97,36%, 82,35%, 100%
et 87%.
Le choix de ce mode VVI (moins cher) dans notre série
serait liée aux possibilités d'acquisition de façon
générale des pacemaker.
Cependant la tendance actuelle est à l'utilisation de la
stimulation double-chambre chaque fois que possible [4, 9, 14, 15, 50,
60], car elle semble le moyen le plus adapté pour assurer une
synchronisation harmonieuse entre les oreillettes et les ventricules avec
possibilité d'adaptation de la fréquence cardiaque aux besoins
métaboliques.
En effet la comparaison des modes de stimulation cardiaque VVI et
DDD sur la performance à l'effort évaluée par la mesure
des échanges gazeux respiratoires montre un bénéfice en
faveur du mode DDD. Ce bénéfice semble surtout lié au gain
en fréquence cardiaque qu'offre le mode DDD [14].
VII- aspects évolutifs
A- évolution des BAV après stimulation
cardiaque définitive
· Pendant la procédure de d'implantation, nous avons
observé sept cas de
syncope (10,93%) dont une par tachycardie ventriculaire et les
autres par asystolie ventriculaire.
Un patient en insuffisance cardiaque globale a
présenté un tableau d'oedème aigu du poumon
nécessitant l'administration intra-veineuse de Furosémide sur la
table d'implantation.
· Durant la période post-implantation, notre travail
n'a couvert que la durée de
l'hospitalisation. Néanmoins, quelques
événements ont été notés :
- un défaut de stimulation dans 2 cas (4,16%) lié
à un défaut de programmation
ayant nécessité une reprogrammation;
- un déplacement de sonde auriculaire
repositionnée;
- un cas d'accident vasculaire cérébral
ischémique régressif (2,08%). Ce type de
complications a été rarement décrit dans la
littérature et serait en rapport avec une malposition de la sonde dans
le ventricule gauche au travers d'un foramen ovale perméable
[57, 58].
Charles a noté un cas d'embolie cérébrale
chez une patiente qui présentait par ailleurs une fibrillation
auriculaire.
- une persistance de l'hypertension artérielle dans 4 cas
(8,33%).
- Un seul décès (2,08%) a été
noté dans la période post-implantation immédiate
chez un patient présentant par ailleurs une pneumopathie
aiguë sévère et une insuffisance tricuspide importante avec
HTAP sévère.
Son décès serait en rapport avec cette
infection.
D'autres auteurs [16, 21, 30, 69] ont
noté : Charles 3 cas de décès (8,57%) dont un par
embolie cérébrale, un par tétanos et un par insuffisance
cardiaque; THIOYE a déploré 5 décès (8,1%)
liés une pathologie associée dans 80% des cas; DAMOUROU a
noté 3 cas de décès (6%); DIOP sur un suivi de 210 jours
n'a signalé aucun décès, seule une malposition de sonde;
NDORI de même n'a noté aucun décès.
Quant à THIAM [80], il a noté 5
décès (5,4%) sans rapport avec la stimulation.
De nombreuses complications secondaires à l'implantation
d'un pacemaker sont décrites dans la littérature. Parmi
celles-ci, les infections sur sondes de pacemaker sont les plus
fréquemment rapportées avec des prévalences qui varient de
0,15 à 12% [19, 27, 29, 38, 39, 42, 55, 63, 64, 79,
85].
En l'absence de recul suffisant nous n'avons observé
aucune complication infectieuse, d'où l'intérêt de
poursuivre ce travail ultérieurement pour l'évaluation à
long terme de nos malades traités par stimulation cardiaque
définitive.
B- L'évolution des BAV non
stimulés
Nous avons noté la régression du trouble conductif
après arrêt d'une intoxication médicamenteuse dans un cas
de BAV du deuxième degré type 1 secondaire à un traitement
par digitalique. Un deuxième cas de régression est survenu pour
un BAV complet apparu précocement à la phase aiguë d'un
infarctus circonférentiel du myocarde qui a été
thrombolysé. Cependant l'évolution finale de ce patient a
été marquée par le décès dans un tableau de
dysfonction ventriculaire gauche sévère avec état de choc
cardio-vasculaire réfractaire aux amines vasopressives. Le BAV dans
l'infarctus du myocarde est largement décrit dans la littérature
avec des prévalences de 10 à 15% dans les infarctus
inférieurs qui s'accompagnent d'une mortalité
élevée (12%) et d'un surcroît de complications
hémodynamiques [8].
Nous avons noté trois autres cas de décès
dont un cas de BAV complet décédé d'une insuffisance
rénale chronique terminale associée à une infection
pulmonaire sévère; un deuxième cas de BAV complet
secondaire à une myocardite aiguë probable chez un adulte jeune.
Son décès est survenu dans un tableau de coma
acido-cétosique sur diabète cortisonique. Le troisième
décès est survenu aussi dans un tableau de décompensation
aiguë d'un diabète de type 2 chez patient porteur d'un bloc
tri-fasciculé.
C- L'évolution globale
La mortalité globale dans notre étude est de 9,37%.
Il s'agit de la mortalité relative à l'ensemble de tous les
malades stimulés et non stimulés. Un seul cas de
décès a été noté après stimulation
cardiaque définitive (1,56%) dans un contexte d'infection pulmonaire sur
insuffisance tricuspide importante avec HTAP sévère; un cas
après stimulation cardiaque temporaire par déplacement de la
sonde (1,56%) et 4 cas de décès par affection intercurrente pour
des BAV non stimulés (6,25%).
Toutefois l'évolution a été favorable dans
62,5% des cas, stationnaire dans 10,93% et 3 malades ont été
perdus de vue (4,68%).

CONCLUSION
Les troubles de la conduction auriculo-ventriculaire constituent
une réalité dans la pratique médicale cardiologique
à Dakar. L'avènement de la stimulation cardiaque dans le
traitement des troubles sévères de la conduction
auriculo-ventriculaire a radicalement transformé le pronostic des blocs
auriculo-ventriculaires. Au Sénégal, la pratique de la
stimulation cardiaque est devenue une méthode thérapeutique de
plus en plus utilisée [16, 21, 30, 54, 77, 78].
Nous avons essayé de montrer, à travers ce travail
certains aspects des troubles de la conduction auriculo-ventriculaire de tout
type dans le service de cardiologie de l'hôpital Aristide Le Dantec de
Dakar, à partir d'une étude prospective et descriptive sur 64 cas
de BAV colligés dans ce service durant la période de janvier 2002
à octobre 2003.
Nous avons noté durant la période que couvrait
notre étude, une prévalence de ce trouble conductif égale
à 4,9% de l'ensemble des malades hospitalisés dans le service
durant la même période. Cette prévalence semble en
progression comparativement aux années précédentes
[30].
Les troubles de la conduction auriculo-ventriculaire semblent
être une affection du sujet âgé dans notre série.
L'âge moyen de nos malades était de 63,81ans.
Une légère prédominance féminine a
été notée avec un sexe ratio égal à 0,94.
Le niveau socio-économique de nos malades est faible
à moyen dans une large majorité (93,7%).
L'antécédent le plus fréquemment
retrouvé demeure l'hypertension artérielle. Il s'agissait
plus-tôt d'une fausse hypertension artérielle car cette
dernière n'a persisté que dans 6,25% après stimulation
cardiaque.
La symptomatologie chez nos patients était dominée
par la dyspnée cependant l'affection est révélée
par une syncope ou un équivalent mineur de la syncope dans la
majorité des cas. Dans bien des cas ces signes sont associés.
Toutefois dans 12,5% le trouble était latent n'a
été découvert qu'au cours d'un bilan.
A l'examen physique, nous avons noté une pression
artérielle systolique moyenne de 166,72 mm Hg et une pression
artérielle diastolique moyenne de 80,33 mm Hg.
Le profil tensionnel des malades était dominé par
la fausse hypertension artérielle (42,18%), tandisque la tension
artérielle était normale dans 35,93% et un collapsus
cardio-vasculaire a été noté dans un contexte d'infarctus
aigu du myocarde.
La fréquence cardiaque auscultatoire moyenne était
de 43 bpm. Plus de la moitié des malades (56,25%) avaient une
fréquence cardiaque inférieure à 40 bpm.
LA bradycardie a été retrouvée dans 85,93%
de l'ensemble de nos malades; rapportée au groupe des BAV complets et
des BAV de haut degré la bradycardie est notée dans 96,49%. Ainsi
la bradycardie demeure le signe spécifique le plus fréquemment
retrouvé. Elle doit rester, pour tout praticien médical un signe
d'appel fort et nécessiter au moins la réalisation d'un
électrocardiogramme de surface à la recherche du trouble de la
conduction auriculo-ventriculaire.
L'assourdissement des bruits du coeur est le second signe
physique le plus fréquent (73,4%), tandisque la systole en écho
n'a été notée que dans 25% et un souffle systolique
apexien dans 28,1%.
Des signes d'insuffisance cardiaque ont été
notés dans 14,5%.
A la radiographie du thorax, l'index cardio-toracique moyen
était de 0,53 et une cardiomégalie était retrouvée
dans 51,56%.
A l'électrocardiogramme de surface, la fréquence
auriculaire moyenne était de
84,22 cycles par minute et la fréquence ventriculaire
moyenne de 41,86 cycles par minute.
La majorité des malades étaient en BAV complet
(79,7%). Nous avons retrouvé 9,3% de BAV de haut degré; 4,6% de
BAV du deuxième degré; 3,12% de BAV du premier degré et
autant de blocs tri-fasciculés.
La durée moyenne du QRS était de 0,11S, elle
était élargie dans 51,57%.
Le rythme auriculaire était sinusal dans 96,87%.
A l'écho Doppler cardiaque la fonction systolique
ventriculaire gauche était conservée dans 76,56%,
altérée dans 7,81% et non étudiée dans 14,62%.
Les autres anomalies retrouvées à l'écho
Doppler cardiaque sont dominées par la dilatation des cavités
cardiaques (37,5%) dont 10,9% de myocardiopathie dilatée; l'atteinte
valvulaire primitive dominée par l'insuffisance mitrale et
l'insuffisance tricuspide; l'hypertension artérielle pulmonaire et les
troubles de la relaxation du ventricule gauche.
La presque totalité de nos malades avaient un BAV
chroniques (98,43%) avec une étiologie dégénérative
dominante (82,81%). Nous avons noté deux cas de BAV aigu par infarctus
du myocarde dont l'un a régressé après thromblyse
tandisque l'autre a dû bénéficié de pacemaker
définitif. Un cas fortement suspect de myocardite aiguë a
été observé, une étiologie iatrogène dans
3,12% et une hypertonie vagale dans 6,24%.
La majorité de nos malades ont
bénéficié de la stimulation cardiaque définitive
(75%). Il s'agissait dans tous les cas de primo-implantation. La voie d'abord
était sous-clavière et la stimulation endocavitaire dans tous les
cas.Les indications de la stimulation cardiaque étaient essentiellement
le BAV complet (91,66%).
Dans 10,93% l'indication d'une stimulation cardiaque a
été posée mais elle n'a pu être
réalisée par défaut de moyens financiers le plus souvent.
La stimulation était de type mono-chambre dans la
majorité des cas (93,75%) dont 83,33% en mode VVI et 10,41% en mode
VVIR.
La stimulation double chambre n'a été
réalisée que dans 6,25%.
Pendant la procédure de stimulation nous avons
noté en per-opératoire 9 cas de syncope à
répétition, un cas d'inefficacité du stimulateur et un
oedème aigu du poumon sur la table opératoire.
La mortalité globale était de 9,37% dont un cas de
décès (1,56%) par infection pulmonaire sur insuffisance
tricuspide après stimulation définitive et un cas de
décès après stimulation cardiaque temporaire suite au
déplacement de la sonde. Les autres cas de décès sont
survenus chez des malades non stimulés et la cause du
décès ne serait pas en rapport avec le trouble conductif.
L'hypertension artérielle a persisté dans 8,33%.
Un cas de déplacement de sonde auriculaire a
été noté de même qu'un défaut de stimulation
et une embolie cérébrale régressive à distance de
la stimulation.
Nous avons enregistré la régression d'un BAV de
deuxième degré iatrogène, par intoxication digitalique,
après arrêt du médicament.
L'évolution était simple dans 62,5% cependant
nous n'avions pas étudié l'évolution à long terme
après stimulation définitive.

BIBLIOGRAPHIE
1. Aliot P (société française de
cardiologie)
Recommandations de la société française de
cardiologie concernant l'électrophysiologie diagnostique et
interventionnelle, la stimulation cardiaque permanente et la
défibrillation automatique implantable.
Arch Mal Coeur 1999; 92 : 243-51.
2. Barbou F, Leyral J, Cellarier G et Cano P.
Tachycardie sur pacemaker : intérêt du mode
sous aimant en pré-hospitalier.
JEUR 2002; 15 : 217-20.
3. Barney C.
La stimulation cardiaque personnalisée :
Différents types de pacemaker, leurs intérêts respectifs,
leur surveillance en pratique cardiologique quotidienne.
Coeur 2000 1989; 3 : 41-9.
4. Barney C, Coste A, Benichou et Medvedowsky.
Étude clinique de la stimulation double chambre. A propos
de 50 observations avec un suivi de 1à 5 ans.
Arch Mal Coeur 1987; 2: 144-51.
5. Barnay C, Follzer E, Tarlet JM, Coste A, Rahal Y et
Lasseri C.
Pièges rythmologiques en stimulation cardiaque.
Arch Mal Coeur 1998;91: 61-9.
6. Barold S, Garrigue S, Jalaïs P, Hocini M,
Haïssaguerre M et Clémenty J.
Définitions du bloc auriculo-ventriculaire de
deuxième degré.
Arch Mal Coeur 2000; 93:1221-5.
7. Batmaz G, Villain E, Bonnet D, Iserin L, Fraise A et
Kachaner J.
Traitement et pronostic du bloc auriculo-ventriculaire complet
infectieux de l'enfant.
Arch Mal Coeur 2000; 93 : 553 -7.
8. Ben Ameur Y, Mghaieth F, Ouchall K, Hmem M, Terras M,
Longo S et Coll.
Valeur pronostique du bloc auriculo-ventriculaire du
deuxième et troisième degré au cours de la phase
aiguë de l'infarctus du myocarde inférieur.
Ann Cardiol Angéiol 2003; 52: 30-3.
9. Ben Ameur Y, Martin E, Jarwe M, Kouakam C, Klug D,
Lacroix D et al.
La stimulation cardiaque en mode VDD à sonde
unique :indications résultats et limites de la
méthode.
Ann Cardiol Angéiol 1997; 46:285-91.
10. Blanc JJ.
L'essentiel de 2001 en stimulation cardiaque.
Arch Mal coeur 2002; 95: 29-32.
11. Brembilla-Perrot B.
Résultats de la stimulation ventriculaire
systématique après infarctus du myocarde. Quel protocole?
Arch Mal Coeur 1993; 86 : 1453-7.
12. Brembilla-Perrot B, Terrier de La Chaise A et Shandel
C.
Caractéristiques et pronostic des tachycardies
ventriculaires induites par stimulation auriculaire.
Arch Mal Coeur 1992; 85 : 1291-7.
13. Carpentier O, Dubost-Brama A, Martin De Lassalle E,
Piette F et Delporte E.
Rhabdomyosarcome sur site d'implantation d'un stimulateur
cardiaque.
Ann Dermatol Venereol 2000; 127 :837-40.
14. Chabernaud JM, Guéret P, Blanc P, Bavoux O et
Bensait J.
Comparaison des modes de stimulation cardiaque VVI et DDD sur la
performance a l'effort évaluée par la mesure des échanges
gazeux respiratoires
Arch Mal Coeur 1993; 86 : 69- 74.
15. Chalvidan T, Deharo JC et Djane P.
Les syndromes du pacemaker.
Ann Cardiol Angéiol 2000; 49 :224-9.
16. Charles D, Gueye PM, Wade B et Diallo A.
Stimulation cardiaque définitive : à propos de
35 cas sénégalais.
Cardiologie tropicale, Tropical Cardiology 1997; 23: 19-24.
17. Chitrit Y, Zorn B, Guillevin L, Filidori M, Godefroy
Y, Kahn MF, Chasseray
JE, Caubel P.
Bloc auriculo-ventriculaire congénital et anticorps
anti-Ro ( SS-A ) / anti-La (SS-B )
J. Gynecol. Biol. Reprod. , Masson, Paris 1993; 22 : 777-81.
18. Clementy J, Vancoline O, Garrigue S, Reuter S,
Bordachar P, Gillet T et al.
De quels moyens disposons-nous pour évaluer la
qualité de vie des patients porteurs d'un stimulateur cardiaque?
Ann Cardiol Angéiol 2000;49 :245-51.
19. Da Costa A, Kirkorian G, Chevalier Ph, Cerisier A,
ChalvidanT, Obadia JF et
al.
Infections secondaires à l'implantation d'un stimulateur
cardiaque.
Arch Mal Coeur 1998; 91 : 753-7.
20. Da Costa A, Kirkorian G, Cucherat M, Delahaye F,
Chevalier Ph, CerisierA et
al.
Antibiotic prophylaxis for permanent pacemaker implantation. A
meta-analysis.
Circulation 1998; 97:1796-801.
21. Damourou FJ M.
La stimulation cardiaque définitive au
Sénégal : Indications et surveillance des patients. A propos
de 32 cas observés á la clinique cardiologique du CHU de
Dakar.
Mémoire de certificats d'études spéciales de
cardiologie, Dakar 2001.
22. Daubert C, Ritter P et Mabo P.
Les stimulateurs cardiaques implantables et leur surveillance -
Éditions Techniques - Encycl. Med. Chir. ( Paris - France ), Coeur
-Vaisseaux, 11036 F10, 12-1990, 11p.
23. Daubert JC, Blanc JJ, Godin JF et Torresani J.
Indications de la stimulation cardiaque
définitive en 1986. Recommandations du groupe de stimulation cardiaque
de la société française de cardiologie.
Arch Mal Coeur 1986;8 :1221-30.
24. Daubert JC, Gras D, Leclercq C et Mabo P.
La stimulation cardiaque définitive en 1993 : ses
objectifs, ses moyens et ses résultats.
Ann Cardiol Angéiol 1994; 43: 237-43.
25. Davy JM, Mons M, Beck L et ferriere M.
Les indications nouvelles de la stimulation cardiaque.
Arch Mal Coeur 1995; 88: 55-62.
26. Davy JM, Pons M, Racza F et Piot C.
Aspects électrocardiographiques de la
pathologie du faisceau de His.
Arch Mal Coeur 1999; 92: 37-40.
27. Delpierre S, Le Heiget H, Sauvaget F, Sevin E,
Montagne O et Lejonc JL.
Infection systémique sur sondes endocavitaires de
stimulation cardiaque. A propos d'un cas et revue de la littérature.
Ann Med Interne 1999 ; 150 : 265-8.
29. Deheedene M, Klug D, Jarwe M, Kouakam C, Marquie C et
Kacet S.
Infections secondaires à l'implantation d'un stimulateur
cardiaque : mise au point.
Ann Cardiol Angéiol 2000; 49 : 230-7.
30. Diop IB, Ba SA, Underwood P, Diack B, Damourou JM,
Kane A, Sarr M,
Thiam O, Diaw M, Ba A, Diouf SM.
Stimulation cardiaque définitive au
Sénégal : Expérience préliminaire a la
clinique cardiologique de Dakar.
Dakar Médical, 2000, 45, 1 : 101-4.
31. Djiane P et Déharo JC.
Blocs auriculo-ventriculaires. Encycl Med Chir (Elsevier, Paris),
Cardiologie-Angiologie, 11-032-A-10, 1999, 12p.
32. Dunica S, Piette JC, Nassar N et Beaufils P.
Une nouvelle cause de bloc auriculo-ventriculaire aigu
transitoire : la maladie de Lyme.
Arch Mal Coeur 1986; 8 : 1251-5.
33. Frank F.
Étude du comportement de 20 stimulateurs cardiaques lors
du
passage des patients dans deux modèles de portes de
détection antivol.
Ann Cardiol Angéiol 2000;49 :187-97.
34. Frank R, Himbert C, Hidden-Lucet F, Petitot JC et
Fontaine G.
Les effets des interférences électriques sur les
stimulateurs cardiaques.
Ann Cardiol Angeiol 2000; 49 :238-44.
35. Frank R, Himbert C, Hidden-Lucet F, Petitot JC et
Fontaine G.
Structures, fonctions et surveillance des stimulateurs
cardiaques. Encycl Med Chir (Éditions Scientifiques et Médicales
Elsevier SAS, Paris, tous droits réservés). Cardiologie
11-036-F-10, 2000, 11p.
36. Gammage MD.
Temporary cardiac pacing.
Heart 2000; 83: 715-720.
37. Ginks W.
Prognosis of patients paced for chronic atrioventricular
block.
Br. Heart J 1979; 41.
38. Girod G, Fromer M, Schläpfer J et Kapenberger L.
Stimulation cardiaque: extraction percutanée de sondes
infectées.
Arch Mal Coeur 1999; 92 : 1479-84.
39. Glock Y, Sabatier J, Salvador-Mazencq M et Puel P.
Les endocardites sur électrodes endocavitaires de
stimulateurs cardiaques.
Arch Mal Coeur 1986; 4 :483-8.
40. Godin JF et Le Marec H.
Quel pacemaker pour quel patient ?
Ann Cardiol Angéiol 1988; 37: 566-73.
41. Gontal H.
Syndrome pleuro-pericardique : une complication rare de la
stimulation cardiaque par voie endocavitaire. A propos d'un cas.
Arch Mal Coeur 1995; 88.
42. Graux P, Lequeuche B, Guyomar Y, Carlioz R, Delfaut
Ph, Beaugeard D et al.
Prévention poly factorielle des endocardites et
stimulateurs cardiaques : une étude prospective à propos de
207 cas.
Ann Cardiol Angeiol 1996; 45: 113-8.
43. Gregoratos G.
Permanent pacemaker in older persons.
J. Am Geriator.
44. Grolleau R, Leclercq F, Guillaumont S et Voisin M.
Le bloc auriculo-ventriculaire congénital.
Arch Mal Coeur 1999; 92: 47 - 55.
45. Grolleau R, Messner P, Leclercq F et Carabasse D.
L'électrocardiogramme des blocs
auriculo-ventriculaires.
Arch Mal Coeur 1992; 85: 45-9.
46. Guerot C. Stimulation cardiaque :
Indications après infarctus du myocarde
ayant présenté un trouble de conduction à la
phase aiguë.
Coeur 2000, 1988; 2 : 43-4.
47. Hanachi N, Derbel F et Ben Ismail M.
Les blocs auriculo-ventriculaires à la
phase aiguë de l'infarctus du
myocarde. Évolution et pronostic. A propos de 90 cas.
Ann Cardiol Angéiol 1988; 37 : 137-42.
48. Hermann G et Galezowski N.
Bloc auriculo-ventriculaire congénital et maladie
auto-immune maternelle.
Coeur 2000, 1986; 11 :367-71
49. Himbert C, Lascault G, Tonet J, Coutte R, Busquet P,
Frank R et
Grosgogeat Y.
Tachycardie ventriculaire chez un porteur de stimulateur
cardiaque à fréquence asservie.
Arch Mal Coeur 1992; 85 : 1605-8.
50. Houeix de la Brousse JM.
Les stimulateurs double-chambre.
Coeur 2000, 1988; 3 : 45-6.
51. Ihenacho HNC, Ebigbo PO et Ikeh VO.
The african patients with cardiac pacemaker.
Cardiologie tropicale, Tropical Cardiology 1987; 13: 11- 6.
52. Ihenacho HNC, Okoroma EO, Anayanwu CH, Swarup AS and
Antao O.
Cardiac pacing for heart block: early experiences in Nigeria.
Tropical Cardiology 1980; 6: 197-203.
53. Jeffrey K et Parsonnet V.
Cardiac pacing, 1960 - 1985.
Circul 1998 ; 97 : 1978-91.
54. Kologo K.
Stimulation cardiaque définitive à propos de 38 cas
sénégalais.
Thèse Méd, Dakar 1992; 27:
55. Kugener H, Rey JL, Tribouilloy C, Hermida JS, Jarry
G, Avinée P et al.
Endocardites infectieuses sur sondes de stimulation endocavitaire
permanentes: Internet de l'échocardiographie trans-oesophagienne: revue
de la littérature.
Ann Cardiol Angéiol 1993; 42: 331-8.
56. Lamaison D, Motreff P, Dauphin C, Briand F, Marcollet
P, Langlade S,
Lusson JR et Cassagnes J.
Syncopes, troubles conductifs. Indications discutées de la
stimulation cardiaque.
Arch Mal Coeur 2000; 93: 47-55.
57. Lascault G, Dûrr A, Juillard JB, Thomas D,
Frank R, Gautier JC et al.
La stimulation cardiaque VVI: cause ou facteur d'embolies
cérébrales.
Arch Mal Coeur 1992; 85 :1527-31.
58. Laury P, Chabert JP, Blaise C, Perotin S, Brasselet
C, Schlick C et al.
Étiologie rare d'accident vasculaire
cérébral chez un patient ayant un stimulateur cardiaque.
Arch Mal coeur 2002; 95 : 219-22.
59. Lescure M, Dechandol AM, Lagorce P, Marot M, Goutner
C et Donzeau JP.
Blocs auriculo-ventriculaires d'effort.
Ann Cardiol Angéiol 1995; 44: 486-92.
60. Mabo Ph, Varin C, De Palace C, Kermarrec Aberder V et
Daubert C.
Echo-Doppler cardiaque et stimulation double chambre.
Ann Cardiol Angéiol 1992; 41:295-304.
61. Maendely R, Aldakar M, d'Hautefeuille B, Fontaine G,
Linares-Cruz E et al.
Mort subite d'un porteur de pacemaker par rupture du coeur en
péricarde cloisonné.
Ann Cardiol Angéiol 1987; 36: 355-9.
62. Marc MO, Anconina J, Dodinot B, Perrin O, Meyer L,
Selton-Suty C et al.
Bloc auriculo-ventriculaire irréversible d'origine
virale.
Ann. Cardiol. Angéiol 1993; 42: 23-4.
63. Meune Ch, Arnal Ch, Hermand Ch et Cocheton
JJ.
Les endocardites infectieuses sur sondes de pacemaker.
Ann Med. Interne, 2000; 151 : 456-64.
64. Meune Ch, Arnal Ch, Hermand Ch et Cocheton
JJ.
Endocardite infectieuse après ablation incomplète
d'un pacemaker.
Ann Med. Interne, 2000; 151 : 150-1.
65. Meyer O.
Actualités sur les anti-SSA/Ro et anti-SSB/La (mise au
point).
Ann. Med. Interne 2002 ; 153, 8 : 520-9.
66. Morau P, Gerbaux A, Heudron F et André
M.
L'étiologie des blocs auriculo-ventriculaires
(d'après l'étude clinique de 552 cas).
Arch. Mal. Coeur, 1963, 56: 609-628.
67. Moustaghfir A, Hda A, Boukili AM, Ohayon V, et
Archane MI.
Blocs atrio-ventriculaires: du mecanisme au traitement.
Espérance Médicale 1998; 43.
68. Muciga J, Podeur H et Rollet M.
La stimulation cardiaque.
Encycl. Méd. Chir, CM 10 - 04, 1987, 839.
69. N'dori R, Metras D et Bertand Ed.
La cardiostimulation à Abidjan.
Cardiologie tropicale 1980; 6: 205-9.
70. Normand J, Bozio A, Heudron F, André M,
Sassolas F, Jocteur-Monrozier D
et Bussillet H.
Pronostic a long terme des blocs auriculo-ventriculaires
congénitaux
Arch Mal Coeur 1992; 85 : 1403-9.
71. Petitot JC.
La surveillance des sondes de stimulation.
Ann Cardiol Angéiol 2000; 49:266-9.
72. Popovic B, Marçon F, Lucron H, Bosser G,
Lethor JP, Sadoul N et al.
Blocs auriculo-ventriculaires complets congénitaux
isolés : suivi à long terme d'une série
consécutive de 54 patients.
Arch Mal Coeur 2003; 96 : 489-93.
73. Ritter P et Fischer W.
Pratique de la stimulation cardiaque.
Spinger-Verlag France, Paris 1997.
74. Rojas M, Papouin G, Hadrami J, Kamblock J, Lionet P
et Victor J.
Syncope d'Adams Stockes révélant
une crise de rhumatisme articulaire aigu.
A propos d'un cas.
Ann Cardiol Angéiol 1997; 46: 592-4.
75. Roux O, Klug D, Jarwe M et Kacet S.
La voie ilio-fémorale: une alternative
pour l'implantation des sondes de stimulation cardiaque
définitives. A propos de trois cas.
Arch Mal Coeur 2001; 94: 57-61.
76. Sakabinis D, Josse T, Ledent T, Bassler B et Liebens
I.
Cause inhabituelle d`insuffisance mitrale : implantation
involontaire d'une sonde de stimulation endocavitaire dans le ventricule
gauche. A propos d'un cas.
Arch Mal Coeur 2001; 94: 1190-4.
77. Shaw DB, Gowers JI, Kekwick CA and Whistance
AWT.
Is Mobitz type I atrioventricular block benign in adults?
Heart 2004; 90: 169-74.
79. Saoudi N, Yaïci K, Rinaldi JP, Bergonzi M et
Ricard Ph.
La conduction nodale.
Arch Mal Coeur 2002; 95: 47-55.
79. Schläpfer J, Buckingham T, Jiang ZY, Fromer M et
Kappenberger L.
Retrait par voie endocavitaire de sondes infectées de
stimulateurs cardiaques. A propos de cinq cas.
Ann Cardiol Angéiol 1996; 45: 321-4.
80. Thiam M, Fall PD, Gning SB, Ott D, Gueye PM, Wade B
et al.
La stimulation cardiaque définitive en Afrique de
l'Ouest : faisabilité, problèmes et perspectives.
Ann Cardiol Angéiol 2003; 52: 212-14
81. Thioye M
Stimulation cardiaque définitive :Indications et
surveillance. A propos
de 62 cas implantés à la clinique cardiologique de
Dakar.
Thèse, Méd, Dakar 2003; 18: 121p.
82. Trigano JA, Paganelli F, Ricard P, Ferracci A,
Avierinos JF et Lévis S.
Perforation du coeur après implantation transveineuse de
stimulation cardiaque.
Presse Med 1999; 28 :836-40.
83. Vacheron A, LE Feuve C et Di Matteo J.
Blocs auriculo-ventriculaires.
Cardiologie. - 3° éd.- Paris, Expansion Scientifique
Publications, 1999.
84. Victor F, De Place C, Leclercq C, Camus C, Gras D, Le
Helleco A et al.
Infections sur sonde de stimulation endocavitaire
permanente : intérêt de l'échocardiographie
trans-oesophagienne.
Arch Mal Coeur 1995; 88 : 1975-81.
85. Wang JN, Tsai YC, Lee WL, Lin CS and Wu
JM.
Complete Atrioventricular block following myocarditis in
children.
Pediatr Cardiol 2002; 23: 518-21.

| 


