II. Les minéraux argileux
Selon J. Mering (1963) le caractère argileux d'un
minéral repose sur quatre caractéristiques : -
la petite dimension des particules de minéraux,
inférieure à 2 um ;
- la dissymétrie des
particules de forme généralement lamellaire ce qui rend compte de
propriétés mécaniques comme la plasticité et de
propriétés physico-chimiques comme la rétention de
molécules d'eau ;
- la possibilité, pour ces
particules, de pouvoir donner des suspensions aqueuses plus ou moins stables
;
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 11
- leur composition chimique ; ce
sont des silicates ;
Ces caractéristiques sont celles des phyllosilicates
qui se définissent ainsi : « Les minéraux argileux
appartiennent à la famille des phyllosilicates et sont constitués
par une couche tétraédrique bidimensionnelle de composition
T2O5, T pouvant être Si4+, Al3+ ou
Fe3+. Ces tétraèdres sont liés dans un
même plan par trois de leurs sommets, le quatrième étant
orienté dans une autre direction. Les couches
tétraédriques sont liées dans la structure à des
couches octaédriques ou à des groupes de cations
coordonnés ou indépendants » [1].
II.1. Edifices phylliteux
II.1.1. Structure des feuillets
Les minéraux argileux sont des aluminosilicates
présentant une structure en feuillets, d'où leur appellation de
phyllosilicates (terme formé d'un morphème "phullon" issu du grec
signifiant: qui a l'aspect de feuille). Ces feuillets sont bidimensionnels et
constitués de deux types de couches [3] :
? La couche tétraédrique (figure I-3)
est formée de silice tétraédrique, c'est-à-dire
d'un cation Si4+ entouré de quatre anions O2-, qui
constituent les sommets du tétraèdre. Chaque
tétraèdre partage trois atomes d'oxygène avec les
tétraèdres adjacents. Ces atomes d'oxygène partagés
sont arrangés en réseau hexagonal qui forme la base de la couche.
Le bilan des charges positives et négatives présentes dans cette
structure n'est pas neutre. En effet, chaque tétraèdre est
formé d'un cation Si4+ et de trois anions O2- qui
forment la base du feuillet et qui appartiennent aussi à un
tétraèdre adjacent, et d'un quatrième anion O2-
qui lui n'est pas partagé. Le bilan des charges est alors : 4 +
3× (-2)/2 + (-2) = -1.
L'électroneutralité de la couche est obtenue par
la liaison avec une couche chargée positivement, par la présence
d'ions compensateurs à la surface de la couche, ou par ajout d'un proton
H+ sur certains O2-. L'épaisseur de cette couche
tétraédrique est de 4,63 Å.
? La couche octaédrique (figure I-3) est
formée de cations Al3+ ou Mg2+ entourés de
six groupements hydroxyle OH-. Ces octaèdres sont
reliés entre eux par des anions communs, et forment une couche plane. Le
bilan des charges présentes dans le feuillet est de +3 pour le cation
Al3+ et -1 pour le groupement hydroxyle, mais chaque OH-
est partagé avec trois cations, ce qui donne : +3 + 6× (-1)/3
= +1. Pour atteindre l'électroneutralité, seulement deux sites
ocatédriques sur trois sont occupés par un cation Al3+
; on parle alors de couche di-octaédrique de gibbsite. Dans le cas
du cation Mg2+, lorsque tous les sites sont occupés, la
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 12
couche est neutre ; c'est la structure tri-octaédrique
de brucite. La couche octaédrique a une épaisseur de 5,05
Å.
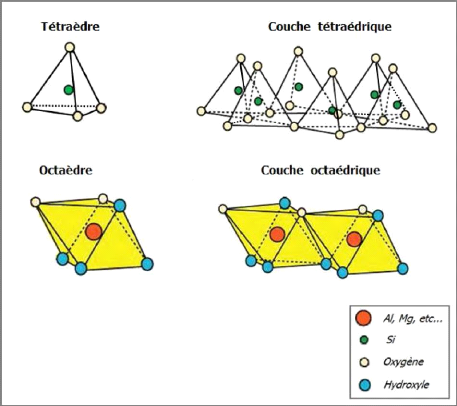
Figure I-3 :
Représentation des tétraèdres et des
octaèdres [4].
Ces couches tétraédriques ou octaédriques
sont donc formées par la superposition de plans d'oxygènes
délimitant des cavités de forme tétraédrique ou
octaédrique. La stabilité du feuillet est assurée par la
présence de cations à l'intérieur de ces cavités.
Dans la couche tétraédrique, le cation dominant est
Si4+ mais de fréquentes substitutions ont lieu avec
Al3+ et, plus rarement, avec Fe3+. Les sites
octaédriques, quant à eux, sont généralement
occupés par les cations Al3+, éventuellement
substitué par Fe2+ et surtout Mg2+, pour les
couches de type dioctaédrique et Mg2+ pour les couches
trioctaédriques [4].
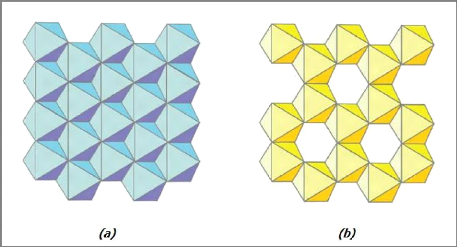
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 13
Figure I-4 :
Représentation schématique des deux types de
couches octaédriques : (a) = trioctaédrique ; (b) =
dioctaédrique [5].
Des couches tétraédriques (T) et des couches
octaédriques (O) forment des feuillets, séparés les uns
des autres par des espaces interfoliaires pouvant contenir des molécules
d'eau et des ions (figures I-5). L'ensemble d'un feuillet et d'un espace
interfoliaire est une unité structurale. Ces unités s'agencent
alors entre elles pour former des particules argileuses. La liaison entre une
couche tétraédrique et une couche octaédrique se fait par
l'intermédiaire du quatrième oxygène de la silice
tétraédrique, qui appartient aussi à un octaèdre du
feuillet octaédrique [3].
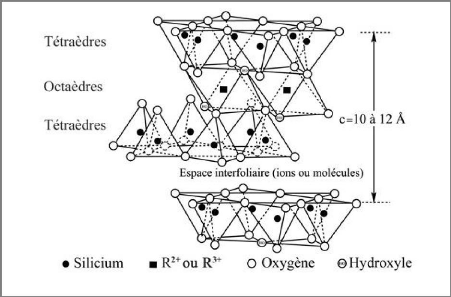
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 14
Figure I-5 : Assemblages de couches
tétraédriques et octaédriques : le feuillet argileux
[6]
Les espaces qui se trouvent entre les feuillets (i.e. espaces
interfoliaires) peuvent être vides ou remplis. Ils sont vides lorsque les
différents feuillets sont neutres, ou ils sont occupés par des
cations dès que l'empilement présente un déficit de charge
[2]. Les cations les plus fréquents sont le calcium
(Ca2+), le magnésium (Mg2+), le potassium
(K+), le sodium (Na+) et le lithium
(Li+).
L'ensemble, composé du feuillet
élémentaire et de l'espace interfoliaire, représente
l'unité structurale dont l'épaisseur constitue une
caractéristique fondamentale du minéral argileux et est
appelée distance interfoliaire ou distance basale et est notée
d001.
La valeur de cette distance basale peut être
déterminée à partir de la position angulaire de la
réflexion basale correspondant au plan réticulaire (001),
résolue par la diffraction des rayons X, et ce en utilisant la loi de
Bragg [7]:
X = 2 d001 sin(O)
Avec :
- O: angle entre le faisceau incident
et le réseau de plans (angle de diffraction)
- D : Espacement entre 2 plans
parallèles successifs du réseau cristallin
- X : Longueur d'onde du faisceau des
rayons X
Chapitre-I- Etude bibliographie
Année : 2012/2013 PFE - Master - Chimie Fondamentale
Page 15
Figure I-6 : Allures typiques des
particules de minéraux argileux [7]
| 


