Chapitre 2
Courbes d'énergie potentielle
2.1 Introduction
L'énergie potentielle de la molécule SiH+
résulte des interactions entre l'ion silicium Si+ et
l'atome d'hydrogène qui la composent. Par ailleurs, cette interaction
étant une fonction de la distance entre ces atomes, il parait alors
naturel que l'énergie potentielle de cette molécule dépend
de sa géométrie. Les solutions de l'équation de
Schrödinger électronique étudiées dans le chapitre 1,
seront présentées dans ce chapitre sous forme de courbes
d'énergie potentielle. Ces courbes sont obtenues en utilisant la
méthode MRCI et la base aV6Z. Avant de discuter nos résultats, il
est important de présenter l'ion moléculaire SiH+.
2.2 Présentation de l'ion moléculaire
SiH+
C'est une molécule diatomique
hétéronucléaire, appartenant au groupe de symétrie
C2v. Ses orbitales sont construites à partir des orbitales atomiques de
l'ion silicium et de l'atome d'hydrogène. Les orbitales atomiques de
type s et pz sont associées aux orbitales moléculaires
de type ó, et les orbitales px et py
respectivement aux orbitales ðx et ðy.
L'ion silicium Si+ a 13 électrons et sa structure
électronique
[1s22s22p6]3s23p1 donne
lieu à 5 orbitales ó, 2 orbitales ðx et 2
orbitales ðy. L'atome H à 1 seul électron, sa
structure électronique est 1s1 et correspond à 1
orbitale ó. On dispose donc d'un espace complet de valence comportant 6
orbitales ó, 2 orbitales ðx et 2 orbitales ðy
(6ó, 2ðx , 2ðy) associé
à la molécule SiH+ dans son état fondamental.
La configuration électronique correspondante est donc :
[1ó22ó23ó21ð2
x1ð2
y]4ó25ó2
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 14
La qualité des résultats du calcul
moléculaire est intimement liée au choix des orbitales atomiques
(OA) ou moléculaires (OM) utilisées pour les décrire. La
base doit représenter le
La molécule SiH+ a un spin spin s = o, ce
qui donne une multiplicité 2s + 1 = 1. L'état fondamental
correspondant est un état de symétrie
1E+.
2.3 Diagramme de corrélation
Nous présentons dans cette partie, la construction du
diagramme de corrélation de l'ion moléculaire SiH+. Ce
diagramme de corrélation nous permet de déterminer les
différents états de la molécule. Ce diagramme est
construit à partir des configurations électroniques des atomes
séparés de Si+ et de H. Pour déterminer les
termes électroniques d'une molécule diatomique linéaire
(cas de SiH+), on a souvent recours aux éléments de
symétries, tels que : - la symétrie axiale, - la
réflexion. Pour plus détails lire la référence
suivante [26].
Le Diagramme de corrélation de la molécule
SiH+ obtenu à partir de l'état fondamental est
présenté dans le tableau 2.1.
TABLE 2.1: Diagramme des états moléculaires
du système SiH+ dans l'intervalle < 10
eV à partir de l'état fondamental
|
Configurations /Termes
Si H
|
Energie
(cm-1)
|
Energie (eV)
|
Etats moléculaires
|
|
3s3p2
|
2Pg
|
1s
|
2Sg
|
83903.105
|
10.4027
|
1,3E-, 1,3Ð
|
|
3s24p 2Pu
|
1s
|
2Sg
|
81221.33
|
10.0702
|
1,3E+, 1,3Ð
|
|
3s23d2Du
|
1s
|
2Sg
|
79346.76
|
9.8377
|
1,3E-, 1,3Ð, 1,3Ä
|
|
3s3p2
|
2Sg
|
1s
|
2Sg
|
76665.35
|
9.5053
|
1,3E+
|
|
3s24s
|
2Su
|
1s
|
2Sg
|
65500.47
|
8.1210
|
1,3E-
|
|
3s3p2
|
2Dg
|
1s
|
2Sg
|
55317.265
|
6.8585
|
1,3E+, 1,3Ð, 1,3Ä
|
|
3s3p2
|
4Pg
|
1s
|
2Sg
|
42954.94
|
5.3257
|
3,5E-, 3,5Ð
|
|
3s23p
|
2Pu
|
1s
|
2Sg
|
0
|
0
|
1,3E+, 1,3Ð
|
2.4 Choix de la base d'orbitales atomiques et de la
méthode de calcul
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 15
système considéré et être
relativement peu étendue pour que les temps de calcul restent
raisonnables. Quant au choix de la méthode, elle est d'autant meilleure
qu'elle prend en compte la corrélation électronique. Pour
réaliser le choix de la méthode de calcul et la base d'orbitale
atomique, nous avons fait une série de tests en utilisant plusieurs
méthodes (RHF, MCSCF, CCSD(T) et MRCI) et les bases aug-cc-pVXZ souvent
notées aVXZ (avec X= T, Q, 5, 6), pour calculer les constantes
spectroscopiques telles que : la distance internucléaire à
l'équi-libre (Re); la constante de rotation-vibration
(áe); la constante rotationnelle à l'équilibre
(Be); la fréquence harmonique (We); la constante
de distorsion centrifuge (De); la constante d'anharmonicité
au premier ordre (Wexe). Les résultats obtenus
sont comparés aux valeurs expérimentales. Les résultats
sont résumés dans le tableau 2.2.
TABLE 2.2: Constantes spectroscopiques de l'état
électronique fondamental
X1Ó+de la molécule
SiH+
|
Méthodes
|
Bases
|
Re(Å)
|
We(cm-1)
|
áe(cm-1)
|
De(eV)
|
Be(cm-1)
|
Wexe(cm-1)
|
|
aV6Z
|
1.506
|
2154.107
|
0.201
|
3.741
|
7.590
|
38.445
|
|
|
0.13 %
|
0.13%
|
0.24 %
|
2.58 %
|
0.88 %
|
10.96 %
|
|
aV5Z
|
1.506
|
2153.566
|
0.195
|
3.855
|
7.587
|
37.292
|
|
CCSD(T)
|
|
0.13 %
|
0.16 %
|
3.33 %
|
1.16 %
|
0.93 %
|
8.21 %
|
|
aVQZ
|
1.508
|
2148.592
|
0.210
|
3.526
|
7.569
|
40.578
|
|
|
0.26 %
|
0.39%
|
4.04 %
|
8.05 %
|
1.72 %
|
15.64 %
|
|
aV6Z
|
1.517
|
2108.160
|
0.200
|
3.623
|
7.479
|
38.027
|
|
|
0.85 %
|
2.321 %
|
0.75 %
|
5.16 %
|
2.38 %
|
9.98 %
|
|
aV5Z
|
1.507
|
2107.802
|
0.196
|
3.624
|
7.477
|
37.995
|
|
MCSCF
|
|
0.199 %
|
2.28%
|
2.80 %
|
9.81%
|
2.35%
|
10.99%
|
|
aVQZ
|
1.519
|
2103.733
|
0.210
|
3.409
|
7.459
|
40.245
|
|
|
0.98 %
|
2.53 %
|
4.04 %
|
11.76 %
|
2.66 %
|
14.94 %
|
|
aV6Z
|
1.506
|
2149.516
|
0.201
|
3.714
|
7.582
|
38.566
|
|
|
0.13 %
|
0.35 %
|
0.24 %
|
2.58 %
|
0.99 %
|
11.24 %
|
|
aV5Z
|
1.507
|
2148.515
|
0.196
|
3.827
|
7.579
|
37.392
|
|
MRCI
|
|
0.199 %
|
0.39 %
|
2.80 %
|
0.44 %
|
1.03 %
|
8.45 %
|
|
aVQZ
|
1.508
|
2145.544
|
0.202
|
3.681
|
7.560
|
38.766
|
|
|
0.26 %
|
0.53 %
|
0.24 %
|
3.50 %
|
1.29 %
|
11.70 %
|
|
Exp
|
|
1.499
|
2157
|
0.2096
|
3.33
|
7.6603
|
34.21
|
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 16
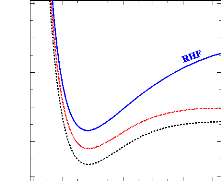
FIGURE 2.1: Comparaison des courbes de potentielle de RHF,
CASSCF et MRCI obtenues pour l'état électronique fondamental
X1Ó+ de la molécule
SiH+.
Il en ressort que la méthode MRCI et la base aug-cc-V6Z
sont appropriées pour le calcul des courbes de potentiel de la
molécule SiH+.
2.5 Résultats et discussions
Notons que tous les résultats présentés
dans cette discussion sont obtenus avec la méthode MRCI et la base aV6Z,
qui ont été choisi et validées dans le paragraphe
précédent. L'approche utilisée ici, consiste à
faire varier la distance interatomique entre les atomes Si+
et H et on calcule l'énergie potentielle à chaque
position. Nous avons ainsi choisi une grille de 45 distances
intranucléaires qui nous ont permis de tracer toutes les courbes.
La fig 2.1 représente une comparaison des courbes
d'énergie potentielle des méthodes RHF, CASSCF et MRCI obtenues
pour l'état électronique fondamental
X1Ó+ de la molécule
SiH+. On remarque que la courbe RHF est au-dessus de la
courbe CASSCF qui elle aussi est au-dessus de la courbe MRCI. Ceci s'explique
par le fait que, la corrélation est mieux prise en compte dans la
méthode MRCI comparé à RHF et CASSCF. Chacune de ces
courbes présentent un minimum, ce qui indique qu'il s'agit d'un
état stable.
1.00 2.00 3.00 4.00 5.00 6.00 7.00
Energie (hartree)
-288.80
-288.90
-289.00
-289.10
-289.20
-289.30
MCSCF MRCI
R (bohr)
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 17
L'analyse des autres courbes permet de dégager les
faits suivants :
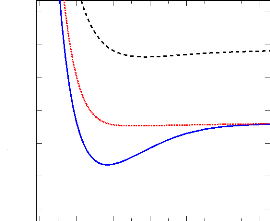
· La figure 2.2 représente les états
singulets calculés. Il est claire dans cette figure que l'état
fondamental X1Ó+ est totalement attractif. Les
états (A1Ð et B1Ð) présentent des
puits de potentiel, mais avec les profondeurs très faibles.
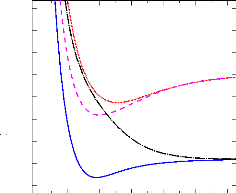
· Dans la figure 2.3, a l'exception de l'état
13Ó+ qui est un état globalement
répulsif, tous les autres états calculés sont attractifs,
puisqu'ils présentent des puits de potentiel, mais avec les profondeurs
variées.
· L'état fondamental X1Ó+
(figure 2.5) présente un puits de potentiel d'une profondeur de
-289.266 hartree localisé à la distance intranucléaire R =
2.86 bohr. Tous les autres puits sont situés au-dessus de celui de
l'état fondamental.
· En comparant nos courbes d'énergie à
celles de la référence [8], on constate que celles-ci ont la
même allure. Cette régularité des courbes prouve la bonne
précision avec laquelle elles ont été
déterminées.
1.00 2.00 3.00 4.00 5.00 6.00 7.00
Energie (hartree)
-288.80
-288.90
-289.00
-289.10
-289.20
-289.30
-289.40
X1Ó+
A1Ð
B1Ð
R (bohr)
FIGURE 2.2: Courbe de potentiel MRCI des états
singulets de la molécule SiH+
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE
18
Energie (hartree)
-288.80
-288.85
-288.90
-288.95
-289.00
-289.05
-289.10
-289.15
-289.20
c3Ó-
a3Ð
d3Ð
b3Ó+
1.00 2.00 3.00 4.00 5.00 6.00 7.00
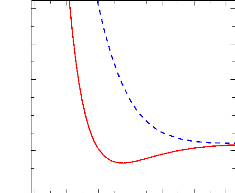
FIGURE 2.4: Courbes de potentiel MRCI des états
quintets de la molécule SiH+
R (bohr)
FIGURE 2.3: Courbes de potentiel MRCI des états
triplets de la molécule SiH+
1.00 2.00 3.00 4.00 5.00 6.00 7.00
Energie (hartree)
-288.80
-288.84
-288.88
-288.92
-288.96
-289.00
5Ó-
5Ð
R (bohr)
·
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 19
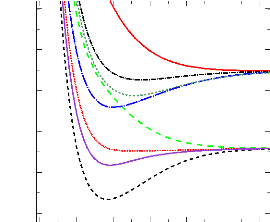
La figure de synthèse (figure 2.5) qui présente
la superposition de toutes les courbes MRCI, montre que les courbes obtenues
sont en accord avec les données du diagramme des états
moléculaires (cf. 3.1). En effet, les états 1,3Ó+
et 1,3H corrèlent à l'asymptote
2Pu + 2Sg ;
tandis que les états 3,5Ó- , 3,5H
corrèlent à l'asymptote 4Pg +
2Sg.
1.00 2.00 3.00 4.00 5.00 6.00 7.00
Energie (hartree)
-288.80
-288.90
-289.00
-289.10
-289.20
-289.30
c3 -
X1 +
a3H
A1H
e5 -
d3H
f5H
b3 +
Si+(2Pu) +
H(2Sg)
Si+(4Pg) +
H(2Sg)
R (bohr)
FIGURE 2.5: Courbe de potentiel MRCI des états les
plus bas de la molécule SiH+.
2.6 Conclusion
Dans ce chapitre nous avons présenté les
résultats de calculs des courbes d'énergie potentielle. Les
énergies de dissociation asymptotique sont obtenues. Il apparaît
bien que nos SEPs obtenues sont en accord avec l'allure générale
des courbes expérimentales et celles données par les valeurs
théoriques existantes. Nous utilisons ces résultats au chapitre
suivant pour déterminer les constantes spectroscopiques.
20
| 


