CHAPITRE II : LES RISQUES DE POLLUTION
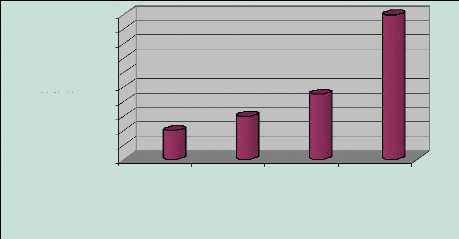
La quasi totalité de la population de Mboro craint la
pollution sous toutes ses formes, 20% déclarent craindre les rejets
atmosphériques, et 30% redoutent plus une possible explosion des camions
de phosphogypse qui traversent la ville de Mboro à toute heure et 45%
sont sceptiques quant à la potabilité des eaux de puits. (Tableau
4 et Figure 8)
Tableau 4 :Craintes des habitants par
rapport aux risques de pollution
Gaz atmosphériques
|
20%
|
Camion de phosphogypse
|
30%
|
Nappe phréatique
|
45%
|
Pollution sous toutes ses formes
|
100%
|
|
Source : Enquêtes JPY Fall Août 2000.
Habitants
100%
40%
20%
90%
80%
70%
60%
50%
30%
10%
0%
Gaz
atmosphériques
Camion de
phosphogypse
Formes
Nappe
phréatique
Pollution sous
toutes ses
formes
Figure 8: Inquiétudes des habitants
par rapport aux risques de pollution. A/ Risques de pollution de
la nappe phréatique
On s'intéresse essentiellement à la nappe
phréatique, néanmoins l'eau de pluie peut présenter un
faciès acide à cause de la précipitation de l 'eau
phosphorée produite par la condensation des gaz rejetés par les
ICS mais cela est à étudier (il n'y a pas de station de mesure de
l'acidité de l'eau de pluie à Mboro).
La menace de dégradation de la qualité de la nappe
phréatique va provenir de la surface du sol, et cela est bien compris
par une bonne partie de la population (45%).
En effet les dépôts insalubres (ordures et
excréments), les produits utilisés pour améliorer les
rendements agricoles, surtout maraîchers, les rejets des industries, les
puits à ciel ouvert sont autant de facteurs susceptibles de contaminer
la nappe.
La nappe phréatique n'est pas très profonde et
le matériel sableux de surface est très perméable ;
à cela vient s'ajouter l'utilisation concurrentielle de la ressource par
les ménages, les maraîchers et les industries qui a fortement
contribué à l'abaissement du niveau piézomètrique.
La conséquence est qu'un biseau salé est en lente progression de
la plage vers l'intérieur (Tchani, 1996).
B/ Les effets nuisants des éléments
chimiques
A l 'état naturel l 'eau est un mélange
complexe composé de substances en suspension et de matières
dissoutes. Certains des sels dissous contenus dans ces eaux, sans
présenter de dangers pour la santé, peuvent néanmoins
donner lieu à des inconvénients lorsqu'ils se présentent
en excès. C'est le cas des Chlorures, des potassium et des calcium
présentés dans le tableau ci-dessous qui donne des indications
sur la nature des effets possibles. On voit qu'outre les effets
organoleptiques, ces substances occasionnent des dégâts dans les
canalisations comme les phénomènes de corrosion qui influencent
fortement la couleur de l'eau (Tableau 5).
Tableau 5: Les inconvénients
liés à la présence excessive des substances chimiques.
(source : adaptée OMS, 1962)
Substances
|
Effets possibles s'il y a excès
|
Valeurs indicatives à ne
pas
dépasser
|
Chlorures (Cl-)
|
-organoleptiques ;
-corrosion dans les
canalisations
|
200 mg/l
|
Nitrates (NO3 -)
|
-dangers de
méthémoglobinémie infantile
;
-cancérigène
|
50 mg/l
|
Sulfates (SO42-)
|
-irritations gastro-intestinales ;
-laxatifs
|
250 mg/l
|
Sodium (Na+)
|
-vomissements, convulsions,
oedèmes
cérébraux et
pulmonaires ;
-hypertension
artérielle
|
150 mg/l
|
Potassium (K+)
|
-corrosion dans les
canalisations
|
12 mg/l
|
Magnésium(Mg2+)
|
-dureté ;
-goût désagréable
|
50 mg/l
|
Calcium (Ca2+)
|
-dureté ;
-entartrage du système
de
canalisation.
|
270 mg/l
|
|
Ainsi, une eau fortement chlorurée et sodique engendre
des effets organoleptiques qui la rendent désagréable et diminue
les rendements agricoles(OMS, 1994). De même l 'ingestion de l 'eau
contenant des concentrations élevées de sulfates peut, en plus
des troubles gastro-intestinales, avoir un effet laxatif ; lequel effet est
renforcé par la présence de magnésium.
Il convient aussi de prêter attention à la
présence de nitrates en excès dont l'incidence sur la
potabilité des eaux est qu'ils constituent un problème
toxicologique pour la santé humaine et pour celle des animaux
domestiques (in Tandia, 2000). En fait, des concentrations
excessives de nitrates dans l'eau sont
particulièrement dangereuses surtout pour les nourrissons. Par rapport
à cela, il est clairement établi par l 'OMS que l'eau très
chargée en nitrates était responsable dans certains pays de cas
de Méthémoglobinémie infantile ayant entraîné
la mort. Cette pathologie est causée par des taux supérieurs
à 100 mg/l dans l 'eau servant à reconstituer les aliments pour
nourrisson. Les nitrates réduits en nitrites dans les voies intestinales
provoquent cette maladie.
Ce problème ne se présente pas pour les
adultes. Par contre la réduction en nitrites se fait dans la bouche ou
ailleurs dans l'organisme faisant apparaître des nitrosamines dont
certains sont cancérigènes. Certaines formes de cancer sont
associées à de fortes doses de nitrates ; celui de l 'estomac
notamment.
CHAPITRE III : ETUDE DE LA QUALITE DE L'EAU DE LA NAPPE
A/ Résultats des analyses
1 .les paramètres physico-chimiques
Il s'agit de la conductivité électrique (C.
E.),du pH, et de la température (T°C) qu'il faut
nécessairement mesurer sur place pour obtenir des résultats
exacts et fiables à cause de leur variation possible au cours du
transport et de la conservation. (Tableau 6).
Tableau 6: Résultats des mesures
effectuées sur le terrain (le 1 2/0 6/2000).
N° des
Puits
|
Profondeur
en mètres/ à
la
margelle
|
Margelle
en cm
|
Distances
approximatives
à la mer en
Km
|
conductivité
en uS/cm
|
pH
|
Températures en
°C
|
1
|
15,6
|
60 cm
|
6,5
|
153
|
3,8
|
20,1
|
2
|
8,64
|
30 cm
|
6,5
|
147,8
|
4,5
|
20,2
|
3
|
1,3
|
13 cm
|
5,25
|
236
|
6,7
|
20,5
|
4
|
14,42
|
68 cm
|
5,25
|
467
|
4,2
|
20,6
|
5
|
20
|
69 cm
|
5,25
|
174
|
6,9
|
20,3
|
6
|
17,5
|
73 cm
|
5
|
285
|
4,5
|
21,0
|
7
|
21
|
110 cm
|
4,7
|
381
|
4,2
|
20,4
|
8
|
14,24
|
75 cm
|
4,7
|
260
|
6,3
|
20,4
|
9
|
19,5
|
95 cm
|
4,5
|
122,9
|
6
|
21,3
|
10
|
5,71
|
65 cm
|
4,5
|
295
|
5,7
|
20 ,7
|
|
1.1 Les températures (T°C)
La température est exprimée en degrés
Celsius. Elle influe considérablement sur la vie aquatique. Par exemple
une température trop élevée va favoriser le
développement des micro organismes qui peuvent accentuer le goût,
l'odeur et la couleur de l'eau. Par ailleurs, les équilibres ioniques en
jeu dépendent dans une certaine mesure de la température. Sa
variabilité est faible (1,2°C), sur le gradient Est-Ouest (du
continent vers la mer).
1.2 La conductivité électrique
(CE)
La CE est une mesure qui permet un contrôle simple et
rapide de la minéralisation des solutions. Elle dépend de la
force ionique de l'eau et augmente en fonction de la teneur en ions dissous, de
la nature des différentes substances dissoutes, à leurs
concentrations réelles et relatives et à la température
à laquelle elle est mesurée.
L'unité principale de CE est le siemens par
mètre (S /m). La T°C influe beaucoup sur la conductivité qui
varie d'environ 2% par °C. Il est préférable de la mesurer
à 20°C qui est prise comme référence pour les
tableaux ou abaques d'interprétations.
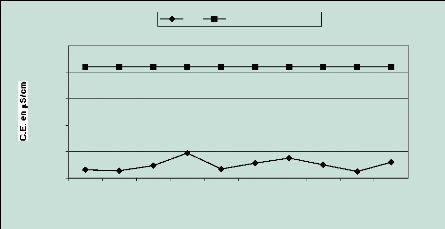
Les valeurs de CE mesurées dans les puits sont
comprises entre 122,9 et 467 uS / cm. Puisque la conductivité augmente
en fonction de la teneur en ions dissous, on peut considérer que la
nappe est faiblement minéralisée (Figure 9).
2500
2000
1500
1000
500
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
C.E. Norme de potabilité OM S
N° des puits
Figure 9 : Evolution de la
conductivité électrique en fonction de l'éloignement
à la mer
D'après l'OMS (1994), la CE de la plupart des eaux
douces ou traitées est comprise entre 50 et 500 uS / cm; celle des eaux
fortement chargées de minéraux atteint 1000 uS / cm et même
plus, et celle de certaines eaux résiduaires industrielles peut
être supérieure à 10 000 uS / cm. Nos échantillons
sont à classer dans la première catégorie et largement en
dessous de la valeur maximum admissible de 2100 uS / cm.
L 'évolution de la courbe vers la mer permet
d'apprécier la minéralisation qui est plus forte au niveau des
puits 4 et 7 ; ajoutons que la dispersion des valeurs, sans doute liée
aux influences marine et anthropique, ne permet pas d'établir de
relations entre la CE et l'éloignement à la mer.
1.3 Le pH
Le pH est une mesure de l'activité des ions
hydrogènes (H+) dans une solution aqueuse exprimée en
moles /litre. L'échelle des pH s'étend en pratique de 0
(très acide) à 14 (très alcaline). La valeur
médiane 7 correspond à une solution neutre.
Le pH des eaux naturelles peut être modifié par des
substances humiques, la bio activité des végétaux, des
sels hydrolysables etc.
Les mesures de pH tendent d'une façon
générale vers le pôle acide ; Six puits sur dix
(1,2,4,6,7,10) présentent une acidité de 3,8 à 5,7, les
autres donnent des valeurs legèrement en dessous de la neutralité
(6 à 6,9). (Figure 10).

Evolution des pH
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
N° des puits
Figure 10 : Evolution des pH
Elles ne sont pas conformes aux normes de l'OMS qui fixent
les valeurs de pH entre 6,5 et 9,2. Ces pH hors normes pourraient être
influencés par la dissociation de l 'acide carbonique issue de la
diffusion du CO2 atmosphérique (Tandia, 2000), ce que confirment les
résultats des analyses chimiques des HCO3 -.
La distribution des pH donne donc le schéma suivant :
[une acidité de 3,8 à 4,7 à
l'intérieur et des valeurs légèrement au dessous de la
neutralité, entre 5,7 et 6,9, vers l'extrémité ouest du
transect ].
2.La composition chimique
Il s'agit des éléments chimiques majeurs que
sont les Chlorures, les Nitrates, les
Sulfates, le Sodium, le Potassium, le
Magnésium, les bicarbonates et le Calcium (Tableau 7).
Tableau 7: Résultats des analyses
chimiques (échantillons du 1 2/0 6/2000).
Echantil
lons
|
HCO3-
en mg/l
|
CL- en
mg/l
|
NO3- en
mg/l
|
SO42- en
mg/l
|
Na+ en
mg/l
|
K+ en
mg/l
|
Mg2+ en
mg/l
|
Ca2+ en
mg/l
|
P1
|
0
|
74,46
|
125,26
|
32,18
|
56,41
|
14,48
|
8,65
|
24,09
|
P2
|
0
|
102,98
|
120,06
|
12,48
|
56,53
|
10,42
|
9,43
|
24,48
|
P3
|
91,50
|
134,38
|
145,96
|
150,07
|
104,41
|
12,61
|
20,90
|
83,20
|
P4
|
0
|
228,12
|
472,00
|
108,49
|
192,29
|
20,83
|
34,21
|
104,14
|
P5
|
73,20
|
101,04
|
37,64
|
110,71
|
80,08
|
8,28
|
13,90
|
44,80
|
P6
|
0
|
135,76
|
226,00
|
110,67
|
112,23
|
10,80
|
4,86
|
104,29
|
P7
|
0
|
216,60
|
256,84
|
96,65
|
153,13
|
20,44
|
26,92
|
78,72
|
P8
|
54,9
|
112,04
|
171,08
|
144,24
|
104,28
|
20,18
|
28,09
|
56,16
|
P9
|
21,35
|
75,86
|
46,30
|
70,91
|
56,41
|
15,47
|
5,54
|
28,80
|
P10
|
12,20
|
133,10
|
240,00
|
94,51
|
121,67
|
25,61
|
18,66
|
60,08
|
|
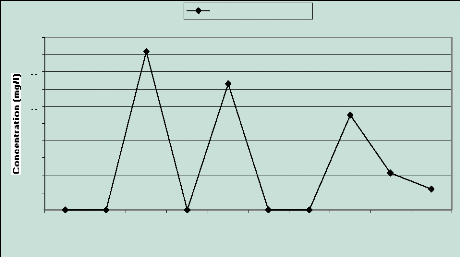
2.1 Les bicarbonates (HCO3 -)
Les valeurs évoluent entre 0 mg/l et 91,50 mg/l. Les
valeurs nulles sont observées dans les puits où les valeurs de pH
sont les plus faibles en rapport avec les équilibres calcocarboniques.
En effet à des valeurs de pH très faibles, les espèces
carbonatées sont essentiellement sous forme d'acide carbonique (Tandia,
2000). (Figure 11)
100
40
90
80
70
60
50
30
20
10
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
N° des puits
Evolution des bicarbonates
Figure 7 : Evolution des
bicarbonates
2.2 Les ions Chlorures (Cl -)
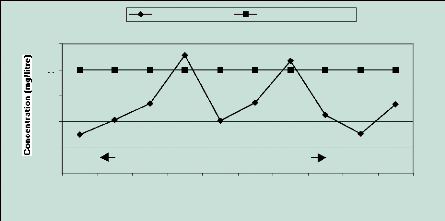
Pour la plupart des échantillons, les niveaux de
Cl- sont en dessous de la teneur limite maximum fixée
à 200mg/l par l 'OMS. Deux puits présentent cependant des valeurs
qui dépassent de peu cette norme ; il s'agit des puits 4 et 7 avec
respectivement 228,12 et 216,60 mg /l (Figure 12).
D'après l 'OMS (1994), dans l 'eau non polluée,
le niveau est souvent inférieur à 10 mg/l et même à
1 mg/l. Les eaux de la nappe phréatique de Mboro ne contiennent pas
moins de 74,46 mg/l de Chlorures ; six (6) puits présentent plus de
100mg/l. Le gradient qui devrait normalement croître d'est en ouest si la
pollution est principalement marine montre une dispersion des valeurs qui
suppose que la pollution proviendrait de plusieurs sources. Ces teneurs en
Chlorures peuvent être attribuées à la lixiviation des
dépotoirs ou à l 'effet d'embruns marins (précipitations
humides ou sèches).
Les puits 4 et 7 sont particulièrement atteints et cela
proviendrait probablement de la surface du sol.
250
200
150
100
50
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
Vers le continent Vers la mer
Courbe des Chlorures Normes de potabilité OM S
N° des puits
Figure 12 : Evolution des ions
Chlorures
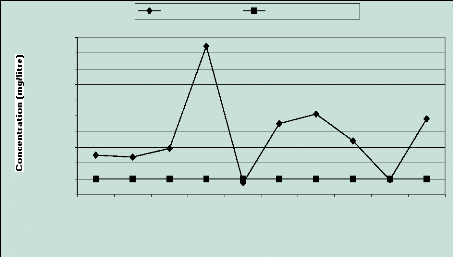
2.3 Les ions nitrates (NO3 -)
Mise à part les puits 5 et 9, tous les autres sont
touchés par des teneurs excessives en nitrates. Celles-ci sont comprises
entre 120 et 470 mg/l, dépassant largement la norme de potabilité
(50 mg/l). Des quantités inquiétantes ont été
observées dans les échantillons provenant des puits 4, 6, 7 et 10
avec un pic de 472 mg/l au niveau du premier ouvrage soit 9 fois la teneur
admissible (Figure 13).
450
400
500
350
300
250
200
150
100
50
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
N° des puits
Evolution des Nitrates Norme de potabilité OMS
Figure 13 : Evolution des nitrates
D'après le programme mondial de surveillance de la
qualité des eaux (GEMS/eau) de l'OMS, le nitrate est la forme la plus
fortement oxydée des composés de l'azote. Il est
communément présent dans les eaux naturelles parce qu'il est le
produit final de la décomposition aérobie de la matière
organique azotée.
Le contexte socio-économique de l 'environnement nous
fait d'ores et déjà penser que ces taux de nitrates proviendrait
sans aucun doute de la lixiviation et de la dégradation des
matières organiques à la surface.
L'activité maraîchère qui utilise des
engrais azotés est une source de pollution probable, mais la
contamination ponctuelle observée au niveau des puits de quartier (1 ,4
,6 ,7 ,10) proviendrait des déchets domestiques (ordures
ménagères, eaux de latrines et parcs d'embouche).
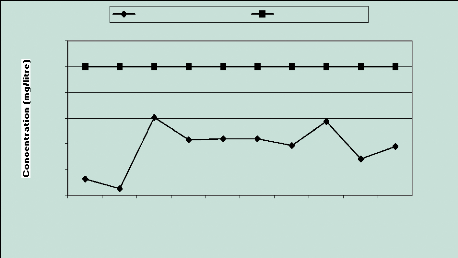
2.4 Les ions Sulfates (SO42-)
On observe l 'évolution suivante : teneurs faibles
à 6,5 Km de la mer (32,8 et 12,48 mg /l), relativement
élevées et stables entre 5,25 et 4,7 Km (entre 96,65 et 150,7
mg/l) et relativement faibles avec une tendance à la hausse à 4,5
Km (70,91 et 94,51 mg/l). L 'ion sulfate étant l'un des anions les moins
toxiques (OMS, 1994), les valeurs observées ne présentent aucun
inconvénient pour la santé d'autant plus qu'elles sont loin de la
teneur limite admissible (250 mg/l ) (Figure 14).
L'origine des sulfates peut être dûe à la
dissolution de gypse qui est un sulfate de calcium hydraté
(Ca2+, S042-, 2H20) ou à des apports indirects
marins liés aux eaux de pluie dont la minéralisation est
dominée par les ions S042- après les ions
Na+ (Travi et al., 1987 in Tandia, 2000).
250
200
300
150
100
50
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
Courbe d'évolution des Sulfates Norme de
potabilité OMS
N° des puits
Figure 14 : Evolution des
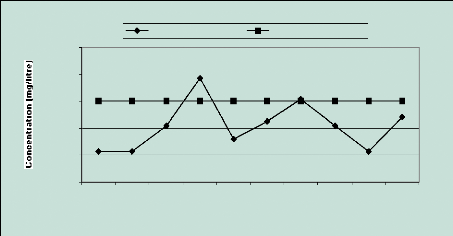
sulfates 2.5 Les ions Sodium (Na+)
L'évolution de ces ions s'apparente à celle des
Chlorures, d'ailleurs leur corrélation est très bonne avec un
coefficient égal à 0,95 ; la norme de potabilité
établie par l 'OMS est 150 mg/l pour l 'eau de boisson. On constate
cependant que cette valeur est dépassée dans les puits 4 et 7.
(Figure 15).
250
200
150
100
50
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
Evolution des ions Sodium Normes de potabilité OMS
N° des puits
Figure 15 : Evolution des ions
sodium
La contamination est sans nul doute marine. En fait les embruns
et les aérosols peuvent jouer un rôle considérable s'ils
sont précipités par les eaux de pluie qui lavent l
'atmosphère.
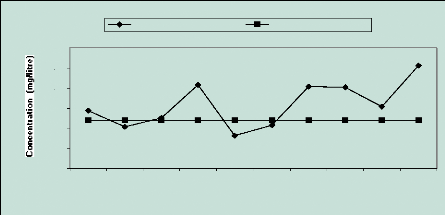
2.6 Le potassium (K+) (Figure 16)
30
25
20
15
10
5
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
Evolution des ions Potassium Normes de potabilité OM S
N° des puits
Figure 16 : Evolution des ions
potassium
C'est l'ion le moins abondant dans les eaux souterraines (OMS,
1994). Sa concentration maximum ne doit pas dépasser 12 mg/l. Et
pourtant seul trois (3) puits
obéissent à ce seuil, il s'agit des n° 2,
5 et 6. Il y a donc une contamination au potassium qui peut s'expliquer par un
faible apport de ces ions par les eaux domestiques qui peuvent contenir
jusqu'à 21% de résidus minéraux (Higgins et Burns, 1975 ;
Walter, 1961 in Tandia, 2000).
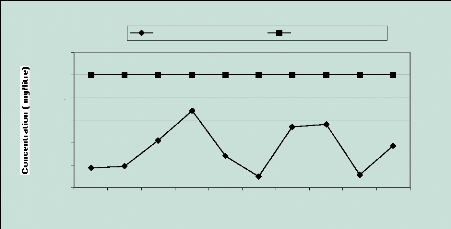
2.7 Le magnésium (Mg2+)
Les valeurs observées sont bien en dessous de la norme
de potabilité de 50 mg/l ; elles se situent entre 4,86 et 34,21 mg/l et
ne présentent de ce point de vue aucun inconvénient pour la
santé. (Figure 17).
Le magnésium est un élément relativement
abondant dans l 'écorce terrestre et rentre toujours dans la composition
des eaux naturelles en contact avec du granite, de la dolomie ou du calcaire
(OMS, 1994). Il peut aussi provenir des embruns marins qui se sont
infiltrés avec les eaux de pluie (Tandia,2000). Donc les concentrations
en Mg2+ proviendraient probablement du substrat marno-calcaire ou de
l'influence marine.
60
40
20
50
30
10
0
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
Evolutio n des ions M agnesium Norme de potabilité OM
S
N ° des puits
Figure 17 : Evolution des ions
magnésium 2.8 Le Calcium (Ca2+)
Les teneurs relevées doivent probablement provenir du
substrat marno-calcaire Paléocène ou des eaux de
l'aquifère des calcaires Lutétiens. Elles sont dans l 'ensemble
faibles, ne dépassant pas 104 mg/l , très en dessous de la norme
de 270 mg /l (Figure 18 ).
Evo lutio n des ions Calcium Normes de potabilité OM S

300 250 200 150 100 50
0
|
|
|
P1 P2 P3 P4 P5 P6 P7 P8 P9 P10
|
|
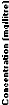
N ° des puits
Figure 18 : Evolution des ions
calcium
Cette campagne de mesures révèle que seul deux
puits renferment des teneurs en éléments chimiques majeurs
acceptables (5 et 9). Tous les autres sont contaminés par les nitrates
et parmi ceux-ci deux accusent des taux de Chlorures et de Sodium qui
dépassent la norme. La potabilité chimique des eaux est ainsi
mise en cause par les nitrates dont la toxicité est reconnue.
| 


