C. LE GROUPE DES BETA-GLOBULINES
Cette groupe constitue 8.5 à 15 % (6 à 10 g/l) des
protéines sériques. 1) Transferrine (Tf) ou
Sidérophiline:
La transferrine est une protéine soluble qui assure le
transport du fer dans le sang. Les cellules de l'organisme dont la teneur en
fer est trop basse synthétisent et expriment à leur surface des
récepteurs à la transferrine. Elles assurent ainsi leur
réapprovisionnement en fer, en internalisant la
transferrine par endocytose.
a) Propriétés: >
Physico-chimiques:
La transferrine sérique ou sidérophiline est une
glycoprotéine, sa masse moléculaire 76 kDa, contenant 6% de
glucides. Leur PHi varie entre 5.5 et 5.9.
> Métaboliques:
Synthétisée dans le foie et sa concentration
sérique est influencée par le contenu du fer dans l'organisme, et
présente une variabilité génétique : 03
phénotypes principaux B.C.D.Sa demi-vie est de 7 jours.
> Biologiques:
Transport du Fe3+, régule l'absorption du fer
suivant sa saturation, mais possède des propriétés
inhibitrices de la multiplication virale.
b) Valeur sémiologique: > Méthode de
dosage:
On sépare la transferrine aisément par
électrophorèse en gel d'amidon. > Valeurs normales et
variations physiologiques: Valeurs normales généralement
admises : 02 à 03,8 g/litre.
Variations physiologiques : chez la femme enceinte, en fin de
grossesse, la concentration s'élève autour de 04,4g/l, en raison
de l'anémie ferriprive, habituelle à cette période.
> Variations pathologiques:
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
44
|
|
-Diminution : dans la néphrose,
syndromes inflammatoires, infectieux et néoplasiques, fuites
protéiques, états de dénutrition ou malnutrition,
insuffisances hépatocellulaires sévères, surcharges en
fer.
-Augmentation : dans la sidéropenie et en
fin de la grossesse, anémies ferriprives, hémorragies aigues ou
chroniques et occultes.
2) C-reactive protein (CRP) ou protéine C
réactive:
La c reactive protein a été ainsi nommée
pour ses capacités à précipiter le polysaccharide C de
Streptococcus pneu moniae.
C'est une protéine de la phase aigue et un marqueur
systémique sensible de l'inflammation et des lésions
tissulaires.
a) Propriétés: >
Physico-chimiques:
La CRP est une holoprotéine de 120 KDa, elle est
constituée d'un pentamère cyclique de 5 protomères de206
aminoacides chacun.
> Métaboliques:
La CRP plasmatique est essentiellement produite par les
hépatocytes.sa transcription
est sous le contrôle de cytokines comme IL-6, TNF-alpha, et IL-1â.
Sa demi-vie est de 6 à 8 heurs.
La sécrétion de CRP débute 4a6 heures
après le stimulus, double ensuit toutes les 8eures et atteint son pic
vers 36-50 heures .la demi-vie plasmatique de la CRP est de 19 heures, mais la
demi-vie clinique des concentrations de CRP après un seul stimulus comme
la chirurgie ou un traumatisme demande plusieurs jours avant de revenir a sa
valeur de base.
> Biologiques:
La CRP est reconnue pour jouer un rôle dans
l'élimination des bactéries .les souris transgéniques pour
la CRP montrent une résistance accrue contre l'infection létale a
Salmonella typhimurium (bactérie Gram-négative).
Elle a par ailleurs un rôle d'activation du
complément, de facilitation de la phagocytose des bactéries et de
modulation de la multiplication des lymphocytes T.
b) Valeur sémiologique: > Méthode de
dosage:
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
45
|
|
Pas visible sur électrophorèse, dosage
spécifique.
> Valeurs normales et variations
physiologiques:
chez l'adulte sain ,le taux de CRP est inferieur a 3 mg/l et
croit en réponse a un stimulus inflammatoire .les taux plasmatiques de
CRP sont déterminés par le taux de synthèse, un marqueur
de l'intensité du processus pathologique stimulant la production de CRP.
L'hémodialyse n'affecte pas le taux de CRP.
> Variations pathologiques:
CRP Ultra sensible au risque cardiovasculaire hors inflammation
(tableau 2).
<1mg/l Pas de risque.
|
1 à 5 mg/l Risque
modéré.
|
>5 mg/l Risque élevé.
Tableau 2: niveau de risque lié à la
variation du CRP.
Toujours dans le sens d'une augmentation: Etats inflammatoires
aigus, quelle que soit leur étiologie, états infectieux,
lésions traumatiques, Néoplasies.
Grand intérêt en pratique médicale
courante.
3) Fibrinogène (FIB):
Le Fibrinogène est une glycoprotéine circulante
soluble. Lorsque sa molécule est scindée par la thrombine au
cours d'une réaction enzymatique, le fibrinogène est
transformé en une protéine plasmatique insoluble : la fibrine. La
conversion du fibrinogène en fibrine est la dernière et plus
importante étape dans la formation du caillot hémostatique
primaire dont le rôle est d'empêcher les pertes liquidiennes
consécutives à un traumatisme.
a) Propriétés:
> Physico-chimiques:
La structure moléculaire du fibrinogène se compose
de trois chaînes polypeptidiques reliées entre elles par des ponts
disulfures pour former un dimère, sa masse moléculaire 330
KDa.
Lors de la conversion du fibrinogène en fibrine, deux
paires de peptides (fibrinopeptide A et fibrinopeptide B) se libèrent
des segments N-terminaux des chaînes á et ß pour former un
monomère, la fibrine, qui est la protéine structurale
prédominante dans la formation du caillot.1-4 Comme presque toutes les
autres protéines responsables de la coagulation.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
46
|
|
> Métaboliques:
Le fibrinogène est synthétisé par le foie,
avec demi-vie de 3 à 5 jours. Les anomalies relatives à la
production du fibrinogène peuvent être congénitales ou
acquises et se traduisent généralement soit par une diminution de
la production de fibrinogène
(afibrinogénémie/hyperfibrinogènémie) ou par une
production de molécules de fibrinogène anormales
(dysfibrinogénémie).
> Biologiques:
Le fibrinogène est le précurseur protéique
plasmatique de la fibrine, qui polymérisé, devient le principal
composant du caillot de fibrine. Sous l'action de la thrombine, le
fibrinogène est clivé et forme un monomère de fibrine. Les
monomères de fibrine sont polymérisés en un réseau
de fibrine insoluble.
c) Valeur sémiologique: > Méthode de
dosage:
On peut doser le niveau de fibrinogène dans le sang par un
prélèvement sanguin. > Valeurs normales et variations
physiologiques:
Le taux normal du fibrinogène dans le sang est de 2
à 4 g/l.
> Variations pathologiques:
-L'afibrinogénémie: (absence de
fibrinogène):
Dans cette forme de déficit en fibrinogène on note
une absence complète du fibrinogène. Le taux du
fibrinogène est < 0,2 g/l de plasma. Environ cinq personnes sur dix
millions en sont atteintes. Des trois types de déficit, c'est celui qui
provoque les saignements les plus graves.
L'afibrinogénémie se traduit par des tendances
hémorragiques modérées à graves.
-Diminution : L'hypofibrinogénémie: (taux
inférieur à la normale):
En présence de cette anomalie, le fibrinogène est
présent, mais à un taux inférieur à la normale : il
se situe entre 0,2 g/l et 0,8 g/l. Cette anomalie est moins fréquente
que l'afibrinogénémie. Les problèmes de saignements
peuvent être légers, modérés ou graves.
Les taux de fibrinogène sont nettement diminués
dans l'afibrinogénémie héréditaire, la coagulation
intravasculaire, la fibrinolyse primaire et secondaire ainsi que dans les
maladies hépatiques.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
47
|
|
Un taux de fibrinogène bas est retrouvé dans
l'afibrinogénémie congénitale, dans
l'hypofibrinogénémie et dans certains cas de
dysfibrinogénémie, mais aussi dans différentes pathologies
comme la coagulation intravasculaire disséminée (CIVD), la
fibrinolyse, la pancréatite et les insuffisances hépatiques
sévères. Le fibrinogène est une protéine
réactive de la phase aiguë dont la concentration augmente en
réponse à différents stimuli physiologiques.
-Augmentation : (6 à 8 g/l) dans les
processus inflammatoires:
Il peut être augmenté au cours d'une inflammation,
d'une infection, au cours de la grossesse et après un traumatisme. Le
fibrinogène est augmenté chez les fumeurs.
Un taux plasmatique élevé de fibrinogène a
été associé à des états
pré-thrombotiques. La concentration en fibrinogène est
corrélée positivement au développement de
l'athérosclérose, de l'infarctus du myocarde et des accidents
vasculaires cérébraux.
- La dysfibrinogénémie: (mauvais
fonctionnement)
En présence de dysfibrinogénémie, le taux de
fibrinogène est normal, c'est-à-dire entre 2 et 4 g/l, mais le
fibrinogène ne fonctionne pas adéquatement. Environ une personne
sur un million en est affectée. En fait, on a répertorié
plus de 100 types différents de dysfibrinogénémie.Les gens
atteints souffrent rarement de problèmes hémorragiques. Ils
peuvent même présenter la situation contraire : une thrombose (le
sang coagule dans la circulation sanguine).
AF I B RI NOG É N ÉMIE HYPO FI B RI N OG É N
ÉMIE DYSF I B RI NOG É N ÉMIE
|
TRANSMISSION Autosomal récessif Autosomal dominant
Autosomal dominant et
(les deux parents et récessif un seul récessif un
seul parent
sont porteurs). parent est porteur les est porteur les deux
deux parents le sont parents le sont
|
INCIDENCE 5 sur 10 millions moins que 1 sur 1 million
l'afibrinogénémie
|
TAUX DEFIBRINOGENE < 0,2 g/l plasma entre 0,2 -0,8 g/l entre 2
et 4 g/l plasma
plasma
|
|
SYMPTOMS - saignement cordon
ombilical
- saignement cutanéo- muqueux -hémorragie gastro-
intestinale
- saignement intracrânien - saignement articulaire (chez
20
% des sujets)
|
- saignement cordon ombilical
- saignement cutanéo muqueux
- hémorragie gastro- intestinale
- saignement intracrânien (peu fréquent)
- saignement articulaire (chez 20 % des sujets)
|
-sans symptôme
-hémorragie
- thrombose
|
|
TRAITEMENT FIBRINOGÈNE FIBRINOGÈNE
FIBRINOGÈNE OU
ANTICOAGULANT
|
Tableau 3: tableau comparatif de déficience en
fibrinogène congénital.
48
Chapitre 2 : Etude descriptive des principales
protéines sériques D. LE GROUPE DES
GAMMA-GLOBULINES:
La réponse humorale se fait à travers un groupe de
protéines ayant des propriétés semblables, mais des
fonctions différentes = les Immunoglobulines.
Les gammaglobulines présentent 9.2 à 18 % (6.4
à 13 g/l).
1) Définition:
Ce sont des protéines animales glycosylée
(glycoprotéines). Elles migrent à l'électrophorèse
dans la zone ã.
Elles sont présentes dans le plasma, les autres
liquides biologiques et les sécrétions. Ce sont les agents de
l'immunité humorale, ce sont des protéines douées
d'activité anticorps.
· Ac : globuline apparaissant dans le
sérum d'un sujet, soumis à un Ag qu'il ne possède pas et
capable de se lier spécifiquement à cet Ag.
2) Propriétés:
a. Physico-chimiques:
> Les Ig sont des molécules bipolaires : 2 pôles
fonctionnels :
· Régions variables : impliquées dans les
fonctions de reconnaissance de l'Ag.
· Région constante : responsable des fonctions
effectrices.
>A côté de cette dualité fonctionnelle,
on a :
· Dualité structurelle : constitution par 2 types de
chaînes : légères et lourdes.
· Dualité génétique : 2 types de
gènes codant chacun pour un type de chaînes.
> On en a 5 classes : IgG, IgM, IgA, IgD, IgE,
synthétisés par le lymphocyte B et surtout plasmocyte et peuvent
être : intracellulaires - membranaires (=récepteurs d'Ag du
lymphocyte) - sécrétées.
> Leur migration dans la zone ã de l'EPPS est à
l'origine de l'appellation = gammaglobulines.
b. Métaboliques:
Elles sont synthétisées par des cellules
spécifiques qui sont dans la moelle osseuse : les plasmocytes,
dérivant des lymphocytes B activés. Cette synthèse est
secondaire au contact de l'organisme avec une substance
étrangère: antigène ou immunogène. Ces anticorps
sont produits et sécrétés dans la circulation
générale.
c. Biologiques:
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
49
|
|
La réponse immunitaire est spécifique; une
immunoglobuline (Ig) est spécifique de l'antigène (Ag) qui a
déclenché sa synthèse. La spécificité est le
plus souvent absolue.
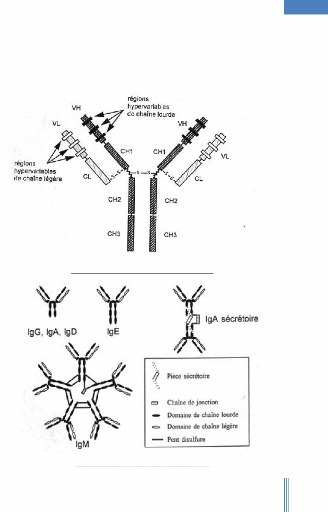
3) Structure générale des immunoglobulines:
On remarque l'extraordinaire
hétérogénéité des Ig. a.
chaînes polypeptidiques:
L'unité de base d'un Ac (monogène d'Ig) comprend 4
chaînes polypeptidiques: - 2 chaînes lourdes identiques
(chaînes « H » pour Heavy).
- 2 chaînes légères identiques (chaînes
« L » pour Light).
La structure générale est du type H2L2.
Cet édifice moléculaire a une masse
moléculaire d'environ 150 KDa. Au microscope électronique, ces Ig
se présentent sous la forme d'un Y avec un axe de symétrie entre
les 2 chaînes lourdes (donc la molécule est symétrique).
> Les chaînes lourdes:
Leur nature varie selon la classe et la sous classe d'Ig. Chaque
chaîne lourde est constituée de 450 acides aminés, ce qui
correspond à une masse moléculaire de 50KDa.
Les deux chaînes lourdes sont reliées
entre-elles:
- par des liaisons covalentes: un ou plusieurs ponts disulfures.
Cette liaison est située dans la zone charnière.
- par de nombreuses interactions non covalentes qui stabilisent
aussi l'ensemble (liaisons ioniques, hydrogène...).
> Les chaînes légères:
Comme pour les deux chaînes lourdes, les deux chaînes
légères sont identiques entrent-elles. Elles sont du type ê
ou ë, commun à toutes les classes d'Ig: Ig G, Ig M, Ig A, Ig D, Ig
E. Leur masse moléculaire est d'environ 25 KDa chacune.
Chaque chaîne légère est reliée
à une chaîne lourde:
- par un pont disulfure inter caténaire (entre
l'extrémité carboxylique de la chaîne légère
et la région charnière de la chaîne lourde).
- par de nombreuses liaisons non covalentes.
Chapitre 2 : Etude descriptive des principales
protéines sériques
>>On distingue deux caractéristiques
principales à cette structure de base: - la grande
stabilité de la molécule H2L2.
- la grande flexibilité des chaînes lourdes (au
niveau de la zone charnière). En effet, l'Y a un angle d'ouverture
très variable, de 0 à 180°. Cette flexibilité permet
l'adaptation de l'Ac à l'Ag qui a suscité sa production.
Figure 1: Structure biochimique d'une
immunoglobuline.
Figure2 : Les différents types des
immunoglobulines.
Belaouar Hamza/Lamri Adlène
50
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
51
|
|
b. Autres composants:
· Les chaînes oligosaccharidiques
Les Ig sont des glycoprotéines.
Les chaînes lourdes contiennent sur leur partie carboxy
terminale des chaînes oligosaccharidiques (glycanniques) en nombre
variable (1 à 7) selon la classe.
· Les chaines de Jonction ou chaînes J.
On les trouve dans la classe des Ig A et M. Elles permettent
la polymérisation de l'unité de base. On a donc le motif (H2L2)
n. Le degré de polymérisation est: n=2 pour les Ig A et n=5 pour
les Ig M.
· La pièce sécrétoire S
Elle se rencontre dans les Ig A sécrétoires qui
sont dimériques.
c. Les domaines d'Ig:
Au sein de chaque chaîne lourde et chaque chaîne
légère, il existe des ponts disulfures intra caténaires
qui obligent la séquence d'acide aminé à se replier sur
elle-même en des boucles peptidiques de 60 à 70 résidus
d'acide aminé. Chaque boucle représente la partie centrale d'une
région globulaire comprenant 110 acides aminés; cette
région est appelée domaine.
Le nombre de domaines varie selon la classe et le type d'Ig: >
sur chaque chaîne lourde: 4 à 5 domaines.
>sur chaque chaîne légère: 2 domaines.
Au cours de l'évolution, on a constaté la
duplication d'un gène ancestral commun. Quand on compare la composition
en acides aminés de deux domaines différents, on remarque
l'existence d'un haut degré d'homologie des séquences.
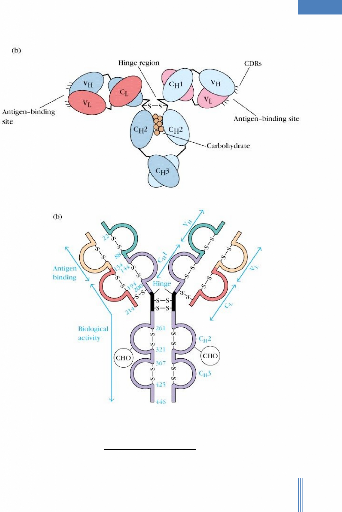
Figure3 : Organisation en domaines.
Belaouar Hamza/Lamri Adlène
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
53
|
|
d. Variabilité des chaînes:
Quand on compare les chaînes lourdes entre-elles ou les
chaînes légères entre-elles, les séquences en acide
aminé sont partiellement différentes.
Les différences sont localisées dans la
région N terminale de ces chaînes; ces régions sont en
conséquence dénommées régions variables ou V.
Les régions C terminales ont une structure relativement
conservée : elles sont de ce fait appelées régions
constantes ou C.
- Cas des chaînes
légères:
On constate deux domaines de longueur équivalente:
- 1 domaine variable N terminal appelé VL (pour Variable
Light) -1 domaine constant C terminal appelé CL (pour Constant
Light).
- Cas des chaînes lourdes:
On constate 4 à 5 domaines de longueur
équivalente:
- 1 domaine variable N terminal appelé VH (pour Variable
Heavy)
- 3 à 4 domaines constants C terminaux appelés CH
(pour Constant Heavy).
Il existe des appariements des domaines entre les chaînes
lourdes et légères ; dans tous les cas, un domaine V s'associe
à un V et un domaine C avec un C.
Ainsi, bien qu'ayant une structure de base commune, les Ig ont un
certain degré de variabilité.
e. Dualité structurale et fonctionnelle des
Ig:
Les Ig peuvent faire l'objet d'un clivage sous l'action d'enzymes
protéolytiques (comme la papaïne d'origine végétale
et la pepsine d'origine animale).
Les principaux résultats sont obtenus avec la
papaïne; on assiste à une scission de l'Ig en 3 fragments de 50 KDa
environ:
- 2 fragments Fab identiques. -1 fragment Fc.
*Les fragments Fab (ab pour "Ag-Binding")
correspondent à la moitié N terminale d'une chaîne lourde
reliée par un pont disulfure à une chaîne
légère.
Ils ont la propriété de se lier à l'Ag mais
sont univalents c'est à dire ils ne possèdent qu'un seul site de
fixation antigénique.
Le site de liaison à l'Ag Fab est constitué:
- du domaine variable d'une chaîne légère
(VL)
- du domaine variable d'une chaîne lourde (VH).
· Le fragment Fc : cristallise
facilement et correspond à deux moitiés C terminales de
chaînes lourdes reliées entre-elles par au moins un pont
disulfure.
Le fragment Fc (constitué des domaines constants des
chaînes lourdes, principalement CH2 et CH3) ne s'associe pas a l'Ag mais
est le support des autres propriétés biologiques des Ig (comme
leur capacité à s'associer au complément...).
f. Structure tridimensionnelle des Ig:
A l'aide de méthodes résolutives physiques
(diffraction, RMN, Microscope Electronique), on a confirmé
l'organisation spatiale des Ig en domaines.
-Figure ci-dessous: exemple de la conformation
d'une Ig. Ce schéma indique l'organisation des chaînes entre elles
et notamment la forme en Y induite par les chaînes lourdes.
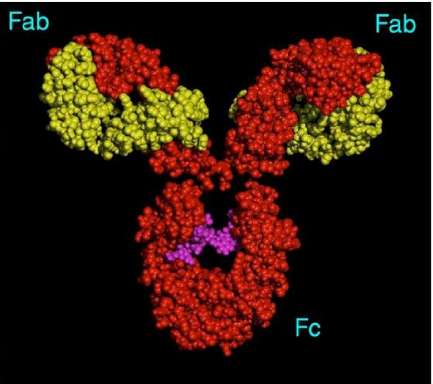
Figure 4: structure tridimensionnel d'une
immunoglobuline
4) Structure particulière des
immunoglobulines:
a. Les IgG : 75% des Ig sériques,
concentration = 12g!l.
- Elle a une structure de base en Y, constituée de 2
chaînes légères K ou ë et 2 chaînes lourdes
ã.
- 4 sous classes décrites : IgG1, IgG2, IgG3 et IgG4
(ã1 - ã2 + ã3 - ã4 = chaînes lourdes).
- Leur déploiement dans l'espace est variable d'une sous
classe à une autre.
- L'IgG est bivalent car elle possède 2 sites Ac (2
paratopes).
b. Les IgA : 10 à 15%. 3.5g!l.
- 2 formes :
* Monomérique : IgA sérique : prédominante
dans le sérum, structure semblable à l'IgG.
* Dimérique : IgA sécrétoire : très
dominante au niveau des sécrétions : salive, larmes,
sécrétions nasales, trachéobronchiques, intestinales,
colostrum...etc.
Formée de 2 monomères d'IgA, réunis par une
pièce J (de jonction) et une pièce S (sécrétoire)
et opposés par leur fragment Fc.
- Chaque molécule comporte : 2 chaînes
légères K ou ë et 2 chaînes lourdes á.
c. Les IgM : 1.5 g!l.
- Elle est pentamérique. Chaque unité a une
structure semblable à celle de l'IgG.
- Les 5 unités sont réunies au niveau de
l'extrémité COOH terminale, par les ponts disulfures d'une
pièce J.
- Chaque unité comporte : 2 chaînes
légères ë ou K et 2 chaînes lourdes ì (chaque
chaine lourde comporte un domaine variable VH mais 4 domaines constants CH.
- La structure pentamérique explique la grande
affinité de l'IgM pour les Ag et ses propriétés
agglutinantes.
- 2 sous classes : IgM1 et IgM2.
d. Les IgE :
- Chaque molécule comprend 2 chaînes lourdes
å et 2 chaînes légères K ou ë. - Les
chaînes lourdes sont formées de 5 domaines chacune (idem IgM).
- Concentrations faibles dans le sérum, localisation
essentiellement tissulaire.
e. Les IgD :
- 2 chaînes légères K ou ë et 2
chaînes lourdes ä.
- concentration sérique faible, joue un rôle en tant
que récepteur de membrane des lymphocytes B.
|
IgA
|
IgM
|
IgD
|
IgE
|
|
á
|
u
|
ä
|
å
|
|
Ê ou ë
|
Ê ou ë
|
Ê ou ë
|
Ê ou ë
|
|
IgA 1 à 2
|
|
|
|
|
H2L2 ou (H2L2)2JS
|
(H2L2)5J
|
H2L2
|
H2L2
|
|
160KDa ou
400KDa
|
950KDa
|
185KDa
|
190KDa
|
|
6 J
|
5 J
|
4 J
|
2 à 3 J
|
|
2 à 4
|
0.5 à 2
|
0.05 à 0.4
|
0.1 à 1
|
|
10
|
0.4 ou 06
|
02
|
02
|
Fonction -Réponse
secondaire. -Anticorps; protection à long terme.
-Réponse primaire. -Anticorps des secrétions.
-Protection des muqueuses. -Protection à cours terme.
-Protection contre les parasites. -rôle plutôt
mineur.
- Anticorps de la réaction allergique.
Structure en Y
Classes IgG
Chaine H ã
Chaine L Ê ou ë
Sous classe IgG 1 à 4
Structure H2L2
Masse Moléculaire 150KDa
Demi-vie moyenne 24 J
[g/l] 8 à 16
Valence 02
Chapitre 2 : Etude descriptive des principales
protéines sériques
5) Classes et sous -classes:
C'est la nature de la chaîne lourde d'une immunoglobuline
qui détermine sa classe et éventuellement sa sous classe.
L'Isotypie de classe ou de sous classe est la
propriété liée à la présence chez tous les
individus de la même espèce, des mêmes marqueurs
antigéniques spécifiques.
Chez les mammifères par exemple existe 5 classes d'Ig
(immunoglobulines) qui
correspondent à un type différent de chaîne
lourde :
- Ig G: chaîne lourde de type ã (Gamma). - Ig A :
chaîne lourde de type á (Alpha). - Ig M : chaîne lourde de
type u (Mu).
- Ig D : chaîne lourde de type ä (Delta).
- Ig E : chaîne lourde de type î (Epsilon).
En ce qui concerne les Ig A et les Ig D la nature de la
chaîne lourde peut faire l'objet d'une variabilité
définissant une sous classe :
- Il existe 4 sous classes d'Ig G: Ig G1, Ig G2, Ig G3, Ig G4 car
il existe 4 sortes différentes de chaînes lourdes gamma.
- Il existe 2 sous classes d'Ig A: Ig A1, Ig A2 car il existe 2
types de chaînes lourdes alpha.
Le tableau ci-dessus indique les principales
propriétés physiques et biologiques des classes et des
sous-classes.
Tableau 4: Classes et sous classes des
immunoglobulines.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
57
|
|
Quelques précisions :
. Dans la catégorie « association moléculaires
possibles », le symbole « J» signifie qu'il existe une
chaîne de jonction, et le symbole « S» signifie qu'il existe
une pièce sécrétoire.
. La valence de l'anticorps correspond au nombre de segments Fab
(nombre de sites de liaison à l'antigène).
. Ig D est plus lourde Que Ig G ou Ig A car elle est plus
glycosylée.
. Ig E est lourde car il existe un 5ème domaine et Ig M
est encore plus lourde car c'est un pentamère. La masse d'Ig A est de
400 000 quand il existe une chaîne de
jonction et une pièce sécrétoire.
.Ig G et Ig A sont les plus synthétisées par jour
par un individu.
.Ig M sédimente plus vite car c'est un pentamère.
6) Exploration des immunoglobulines sériques:
L'exploration des immunoglobulines est de règle quand:
- il existe des infections répétées,
inexpliquées, surtout bactériennes,
- on évoque un déficit immunitaire compliqué
de manifestations infectieuses, auto- immunes ou
lymphoprolifératives,
- il existe des éléments en faveur d'une
prolifération lymphoplasmocytaire susceptible de sécréter
une IM (cf. exploration d'une gammapathie monoclonale),
- la VS est accélérée avec ou sans syndrome
inflammatoire. > Méthodes d'exploration des Ig :
Elle comporte une électrophorèse des
protéines sériques complétée par un dosage
pondéral des Ig sériques : IgG, IgA et IgM, éventuellement
des sous-classes d'IgG.
* Electrophorèse des protéines
sériques;
La séparation électrophorétique du
sérum humain donne 5 (ou 6) fractions. A l'état normal, un grand
nombre de molécules d'Ig d'isotypes, d'allotypes et d'idiotypes
différents provenant d'une multitude de clones lymphoplasmocytaires
circulent dans le sang : ce sont les Ig polyclonales. Les Ig migrent
essentiellement dans la zone des ãglobulines. La concentration en
ã-globulines estimée à l'EP varie selon l'âge,
physiologiquement elle est de 6 à 13 g/l chez l'adulte.
* Dosage pondéral des Ig (IgG, IgA, IgM):
Le dosage pondéral (quantitatif) des Ig
(néphélémétrie) donne plus de précisions.
Les concentrations en Ig varient en fonction de l'âge. Chez
l'adulte sain, les concentrations sériques sont les suivantes :
IgG : 7,20 -14,70 g/l, IgA : 1,10 - 3,60 g/l, IgM : 0,48 - 3,10
g/l. *Dosage des sous-classes d'IgG (IgG1, G2, G3, G4).
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
58
|
|
Il s'effectue essentiellement par
néphélémétrie. Les concentrations varient en
fonction de l'âge. L'interprétation des résultats est
délicate lorsque les concentrations sont à la limite
inférieure de la normale et chez l'enfant de moins de 18 mois.
a. Dosage: á) Prélèvement de sang du foetus
dans les derniers mois de grossesse:
- La teneur en augmente jusqu'à la naissance où
elle atteint son point culminant. Mais ce stock d'Ig G à la naissance
provient essentiellement de la mère car les Ig G sont les seuls capables
de passer la barrière placentaire.
- Les IgM qui sont moins nombreuses sont elles d'origine
foetale.
- On ne trouve ni Ig A ni Ig D ni Ig E.
â) Prélèvement à la naissance:
- Il y a diminution des Ig C} d'origine maternelle (1/2 vie
d'environ 3 semaines) mais la production d'Ig G démarre dès la
naissance et compense cette chute.
- La production des Ig M se poursuit jusqu'à atteindre un
plateau vers le sixième mois. - La production des autres Ig augmente
progressivement.
· Réponses immunitaires primaires et
secondaires.
Lors du premier contact entre l'organisme et l'antigène:
pendant quelques jours rien ne se passe (temps de latence) puis au bout d'une
semaine apparaissent dans le sang des anticorps spécifiques de
l'antigène puis le taux d'anticorps se stabilise avant de diminuer.
Lors du second contact entre l'anticorps et l'antigène:
la réaction immunitaire secondaire est très rapide (pas de
latence) et beaucoup plus ample. Elle traduit l'existence chez un individu
d'une mémoire antigénique portée par les lymphocytes B
mémoires.
b. Typage par immunofixation d'une gammapathie monoclonale: + Le
principe de l'immune fixation repose sur 2 propriétés:
-Mobilité électrophorétique dans un champ
électrique.
-Caractère antigénique des protéines. C'est
une propriété inhérente à toutes les
protéines.
Ex: si on injecte une protéine purifie (ex albumine
humaine) à un mouton, il ne reconnaît pas cette albumine et donc
fabrique des anticorps anti-albumine. Le mouton est alors immunisé
contre l'albumine humaine et il est possible d'isoler ses anticorps
anti-albumine humaine. D.
+ Technique de l'immunofixation (lors de cette
expérience):
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
59
|
|
- On dispose d'un support plastifié sur lequel on coule un
gel hydraté et tamponné par un Ph de 8,6.
- A l'aide d'un applicateur on dépose sur ce support
quelques microlitres de sérum sur les 6 pistes correspondantes.
- On applique alors un courant électrique entre les
électrodes (200 V).
- Les protéines migrent alors en fonction de leur
taille.
- Sur la piste de gauche on applique un colorant des
protéines (électrophorèse normale).
- Sur les 3 pistes suivantes on dépose un anticorps
spécifique d'une Ig (G, A, M). - Sur les 2 dernières pistes on
dépose un anticorps anti-chaîne légère (K et L).
Anticorps et antigène forment un complexe et donnent une
réaction colorée. + Analyse de cette immunofixation:
- Sur la première piste on repère une zone intense
qui correspond à une production anormale d'une catégorie d'Ig.
- On détermine cette classe d'Ig en étudiant les
complexes antigène/anticorps. - La chaîne lourde correspondante
est de type G et la chaîne légère de type L.
- Il y a donc une synthèse trop importante d'Ig de type
ë2ê2.
7) FONCTIONS DES IMMUNOGLOBULINES :
Ils assurent plusieurs fonctions dans le déroulement de la
réaction immunitaire :
a) Reconnaissance de l'Ag :
- La principale fonction d'une Ig est de reconnaître et de
se lier spécifiquement à un Ag.
- Cette fonction est assurée par une région
appelée : site Ac ou paratope, située sur le fragment Fab, et
constituée de 6-10 acides aminés, qui ne sont pas voisins, et qui
appartient aux régions « hypervariable » de la chaine lourde
et de la chaine légère.
- Ainsi, se forment des complexes Ag-Ac= complexe immuns
(lorsque l'Ag est soluble).
- Lorsque les Ac se fixent aux cellules cibles, leur forme se
modifie faisant apparaître des sites de 4 fixation du complément,
sur le fragment Fc.
b) Fixation et activation du complément
:
- En fonction de leurs classes et sous-classes les Ig peuvent
activer le complément par les deux voies : Classique et alterne.
Ce qui déclenche la fixation de certains facteurs du
complément sur la surface de la cellule antigénique et par
conséquent sa lyse.
c) Propriétés cytophylitiques
:
- Le fragment Fc présente également des sites de
fixation de nombreuses cellules immunitaires : macrophage, PNN, lymphocytes et
mastocytes...
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
60
|
|
- Les Ig en reliant l'Ag ou la cellule aux PNN et macrophages ou
monocytes jouent le rôle d'opsonines (facilitent la phagocytose).
d) La neutralisation :
- L'Ig peut bloquer des sites spécifiques sur les
exotoxines bactériennes et les virus. Ce qui les empêche
d'endommager les cellules normales de l'organisme = neutralisation.
e) Agglutination et précipitation :
- Agglutination : lorsque plusieurs cellules
étrangères, en l'occurrence, sont réunies par des Ig,
formant un amas.
- Précipitation : lorsqu'il s'agit de molécules
solubles réunies, pour former de grands complexes immuns.
- Ce qui facilite la phagocytose de ces bactéries ou
molécules d'Ag précipités.
Neutralisation, agglutination et précipitation
découlent de la fonction de fixation et de connaissance des Ac et donc
du fragment Fab.
f) Passage transplacentaire des IgG :
- Le site qui permet ce passage est situé sur le fragment
Fc des IgG : les seules à pouvoir traverser le placenta.
g) Propriétés particulières
:
· IgM :
- Les premières à apparaître au cours de
l'ontogénie et de la réponse immune.
- Puissants agents agglutinants et dans la fixation du
complément et son activation. - Récepteurs antigéniques
à la surface des lymphocytes B.
· IgG : - Principal Ac des
réactions primaires et secondaires.
· IgA :
- Interviennent dans les réponses immunitaires locales au
niveau de la sécrétion des muqueuses :
* En empêchant l'adhérence des germes aux cellules
épithéliales. * En neutralisant certaines toxines.
* En agglutinant les bactéries ou champignons.
· IgE :
- Se lient au mastocytes et basophiles, lorsque
associés aux Ag, déclenchent la libération de
médiateurs : histamine.... (Dégranulation) qui participe à
des réactions allergiques et à la défense
antiparasitaire.
· IgD : Belaouar Hamza/Lamri
Adlène
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
61
|
|
|
- Leur rôle n'est pas bien connu : probablement =
rôle de récepteur à la surface des lymphocytes B5
immunocompétents.
- Bipolarité fonctionnelle :
* Le fragment Fab reconnaît et se fixe à l'Ag.
* Le fragment Fc est responsable des propriétés
biologiques. N.B= Niveaux
d'hétérogénéité des immunoglobulines
:
- Isotypie : les isotypies : déterminants
antigéniques identiques chez les individus d'une même
espèce. Ils sont portés par la partie constante des chaînes
lourdes et légères.
L'Isotypie définit les classes et les sous classes
d'Ig.
- Allotypie : les allotypies sont des déterminants
antigéniques provenant des variations génétiques
interindividuelles au sein d'une même espèce de structure des
chaînes lourdes á, ã et des chaînes
légères kappa K.
_ Ils sont portés par les parties constantes de ces
chaînes.
_ Il existe 28 allotypes pour les chaînes lourdes gamma
appelés Gm. _ Il existe 2 allotypes pour les chaînes lourdes alpha
appelés Am.
- Idiotype :
* Sont des déterminants antigéniques (ou Epitopes)
localisés sur le fragment Fv formé par l'association des domaines
variables des chaînes lourdes et légères= VL et VH. La
spécificité idiotypique = étroite individuelle, produit
d'un clone cellule.
* La cascade d'auto-anticorps anti-idiotypes = le réseau
idiotypique, a pour rôle de réguler la réponse humorale.
8) Principales anomalies des immunoglobulines:
a. Les hypogammaglobulinémies:
> Hypogammaglobulinémies
physiologiques:
Les déficits de l'immunité humorale se
caractérisent par un trouble de la production globale des anticorps par
les lymphocytes B responsable d'une hypogammaglobulinémie plus ou moins
sévère selon l'étiologie. Quatre cas cliniques illustrent
les principales causes hypogammaglobulinémies de l'enfant, la maladie de
Bruton - dans sa forme typique et dans sa forme atypique -,
l'hypogammaglobulinémie transitoire de l'enfance et de la
déficience immunitaire commune variable.
Les manifestations cliniques que partagent ces diverses
pathologies sont les infections bactériennes à
répétition touchant principalement le tractus respiratoire.
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
62
|
|
|
Les infections opportunistes et les manifestations auto-immunes
sont plus fréquentes dans la déficience immunitaire commune
variable et dans l'hypogammaglobulinémie avec hyper IgM qui, en raison
de sa rareté, n'est que brièvement abordée.
Les récents progrès de la génétique
et de la biologie moléculaire ont partiellement
révélé l'origine et la physiopathologie de ces affections.
L'administration intraveineuse d'immunoglobulines améliore
considérablement la qualité de vie des patients et le pronostic
de leur affection.
> Hypogammaglobulinémies
pathologiques:
Dites globales lorsque la concentration de toutes les classes
d'Ig est diminuée, sélectives lorsqu'elle ne touche qu'une ou
deux classes d'Ig, les hypogammaglobulinémies relèvent de
différentes étiologies. On distingue :
>Les déficits immunitaires acquis
(étiologie la plus fréquente) :
- maladies infectieuses, syndromes lymphoprolifératifs
(LLC, myélome), - atteinte médullaire néoplasique,
toxique, post-radique,
- médicaments : immunosuppresseurs, APS, ...
- pertes excessives : fuites rénales, cutanées,
digestives.
-Hémopathies malignes.
-Causes iatrogènes.
-Pertes Protéiques.
-Certaines maladies virales.
> Les déficits immunitaires primitifs :
Le dosage des différents isotypes des Ig permet de
détecter les déficits en IgA, déficits immunitaires
humoraux les plus fréquents (1/700 sujets), les déficits
immunitaires communs variables, les déficits avec hyper-IgM.
L'agammaglobulinémie ou maladie de Bruton (absence d'Ig et de
lymphocytes B) est exceptionnelle.
Déficits congénital en IgA (<50mg/l).
Déficits immunitaires combinés
sévères(DICS).
>>Les déficits en sous-classes
d'Ig
Les déficits en IgG2 sont les mieux
caractérisés (infections des voies aériennes
supérieures à germes encapsulés). Parfois il existe des
déficits combinés IgG2 et IgA, IgG2-IgG4. L'existence du
déficit en IgG4 est controversée : 20 % des sujets sains ont des
concentrations en IgG4 à la limite des possibilités de
détection.
b. Les hypergammaglobulinémies polyclonales:
> Caractéristiques:
Une hypergammaglobulinémie (augmentation des
gammaglobulines) inférieure à 30 g/l a rarement une valeur
d'orientation diagnostique décisive car elle s'observe dans de
nombreuses circonstances inflammatoires ou infectieuses chroniques mais
également dans certaines MAI (S. de GougerotSjögren+++,
lupus systémique [on le revoie dans la partie
expérimental], ...). Une
hypergammaglobulinémie supérieure à 30 g/l oriente vers
une infection VIH, une parasitose ou une hépatite auto- immune.
> Situation pathologique:
+ Maladies infectieuses:
· infections aiguës: Ig monoclonale transitoire.
· infections chroniques.
· virus: VIH, EBV, CMV, VHB, VHC.
· bactéries: salmonelles, leptospires, EI.
· parasites: paludisme, toxoplasmose.
+ Maladies auto-immunes:
· syndrome de Gougerot-Sjögren essentiellement
· autres maladies auto-immunes (PR, LED...):
fréquence peu élevée
d 'Ig monoclonale posant la
question d'une association fortuite.
+ Hépatopathies:
· capacité de synthèse hépatique
diminuée: o Diminution de l'albumine et d'autres protéines.
· autres perturbations biochimiques: o Augmentation des
enzymes hépatiques (transaminases, PAL, ...) (cytolyse).
o Augmentation de la bilirubine (ictère).
· hypergammaglobulinémie polyclonale (IgA): o
compensation de synthèse par les plasmocytes. o bloc â /
ã.
o diagnostic différentiel des autres
hypergammapolyclonales.
c. Les dysglobulinémies monoclonales:
> Caractéristiques:
Anomalie des globulines qui constituent, avec l'albumine, les
protéines du sang. En pratique on réserve ce mot à des
modifications des gammaglobulines ou anticorps. On regroupe ainsi sous le nom
de dysglobulinémies, ou gammapathies monoclonales, des maladies dans
lesquelles existe, dans le sang ou dans les urines, une immunoglobuline
monoclonale en excès. Elle peut être mise en évidence dans
le sérum par des réactifs qui identifient la classe de
chaînes lourdes et le type de chaînes légères.
Chez un sujet normal, les différentes classes
d'immunoglobulines sont présentes à des taux stables, leur
production étant soumise à une régulation. Les
dysglobulinémies monoclonales sont caractérisées par une
rupture de cette régulation et par la prolifération excessive et
maligne d'un clone qui entraîne une synthèse importante d'une
espèce moléculaire dite monoclonale.
La présence d'une immunoglobuline monoclonale anormale a
été longtemps synonyme de myélome ou de
macroglobulinémie de Waldenström. On sait maintenant qu'il existe
d'autres gammapathies monoclonales, au cours d'autres cancers, d'états
inflammatoires chroniques et de certaines maladies auto-immunes. Il
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
64
|
|
|
y a aussi des modifications modérées et
bénignes qui régressent sans traitement (Tableau 5).
DYSGLOBULINÉMIES MONOCLONALES
Malignes :Myélome
Macroglobulinémie de Waldenström
Lymphomes malins (leucémie lymphoïde
chronique, lymphomes) non-hodgkiniens
Maladies des chaînes lourdes
Non malignes : Associées à une autre
affection
· Cancers
· Cirrhoses
· Inflammation chronique · Maladies
auto-immunes Formes dites« essentielles bénignes »
· Formes sporadiques
· Formes familiales (prédisposition
génétique).
Tableau 5: Dysglobulinémies monoclonales.
Le diagnostic est assez souvent évoqué par un
examen biologique sanguin fait pour une autre raison, s'il révèle
une ou plusieurs anomalies : une augmentation de la vitesse de
sédimentation, une précipitation du sérum ou du plasma au
froid, des «rouleaux» de globules rouges sur un frottis sanguin, une
pseudo-agglutination lors de la détermination d'un groupe sanguin, une
anémie isolée, une augmentation des lymphocytes dans le sang. Ces
modifications amènent à analyser les protéines par
électrophorèse du sang et des urines. L'immunoglobuline
monoclonale recherchée peut exister sous forme de molécules
entières d'anticorps ou de chaînes isolées. On identifie de
façon précise l'anomalie et l'anticorps concerné et on
constate que les autres immunoglobulines sont diminuées.
Les anomalies les plus fréquentes portent sur les
immunoglobulines et en cas de myélome. L'augmentation des
immunoglobulines monoclonales correspond à la maladie de
Waldenström.
Remarque:
Dans les cas de gammapathie bénigne, sans signe
clinique, les immunoglobulines normales ne sont pas abaissées. Il n'y a
pas de cellules anormales dans le sang ni dans la moelle osseuse. Il faut
cependant surveiller ces formes bénignes car elles peuvent
évoluer vers un myélome.
> Situations pathologiques:
+ Maladie de Kahler: (myélome multiple
classique):

· Prolifération maligne monoclonale des plasmocytes
dans la moelle osseuse- Maladie de Kahler-
· 20 % des Ig monoclonales; IgG (53 %), IgA (25 %),
chaînes légères isolées (20 %),
IgD (1 %), IgE exceptionnelle.
· Manifestations: - Signes osseux:
Douleurs lombaires, costales, des membres; fracture
pathologique; tuméfaction osseuse.
- Signes radiologiques:
Lacunes à l'emporte-pièce des os du crâne,
des côtes, du bassin; déminéralisation osseuse ; tassements
vertébraux.
- Signes rénaux :
Tubulopathie chronique, insuffisance rénale. -
Signes neurologiques:
Paraplégie par compression épidurale; neuropathie
périphérique.
Amylose.
· Manifestations hémorragiques:
Infection bactérienne.
· Manifestations cutanées:
nodules de coloration rose-chamois.
· Critères diagnostiques du myélome
multiple:
· Critères majeurs:
1- Tumeur plasmocytaire sur une biopsie.
2- Plasmocytose médullaire > 30 %.
3- Pic monoclonal sérique: IgG >30 g/l, IgA > 20
g/l, excrétion urinaire de chaînes légères Kappa ou
Lambda > 1 g/24heures.
· Critères mineurs:
a- Plasmocytose médullaire comprise entre 10 et 30 %.
b- Composant monoclonal sérique ou urinaire à un
taux inférieur à ceux cités dans 3.
c- Lésions osseuses lytiques.
d- Baisse des Ig résiduelles: IgM < 0,5 g/l, IgA< 1
g/l, IgG < 6 g/l.
Chez des malades symptomatiques: anémiques et/ou
hypercalcémiques et/ou hyperazotémiques et/ou
hypoalbuminémiques et/ou présentant une
déminéralisation osseuse et des fractures compressives.
Le diagnostic de myélome multiple est retenu si: á)
1 + b ou c ou d;
â) 2+ b ou c ou d;
ã) 3;
ä) a + b + c ou a+ b + d.
· Variant du myélome multiple:
-3 % des Ig monoclonales. - Smoldering myeloma:
· 3 % des Ig monoclonales
· Critères de définition:
-Malade asymptomatique.
-Taux de l'Ig monoclonale sérique > 30 g/l.
-Plasmocytose médullaire entre 10 et 30 %. -stabilité de l'Ig
monoclonale au cours de l'évolution.
· Surveillance à vie en raison du risque
d'évolution vers un myélome multiple.
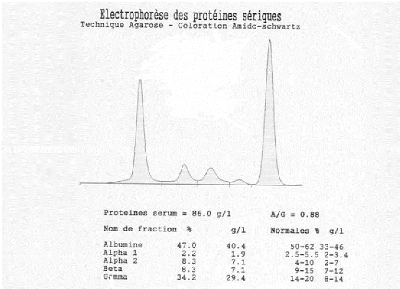
Figure 5: Profile électrophoritique d'un
patient atteint le myélome multiple classique.
+ Macroglobulinémie de
Waldenström:
· Macroglobulinémie de Waldenström:
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
67
|
|
|
2 % des Ig monoclonales.
· prolifération de cellules lymphoïdes B de
maturation intermédiaire entre le petit lymphocyte et le plasmocyte,
excrétant une IgM monoclonale dite
macroglobuline.
· manifestation cliniques: fièvre, sueurs nocturnes,
adénopathies,
hépatosplénomégalie, neuropathie
périphérique, syndrome d'hyperviscosité.
· diagnostic:
· Ig monoclonal IgM > 5 g/l.
· myélogramme et BOM: prolifération
lymphoïde polymorphe comportant
lymphocytes, lymphoplasmocytes et plasmocytes.
+ Maladies des chaînes lourdes:
· syndromes immunoprolifératifs
caractérisés par la production d 'Ig monoclonales
incomplètes sous forme de chaînes lourdes
délétées sans chaines légères.
· électrophorèse le plus souvent normale (Ig
< 1g/l).
· diagnostic sur l'immunoélectrophorèse ou
l'immunofixation.
· trois types:
-Maladie des chaînes lourdes alpha: la plus
fréquente; sujets jeunes du pourtour méditerranéen;
tableau de malabsorption intestinale sévère.
-Maladie des chaînes lourdes gamma: présentation de
type lymphome. -Maladie des chaînes lourdes mues: très rares.
+ MGUS:
· Gammapathies monoclonales de signification
indéterminée (MGUS):
· 60 % des Ig monoclonales; IgG (70 %), IgA (15 %), ou IgM
(15 %).
· découverte d'une Ig monoclonale de manière
fortuite.
· examens para cliniques:
Électrophorèse des protéines
sériques.
Immunoélectrophorèse ou immunofixation des
protéines sériques. NFP, calcémie,
créatininémie.
Myélogramme.
Radiographies osseuses: crâne, bassin, colonne dorsale et
lombaire, humérus, fémur, thorax; éventuellement.
IRM du squelette axial.
Électrophorèse et
immunoélectrophorèse ou immunofixation des protéines
urinaires.
· Critères de définition des MGUS:
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
68
|
|
|
Malade asymptomatique ne présentant pas de: lésion
lytique osseuse, anémie, hypercalcémie, insuffisance
rénale.
Taux de l'Ig monoclonale sérique < 30 g/l.
Pas d'excrétion urinaire de chaînes
légères (ou taux très faible). Plasmocytose
médullaire < 10 %.
Stabilité de l'Ig monoclonale au cours de
l'évolution. ? Evolution des M GUS:
Évolution possible vers un myélome multiple (IgG
et IgA) ou une lymphopathie maligne (IgM) après parfois de très
nombreuses années: risque actuariel de transformation maligne de 15 %
à 10 ans et 30 % à 20 ans.
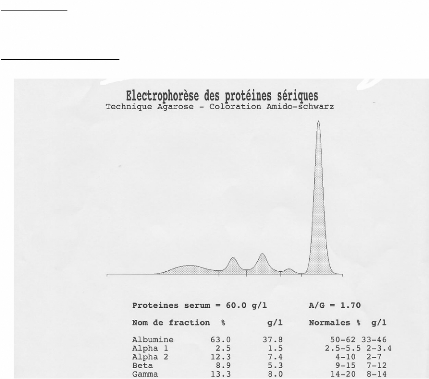
Surveillance:
Après 3 mois puis tous les 6 mois.
Clinique et biologique: électrophorèse des
protéines sériques, NFP, calcémie,
créatininémie, excrétion urinaire de chaînes
légères.
Figure 6 : Profile électrophoritique d'un
patient atteint le syndrome MOUS.
d. Profils immunitaires oligoclonaux: >
Immunodéficience sévère.
> Certains types de cancers.
> Maladies auto-immunes.
| 


