II.5.2.1. Chimiothérapie du cancer
Le cancer est une maladie qui a pour cause la division et la
prolifération cellulaires incontrôlées. Ce
phénomène est causé par plusieurs facteurs, certains
d'entre eux sont exogènes (maladies infectieuses, produits chimiques,
tabagisme, exposition aux radiations) et d'autres sont endogènes (profil
génétique, hormones). Le cancer est considéré comme
l'une des premières causes de mortalité chez l'homme, avec plus
de 150 000 nouveaux cas répertoriées au canada en 2006.
Parmi les méthodes traditionnelles utilisées
pour le traitement du cancer on trouve la chirurgie. Cette dernière a
été utilisée, particulièrement, pour les tumeurs
solides et pour éliminer les foyers tumoraux visibles. Cependant, les
foyers de cellules métastatiques difficilement perçus ne peuvent
être retirés par une intervention chirurgicale. Par
conséquent,
d'autres méthodes à caractère traditionnel,
sont souvent envisagées, à savoir la radiothérapie, la
chimiothérapie et l'immunothérapie (B. A. Chabner,
2006).
La chimiothérapie consiste à un traitement
médical ayant recours à de substances chimiques. Cependant,
à la différence d'autres classes d'agents chimiques, les agents
anticancéreux engendrent une toxicité importante dans
l'organisme. Malgré son développement au fil des années,
la chimiothérapie se trouve limitée par plusieurs obstacles
à savoir les mécanismes de résistance
développés par les cellules tumorales vis-à-vis des
différents types d'agents anticancéreux et leurs
mécanismes d'action. Parmi ces mécanismes, on trouve (D.
R. Ryan, 2006) :
i. Altération de la cible intracellulaire du
médicament ainsi qu'une diminution des voies d'activation
anticancéreux au niveau cellulaire.
ii. Plusieurs médicaments anticancéreux sont
labiles et susceptibles d'être dégradés au contact du
milieu physiologique.
De plus, les traitements chimiothérapeutiques
génèrent une toxicité importante dans l'organisme. En
effet, cette toxicité est attribuable en partie au manque de
spécificité des agents anticancéreux, ce qui provoque une
distribution de médicaments non spécifique dans l'organisme
affectant les tissus sains et n'atteignant qu'en faible quantité les
tissus tumoraux (J. L. Grem, 2006) (figure 48A). D'autre part,
plusieurs agents anticancéreux puissants possèdent une
solubilité aqueuse limitée, et malgré leur dissolution
dans des solvants organiques, il ya risque de précipitation au site
d'injection suite à la diffusion rapide du solvant dans le sang
(G. Gaucher, 2009).
Plusieurs molécules chimiques sont utilisées
pour le traitement du cancer, citant à titre d'exemple paclitaxel (PTX),
doxorubicine, étoposide, alcaloïde de la vinca, topotécan
(G. Gaucher, 2009) et bléomycine (T.
Kumanohoso, 1997).
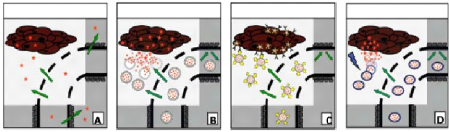
Figure 48. Les stratégies de ciblage
d'un principe actif (PA) anticancéreux. (A) libération du PA tant
au niveau
des tissus tumoraux que les tissus sains, (B) libération du
PA dans la tumeur et internalisation du PA par les
cellules tumorales, (C)
internalisation du vecteur suite à l'interaction spécifique entre
la molécule de
reconnaissance attachée à la surface du
vecteur et son récepteur sur la membrane des cellules cibles,
(D)
libération du PA en réponse à l'environnement ou
à un stimulus externe (T. Lammers, 2008).
Dans le but d'avoir une formulation de principe actif qui
serait mieux tolérée, plusieurs types de systèmes
colloïdaux à base de polymères ont été
appliqués. Pour le ciblage d'un anticancéreux au niveau de la
tumeur solide, le vecteur idéal doit avoir un temps de circulation
plasmatique prolongée. Ensuite, le vecteur doit sortir de la circulation
sanguine et
s'accumuler dans le tissu tumoral. Enfin, une fois dans le
tissu cible, le vecteur doit libérer son contenu pour que le principe
actif puisse agir au niveau de sa cible intra ou extracellulaire (figures 46B,
46C et 46D). Parmi les polymères utilisés, on trouve les
polyesters synthétiques, en particulier, le poly(acide lactique) et ses
dérivés (G. Gaucher, 2009).
Le poly(acide lactique) est un polyester aliphatique ayant
trois configurations stéréochimiques qui sont poly(D-acide
lactique) (PDLA), poly(L-acide lactique) (ou PLLA) et le poly(D,L-acide
lactique) (ou PDLLA). Ce dernier est très utilisé comme vecteur
de principes actifs soit sous forme d'un homopolymère ou
copolymère (ex. PLGA).
II.5.2.1.1. Utilisation du PDLLA pour améliorer
l'efficacité thérapeutique de l'agent anticancéreux
bléomycine (BLM)
La bléomycine est un agent anticancéreux soluble
dans l'eau utilisé pour le traitement de nombreux cancers. Cependant,
cet agent est rapidement absorbée dans le sang avec une faible
distribution sélective, ce qui provoque une toxicité importante
dans l'organisme. Pour réduire la toxicité et maintenir la
concentration de la bléomycine élevée dans les
lésions, divers systèmes de chimiothérapie locale ont
été développés (M. Shimada,
1993).
Parmi ces systèmes, citant celui à base de
poly(D,L-acide lactique). Toru Kumanohoso et al. (T. Kumanohoso, 1997)
ont préparé un nouveau système de vectorisation
de la bléomycine pour le ciblage des lésions. Ce système
est préparé par l'incorporation de la bléomycine dans un
petit cylindre de PDLLA de faible masse moléculaire (Mw =
3500 Da) par la technique de pressurage à l'état fondu.
Dans le but de déterminer l'efficacité de la
nouvelle formulation BLM-PDLLA comparativement à la solution de PLM
(BLM-SOL), un test in vitro (pH = 7,4 à 37 °C) pour l'étude
de la libération de PLM à partir de la formulation BLM-PDLLA a
été effectué d'une part, et d'autre part, des
expériences in vivo sur des rats ont été aussi
réalisées. Toru Kumanohoso et al. (T. Kumanohoso, 1997)
ont choisi 84 rats divisés en deux groupes pour tester les deux
formulations, la formulation BLM-SOL est injectée dans le dos de chaque
rat du groupe 1 (48 rats), et la formulation BLM-PDLLA est implantée
dans le dos de chaque rat du groupe 2 (36 rats).
Les résultats trouvés pour le test in vitro sont
montrés sur la figure 49. D'après cette dernière, le
cylindre BLM-PDLLA se dissous progressivement au fil du temps jusqu'à sa
disparition complète après 35 jours. Cela signifie que BLM est
libéré à partir de la formulation BLM-PDLLA lentement sur
une période dépassant les trois semaines.
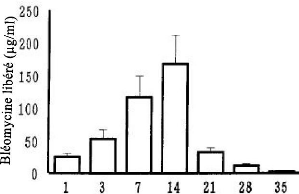
Temps (jours)
Figure 49. Libération de la
bléomycine à partir de BLM-PDLLA dans le milieu
physiologique
(pH = 7,4 à 37°C).
Pour le test in vivo, l'activité de BLM au cours du
temps a été mesurée dans 2 cm de tissu sous-cutané
autour du site d'implantation dans le cas des cylindres BLM-PDLLA et du site
d'injection dans le cas de la solution BLM-SOL. Une activité
élevée a été maintenue dans le tissu
sous-cutané dans le cas des implants BLM-PDLLA pour au moins 14 jours.
Par contre, la solution BLM-SOL n'a démontré aucune
activité au-delà de 3 jours (figure 50).
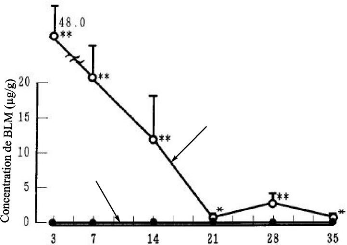
BLM-PDLLA
BLM-SOL
Temps (jours)
Figure 50. Variation de la concentration de
BLM dans les tissus sous-cutanés autour de site d'implantation.
En plus, l'analyse macro et microscopique des rats du groupe 2
(traités par BLM-PDLLA) a montré que les tumeurs
sous-cutanés ont disparus dans 14 rats parmi 21 après traitement.
Le volume de la tumeur a commencé de diminuer 4 jours après
traitement jusqu'à sa disparition complète après 27 jours.
Par contre, dans le groupe 1 (traités par BLM-SOL), une réponse
micro et macroscopique a été détectée dans
seulement 5 rats parmi 21, et le volume de la tumeur augmente
régulièrement après traitement et 21 rats ont
trouvés la mort dans 15 jours comme un résultat de
métastase systémique de la tumeur.
En conclusion, Toru Kumanohoso et al. (T. Kumanohoso,
1997) ont montré que la formulation BLM-PDLLA libère la
bléomycine dans les tissus prés du site d'implantation ainsi que
dans les ganglions lymphatiques régionaux sur une longue période
de temps, et elle a montrée une grande efficacité
thérapeutique que la solution BLM-SOL. Ces résultats indiquent
que le mélange BLM-PDLLA pourrait être une méthode utile
pour un traitement chimiothérapeutique loco- régional.
II.5.2.1.2. Ciblage d'un agent anticancéreux
hydrophobe (Paclitaxel) par l'utilisation d'un copolymère amphiphile
(PVP-b-PDLLA)
Le paclitaxel est une molécule modèle pour le
traitement du cancer. À cause de sa faible solubilité dans l'eau,
le paclitaxel (PTX) a été mélangé avec l'huile de
recin polyoxyélhylée (CrEL) pour la préparation d'une
nouvelle formulation appelée Taxol (c'est la forme commerciale de PTX).
Cette dernière a été utilisée en 1985 pour le
traitement du cancer de l'ovaire réfractaire (D. J. I. Kingston,
1995).
La résistance des cellules anticancéreuses
peuvent limiter l'efficacité du PTX en provoquant le passage rapide de
PTX à travers la membrane cytoplasmique (i.e. diminution de la
concentration de PTX autour de site d'action) (E. K. Rowinsky,
2006). En plus, la formulation Taxol présente un certain nombre
de problèmes, à savoir les patients ont eu une réaction de
choc anaphylactique et d'hypersensibilité sévère
caractérisée par la dyspnée, l'urticaire,
l'angioédème et l'hypotension (H. Gelderblom,
2001).
Afin de résoudre certains défis liés
à la formulation de paclitaxel hydrophobe et pour minimiser des
réactions d'hypersensibilité sévères de surfactif
CrEL formant le Taxol, des nanoparticules à base de copolymère
amphiphile (PVP-b-PDLLA) chargées de PTX ont été
développées.
Genevière Gaucher et al. (G. Gaucher,
2007), ont préparé des nanoparticules de PDLLA
chargées de PTX et entourées d'une couronne hydrophile de PVP.
Ces nanoparticules sont préparées par la méthode
d'émulsion huile/eau (H/E) suivi par évaporation de solvant.
Différentes techniques ont été utilisées pour
caractériser l'interaction entre la matrice polymérique et le
principe actif ainsi que pour déterminer l'efficacité de ces
nanoparticules dans le contrôle de la libération du principe actif
dans le milieu physiologique. Parmi ces méthodes, citant la DRX, la DSC
et le test de dissolution.
L'étude du profil de libération in vitro de PTX
à partir des nanoparticules dans un milieu physiologique (pH = 7,4
à 37 °C) a montré une libération de PTX rapide au
début qui pourrait être attribué à la
présence de molécules du PTX près de la surface des
nanoparticules. Ensuite, la vitesse de libération de PTX devient
inversement proportionnelle à la masse molaire de PDLLA formant le coeur
des nanoparticules. En effet, le PDLLA de masse molaire plus
élevée crée un environnement plus
visqueux menant à une meilleure rétention de PTX dans le vecteur
et à une libération prolongée sur plusieurs jours (figure
51) (G. Gaucher, 2007 ; T. Niwa, 1993).
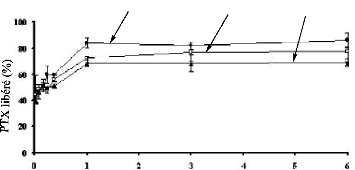
PDLLA 13400 PDLLA 22000 PDLLA 40500
Temps (jours)
Figure 51. Cinétique de
libération de paclitaxel à partir des nanoparticules de PDLLA
préparées dans le
dichlorométhane comme solvant
organique.
À la lumière des résultats de
libération in vitro du PTX, les nanoparticules à base de PDLLA
ont été sélectionnées pour les expériences
de pharmacocinétique et de biodistribution. Un double marquage à
la radioactivité a été appliqué afin de suivre le
vecteur et le principe actif simultanément dans le sang et dans les
organes. Le PTX solubilisé dans les micelles de CrEL (Taxol) a
été inclus dans l'étude comme formulation
contrôlée. Ces expériences ont été
essayées sur des rats. Les résultats ont montré que les
nanoparticules de PDLLA confères des temps de circulation plasmatique
prolongé au paclitaxel chez l'animal. Ces nanoparticules de PDLLA ont
permis un ciblage du PTX au niveau des tissus tumoraux supérieurs
comparées à la forme commerciale (Taxol).
En résumé, l'incorporation de paclitaxel dans de
nanoparticules de PDLLA est possible et que ces nanoparticules ont
assurées une libération in vitro contrôlée sur
plusieurs jours. Enfin, les nanoparticules polymères de PDLLA
constitueraient une stratégie de vectorisation mieux adaptée au
ciblage tumoral du PTX.
| 


