|
Propriétés mécaniques des
biomatériaux
Les essais pratiqués pour apprécier les
propriétés mécaniques peuvent se diviser en deux grands
groupes :
Les essais peu liés au temps dans lesquels la
déformation provoquée est peu liée à la
durée d'application de la force :
L'essai de traction, de compression ou de flexion,
détermine l'aptitude à la déformation d'un matériau
soumis à un effort progressif
L'essai de dureté fournit des renseignements sur
la résistance à la pénétration d'une pièce
dure soumise à un effort constant
L'essai de résilience caractérise la
résistance au choc
Les essais fortement liés au temps dans lesquels la
déformation provoquée dépend de la durée
d'application de la force :
-L'essai de fatigue étudie le comportement du
matériau vis à vis de sollicitations alternées bien
inférieures à la contrainte nécessaire pour le rompre
-L'essai de fluage mesure la déformation, en
fonction du temps, du matériau sous charge constante.
Essai de traction :
L'essai le plus fréquemment utilisé afin de
déterminer le comportement mécanique d'un matériau est
l'essai de traction. Cet essai est caractérisé par sa
facilité de mise en oeuvre et par la richesse des informations fournies.
On exerce une force de traction sur un barreau de dimension
standardisée, jusqu'à sa rupture, en suivant un processus de mise
en charge à une vitesse de déformation constante.
L'éprouvette d'essai est prélevée dans le
matériau à caractériser et usinée à des
dimensions normalisées, afin d'assurer une meilleure comparaison des
essais effectués dans différents laboratoires. Pour chaque type
de matériau, il existe un type d'éprouvette.
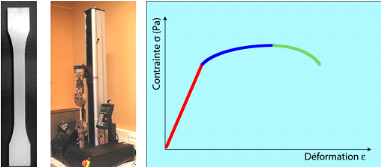
Figure 1. Eprouvette. Machine de traction. Courbe
contrainte-déformation
En enregistrant la force appliquée à
l'éprouvette par la machine de traction et son allongement progressif on
obtient un diagramme contrainte-déformation.
Diagramme contrainte-déformation en traction d'une
éprouvette en métal
L'application d'une force provoque initialement une
déformation élastique de l'éprouvette. Cela se traduit sur
le diagramme par une droite car la déformation est proportionnelle, pour
un métal, à la contrainte (loi de HOOKE).
Cette déformation élastique est réversible.
Si la contrainte est annulée, l'éprouvette revient
instantanément à sa forme initiale. Cette déformation
élastique est suivie d'une déformation irréversible
(permanente) appelée déformation plastique, qui se traduit sur le
diagramme par une courbe qui se termine au moment de la rupture de
l'éprouvette.

Figure 2. Courbe contrainte-déformation. Domaine
élastique et domaine plastique
Différents paramètres sont remarquables :
Le module d'élasticité E (ou module de YOUNG)
donné par la pente du domaine élastique du diagramme
contrainte-déformation
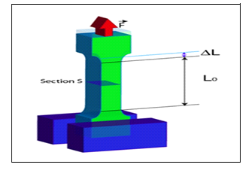
Figure 3 : Traction simple : force et allongement
Le module d'élasticité :
Si l'on raisonne, par simplification, sur un corps
parallélépipédique supposé à une seule
dimension dans un essai de traction dans un seul axe (uniaxiale, selon l'axe
des x), l'éprouvette subit un allongement (figure 3). Pour les petites
déformations, il existe une relation linéaire entre la contrainte
et la déformation :
óx = E.åx = E ÄL/L0= E (L- L0)/ L0
E est le module d'élasticité ou module de YOUNG
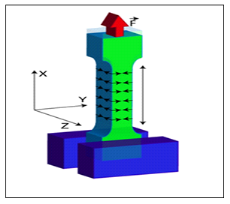
Figure 4 : déformations dans les trois directions
En réalité, l'éprouvette se
déforme dans les 3 directions ( figure 4).
Dans le sens Ox il y a un allongement, dans les sens Oy
et Oz il y a raccourcissement.
Dans ce cas de traction simple, si les contraintes óy et
óz sont nulles, les déformations åy et
åz ne le sont pas. Les 3 déformations sont
reliées par le coefficient de POISSON.
? x 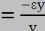 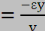 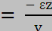 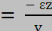
v est le coefficient de POISSON
La limite d'élasticité Re correspond à la
contrainte à partir de laquelle le matériau commence à se
déformer plastiquement. En pratique, bien que la définition soit
simple, cette limite est difficile à apprécier car le passage du
domaine élastique au domaine plastique se fait de façon
progressive. La difficulté de lecture donnerait des
interprétations erronées de cette limite d'un laboratoire
à l'autre. Pour s'en affranchir, on a déterminé une limite
conventionnelle d'élasticité à 0,2% (Re 0,2%). C'est la
contrainte pour laquelle on mesure une déformation plastique de 0,2%.
La résistance à la traction Rm se définit
comme la contrainte maximale atteinte durant l'essai de traction.
L'allongement à la rupture år que l'on peut lire
sur le diagramme ou sur l'éprouvette rompue.
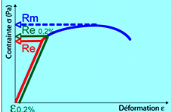
Figure 5 : Courbe contrainte-déformation. Limite
d'élasticité et résistance à la traction
On peut également définir certaines
caractéristiques déterminées par l'essai de traction :
La rigidité est fonction de l'énergie des liaisons
entre les atomes ou les molécules constituant le matériau. On
mesure la rigidité principalement par le module d'YOUNG.
Plus ce module est élevé, plus le matériau
est rigide.
La résistance caractérise la contrainte maximale
qu'un matériau supporte avant de se rompre. Cette résistance est
fonction de l'intensité des liaisons mais également de la forme
des pièces ou de ses défauts.
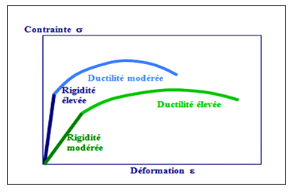
La ductilité correspond à la capacité d'un
matériau à se déformer de façon permanente avant de
se rompre. Plus l'allongement à la rupture est élevé, plus
le matériau est considéré comme ductile. A
l'opposé, lorsque la déformation permanent est très
réduite ou nulle, on parle d'un matériau fragile. Un
matériau fragile peut présenter une résistance très
élevée (figure 6).
Figure 6. Courbe contrainte-déformation. Deux
matériaux avec des rigidités et des ductilités
Différentes
La ténacité qui représente la
quantité d'énergie absorbée à la rupture par un
matériau. Elle caractérise la résistance à la
propagation brutale de fissures. Sa valeur est égale à l'aire de
la surface sous la courbe contrainte-déformation. Cette
caractéristique est importante pour les céramiques.
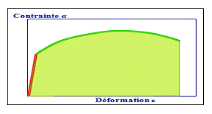
Figure 7. Courbe contrainte-déformation.
Ténacité = surface sous la courbe
Essais de dureté
La dureté peut être définie comme une mesure
de la résistance à la déformation plastique
localisée. Les méthodes de mesure de la dureté sont
basées sur la pénétration forcée d'un indenteur
à la surface d'un matériau. Une valeur de dureté est
déterminée par la mesure de la dimension ou de la profondeur de
l'empreinte faite par l'indenteur soumis à des charges et des vitesses
d'application contrôlées.
Essai de résilience ou rupture par
fragilité
L'aptitude d'un métal à ne pas se rompre par
fragilité c'est-à-dire à résister aux
sollicitations par choc s'appelle la « résilience ».
Principe :
Cet essai consiste à rompre en son milieu d'un seul coup
de mouton-pendule une éprouvette entaillée en U en son milieu et
reposant sur deux appuis.
Essai de Fatigue :
Les essais mécaniques ci-dessus cités (Traction -
Dureté - Résilience) constituent une étude en statique du
matériau. En effet, on cherche le plus souvent à travailler dans
le domaine élastique d'un matériau, et une étude statique
permet de déterminer la zone élastique.
Mais, lorsque les efforts varient avec le temps, c'est le
phénomène de fatigue qui intervient. Les pièces peuvent
rompre même si elles fonctionnent dans le domaine élastique.
On a constaté expérimentalement qu'un
matériau, soumis à des efforts répétés,
inférieurs à la charge de rupture, pouvait se rompre sans
déformation préalable.
Essai de fluage
Dans la déformation permanente l'éprouvette
après avoir subi un effort unitaire supérieur à sa limite
élastique prenait un allongement déterminé et conservait
une longueur constante pendant la maintien de la charge.
Mais si l'effort est prolongé et si, de plus,
l'éprouvette est portée température élevée,
un nouveau phénomène apparaît : la déformation
visqueuse.
La limite élastique baisse avec le temps, et
l'éprouvette s'allonge : on dit qu'elle « flue » et
le phénomène, appelé « fluage », se
poursuit après l'application de la contrainte.
Propriétés chimiques et
électrochimiques
Les propriétés chimiques et
électrochimiques des biomatériaux métalliques sont d'une
grande importance, puisque tant au laboratoire qu'en clinique ces
biomatériaux sont susceptibles de présenter différentes
forme d'altérations.
Schématiquement, il existe deux types
d'altérations :
§ En atmosphère sèche, nous parlerons des
«corrosions simples».
§ En atmosphère humide, on a présence d'un
électrolyte, nous parlerons de «corrosions
électrochimique».
Remarque :
Le terme corrosion désigne :
§ Le processus d'interaction métal/milieu ambiant.
§ La destruction partielle ou totale du matériau
métallique.
Corrosion chimique
Le métal est susceptible de réagir lorsqu'il est
directement en contact avec un gaz.
Exemple :
ü Fe + O2 (à haute
température)
ü La sulfuration de l'Ag (dans l'air polluée
par les composées sulfureux)
ü La sulfuration d'alliages dentaires
(chauffés en atmosphère réductrice)
Définition de l'oxydation
Au sens étroit, l'oxydation est la fixation
d'oxygène, le phénomène inverse (enlèvement
d'oxygène) étant la réduction.
Au sens large, l'oxydation correspond à la fixation
d'un élément électronégatif (oxygène,
halogène, soufre, azote...) ou à l'enlèvement d'un
élément électropositif (hydrogène ou
métal).
Au sens atomique, l'oxydation est une
dé-électronation, c'est-à-dire la perte d'électrons
par un atome ou un groupe d'atomes, le gain d'électrons constituant la
réduction.
Formation de la pellicule d'oxydation
Exemple : CuO
Lorsque le «Cu» est chauffé
à une température (500-800 c°), les molécules
d'O2 sont absorbées à la surface sous l'action des
attractions exercées par les atomes superficiels (on a la rupture des
molécules d'O2 qui vont s'adjoindre aux atomes de Cu) il se
forme à la surface une 1ère pellicule mono moléculaire
d'oxyde cuivreux Cu2O de couleur rouge vif, puis d'oxyde cuivrique
CuO de couleur noir.
Une fois la première pellicule formée, plusieurs
mécanismes sont possibles :
Type P
La croissance peut se faire à l'interphase
métal/oxyde pour les oxydes semi-conducteurs de type
«P» telle que : Cu2, NiO, FeO, CoO,
Cr2O3
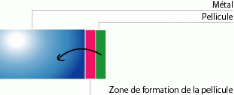
Type N
La croissance de la pellicule peut également se faire
à l'interphase oxyde/air pour les semi-conducteurs de type
«N» : ZnO, CdO, TiO2.
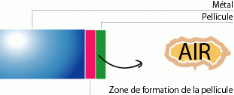
Le ZnO ; produit de base de la plupart des biomatériaux
d'obturation et de scellement minéraux ou organique
Type bilatéral
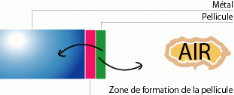
Cette croissance peut se faire bilatéralement et
simultanément en son épaisseur : métal / oxyde / Air.
Classification des pellicules d'oxydation:
Elle est liée à la diffusion de la couche
d'oxydation, vue le rôle important de la pellicule d'oxydation dans le
mécanisme et l'évolution de la corrosion, on a pu constater 2
possibilités :
ü La diffusion du métal ou de l'O2
à travers la pellicule d'oxyde formée est impossible ou
très lente parce que le volume atomique de l'oxyde est supérieur
à celui du métal.
Exemple : Al, Sn, Cu, Fe, Mn, Cr.
ü La diffusion du métal ou de l'O2 est
possible à travers la couche d'oxyde parce que le volume atomique de
l'oxyde est inférieur à celui du métal
Exemple :
Na, Ba, Ca, K, Mg.
Dans le premier cas la pellicule aura le rôle protecteur
et sera susceptible d'arrêter la corrosion, alors que dans le second cas
elle évoluera de façon plus ou moins continue. En pratique, les
pellicules protectrices peuvent être épaisses visibles ou minces
invisibles.
Remarque
Pour les alliages précieux, comme les alliages
contenant d'or, de platine, ou d'argent par exemple, afin d'améliorer
leurs propriétés mécaniques, le
«Cu» contenu dans l'alliage peut, suite à un
chauffage s'oxyder en surface, diffuser à travers la couche d'oxyde, ce
qui nous donne une coloration disgracieuse (qui manque totalement de charme).
Afin d'éviter un tel déboire, il est préférable de
chauffer l'alliage d'or soi à l'abri de l'air (en présence d'un
gaz neutre, en milieu réducteur ou encore en faisant le vide) soit dans
un bain de sel, soit enfin on les protégeant par un flux (acide
borique).
Si le métal à été oxydé en
surface on pourra éliminer la pellicule d'oxydation formée en le
dissolvant par un acide (H2SO4 à 10%) c'est le
décapage.
Corrosion électrochimique (endobuccale)
L'interaction métal-salive engendre des micro-courants
entraînant l'altération partiel du matériau
métallique, ainsi que des manifestations pathologiques buccales, cette
interaction peut se produire entre :
ü Deux couronnes métalliques
séparées par la salive qui sert d'électrolyte, les
couronnes conçues en alliages différents. C'est la macro pile.
ü Au sein d'une même couronne, ou d'une même
reconstitution lorsqu'il y a un défaut cristallin en surface. C'est la
micro pile.
Macro pile
Deux couronnes métalliques séparées par
la salive qui sert d'électrolyte, les couronnes conçues en
alliages différents.
Exemple :
ü Une couronne en alliage d'or et l'autre en alliage de
nickel-chrome
ü Entre une couronne et une reconstruction métallique
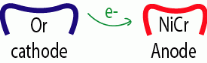
Dans ce cas nous pouvons dire qu'il y a passage d'un courant
galvanique; à ce moment, les ions se déplacent vers le
métal le plus noble et les électrons vont vers le métal le
moins noble, on réalise se que l'on appelle une «macro
pile».
Micro pile
Au sein d'une même couronne, ou d'une même
reconstitution lorsqu'il y a un défaut cristallin en surface.
Exemple : Piqûre de surface au niveau d'une
couronne en or.
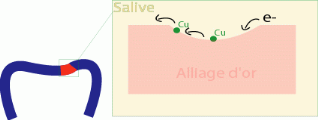
Les ions cuivre vont se déplacer vers la surface de
l'alliage d'Or et entraîne une coloration de la couronne (ternissement
local rouge et puis elle s'étend) on a alors une «micro
pile».
Conditions
Pour que ces phénomènes micro et macro pile
puissent se produire il faut:
Réaction d'oxydation
Que le potentiel de la réaction d'oxydation soit plus
négatif que le potentiel de la réaction de réduction
conjuguée car tout métal solide peut être considérer
comme un ensemble d'atomes ions et d'électrons, lorsque le métal
entre en contact avec l'électrolyte, les atomes-ions pourront passer en
solution sous forme d'ions hydratés à condition que
l'énergie libérée soit plus grande que l'énergie
nécessaire pour rompre la liaison atomes-ions électrons.
Cependant deux phénomènes peuvent se produire:
ü si les forces d'hydratation sont insuffisantes pour rompre
la liaison atome-ion-électron, dans ce cas une quantité de
cathions de la solution pourra être absorbée par la surface
métallique et constituer la couche la plus interne positive. La couche
externe étant constituée par les anions excédentaires de
la solution. Exemple:cas de l'or et du platine.
ü s'il y a absorption d'un gaz dissous dans
l'électrolyte (O2 par exemple), dans ce cas il n'y aura pas
de départ d'ions du métal ni absorption de cathions de la
solution.
Surface de séparation
Il faut que la surface de séparation
métal-électrolyte présente une
hétérogénéité électrochimique ou ont
lieu respectivement les réactions de dissolution du métal et les
réactions d'assimilation des électrons excédentaires
par les cations de la solution.
Facteurs de variation des potentiels d'électrode selon
Portevin et Chamdron
Les facteurs internes :
Selon la nature du métal :
Le platine (=Pt) et le lithium (=Li) présente une DDP de 4
volt
Selon la structure :
La corrosion se réalise le long des grains
cristallographiques, elle sera intense lorsque le grain est gros.
1. Selon l'état de surface :
En fonction du degré de polissage et de la propreté
de la surface
2. Selon les couches protectrices :
Les couches protectrices diminuent la valeur du potentiel de
quelque dixièmes du volte à 1 volt
3. Déformations et tensions mécaniques :
Les déformations et les tensions mécaniques
diminuent le potentiel des électrodes. (Toute variation de courbure,
angle vif, sillon peuvent engendrés les couples galvanique).
4. La fatigue :
Les tensions alternées peuvent provoquées le
phénomène de fatigue, il sera accentué lorsque le milieu
est corrosif.
Les facteurs externes
Facteurs chimiques :
ü «PH» des solutions d'électrolytes, la
corrosion est élevée en milieu acide, faible en milieu neutre,
elle est stable en milieu basique
ü Oxydants, ce sont la température, la concentration
de la solution et la durée d'exposition.
Effet de la corrosion
Effet chimique
Le ternissement de la surface est le 1er signe de l'oxydation
Effet physio mécanique
La corrosion peut être lente et uniforme ou
généralisée, elle peut-être localisée sous
forme de plaque ou de piqûre, la corrosion inter cristalline se situe en
profondeur et suit le trajet des joins de grain.
La corrosion peut enfin être sélective et ne
concerne qu'un seul constituant de l'alliage.
Applications des biomatériaux
Evaluation préclinique de la biocompatibilité
Evaluer la biocompatibilité c'est assurer la
tolérance et la biofonctionnalité du produit. Il faudra donc
évaluer respectivement le retentissement local et général
de la mise en place du matériau dans l'organisme, mais aussi le
retentissement de l'organisme sur le matériau. La
biocompatibilité n'ayant pas de définition absolue, il faut, pour
qu'un nouveau matériau soit correctement évalué, le
comparer à des témoins dont la compatibilité ou
l'intolérance sont connues, il s'agit de matériaux dits de
référence (ou contrôles) : en orthopédie ces
matériaux de référence peuvent être le
polyéthylène, les métaux purs, la céramique
d'alumine. Les caractéristiques précises propres à
l'implant utilisé comme référence
(géométrie, état de surface...) doivent être
également connus.
Evaluation physicochimiques du matériau
Avant d'implanter un produit, il est nécessaire de le
caractériser. C'est la première étape qui conditionne les
suivantes. Les caractéristiques du matériau sous forme massive
sont :
La composition chimique y compris les adjuvants
nécessaires à la fabrication, et les impuretés ;
es propriétés physiques incluant souvent dans ce chapitre
les caractéristiques mécaniques. Lorsqu'il s'agit, par exemple,
d'un matériau utilisable en frottement, des tests sur simulateurs de
frottement (pion-disque ou disque-disque) ou sur simulateur articulaire sont
nécessaires. De cette façon, on peut mesurer les débris
libérés, le coefficient de frottement et les
éléments de dégradation du produit après plusieurs
millions de cycles.
Les propriétés de surface incluent en un terme
général des éléments comme la chimie de la surface,
les propriétés électriques de la surface et la structure
de la surface. Pour connaître les caractéristiques chimiques de la
surface des techniques comme la spectroscopie infrarouge ou la mesure de
l'angle de contact sont réalisées. La structure de la surface
peut être connue par une étude au microscope électronique
à balayage, la rugosité peut être calculée, enfin
des mesures du potentiel de surface et du potentiel zêta évaluent
une partie des propriétés électriques.
Evaluation du retentissement local
Il s'agit sans aucun doute d'une partie essentielle de
l'évaluation.
In vitro :La complexité
de la mise en oeuvre, le coût, et la complexité même du
modèle animal qui réalise un milieu biologique complexe font
préférer les méthodes in vitro aux méthodes in vivo
pour une première approche ou « screening » des
matériaux. Il est par ce biais possible d'évaluer rapidement et
à moindre coût un nombre important de matériaux et de
choisir de la sorte le moins toxique.
Ainsi les cultures cellulaires de mammifères sont
connues et utilisées dans le domaine depuis plus de 20 ans.
Initialement, la viabilité cellulaire était seule
étudiée, plus récemment des études fonctionnelles
qui analysent l'inhibition de la croissance cellulaire, plus récemment
encore des cultures cellulaires organotypiques permettent de rendre le
modèle un peu moins schématique.
Les méthodes morphologiques peuvent se séparer
en deux principales : celles reposant sur la diffusion ou la migration
d'éléments du matériau dans la culture cellulaire (essai
de contact direct, essai de diffusion dans l'agar) et les méthodes
cultivant les cellules dans un milieu où un extrait du matériau a
été placé. Des colorations vitales sont ensuite
appliquées et la cytotoxicité est ainsi mesurée.
In vivo : L'implantation
animale reste encore une étape obligée de l'appréciation
d'un matériau. De façon générale, il faut insister
sur le fait que les méthodes qualitatives ne sont plus de mise. Les
méthodes semi-quantitatives deviennent obsolètes même si
elles demeurent encore un élément de normalisation. Seules les
méthodes quantitatives doivent être utilisées.
En tissu mou :
L'évaluation quantitative de la réponse tissulaire en tissu
mou peut se faire par des méthodes morphologiques histologiques, et/ou
par des méthodes fonctionnelles. L'implantation animale se fait
préférentiellement dans le muscle (muscles paravertébraux,
quadriceps), le tissu cellulaire sous-cutané est moins souvent
utilisé comme site récepteur.
La quantification histologique repose classiquement sur la
mesure de l'épaisseur de la membrane d'encapsulation. Dans une
étude publiée par notre équipe une évaluation plus
fine a été proposée. Elle repose sur la quantification de
chaque type cellulaire et de leur localisation par rapport à la surface
de l'implant. Il a été observé grâce à ces
méthodes que les cellules n'étaient pas distribuées au
hasard dans la membrane mais qu'elles répondaient à une
distribution statistique d'un type particulier : la loi de Weibull.
Schématiquement, le nombre de cellules quel qu'en soit le type
croît rapidement à partir de l'interface pour diminuer de
façon progressive ensuite ; la courbe est donc en forme de cloche
asymétrique. Les paramètres de distribution de la loi de Weibull
permettent de décrire une partie de la réponse tissulaire.
L'évaluation fonctionnelle repose sur la modification
de la quantification des enzymes produites lors de la réponse
tissulaire. Des colorations spécifiques des enzymes sont
utilisées et la quantification est réalisée par analyse
d'image. La signification des différentes enzymes étudiées
est indiquée dans le.
D'autres techniques sont en développement comme le
marquage par des anticorps spécifiques qui permettent de marquer soit
des types cellulaires particuliers (macrophages, lymphocytes...) soit des
protéines particulières. La quantification se fait ensuite par
des techniques d'analyse d'image.
En tissu osseux : La fonction
de support du tissu osseux impose aux matériaux qui sont susceptibles de
s'y substituer temporairement ou définitivement des contraintes en
partie différentes de celles qui ont été
évoquées précédemment. Le problème
particulier de la repousse osseuse dans un matériau est
spécifique. Les évaluations dans ce cadre comprennent donc des
études mécaniques et des études histologiques.
Les paramètres mécaniques sont par exemple : la
tenue en cisaillement d'un implant dans de l'os (cortical ou spongieux), il
s'agit des « push-out » ou « pull-out tests », les
modifications des caractéristiques de l'os peuvent être
évaluées par les méthodes mécaniques classiques (cf
Biomécanique du traitement des fractures) ou par des méthodes
plus fines prenant en compte le caractère anisotropique de l'os
(microscopie acoustique). Enfin des modèles mathématiques tels
que les méthodes par éléments finis constituent des outils
souvent utiles, si le modèle est bien conçu.
Les études morphologiques intègrent les
appréciations de la repousse à l'aide de microradiographies et/ou
à l'aide de techniques histologiques (en ne décalcifiant pas
l'os). On évalue ainsi le taux de repousse osseuse au contact d'un
matériau ou dans les anfractuosités d'un matériau poreux.
Les méthodes d'analyse d'image permettent de quantifier ces
phénomènes.
Evaluation du retentissement de l'organisme sur le
matériau
Un matériau mis dans un environnement biologique se
dégrade, il s'agit de corrosion pour les matériaux
métalliques ou polymériques. Les matériaux
céramiques et polymériques sont susceptibles de relarguer des
produits détachables (comme les additifs nécessaires à la
fabrication des polymères, ou les impuretés contenues dans les
céramiques). Il faut donc étendre l'étude
précédemment évoquée aux produits de
dégradation qui par eux-mêmes sont susceptibles de
déclencher des effets indésirables.
Les principes de base de l'ostéosynthèse par
plaque et vis
Moyens d'ostéosynthèse vis et plaques
Nous allons maintenant détailler les différents
types de vis et de plaques disponibles ainsi que leur mode de
fonctionnement.
Ostéosynthèse par vis seule
Définition d'une vis en tant que moyen de
synthèse
Une vis est en général utilisée comme
moyen de traction assurant ainsi une compression entre deux fragments
osseux.
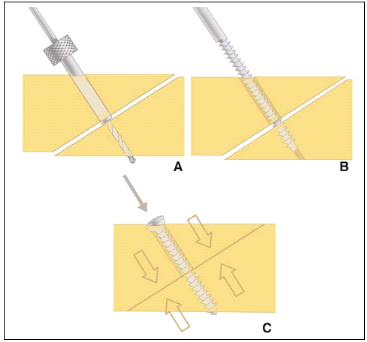
Figure 1. Le trajet de la vis est préparé à
l'aide d'une mèche (A). Un méchage d'un diamètre
légèrement supérieur à celui de la vis dans la
partie proche de la tête de la vis permet d'obtenir une compression
maximale (B, C).
La mise en place d'une vis dans un os nécessite au
préalable d'avoir préparé son trajet par un forage
réalisé au moteur. La mèche utilisée pour le forage
est d'un diamètre légèrement inférieur au
diamètre de la vis. Par exemple, l'utilisation d'une vis corticale d'un
diamètre de 3,5 mm nécessite un forage à l'aide d'une
mèche de 2,7 mm. Cette différence de diamètre permet ainsi
au filetage de la vis de pouvoir s'ancrer dans l'os.
Pour obtenir un effet de compression maximal, le diamètre
de forage doit être légèrement supérieur au
diamètre de la vis du côté de la tête de la vis (Fig.
1A) ; l'ancrage de la vis ne se faisant que dans la partie distale de la vis,
l'effet de traction en est renforcé. Le taraudage permet de créer
un pas de vis dans l'os (Fig. 1B, C). Sa nécessité reste
toutefois controversée [6-8].Il doit être réalisé de
préférence au moteur, sans notion de vitesse
préférentielle [7]. On doit toutefois prendre garde à
utiliser des mèches aiguisées, une mèche
émoussée produisant un échauffement de l'os et un risque
de nécrose osseuse. Certaines vis créent leur propre pas de vis
dans l'os : ce sont des vis autotaraudeuses.
Différents types de vis
Le nom d'une vis est défini par le type de vis et par le
diamètre extérieur du filetage principal. Le nom peut aussi
être défini par la manière dont une vis est
utilisée. Par exemple : une vis de traction peut être une vis
corticale ou une vis spongieuse.Toutes les vis sont disponibles dans
différentes tailles et longueurs.
Vis cor ticale (Fig. 2)
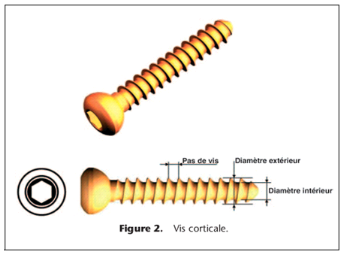
Le pas de vis des vis corticales est conçu pour obtenir
une bonne prise dans l'os cortical. La vis corticale est normalement
utilisée pour comprimer et fixer une plaque à l'os. Elle est en
général filetée sur toute sa longueur, mais peut
également être filetée sur une partie de sa longueur.
Vis spongieuse (Fig. 3)
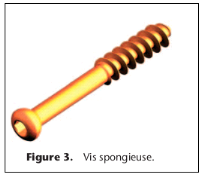
Les vis spongieuses ont un rapport diamètre
extérieur/âme de la vis (diamètre intérieur)
supérieur à celui des vis corticales afin d'avoir une meilleure
tenue dans l'os spongieux. Ce type de vis est surtout utilisé comme vis
de traction pour obtenir unecompression interfragmentaire dans les zones
épiphysométaphysaires. Pour cette raison une vis spongieuse est
normalement une vis dont le filetage est limité à une partie de
la vis. Mais le filetage peut se situer aussi sur toute la longueur de la
vis.
Vis canulées ou per forées
Les vis canulées ont la particularité d'être
creuses afin de permettre le passage en leur centre d'une broche qui sert de
guide. Cette broche permet également une plus grande précision
dans le positionnement de la vis. De plus, la broche est utilisée pour
mesurer la longueur de la vis avec une jauge. Les vis canulées ont pour
la plupart un filetage type spongieux parce qu'elles sont indiquées pour
les zones épiphysométaphysaires.
Vis qui per mettent un placement sous-articulaire
Pour le traitement des fractures ou la réalisation
d'ostéotomies dans les régions périarticulaires,
spécialement dans la main ou le pied, existent différents types
de vis qui permettent un placement sous-articulaire. Ces vis sont aujourd'hui
pour la plupart perforées.

Vis à double pas (type Herber t, Fig. 4). Ces vis
comportentun filetage dont le pas ainsi que le diamètre sont
différents à chaque extrémité. La partie centrale
de la vis est dépour vue de filetage. Le pas de vis conducteur est
supérieur au pas du deuxième filetage. L'insertion de la vis
permet d'obtenir une traction limitée et une compression maximale qui
est définie par la différence du pas entre les deux filetages.
Ces vis ont comme avantage l'enfouissement total de leur
tête elle-même et sont utilisées pour
l'ostéosynthèse en compression des os de petite taille
(scaphoïde, tête radiale, métacarpiens) ou la
réalisation d'ostéotomies (type Scarf). Il a toutefois
été montré que la compression exercée par ces vis
n'excédait pas 0,7 mm en tenant compte d'une force de compression
maximale de 8 Newton.
quelques vis utilisée dans
l'ostéosynthèse


Principe de l'ostéosynthèse par plaque
Définition d'une plaque
Une plaque est un système extramédullaire qui
permet, combiné avec des vis, de stabiliser une fracture jusqu'à
la consolidation de celle-ci. On distingue aujourd'hui principalement deux
types de plaques.
Plaques classiques
Elles sont seulement utilisées avec des vis standards (non
verrouillables). La stabilité obtenue dépend surtout du type de
montage choisi et de la friction obtenue entre plaque et os. Un modelage
précis de l'implant en cours d'inter vention est important.
Dans les plaques on distingue en outre les plaques droites
utilisées surtout dans les diaphyses et les plaques
préformées ou spéciales. Ces plaques sont adaptées
souvent aux zones épiphysométaphysaires. En particulier, les
plaques préformées offrent une stabilité angulaire, et ne
nécessitent plus un modelage précis peropératoire.
Ostéosynthèse classique
Système de fixation
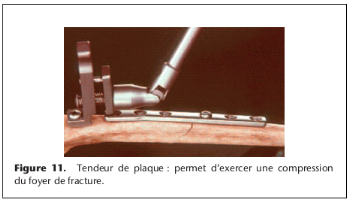
Plaque à trou rond. La plaque à trou rond simple
était la première plaque disponible. Pour obtenir de la
compression interfragmentaire dans les fractures simples, cette plaque
était utilisée avec un tendeur de plaque, comme décrit sur
la Figure 11. Pour cette raison, ainsi que pour des raisons d'ordre technique
et les problèmes rencontrés lors de la mise en application, ce
système n'est plus utilisé en pratique courante.
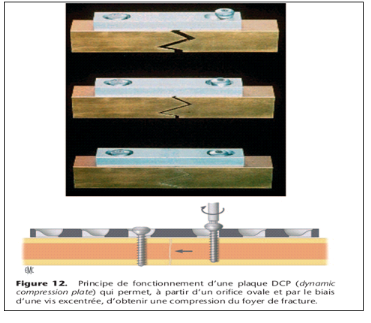
Plaque à trou excentré. Dans les années
1960, à partir des travaux d'Allgöwer [3], le concept de la plaque
à trou excentré dit DCP (dynamic compression plate) a
été introduit. L'avantage de ce type de plaque est qu'on peut
obtenir une compression interfragmentaire avec un simple placement excentrique
de la vis (Fig. 12). De plus, il est possible d'augmenter le débattement
de la vis par rapport à une plaque à trou rond. Ceci est
particulièrement intéressant dans les fractures obliques pour
pouvoir placer une vis orthogonalement par rapport au trait de fracture afin
d'obtenir une plus grande stabilité.
Ostéosynthèse moderne
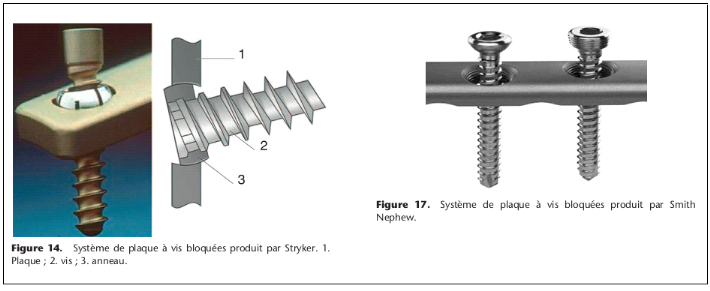
Plaque à vis bloquée
Comme déjà mentionné, la tenue d'une vis
dépend largement de la qualité de l'os. Dans les années
1980 au sein de l'AO des développements ont débuté avec
l'idée de respecter mieux la biologie et d'améliorer la
stabilité [9-11]. L'idée de départ était de faire
une jonction verrouillable entre la plaque et la vis. Mais déjà
en 1886, Hansmann de Hambourg avait publié deux cas
d'ostéosynthèse avec une plaque offrant une stabilité
angulaire limitée [12]. Un autre pionnier est Reinhold de Paris qui a
breveté une plaque avec des vis verrouillées en 1931. Cette
plaque a d'ailleurs été produite industriellement et
commercialisée. D'autres produits plus récents ont
été utilisés dans la reconstruction maxillofaciale et
également pour le traitement des fractures (plaque Zespol [13, 14],
PC-Fix [15]. Pour les fractures diaphysaires simples il n'a pas
été possible de démontrer un avantage comparé
à des plaques conventionnelles). Dans les années 1990, le
développement de plaques verrouillables adaptées pour
l'utilisation dans les zones épiphysométaphysaires a permis de
démontrer la supériorité de ce type d'implant, surtout
dans l'os
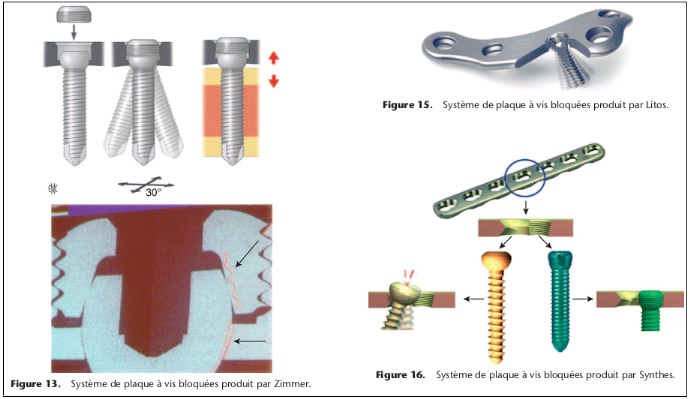
porotique et dans les fractures comminutives [16, 17] .
Domaines d'applications des différents types de
biomatériaux
Les domaines d'application des différents types de
biomatériaux sont très variés comme indiqués
ci-dessous.
Biomatériaux métalliques : Stomatologie
(Implants dentaires) ; chirurgie orthopédie (Implants, prothèses
de hanche...) Cardiologie vasculaire (Simulateur cardiaque, pompe
implantable).
Biomatériaux en céramiques : Stomatologie
(Implants dentaires) ; chirurgie orthopédie (Têtes de
prothèse de hanche, comblement et implants).
Biomatériaux à base de polymères :
ophtalmologie ; odontologie -stomatologie ; chirurgie orthopédie ;
cardiologie vasculaire ; urologie néphrologie ; dermatologie - chirurgie
esthétique.
Problèmes rencontrés selon les classes
des principaux biomatériaux
D'un point de vue de leur dégradation dans le corps
humain, et compte tenu de la multitude des biomatériaux et de leurs
applications, la plupart des problèmes rencontrés (et souvent
encore mal compris et résolus, car ils peuvent entrer en synergie ou en
compétition) sont multiples et variés. Le tableau suivant
répertorie les principaux dommages avérés par retour
clinique.
|
Classe de matériaux
|
Principaux problèmes rencontrés mal
résolus
|
|
Métaux et alliages métalliques
|
- Corrosion électrochimique et durabilité
- Mécanisme de dégradation non
électrochimique incluant les interactions protéine/métal
(biodégradation)
- Réactions immunitaires et
d'hypersensibilité
- Adaptation des propriétés
mécaniques
- Propriétés de frottement et problèmes
de débris
|
|
Céramiques
|
- Mécanismes de dégradation et
durabilité
- Résistance à la fissuration
- Activité de la surface
- Adhésion des protéines ou des cellules en
surface
|
|
Polymères et matière molle
|
- Instabilité au rayonnement gamma
(stérilisation)
- Vieillissement physique et chimique
- Manque de base de données, de standard
- Stabilité hydrolytique
- Effets des enzymes sur la dégradation
|
Conclusion
Pendant de nombreuses années le développement des
biomatériaux a été focalisé sur la synthèse
ou l'utilisation de produits inertes avec l'objectif principal d'une
biotolérance au niveau des sites d'implantation. L'orientation actuelle
est de profiter des progrès considérables du génie
tissulaire pour concevoir et optimiser des systèmes hybrides, associant
des matériaux inertes et des matrices cellulaires vivantes, avec la
perspective d'une amélioration fonctionnelle
déterminante.
Le suivi de la qualité des relations
des nouveaux biomatériaux utilisés en clinique humaine avec leur
environnement anatomique devrait être organisé de manière
à prévoir l'apparition d'effets indésirables,
événements qui doivent être déclarés et
documentés dans le cadre de la
matériovigilance.
Depuis 1994, la loi rend, en effet,
obligatoire la déclaration d'un incident en rapport avec un dispositif
médical tel qu'un biomatériau. En cas d'incident grave, la
Commission Nationale de Matériovigilance, qui dépend du
Ministère de la Santé, instruit une enquête afin
d'élucider les causes de l'incident et de prendre ensuite des mesures
correctives comprenant une modification du dispositif et une meilleure
information des utilisateurs.
Bibliographiques
|
|
[1]
|
ANDERSON JM, MILLER KM Biomaterial
compatibility and the macrophage. Biomaterials 1984 ;
5 : 5-10
|
|
[2]
|
BACO-GRANELL J, AGUIRRE-CANYADELL M, NARDI
J , et al. Malignant fibrous histiocytoma of bone at site
of total hip arthroplasty : a case report. J Bone Joint Surg 1984
; 66A : 30-40
|
|
[3]
|
BARDOS DI. Titanium and titanium alloys. In : Concise
encyclopedia of medical and dental materials. Pergamon press. Oxford. 1990 ; pp
360-365
|
|
[5]
|
BAUER TW, GEESINK RC, ZIMMERMAN R,
McMAHON JT Hydroxyapatite-coated femoral stem. J Bone
Joint Surg 1991 ; 73A : 1439-1452
|
|
[6]
|
BLACK J. Orthopaedic biomaterials in research and practice.
Churchill Livingstone. New York. 1988 ; 394 p
|
|
[7]
|
BLACK J Does corrosion matter ? J Bone
Joint Surg 1988 ; 70-B : 517-520
|
|
[8]
|
BOUTIN P, BLANQUAERT D Le frottement
alumine-alumine en chirurgie de la hanche. 1 205 arthroplasties totales.
Rev Chir Orthop 1981 ; 67 : 279-287
|
|
[9]
|
BOUTIN P, CHRISTEL P, DORLOT JM ,
et al. The use of dense alumina-alumina ceramic combination in total hip
replacement. J Biomed Mater Res 1988 ; 22 :
1203-1232
|
|
[10]
|
BURKE DW, GATES EI, HARRIS WH
Centrifugation as a method of improving tensile and fatigue properties of
acrylic bone cement. J Bone Joint Surg 1984 ; 66A
: 1265-1273
|
|
[11]
|
CARR AJ, MORRIS RW, MURRAY DW, PYNSENT
PB Survival analysis in joint replacement surgery. J Bone
Joint Surg 1993 ; 75B : 178-182
|
|
[12]
|
CHARNLEY J. Low friction arthroplasty. Springer-Verlag. New
York. Berlin. 1979
|
|
[13]
|
CHRISTEL P, CHABOT F, LERAY JL. Biodegradable composites for
internal faxation. In : Winter GD, Gibbons DF, Plenck H eds. Biomaterials. John
Wiley. New York. 1982 ; pp 271-280
|
|
[14]
|
CHRISTEL P, MEUNIER A A histomorphometric
comparison of the muscular tissue reactions to high-density polyethylene in
rats and rabbits. J Biomed Mater Res 1989 ; 23
: 1169-1182
|
|
[15]
|
CHRISTEL P, MEUNIER A, HELLER M, TORRE
JP, PEILLE CN Mechanical properties and short term in vivo
evaluation of yttrium-oxyde-partially-stabilized zirconia. J Biomed
Mater Res 1989 ; 23 : 45-61
|
|
[16]
|
CHRISTEL PS Biocompatibility of surgical-grade
dense polycristalline alumina. Clin Orthop 1992 ;
282 : 10-18
|
|
[17]
|
CLARKE IC, JUNG H, CHONG S, SERBOUSEK J. Mechanical evaluation
of 28 mm ceramic THR balls Bioceramico. Vol 1
|
|
[18]
|
COHEN J. Metal implants : historical background and biological
response to implantation. In : Rubin LR ed. Biomaterials in reconstructive
surgery. CV Mosby. St Louis. 1983 ; pp 49-61
|
|
[19]
|
COOK SD, RENZ BA, BARRACK RL , et
al. Clinical and metallurgical analysis ot retrieved internal fixation
devices. Clin Orthop 1985 ; 194 :
236-247
|
|
[20]
|
COOK SD, THOMAS KA, HARDING AF, COLLINS
CL, HADDAD RJ The in vivo performance of 250 internal
fixation devices : a follow-up study. Biomaterials 1987 ;
8 : 177-184
|
|
[21]
|
COOK SD, THOMAS KA, KAY JF, JARCHO
M Hydroxyapatite coated titanium for orthopedic implant apllications.
Clin Orthop 1988 ; 232 : 225-243
|
|
[22]
|
DAMIEN CJ, PARSONS RUSSEL Bone grafts and
bone grafts substitutes : a review of current technology and applications.
J Appl Biomat 1991 ; 2 : 187-208
|
|
[23]
|
DE LANGE GL, DE PUTTER C, DE WIJS FL
Histological and ultastructural appearance of the hydroxyapatitebone
interface. J Biomed Mater Res 1990 ; 24 :
829-845
|
|
[24]
|
DIGBY JM, WELLS AL Malignant lymphoma
with intranodal refractile particles after insertion of silicone prostheses.
Lancet 1981 ; 2 : 580
|
|
[25]
|
DORLOT JM, CHRISTEL P, MEUNIER A
Wear analysis of retrieved alumina heads and sockets of hip prostheses.
J Biomed Mater Res 1989 ; 23 : 299-310
|
|
[26]
|
DUCHEYNE P, BEIGHT J, CUCKLER JM, EVANS
B, RADIN S Effect of calcium phosphate coating
characteristics on early post-operative bone tissue ingrowth.
Biomaterials 1990 ; 11 : 531-540
|
|
[27]
|
DUCHEYNE P, CUCKLER JM Bioactive ceramic
prosthetic coatings. Clin Orthop 1992 ; 276
: 102-115
|
|
[28]
|
DUCHEYNE P, HENCH LL The processing and
static mechanical properties of metal fiber reinforced bioglass. J Mater
Sci 1982 ; 17 : 595
|
|
[29]
|
DUCHEYNE P, RADIN S, HEUGHEBAERT M,
HEUGHEBAERT JC Calcium phosphate ceramic coatings on porous
titanium : effect of structure and composition on electrophoretic deposition,
vacuum sintering and in vitro dissolution. Biomaterials 1990
; 11 : 244-254
|
|
[30]
|
ELLIES LG, NELSON DG, FEATHERSTONE JD
Crystallographic changes in calcium phosphates during plasma-spraying.
Biomaterials 1992 ; 13 : 313-316
|
|
[31]
|
EYERER P, ELLWANGER R, FEDEROLF HA, KURT M, MADLER H.
Polyethylene. In : Concise encyclopedia of medical and dental materials.
Pergamon press. Oxford. 1990 ; pp 271-280
|
|
[32]
|
FOWLER PJ, JOHNSON PQ. Knee ligament prostheses and
allografts. In : Insall JN ed. Knee surgery. Churchill-Livingstone. New York.
1993 ; pp 561-572
|
|
[33]
|
FRENCH HG, COOK SD, HADDAD RJ
Correlation of tissue reaction to corrosion in osteosynthetic devioes. J
Biomed Mater Res 1984 ; 18 : 817-828
|
|
[34]
|
GAUSSENS G. Les polyéthylènes et leurs
applications en orthopédie. In : Sedel L ed. Biomatériaux en
chirurgie orthopédique. Expansion scientifique française. Paris.
1986 ; pp 33-50
|
[35]. Ministère de la Recherche,
«Biomatériaux et suppléance fonctionnelle».Les
technologies pour la santé. (2005)
[36]. Cambier, «Les céramiques,
biomatériaux de choix pour la réalisation d'implants».
Euroceram News, [5] (2001)
[37]. Hench et al, «Bioactive Materials». Ceramic
International, [22] 493-507. (1996)
[38]. Hench, «Bioceramics». Journal of the American
Ceramic Society, 81 [7] 1705-28. (1998)
[39]: Y.L. Wang, K.Y. Zhang, Surf. Coat. Technol. 140 (2001)
155.
[40]: H.Y. Ha, S.W. Nam, T.H. Lim, I.H. Oh, S.A. Hong, J.
Membr. Sci. 111
(1996) 81.
[41]: L. Hu, T. Yoko, H. Kozuka, S. Sakka, Thin Solid Films
219(1992) 18.
[42] : Michel Munsch, Elaboration Et Etude De
Nanocomposites Adaptables STRASBOURG, JUIN (2001).
[43] Müller ME. Internal fixation for fresh fractures and
for non union. Proc R Soc Med 1963;56 :455-60.
[44] Muller ME, Allgöwer M, Willenegger H. Technique of
internal fixation of fractures. Heidelberg: Springer-Verlag; 1965.

| 

