1-6-2- Folliculogénèse
- Follicule primordial et primaire : le
follicule primordial est constitué d'un ovocyte
de 1er ordre entouré d'une couche de
cellules folliculeuses aplaties. Le follicule primaire est
caractérisé par les cellules folliculeuses devenant cubiques.
- Follicule secondaire : le follicule est
qualifié de secondaire au moment où
l'épithélium
folliculaire devient pluristratifié
formant ainsi la couche granuleuse. En outre, la zone pellucide apparaît
entre l'ovocyte et l'épithélium et au-delà de la membrane
basale, le stroma ovarien se transforme en thèque du follicule.
- Follicule tertiaire : il est
caractérisé par la présence d'une cavité (antrum)
dans la granulosa
et d'une thèque externe, couche fibreuse autour de
la thèque interne. Au terme de son développement, le follicule
est appelé follicule de De Graaf (Le Moigne et Foucrier, 2009).
1-6-3- Ovulation
Le follicule de De Graaf réagit à la
décharge d'hormones gonadotropes aboutissant à la
libération d'un ovule fécondable et permettant la constitution du
corps jaune.
1-6-4 -Corps jaune
Après l'expulsion de l'ovocyte, les trois couches de la
paroi folliculaire se réorganisent pour former une glande endocrine ; le
corps jaune. Il deviendra fonctionnel vers le sixième jour post
ovulatoire. En l'absence de fécondation, il régresse juste avant
les menstruations (Turpin, 1995).
1-6-5- Physiologie ovarienne
L'ovaire a une double fonction, exocrine (maturation et
émission cyclique de l'ovocyte) et endocrine (imprégnation
hormonale oestroprogestative de l'appareil génital féminin), sous
le contrôle des gonadotrophines hypophysaires : l'hormone
folliculostimulante (FSH) et l'hormone lutéinisante (LH) (Gougeon,
2008).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
9
L'activité ovarienne au cours du cycle comporte quatre
phases : la phase menstruelle qui marque le début de chaque cycle, la
phase folliculaire, la phase ovulatoire et la phase lutéale. La phase
folliculaire, qui dure de 12 à 16 jours, est marquée par le
recrutement d'un follicule primordial que sa maturation conduit à
devenir un follicule ovulatoire. Ce processus de recrutement se fait par le
passage du stade de follicule primordial à celui de follicule primaire,
puis se fait le passage au stade de follicule secondaire, le follicule continue
sa croissance inévitablement jusqu'à ce qu'il soit détruit
par atrésie ou qu'il ait ovulé. Les cinq stades ultérieurs
comportent la transformation en follicules préantraux de classe 1
marqués par l'apparition de cellules thécales. 70% de ces
follicules préantraux vont évoluer vers les stades
ultérieurs, passant par le stade de follicule antral débutant de
classe 2, puis de classe 3 et 4. Le passage de la classe 4 à la classe 5
a lieu pendant la phase lutéale du cycle précédent
l'ovulation, n'impliquant que des follicules prêts (qui dure jusqu'au
dernier jour du cycle ovarien). L'ovulation est caractérisée par
l'expulsion de l'ovocyte, ce qui suppose le développement d'une
activité protéolytique altérant la membrane basale et la
rupture des différentes couches de la thèque. Elle a
été précédée par un pic de l'LH lié
à l'augmentation rapide de l'oestradiol, durant 48 heures (Gougeon,
2008).
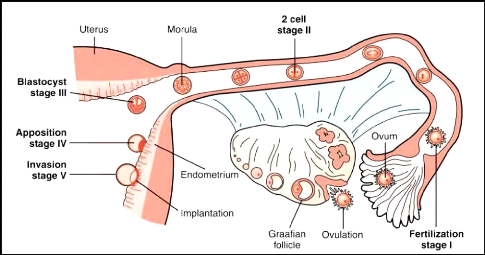
2- Les étapes d'implantation embryonnaire 2-1 - La
fécondation
La rencontre entre le spermatozoïde et l'ovocyte est
l'une des étapes essentielles de la reproduction. Elle nécessite
un ovocyte et un spermatozoïde tous deux compétents. Elle se
déroule généralement au tiers moyen supérieur de la
trompe de Fallope. Lors de la fécondation, le spermatozoïde entre
en contact avec la zone pellucide entourant l'ovocyte, cette zone pellucide
sert de barrière empêchant la polyspermie. La première
division a lieu très rapidement (durant les 24 premières heures)
et se déroule toujours dans la trompe. L'embryon n'atteint
l'utérus que durant le 5ème jour de son
développement. Il reste entouré des cellules de la corona
radiata jusqu'au stade blastocyste (Gridelet, 2015) (figure 04).
2-2- Division cellulaire (segmentation)
Les facteurs maternels précoces jouent un rôle
primordial durant le début du développement embryonnaire.
L'ovocyte supporte les premières divisions du zygote et fournit le
matériel protéique nécessaire jusqu'au stade 4-8 cellules.
Il apporte la grande majorité du cytoplasme et des composants
nucléaires de l'embryon. Les cellules embryonnaires, aussi
appelées blastomères, sont flexibles et totipotentes, autrement
dit, elles sont capables en se développant et en se multipliant de
donner tous les types cellulaires du corps humain (De Paepe et al.,
2014).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
Figure 04 : Les étapes de la
fécondation (Strauss et Lessey, 2009).
2-3- Le blastocyste
Au stade blastocyste, l'embryon sort de la zone pellucide qui
l'entoure et ses cellules s'organisent, pour la première fois, en deux
types cellulaires différenciés, le premier, appelé
trophoblaste, qui forme une couche unicellulaire et forme le pourtour du
blastocyste, le second type forme la masse cellulaire interne cellules qui
donnent le futur foetus. Le trophoblaste est à l'origine du chorion qui
forme le placenta et la séparation entre l'embryon et les cellules
maternelles (De Paepe et al., 2013) (figure 05).
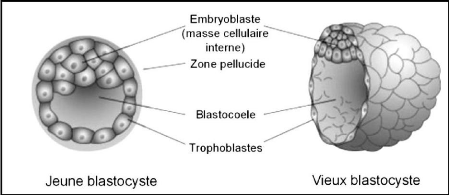
Figure 05 : Jeune vs vieux
blastocyste (Moore et Persaud, 2003).
10
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
11
2-4- Implantation embryonnaire
Le succès de l'implantation embryonnaire n'est pas
uniquement une préparation hormonale adéquate de
l'endomètre mais nécessite une interaction étroite,
synchronisée et réciproque entre les différentes cellules
de l'endomètre et l'embryon. C'est ce qui est appelé dialogue
materno-foetal durant la phase d'implantation. Ce dialogue s'établit
grâce à de nombreuses cytokines, facteurs de croissance,
chimiokines, récepteurs et molécules d'adhésion produits
et sécrétés par l'endomètre et par l'embryon
(Thouas et al., 2014). La plupart des grossesses biochimiques, qui
sont définies par l'incapacité de l'embryon à ce
développer correctement, et les fausses couches spontanées,
approximativement deux tiers, sont dues à une implantation
incomplète de l'embryon (Norwitz et al., 2000).
L'éclosion embryonnaire permet un contact direct avec les cellules
épithéliales de l'endomètre. Ce contact est appelé
phase d'apposition. Durant cette phase, de véritables contacts
dynamiques ont lieu entre le blastocyste et l'endomètre via des
molécules d'adhésion et des récepteurs :
- L'interleukine-1 (l'IL-1) :
sécrété par le blastocyste, elle augmente
l'expression d'intégrines
à la surface de l'endomètre
lui permettant d'interagir avec l'embryon.
- La mucine MUC-1 :
l'épithélium est recouvert sur toute sa surface
épithéliale de glycocalyx,
expliquant en partie sa nature non adhésive. Au niveau
du site d'implantation, une diminution de l'expression des mucines
(principalement de MUC-1) à la surface des cellules
épithéliales endométriales est observée et serait
impliquée dans le positionnement du blastocyste. (Brayman et
al., 2004).
- L'expression de selectines à la surface du blastocyste
ainsi que celles de sélectines
complémentaires à la surface de
l'épithélium endométrial durant la phase réceptive
(Genbacev et al., 2003).
Après la phase d'apposition vient la phase
d'adhésion, durant laquelle l'embryon et l'endomètre ont des
contacts plus précis via des molécules d'adhésion (et
principalement des intégrines). Le trophoblaste se sépare en deux
types cellulaires distincts : le syncytiotrophoblaste et le cytotrophoblaste
(Gridelet, 2015).
Le syncytiotrophoblaste forme la couche extérieure des
futures annexes embryonnaires qui est en contact avec les cellules
épithéliales de l'endomètre et la lumière de la
cavité utérine. Le cytotrophoblaste forme une couche interne qui
est en contact avec la masse cellulaire interne et le blastocoele. Le
syncytiotrophoblaste sécrète des enzymes lytiques et des facteurs
déclenchant l'apoptose des cellules épithéliales de
l'endomètre pour permettre l'invasion de l'embryon au sein de
l'endomètre qui correspond à la dernière phase de
l'implantation (Gridelet, 2015).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
12
L'invasion du blastocyste dans l'endomètre commence par
la liaison des cellules du syncytiotrophoblaste aux constituants de la membrane
basale et de la matrice extracellulaire de l'endomètre via les
intégrines. Le trophoblaste envahit ensuite le stroma conjonctif
sous-épithélial suite à une décomposition des
composants de la membrane basale et de la matrice extracellulaire. Cette
décomposition est liée à l'activation de
métalloprotéases (figure 06).
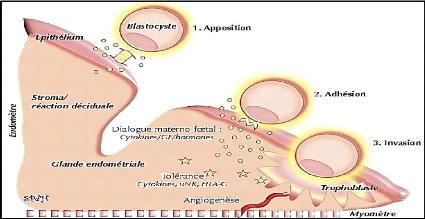
Figure 06 : Les phases d'implantation
embryonnaire (D'Hauterive, 2010).
L'endomètre joue donc un rôle important par
l'expression de protéines d'ancrage et par sa modification en
décidue lors de l'implantation. La placentation débute
après l'enfouissement total de l'embryon au sein de l'endomètre
et le placenta se forme suite à l'apparition de villosités dans
le trophoblaste (Gellersen al., 2007).
2-5 -Molécules et cellules importantes dans le
dialogue materno-foetal
À côté des molécules
d'adhésion qui représentent la « partie visible » du
dialogue existant entre le blastocyste et l'épithélium
endométrial, toute une série de molécules et de cellules
sont impliquées dans la régulation de l'implantation.
2-5-1- L'hCG
L'hormone chorionique gonadotrope (hCG) est une hormone
glycoprotéique de 36 à 40 kDa. Elle est composée de deux
sous-unités (á et â) liées par une liaison non
covalente. La sous-unité á, composée de 92 acides
aminés, est codée dans le chromosome 6 et est commune aux
différentes hormones de la famille des glycoprotéines dont font
partie la LH, la FSH et l'hormone thyréostimuline (TSH) (Policastro
et al., 1986).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
13
La sous-unité f3, qui est différente pour chaque
hormone, est codée sur différents gènes situés sur
le chromosome 19 (LH, hCG et TSH) ou sur le chromosome 11 (FSH). La
sous-unité f3 de l'hCG est codée dans 6 gènes
différents mais très similaires situés dans un groupe de
gènes sur le chromosome 19. L'hCG a une structure similaire à la
LH, mais contrairement à elle, l'hCG existe sous plusieurs formes,
connues comme l'hCG classique, l'hCG hyper-glycosylée et l'unité
f3 libre de l'hCG hyper-glycosylée (Cole, 2009 ; Fournier et
al., 2015). Chacune de ces 4 molécules ont des fonctions
physiologiques différentes.
Cette hormone a été appelée hormone
chorionique gonadotrope. La stimulation de la production de la
progestérone par le corps jaune a été longtemps la seule
fonction connue de l'hCG. La glycosylation des hormones aurait une influence
directe sur leur bioactivité. L'hCG hyper-glycosylée
interviendrait davantage dans l'implantation que l'hCG classique (Cole, 2009).
Trois équipes indépendantes ont montré que le blastocyste
pré-implantatoire sécrète l'hCG dans l'espace
utérin qui se lie à son récepteur hCGR sur la surface
déciduale. En réponse, la décidue se prépare pour
l'implantation (Srisuparp et al., 2001 ; D'Hauterive et al.,
2004). L'hCG augmente la sécrétion du Leukemia Inhibitory Factor
(LIF) et diminue celle de l'interleukine 6 par les cellules
endométriales, molécules connues pour leur influence sur
l'implantation embryonnaire (D'Hauterive et al., 2004). Il favorise la
différenciation des cytotrophoblastes en synciotiotrophoblastes. Il peut
réguler la synthèse des prostaglandines et la formation de
l'Adénosine monophosphate cyclique (AMPc). Une étude
publiée en 2013 a montré que les différentes formes d'hCG
stimuleraient l'invasion trophoblastique indépendamment du
récepteur classique à l'hCG, le LHCGR (Lee et al.,
2013). L'hCG a également des actions angiogéniques et
immunologiques, il augmente la formation des vaisseaux sanguins et la migration
et la maturation des péricytes (Berndt et al., 2006 ; Bourdiec
et al., 2013). L'hCG assure au placenta un approvisionnement en sang
maternel adéquat durant son invasion de l'endomètre fonctionnel
avec une nutrition optimale du foetus. L'hCG régule la
prolifération des cellules Natural killer utérines (uNK) (Bansal
et al., 2012). Ces cellules n'expriment pas le LHCGR et l'hCG agirait
directement sur ces cellules par un autre récepteur, le mannose
récepteur qui est exprimé par les uNK (Kane et al.,
2009). L'hCG agit également sur d'autres cellules immunitaires, les
monocytes, en promouvant leur fonction et leur sécrétion d'IL-8
(Kosaka et al., 2002), et aussi induisant les fonctions des
macrophages (Wan et al., 2007). En stimulant la fonction des
macrophages, l'hCG assainit l'endomètre en l'épurant des cellules
apoptotiques et en le défendant d'éventuelles infections, deux
mécanismes importants pour le maintien de la grossesse. Par ailleurs,
l'hCG influence la différentiation et la fonction des cellules
dendritiques, diminuant leur capacité à stimuler la
prolifération des LT (Wan et al., 2008).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
14
Au niveau des cellules nucléaires du sang
périphériques, l'hCG induit la sécrétion de
différentes cytokines, dont l'IL-1â et LIF et pourrait stimuler
l'invasion trophoblastique (Yu et al., 2015).
Finalement, l'hCG a différents effets sur les
lymphocytes T (Cluster de Différenciation CD4+), avec un impact positif
sur la prolifération des cellules T CD4+25+ et en attirant ces cellules
vers l'endomètre en début de grossesse (Khil et al.,
2007 ; Schumacher et al., 2009). Des études récentes
montrent par ailleurs qu'une trop grande quantité d'hCG, telle
qu'utilisée en Procréation Médicalement Assistée
(PMA) pour déclencher l'ovulation, serait délétère
pour la réceptivité utérine, tout est une question
d'équilibre (Evans et Salamonsen, 2013).
2-5-2- La LH
La LH est sécrétée par la glande
pituitaire et est une glycoprotéine hétérodimérique
avec une masse moléculaire de 28kDa comprenant deux sous-unités.
Cette hormone a un rôle essentiel dans la reproduction en induisant la
maturation ovocytaire et en provoquant l'ovulation durant le cycle menstruel.
La LH contrôle la production de la progestérone par le corps jaune
et si une grossesse survient chez l'être humain, l'hCG
sécrétée par les cellules embryonnaires supplante le
rôle de la LH pour la régulation de la production de la
progestérone. Pour l'établissement de la grossesse, la LH
favorise la décidualisation de l'endomètre. Des scientifiques ont
exploré les propriétés d'adhésion des lymphocytes
dans l'utérus murin et ont révélé que cette
adhésion était plus grande en présence de LH. Ces auteurs
ont suggéré que la LH pourrait activer les molécules
d'adhésion à la surface des précurseurs des cellules uNK,
ainsi qu'augmenter leur recrutement dans l'utérus. Ils suggèrent
encore que la LH pourrait avoir un impact sur le recrutement des cellules uNK
(Van Den Heuvel et al., 2005).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
15
3- Développement embryonnaire et grossesse 3-1- La
période embryonnaire
La période embryonnaire va de la quatrième
à la huitième semaine du développement, et au cours de
laquelle la gastrulation à lieu (Le Moigne et Foucrier, 2009).
3-1-1- La gastrulation
C'est la période de développement au cours de
laquelle se mettent en place les 3 feuillets primitifs de l'embryon, à
l'origine de tous les organes/tissus du nouveau-né et de l'adulte :
- Ectoderme ou ectoblaste, feuillet superficiel.
- Mésoderme ou mésoblaste, feuillet moyen.
- Endoderme ou endoblaste, feuillet inférieur (Bourenane,
2011).
Le domaine latéral forme l'ectoderme de surface,
précurseur de l'épiderme. L'endoderme qui donne naissance
à l'épithélium de surface des muqueuses digestive et
respiratoire ainsi qu'à l'épithélium glandulaire de
nombreuses glandes annexées à ces tractus. Les cellules
endothéliales des futurs vaisseaux sanguins de l'embryon dérivent
du mésoderme (Catala, 2002).
3-1-2- La neurulation
La neurulation primaire est la transformation de l'ectoderme
de la région sus-chordale en un tube neural primitif. La neurulation
secondaire, par opposition à la neurulation primaire, concerne le
développement de la partie terminale de la moelle
épinière. Rappelons que la ligne primitive produit avant de
disparaître (29ème jour), une structure
mésoblastique qui persiste et qui s'appelle l'éminence caudale.
Cette dernière sera à l'origine de la partie caudale du tube
neural et de l'élongation de la moelle épinière (Lowery et
Sive, 2004).
3-1-3- La métamérisation
Le mésoblaste para-axial est constitué de
cellules épiblastiques s'invaginant depuis le noeud primitif et depuis
la partie crâniale de la ligne primitive. Il forme une paire de
condensations cylindriques au contact immédiat de la notochorde.
Dès le début de la troisième semaine, ces cylindres vont
être segmentés en somitomères
(métamérisation) cranio-caudale. Les somitomères sont
constitués d'amas de cellules mésoblastiques prismatiques
pluristratifiés enroulés autour d'un axe central. C'est à
partir de ces somites que vont développer les 33 vertèbres de la
colonne vertébrale et les muscles squelettiques correspondants
(Lopez-Sanchez et al., 2001).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
16
3-2- Évolution définitive des
feuillets
Pendant le 2ème mois a lieu
l'organogénèse : les principaux organes se forment entre la
4ème et 8ème semaine. L'embryon de 8 semaines a des
membres, une face, des oreilles, un nez, des yeux, son coeur est
cloisonné, sa gonade différenciée. Son cerveau, son
estomac, son foie, ses reins sont fonctionnels. Durant la période
foetale, les organes qui se sont développés durant la
période embryonnaire (organogénèse) croissent et se
différencient. On estime que 90% des 4500 structures
répertoriées chez l'adulte apparaissent à l'état
d'ébauches déjà durant la période embryonnaire.
Dès la 8ème semaine, le foetus prend des allures
typiquement humaines, bien qu'à la fin du premier trimestre la
tête soit toujours proportionnellement plus grande. Les yeux en revanche
se déplacent vers l'avant, et tant le pavillon de l'oreille que la
crête du nez sont déjà formés. Il en va de
même pour les paupières qui sont nettement reconnaissables. Sur le
corps se développe le lanugo qui est un duvet très fin qui couvre
tout le corps du foetus, à l'exception des paumes des mains et des
plantes des pieds, et qui apparait dès la 18ème
semaine de grossesse. Ce duvet sera remplacé peu avant l'accouchement
par des cheveux terminaux (Moore et al., 2018).
4- Modifications physiologiques durant la
grossesse
La grossesse se caractérise par d'importants
ajustements physiologiques de tous les systèmes. Ces nouvelles
caractéristiques ne sont pas toujours à l'avantage de la
mère : elles permettent vraisemblablement une efficacité maximale
de la croissance et du métabolisme du foetus. Le foetus, par
l'intermédiaire des hormones placentaires déversées dans
la circulation maternelle, manipule les mécanismes homéostatiques
de la mère. Un grand nombre de modifications apparaissent tôt au
cours de la grossesse, anticipant les demandes métaboliques du foetus.
Il est utile de savoir quels paramètres biologiques sont
perturbés pour ne pas faire d'examens inutiles car
ininterprétables et pour ne pas les considérer comme
pathologiques et traiter à tort (Le Moigne et Foucrier, 2009).
4-1- Modification cardiovasculaires
Au cours du 1ier et 2ème
trimestre, les changements hémodynamiques apparaissent dès la
6ème semaine d'aménorrhée et sont
caractérisés par une augmentation du débit cardiaque
associé à une baisse des Résistances Vasculaires
Systémiques (RVS) et pulmonaires et une augmentation du volume
d'éjection systolique. Cette baisse d'RVS par la sécrétion
de la progestérone et d'autres facteurs qui est à l'origine de
cet état d'hyperdynamisme circulatoire. La baisse de la pression
artérielle stimule la sécrétion de la vasopressine,
l'hyper-débit est dû à l'augmentation de la volémie
qui est l'expression de la rétention hydrosodée par les
oestrogènes et de l'augmentation de la sécrétion
d'aldostérone puis à la tachycardie (Cabrol et al.,
2003, Thoulon, 2005).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
17
En parallèle, la progestérone permet
l'adaptation vasculaire à cette hypervolémie par un
relâchement des parois veineuses et des sphincters capillaires en
augmentant la capacité du lit vasculaire (Cabrol et al., 2003,
Thoulon, 2005).
Le coeur subit des modifications structurales semblables au
coeur d'un sportif de haut niveau. La taille des quatre cavités et
surtout de l'oreillette droite augmente dès la fin du premier trimestre.
Une hypertrophie ventriculaire gauche est également remarqué, et
une augmentation du diamètre des anneaux valvulaires pulmonaires et
tricuspides (Campos, 1993 ; Le Moigne et Foucrier, 2009).
4-2- Modifications endocrines 4-2-1- La
thyroïde
La TSH plasmatique diminue quand il y a le pic d'hCG
placentaire puis augmente en restant dans la normale. Il existe une
possibilité de goitre maternel par carence iodée car : il y a une
augmentation de la filtration glomérulaire et de l'excrétion
rénale d'iode, ou il y a des pertes d'iode au niveau du complexe
foeto-placentaire en fin de grossesse. L'hypertrophie de la glande est un
mécanisme compensateur, afin de maintenir la production hormonale.
L'hyper-oestrogènie entraîne un taux plus que doublé de la
protéine de transport, la Thyroxin Binding Protein (TBG) pendant la
grossesse. L'augmentation de la TBG accroît la liaison de thyroxine (T4)
et de triiodothyronine (T3). La production hormonale thyroïdienne augmente
d'au moins 40% dès le 1er mois, et atteint le seuil de 75% au
3ème mois. Il en résulte une augmentation de la
concentration de la T4 totale et à un moindre degré de la T3
totale proche de 1,5 fois la normale, apparaissant dès le début
de grossesse (Letombe, 2012).
4-2-2 La parathyroïde
Les modifications maternelles du métabolisme
phosphocalcique au cours de la grossesse sont importantes. Elles sont
principalement liées à la minéralisation rapide du
squelette foetal, une augmentation de l'absorption intestinale du calcium, une
diminution de l'excrétion rénale de calcium, une augmentation des
stocks calciques du squelette, une phosphoremie diminue jusqu'à la
30ème semaine d'aménorrhée, puis augmente
jusqu'au terme de la grossesse (Cabrol et al., 2003 ; Thoulon,
2005).
4-2-3- L'hypophyse
Le taux de prolactine sérique monte progressivement
pour être 5 à 10 fois plus élevé en fin de
grossesse. Plus sa production augmente, plus celles de FSH et de LH (qui sont
bas pendant la grossesse) diminuent. L'ocytocine augmente en cours de
grossesse, pour atteindre 165 ìg/ml.
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
18
Son rôle dans le déclenchement physiologique du
travail est discuté, sa sécrétion pendant le travail est
périodique et brève, et la fréquence des pics augmente au
fur et à mesure que le travail avance. L'ocytocine aurait un rôle
régulateur, mais non inducteur dans le déclenchement du travail
(Cabrol et al., 2003 ; Thoulon, 2005).
La progestérone collabore avec les oestrogènes
pour préparer l'endomètre à la nidation de l'ovule
fécondé. Un taux élevé de progestérone
inhibe également la libération de l'hormone de libération
des gonadotrophines hypophysaires (GNRH) et de prolactine. Lorsque la
concentration de progestérone baisse durant la grossesse ou que son
action est inhibée, une menstruation est déclenchée et
l'embryon est évacué en même temps que le revêtement
(Diaby, 2006).
4-2-4- La glande surrénale
L'unité foeto-placentaire sécrète une
grande quantité d'hormones stéroïdes ou peptidiques qui
modifient le fonctionnement des glandes endocriniennes maternelles. Les
stéroïdes sexuels augmentent oestrogènes,
progestérones et androgènes (élevés au
1ier trimestre et atteint leur maximum vers la
32ème SA), ainsi que l'hormone placentaire lactogène.
La synthèse des stéroïdes s'effectue à la fois dans
les surrénales maternelles et foetales. Le placenta ne synthétise
pas les stéroïdes, mais il joue un rôle important dans leur
métabolisme. Les catécholamines sont peu modifiées sauf
l'adrénaline et la noradrénaline qui diminuent. Le cortisol
plasmatique double dès le début de la grossesse. Mais, la
fraction libre restant stable, il n'y a pas de trouble clinique.
L'aldostérone (minéralo-corticoïdes) augmente
également car le système
rénine-angiotensine-aldostérone est stimulé pendant la
grossesse. Ce système est régulé par la volémie, la
natrémie et la kaliémie. La sécrétion est fortement
stimulée lors de l'accouchement (Cabrol et al., 2003 ; Thoulon,
2005).
4-3- Modification du métabolisme
glucidique
Au cours du 1ier et 2ème
trimestre, les métabolismes sont modifiés pour faire face aux
exigences du développement de l'oeuf et de ses annexes. Le
métabolisme de base augmente de 15 à 30% surtout, la prise de
poids est continue. Elle répond au développement de l'oeuf, de
l'utérus, des glandes mammaires, de l'eau et des électrolytes et
des réserves stockées. Le métabolisme glucidique est le
plus précocement et le plus profondément modifié pour
répondre aux besoins énergétiques. La prédominance
habituelle de l'hyper-insulinémie, en début de grossesse sera
responsable des hypoglycémies avec baisse de la tension
artérielle, le plus souvent associées à des fringales et
surtout à une acétonémie apparaissant au lever et se
traduisant par les nausées et les vomissements gravidiques classiques
(Catov et al., 2007).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
19
Au cours du 3ème trimestre, la croissance du
foetus devient exponentielle et ses besoins nutritionnels augmentent. Pour
s'adapter à cette nouvelle configuration, le métabolisme maternel
est réorienté vers un catabolisme : la progestérone, le
cortisol, les prolactines et la leptine induisent une diminution de la
réponse à l'insuline ayant pour conséquence une
augmentation des concentrations plasmatiques en acides gras libres et en
glycérol. Il en résulte une plus grande concentration de
nutriments maternels disponibles pouvant traverser le placenta et atteindre le
foetus (Catov et al., 2007).
4-4- Modifications hématologiques
Dès le 3ème mois de grossesse, la
masse sanguine augmente de façon précoce et progressive au cours
de la grossesse, avec une augmentation importante du volume plasmatique (+ 40%)
et dans une moindre mesure du volume globulaire (+ 15%). L'augmentation du
volume plasmatique n'est pas compensée par l'augmentation de
l'érythropoïèse, ce qui aboutit à une fausse
anémie par hémodilution. L'augmentation de
l'érythropoïèse nécessite un apport accru en fer et
en acide folique. La ferritine diminue au cours de grossesse (-35% au
3ème trimestre) du fait de la consommation foeto-placentaire.
L'hyperleucocytose, essentiellement à polynucléaires
neutrophiles, débute dès le 1ier trimestre et
s'accentue en fin de grossesse. Le taux des ions sodium (Na+),
potassium (K+) et chlore (Cl-) restent à peu
près stables, le calcium (Ca++) et le magnésium
(Mg++) diminuent à cause du transfert de ces
électrolytes de la mère au foetus et de l'augmentation de leur
filtration glomérulaire. La diminution du Ca++ entraine la
stimulation de la parathormone (Cabrol et al., 2003, Thoulon,
2005).
4-5- Modifications des fonctions
rénales
La grossesse normale entraîne des modifications
physiologiques de la fonction rénale et des compartiments liquidiens de
l'organisme.
- Augmentation du débit de filtration
glomérulaire (DFG) de 30 à 50% au cours
de la grossesse : elle
débute dès la 6ème SA, est maximale aux
2ème et 3ème trimestres puis diminue
à partir de la 36ème SA.
- L'augmentation du DFG s'explique par la forte augmentation
du flux plasmatique rénal,
auquel s'associent une diminution
précoce de l'albumine plasmatique et la diminution de la pression
oncotique (Le Moigne et Foucrier, 2009).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
20
- Augmentation de l'excrétion urinaire de sucres
réducteurs, de nombreux acides aminés
et de protéines, l'excrétion d'autres sucres
(lactose, fructose, xylose) est également augmentée pendant la
grossesse et une lactosurie est présente chez 50% des femmes enceintes
à terme. Il existe une protéinurie physiologique, pouvant aller
jusqu'à 300 mg/ 24 heures.
- L'augmentation de l'eau totale est de l'ordre de 7,5 kg. La
majeure partie de cette eau
est intracellulaire, mais il existe une
expansion associée des volumes extracellulaires. Le volume plasmatique
augmente de 50% pendant la grossesse. Cette hypervolémie est
perçue comme normale par les récepteurs volémiques
d'où l'inutilité des diurétiques ou de la restriction
sodée.
- L'osmolarité plasmatique diminue du fait de la
baisse de l'urée sanguine, une baisse modérée
de la
natrémie et une diminution du seuil osmotique de la soif (Letombe et
al., 2012; Pierre et al., 2009).
4-6- Modifications respiratoires 4-6-1- Modifications
anatomiques
Certaines modifications surviennent dès la
10ième à la 12ième SA,
c'est-à-dire bien avant que l'utérus refoule le diaphragme : les
cotes inferieures s'évasent, l'angle xiphoïdien passe de 70°
à 105°, le niveau du diaphragme s'élève de 4 cm, le
diamètre antéro-postérieur du thorax augmente de 2
à 3 cm. Il existe aussi une hypotonie des muscles abdominaux ainsi
qu'une congestion de l'arbre respiratoire (Cabrol et al., 2003,
Thoulon, 2005).
4-6-2- Modifications fonctionnelles
Il y a une augmentation du débit sanguin pulmonaire et
une augmentation de la captation de l'oxygène par minute. L'augmentation
des besoins en oxygène (pour le foetus et le placenta) est de 20
à 30%. L'élévation du taux de progestérone entraine
une augmentation du débit respiratoire avec une augmentation de la
ventilation alvéolaire d'où une hyperventilation qui entraine une
hypocapnie et une légère alcalose respiratoire. L'augmentation de
l'élimination du dioxyde de carbone (CO2) entraine une baisse de la
pression CO2 artériel. Il y a donc une polypnée et une hypocapnie
maternelles avec une tendance à l'alcalose respiratoire. Le potentiel
d'H+ (pH) reste cependant normal car il y a une augmentation de
l'excrétion rénale des bicarbonates et une diminution de leur
réabsorption. L'ensemble de ces phénomènes expliquent que
de nombreuses femmes enceintes se sentent facilement essoufflées (Cabrol
et al., 2003, Thoulon, 2005).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
21
4-7- Modifications hépatiques
Au niveau de la vésicule biliaire, la
progestérone entraine une hypotonie et donc une stase
vésiculaire. La vidange est donc ralentie. En parallèle, sous
l'effet des oestrogènes, la concentration en cholestérol est
accrue, augmentant l'indice de lithogénicité de la bile. Ces 2
phénomènes font que le risque de lithiase biliaire est
augmenté. Au 3ème trimestre, le foie n'est pas
palpable car il est refoulé par l'utérus en haut, à droite
et en arrière. Son volume est inchangé. Les conséquences
biologiques de ces modifications, surtout en fin de grossesse, sont multiples :
une augmentation des phosphatases alcalines de 2 à 15 fois la normale,
une augmentation des lipides et du fibrinogène ainsi qu'une diminution
de l'albumine, de la bilirubine et de la créatinine (Le Moigne et
Foucrier, 2009).
4-8- Modifications de la coagulation
La grossesse normale s'accompagne d'un état
d'hypercoagulabilité avec une augmentation du fibrinogène et des
facteurs VII, VIII et X, une diminution de l'activité fibrinolytique de
la protéine S. Une interprétation finaliste serait de
considérer la protection contre l'hémorragie du post-partum, au
prix du risque de thrombose.
- Facteurs de coagulation : les taux d'un
grand nombre d'entre eux (comme le fibrinogène
et le facteur VII
coagulant) augmentent considérablement dès le
3ème mois de grossesse pour atteindre un taux maximum au
3ème trimestre, mais les taux des facteurs XIII et XI
diminuent jusqu'à 50%.
- Activité fibrinolytique : elle
diminue progressivement au cours de la grossesse,
puis se normalise
rapidement après l'accouchement.
- La protéine S : sous sa forme
totale et libre diminue fortement en cours de grossesse
(Letombe et
al., 2012; Pierre et al., 2009).
4-9-Modifications immunitaires
Pour l'immunité humoral, la synthèse des
immunoglobulines (Ig) commence tôt complétant ainsi par le passage
transplacentaire de ces Ig l'arsenal immunologique du foetus. Par rapport
à la réponse immunitaire de type cellulaire, elle peut apparaitre
dès la 20ème semaine d'aménorrhée. En
effet, la grossesse constitue un paradoxe immunologique qui a permet la
formulation de plusieurs hypothèses afin de comprendre ce
mécanisme de tolérance de la greffe que constitue le foetus.
Parmi lesquelles, une hypothèse qui s'appuie sur le fait que le foetus
ne développe pas une maturité antigénique ne peut pas
être retenue car les antigènes apparaissent précocement
à la surface des cellules pendant la vie embryonnaire (Cabrol et
al., 2003 ; Bruyére et al., 2014).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
22
Une autre hypothèse qui consolide l'absence de la
réponse maternelle ou l'inaptitude de la mère à se
sensibiliser vis-à-vis des allo antigènes d'origine foetale ne
peut également être retenue comme hypothèse car cette
sensibilisation existe pour les antigènes du système ABO et du
système HLA (Human Leukocyte Antigen) (Poncelet et Sifer, 2011 ;
Bruyére et al., 2014).
5- Physiopathologie de la reproduction chez l'être
humain
L'infertilité est depuis plusieurs années,
considérée par l'organisation mondial de la santé comme
une pathologie à part entière, dans le cadre du concept de
santé reproductive qui reconnait à chaque être humain le
droit à la procréation (Poncelet et al., 2011). L'OMS
fournit diverses définitions pour l'infertilité. Certaines
définitions ont un caractère clinique, alors que d'autres ont
été élaborées dans des contextes
démographiques ou épidémiologiques (OMS, 2013).
Deux exemples d'une définition clinique de
l'infertilité de l'OMS :
- « Infertility is a disease of the reproductive system
defined by the failure to achieve
a clinical pregnancy after 12 months or more of regular
unprotected sexual intercourse ».
- « Infertility is the inability of a sexually
active, non-contracepting couple to achieve
pregnancy in one year »
(OMC, 2013c).
Les définitions démographiques ont pour but de
refléter les changements démographiques au sein d'une population
ainsi que les différences de fécondité entre diverses
populations (Gurunath et al., 2011 ; Poncelet et Sifer, 2011).
- « An inability to become pregnant with a live birth,
within five years of exposure based upon
a consistent union status, lack of contraceptive use,
non-lactating and maintaining a desire for a child » (OMC, 2013c).
Les définitions épidémiologiques se
rapportent la prévalence de l'infertilité médicale au sein
d'une population donnée. Ainsi, la mesure privilégiée est
l'absence de grossesse. L'exposition au risque de devenir enceinte doit
être prise en compte, bien qu'il soit défini de façon
variable d'une étude à l'autre (Gurunath et al.,
2011).
- « Women of reproductive age (15-49 years) at risk of
becoming pregnant (not pregnant, sexually active, not using contraception and
not lactating) who report trying unsuccessfully for a pregnancy for two years
or more » (OMC, 2013c).
Chapitre I Physiologie et physiopathologie de la
reproduction chez l'humain
23
Malgré les variations de termes et de
définitions de l'infertilité, certains auteurs ont
signifié que l'infertilité correspondait davantage à la
définition de l'incapacité plutôt qu'à celle de la
maladie. Puisqu'une personne présentant une infertilité
idiopathique peut-être en parfaite santé physique et
émotionnelle malgré l'échec de la reproduction. En effet,
l'infertilité peut être causée par une maladie telle que
l'endométriose ou le cancer des testicules. Elle peut également
être causé par une dépression et des troubles
d'anxiété. Les défauts de différenciations des
spermatozoïdes, d'implantation embryonnaire, ou également un
dysfonctionnement utérin, les maladies endocrines, les anomalies du
cycle menstruel et tubaires, chez la femme, l'hypogonadisme
hypo-gonadotrophique, l'insuffisance testiculaire, et anomalies du spermogramme
chez l'homme sont parmi les causes de l'infertilité du couple (Poncelet
et Sifer, 2011 ; Khetarpal et Singh, 2012). L'infertilité peut
être causée par des anomalies de la fécondation, elles
surviennent si :
- L'un des gamètes est porteur d'une anomalie
chromosomique, celle-ci sera transmise
au zygote.
- Deux spermatozoïdes entrent ensemble dans l'ovocyte :
ce phénomène rare est à l'origine
d'un oeuf à 66
chromosomes + 3 chromosomes sexuels (triploïdie).
- Une erreur de réplication de l'ADN des pronucléus
qui survient au moment de l'amphimixie.
- La répartition des chromosomes au moment de la formation
des deux blastomères est inégale.
C'est l'étiologie retrouvée qui oriente la prise
en charge. Celle-ci peut être l'abstention thérapeutique, lorsque
l'infertilité est récente, la femme jeune et l'exploration
initiale négative. À l'autre extrême en cas de pathologies
sévères intéressant l'un ou les deux membres du couple, on
fait appel aux techniques les plus sophistiquées d'aide médicale
à la procréation (Poncelet et Sifer, 2011 ; Bry-Gauillard et
al., 2014).

1- Chapitre II Les Avortements Spontanés
à Répétition
24
Définition
L'Avortement spontané selon l'OMS correspond à
l'expulsion hors de l'organisme maternel d'un foetus de moins de 500 grammes ou
de 22 SA (Garcia-Enguidanos et al., 2002). Les avortements
spontanés apparaissent souvent de façon aléatoires, et
nombreuses sont les femmes qui vont en être touchées au cours de
leur vie. Plusieurs femmes recevront un diagnostic d'avortement spontané
suite à des saignements vaginaux et/ou des crampes utérines.
D'autres n'auront eu aucun signe avant-coureur de cet arrêt de grossesse
que sont les saignements ou les crampes, par exemple, et l'apprendront
seulement au moment de leur première échographie (Morin et Vanden
Hof, 2006). L'avortement spontané peut être classé, selon
ses caractéristiques cliniques, en différentes catégories
(Poncelet et Sifer, 2011).
2- Symptomatologie
Plusieurs signes peuvent être rencontrés en fonction
du stade évolutif. 2-1- La menace d'avortement
Métrorragie et coliques discrète : ces
métrorragies sont faites de sang rouge ou noir mais toujours sans
caillots. Un fait important est à signaler ici : l'absence de
contractions utérines et de fièvre. C'est une phase importante
car un traitement entrepris précocement peut sauver l'oeuf s'il est
vivant et génétiquement viable. À l'examen, le col est
long et fermé, l'utérus est d'une taille en rapport avec le terme
de la grossesse (Daftary, 2005).
2-2- L'avortement proprement dit
La patiente consulte pour des métrorragies
persistantes, d'un sang rouge avec des caillots et/ou des douleurs à
type de contractions utérines rythmées. À l'examen on
retrouve :
- Au speculum de saignements souvent abondants gênant
l'examinateur, le produit est expulsé
au niveau du vagin.
- Au toucher vaginal on retrouve un col modifié,
ramolli, raccourci, surtout ouvert
aux 2 orifices. L'utérus est d'un
volume inférieur ou supérieur au terme de la grossesse (Sennaoui
et al., 2015).
3- Chapitre II Les Avortements Spontanés
à Répétition
25
Classification générale 3-1- L'avortement
thérapeutique
C'est l'interruption de la grossesse décidée
par le médecin pour une raison médicale. Elle peut être
eugénique lorsqu'il existe une malformation foetale reconnue ou
suspectée. Elle peut se faire pour sauvetage maternel si
l'évolution de la grossesse engendrera un risque majeur pour la
santé ou la vie de la mère (Merger et al., 2003).
3-2- L'avortement non
médicalisé
Selon L'OMS, il est défini comme : « une
intervention visant à interrompre une grossesse non
désirée soit par des personnes qui ne possèdent pas les
compétences nécessaires soit dans un contexte où les
conditions sanitaires minimales n'existes pas ou les deux à la fois
» (OMS, 2019).
3-3- L'avortement à
répétition
Selon l'OMS, c'est la survenue de deux FCS ou plus ;
consécutifs chez la même patiente, également appelé
: maladie abortive (Lansac et al., 2002).
3-4- L'avortement inévitable
Le processus d'avortement est réellement
déclenché, la grossesse sera expulsée tôt ou tard ;
aucun retour en arrière n'est possible car la contractilité
utérine est intense et ne s'arrête qu'à l'expulsion du
produit de la grossesse en dehors de la cavité utérine (Daftary,
2005).
3-5- L'avortement manqué
C'est une rétention des produits de conception bien
après la mort reconnue du foetus avec une période d'une
durée de 2 mois de façon conventionnelle dans la
définition (Daftary, 2005).
4- Classification des fausses couches spontané
à répétition en fonction de 4-1- La
chronologie
4-1-1- Fausses couches spontanées
ultra-précoces ou infracliniques
Appelées aussi avortements menstruels spontanés,
ou nidations précocement abortives, survenant avant l'implantation du
blastocyste ou juste après l'implantation, ce type d'avortement
désigne tout avortement spontanée survenant dans les
7ème au 10ème jour suivant l'implantation
ovulaire, ce qui correspond aux 8ème au
17ème jour post-conceptionnel (Abbara, 2015).
Chapitre II Les Avortements Spontanés à
Répétition
26
4 1-2- Fausses couches spontanées
précoces
Qui survient à partir du 18ème jour
post-conceptionnel jusqu'à la fin du premier trimestre, après que
l'oeuf ait été bien implanté dans l'endomètre
utérin. La grossesse est cliniquement décelable
(Andriatsiaronimanga, 2005 ; Diacoumba, 2008).
4-1-3- Fausses couches spontanées
tardives
L'avortement spontané du 2ème
trimestre de la grossesse : c'est l'expulsion spontané au
2ème trimestre de la grossesse d'un foetus avant la
22ème SA ou moins de 500 grammes.
4-2- Le stade évolutif
4-2-1- La FCS retardée ou grossesse
arrêtée : il s'agit d'une découverte fortuite
d'une grossesse arrêtée au premier trimestre avec un embryon sans
activité cardiaque ou un oeuf clair.
4-2-2- La mort foetal in utéro :
avortement après 25 SA.
4-2-3- La FCS menaçante ou menace de FC :
présence de métrorragie au premier trimestre, absence
d'expulsion en cours avec un col fermé.
4-2-4- La FCS en cours ou inévitable :
associant douleur et métrorragie d'intensité croissante,
col ouvert et expulsion en cours.
4-2-5-La FCS complète : définie
par une disparition des douleurs, une diminution des saignements, col
fermé après une expulsion associée à une
vacuité utérine à l'échographie.
4-2-6-La FCS incomplète ou rétention
trophoblastique : avec rétention du produit de conception qui
se manifeste par la persistance de douleur et/ou de saignements secondaires
à la persistance d'une rétention retrouvée à
l'échographie (Agostini et al., 2006 ; Beucher, 2010).
5- Épidémiologie
L'incidence des ASR correspond au nombre des femmes qui
souffrent chaque année des pertes consécutives de grossesse dans
une population à risque. Les ASR sont fréquentes, concernant 15
à 20% des grossesses et au moins une femme sur quatre durant sa
période d'activité génitale présente une FCS
(Beucher et al., 2014). En outre, ces chiffres peuvent être
incertain, car certaines femmes ne se rendent pas compte qu'elles ont
avorté et d'autres ne consultent pas un médecin même en cas
de doute (Sennaoui et al., 2015).
Chapitre II Les Avortements Spontanés à
Répétition
27
Pour chaque année, de 2003 à 2012, une
étude a été menée sur l'incidence des ASR et qui a
été calculée dans deux différentes populations
à risque : la première population a inclus les femmes
âgées entre 18 et 42 ans, la deuxième population a inclus
les femmes enregistrées comme enceintes (qui ont accouché ou
ayant vécu des fausses couches). L'incidence des ASR dans les deux
populations a augmenté de 74% et 58%, respectivement, au cours de la
période d'étude (Rasmark et al., 2017).
6- Étiologie et hypothèse
physiopathologique 6-1- Étiologie mécanique
Des anomalies utérines seraient trouvées chez
jusqu'à 19% des femmes atteintes d'ASR et peuvent être
classées comme acquises ou congénitales. Les anomalies acquises
comprennent les myomes et les polypes de l'endomètre, les
synéchies tandis que l'utérus cloisonné est classé
parmi les anomalies congénitales (Jaslow et al., 2010).
6-1-1- Anomalie utérine
6-1-1-1- L'utérus cloisonné
Les avortements sont fréquents dans les utérus
cloisonnés. Plusieurs mécanismes sont proposés pour
expliquer les avortements :
- Un défaut de croissance de la taille de
l'utérus qui ne peut s'adapter à la grossesse,
théorie contredite par les résultats des
métroplasties abdominales qui réduisent cette taille.
- Une incompétence cervicale, parfois
secondaire aux manoeuvres instrumentales
lors des avortements précédents mais qui n'explique
pas les avortements du premier trimestre.
- Une vascularisation et une innervation anormale de
la cloison à l'origine
d'une implantation
défectueuse. Le site d'implantation est fondamental, les grossesses qui
s'implantent ailleurs que sur la cloison se déroulent normalement.
Les métroplasties abdominales bien qu'efficaces avaient
l'inconvénient théorique d'imposer une césarienne, mais
avaient surtout la réputation d'entraîner environ 30% de
stérilités post-opératoires. La métroplastie
contrôlée par hystéroscopie ou échographie est
efficace et sans danger. L'indication de la résection
hystéroscopique de la cloison sera posée dans un contexte
d'avortements à répétition, d'avortement au second
trimestre ou d'accouchement prématuré. Dans une série de
165 patientes dont 67 ont eu deux fausses couches et 98 au moins trois, on
retrouve à l'hystéroscopie 28% d'anomalies utérines dans
le premier cas et 32% dans le second (Weiss et al., 2005).
Chapitre II Les Avortements Spontanés à
Répétition
28
6-1-1-2-Les synéchies
Les synéchies correspondent à l'accolement par
adhérences des faces internes de l'utérus. Elles peuvent
être totales lorsqu'elles intéressent l'ensemble de la
cavité et l'isthme utérin ou être partielles lorsqu'elles
concernent une portion variable de la cavité utérine et/ou de
l'isthme (Bricou et al., 2009). Les synéchies sont
présentes chez environ 1,5% des patientes ayant un
antécédent opératoire et chez 7 à 21,8% des
patientes présentant des ASR (Ventolini et al., 2004).
6-1-1-3-Les Myomes
Le léiomyome, plus communément appelé
myome ou encore fibrome utérin, est une tumeur bénigne de
l'utérus humain, qui se développe aux dépens des cellules
musculaires lisses (Bazot et al., 2004). La transformation du
myomètre en fibrome implique des anomalies génétiques,
l'influence de facteurs de croissance locaux, et surtout l'action des
oestrogènes et de la progestérone. Les fibromes augmentent le
risque de fausse couche spontanée en début de grossesse (Bukulmez
et Doody, 2006). Cela concerne uniquement les femmes ayant de volumineux
fibromes sous-muqueux qui déforment la cavité utérine, ou
lors de la croissance rapide du volume du myome (Ouyang et al.,
2006).
6-1-1-4- Autres malformations utérines
- L'hypotrophie utérine : c'est un
utérus d'aspect rigoureusement normal mais
dont les dimensions sont réduites.
- L'hypoplasie utérine : c'est un
utérus dont les dimensions sont réduites et dont
la
morphologie et les proportions sont également modifiées. Les
dimensions et les proportions sont celles d'un utérus infantile ou
foetal.
- De béance cervico- isthmique :
c'est la rupture du verrou de la chambre utérine
(Diaby,
2006).
6-1-1-5- Endométriose
L'endométriose se définit par la
présence, en situation ectopique, de foyers composés d'un tissu
possédant les mêmes caractéristiques morphologiques et
fonctionnelles que l'endomètre (cellules glandulaires et stroma). Ces
foyers, en se comportant comme l'endomètre, sous l'influence des
hormones, entraînent des lésions et des signes spécifiques
de la maladie (Daraï et al., 2007 ; Poncelet et Sifer, 2011).
Chapitre II Les Avortements Spontanés à
Répétition
29
Sur de petites séries rétrospectives
étudiant son effet dans le cadre de cycles d'AMP, elle serait
associée à une diminution des taux d'implantation et à une
augmentation des taux de FCS allant jusqu'à 50% contre 2,8% en l'absence
d'adénomyose (Maheshwari et al., 2012).
6-1-2-Les anomalies des annexes
Plusieurs anomalies sont décrites dont la
majorité concerne : l'artère ombilicale unique, les noeuds du
cordon, les anomalies du placenta et l'hydramnios qui est un excès de
liquide amniotique. Ces anomalies sont associées à des
complications maternelles et foetales telles que : mort foetale ou le
décollement placentaire prématuré (Keita, 2008).
6-2- Étiologie infectieuse
Toute infection aigue peut provoquer des avortements. Ces
avortements peuvent récidiver si l'infection n'est pas découverte
et guérie. L'infection arrive soit :
- Par voie hématogène
(nécessité de traverser la barrière placentaire
au niveau des villosités) :
les infections virales seraient plus
fréquentes durant le 1ier trimestre car les virus et les
protozoaires traversent la barrière placentaire plus facilement que les
bactéries.
- Par voie ascendante : principalement les
infections bactériennes trans-cervicales
après le premier
trimestre (Poncelet et Sifer, 2011 ; Sennaoui et al., 2015).
6-3- Étiologie endocrinienne
6-3-1- Syndrome des ovaires polykystiques
Le Syndrome des Ovaires Poly-Kystiques (SOPK) est l'un des
désordres hormonaux féminins les plus communs. Ses composantes
sont multiples : reproductifs, métaboliques, néoplasiques et
cardiovasculaires, ont un impact majeur sur la santé publique.
L'excès d'androgène et la résistance à l'insuline,
probablement d'origine génétique, sont à la base d'une
grande partie de la symptomatologie clinique. La résistance à
l'insuline du SOPK semble s'accompagner d'un plus grand risque
d'intolérance au glucose, de diabète de type 2, d'anomalies
lipidiques et peut entraîner le développement de maladies
cardiovasculaires. En cas de traitement inducteur par citrate de
clomifène dans le cadre de SOPK anovulant, est mis en évidence un
taux de fausses couches d'environ 20%, potentiellement lié à
l'effet anti-oestrogénique responsable d'une atrophie
endométriale avec échec d'implantation. Toutefois, aucune
étude ne met en évidence un risque accru d'ASR en cas de SOPK. Il
est important en cas de SOPK avéré de rechercher un syndrome
métabolique associé (Koivunen et al., 2008).
Chapitre II Les Avortements Spontanés à
Répétition
30
6-3-2-Insuffisance lutéale
Après ovulation, le corps jaune sécrète
de la progestérone qui provoque une transformation
sécrétoire de l'endomètre pour que l'implantation puisse
se produire
avant que le placenta ne prenne le relais de la production de
progestérone. Cette dernière produite par le corps jaune fournit
également le soutien nécessaire à une grossesse
précoce. Un défaut dans la fonction du corps jaune est non
seulement associé à l'échec d'implantation, mais aussi
à une augmentation du risque de fausse couche (Haas et Ramsey, 2008).
Un dysfonctionnement en phase lutéale est
associé à une production de progestérone insuffisante et
à un risque d'échec d'implantation conséquent. Bien que
certaines estimations suggèrent qu'il peut représenter un
pourcentage important des cas d'infertilité, il reste peu de consensus
sur ses critères diagnostiques, l'étiologie ou la réponse
au traitement. La supplémentation par un progestatif est le traitement
le plus couramment utilisé lorsque la dysfonction de la phase
lutéale est suspectée. Cependant, comme la majorité des
études cliniques ont mis l'accent sur le soutien de la phase
lutéale en cours d'AMP (utilisation d'analogues de la GnRH ou aspiration
des cellules de la granulosa au cours de la ponction ovocytaire), on en sait
beaucoup moins sur le rôle des progestatifs chez les femmes
présentant une infertilité due à un dysfonctionnement de
la phase lutéale en dehors des cycles d'AMP. Malgré l'utilisation
répandue de ces progestatifs et de nombreuses années
d'expérience clinique, les essais contrôlés bien conduits
sont actuellement limitées et il semblerait qu'en cas de FCS sporadique,
les progestatifs soient inefficaces pour prévenir le risque de
récidive de FCS (Haas et Ramsey, 2008).
6-3-3- Dysthyroïdies
L'hyperthyroïdie est associée à une
augmentation du risque de fausse couche spontanée. De même que
l'hypothyroïdie auto-immune (maladie d'Hashimoto) par le biais des
anticorps antithyroïdiens anti-thyro-peroxydase (TPO) et anti
thyroglobuline. Une augmentation du risque de fausse couche spontanée a
également été mise en évidence en début de
grossesse en cas de TSH supérieure à 2,5 mUI/L (De Groot et
al., 2012).
6-3-4- Diabète
Le diabète équilibré n'est pas
responsable de FCS, alors qu'un diabète
déséquilibré est associé à une majoration du
risque de FCS (Jovanovic et al., 2005).
Chapitre II Les Avortements Spontanés à
Répétition
31
6-3-5- L'hyperprolactinémie
L'hyperprolactinémie est fréquemment
associée à des anomalies ovulatoires. Elle pourrait
également être imputée dans les ASR à une
altération de la folliculogénèse ou de la maturation
ovocytaire ou à une phase lutéale courte. Une étude
portant sur un sous-groupe de patientes ayant fait des ASR dans un contexte
d'hyperprolactinémie a montré l'efficacité de la
bromocriptine sur le maintien des grossesses ultérieures. Le rôle
délétère de l'hyperprolactinémie n'a pas
été confirmé par une autre série, dont le faible
effectif limite cependant l'intérêt (Gurbuz, 2003 ; Poncelet et
Sifer, 2011).
6-4- Étiologie immunitaire
6-4-1- Syndrome des anti-phospholipides
Le Syndrome des Anti-Phospho-Lipides (SAPL) est une
entité complexe associant des anomalies cliniques (de type thrombotique)
et biologiques (la présence d'anticorps de type anti-phospholipides). Il
se définit en obstétrique par l'association
d'antécédents de pertes foetales et de la présence
d'anticorps anti-phospholipides (anti-cardiolipides et/ou anticoagulant
circulant). Les Anti-Phospho-lipides (APL) pourraient nuire à la
formation du placenta. Les deux auto-anticorps les plus fréquents
l'anti-coagulant-lupique et l'anticorps anti-cardiolipine (ACL) sont
dirigés contre la phospho-sérine et la
phospho-éthanol-amine, protéines adhésives
impliquées dans la formation et l'invasion trophoblastique. Des APL
inhibent la synthèse d'hCG par du trophoblaste murin en culture. Ainsi,
les ASR, reconnues comme facteurs de risque de pathologies placentaires
thrombotiques tardives comme la prééclampsie ou l'hématome
rétro-placentaire pourraient être dues à des thromboses
placentaires précoces (Arvieux et Hachulla, 2002 ; Lejeune, 2003).
6-4-2- Avortement immunologique
Les Incompatibilités Foeto-Maternelles
Érythrocytaires (IFME) sont définies par la fixation
d'allo-anticorps maternels sur le globule rouge du foetus, anticorps transmis
pendant la grossesse et qui ont pour cible les antigènes de groupes
sanguins du foetus, d'origine paternelle. Les complexes immuns ainsi
formés provoquent une immuno-hémolyse tissulaire. Les anticorps
anti-érythrocytaires peuvent se développer au cours ou au
décours d'une grossesse par activation du système immunitaire
maternel, après une première étape de sensibilisation par
des hématies foetales porteuses de caractéristiques paternelles
parvenues dans la circulation maternelle (Cortey et al., 2012).
Chapitre II Les Avortements Spontanés à
Répétition
32
Ce passage d'hématies correspond à des
Hémorragie Foeto-Maternelle (HFM) qui sont spontanées et dans ce
cas occultes en cours de grossesse, avec une fréquence de 45% au
troisième trimestre. Les HFM peuvent être provoquées :
fausse-couche, interruption volontaire de grossesse, mort foetale in
utero, accouchement, etc. (Cortey et al., 2012). La grossesse
pourrait échouer par défaut d'anticorps bloquant.
L'hypothèse des anticorps bloquants a inspiré les traitements
immunologiques dont les fondements théoriques sont :
- La mère met en place une réponse immunitaire
cellulaire qui doit être bloquée.
- Les anticorps bloquants apparaissent dans toutes les grossesses
d'évolution normale.
- En l'absence de ces anticorps, il y a avortement.
L'identité des antigènes HLA entre les deux
partenaires a été accusée d'être
à l'origine du défaut de synthèse des facteurs
bloquants.
Des dysfonctionnements de l'immunité cellulaire sont
à l'origine de plusieurs hypothèses. Une orientation de la
réponse cellulaire T vers la voie T-helper1 (Th1) produirait des
cytokines responsables de l'avortement. Chez les femmes affectées, le
trophoblaste, le sperme, les microbes activeraient le système
immunitaire maternel qui produirait les cytokines Th1, les interférons
(IFN-y) et les (Tumor Necrosis Factor) TNF-a, capables d'inhiber la
prolifération, les fonctions du trophoblaste et la croissance
embryonnaire. TNF-a induit la formation de thromboses. Selon les séries,
50 à 80% des femmes souffrant d'ASR inexpliqués auraient une
réponse cellulaire anormale de typeTh1 vis-à-vis des
antigènes trophoblastiques. L'activité des cellules NK serait
plus élevée dans certains cas d'ASR (environ 12%). Ces
hypothèses (défaut de reconnaissance, absence de facteurs
bloquants, déficit en cytokines de type Th2, excès de cytokines
Th1, excès d'activité NK) n'ont pas trouvé de confirmation
pour l'instant (Poncelet et Sifer, 2011).
6-4-3- Le lupus
C'est une maladie d'origine auto-immune qui comporte des
manifestations cliniques extrêmement polymorphes,
cutanéo-viscérales, évoluant par poussées,
associées à la présence d'auto-anticorps dirigés
contre les constituants du noyau cellulaire. Concernant les FCS
répétées, toutes les études montrent que leur taux
est augmenté en cas de lupus, atteignant 20 à 30% des grossesses.
Les facteurs de risque de FCS précoces et de pertes foetales tardives
sont la présence d'anti-phospholipides et les antécédents
de perte foetale. Les études in vitro évoquent une
toxicité directe des anti-phospholipides sur le développement
embryonnaire et trophoblastique, avec des défauts d'invasion expliquant
les FCS précoces et les pathologies placentaires plus tardives (Molad
et al., 2005).
Chapitre II Les Avortements Spontanés à
Répétition
33
6-5- Étiologie vasculaire et
métabolique
6-5-1- L'hypertension et les maladies
vasculaires
Les maladies hypertensives peuvent avoir une influence
néfaste sur le développement ovulaire au début de la
grossesse et comporte aussi bien des risques d'avortements que d'hypotrophie et
de mort in utero. Facile à mettre en évidence, si
l'hypertension évidente, si la tension artérielle se
révèle normale dans les conditions de repos, il ne faudra pas
éliminer l'origine vasculaire car il arrive qu'elle soit en cause
lorsqu'ils existent des facteurs de risque tels que des
antécédents familiaux d'hypertension ou d'accidents vasculaires
chez les parents ou collatéraux, aggravés éventuellement
par le tabagisme. Chez ces patientes, il faudra découvrir l'origine
vasculaire par des tests a l'effort, l'épreuve du froid, le roll
overtest et l'étude des vaisseaux au niveau du fond d'oeil et de
l'endomètre qui peuvent être le siège de lésions
vasculaires importantes (Diaby, 2006).
6-5-2- Maladie coeliaque
La maladie coeliaque est un trouble auto-immun associé
à une intolérance au Gluten qui a pour effet la destruction
progressive des villosités de l'intestin grêle. Les
symptômes de la maladie coeliaque sont très divers et peuvent se
produire à tout âge. Parmi ces symptômes, la maladie
abortive est une circonstance rare de découverte de la maladie
coeliaque. En effet, 19,4% des femmes atteintes de cette maladie ont des
aménorrhées mais aussi, des oligo-hypo-ménorrhées,
dysménorrhées et des métrorragies (Stazi et Mantovani,
2000). Il existe aussi une forte corrélation entre maladie coeliaque et
fausses couches précoces, menaces d'avortement, toxémie
gravidique et retard de croissance intra-utérin. La pathogénie de
tous ces problèmes gynéco-obstétricaux reste
méconnue, mais les hypothèses sont partagées entre
l'origine auto-immune et la malnutrition (Eliakim et al., 2001). Dans
le cadre de la recherche de la physiopathologie de ces troubles, certains
auteurs se sont intéressés à des vitamines et
oligoéléments comme l'acide folique, le sélénium et
le zinc. Ceux-ci sont des nutriments essentiels pour la fonction reproductive
de la femme, et sont mal absorbés en cas de maladie coeliaque. Ces
auteurs ont montré, entre autres, que le déficit en zinc engendre
un trouble dans la sécrétion et l'action de la LH et celle de la
FSH ce qui perturbe le fonctionnement ovarien. Ceci peut expliquer en partie
les problèmes d'infertilité et de fausses couches précoces
engendrées par la maladie coeliaque. L'autre piste physiopathologique
explorée pour essayer de saisir le mécanisme de ces perturbations
de la vie génitale associées à la maladie coeliaque est
celle de l'auto-immunité. Dans ce sens, certains auteurs ont
comparé des sérums de femmes en bonne santé à ceux
de femmes atteintes de maladie coeliaque active avec des manifestations
gynéco-obstétricales (Shamaly et al., 2004).
Chapitre II Les Avortements Spontanés à
Répétition
34
Ils ont prouvé qu'il existait une relation entre la
présence d'anticorps anti endomysium et anti trans-glutaminase et ces
manifestations cliniques. Ces cas cliniques illustrent bien l'association entre
la maladie coeliaque et les fausses couches à répétition
(Shamaly et al., 2004).
6-6- Thrombophilie
En début de grossesse (5 à 7 SA), l'invasion
trophoblastique des artères spiralées utérines
entraîne l'apparition de bouchons vasculaires (plugs) conduisant
au maintien de l'hypoxie embryonnaire nécessaire à sa bonne
évolutivité. En effet, l'embryon est à ce stade
dépourvu des moyens de défense enzymatique contre les radicaux
libres de l'oxygène, et ces plugs luttent également
contre les variations tensionnelles maternelles et permettent la mise en route
du coeur embryonnaire et l'extraction des déchets embryonnaires vers les
premiers lacs intervilleux (Merviel et al., 2004).
Le problème est qu'en amont de ces plugs, les
éléments figurés du sang stagnent et peuvent conduire
à la formation d'un thrombus si la femme présente des facteurs de
risque comme une thrombophilie. Lorsque les plugs doivent commencer
à disparaître (à partir de la 8ème SA), les thrombus
restent et la grossesse s'interrompt par défaut de perfusion de
l'embryon. De même, ces thrombus peuvent empêcher la
deuxième colonisation trophoblastique des vaisseaux utérins, et
conduire à la survenue d'une pathologie vasculaire de la grossesse. Les
thrombophilies génétiques sont liées soit à un
déficit des inhibiteurs naturels de la coagulation (antithrombine III,
protéines S et C), soit à des mutations du gène de la
méthylène tétra-hydro-folates réductase, du
gène de la prothrombine (G20210A) ou du facteur V (mutation Leiden)
(Merviel et al., 2004).
6-7- Étiologie génétique
Les variables génétiques semblent jouer un
rôle complexe dans l'efficacité de la reproduction humaine.
Classiquement, les taux élevés d'erreurs chromosomiques ont
été parmi les principales étiologies de la perte foetale
et des études plus récentes ont commencé à mettre
en évidence le rôle important que des anomalies
monogéniques spécifiques peuvent jouer dans le maintien de la
grossesse (Kassie et al., 2015).
6-7-1- Anomalies chromosomiques
Les études cytogénétiques ont
montré que la plupart de ces anomalies sont des anomalies chromosomiques
numériques ou aneuploïdies (86%), et une minorité des cas
sont causés par des anomalies chromosomiques structurales (6%) ou
mosaïsme chromosomique (8%) (Goddijn et Leschot, 2000 ; Poncelet et Sifer,
2011).
Chapitre II Les Avortements Spontanés à
Répétition
35
Chapitre II Les Avortements Spontanés à
Répétition
On suppose que 50% des anomalies chromosomiques
détectées dans les avortements spontanés se produisent
de novo alors que les parents présentent des caryotypes normaux
(Carvalho et al., 2010). Les anomalies survenant de novo sont
donc accidentelles et ne sont donc en principe pas responsable d'ASR.
Cependant, l'incidence de certaines aneuploïdies méiotiques
augmentant avec l'âge maternel (Stephenson et al., 2002).
Les anomalies de nombre sont la majeur cause des FCS
sporadiques et répétées, parmi ces anomalies ; des
trisomies (16, 18, 21 ou 22), des triploïdies, polyploïdies et des
monosomies X. Les anomalies de structure représentent 3 à 4% des
aberrations chromosomiques et sont constituées de 3
variétés : la translocation, la mosaïque et les chromosomes
en anneau (Carvalho et al., 2010).
6-7-2- Anomalie génique
La mutation génique consiste en une altération
fine de la molécule ADN. Elle n'est donc pas visible, contrairement
à l'aberration chromosomique, jusqu'à présent il a
été détecté que les mutations des gènes de
structures responsables de la synthèse des enzymes, des protéines
et des récepteurs des cellules. Ainsi, des altérations graves
d'un ou plusieurs gènes, incompatible avec la vie sont non seulement
hautement probable mais a priori fréquentes en début
d'embryogenèse et seraient à l'origine d'avortement très
précoce, notamment infra clinique. Cette hypothèse est
étayée par divers arguments. Après avoir
éliminé toutes les causes connues d'avortements, y compris les
aberrations chromosomiques, il reste une proportion importante d'avortement
d'étiologie inconnue parmi lesquels le pathologiste constate surtout les
décès embryonnaires foetaux apparemment primitif in
utero. À l'origine de ces décès, il peut y avoir un
blocage d'une grande voie métabolique et surtout, en raison de la nature
dominante la transmission, des anomalies de structures des protéines
(Diaby, 2006 ; Coutton et al., 2012).
6-8- Étiologie fortuite et
psychologique
Sous ce qualificatif sont habituellement
désignées les causes qui peuvent avoir une influence non
prouvée médicalement mais auxquelles l'expérience donne un
certain crédit : la fatigue, le travail debout, les trépidations,
les longs voyages en voiture, etc. Il s'agit en général plus de
facteurs déclenchant ou favorisants que de causes véritables. Il
est certain qu'un utérus hypotrophique et hyper-contractile se
contractera plus facilement et plus souvent chez une femme ayant une importante
activité physique que chez une femme au repos ou ayant une vie calme :
d'où les prescriptions logiques de prudence qui en découleront
(Lejeune et Carbonne, 2007).
36
L'écoute des patientes, le décryptage du
traumatisme lié à l'annonce ou à la prise en charge des
échecs de grossesses antérieures, la pression subie et la
confiance qu'elles mettront dans la relation avec le médecin, augmentent
les chances de succès des grossesses futures, de l'avis de tous les
médecins qui les prennent en charge. Ce que les Anglo-Saxons appellent
le loving care, c'est-à-dire l'empathie et le suivi
rapproché en début de grossesse améliore de façon
significative le pronostic obstétrical (Lejeune et Carbonne, 2007).
6-9- Autres étiologies
- Le traumatisme unique, même violent, est une cause rare
d'avortement avant la douzième
semaine, l'utérus étant protégé de
la contusion par la ceinture osseuse. Mais, il peut être l'occasion de
l'interruption d'une grossesse déjà compromise.
En revanche, les microtraumatismes
répétés peuvent provoquer l'avortement. L'usage des engins
motorisés en fournit un exemple et le travail sur certaines machines
trépidantes en est un autre (Andriatsiaronimanga, 2005).
- La béance du col est une affection
obstétricale rare, caractérisée par une dilatation
cervicale
indolore au cours du deuxième trimestre de la grossesse
conduisant à l'expulsion du produit de la conception suite à une
destruction traumatique des fibres musculaires de l'orifice interne du col ou
suite à une inefficacité constitutionnelle congénitale.
L'incompétence cervico-isthmique a été décrite pour
la première fois par Palmer et Lacomme en 1947
(Abbara, 2016).
- Le facteur d'âge, lorsque la femme à
l'âge > 30 ans, ayant des antécédents de fausse
couches
spontanée, le surpoids ou le faible poids suite à des
mauvaises habitudes alimentaires (Toilibou, 2009).
7- La part de l'homme dans les FCSR
En effet, si 60% des fausses couches du premier trimestre sont
dues à des anomalies chromosomiques et qu'une majorité est
d'origine maternelle, la technique d'hybridation in situ en
fluorescence (FISH) sur les spermatozoïdes a montré une origine
paternelle dans 8 à 12% des cas, correspondant à une incidence
plus grande d'anomalies chromosomiques dans leurs gamètes. Une mesure de
la fragmentation de l'ADN spermatique peut également être
réalisée. Les causes de la fragmentation peuvent être
génétiques : insuffisance en enzymes de réparation,
augmentation des substances oxydantes secondaires à l'âge,
processus infectieux et inflammatoire, ou à des facteurs
environnementaux : toxiques, hydrocarbures, insecticides, chaleur, etc. Ces
anomalies sont associées au risque de FCS (Gil-Villa et al.,
2009).
Chapitre II Les Avortements Spontanés à
Répétition
37
Les études chromosomiques des spermatozoïdes
peuvent être établies et elles constituent une étiologie
non négligeable à ce dysfonctionnement (Auger et al.,
2009). Elle peuvent être faites :
- Par fécondation hétérospécifique :
c'est une technique qui permet de voir les spermatozoïdes
et d'apporter des renseignements sur leur forme et leur
structure.
- Par hybridation in situ : réalisée sur
le noyau en interphase.
- La mesure de la fragmentation d'ADN : pour l'identification des
cassures de l'ADN simple
et double brin au niveau de l'ADN des
spermatozoïdes.
- Par la recherche d'anticorps anti-spermatozoïdes :
suite à des traumatismes ou à une infection,
les hommes
peuvent développer une immunité contre leurs propres
spermatozoïdes, cela peut diminuer leur mobilité (Rives et
al., 2004 ; Auger et al., 2009 ; Belloc, 2014).
8- Démarche diagnostique et prise en charge 8-1-
Interrogatoire
Il est établi pour chercher et préciser :
l'âge maternel, l'indice de masse corporel, des antécédents
personnels gynécologiques, des antécédents
obstétricaux, ainsi que des antécédents personnels
thromboemboliques. La prise de toxiques, tabac, alcool, drogues ou
médicaments, ainsi que les habitudes alimentaires sont explorés
(Poncelet et Sifer, 2011 ; Lepage et al., 2015).
| 


