CHAPITRE IV : L'EAU DANS LA DATTE ET LES
ISOTHERMES DE SORPTION
________________________________________________________________
1. L'eau dans la datte
L'eau est l'une des composantes biochimiques les plus
importantes des produits naturels et biologiques. Pour la datte, on observe que
le débit de circulation de l'eau physiologique diminue progressivement
au cours de la période de formation, depuis la
fécondation jusqu'à la maturité physiologique. La teneur
en eau initialement de 78% décroît jusqu'à une valeur
comprise entre 20 - 30 %.
La connaissance de l'eau adsorbée est d'un
intérêt considérable en technologie alimentaire. En effet,
l'activité thermodynamique de l'eau conditionne la vitesse et
l'intensité des réactions chimiques (oxydation, réaction
de Maillard), des réactions enzymatiques, le
développement et la physiologie des micro-organismes et modifie la
plupart des propriétés physiques (propriétés
rhéologiques, mécaniques) (Multon, 1982).
La maîtrise technologique des opérations de
transformation industrielle de séchage et d'entreposage, où
interviennent toutes ces réactions ; nécessite que l'on
connaisse bien la nature des interactions eau-substrat (l'état
de l'eau dans ces denrées).
1.1. Paramètres de mesure de l'état de l'eau
dans les substances biologiques
Le rôle primordial de l'eau ayant été
reconnu en science alimentaire, aussi bien dans les processus
d'altération que dans les technologies de transformation. Il a fallu
définir des grandeurs quantitatives qui la caractérisent :
Teneur en eau et Activité de l'eau.
1.1.1. La teneur en eau (grandeur quantitative)
La teneur en eau ou « Titre en eau » ou
plus communément « Humidité » définie
par Guilbot (1949, 1964) : « la quantité d'eau perdue
par la substance lorsqu'on l'amène en équilibre vrai avec une
pression d'eau nulle, dans des conditions telles que des réactions
perturbatrices éventuelles soient évitées ».
La teneur en eau s'exprime en grammes d'eau rapportés
à 100g de substance sèche (teneur en eau en % S.S) ou plus
communément rapportés à 100g de substance humide (teneur
en eau en % S.H).
La teneur en eau, grandeur caractéristique de la
quantité d'eau contenue par une substance et sa connaissance, est
cependant insuffisante pour rendre compte des propriétés
fonctionnelles de l'eau, en particulier sa « disponibilité
biochimique » et de son rôle dans les mécanismes
d'altérations. En effet, même si d'une manière
générale, une augmentation de l'humidité entraîne
une accélération des réactions d'altérations, le
critère « teneur en eau » ne permet aucune
généralisation d'un produit à un autre : un amidon de
pomme de terre a une teneur en eau de 20%, un blé de 14% sont
stables ; cependant qu'une poudre de lait à 12% ou de sucre
à 4% s'altèrent rapidement (Multon, 1982).
L'eau n'apportant aucune valeur énergétique
à l'aliment et étant de mauvaise conservation, il convient
souvent de réduire sa teneur en eau au maximum
(Alais et Linden, 1997).
Afin de mieux exprimer cet état de l'eau en relation
avec la conservation du produit, on doit donc définir un autre concept
plus qualitatif celui de « l'activité de l'eau »
(aw).
1.1.2. L'activité de l'eau
L'activité de l'eau (aw) est un paramètre
thermodynamique qui caractérise les denrées alimentaires (Gautier
et al., 1986). Elle se définit par rapport au potentiel
chimique de l'eau, soit :
u (P, T) - u' (P, T) = R.T. Loge aw
u (P, T) - u' (P, T) = R.T. Loge aw
u : potentiel chimique de l'eau dans le produit ;
u' : potentiel chimique de l'eau pure à la
même température T (°K) et à la même pression
P ;
R : Constante des gaz parfaits.
1.2. Disponibilité de l'eau dans les aliments
Lorsqu'un produit humide est placé dans une
atmosphère gazeuse contenant de la vapeur d'eau, il y a en
général des échanges de chaleur et de vapeur d'eau entre
les deux phases (solide, vapeur) ; soit que le produit absorbe de l'eau
et se rehumidifié, soit au contraire qu'il perd de l'eau au profit
de l'atmosphère, jusqu'à ce que l'équilibre
thermodynamique s'établisse. Les températures et les pressions
sont alors constantes et égales dans les deux phases.
L'état de l'eau dans l'aliment a autant d'importance
que la teneur en eau, la disponibilité de l'eau est
définie par « l'activité de l'eau » (aw),
celle même définie par l'abaissement de pression partielle de
vapeur créée par l'aliment.
P H.R.E. %
aw = -- = ---------- P' 100
P : Pression partielle de l'eau dans l'aliment ;
P' : Pression partielle de l'eau pure à la
même température ;
H.R.E : Humidité relative d'équilibre.
En supposant que la vapeur d'eau soit un gaz parfait ; on
admet que l' aw dans un produit solide ou dans une solution
s'identifie par l'H.R. de l'atmosphère en équilibre avec la
phase condensée à la température considérée
(Morin, 1980).
T
T
P,
Pression de vapeur d'eau
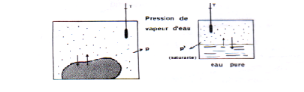
(Saturante)
(Etat de référence)
Eau pure
Produit
P
Fig. 7 : Eléments de l'équilibre
thermodynamique (Multon, 1982).
A la température constante, il existe donc pour un
produit en équilibre thermodynamique une atmosphère qui
l'environne, une relation entre la teneur en eau du produit d'une part, et l'aw
de ce produit ou l'H.R. de l'atmosphère d'autre part. Cette relation est
la traduction macroscopique des affinités et des interactions
moléculaires.
Les groupes polaires des macromolécules, notamment ceux
des glucides et des protéines (-OH, -NH2 ...etc.) créent
à la surface de celles-ci un champ de forces, de nature
électrostatique, responsable de la fixation des molécules d'eau,
en équilibre avec celles dont l'agitation thermique crée
la pression de vapeur d'eau dans l'atmosphère environnante
(Alais et Linden, 1997).
La corrélation entre la teneur en eau et aw nous donne
les courbes de sorption qui sont l'expression graphique des
réactions citées précédemment à
l'échelle moléculaire (Martin, 1990).
1.3. Comportement de l'eau dans les aliments
1.3.1. Isotherme de sorption pour les dattes
Au cours du stockage et d'entreposage, la datte absorbant
l'humidité ou la cédant à l'atmosphère
environnante, jusqu'à un état d'équilibre
caractérisé par une même H.R., laquelle est directement
proportionnelle à l'activité de l'eau (aw) dans la
substance ; dans ce cas on dit que la datte est hygroscopique.
Ainsi le système tend vers un équilibre statique
entre le nombre de molécules d'eau adsorbées (teneur en eau de la
substance) et le nombre de molécules d'eau présent dans
l'atmosphère et mesurées par la pression de vapeur d'eau (Multon,
1978). L'équilibre air-produit s'exprime par la courbe
d'isotherme de sorption de forme sigmoïde qui caractérise
l'affinité pour l'eau d'un produit.
Loncin et Weisser (1977) ont montré que durant le
stockage et la transformation des aliments, des changements physiques,
chimiques et microbiologiques prennent place. Loncin (1975) a rapporté
que le changement durant le stockage est particulièrement
influencé par l'activité de l'eau, l'humidité de l'aliment
et la température de stockage. L'activité de l'eau des aliments
à des températures élevées joue un rôle
majeur durant la transformation par le séchage et le stockage des
aliments.
La figure 8 nous montre les courbes de sorption dont l'une
représente l'équilibre qui se crée lors
de l'humidification du produit (courbe d'adsorption) et l'autre
l'équilibre lors de la dessiccation (courbe de désorption). La
relation entre la teneur en eau du produit Xeq (g d'eau/100g de M.S) et son
activité aw qui traduit « la disponibilité »,
est l'aptitude de l'eau pour les différentes réactions. Cette
relation est tirée des courbes d'équilibres d'adsorption-
désorption à une température donnée.
Fig. 8 : Courbe d'isotherme d'adsorption-
désorption (Jannot, 2003).
La courbe d'isotherme de sorption est arbitrairement
découpée en trois domaines correspondant aux valeurs
suivantes :
(1) pour 0 < aw < 0.2 : représente l'eau
fortement liée ou retenue à la surface des molécules du
soluté sous forme d'une couche monomoléculaire d'eau
fixée sur des groupes polaires (-NH3+ et -COO- des
protéines, -OH des glucides...etc.). L'eau liée représente
une énergie d'adsorption très élevée. D'une
part, cette eau n'est pas congelable, et d'autre part elle n'est pratiquement
pas libre en tant que solvant ou réactif. Ces molécules d'eau ont
une orientation spécifique et rigide. De ce fait, leur mobilité
est pratiquement nulle et elles ne peuvent participer à aucune
interaction ou réaction.
(2) Pour 0.2 < aw < 0.6 : La courbe d'isotherme est
linéaire et l'eau se trouve sous forme de couches
polymoléculaires (multicouche) recouvrant partiellement la
surface de substrat. L'eau dans cette couche, animée d'une
énergie cinétique suffisante, s'échappe du produit. Dans
cette partie d'isotherme même aux basses activités d'eau, l'eau
présente les propriétés habituelles, autrement
dit elle est disponible comme solvant et réactif.
(3) Pour aw > 0.6 : ce domaine, correspond à la
fraction d'eau libre qui se trouve à l'état liquide et qui n'est
retenue à la surface du substrat sec que par des forces capillaires.
C'est uniquement sous cette forme que l'eau est utilisable par
les micro-organismes et peut permettre les réactions enzymatiques. C'est
pourquoi on l'appelle parfois « eau biologique ». C'est
uniquement sous cette forme que l'eau est mobilisable pour la solvatation des
ions et des molécules (Cheftel, 1977 ; Mafart, 1991 et Multon,
1978).
La figure 9 montre les différentes zones d'une isotherme
de sorption (monocouche, multicouche et eau liquide).
Fig. 9 : Les zones d'une isotherme de sorption (Jannot,
2003).
1.3.2 Influence de la température
La première zone (aw < 0.7) plus la
température est élevée, plus l'isotherme de
sorption est bas (Multon, 1980). Ce phénomène est observé
par Erol et Tsami (1991) pour trois produits différents.
La deuxième zone (aw > 0.7) le comportement est
inverse (teneur en eau augmente à aw constante). Ce
phénomène est observé dans les produits qui sont riches en
sucre solubles. A des activités d'eau élevées l'adsorption
d'eau augmente avec l'augmentation de la température, qui donne un
croisement des isothermes, ceci est dû à une augmentation de la
solubilité des sucres dans l'eau.
Un comportement similaire de croisement d'isothermes a
été observé par plusieurs études sur
différents produits, pour les raisins sultanine le point d'intersection
se trouve à une aw = 0.55, aw = 0.65 pour les figues, aw = 0.7
pour les prunes, aw = 0.75 pour l'abricot.
1.3.3 Isothermes de sorption des fruits secs
La connaissance des isothermes de sorption est utile pour
comprendre le séchage et le stockage des fruits, en
particulier :
- pour prédire la teneur en eau minimale que pourrait
atteindre le produit en fin de séchage dans un air donné :
la température du produit serait égale à celle de l'air et
son activité d'eau serait égale au degré
hygrométrique de l'air ;
- pour relier les caractéristiques de l'air de
séchage à la teneur en eau de la surface du
produit ;
Plusieurs travaux ont été faite sur les
isothermes de sorption des fruits, parmi lesquelles les
travaux qui ont été faite par Kaymak-Ertekin et Gedik (2004) sur
trois fruits (abricot, raisin et pomme) et la pomme de terre ; Les travaux
de Saravacos et al. (1986) sur le raisin ; Kechaou et
al. (1996) ; Belarbi et al. (2000) sur les dattes, ainsi
que les travaux de Do Amaral Sobral et al. (1999) sur les
isothermes de sorption de la pomme de terre.
L'étude des isothermes de sorption des aliments
est un moyen privilégié pour connaître l'intensité
des liaisons de l'eau ainsi que de sa disponibilité fonctionnelle dans
les substances biochimiques et biologiques alimentaires, peu ou moyennement
hydratées.
1.3.4 Représentation mathématique des isothermes de
sorption
1.3.4.1 Chaleur de sorption
Ø Chaleur isostérique de sorption
La méthode la plus courante pour la
détermination de la chaleur de sorption (ÄHb),
résulte de l'équation Clausius-Clapeyron (Do Amaral Sobral et
al., 1999 ; Iglesias et al., 1989).
aw1
ÄHb 1 1
Ln ---- = ---- -- -
--
aw2 R
T1 T2
ÄHb : la chaleur de sorption (kJ/mole).
aw1 et aw2 sont les activités d'eau à des
températures T1 et T2 respectivement, R est une constante des gaz.
La chaleur isostérique (Qst) est ensuite
calculée par l'équation :
Qst = ÄHb + ÄHo
Dans laquelle ÄHo est la chaleur de vaporisation de l'eau
pure.
Ø Modèles théoriques d'isothermes
De très nombreux essais de modélisation
mathématique ont été tentés, deux voies ont
été explorées, la première consiste à
construire des équations théoriques intégrant des
propriétés caractéristiques de l'adsorption, la
deuxième voie plus utile en pratique consisterait à ajouter aux
résultats expérimentaux une équation empirique.
· Modèle BET
Parmi ces modèles thermiques l'un de ceux qui ont
été appliqués le plus souvent aux aliments est celui de
Baunauer, Emmett et Tellar (BET).
Cette équation fournit la valeur de la teneur en
humidité des couches superficielles (monocouche), qui est un
paramètre important dans l'étude des
détériorations des aliments (Erol et Tsami, 1991).
Le modèle BET est représenté par
l'équation suivante :
(Xm. C. aw)
X =
(1 - aw)(1 -.aw + C. aw)
C : constante de BET.
X : teneur en eau du produit (g /100g de matière
sèche).
Xm : teneur en eau correspondant à la couche
monomoléculaire (g /100g de matière sèche).
Le modèle BET est connu pour être utilisé
pour les aw jusqu'à environ 0.5 (Iglesias et al., 1989).
L'application de données de sorption avec l'équation de BET
même dans cette zone d'aw basse n'est pas toujours satisfaisante.
· Modèle GAB
Ces dernières années le modèle le plus
utilisé pour les isothermes de sorption a
été le modèle de GAB (Guggenheim, Anderson et Boer)
(Labuza et al., 1985). Ce modèle est le meilleur modèle
théorique pour les aliments, il est utilisé et accepté en
technologie alimentaire par tous les chercheurs en Europe (Bizot, 1989).
L'équation de GAB selon Kiranoudis et al.
(1993) :
(Xm. C. K. aw)
X =
(1 - K. aw)(1 - K.aw + C. K. aw)
D'où:
X : taux d'humidité de la matière.
Xm : Teneur en eau correspondante à l'occupation
de tous les sites de sorption de la couche monomoléculaire d'eau dans le
produit (exprimée en % par rapport à la matière
sèche).
aw : activité de l'eau.
C : Constante de GAB.
K: facteur correctif aux propriétés de la
multicouche.
D'après Do Amaral Sobral et
al. (1999), K augmente avec
l'élévation de la température. Du point de
vue énergétique, cela correspond à l'affaiblissement des
liaisons entre l'eau et les sites de sorption avec la température.
v Dans le cas de la désorption
C = C'. exp (?H1/RT)
Dont :
?H1 = (HL - Hm)
D'où :
HL: chaleur latente de vaporisation de l'eau
liquide (J/ mole), soit 43980 J/mole (10500cal/mole) sur le domaine (20
°C ; 80 °C).
Hm: chaleur totale de sorption de la couche
monomoléculaire (J/mole).
K= K'.exp (?H2 / RT)
Dont :
?H2 = (HL - Hq)
D'où :
Hq : chaleur totale de sorption de la
multicouche (J/mole).
V Dans le cas d'adsorption
C = C'. exp (?H1/RT)
Dont :
?H1 = (Hm -
Hq)
D'où :
HL : chaleur latente de vaporisation de l'eau
liquide (J/mole), soit 43980 J/mole (10500cal/mole) sur le domaine (20
°C ; 80 °C).
Hm: chaleur totale de sorption de la couche
monomoléculaire (J/mole).
K= K'.exp (?H2 / RT)
Dont :
?H2 = (HL -
Hq)
D'où :
Hq : chaleur totale de sorption de la
multicouche (J/mole).
Les trois constantes de GAB dépendent des
caractéristiques du produit et de la température, elles sont
déterminées à partir des résultats
expérimentaux.
Labuza et al. (1985) ont constaté que le taux
d'humidité de la couche monomoléculaire obtenu par
l'équation de GAB, ne diffère pas de celui obtenu par
l'équation de BET à un niveau de 95% signification pour chaque
température.
En effet, des tests de Erol et Tsami (1991), montre que la
valeur de Xm obtenue par les deux modèles décroît avec
l'augmentation de la température.
D'après Bizot (1983), le modèle GAB
présente l'avantage de décrire correctement les isothermes
de sorption des produits agroalimentaires pour des valeurs d'activité
d'eau ne dépassant pas 0.90. L'utilisation du
modèle BET est limitée à des activités de l'eau ne
dépassant pas 0.50 (Belarbi et al., 2000; Do Amaral Sobral
et al., 1999).
L'ajustement des valeurs expérimentales par le
modèle GAB et l'estimation de ses paramètres, se réalisent
à l'aide du logiciel STATISTICA dont la méthode
d'estimation utilisée est celle de quasi-Newton.
La qualité d'ajustement de ces modèles (BET et
GAB) est appréciée par Les valeurs de la moyenne relative du
pourcentage de déviation P (%).
? [(Xexp - Xcal) /
Xexp]2
P (%) = x 100
N
D'où Xexp et Xcal sont respectivement les teneurs en
eau expérimentales et calculées. Le N est le nombre de points
expérimentaux
1.3.5 Phénomène de
l'hystérésis
Pour un produit donné et pour une température
déterminée la courbe d'isotherme d'adsorption est
décalée par rapport à celle de désorption. Cette
non coïncidence des courbes est appelée :
Hystérésis, pour une même teneur en eau,
l'équilibre lors de la désorption s'établit à une
valeur d'aw plus faible que lors de l'adsorption. Un phénomène
similaire a été observé par Multon (1982) pour les
isothermes de sorption de la pomme de terre.
1.4 Intérêts pratiques des isothermes
d'adsorption-désorption pour la technologie alimentaire
1.4.1 Cas de l'adsorption
Ø Prévoir l'aw (encore difficile et
coûteux à mesurer) en fonction de la teneur en eau (séchage
des céréales en vue de leur stockage) ;
Ø Prévoir l'évolution de aw en
fonction de la modification de la teneur en eau (hydratation,
déshydratation) ou du passage, pour les denrées sucrées
(confiserie), du sucre de l'état amorphe à l'état
cristallin;
Ø Décider le mode de conditionnement
(étanche ou non, à la vapeur d'eau) pour une denrée en
fonction de l'humidité relative de l'atmosphère dans laquelle est
maintenue (sucre cristallisé en sacs de papier) ;
Ø permettre de calculer le nombre de sites actifs ou la
surface effective d'un produit. Cela intéresse aussi l'adsorption de
substances volatiles ou de gaz comme divers composés aromatiques,
l'oxygène et l'azote ;
Ø Prévoir l'activité de l'eau de
mélange de divers ingrédients plus ou moins humides ;
Ø Enfin les isothermes d'adsorption donnent la
possibilité de faire des prévisions sur le comportement
d'un aliment ; lors du traitement ou de l'entreposage, dans
des conditions que celles qui ont été étudiées
expérimentalement. Ce dernier présente un intérêt
pratique évident : voici quelques exemples concernant
principalement l'entreposage :
- Les courbes d'adsorption permettent de
prévoir l'influence des variations de l'humidité relative
ambiante sur la teneur en eau d'un produit non protégé. Elles
indiquent donc l'hygroscopicité du produit.
- Si la déshydratation d'un produit a
été effectuée au-delà d'un point optimum
Mo, on peut prévoir que la réhumidification
jusqu'à la teneur en eau correspondant à Mo ;
peut conduire, du fait de l'hystérésis, à une
activité de l'eau dangereusement
élevée (Cheftel, 1977).
1.4.2 Cas de la désorption
Les isothermes de désorption sont utiles pour
comprendre le séchage et le stockage des aliments, en
particulier :
Ø Pour prédire la teneur en eau minimale que
pourrait atteindre le produit en fin de séchage dans un air
donné. La température du produit serait égale à
celle de l'air. Son activité d'eau serait égale au
degré hygrométrique de l'air ;
Ø Pour relier les caractéristiques de l'air de
séchage à la teneur en eau de la surface
du produit ;
Ø Pour calculer la chaleur de désorption et
préciser la quantité d'énergie nécessaire
à l'élimination de l'eau la plus liée (Do Amaral Sobral et
al., 1999).
1.5 Altération des aliments et l'activité de
l'eau
Dans la figure 10, nous allons voir combien la notion
d'activité biologique de l'eau est primordiale en technologie
alimentaire. Elle permet de mettre en oeuvre une stratégie de protection
des aliments en contrôlant les détériorations
physico-chimiques, les activités enzymatiques et la multiplication
microbienne.
Fig. 10 : Vitesse de détérioration des aliments
en fonction de l'activité de l'eau. (Labuza, 1975).
MATERIEL ET METHODES
________________________________________________________________
1. MATERIEL VEGETAL
1.1. Le choix de la variété
La datte étudiée, la variété
Deglet-Nour, provient d'une unité de conditionnement de Biskra.
Elle est récoltée au mois de novembre 2003. Sa pleine
maturité s'est déroulée au mois d'Octobre-novembre. Le
choix de cette variété se justifie par son abondance au niveau du
marché national et sa qualité gustative appréciée
par le consommateur.
1.1.1. Caractéristiques du fruit (Fig. 11)
- longueur moyenne : 4.33 cm/ pulpe et 2.4
cm/noyau ;
- largeur moyenne : 2.2 cm/ pulpe et 0.6
cm/noyau ;
- poids moyen de la datte : 11.70 g ;
- poids moyen de la pulpe : 10.9 g ;
- poids moyen du noyau : 0.8g ;
- grain/Fruit : 0.08 g.
Afin de préserver les caractéristiques de
départ et éviter toutes altérations pouvant changer les
propriétés de notre échantillon ; ce dernier est
stocké à une température de + 4°C.


Fig. 11 : Caractéristiques morphologiques des
organes de fructification de la datte
variété Deglet-Nour.
2. METHODES D'ANALYSE
2.1. Détermination du taux d'humidité
2.1.1. But
C'est la détermination de l'humidité, afin de
savoir l'activité de l'eau (aw) de la datte.
2.1.2. Principe
C'est la dessiccation d'une prise d'essai à une
température voisine de 103 °C à la pression
atmosphérique jusqu'à l'obtention d'un poids constant.
Pour la détermination de l'humidité de
l'échantillon on a utilisé un analyseur d'humidité de type
SARTORIUS MA. Ainsi, les rayons infrarouges pénètrent dans
l'échantillon, le séchant rapidement dans un temps très
court de 5 à 15 minutes. L'humidité finale de
l'échantillon s'affiche en pourcentage lorsqu'on a le mot
«END» dans l'écran d'affichage (Affichage digital), à
cet instant on peut lire aussi le poids constant.
2.2. Dosage des glucides par la liqueur de
Fehling (Anonyme)
2.2.1. Principe de la réaction
Il s'agit d'utiliser la réaction des sucres
réducteurs avec la liqueur de Fehling pour évaluer la
concentration en sucre d'une solution. Les ions Cu2+ contenus dans
la liqueur de Fehling et responsables de la couleur bleue sont
transformés en ions Cu+ par le sucre réducteur. Ces
ions s'associent avec l'oxygène pour former de l'oxyde de cuivre
(Cu2O) qui donne un précipité rouge brique. La liqueur
de Fehling se décolore progressivement. Le dosage est
terminé lorsque la couleur bleue a disparu.
2.2.2. Matériels et réactifs
- carbonate de calcium ;
- acétate de plomb à 10 % ;
- oxalate de potassium ;
- liqueur de Fehling (50% de solution A et 50% de solution B.
mélange à faire le jour de la manipulation) :
* solution A : solution saturée de CuSO4 (environ 45 g/l).
*solution B : 200 g de tartrate double de potassium et de sodium, 4
H2O.
- 150 g de NaOH ;
- H2O quantité suffisante pour un
litre ;
- un agitateur magnétique chauffant et un
turbulent ;
- une burette graduée de 25 ml ;
- deux erlenmeyers de 100 ml ;
- une pipette graduée de 10 ml ;
- glucose solide ;
- une balance électronique ;
- eau distillée ;
- fiole jaugée de 100 ml ;
- Hcl 20% ;
- NaOH à 50%.
2.2.3. Extraction et purification des glucides
Ø Porter 10 g de l'échantillon à
l'ébullition pendant 30 min en présence de 300 ml d'eau
distillée et de 3 g de carbonate de calcium (CaCO3).
Ø Après l'extraction, il est nécessaire
d'effectuer une purification qui consiste à ajouter à l'extrait
une petite quantité d'acétate de plomb jusqu'à
l'apparition d'un précipité, puis de compléter avec 1
litre d'eau distillée, ensuite filtrer le contenu.
Ø L'élimination du plomb s'effectue par
l'addition au filtrat d'une petite quantité d'oxalate de potassium
[K2 (COO) 2 2H20], puis filtrer pour éliminer le précipité
d'acétate de plomb.
Pour vérifier si l'acétate de plomb a
été éliminé, on ajoute une petite quantité
d'oxalate de plomb dans un tube à essai. Si un précipité
apparaît, il faut ajouter de nouveau l'oxalate de potassium au
filtrat.
2.2.4. Mode opératoire
2.2.4.1. Réalisation du dosage témoin avec
une solution de glucose à une concentration C0 = 1 g / L
· Remplir la burette graduée avec la solution de
glucose à 1 g / L jusqu'à la graduation 0.
· Introduire 10 ml de liqueur de Fehling et le turbulent
dans un erlenmeyer de 100 ml.
· Placer l'erlenmeyer sur l'agitateur magnétique
chauffant et porter la liqueur de Fehling à une température de 95
°C.
· Verser la solution de glucose contenue dans la
burette goutte à goutte afin de minimiser les variations de
température. La solution se décolore progressivement au fur et
à mesure qu'apparaît un précipité rouge brique
d'oxyde de cuivre.
· Ajouter la solution de glucose jusqu'à
disparition de la teinte bleue de la solution.
· Conserver ce mélange comme témoin de
couleur pour le dosage suivant. D'après les conditions
expérimentales, V0 est compris entre 4,5 et 5,5 ml.
Réalisation du dosage test avec une solution de
concentration Cg inconnue en sucres réducteurs :
· Rincer la burette par l'eau distillée.
· Recommencer le dosage précédent en
plaçant 10 ml de liqueur de Fehling dans un autre erlenmeyer et en
remplissant la burette avec la solution à tester.
· Ajouter la solution de sucres de concentration inconnue
jusqu'à disparition de la teinte bleue de la solution. La teinte obtenue
doit être identique au témoin. On obtient alors le volume
V1 en ml.
2.2.4.2. Calculs
§ Soit n0, le nombre de molécules de
glucose utilisées pour transformer les ions Cu2+ en ions
Cu+ pour le dosage de la solution témoin.
§ Soit n1, le nombre de molécules de
glucose utilisées pour transformer les ions Cu2+ en ions
Cu+ pour le dosage de la solution test.
Le nombre de molécules de glucose utilisées pour
transformer les ions Cu2+ en ions Cu+ pour le dosage
témoin et le dosage test est identique.
Donc n0 = n1 et
C0.V0 = Cg.V1 par conséquent :
Cg (1) = C0.V0 /
V1 en g / L
2.2.5. Dosage des sucres totaux (réducteurs et non
réducteurs)
2.2.5.1. Hydrolyse chimique du saccharose
Ø Mettre dans une fiole à jauger de 100 ml, 50
ml de la solution de sucre (échantillon) et y ajouter 25 ml d'eau
distillée.
Ø Ajouter 10 ml de Hcl 20%.
Ø Chauffer à 70 °C pendant 20 minutes en
agitant d'un temps à autre.
Ø Refroidir à la température ambiante, puis
neutraliser la solution de NaOH (50%) en présence de
Phénolphtaléine.
Ø Compléter à 100 ml avec H2O
distillée.
Ø La solution obtenue est utilisée pour doser les
sucres réducteurs totaux.
2.2.5.2. Calculs
Exprimer le Cg (1) en pourcentage.
Cg (2) : Sucres réducteurs totaux en pourcentage.
Cg (2) = C0.V0 /
V2 en g / L
Enfin pour calculer le pourcentage des sucres non
réducteurs on utilise la formule
suivante :
(%) Sucres non réducteurs = (% sucres totaux
réducteurs*0.9)-(%Sucres réducteurs)
2.3. Détermination de la teneur en cendre (NF V
03-922)
2.3.1. Principe
Incinération d'une prise d'essai dans une
atmosphère oxydante, à une température de 550
+ 15°C jusqu'à combustion complète de la
matière organique et pesée du résidu
obtenu.
2.3.2. Matériels et méthodes
- balance analytique ;
- dessiccateur garni d'un agent déshydratant
efficace ;
- capsule en porcelaine ;
- four à moufle réglé à 550
+ 15°C.
2.3.3. Mode opératoire
· Chauffer durant 10 min les capsules dans un four
réglé à 550 + 15°C, les laisser en
suite refroidir à la température ambiante dans un dessiccateur
et les peser à 0.1mg prés.
· Dans les capsules, peser 2 à 6 g
d'échantillon broyé. Placer les capsules et leurs contenus dans
le four régler à 550 + 15°C. Poursuivre
l'incinération jusqu'à disparition des particules charbonneuses
qui peuvent être incluses dans le résidu pour obtenir une couleur
grise, claire ou blanchâtre.
· Retirer les capsules du four et les mettre à
refroidir dans le dessiccateur jusqu'à la température ambiante et
puis les peser.
2.3.4. Expression des résultats
Le pourcentage des cendres est calculé selon la
formule suivante :
Teneur en cendre : (%MS) = (M2-
M0) × 100
(M1-M0)
M0 : masse en gramme de la
capsule vide d'incinération ;
M1 : masse en gramme
de la capsule d'incinération chargée de la prise
d'essai ;
M2 : masse en gramme de
la capsule d'incinération chargée des cendres.
2.4. Détermination de l'acidité titrable (NF V
05-101)
2.4.1. Méthode utilisée
L'acidité titrable est déterminée par une
méthode en utilisant un indicateur coloré. (Afnor, 1986).
2.4.2. Principe
Cette norme décrit une méthode de
détermination de l'acidité titrable des produits
dérivés des fruits et légumes en utilisant une solution
d'hydroxyde de sodium en présence de Phénolphtaléine comme
indicateur.
2.4.3. Matériels et réactifs
- mortier ;
- pipette jaugée de
25 ml ;
- fiole jaugée de
250 ml ;
- réfrigérant
à reflux ;
- burette de 100
ml ;
- bêcher de 100
ml ;
- balance ;
- hydroxyde de sodium :
solution titrée 0,1 N ;
-
phénophtaléine Solution à 10 g litre d'éthanol
à 95 %.
2.4.4. Mode opératoire
Dans le cas des produits déshydratés ou
séchés, on découpe en petits morceaux une partie de
l'échantillon pour le laboratoire.
Homogénéiser le poids, peser à
0,01 g prés au moins 25 g de l'échantillon à analyser, les
placer dans une fiole conique avec 50 ml d'eau distillée chaude
récemment bouillie et refroidie, puis bien mélanger
jusqu'à l'obtention d'un liquide homogène.
Adapter un réfrigérant à
reflux à la fiole conique puis chauffer le contenu au bain d'eau
bouillante pendant 30 mn.
Refroidir, transvaser quantitativement le continu de la fiole
conique dans une fiole jaugée de 250 ml et compléter jusqu'au
trait de jauge de l'eau distillée récemment bouillie et
refroidie. Bien mélanger, puis filtrer.
Prélever à la pipette 25 ml,
50 ml ou 100 ml de l'échantillon pour essai selon l'acidité
présumée et les verser dans un bêcher.
Ajouter de 0,25 à 0,5 ml de
Phénolphtaléine et tout en agitant, verser à l'aide de
la solution d'hydroxyde de sodium jusqu'à l'obtention d'une
couleur rose persistante pendant 30 secondes. Effectuer deux
déterminations sur le même échantillon pour essai.
2.4.5. Mode de calcul
L'acidité titrable, exprimée en
milliéquivalent pour 100 ml ou 100 g de produit est
égale à:
Acidité = (250 . V1 . 100 ) / (
Vo . M . 10 )
Où :
M : la masse, en grammes, de produit
prélevé ;
V0 : le volume en
millilitres de la prise d'essai ;
V1 : le volume en millilitres de la
solution d'hydroxyde de sodium 0.1 N utilisé.
Il est également possible d'exprimer
conventionnellement l'acidité titrable en grammes d'acides pour 100 g
ou 100 ml de produit en multipliant par le facteur correspondant à
l'acide (Voir Tableau 9).
Tableau 9 : Acidité exprimée en fonction de
l'acide (g /100g de produit).
(Afnor, 1986)
|
Acide
|
Facteur
|
|
Acide malique
|
0.067
|
|
Acide oxalique
|
0.045
|
|
Acide citrique monohydraté
|
0.070
|
|
Acide tartrique
|
0.075
|
|
Acide sulfurique
|
0.049
|
|
Acide acétique
|
0.060
|
|
Acide lactique
|
0.090
|
3. MATERIEL TECHNIQUE
Séchoir de laboratoire (Soufflerie)
Le séchoir expérimental du laboratoire est une
soufflerie (Voir figure13a et 13b), utilisée pour sécher les
dattes. Il est composé de deux parties distinctes :
Ø La soufflerie.
Ø L'enceinte de séchage.
Soufflerie
Elle est constituée de :
· Un ventilateur hélicoïdal.
· Un système de chauffage d'air.
3.1.1.1 Ventilateur
Le Ventilateur situé en amant de la soufflerie, sert
à créer un courant d'air vapo-transporteur et de le canaliser
vers l'enceinte de séchage.
3.1.1.2 Système de chauffage d'air
Constitué de plusieurs résistances
électriques, qui servent à chauffer l'air, sont divisées
en deux parties :
· La première partie : constituée de
résistances immergées dans un bac d'eau doté d'une
puissance de 5 kW, qui servent à chauffer l'air et à
l'humidifier.
· La deuxième partie : constituée de
résistances qui se positionnent dans le même sens du courant d'air
créé par le ventilateur. Leur puissance est de 3kW.
La soufflerie communique avec l'enceinte de séchage
par l'intermédiaire d'une plaque métallique de forme cylindrique
calorifugée, dont le diamètre est de 16.5cm.
3.1.2 Enceinte de séchage
L'enceinte de séchage de hauteur de 48 cm,
d'une largeur de 28.5 cm et d'une longueur de 29 cm. A sa partie
supérieure se trouve une vitre en Plexiglas qui permet
de visualiser le contenu de l'enceinte. Au-dessous de l'enceinte de
séchage, une balance de précision de type Sartorius
(0.01g) assure la mesure du poids des dattes par le
biais d'un support de claie qui se trouve juste sur le plateau de la balance.
Cette dernière est reliée à un micro-ordinateur.
L'enceinte de séchage est calorifugée par une
couche de liège. Elle est dotée de deux
thermomètres : l'un sert a déterminer la température
sèche de l'air de séchage et l'autre à
déterminer la température humide.
Batteries de chauffage
Calorifuge
Variation de vitesse de la soufflerie
Ts s
Th
Conduit de vapeur
Ventilateur
Enceinte de séchage
Echantillon
Support
Résistances
Balance
Micro-ordinateur
Datte
Fig. 12 : Schéma du dispositif
expérimental pour la détermination de la cinétique
de séchage (soufflerie).

![]()
Fig. 13a : Séchoir de laboratoire : soufflerie
(vue d'avant).

Fig. 13b : Séchoir de laboratoire : soufflerie
(vue d'arrière).
4. PROTOCOLES EXPERIMENTAUX
Les isothermes de désorption-adsorption (D'après
Jannot, 2003)
Les isothermes de désorption-adsorption sont d'une
grande importance dans les industries agro-alimentaires et
notamment dans les opérations de séchage, de stockage et de
conservation des aliments.
L'étude des isothermes de
désorption-adsorption permet d'assurer un meilleur stockage des
denrées et une détermination rationnelle des limites de
séchage.
(Adambounou et al., 1983).
4.1.1 Objectif
L'objectif principal de cette étude consiste à
déterminer expérimentalement les isothermes de
désorption-adsorption des dattes à différentes
températures, en utilisant la méthode statique
standardisée (Jannot, 2003 et Multon, 1981).
4.1.2 Principe
L'étude consiste à amener en phase vapeur ;
le produit sec (adsorption) ou humide (désorption) en équilibre
avec une atmosphère d'humidité relative (H.R)
déterminée, dans une enceinte spécialement conçue
à cet effet.
4.1.3 Matériels
Les dattes utilisées sont de la variété
Deglet-Nour. Ces dernières sont mises à adsorber ou
à désorber dans des enceintes qui maintiennent à une
température et H.R constante, le temps nécessaire pour atteindre
l'équilibre. Dix hygrostats de un litre (cuve en verre) ont
été utilisés (voir figure 15). Chaque hygrostat contient
une solution d'acide sulfurique (H2 SO4) à une
concentration bien déterminée pour prévenir une
humidité relative constante bien définie (voir figure 14).
4.1.4 Méthode
De fines tranches de la datte (1 à 2 mm
d'épaisseur approximativement) sont coupées à partir
d'un échantillon représentatif afin de faciliter l'échange
entre le milieu environnant.
Pour le cas de la préparation de l'adsorption, des
échantillons d'environ 50 g sont placés dans des pots
de pesée et prés séchés dans une enceinte
hermétique, contenant l'acide sulfurique (H2SO4)
à une concentration de 96 % pendant 15 jours
à une température de chambre.
Quatre applications d'échantillons (hydratés ou
desséchés) sont placés dans chacune des 10
hygrostats (4 capsules/ hygrostat) et équilibrés avec adsorption
ou désorption de vapeur d'eau à une humidité relative et
une température constante (Voir la figure 14).
Une étuve était utilisée pour maintenir
les températures choisies (25, 30 et 40 °C).
L'équilibre est atteint dans 15 jours ou plus (lorsque
la différence de masse entre trois pesées consécutives
étaient inférieures à 2%, la durée entre les
pesées est de 24 h).
A des aw élevées (aw > 0.7), des cristaux de
thymol ont été placés dans les hygrostats pour
éviter le développement des moisissures.
Le temps total pour enlever, peser et replacer les
échantillons était limité à environ 30 secondes
(recommandé par COST 90).
Le taux d'humidité équilibré était
déterminé par l'humidimètre à infrarouge.
Tableau 10 : Valeurs de l'aw de solution d'acide
sulfurique en fonction de la concentration (% volume/volume) et de la
température (Multon, 1981).
|
Concentration
%
(volume/volume)
|
Température de la solution et de l'air (°C)
|
|
25
|
30
|
40
|
|
10
|
94.29
|
94.27
|
95.62
|
|
20
|
87.56
|
87.36
|
87.85
|
|
25
|
81.66
|
81.70
|
83.42
|
|
30
|
74.93
|
74.79
|
75.37
|
|
35
|
66.51
|
66.62
|
67.42
|
|
40
|
56.83
|
56.56
|
57.48
|
|
45
|
45.88
|
46.19
|
47.00
|
|
50
|
35.57
|
35.51
|
36.69
|
|
55
|
25.89
|
26.05
|
26.75
|
|
60
|
16.71
|
17.00
|
17.80
|
|
65
|
9.43
|
9.71
|
10.23
|
|
70
|
4.34
|
4.52
|
4.97
|
|
75
|
1.72
|
1.82
|
2.06
|
|
80
|
0.52
|
0.58
|
0.69
|
|
85
|
0.16
|
0.18
|
0.23
|
|
90
|
0.03
|
0.04
|
0.05
|
|
95
|
-
|
-
|
0.01
|
(1)
(2)
(3)
(4)
![]()
(5)
![]()
Fig. 14 : Schéma d'une unité du dispositif
expérimental (Hygrostat).
(1) : Bocal à fermeture étanche.
(2) : Enceinte.
(3) : Capsule contenant le produit.
(4) : Support en verre troué.
(5) : Solution d'acide sulfurique à une concentration
déterminée (100 ml).

![]()
Fig. 15 : Les hygrostats utilisés pour la
détermination des isothermes de
désorption-adsorption.
4.2 Cinétique de séchage
4.2.1 Objectif
C'est de voir l'évolution du poids en fonction du temps
(allure de séchage), ainsi que l'effet des conditions
(température et vitesse de l'air) sur la cinétique de
séchage.
4.2.2 Principe
Il consiste à faire sécher des dattes dans un
courant d'air chaud (température et vitesse bien
définies) et de tracer la courbe décrivant la perte de poids en
fonction du temps de séchage.
4.2.3 Matériels
Le séchage est effectué par une soufflerie (la
vitesse et la température du courant d'air sont
contrôlées).
4.2.4 Procédure
Après la préparation des échantillons,
les dattes sont mises sur une claie (dans l'enceinte de séchage)
connectée directement à une balance de précision. Un
courant d'air chaud et sec envoyé par la soufflerie, dont la
température et la vitesse sont réglées, assure le
séchage par entraînement des dattes.
Le poids de l'échantillon était pris dans un
intervalle de temps bien défini assurant son évolution en
fonction du temps de séchage.
La température sèche et humide de l'air de
séchage et de l'air ambiant est prise chaque demi-heure.
Tableau 11 : Conditions d'essai de séchage.
|
Vitesse de l'air (m/s)
|
Température (°C)
|
|
0.5
1
1.5
|
30
30
30
|
|
0.5
1
1.5
|
40
40
40
|
| 


