CHAPITRE I
AEROTHERMOCHIMIE ET STOECHIOMETRIE
1) Introduction
Un gaz en réaction est un mélange non isotherme
d'espèces multiples (hydrocarbures, oxygène, eau, dioxyde de
carbone, etc.) qui doivent être suivies individuellement et
instantanément. Les données thermodynamiques sont
également plus complexes que dans l'aérodynamique classique car
les chaleurs spécifiques changement dans le gaz réactif de
façon significative avec la température et la composition.
v' Les espèces réagissent chimiquement avec des
vitesses (taux de réactions) qui exigent des modélisations
spécifiques.
v' Etant donné que le gaz en réaction est un
mélange de plusieurs espèces, les coefficients de transport
(diffusivité thermique, diffusion des espèces, viscosité,
etc.) nécessitent une attention particulière.
La dérivation des équations de conservation de
la masse, des espèces ou des bilans d'énergie peut être
trouvé dans les ouvrages classiques tels que ceux de Williams, Kuo ou
M ?
Candel [6]. Dans ce chapitre on se limite à citer les
différentes formes utilisées dans les
M ?
codes de calcul et sur leurs implications pour des techniques
numériques 2) Choix des variables primitives
La combustion implique multiples espèces qui
réagissant dans diverses réactions chimiques. Ces espèces
sont caractérisées par leurs fractions massiques Yk pour k = 1
à N, où N est le nombre d'espèces dans le mélange
réactif. Les fractions de masse Yk sont définis par:
(1.1)
Où Mk et sont respectivement : la masse et la
densité de l'esSqFeINIprésente dans un
volume donné V, M est la masse totale de gaz dans ce
volume.
Les variables primitives pour le cas tridimensionnel
réactif sont:
·
(1.4)
(1.5)
(1.6)
La densité,
(1.2)
· Les vitesses dans les trois directions i
(i=1,2 et 3)
· Une seule variable pour l'énergie (enthalpie h ou
température T)
· Les fractions massiques Yk des espèces
Il faut donc calculer N+5 variables au lieu de 5 dans le cas
non réactif. Sachant que la combustion implique un grand nombre
d'espèces (N est supérieur à 50 pour la plupart des
hydrocarbures simples), l'effort de calcul est considérable dans la
simulation des
n M
k
X Y
écoulements réactifs (vu le nombre
d'équations de conservation à résoudre). n M
tot k
3) Notions sur la thermochimie
Il est nécessaire de définir quelques variables
usuelles ainsi que des notions de la thermochimie. Commençons par
l'équations d'état du gaz parfait qui relie la pression, la
température et la densité du gaz en question:

(1.3)
Pour un mélange gazeux la masse molaire du gaz est
calculée par :
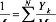
La fraction molaire Xk de l'espèce k s'écrit :
Où n est le nombre de molles.
La concentration [Xk] de l'espèce k est donnée par
:
T
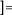
L'énergie sensible de l'espèce k est donnée
par :
(1.7)
I.'entIia1pie sensible J.e III 1 I 11111 II I I 1111111111 II
33 33 3
IE1.' LI Ll1IpLIL1I Lillilil I I I I I III I I III I I I I HI I I
I I I I I I I I I I liii I I I I I II I I II I 1IflJ JJ LII I III I I I Ii
IIIIIIIIIII!
33 3' 3
LIILLI] ' LLIientha1pie JLflhi1JI III HII 11111
IL II H
33 33 ' 3
I H IL Ij LiIIIJJLIJ_p H I I I H I H I H I ILl H H II I H HIll I
liii H I I1IJI I I I I I H 11111 LH I H Hi I' LI Hill
IWH'erithalpie
LLImJI1Lour former 1kg de l'i I I III ILIIIIIII III H ILLhIL1J p
I IIJJ' II
33 33 3 3
|
____ 1 i iii ii
|
3LJJ L1
|
|
Ahm
fk
3LJ fflLJ3L1
|
|
|
''''JLI1
|
|
|
|
'J'''LI1
|
'3''33L11
|
|
|
!33J!
|
'J' JLI1
|
|
|
|
''''JLI1
|
|
|
'3'''JLI1
|
'J'333LI1
|
|
3! !
|
!
|
!
|
|
3! !
|
!
|
!
|
|
'3'J3LI1
|
'LII
|
'LII
|

4) La stoechiométrie dans les flammes
prémélangées
Dans la combustion prémélangée le fuel et
l'oxydant sont mélangé avant d'entrer dans la chambre de
combustion.
Considérons la réaction globale suivante
Par exemple ( + o0. --> CO. + oll.0 ). Les constantes
sont les coefficients
stoechiométriques correspondants au fuel et à
l'oxydant.
m n défini le rapport stoechiométrique s par
(1.12
(1.13
(1.1
La richesse du mélange est définie p

Qui s'écrit aussi

vec et sont les débits massiques du fuel et de
l'oxydant
La richesse est un paramètre principal pour les gaz
prémélangé
· 0 > 1 combustion riche en fuel
· 0 < 1 combustion pauvre en fuel
Dans les flammes hydrocarbures/air, CIEIBFtiR(EP DAiqXe
EdXEIXeEEstATFKiRP pITiIXeE ( =1 ) est donnée par :
(1.15)
/ IiIEpta(tEFRP SRspEd'X(eEP RleEE'Rx\ Jq(eETIET.76 EP
ROEdIE(itARTq(1E3(EYRlXP Hi ELe tableau suivant donne quelques valeurs du
coefficient VATFKiRP pITiqXeEsEItElEEIrIFtiR(E P DAiqXIEstATFKiRP ptriqXe
EdXEIXel ( =1).
|
Réactions globale
|
s
|
Y:
|
|
CH4 +2(02 +3.76N2)
-*CO2 +2H20 +7.52N2
|
4.00
|
0.055
|
|
C3H8 +5(02 + 3.76N2)
-->3CO2 +4H20 +18.8N2
|
3.63
|
0.060
|
|
2C81/18 + 25(02 +
3.76N2) -->16CO2 +18H20 +
94N2
|
3.51
|
0.062
|
|
2H2 + (02 + 3.76N2) -->
2H20 + 3.76N2
|
8.00
|
0.028
|
Tableau (1.2) :valeurs de S et Y pour quelque réactions
&I EtIRDIXEP R(t11E1Xe ESRXrEaYRi1EX(e EFRP
FXstiR(EstATFKiRP pITiqXE, ENEqXE(titpEdXE combustible injectée est
très faible comparativement à l'air qui est composé en
grande partie par l'azote.
5) Equation de conservation des
espèces
Puisque notre travail consiste à étudier les
écoulements réactifs, on va détailler la procédure
de déduction de l'équation de conservation de la masse de
n'importe quelle espèce dans un mélange multi composants. Cette
déduction va se faire en prenant simultanément le taux de
réaction en g 3 et en 3 ce qui va permettre d'introduire le loi de
Fick.
Nous commençons par faire un bilan de masse sur un
élément fluide arbitraire dans un mélange binaire.
Appliquons la loi de conservation de la masse sur un élément de
volume
z fixe dans un espace à travers lequel un mélange
binaire des espèces A et B s'écoule et réagit.
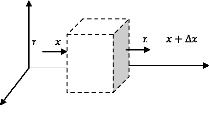
y
? I
? I
X
Figure(1.1)
Z
Dans ce volume de contrôle infinitésimal,
l'espèce A peut être produite ou consommée par
réaction chimique avec un taux ? g 3 . Si ? , l'espèce A est
consommée. Les différents thermes qui contribuent à
l'équilibre massique sont :
Le taux d'accumulation de la masse de l'espèce dans le
volume de contrôle
t z (1.16)
Les flux de A entrants et sortants dans le volume par la
direction x respectivement aux positions x et sont
?
/ z (1.17)
?
z (1.18)
Le taux de production de l'espèce A par la réaction
chimique ? z
?
est le taux de production spécifique de A.
Le même principe est appliqué aux autres directions,
on somme puis on divise par z ce qui donne :
( ?
?
? ~
~ ) ? (1.19)
~
|
C'est l'équation de continuité du composant A,
elle
|
aussi appelée l'équation de
|
|
?
|
?
|
?
|
|
conservation du masse d'espece A. Les quantités
|
|
|
|
|
z sont les composantes
|
|
|
|
z
|
scalaires du vecteur du flux de masse ? , dans le rectangle de
coordonné. Dans la notation
vectorielle, l'équation s'écrit :
t rh ci) (1.20)
D e la même façon, l'équation de la
continuité du composant B est
t B
rh ci) (1.21)
D ans un mélange binaire, une espèce peut se
convertir vers l'autre et vice versa. Le taux
de production d'une espèce et égal au taux de
destruction de la deuxième ce qui implique
que la somme des équations (1.20) et (1.21) donne
l'équation de conservation du mélange
t V (1.22)
Pour obtenir l'équation (1.22), on a utilisé ? ? l
et ? ?
Pour un fluide de densité massique constante
l'équation (1.22) devient : ~
G On va maintenant faire le développement en terme de 3 ,
Si ? est le
taux molaire de production de A par unité de volume, alors
l'analogue molaire de l'équation (1.20) est :
En remplaçant ? V -- ~ dans l'équation (1.20) on
obtient :
t V Y ? (1.24)
Avec l la vitesse massique de diffusion et dans B
En remplaçant aussi ? V -- dans l'équation (1.24)
on obtient :
Oil V est la vitesse molaire de diffusion [6]
Si on a pas de réaction chimique, les taux de
réactions massiques et molaires ? , ? , ? , et ? sont nuls. Si en plus,
V est nulle dans l'équation 5 ou ~ est nulle dans l'équation
|
6, on obtient :
|
c
t
|
(1.26)
|
Cette relation est dite "la deuxième loi de Fick de
diffusion" . Cette équation est généralement
utilisée pour la diffusion dans les solides, les liquides
stationnaires,... Cette équation est similaire à
l'équation de la conduction de la chaleur :

(1.27)
t
A l'aide de les relations ~ et v v V pour un système multi
composants,
l'équation 3 devient :
~ [~ ~ V ] ? (1.28)
t
L'équation ci-dessus dans sa forme de divergence peut
être réduite à la forme d'Euler. Par expansion des termes
à gauche on a :
Y
t
Y
t
~ ~ ~ ~ ~ ~ ? (1.29)
Alor on obtient :

t
Y v( ? Y ) -- v( ) ? (1.30)

Avec le flux de diffusion moléculaire. On adopte la loi de
Fick pour le transport diffusif de la masse :
?
_ Y (1.31)
Avec le coefficient de diffusion moléculaire de
l'espéce .
6) Mécanismes réactionnels et taux de
réaction
On a vu que chaque espèce dans le mélange gazeux
doit être représentée par une équation de
conservation. Cette dernière décrit l'évolution de
l'espèce donnée dans l'espace et dans le temps. Dans le milieu
réactif, plusieurs espèces entrent en compétition chacune
avec un taux de réaction bien déterminé.
Pour expliquer la méthode de calcul du taux de
réaction, prenons une partie d'un mécanisme réactionnel de
la combustion de l'hydrogène dans l'oxygène -- .
(1.33) (1.34) (1.35) (1.36) (1.37) (1.38)
Ou Kf et K sont les coefficients du taux
élémentaire de réaction dans le sens direct (gauche
à droite) et dans le sens inverse de la réaction j.
Par exemple, le taux net de production d'oxyg~ne est la somme
de tous les taux élémentaires des réactions qui produisent
l'oxyg~ne moins la somme de tous les taux élémentaires des
réactions qui consomment l'oxygqne.
|
[0 1
t
|
~ [ ][ ] K [ ][ ] K [ ][ ]
|
--Kf [ ][ ] -- Kf [ ][ ] -- Kf [ ] (1.39)
De la même façon, on peut écrire cette
expression pour chaque espèce qui participe dans le mécanisme.
Cela donne un ensemble d'équations différentielles ordinaires du
premier ordre qui représentent l'évolution du système
chimique à partir des conditions initiales :
|
[ ] t
t
|
{[ ] [ ] ... [ ] } (1.40)
|
Avec [ ] [ ~
Une fois qu'on a trouvé taux de réactions
élémentaires, on peut résoudre les équations de
conservations des espèces et finalement trouver toutes les variables
primitives.
7) Formulation générale pour le calcul du
taux de réaction
Un mécanisme réactionnel peut être
écrit sous une forme compacte, pour une réaction
élémentaire i, qui combine N (j=1,N) espèces chimiques, on
écrit
~ ~ì
? ~ ~ ~ìì
~ (1.41)
~
|
Où ~ì et ~ìì
produits.
|
sont les coefficients stoechiométriques respectivement
des réactifs et des
|
Pour expliquer cette notation, reprenons les réactions
(1.33)- (1.38), qui combinent six espèces à savoir :
On définit j comme espèce et i comme
réaction selon la table suivante:
|
j
|
Espèces
|
i
|
Réaction
|
|
1
|
|
1
|
(1.33)
|
|
2
|
|
2
|
(1.34)
|
|
3
|
|
3
|
(1.35)
|
|
4
|
|
4
|
(1.36)
|
|
5
|
|
5
|
(1.37)
|
|
6
|
|
6
|
(1.38)
|
D'autre part, on utilise j comme l'indexe des colonnes et i des
lignes, ce qui donne une matrice des coefficients stoechiométriques
et
On remarque que la réaction élémentaire
implique au maximum trois à quatre espèces réactives, ce
qui fait que la matrice des coefficients est presque nulle lorsque le nombre
d'espèce est grand.
Le taux de production de l'espèce j est calculé en
sommant sur toutes les réactions i, il est donné par
cb El1= t q j=1.2...N (1.42)
0
Oil
|
0Et
|
iì ~ìì ?? 1
|
-- ~ì (1.43)
|
q Kf ?i1= [ ] ì j -- K ?i1= [ ]
ììi
(1.44)
Le taux de production ? correspond au terme gauche des
équations (1.39) et (1.40), on a pour un mécanisme complet
?
[dt l (1.45)
L'équation (1.44) définit le taux de progression q
pour la réaction élémentaire, par
exemple pour la
réaction (1.33), on pose i=1ce qui donne
q Kf [ ] [ ] [ ] [ ~ [ ] [ ~
--K [ ] [ ] [ ] [ ] [ ] [ ] (1.46)
q Kf [ ] [ ] K [ ] [ ] (1.47)
De même façon on écrit les expressions pour
i=2.3...6, et on somme l'équation (1.42) pour obtenir le taux de
réaction ? .
Le calcul des constantes et constitue un problème central
dans la modélisation
de combustion. Souvent, elles sont modélisées en
par la loi empirique d'Arrhenius qui est basée sur l'observation
expérimentale.
8) Approximation de la combustion par une seule
réaction globale
Pour simplifier les calculs, on approxime la combustion par
une réaction globale d'une mole de fuel avec « á »
moles d'oxygène pour produire « â » moles d'un produit
de combustion P
F á â 1 (1.48)
D'une part on facilite les calculs, et d'autre part perd des
informations sur les espèces intermédiaires qui sont parfois
très importantes.
'apr~s l'expérience, le taux de réaction du fuel
est donné par
|
[ ]
t
|
KG [ ] [ O ] (1.49)
|
Avec [ ] concentration molaire 3 de l'esp~ce i dans le
mélange,
KG est le coefficient du taux global de réaction qui est
généralement fonction de la température,
Les exposants n, m sont reliés aux coefficients
stoechiométriques de la réaction, d'après
l'équation (1.49) le fuel est dit d'ordre n et le combustible d'ordre
m.
9) Approximation par un mécanisme
réactionnel formé par des réactions
élémentaires Dans le cas général, la
combustion est approximé par un mécanisme réactionnel
formé
par plusieurs réactions élémentaires. La
plus part des réactions élémentaires concernant la
combustion sont « bi moléculaires » c'est-à-dire deux
molécules réagissent pour donner deux molécules
différents :
Le taux de réaction s'écrit en fonction de la
concentration molaire de [A]
|
[ ]
t
|
3
K ano [ ] [ ] ( )
k o / (1.50)
|
Le coefficient K o est donné par [6]
(1.51)
*~ +
T
K o
Cette formule est donnée par l'expérience. Les
constantes A, c et (l'énergie
d'activation) sont tabulées et donnée pour chaque
mécanisme réactionnel.
Dans ce qui suit un exemple qui montre un mécanisme
réactionnel H2-O2 (9 espèces et 19 réactions)
écrit sous un format universel dit format : CHEMKIN [8] (les
commentaires entre parenthèses ne font pas partie du mécanisme,
elles sont données à titre explicatif)
ELEMENTS
H O N F (dans cette ligne on un les elements chimiques)
END SPECIES
H2 O2 OH O H H2O HO2 H2O2 N2 F (ici les espèces
chimiques)
END
REACTIONS F ( dans ce qui suit les reactions
élémentaires)
(Réaction const. A c Ea)
H2+O2=OH+OH 1.700E13 0.0 47780.0
H2+OH=H2O+H 1.170E09 1.30 3626.0
H+O2=OH+O 5.130E16 -0.816 16507.0
O+H2=OH+H 1.800E10 1.0 8826.0
H+O2+M=HO2+M 2.100E18 -1.0 0.0
H2/3.3/ O2/0./ N2/0./
H2O/21.0/
H+O2+O2=HO2+O2 6.700E19 -1.42 0.0
H+O2+N2=HO2+N2 6.700E19 -1.42 0.0
OH+HO2=H2O+O2 5.000E13 0.0 1000.0
H+HO2=OH+OH 2.500E14 0.0 1900.0
O+HO2=O2+OH 4.800E13 0.0 1000.0
|
Aérothermochimie et stoechiométrie
|
|
|
19
|
|
OH+OH=O+H2O
|
6.000E08
|
1.3
|
0.0
|
|
H2+M=H+H+M
|
2.230E12
|
0.5
|
92600.0
|
|
H2/3./ H/2./ H2O/6.0/
|
|
|
|
|
O2+M=O+O+M
|
1.850E11
|
0.5
|
95560.0
|
|
H+OH+M=H2O+M
|
7.500E23
|
-2.6
|
0.0
|
|
H2O/20.0/
|
|
|
|
|
HO2+H=H2+O2
|
2.500E13
|
0.0
|
700.0
|
|
HO2+HO2=H2O2+O2
|
2.000E12
|
0.0
|
0.0
|
|
H2O2+M=OH+OH+M
|
1.300E17
|
0.0
|
45500.0
|
|
H2O2+H=H2+HO2
|
1.600E12
|
0.0
|
3800.0
|
|
H2O2+OH=H2O+HO2
|
1.000E13
|
0.0
|
1800.0
|
|
END
|
|
|
|
|
10) Conclusion
|
|
|
|
Ce chapitre représente la formulation
mathématique du phénomène, les détails de calcul du
taux de production pour une réaction globale, la conservation des
espèces. Ainsi, que des notions sur la thermochimie et la \toeFKLRP
ptrLe.J
| 


