Introduction
Matérielset méthodes
Localisation du site d'étude et échantillonnage
«
Description macro- et micro-morphologique des croûtes
microbiotiques et évaluation du taux
decouverture...................... « «
Mesure de l'hydrophobicité
0
Mesure de la teneur en chlorophylle
a.............................................................................
1
... 10 ... 11 11
Analyses statistiques
Résultatsobtenus
Description de la surface des croûtes à la loupe
binoculaire................................................ <
Échantillons provenant de la butte
sableuse............................................................
1
1
12
13 ... 17 ... 19 21 . 23 . 26 27
Échantillons provenant d'une zone en dépression
entre deux buttes sableuses
Échantillons des croûtes développées
sur plaquage sableux
Observationau MEB
Hydrophobicité des croûtes microbiotiques
La teneur en chlorophylle
a.....................................................................................
<
Discussion des résultats
Conclusion et
perspectives.........................................................................................
Référencesbibliographiques
«
Introduction
Les régions arides et semi-arides sont
caractérisées par un couvert végétal discontinu.
Les zones dépourvues de végétation peuvent
néanmoins être colonisées par des micro-organismes et
« microphytes » formant des croûtes superficielles, connues
dans la littérature sous divers noms: croûtes microbiotiques
(dénomination que nous utiliserons tout au long de ce rapport),
croûtes biologiques du sol (Biological soil crusts : BSC) (Belnap et
Gardner 1993 ; West 1990), croûtes cryptogamiques, cryptobiotiques,
microflorales, microphytiques (West 1990; Belnap 2006), biogéniques
(Orlovsky et al. 2004; Nisha et al. 2007) et croûtes biologiques du
désert (Garcia-Pichel et Belnap 1996; Garcia-Pichel et al. 2001).
Les croûtes microbiotiques sont constituées
d'organismes autotrophes ou hétérotrophes, intimement
associés aux particules minérales du sol : principalement des
Cyanobactéries accompagnées de Bactéries
photosynthétiques ou non, Algues, Bryophytes (Mousses,
Hépatiques), Champignons et Lichens (Smith et al. 2004; Büdel 2005;
Bowker 2007). Malgré une littérature abondante, la typologie des
croûtes microbiotiques n'est pas définitivement établie.
Ceci est notamment dL au fait que l'aspect, la biomasse et les espèces
microbiennes présentes varient considérablement en fonction du
régime climatique et du type de sol (Belnap et al. 2001 et 2007, Belnap
2006). Parmi les critères utilisés pour établir les
différentes classifications, on trouve : la couleur des croûtes,
(ex. Hahn et Kusserow 1998), leur structure, le type d'organismes
prépondérant (Belnap et al. 2001), la biomasse
bactérienne, l'aspect extérieur et la micromorphologie (lisses,
rugueuses, à pinacles et onduleuses) (Belnap 2006).
Il est bien établi que les croûtes
microbiotiques, et plus généralement les Cyanobactéries,
ont un effet positif sur les propriétés chimiques et physiques
des sols. Sous l'angle chimique, cet effet tient tout d'abord aux
capacités métaboliques des Cyanobactéries (Garcia-Pichel
et Belnap 1996), mais aussi aux propriétés intrinsèques de
leurs enveloppes mucilagineuses. Par la combinaison de leur capacité
à réaliser la photosynthèse et dans certains cas la
fixation de l'azote atmosphérique, elles forment une source
d'entrée de C et N pour les régions à faible
productivité (Malam Issa et al. 2001b ; Acea et al. 2003 ; Brostoff et
al. 2005 ; Tirkey et Adhikary 2005 ; Nisha et al. 2007). Grâce à
leur enveloppe mucilagineuse, les Cyanobactéries sont capables de fixer
certains éléments nutritifs, comme le Fe, Zn, Mo, Cu, Mn
(Vaishampayan et al. 2001). Sous l'angle physique, les croItes microbiotiques
favorisent l'agrégation du sol et la stabilité structurale gr~ce
au piégeage des particules grossières par le réseau de
filaments des Cyanobactéries et la cimentation des particules fines par
leurs sécrétions polysaccharidiques (EPS) (Falchini et al 1996;
Malam Issa et al. 2001a et 2007 ; Nisha et al. 2007 ; Maqubela et al. 2009).
Ceci entraîne une augmentation de la résistance du sol
vis-à-vis de l'érosion hydrique et de l'érosion
éolienne, qui sont d'importants acteurs de la désertification
(Belnap et Gillette 1997 ; Eldridge et Leys 2003 ; Zhang et al. 2006). En
outre, les particules d'argiles chargées négativement qui collent
à la surface adhésive de l'enveloppe polysaccharidique sont le
siège de fixation des éléments chimiques de charge
positive, ce qui constitue une réserve d'éléments
nutritifs pour les plantes (Belnap et Gardner. 1993). Les croEtes
microbiotiques ont aussi un effet sur l'amélioration de la
capacité de rétention de l'eau. Ceci est la conséquence de
la capacité des constituants polysaccharidiques des
Cyanobactéries à absorber de l'eau par gonflement par suite d'une
simple humectation, et à retenir énergiquement celle-ci
grâce à des forces intenses de capillarité
(Belnap et Gardner 1993; Atwood et Krannitz 1999 ;
Défarge et al. 1999 ; Malam Issa et al. 2008). Au contraire,
malgré des nombreux travaux sur les croItes microbiotiques, leur
rôle sur l'infiltration et le ruissellement, est mal connu. Pour certains
auteurs l'infiltration de l'eau est favorisée au niveau des croEtes
microbiotiques (Eldridge 1993, Pérez 1997) ; Pour d'autres les croEtes
microbiotiques sont défavorables à l'infiltration et conduisent
à des phénomènes intenses de ruissellement (Kidron et al.
1999 ; Malam Issa et al. 2008), ou n'ont aucune influence sur l'infiltration
(Eldridge et al. 1997 ; Williams et al. 1999). Le comportement des sols
couverts de croûtes microbiotiques vis-à-vis de l'eau
dépendrait du type de sol et de ses propriétés physiques
(texture, porosité, rugosité...), mais aussi du comportement des
composés organiques des micro-organismes des croItes en présence
de l'eau (hydrophobicité et capacité de rétention en eau).
La connaissance de ces différentes propriétés et
caractéristiques est nécessaire à la compréhension
du comportement contradictoire observé au droit des sols couverts de
croûtes microbiotiques vis-à-vis de l'eau.
Dans la partie occidentale du Niger, les croûtes
microbiotiques couvrent des vastes surfaces notamment dans les champs mis en
jachères et la brousse tigrée (Malam Issa 1999). Elles sont
majoritairement constituées par des Cyanobactéries (Hahn et
Kusserow 1998; Malam Issa et al. 1999, 2001 et 2008). Les premiers travaux sur
les croûtes microbiotiques du Niger se sont limités à la
détermination des espèces présentes (Hahn et Kusserow
1998). Malam Issa (1999) a réalisé les premiers travaux sur les
caractéristiques morphologiques et structurales des croEtes
microbiotiques en zone sahélienne du Niger par la mise en oeuvre d'une
méthodologie comprenant des observations à différents
niveaux d'organisation. Ces travaux ont permis des avancées dans la
connaissance des caractéristiques morphologiques et micromorphologiques
de la surface et du profil de croûtes microbiotiques (Malam Issa et al.
1999 ; 2001a). Ils ont permis la compréhension des processus de mise en
place et de la dynamique d'évolution des cro~tes, d'une part, sur les
sols sableux et argilo-sableux de la brousse tigrée (Fig. 3) et d'autre
part, sur les sols sableux des surfaces mises en jachères. Ces
résultats ont servi de base jà l'élaboration d'un projet
de recherche intitulé BIOCRUST «Vulnérabilité des
cro~tes biologiques et dégradation des sols en zones sahélienne
a», financé par l'ANR (Agence Nationale de la Recherche)
et coordonné par le GEGENA2 (Groupe d'Étude sur les
Géomatériaux et Environnements Naturels, Anthropiques et
Archéologiques). Ce projet a pour objectif d'utiliser les cro~tes
microbiotiques comme un indicateur précoce de l'altération des
fonctions des écosystèmes sahéliens face aux changements
climatiques et aux changements d'usage de terres. Il comprend l'étude
à l'échelle locale et régionale des
caractéristiques physiques, chimiques et biologiques des croûtes
microbiotiques et celle de la vulnérabilité de leurs fonctions
écologiques.
Notre étude est inscrite dans le cadre du projet
BIOCRUST. Elle a eu pour objectif de comprendre le comportement des
croûtes microbiotiques vis-à-vis de l'eau à travers la
mesure de l'hydrophobicité. Nous avons étudié
l'hydrophobicité de la surface des croEtes biologiques provenant de la
région de Banizoumbou dans la partie occidentale du Niger. Les
croûtes microbiotiques ont été prélevées sur
des parcelles en jachère soit mises en défens,
c'est-à-dire protégés contre le passage du bétail
et des humains, soit ouvertes au pâturage et au passage des hommes. Notre
travail a également porté sur la mesure des paramètres
liés à la biomasse des organismes constituants les croûtes
microbiotiques, notamment le taux de couverture et la teneur en chlorophylle
a. Ces paramètres seront confrontés avec le taux
d'hydrophobicité des différentes croItes
microbiotiques.
Le rapport est organisé comme suit. Une première
partie sera consacrée à la présentation des sites et des
échantillons étudiés, ainsi que les méthodes
d'étude employées. La présentation des résultats
acquis dans le cadre de cette étude fera l'objet d'une deuxième
partie. Une dernière partie sera consacrée à la discussion
des résultats. La conclusion portera sur l'exposé des
résultats majeurs et leur portée dans la compréhension de
la dynamique de l'eau au droit des sols portant les croEtes microbiotiques.
Matériels et méthodes
Localisation du site d'étude et
échantillonnage
Les échantillons étudiés proviennent du
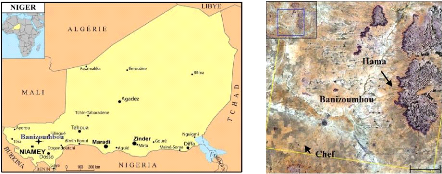
site de Banizoumbou, dans la partie occidentale du Niger (Sahel), à 70
km au nord-est de la capitale Niamey (Fig. 1). Le site d'étude est
situé dans le domaine sahélien, le climat est marqué par
deux saisons : une saison humide d'environ 4 mois (Juin à Septembre),
une saison sèche d'environ 8 mois (Octobre à Mai). Le
régime pluviométrique est irrégulier, avec
généralement un maximum au mois d'Ao~t, et une moyenne annuelle
de précipitations proches de 560 mm (Le Barbé et Lebel, 1997).
2 km
Figure 1 : Localisation de la région
d'étude. Figure 2 : Localisation des sites de
prélèvement.
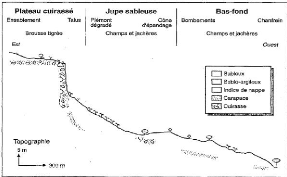
Figure 3 : Différentes unités
géomorphologiques de la région de Banizoumbou (d'après
Courault et al. 1990).
La figure 3 fait ressortir, sur un transect, l'agencement des
différentes unités géomorphologiques rencontrées
dans la zone de Banizoumbou, où on rencontre :
- Des plateaux : formés par des formations
géologiques appelées continental terminal (CT). Ce sont des
surface planes sur lesquelles se forment des plaquages sableux d'origine
éolienne. Ils sont caractérisés par une pente très
faible (maximum 1 %).
- Des jupes sableuses (buttes sableuses): formées par des
dépôts éoliens datant du quaternaire, avec une pente de 2
à 4 %. Elles constituent le domaine des terres de culture.
- Des bas fonds : formés par des dépôts
d'eaux de ruissellement, leur pente est de l'ordre de 3 à 4 %.
En dehors des zones cultivées, la couverture
végétale naturelle est représentée par une savane
arbustive, dominée par les deux espèces Guiera senegalensis
et Combretum micranthum, accompagnée par une strate
herbacée, formée par des espèces annuelles dont Zornia
glodichiata, Ctenium elegans, Microchlora indica, Cyanotis lanata, Sida ovata,
Pennisetum pedicellatum, Fimbristilys sp., Schirizacarium exile, Walteria
indica, Digitaria horizontales, Boreria distichophylla et Andropogon
gayanus.
Les sols sont essentiellement de texture limoneuse à
limono-sableuse, avec une faible teneur en matière organique, ce qui les
rend plus susceptibles à l'encro1tement physique.
Pour plus de détails sur la région et les sites
d'études, une bonne description a été faite par Malam Issa
(1999).
Dix prélèvements ont été
effectués sur les trois parcelles choisies (Tableau. 1, Fig. 2). En
effet, le choix des sites et des parcelles de prélèvement avait
pour objectif de présenter des niveaux variables de développement
des croûtes microbiotiques.
La parcelle HMd est une parcelle de 40x40 m mise en
défens depuis plus de 10 ans et située au sommet d'une butte
sableuse. Quatre prélèvements y ont été
effectués sur un transect E-W perpendiculaire à la pente : HMd 1
et 2 vers l'intérieur de la parcelle, HMd 3 et 4 vers
l'extérieur. Les croûtes de cette parcelle sont bien
développées avec une forme rugueuse et une couleur noire.
La parcelle HMp est située au sommet d'un plaquage
sableux, et en jachère pâturée. Elle a fourni les
prélèvements HMp 5 et 6. Les croûtes dans cette parcelle
sont moins développées, avec une forme plus au moins lisse, elles
couvrent d'une manière irrégulière la surface,
la couleur des cro~tes varie entre rouge noir et noir avec parfois des
taches noires.
La parcelle CHd est située à environ 9 km des
précédentes. Elle correspond à une jachère en
défens depuis la même période que la parcelle
protégée de Hama. Les prélèvements CHd 1 et 2 ont
été effectués au sommet d'une butte sableuse. Les
croûtes ont un aspect rugueux et une couleur noire. Les
prélèvements CHd 3 et 4 ont été effectués au
pied de la butte sableuse, dans une zone en dépression entre deux buttes
sableuses, avec une surface partiellement couverte de croûtes
microbiotiques de couleur rouge.
Des fragments de croûtes microbiotiques ont
été prélevés soigneusement aux différents
points décrits plus haut, durant le mois de Janvier 2009. Les
échantillons ont été placés dans des sachets
transparents hermétiques et transportés ensuite au laboratoire.
Pour chacun des 10 prélèvements, 10 fragments de croûte ont
été sélectionnés, préférentiellement
les plus grands (environ 5 à 16 cm2 et 1.5 à 10 g)
(Fig. 4), ils ont subi ensuite les différentes analyses
présentées ci-dessous.
Tableau 1 Récapitulatif des parcelles
et des prélèvements effectués.
Site
|
Etat de la parcelle
|
Topographie de la surface
|
Echantillons
|
Désignation
|
Hama
|
Jachère en défens
|
Butte sableuse
|
1
|
HMd 1
|
|
|
|
2
|
HMd 2
|
|
|
|
3
|
HMd 3
|
|
|
|
4
|
HMd 4
|
|
Jachère pâturée
|
Plaquage sableux
|
5
|
HMp 5
|
|
|
|
6
|
HMp 6
|
Chef
|
Jachère en défens
|
Butte sableuse
|
1
|
CHd 1
|
|
|
|
2
|
CHd 2
|
|
|
Dépression entre deux
|
3
|
CHd 3
|
|
|
buttes sableuses
|
4
|
CHd 4
|
|

Figure 4 : Vue des fragments de
croûtes analysés. La surface des fragments varie entre 5 à
16 cm2 et leur poids et de 1,5 à 10g).
Les fragments de croIte ont subi d'abord les analyses
non-destructives (observations macro- et microscopiques, hydrophobicité)
puis les analyses destructives (mesure de la teneur en chlorophylle
a).
Description macro- et micro-morphologique des croûtes
microbiotiques et évaluation du taux de couverture
Les fragments de croûte ont été
examinés, en commençant par une observation macroscopique de
l'aspect externe (forme, aspect, couleur et épaisseur), suivie par une
observation microscopique de la surface et de l'organisation interne des
croItes. Les critères d'observation et de comparaison entre
échantillons étaient les différentes
caractéristiques des filaments (forme, couleur, taille, abondance,
organisation ...etc.).
La loupe binoculaire (Olympus BX60) utilisée permet
d'observer la surface des croEtes avec un grossissement de 7,5 jà 120x.
L'existence de reliefs à la surface des cro~tes est, dans une
certaine mesure, compensée par le réglage de profondeur du champ
(diaphragme réglable). Cet appareil est relié à une
caméra Sony DXC #177; 930P, connectée à un ordinateur, ce
qui nous permet de visualiser directement la surface des croEtes sur
l'ordinateur, d'analyser et prendre des images en mrme temps, à l'aide
de trois logiciels édités par Microvision (Areas 6.0.0,
Archimède 5.0.0 et Saisam 6.0.0).
Le logiciel Areas 6.0.0 grkce à l'option
détection de phases, permet de distinguer les différents
composants de la croûte en fonction de leur couleur : partie
minérale et filaments. Les résultats (proportions) sont fournis
sous forme de tableau ou enregistrés directement dans un fichier texte.
Cinq mesures ont été réalisées sur chaque fragment
de croûte sur une surface de 2,5 mm2, puis moyennées.
Une moyenne générale pour chaque site a été
calculée.
Un microscope électronique à balayage (MEB)
(HITACHI TM - 1000) a été également utilisé, pour
une observation plus fine des filaments, jusqu'à un grossissement de
5000x. Les échantillons sont introduits sans préparation
particulière, maintenus sur la platine par un scotch carbone. Les
paramètres d'observation sont les suivants : tension
d'accélération 15 KV, courant émis environ 100 IAA,
distance de travail environ 8 mm.
Mesure de l'hydrophobicité
L'hydrophobicité d'un sol est sa tendance à
résister à la pénétration de l'eau (Woche et al.
2005 ; Leelamanie et al. 2008). Elle peut être mesurée par
différentes méthodes : (i) Mesure du temps de
pénétration de la goutte d'eau à l'intérieur des
agrégats (WDPT : Water Drop Penetration Time) (DeBano 1981), (ii)
Molarité d'une goutte de solution eau #177; éthanol (MED :
Molarity of an Ethanol Droplet) (Doerr 1998), (iii) Mesure de l'angle de
contact que fait la goutte d'eau avec la surface du sol (Bachmann et al. 2000 ;
Leelamanie et al. 2008).
La mesure de l'hydrophobicité sur des
échantillons séchés au laboratoire détermine
l'hydrophobicité potentielle, par contre celle mesurée
directement sur champs sous les conditions naturelles notamment
l'humidité contenue donne l'hydrophobicité réelle (Dekker
et Ritsema 1994; Fox et al. 2007).
Dans cette étude, la méthode WDPT a
été utilisée. C'est une méthode simple, facile
à mettre en oeuvre et qui fournit des résultats immédiats.
Son principe, décrit par Dekker et Ritsema (1994) consiste à
déposer soigneusement une goutte d'eau
déminéralisée à la surface du sol et à
enregistrer le temps que met la goutte pour disparaitre totalement de la
surface par absorption. Pour éviter la modification de la tension de
surface de la goutte d'eau (Dekker et Ritsema 2000), l'essai a
été mené dans une chambre de culture en conditions
contrôlées. Le protocole expérimental utilisé
était le suivant :
- Les fragments de croûtes ont été
placés dans des boites et laissés à l'étuve
à 45°C, 48 h avant l'essai, afin de les sécher et avoir un
taux d'humidité identique pour toutes les cro~tes.
- Ils ont ensuite été transférés
dans une chambre à conditions contrôlées
(température de 24°C et une humidité relative de l'air de 48
%). Les croûtes y séjournent une heure avant le test, pour les
équilibrer avec les conditions de la chambre.
- -- l'aide d'une micropipette réglable, 3 à 5
gouttes d'eau déminéralisée de 5 IAl ont été
déposées sur chaque fragment de croûte (en fonction de sa
surface).
- Le temps qui s'écoule entre le dépôt de la
goutte d'eau et sa pénétration totale a été
mesuré à l'aide d'un chronomètre.
On utilise la classification de Dekker et Ritsema (1994), pour
caractériser le niveau de l'hydrophobicité (Tableau 2).
Tableau 2 Classes d'hydrophobicité
d'après Dekker et Ritsema (1994).
WDPT (s) Classe de l'hydrophobicité
<5
5 #177; 60
60 #177; 600
600 #177; 3600
>3600
|
Mouillable ; non hydrophobe Légèrement hydrophobe
Fortement hydrophobe Sévèrement hydrophobe Extrêmement
hydrophobe
|
|
Mesure de la teneur en chlorophylle a
La concentration en pigments chlorophylliens a été
déterminée après extraction à l'éthanol :
Immédiatement après la mesure
d'hydrophobicité, les fragments de croûtes ont été
séchés à l'étuve (45°C pendant 16 h) et la
surface de chaque fragment de croûte a été
déterminée ;
La partie supérieure des croûtes a
été séparée de la partie inférieure par
grattage. Les deux parties séparées ont été
pesées à l'aide d'une balance de précision puis
broyées ;
0,5 g du sol est placé dans un tube contenant 5 ml
d'éthanol à 90 %, agité pour homogénéiser
l'éthanol sur l'ensemble du contenu ;
Les tubes sont ensuite placés dans l'étuve
à une température de 75°C (ébullition de
l'éthanol) pendant 3 heures. Après ce délai, les tubes
sont transférés au réfrigérateur, et gardés
à l'obscurité pendant une nuit pour limiter la formation sous
l'effet de la lumière et de la chaleur des pigments de
dégradation (phéopigments) ;
L'absorption de l'échantillon à 665 nm est
mesurée à l'aide d'un spectrophotomètre (Thermo GENESYS 10
UVScanning), et la quantité de la chlorophylle a est
calculée en utilisant un facteur de conversion de 72,3 mg chl/ml, selon
l'équation suivante :
(QChl: Quantité de chlorophylle a (mg/g),
Abs665: Absorbance à 665 nm) (Malam Isssa 1999) ;
La quantité de chlorophylle a a été
calculée pour les deux parties de la croûte (superficielle et
sous-jacente) ;
Finalement la quantité de chlorophylle a a
été calculée par unité de masse et par unité
de surface de sol pour chaque partie.
Analyse statistique des résultats
Les résultats de mesure du taux de couverture, de
l'hydrophobicité et de la quantité de chlorophylle a,
ont été traités par deux logiciels : Excel (Microsoft
Office 2007) et Minitab 13.20.
Résultats obtenus
Description de la surface des croûtes à la
loupe binoculaire
Le Tableau 3 resume les resultats de l'observation à
la loupe binoculaire. La presentation des resultats d'observations à la
loupe et de mesures du taux de couverture par le logiciel Areas sera basee sur
le regroupement des echantillons en trois groupes selon les caracteristiques de
leur parcelle d'origine :
- Les échantillons provenant de la surface
d'une butte sableuse. Ils regroupent les échantillons des
parcelles en defens : HMd 1, 2, 3, 4 et CHd 1et 2 ;
- Les échantillons provenant d'une zone en
dépression entre deux buttes sableuses. Cette categorie comprend des
echantillons des parcelle en defens : CHd 3 et 4 ;
- Les echantillons sur plaquage sableux. Ils regroupent les
echantillons de la parcelle pâturee: HMp 5 et 6. Échantillons
provenant de butte sableuse
Les croûtes qui couvrent la surface de la butte
sableuse sont epaisses de 0,5 à 4 mm. Elles montrent une adherence
faible vis-à-vis du substrat sableux sous-jacent. Leur surface est
irregulière et granuleuse due à la presence des particules
minerales grossières et de quelques morceaux de debris de vegetaux,
ainsi que des bosses de 0,5 à 1,5 mm visibles par endroit. Elles sont de
couleur noire et parfois rouge noire en relation avec la couleur de
Cyanobacteries qui les constituent (Photo 2 et 4, pl. I). Au total, on
distingue des filaments de couleur noire, rouge et rouge noire et des
organismes coccoïdes.
Les filaments sont abondants à la surface de ces
croûtes. Ils representent 30 à 52 % de la surface totale des
croûtes. Ils sont colles les uns aux autres grâce à une
substance brillante ou produits de secretions polysaccharidiques (EPS),
particulièrement abondantes dans les echantillons du site Chef (photo 2,
pl. I). On distingue quatre types de filaments selon la couleur de leurs
pigments :
Des filaments noirs epais dont la longueur peut atteindre
1500 um, qui dominent la surface. Parfois ils sont accompagnes par des petits
filaments noirs formant des amas denses et isoles (photo 3, pl. I). Certains de
ces filaments noirs sont ramifies, ils forment un reseau touffu surtout dans
les zones irregulières oft la microtopographie est complexe, et se
dressent vers la surface formant des pinacles d'une longueur de 300 à
900 um (ils sont peu abondants).
Des filaments rouges de petite taille, peu épais et long
d'environ 150 um ; ils sont rares et ne s'organisent pas en reseau.
Des filaments rouges noir~tres d'épaisseur moyenne, longs
de 400 à 800 um ; peu abondants, ils forment un reseau en association
avec les filaments noirs.
Les organismes coccoïdes correspondent à des
Cyanobacteries appartenant au genre Nostocale. Elles sont
constituees par
des filaments organises en colonies de forme spherique (boulette). Ces
organismes sont de
couleur très sombre à noire. Leur taille varie
entre 80 à 200 um. Ils sont présents en abondance,
particulièrement dans les endroits oft la densité des autres
filaments est faible. Parfois on les trouve en faible densité à
la surface du réseau de filaments (elles sont nombreuses et petites
surtout dans les échantillons de Chef) (photo 4, pl. I).
Le taux de couverture organique varie entre les
différents prélèvements réalisés à la
surface de la butte sableuse. Le taux de couverture organique le plus
élevé est observé sur les prélèvements issus
des parcelles en défens de la butte sableuse HMd 1 et 2 (48 à 52
% de recouvrement par les filaments ; Fig. 5a) et CHd 2 (52 % de recouvrement
par les filaments ; Fig. 5a). Le taux de couverture mesuré dans les
autres parcelles est beaucoup plus faible : 32 % de filaments pour HMd 3 et 34
% de filaments, pour les parcelles en défens de Chef (CHd 1), là
oft il y a une forte présence de débris de
végétaux.
Les filaments sont absents dans la partie inférieure de
la croûte, dominée par les particules minérales (photo 1,
pl. I). Ces particules minérales sont de forme arrondie et une couleur
transparente et parfois orange ou rouge. Leur taille varie entre 20 à
250 um.
Échantillons provenant d'une zone en
dépression entre deux buttes sableuses
Les croûtes qui couvrent la surface de cette zone sont
épaisses de 2 à 5 mm. Elles sont issues de la superposition de 2
ou 3 générations de croEtes sous l'effet de l'entraînement
des particules minérales et organiques par l'action de l'eau
et du vent (cro~tes de dépôt), et montrent une forte
adhérence vis-à-vis du substrat sous-jacent. Leur surface se
caractérise par un aspect généralement lisse (CHd 3) et
parfois irrégulier (CHd 4). On observe parfois une structure
alvéolaire (en nid d'abeille, photo 5, pl. I) issue de l'association de
plusieurs filaments. La taille de ces alvéoles couvrant la
surface des cro~tes est d'environ 0,5 à 1 mm (structure
dominante chez CHd 4, et absente chez tous les autres échantillons). La
surface de ces croûtes est également caractérisée
par des structures de desquamation représentée par des plaquettes
qui se détachent de la surface.
Ces croûtes sont caractérisées par une
couleur rouge typique. Les filaments sont peu abondants et inégalement
repartis à la surface des croûtes. Ils sont
généralement couverts par les particules minérales
(généralement de petite taille), de ce fait, ils ne
représentent que 11 et 21 % (CHd 3, CHd 4) de la surface observée
(photo 6, pl. I, Fig. 5b). Ils ne montrent pas une organisation en
réseau, à l'exception de certains cas où ils forment un
réseau profond composés de filaments couverts par les particules
minérales fines, laissant entre eux des pores d'une taille voisine de 40
à 100 um.
On distingue 4 types de filaments :
Les filaments rouges sont les plus abondants, avec une petite
taille, variant entre 100 et 250 um, ils forment un réseau profond en
association avec des filaments rouges noirs ;
Les filaments rouges noirs sont abondants, de longueur moyenne
(500 à 900 um), ils se trouvent partout même en dessous des
croûtes. Souvent ils sont associés avec les filaments rouges ;
Les filaments noirs sont de grande taille, ils sont plus
longs que les autres filaments (600 à 1550 um) mais en faible abondance,
et repartis d'une manière aléatoire à la surface ;
Les boulettes de Nostoc sont présentes en abondance,
elles ont une taille petite par rapport aux échantillons de la butte
sableuse, elles se trouvent parfois regroupées et parfois
isolées, avec une taille de 20 à 60 um,
généralement elles sont couvertes par les particules
minérales ce qui les rendent moins visibles. Les substances brillantes
sont présentes à la surface des filaments et des boulettes.
Les particules minérales sont très abondantes en
surface (taux de recouvrement 62 à 68 %, Fig. 5b). Les particules fines
de couleur rouge ou orange sont les plus abondantes et adhérent parfois
à la surface des filaments et des boulettes et s'unissent parfois avec
les particules grossières pour former des agrégats de 250
à 1000 um. Les particules grossières sont peu abondantes, elles
sont enserrées entre les filaments, avec une taille qui peut atteindre
300 um.
Échantillons des croûtes
développées sur plaquage sableux
Les croûtes qui couvrent la surface de plaquages
sableux sont épaisses de 2 à 3 mm. Elles montrent une faible
adhérence vis-à-vis du substrat sableux sous-jacent. Leur surface
se caractérise par la prédominance des particules
minérales, dont la taille varie entre 8 et 280 um, transparentes ou de
couleur rouge ou orange. Elles donnent à la surface des croûtes un
aspect grenu et une couleur rouge noirâtre à noire.
Les filaments sont moins abondants et moins denses (taux de
couverture : 16 à 28 %, Fig. 5c). On distingue différentes formes
de filaments :
Des filaments noirs de petite taille (100 à 300 um),
formant des amas isolés et denses (photo 7, pl. I); ce sont les formes
les plus abondantes ;
Des filaments noirs épais et longs (400 à 1220
um), qui se trouvent en association avec d'autres filaments de même
couleur et de petite taille, pour former des amas moins denses que les
précédents ;
Un réseau de filaments dense localisé sur
certains endroits; formé par l'association à une proportion
égale de différents types de filaments : filaments noirs de
petite taille, filaments noirs de grande taille et filaments rouges noirs ;
Des filaments transparents de petite taille et d'une forme
ramifiée (peu abondants), ils forment parfois des pinacles
(pédicelles);
On trouve également en abondance des petits filaments
rouges isolés à la surface dont la taille ne dépasse pas
100 um. Les boulettes de Nostoc sont peu abondantes, cependant elles sont de
plus grande taille que dans les autres échantillons (50 à 350 um)
(photo 8, pl. I). Elles sont parfois regroupées en des amas
constitués de 2, 3 voire 4 boulettes ce qui les rend visibles a l'oeil
nu (points noirs observés sur certaines croEtes).






b

Figure 5 : Résultats de
l'évaluation de taux de couverture par le logiciel Areas 6.0.0 (a et b :
échantillons de la jachère en défens, c:
échantillons de la jachère pâturée).
La surface de la parcelle pâturée (HMp 5 et 6)
est très faiblement couverte de filaments (16 à 28 %), alors que
les particules minérales sont abondantes (72 à 84 %). Mis
à part pour les prélèvements CHd 3 et 4 situées
dans la zone de dépression (qui reçoit des éléments
entraînés par l'érosion hydrique ou éolienne), les
parcelles en défens sont fortement couvertes de filaments (Fig. 5c).
HMd 1 HMd 2 HMd 3 HMd 4

1
2
Q
Q
P
F
P
Q
EPS
EPS
100um
100um
3 F
4
BN
F
Q
F
300um
200um
5
6
F
F
F
450um
120um
7
8
BN
F
Q
Q
F
200um
F
300um
F
BN
15
Planche I Observation à la loupe
binoculaire de la surface des croûtes microbiotiques.
Abréviations F: filaments,
Q: quartz, BN: boulette de Nostoc,
P: pore
(1).Vue de la partie inférieure des
croûtes des échantillons de la butte sableuse, montre une surface
sans filaments. (2) (3) (4). Vues de la surface des
croûtes des échantillons de la butte sableuse montrant : un
réseau de filaments dense et touffu avec des produits de
sécrétions (2), un amas denses et isolés
formés de filaments noirs, longs et épais, avec des petits
filaments noirs (3), des boulettes de Nostoc à la
surface (4). (5) (6). Vues de la surface des
croûtes des échantillons de la dépression entre deux buttes
sableuses montrant : une structure alvéolaire (5), des
filaments peu abondants à la surface (6). (7)
(8). Vues de la surface des croûtes des échantillons du
plaquage sableux montrant : des Amas de filaments isolés et denses
(7), des boulettes de Nostoc de grande taille associées
au réseau de filaments (8).
Tableau 3 Éléments constitutifs
de la surface des croûtes microbiotiques étudiées
Abréviation : ?:
Elément rare, +: Peu abondant, ++:
Abondant, +++: Très abondant, N:
Noire, R: Rouge, RN: Rouge noir,
Tr: Transparent, BN: Boulette de Nostoc,
P: Pinacle, EPS: Produits de
sécrétion extracellulaire.
Etat des parcelles Substrat
|
Caractéristiques
de la croûte Filaments Élements minéraux
Résidus de végétaux
|
|
Épaisseur (mm) Couleur N R RN Tr BN P EPS Taille (um)
Abondance
|
|
|
Butte sableuse 0,5 à 4 N +++ + ++ + ++ ++ + 20 à
250 + +
Parcelles en jachères
Dépression entre deux 2 à 5 R + +++ ++ + ++ ? ++ 1
à 300 +++ +++
buttes sableuses
Parcelle pâturée Plaquage sableux 2 à 6 RN
++ ++ ++ + + + ? 8 à 280 +++ +
Observation au MEB
L'observation des échantillons à
l'échelle du MEB a permis de décrire plus en détail
l'organisation et la structure des filaments formant les croûtes, ainsi
que leur association avec les particules minerales. Nous presentons les
resultats obtenus sur des echantillons provenant de la surface des parcelles en
defens (butte sableuse : HMd 1, 2, 3, 4 et CHd 1, 2 ; zone en depression au
sein d'une butte sableuse : CHd 3 et 4), et ceux issus de la parcelle
pâturee (placage sableux : HMp 5 et 6).
Les echantillons issus de la parcelle en defens Hama
revèlent la presence de deux categories de filaments. Des filaments dont
l'epaisseur varie entre 7 et 15 um, constitues par une gaine protectrice dont
la surface est lisse ou formee de nombreux replis (photo 3, pl. II). La gaine
est parfois couverte par des secretions de nature mucilagineuse qui permettent
la liaison entre les filaments (photo 3, pl. II). Ils sont organises en un
reseau superficiel au sein duquel sont piegees les particules grossières
(photo 1, pl. II). Ce reseau est touffu est mal organise, contenant des
filaments dresses verticalement qui forment des pinacles (photo 2, pl. II).
Cette categorie correspond à des filaments noirs. La deuxième
categorie est representee par des filaments dont la surface externe est
torsadee, avec une epaisseur egale à celle des filaments noirs. Ce sont
des filaments rouges et rouges noirs.
L'imbrication du réseau de filaments et de la fraction
minérale est assuré par l'enserrement des particules
grossières dont la taille est comprise entre 50 et 250 um dans le reseau
de filaments (photo 4, pl. II), et par le collage des particules fines de
taille de moins de 2 um à la surface adhesive des filaments (photo 3 et
4, pl. II).
L'observation des echantillons CHd 1 et 2 au MEB
revèle la presence de filaments d'une epaisseur de 10 à 20 um,
associés en faisceau grIce à l'action des produits de
secrétions extracellulaires (photo 5, pl. II). Un reseau touffu
associant une porosite superficielle resulte de la disposition des filaments
(photo 5, pl. II). Celui-ci fixe les particules minerales. Les filaments en
faisceau sont accompagnes par des boulettes de Nostoc, composees de
l'association de plusieurs filaments reunis et entremêles. Les boulettes
contribuent egalement à la fixation de particules minerales au sein de
la croûte.
Les parcelles situees dans la zone de depression entre les
deux buttes sableuses sont composees majoritairement de filaments torsades,
entièrement couverts par les particules minerales de differente taille
grâce à la presence en abondance de produits de secretions
à leur surface (photo 6, pl. II).
La surface des croûtes de la parcelle pâturee,
montre une faible abondance des filaments (photo 7, pl. II), elle est composee
de filaments dont les constituants externes sont torsades (filaments rouge et
rouge noirs), et des filaments de surface lisse (filaments noirs). Les
particules minerales fines sont associees entre elles en agregats dont la
taille varie de 50 à 200 um grâce à des EPS.
Au MEB, la surface des organismes cocoïdes apparaît
ornee de nombreuses circonvolutions, qui leur donnent une allure mamelonnee.
Elles sont regroupees en colonies dont la taille atteint 150 à 250 um
(photo 8, pl. II).

5 6
F
7 8
3
1 2
P
F
F
F
EPS
Q
Q
Q
4
Q
F
Q
BN
F
Q
F
Planche II: Observation de la surface des
croûtes microbiotiques au MEB.
Abréviations: F:
Filaments, Q: Quartz, BN: Boulette de Nostoc,
EPS: Produits de sécrétions extracellulaires,
P: Pore
(1) (2) (3) (4) (5). Observations de la
surface des croûtes des échantillons de la butte sableuse
montrant: un réseau de filaments dense et touffu (1)
des filaments dressés verticalement (2), une
gaine vide couverte par des produits de sécrétions
(3), une particule de quartz emprisonnée dans le
réseau de filament (4), des pores crées par
l'organisation en réseau des filaments (5).
(6). Observation de la surface des croûtes des
échantillons de la dépression entre deux buttes sableuses montre
des filaments couverts par les particules fines. (7) (8).
Observations de la surface des croûtes des échantillons
du plaquage sableux montrant : une surface sans filaments (7),
3 boulettes de Nostoc regroupées, dont la surface montre une allure
mamelonnée (8).
Hydrophobicité des croûtes
microbiotiques
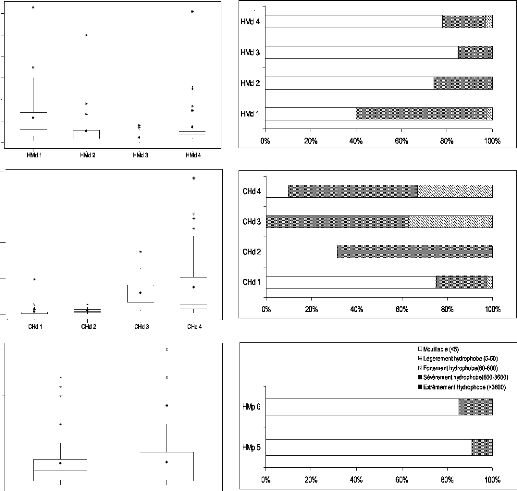
L'hydrophobicite potentielle de la surface de croûtes
microbiotiques a ete mesuree par le test de penetration de la goutte d'eau
(WDPT). Les resultats de ces mesures sont regroupes dans les figures 6 et 7.
Le temps de penetration de la goutte d'eau montre une grande
variabilite selon les differents echantillons de croûtes (figure 6).
Des temps de pénétration de la goutte d'eau
variant entre 1 à 63 s ont été enregistrés sur les
échantillons de la parcelle Hama en defens. Le temps de penetration le
plus eleve (63 s) est enregistre dans les echantillons HMd 1 et 2, caracterises
par une forte abondance de filaments. Les echantillons HMd 3 montrent des temps
de penetration qui ne depassant pas 8 s (Fig. 6a). Selon la terminologie
d'hydrophobicité définie par Dekker et Ritsema (1994), 57 % de la
surface des croûtes de HMd 1 est legèrement hydrophobe, 40 % est
mouillable et 3 % et fortement hydrophobe (Fig. 7a). Au niveau des echantillons
HMd 2 et 3 et HMd 4 la proportion de la partie legèrement hydrophobe est
faible, comprise entre 15 et 26 % (26, 15 et 19 % chez HMd 2, 3 et 4) (Fig.
7a). Au total la parcelle en defens Hama est partagee entre des surfaces
mouillables (HMd 2, 3 et 4) et legèrement hydrophobes (HMd 1).
Des temps de pénétration de la goutte d'eau
compris entre 4 et 382 s ont été observés pour des
échantillons de la parcelle Chef. Les valeurs de WDPT les plus elevees
ont ete observees sur les echantillons de croûtes CHd 3 et 4. Des valeurs
moyennes ont ete obtenues sur les echantillons CHd 2, alors que les valeurs les
plus faibles sont obtenues chez les echantillons CHd 1 (Fig. 6b). Environ 75 %
de la surface des croûtes des echantillons CHd 1 est mouillable, 22 %
legèrement hydrophobe et 2 % fortement hydrophobe. Les deux echantillons
CHd 3 et 4 sont les plus hydrophobes, surtout les croûtes des
echantillons CHd 3 où la fraction mouillable est absente (63 % de la
surface est legèrement hydrophobe, 37 % fortement hydrophobe). Environ
10 % de la surface des croûtes des echantillons CHd 4 est mouillable, 57
% legèrement hydrophobe et 33 % fortement hydrophobe. Au total les
échantillons de la parcelle en défens Chef sont
légèrement à fortement hydrophobes, à l'exception
des echantillons CHd 1 qui sont mouillables à legèrement
hydrophobes.
La parcelle pâturee sur plaquage sableux se caracterise
par des temps de penetration de la goutte d'eau faibles. Les valeurs obtenues
sont en general comprises entre 1 et 4 s (Fig. 6c). Environ 85 à 90 % de
la surface des croûtes est mouillable. La partie legèrement
hydrophobe ne represente que 10 à 15 % de l'ensemble (Fig. 7c).
D'après les résultats, les parcelles
situées sur la dépression entre deux buttes sableuses (CHd 3 et
4), enregistrent les temps de pénétration de la goutte d'eau les
plus élevés, les échantillons des parcelles situées
sur des buttes sableuses (HMd 1, 2, 3, 4, CHd, 1 et 2) ont des temps moyens,
alors que les temps les plus faibles ont ete obtenus chez les echantillons du
plaquage sableux (HMp 5 et 6).
H
a
b
c
c
a
b
Hd 3
Figure 6 : Résultats des tests de
pénétration de la
Md 1
goutte d'eau (WDPT) réalisés sur les
illable
différentes croûtes microbiotiques. (a et b:
égèent hoph
Hd 2
échantillons des parcelles en défens, c:
Fortem
0% % 40% 60% 80
Séèreent pho
échantillons de la parcelle pâturée)
Figure 7 : Taux d'hydrophobicité des
différentes surfaces de
croûtes microbiotiques calculés
selon les valeurs théoriques
-60)
de Dekker et Ritsema (1994) (a et b: échantillons des
parcelles
100%
en défens, c: échantillons de la parcelle
pâturée)
)
003600)
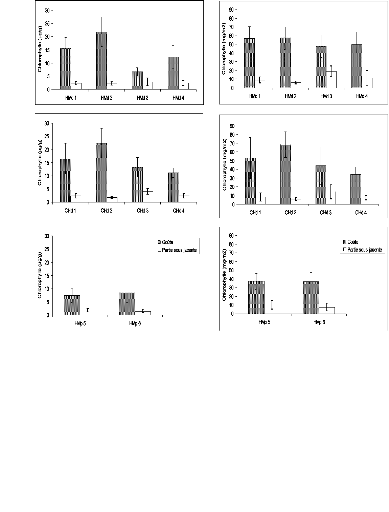
La teneur en chlorophylle a
Les teneurs en chlorophylle a des différents
échantillons pour les deux parties (croûte et partie sous
jacente), sont regroupées dans les figures 8 et 9.
La quantité de chlorophylle a mesurée
dans les croûtes, où les micro-organismes sont abondants,
dépasse celle obtenue dans la partie sous jacente. Les valeurs obtenues
sont comprises entre 6,75 et 22,41 ug/g pour la croûte et entre 1,48 et
4,06 ug/g pour la partie sous croûte.
Les teneurs en chlorophylle a les plus
élevées sont mesurées dans les échantillons de
croûtes de la parcelle en défens située sur une butte
sableuse (HMd 1, 2 et CHd 1, 2). Les valeurs obtenues dans ces
échantillons varient en général entre 15 et 22,4 ug/g
(Fig. 8a et b). Les valeurs obtenues sur les échantillons de la parcelle
située dans la zone en dépression entre les buttes sableuses sont
comprises entre 11,14 et 13,24 ug/g (Fig. 8b). Les échantillons de la
parcelle pâturée sur plaquage sableux montrent des valeurs
comprises entre 7,31 et 8,42 ug/g (Fig. 8c).
La quantité de chlorophylle a par
unité de surface (mg/m2), est toujours élevée
dans la croûte et chez les parcelles en défens (Fig. 9), elle
varie entre 34,16 et 68,42 mg/m2 pour la croûte, et entre 5,71
et 18,98 mg/m2 pour la partie sous jacente. Les teneurs en
chlorophylle a les plus importantes sont enregistrées chez la
parcelle située sur la butte sableuse (47,71 à 68,42
mg/m2) (Fig. 9a et b). Des teneurs moyennes à faibles sont
obtenues chez les échantillons de la dépression entre les deux
buttes sableuses (34,16 à 44,17 mg/m2)(Fig. 9b), et les
échantillons du plaquage sableux (34,16 à 37,17
mg/m2)(Fig. 9c). La teneur en chlorophylle a la plus
élevée est mesurée dans le site Chef (61,41
mg/m2 chez les croûtes de CHd 2 et 13,97 mg/m2 dans
la partie sous jacente des croûte de CHd 3).
Les résultats de la teneurs en chlorophylle a
par unité de surface, présentent une légère
différence par rapport à celles mesurés par unité
de poids (faible différence entre les teneurs en chlorophylle a
mesurées par mg/m2 entre les différents
échantillons de même nature)
22
c
90
Figure 8 : Résultats de mesures de la
teneur en
40
80
chlorophylle a (ug/g) (a et b: échantillons
des parcelles
30
en défens, c: échantillons de la parcelle
pâturée)
20
60
Figure 9 : Résultats de mesures de la
teneur en chlorophylle a (mg/m2) (a et b:
échantillons des parcelles en défens, c: échantillons de
la parcelle pâturée)
... ....
c
Discussion des résultats
L'observation des croûtes microbiotiques de la
région de Banizoumbou à différentes échelles (de la
loupe binoculaire au MEB) révèle différentes formes de
micro-organismes et différents modes de recouvrement de la surface du
sol selon l'occupation du sol (parcelles en défens ou
pâturées) et la topographie locale (parcelles sur butte sableuse,
sur plaquage sableux et dépression entre deux buttes sableuses). La
parcelle pâturée sur plaquage sableux contient une
diversité de micro-organismes regroupant des filaments et des organismes
coccoïdes. En revanche le taux de couverture et la quantité de
micro-organismes sont faibles (Fig. 5c, 8c, 9c). Les croûtes
microbiotiques de la surface de la parcelle en défens sur butte sableuse
sont caractérisées par des taux de couverture
élevés et la prédominance des filaments noirs (Tableau 3 ;
Fig. 5a, 8a, b, 9a, b). Celles des zones en dépression entre les buttes
sableuses sont caractérisées par la prédominance des
micro-organismes à pigments rouges. Le taux de couverture mesuré
sur ces croûtes est faible (Fig. 5b, 8b, 9b), en liaison avec la
topographie locale, favorable à l'accumulation des particules
minérales fines et des débris de végétaux
transportés par le vent et l'eau.
Ces observations sur la surface et l'abondance
des micro-organismes sont des indicateurs du stade de développement des
croûtes microbiotiques (Hahn et Kusserow 1998 ; Belnap et al. 2008). Les
croûtes microbiotiques légèrement colorées ou rouges
représentent les premiers stades de colonisation par les
Cyanobactéries, tandis que les croûtes noires représentent
des stades avancés de développement des croûtes (Belnap et
al. 2008). Les résultats obtenus par Hahn et Kusserow (1998) au Niger
associent les croûtes microbiotiques rouges à une faible biomasse
des Cyanobactéries, à l'inverse les croûtes microbiotiques
noires montrent une biomasse élevée. Ces observations de la
surface des sols permettent d'émettre une hypothèse sur le stade
de développement des croûtes microbiotiques dans la région
de Banizoumbou au Niger. Les croûtes microbiotiques les plus
développées se rencontrent sur la parcelle en défens
installée sur la butte sableuse. Elles sont constituées de
nombreux filaments ramifiés, formant des irrégularités
à la surface du sol. Le fort taux de couverture est lié à
l'abondance de la biomasse cyanobactérienne, comme en témoignent
des teneurs élevées en chlorophylle a à la
surface de ces croûtes (15 à 22,4 ìg/g). Au contraire les
croûtes microbiotiques des zones en dépression sont
caractérisées par un stade de développement
précoce. Les teneurs en chlorophylle a dans ces croûtes
sont relativement faibles (11,14 à 13,24 ìg/g).
Ces résultats sont similaires à ceux obtenus par
Belnap et Gardner (1993) sur des croûtes microbiotiques du plateau du
Colorado aux États-Unis. D'après leurs résultats, le
développement des espèces ramifiées est associé
à la complexité de la microtopographie de la surface des
croûtes. Ces endroits sont caractérisés par un bon
développement des croûtes, qui se traduit par une biomasse assez
importante des Cyanobactéries.
Les résultats obtenus sur les parcelles
pâturées sur plaquage sableux traduisent la sensibilité des
croûtes microbiotiques vis-à-vis des perturbations anthropiques,
en particulier le piétinement de la surface du sol par le bétail.
Le taux de couverture et les teneurs en chlorophylle a obtenues sur
ces parcelles sont, en effet, 2 à 3 fois plus faibles que ceux obtenus
dans les parcelles en défens. Ces perturbations semblent donc limiter le
développement des Cyanobactéries à la surface du sol, avec
des conséquences sur la stabilité et l'érosion de la
surface des sols. Les résultats obtenus par Belnap et
Gillette (1998) indiquent une accélération de l'érosion
eolienne liee au pietinement du sol par le betail ; la destruction des
croûtes reduit la resistance à l'erosion eolienne de 69 à
5247 %, ce qui accentue le processus de desertification (Belnap 1995; Orlovsky
et al. 2004; Bowker et al. 2005).
Les tests de penetration de la goutte d'eau revèlent
que la surface des croûtes microbiotiques de la region de Banizoumbou au
Niger est partagee entre des surfaces mouillables et legèrement
hydrophobes voire fortement hydrophobes (Fig. 7a et b). Les echantillons de la
parcelle en defens sur la butte sableuse montrent des degres
d'hydrophobicité élevés. Un temps moyen de
pénétration de la goutte d'eau de 7,09#177;10,91 s a ete obtenu
sur ces parcelles. Cette forte hydrophobicite est correlee avec un taux de
couverture moyen de 43,27#177;15,45 % (Fig. 5a). La parcelle pkturée
montre des degrés d'hydrophobicité faibles (WDPT moyen de
2,86#177;3,18 s) et un taux de couverture moyen de 22,43#177;10,86 % (Fig. 5c).
Au total, l'hydrophobicité varie selon le type de substrat, l'occupation
du sol et le taux de couverture des différentes croItes microbiotiques,
à l'exception de celles des echantillons CHd 3 et 4, situees dans les
zones en depressions. Sur ces croûtes microbiotiques les resultats
obtenus montrent une forte hydrophobicite (WDPT moyen de 68,07#177;75,64 s)
malgre un faible taux de couverture (% couverture moyen de 16,19#177;8,66 %)
(Fig. 5b). Il y a lieu de se demander quelle est l'origine de la forte
hydrophobicite de ces echantillons ?
D'après la littérature, l'hydrophobicité
de la surface est en premier lieu reliée aux composés organiques
(Doerr et al. 2000). Ceux-ci agissent par differents mecanismes dont les
principaux sont : (i) Les proprietes intrinsèques des produits de
decomposition de la matière organique et leurs produits derives
synthetises par les microorganismes (Bond et Harris 1964; Mazor et al. 1996).
Ces composes sont caracterises par une faible affinite vis-à-vis de
l'eau, ayant comme résultat un ralentissement de la
pénétration de l'eau à l'intérieur des agregats ;
(ii) Le comportement irreversible de la matière organique lors de la
dessiccation (difficulte de remouillage) (Dekker et Ritsema 2000). Ainsi,
l'enrobage des particules minerales par ces produits cree une surface
hydrophobe, qui diminue la tension de la surface du sol par rapport à
celle de la goutte d'eau et augmente l'angle de contact (Leelamanie et Karube
2007). À ces mecanismes essentiellement lies à la matière
organique s'ajoute l'effet de la texture du sol. La fraction fine, en
particulier les particules de la taille des argiles, joue un rôle
très important sur l'hydrophobicite des sols (Doerr et al. 1996).
La forte hydrophobicite des croûtes microbiotiques des
zones en depression peut être expliquee par les paramètres
suivants :
- Les matières organiques liees à la presence
des Cyanobacteries. Leur presence est attestee par une teneur en chlorophylle
a élevée et la présence d'un réseau
profond de filaments (Fig. 8b, 9b ; photo 5, pl. I ; photo 6, pl. II); cette
matière organique d'origine cyanobactérienne en association avec
d'autre constituants contribue à la formation d'une couche hydrophobe
à la surface, qui emprche l'infiltration et la circulation de l'eau
à travers les espaces poraux (Kidron et al. 1999).
- La teneur elevee en particules fines (argiles et limons) et
les matières organiques issues des vegetaux superieurs, elles aussi
particulièrement abondantes à la surface de ces sols (photo 5 et
6, pl. I ; photo 6, pl. II).
Ceci est dL aux caractéristiques topographiques des
parcelles qui, en effet, sont favorables à l'accumulation des particules
minérales fines et des débris de végétaux
transportés par le vent et l'eau. Les observations micromorphologiques
à différentes échelles ont révélé les
résidus végétaux, mais aussi l'adhésion des
particules minérales à la surface des filaments et de leurs
produits de secrétions extracellulaires (EPS ; photo 6, pl. II). Ces
phénomènes sont la cause du faible taux de couverture de la
surface par les micro-organismes.
De nombreux travaux ont montré que la présence
des croûtes microbiotiques à la surface du sol diminue
significativement l'infiltration et la perméabilité du sol, en
relation avec l'hydrophobicité des matières organiques des
Cyanobactéries (Dulieu et al. 1977; Kidron et al. 1999; Warren 2001 ;
Malam Issa et al. 2008). L'hydrophobicité des matières organiques
des Cyanobactéries est également une caractéristique
très importante dans la colonisation et l'adhésion de ces
micro-organismes aux substrats solides (Fattom et Shilo 1984; De Philippis et
Vincenzini 1998; Hu et al. 2003). Le caractère hydrophobe des
matières organiques des Cyanobactéries se manifeste en
particulier suite à une longue période de dessiccation (Kidron et
al. 1999). Il s'ensuit une résistance à la
pénétration responsable de la génération de
ruissellement pendant la période d'imbibition des sols par les pluies.
D'après les travaux de Malam Issa et al. (2008) la pluie d'imbibition
à la surface des sols à fort recouvrement est de 3,5 mm. Le taux
moyen de ruissellement pendant cette phase d'humectation du sol atteint 39 %.
Ce fort taux de ruissellement contribue à la redistribution de l'eau et
des éléments nutritifs au profit des zones situées
immédiatement en aval (Seghieri et al. 1994). Cependant cet effet
s'atténue progressivement pour disparaître avec l'absorption de
l'eau par gonflement des matières organiques riches en polysaccharides
et l'humectation complète des croItes microbiotiques (Kidron et al.
1999). La quantité d'eau absorbée par ces matières
organiques est estimée à huit fois leur poids sec (Belnap et
Gardner. 1993).
Les résultats de mesures d'hydrophobicité
obtenus dans le cadre de ce travail serviront de base pour une bonne
compréhension des mécanismes qui gouvernent la dynamique de l'eau
à la surface des sols dominée par les croûtes
microbiotiques dans la région sahélienne du Niger. Ce travail
doit néanmoins être complété par l'étude du
gonflement des matières organiques des Cyanobactéries dont
l'effet sur la réduction de la porosité et l'augmentation du
ruissellement de l'eau est bien connu (Verrecchia et al. 1995).
| 


