Notre travail est une étude prospective (février
à mai 2011) portant sur la recherche de Helicobacter
pylori , à partir de la culture de biopsies gastriques
provenant de 38 patients suivis dans les services de médecine interne et
de pédiatrie de l'hôpital Bologhine Ibn Ziri , adressés
pour une endoscopie digestive haute.
1- Materiel Biologique :
Les biopsies gastriques constituent le matériel
biologique objet de notre étude. Celles-ci sont prélevées
en salle d'endoscopie et sont acheminées au laboratoire de
bactériologie dans un délai n'excédant pas 10 minutes.
En règle générale, pour chaque patient,
deux prélèvements sont effectués : une biopsie antrale (au
niveau de l'antre) et une biopsie fundique (au niveau du fundus).
Cependant, si l'endoscopiste est contraint de mettre fin
à l'examen, en cas de reflexes nauséeux ou d'hémorragies
digestives constatées, une seule biopsie est prélevée.
Lorsqu'il s'agit de patients suivis en pédiatrie, le
protocole n'exige qu'un seul prélèvement : la biopsie antrale.
Nous avons établi, pour chaque patient, une fiche de
renseignements mentionnant outre le nom, le prénom et le sexe, la
pathologie ayant motivée la recherche de Helicobacter
pylori et les éventuels traitements actuels ou
antérieurs. (Annexe n°3)
2- Materiel non biologique : 2-1- Materiel pour le
broyage des biopsies :
- Pipette Pasteur (1mL)
- Bistouri
- Porte bistouri
- Boite de Pétri (90mm de diamètre)
- Poire en plastique
- Portoir
- Alcool (70°)
- Lames propres
2-2- Matériel pour la realisation du test rapide
a l'urée :
- Milieux Urée-Indole
- Pipette Pasteur (1mL)
- Tablette en plastique blanc
- Poire en plastique
2-3- Materiel pour l'isolement, l'identifi cation et
l'in cubation :
- Lame
- Lamelle
- Boite de Pétri (90mm de diamètre)
- Pipette Pasteur (1mL)
- Poire en plastique
- Portoir
Milieux de base :
- Flacon de gélose Columbia (180ml) (Annexe n°4)
- Sang frais humain (groupe O rhésus +)
- Supplément sélectif pour
Helicobacter pylori : Trimétoprime,
Cefsulodine
Vancomycine, Amphotéricine B (Oxoid)
Réa ctifs :
- Milieux de réaction Urée-Indole (Annexe
n°5)
- Générateurs d'atmosphère
microaérophile (Annexe n°6)
- Peroxyde d'hydrogène (H2O2)
- Disque d'oxydase (1% diméthyl para
phényléne diamine)
- Alcool (70°)
- Violet de Gentiane
- Lugol
- Fushine
2-4- Matériel pour l'étude de la
sensibilité :
- Boite de Pétri (90mm de diamètre)
- Pipette Pasteur (1mL)
- Ecouvillon stérile
- Disques d'Antibiotiques
- Pince stérile
- Poire en plastique
Milieux de base :
- Milieux Mueller-Hinton (Annexe n°7)
- Sang frais humain (groupe O rhésus +)
2-5- Matériel pour la conservation :
- Pipette Pasteur (1mL)
- Tube stérile
- Poire en plastique
- Portoir
Milieux de base :
- Gélose Columbia au sang cuit coulé en pente.
2-6- Appareillage né cessaire :
- Etuve
- Congélateur -50°C
- Réfrigérateur
- Bain-Marie
- Microscope photonique
- Vortex
- Densitomètre
- Bec Bunsen
3- Méthodes de recherche et d'identifi cation
de Helicobacter pylori :
Les biopsies gastriques étant récoltées en
salle d'endoscopie et immédiatement
transportées au laboratoire, les
prélèvements ne nécessitent pas de milieux de transport
particuliers. Ils sont déposés, lors de l'endoscopie, dans des
tubes à essai contenant uniquement de l'eau physiologique
stérile. Une fois au laboratoire de bactériologie, nous
soumettons les prélèvements à un examen direct comportant
un test rapide à l'urée, une observation microscopique à
l'état frais et une coloration de Gram. Nous procédons alors a
leur mise en culture dans des conditions favorables au développement de
Helicobacter pylori. Ces opérations se
déroulent selon le protocole suivant :
3-1- Broyage des biopsies :
- Essuyer une lame avec de l'alcool et flamber
au bec Bunsen. - Mettre la lame dans une boite de Pétri
stérile.
- Prélever et jeter l'eau physiologique
des tubes contenant les biopsies et la remplacer par du BHIB (Bouillon
coeur-cervelle)
- Pipeter les biopsies avec le BHIB et les
déposer sur une lame. - Dilacérer les biopsies
à l'aide d'un bistouri.
3-2-Realisation du test rapide a l'uree :
- Déposer une goutte de milieu Urée-Indole sur une
tablette en plastique blanc (permet d'apprécier le virage du milieu)
- Pipeter un fragment de biopsie et le déposer dans la
goutte de milieu Urée-Indole.
En présence de l'uréase bactérienne, au
bout de quelques minutes, le milieu passe du jaune-orangé au rose
fushia. (Figure n°16)
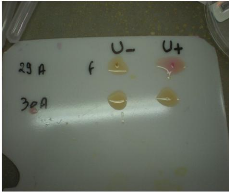
Figure n°16 : Test rapide a l'uree (photo prise au
laboratoire de bacteriologie, de l'EPH Bologhine Ibn Ziri).
3-3- Observation mi cros copique a l'état frais
:
- Essuyer une lame avec de l'alcool et flamber au bac Bunsen.
- Déposer une goutte d'eau stérile à l'aide
d'une seringue ou d'une pipette Pasteur sur la lame.
- Pipeter un fragment de biopsie et déposer sur la lame.
Observation au microscope photonique :
- Déposer une lamelle sur la lame.
- Déposer une goutte d'huile à immersion sur la
lamelle. - Observer à l'objectif x100.
L'observation d'un petit bacille incurvé avec une
mobilité caractéristique très
importante, indique la présence de
Helicobacter pylori.
3-4- Coloration de Gram : Frottis :
- Déposer une goutte d'eau distillée sur une lame
propre, à l'aide d'une seringue ou d'une pipette Pasteur.
- Pipeter un fragment de biopsie, le déposer dans la
goutte d'eau et l'étaler en
effectuant des mouvements circulaires, à l'aide d'une
pipette Pasteur.
- Laisser sécher la lame dans une boite de Pétri
stérile à température ambiante, la coloration et
l'observation se fontt le lendemain.
Coloration :
- Recouvrir le frottis de Violet de Gentiane. Laisser agir 1
minute. Rincer à l'eau.
- Verser le lugol. Laisser agir 1 minute 30. Rincer.
- Verser l'alcool (70°) goutte à goutte sur la lame
jusqu'à recouvrir tout le frottis. Laisser agir 30 secondes, puis
rincer.
- Recouvrir la lame de Fushine. Laisser agir 1 minute. Rincer.
Sécher. Observation au microscope photonique :
- Déposer une goutte d'huile à immersion sur la
lame.
- Observer à l'objectif x100.
L'observation d'un bacille de forme hélicoïdale,
coloré en rose (Gram -), indique la présence de
Helicobacter pylori.
3-5- Culture :
3-5-1- Ensemencement :
- Pipeter un fragment de biopsie et le déposer sur le
milieu Colombia au sang frais avec supplément (prélablement
coulé et incubé pendant 24 heures, à 37°C)
- Ensemencer à l'aide d'une pipette en râteau en
effectuant des mouvements circulaires sans toucher les bords de la boite de
Pétri.
3-5-2- Incubation :
L'incubation se fait dans des jarres contenant des
générateurs de microaérophilie (2 sachets par jarre). Ces
dernières sont placées dans une étuve à 37°C
pendant 2 à 15 jours.
3-6- Identification des cultures :
Les milieux ensemencés et mis à l'étuve
à 37°C en atmosphère microaérophile, sont
observés tous les deux jours pour détecter une éventuelle
croissance de colonies suspectes : petites (environ 1mm de diamètre) et
translucides. (Figure n°17)
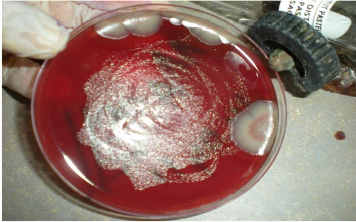
Figure n°17 : Helicobacter pylori en
primo- culture (photo prise au laboratoire de bacteriologie, de l'EPH Bologhine
Ibn Ziri).
L'identification repose sur les conditions de culture (notamment
la microaérophilie), et sur les caractères morphologiques et
biochimiques. Elle comprend les étapes suivantes :
3-6-1- Réalisation d'un frottis coloré par la
méthode de Gram : Frottis :
- Déposer une goutte d'eau distillée sur une lame
propre, à l'aide d'une seringue ou d'une pipette Pasteur.
- Prélever une colonie, la déposer dans la goutte
d'eau et l'étaler en effectuant des
mouvements circulaires, à l'aide d'une pipette
Pasteur.
- Sécher puis fixer au bec Bunsen.
Coloration :
- Recouvrir le frottis de Violet de Gentiane. Laisser agir 1
minute. Rincer à l'eau.
- Verser le lugol. Laisser agir 1 minute 30. Rincer.
- Verser l'alcool (70°) goutte à goutte sur la lame
jusqu'à recouvrir tout le frottis. Laisser agir 30 secondes, puis
rincer.
- Recouvrir la lame de Fushine. Laisser agir 1 minute. Rincer.
Sécher la lame.
Observation au microscope photonique :
- Déposer une goutte d'huile à immersion sur la
lame. - Observer à l'objectif x100.
L'observation d'un bacille de forme hélicoïdale,
coloré en rose (Gram -), isolé ou en « banc de poissons
», indique la présence de Helicobacter
pylori.
3-6-2- Recherche de la cytochrome oxydase :
- Humidifier un disque de diméthyl
paraphényléne diamine, avec une goutte d'eau distillée.
- Prélever une colonie et l'écraser sur le disque
avec une pipette Pasteur.
La présence d'une cytochrome oxydase se traduit par
l'apparition d`une coloration brunnoir sur le disque.
3-6-3- Recherche de la catalase :
- Déposer une goutte d'eau oxygénée (H2O2)
sur une lame propre.
- Prélever une colonie avec une pipette Pasteur et
déposer dans la goutte d'eau oxygénée.
La présence de l'enzyme se traduit par le
dégagement de bulles gazeuses. 3-6-4- Recherche de l'uréase :
- Déposer une goutte de milieu Urée-Indol sur une
tablette en plastique blanc . - Prélever une colonie et la
déposer dans la goutte de milieu Urée-Indol.
En présence de l'enzyme, au bout de quelques minutes, le
milieu passe du jaune-orangé au rose fushia. (Annexe)
3-6-5- Résistance à l'acide nalidixique :
Cette résistance est appréciée par la
méthode de diffusion sur gélose. (cf § 3-7)
4-Methodes d'etude de la sensibilite aux antibiotiques :
Après recherche et identification de
Helicobacter pylori, nous procédons à
l'étude de la sensibilité de la bactérie aux antibiotiques
habituellement prescrits dans les pathologies gastriques qui lui sont
liées.
Helicobacter pylori présentant
une résistance naturelle à l'acide nalidixique, nous testons cet
antibiotique pour confirmer l'identification.
4-1- Antibiogramme par la methode de diffusion sur
gelose :
4-1-1- Liste des antibiotiques testés :
- Amoxicilline
- Ciprofloxacine
- Tetracycline
- Erythromycine
- Acide nalidixique (caractère d'identification) 4-1-2-
Préparation de l'inoculum :
L'inoculum est préparé à partir de
colonies viables fraîchement identifiées dans un tube à
essai stérile contenant de l'au distillée. La turbidité
est ajustée à l'aide d'un vortex et d'un densitomètre
à 3 Mac Farland.
4-1-3- Inoculation : (méthode par écouvillonnage
ou méthode de KIRBY-BAUER)
- Plonger un écouvillon stérile dans l'inoculum et
bien l'essorer sur les rebords du tube.
- Frotter l'écouvillon sur la totalité de la
surface gélosée d'un milieu Mueller- Hinton au sang frais, de
haut en bas, en stries serrées.
- Répéter l'opération deux fois en tournant
la boîte de Pétri à 60°, à chaque fois. Finir
en en passant l'écouvillon sur toute la périphérie de la
boîte.
4-1-4-Application des disques d'antibiotiques :
Les disques d'antibiotiques sont d'abord retirés du
congélateur (-20°C), puis laissés à
température ambiante.
A l'aide d'une pince stérile, déposer les
disques, un à un, sur la gélose ensemencée, à
l'extrémité de la boite de Pétri. Pour une bonne lecture,
déposer trois disques maximum par boite.
4-1-5- Incubation :
Incuber à l'étuve à 37°C deux à
trois jours, en atmosphère microaérophile. 4-1-6-
Interprétation des résultats :
La lecture est faite après une période minimale
d'incubation de 72 heures. Si la croissance, à la surface de la
gélose, est significative et que les zones d'inhibitions sont clairement
visibles, on peut mesurer les rayons d'inhibitions à l'aide d'un pied
à coulisse métallique (les disques ayant été
déposés aux bords de la boite de Pétri) et les multiplier
par deux pour obtenir les diamètres d'inhibition. Les valeurs obtenues
sont alors interprétées en fonction d'un abaque de lecture. Si
ces conditions ne sont pas remplies, on prolonge le délai
d'incubation.
4-2- Determination de la CMI (concentration minimale
inhibitri ce) pour l'Amoxi cilline par E-test® :
4-2-1- Définition :
Le système E-test® consiste en une bande plastique
non poreuse calibrée par un gradient de concentration d'antibiotiques
contenant 15 dilutions.
Les concentrations prédéfinies sont
immobilisées à la face opposée à l'échelle
et représentent des valeurs de CMI (la CMI est définie comme
étant la plus faible concentration d'antibiotiques inhibant en 72 heures
la multiplication des bactéries).
4-2-2- Méthodologie :
La CMI est déterminée à partir du
même inoculum bactérien, après inoculation par les
mêmes méthodes et sur le même milieu que pour
l'antibiogramme par méthode de diffusion sur gélose.
Application des bandes (retirées du congélateur
puis laissées à température ambiante) :
- Déposer la bande de E-test® sur la gélose
sèche à l'aide d'une pince stérile en mettant
l'échelle de la CMI face à l'ouverture de la boîte.
- Assurer un bon contact entre la bande et la gélose en
appuyant sur la bande en partant de la base.
4-2-3- Incubation :
L'incubation se fait à l'étuve à
37°C pendant 72 heures en atmosphère microaérophile (
à condition que la croissance soit significative et que l'ellipse
d'inhibition soit clairement visible).
4-2-4- Interprétation des résultats :
La CMI est lue au point d'intersection de l'ellipse et de la
bande. 5- M6thode de conservation des sou ches :
La conservation des souches de Helicobacter pylori se fait
sur milieu Columbia au sang cuit, coulé en pente dans des tubes à
essai stériles. La gélose est ensemencée en stries
à partir des colonies obtenues en primo-culture ou à partir des
réisolements.



