
|
|
RÉPUBLIQUE TUNISIENNE
MINISTERE DE L'ENSEIGNEMENT SUPÉRIEUR ET DE
LA
RECHERCHE SCIENTIFIQUE
|
|
|
Université de Tunis El
Manar
Institut Pasteur de
Tunis
Institut Supérieur des
Technologies
Médicales de Tunis
Mémoire
De
Projet de Fin
d'Études
Pour l'obtention de la
LICENCE en Biotechnologies
Médicales
Option: Génie Cellulaire
Sujet
|
|
Validation de procédé de production
d'antigène viral
sur culture cellulaire BHK21
|
|
Elaboré par: Encadré par:
Ghaith BEN MESSAOUD Pr. Abderrazak MAAROUFI
|
|
Année Universitaire 2012-2013
|
|
|
|
RÉPUBLIQUE TUNISIENNE
MINISTERE DE L'ENSEIGNEMENT SUPÉRIEUR ET DE
LA
RECHERCHE SCIENTIFIQUE
Université de Tunis El
Manar
Institut Pasteur de
Tunis
Institut Supérieur des
Technologies
Médicales de Tunis
Mémoire
De
Projet de Fin
d'Études
Pour l'obtention de la
LICENCE en Biotechnologies
Médicales
Option: Génie Cellulaire
Sujet
|
|
|
Validation de procédé de production
d'antigène viral
sur culture cellulaire BHK21
|
|
Elaboré par: Encadré par:
Ghaith BEN MESSAOUD Pr. Abderrazak MAAROUFI
|
|
Année Universitaire 2012-2013
|
|
DEDICACE
Je dédie ce travail à:
A mes
parents
Vous vous êtes dépensés pour moi sans compter.
En
reconnaissance de tous les sacrifices consentis pour me
permettre
d'atteindre cette étape de ma vie.
A mon frère et à ma soeur
Pour leur affection, compréhension et
patience.
Meilleurs voeux de succès dans vos vies et vos
études.
A toutes ma famille
Vous avez de près ou de loin contribué
à ma formation.
Affectueuse reconnaissance.
Aux membres de l'Association Tunisienne de lutte Contre
le
Cancer
Pour leur aide précieuse dans mon travail et le savoir
qu'ils
m'ont donné.
A mes amis et camarades de l'ISTMT.
Merci...
REMERCIMENTS
Comme préambule à cette mémoire,
je souhaite adresser mes
remerciements les plus sincères aux
personnes qui m'ont
apporté leur aide et qui ont contribué
à l'élaboration de cette
mémoire ainsi qu'à la
réussite de cette formidable année
universitaire.
Je tiens
à remercier sincèrement Monsieur Hechmi LOUZIR
directeur
général de l'Institut Pasteur de Tunis pour m'avoir
offert
l'opportunité d'effectuer ce stage au sein de
son
institution.
Mon Encadreur Monsieur Abderrazak MAAROUFI responsable du
Service d'Immunotechnologie et Réactifs Biologiques, qui s'est toujours
montré à l'écoute et très disponible tout au long
de la réalisation de cette mémoire, sa confiance et tous ses
conseils
utiles pour la réalisation de ce modeste
travail.
J'adresse mes plus sincères remerciements aux
membres de
jury qui ont accepté de juger mon travail.
Mes remerciements s'adressent également à
Madame Nejia
BEN ALI pour sa générosité et pour la
grande patience dont elle
a su faire preuve malgré ses charges
professionnelles.
J'exprime ma gratitude à tous le personnel du
Service d'Immunotechnologie et Réactifs Biologiques et en particulier
à Madame Faten MEZNI, Madame Chedia AOUADHI, Madame Raja REZGUI et
Madame Najet HAMMAMI qui ont accepté de répondre
à mes questions avec gentillesse.
Je tiens à remercier le personnel du Service de
Virologie Clinique
et Service de Microbiologie Vétérinaire de
L'Institut Pasteur de
Tunis pour leurs aides précieuses dans ce
travail.
Je tiens à saisir cette occasion pour adresser mes
sincères
remerciements et mes profondes reconnaissances à
Madame
Halima MAHJOUBI Directrice de l'ISTMT et tous mes Professeurs
qui
m'ont aidé pendant ces trois ans en particulier Madame Ines
ZIDI et
Madame Ahlem DJEBBI
Introduction 1
Partie bibliographique
I. Maladie de la rubéole 2
II. Caractéristiques cliniques 2
III. Infection par le virus de la rubéole . 3
III.1. La rubéole acquise . 3
III.2. Réinfection rubéolique 3
III.3. La rubéole congénitale . 3
IV. Virus de la rubéole . 4
IV.1. Historique 4
IV.2. Classification du virus de la rubéole ... 5
IV.3. Morphologie du virus .. 6
IV.4. Type et classification antigénique . 6
IV.4.1. Protéines non structurales . 7
IV.4.2. Protéines structurales 7
IV.5. Génome du virus de la rubéole 8
IV.6. Réplication du virus 9
V. Réponse immunitaire ... 10
VI. Epidémiologie et prévention .. 11
VI.1. Epidémiologie 11
VI.2. Prévention et vaccination 12
VI.2.1. Prévention 12
VI.2.2. Vaccination 12
VII. Cellule BHK21 et multiplication du virus de la
rubéole à l'échelle cellulaire 13
VII.1. Cellule BHK21 13
VII.2. Multiplication du virus de la rubéole a
l'échelle cellulaire 13
VIII. Diagnostic 14
VIII.1.Diagnostic direct 15
VIII.1.1. Recherche du virus par isolement en culture de
cellules 15
VIII.1.2. Détection du génome viral . .. 16
VIII.2. Diagnostic indirect 17
VIII.2.1. Centrifugation en gradient de saccharose . 17
VIII.2.2. Mesure de l'avidité spécifique des IgG
. .. 17
VIII.2.3. ELISA (Enzyme-Linked-Immuno Sorbent Assay) 17
VIII.2.4. Agglutination sur latex 18
VIII.2.5. Hémolyse radiale (HR) . 19
VIII.2.6. Test de neutralisation . .. 19
VIII.2.7. Technique de fixation du complément 19
VIII.2.8. Test d'Inhibition d'hémgglutination (IHA)
20
VIII.2.9. Hémagglutination virale . 20
Matériel et méthodes
I. Préparation du local et matériel 21
I.1. Préparation du local 21
I.1.1. Stérilisation de l'atmosphère ... 21
I.2. Préparation du matériel 21
I.2.1. Stérilisation du matériel 21
I.3. Contrôle de stérilité du local
22
II. Matériel utilisé pour la production et la
Validation de l'hémagglutinine (HA)
rubéolique .. 22
II.1. Appareillage et matériel technique de culture
cellulaire et test ELISA indirect
de type IgG 22
II.2. Réactifs chimiques et Tampons pour la production
et Validation de l'HA
rubéolique . 23
III. Milieu pour la culture cellulaire . 23
III.1. Milieu DMEM (Dulbecco's Modified Eagle Medium) 23
III.2. Additifs pour Milieu DMEM 24
III.2.1. La Trypsine . 25
III.2.2. Préparation du Milieu de culture par la
méthode de stérilisation à froid. 25
III.3. Contrôle de stérilité du Milieu de
culture et des additifs . 26
IV. Production de l'HA rubéolique 27
IV.1. Matériel biologique .. 27
IV.2. Procédé de production de l'HA
rubéolique par la technique de culture
cellulaire 27
IV.2.1. Décongélation des cellules BHK21 27
IV.2.2. Les différents passages lors de la culture des
cellules BHK21 . 28
V. Inoculation du virus M33 30
V.1. Récolte 31
V.2. Extraction de l'HA rubéolique . 31
V.3. Titrage de l'HA rubéolique par la technique
d'hémagglutination 31
V.3.1. Etapes de titrage de l'HA 32
VI. Validation du procédé de production de l'HA
rubéolique par le test ELISA
indirect type IgG 33
VI.1. Matériel biologique .. 33
VI.2. Principe et étapes du test ELISA . 33
VI.2.1. Principe 33
VI.2.2. Réalisation du test ELISA indirect type IgG 34
Résultats et discussion 37
Conclusion et perspectives 43
Références bibliographiques .
44
Annexes
|
·
|
C: Protéine C
|
·
|
BHK21: Baby Hamster Kidney
|
|
·
|
E1: Protéine E1
|
·
|
RK 13: Rabbit Kidney
|
·
|
E2: Protéine E2
|
·
|
ECP: effet cytopathique
|
|
|
·
|
HA: Hémagglutinine
|
·
|
HR: Hémolyse Radiale
|
|
·
|
ARN: acide ribonucléique
|
·
|
IHA: Inhibition d'hémagglutination
|
|
·
|
S: coefficient de sédimentation
|
·
|
ELISA: Enzyme-Linked-Immuno-
|
|
|
|
Sorbent-Assay
|
|
·
|
DMSO: diméthysulfoxyde
|
·
|
PCR: Polymerase Chain Reaction
|
|
·
|
nm: nanomètre
|
·
|
RT-PCR: Reverse Transcriptase
|
|
|
|
PCR
|
|
·
|
kDa: kilo Dalton
|
·
|
Nested PCR: PCR nichée
|
|
·
|
kb: kilobase
|
·
|
DMEM: Dulbecco's Modified Eagle
|
|
|
|
Medium
|
|
·
|
IgM: immuglobuline M
|
·
|
SVF: Sérum de veau foetal
|
|
·
|
IgG: immuglobuline G
|
·
|
ATB: Antibiotique
|
|
·
|
Ig A : immuglobuline A
|
·
|
GR: Globules Rouges
|
|
·
|
HLA: Human leukocyte antigen
|
·
|
UHA: unité hémagglutinante
|
|
·
|
Ac: Anticorps
|
·
|
OPD: Ortho-Phénylène-Diamine
|
|
·
|
Ag: Antigène
|
·
|
LIRB: Laboratoire
d'Immunotechnologie et Réactifs
|
|
|
|
Biologiques
|
Figure 1: Symptômes de la rubéole (
www.larousse.fr) 2
Figure 2: Un enfant atteint de rubéole congénitale
(Lasek-Duriez et al., 2008) 4
Figure 3: Représentation schématique du virus de la
rubéole (Guillet, 2010) 6
Figure 4: Virus de la rubéole au microscope
électronique (Bienvenu et al., 2004) 6
Figure 5: Représentation du génome de la
rubéole (Bienvenu et al., 2004) 9
Figure 6: Réplication du virus de la rubéole
(Bienvenu et al., 2004) 10
Figure 7: Cinétique d'apparition des anticorps lors d'une
infection et réinfection
rubéolique (
www.microbe-edu.org)
11
Figure 8: Détection du virion de la rubéole dans les
cellules BHK21 (Risco et al.,2003).....
14
Figure 9: Cellules VERO et BHK21 infectées par le
virus de la rubéole. (Risco et al.,
2003) 14
Figure 10: Technique de détection de
l'infection rubéolique a partir du liquide amniotique
de foetus par PCR et électrophorese RT-PCR(A),Nested
PCR(B) (Bienvenu et al.,2004) 16
Figure 11: Contrôle de stérilité 22
Figure 12: Milieu DMEM 23
Figure 13: SVF 24
Figure 14: Antibiotiques 24
Figure 15: Tryptose phosphate 25
Figure 16: Trypsine 25
Figure 17: Contrôle de stérilité du Milieu de
culture et additifs 26
Figure 18: Observation Microscopique des cellules BHK21 27
Figure 19: Décongélation des cellules BHK21 28
Figure 20: Observation Microscopique des cellules BHK21 dans la
flasque 150cm2 29
Figure 21: Incubation dans l'Étuve à 37°C
29
Figure 22: Passage des cellules BHK21 30
Figure 23: Inoculation du virus 30
Figure 24: Lot d'hémagglutinine 31
Figure 25: Titrage de l'hémagglutinine rubéolique
32
Figure 26: Lavage par le Tampon PBS Tween de la plaque ELISA
35
Figure 27: Incubation du sérum des malades 35
Tableau 1: Résultats de titrage de l'HA 37
Tableau 2: Test numéro 1 . 38
Tableau 3: Test numéro 2 . 39
Tableau 4: Test numéro 3 .. 40
Tableau 5: Test numéro 4 . 41
ipiroducijOP
L
ISTMT-IPT 2012-2013

1
a culture cellulaire s'est considérablement
développée tant pour ses aspects fondamentaux que pour ses
applications pratiques et cliniques. Cette discipline s'avère
aujourd'hui d'une grande utilité dans le domaine de virologie
puisqu'elle nous permet d'isoler des virus et contribuer aux diagnostics des
maladies virales.
Le virus utilisé au cours de ce projet, est le virus de
la rubéole. Ce virus appartient à la famille des
Togaviridae. C'est un virus enveloppé, à acide
ribonucléique (ARN) de polarité positive.
La transmission de ce virus peut se faire par les gouttelettes
nasales expulsées par les personnes infectées lorsqu'elles
éternuent ou toussent. L'homme est le seul hôte connu.
Plusieurs techniques de sérodiagnostic de la
rubéole nécessitent la présence de l'hémagglutinine
(HA) rubéolique, comme:
· Technique d'Inhibition d'hémagglutination (IHA)
· Technique d'agglutination sur latex
· Test ELISA (Enzyme-Linked-Immuno-Sorbent-Assay) ...
Le développement des techniques immunoenzymatiques en
particulier la technique ELISA a contribué à améliorer la
spécificité et la sensibilité de dépistage des
antigènes (Ag) et des anticorps (Ac), en particulier dans le diagnostic
de la rubéole.
Pour la femme enceinte, la sérologie rubéolique
est demandée d'une manière systématique. Ainsi des
milliers d'analyses sérologiques sont réalisées chaque
année en Tunisie. Ceci représente une importante consommation des
réactifs pour le diagnostic de cette virose.
C'est dans ce cadre que nous nous sommes
intéressés à développer une technologie de
production de réactifs pour le sérodiagnostic de la
rubéole ce qui nous permettra d'éviter le cout
élevé d'importation du Kit commercial de diagnostic.
Toute fois, le développement de tel Kit de diagnostic
nécessite la préparation de l'Ag rubéolique.
f art1
.b llograp
I. ISTMT-IPT 2012-2013

2
Maladie de la rubéole
Le nom «rubéole» est dérivé de
l'exanthème typique, qui signifie rouge clair à petite
tâche. Le virus responsable est ubiquitaire, strictement humain
(Ellakhdi et al., 2009). Le virus de la rubéole est responsable
de maladie éruptive, contagieuse, épidémique et
immunisante, le plus souvent bénigne. La transmission se fait par voie
aérienne (rubéole acquise) ou par voie transplacentaire au cours
de la grossesse (rubéole congénitale). La gravité est due
à la tératogénicité du virus lorsqu'il contamine
une femme enceinte surtout au premier trimestre de la grossesse. (Pebret,
2003). Au cours de la grossesse le virus peut exercer des effets
dévastateurs sur le foetus en développement. Ce virus est
responsable de plusieurs cas de mort foetale et de graves malformations
congénitales (Dontigny et al., 2008).
II. Caractéristiques cliniques
La rubéole s'annonce généralement par une
éruption brusque, une sensation de malaise, un faible degré de
fièvre et apparition le même jour d'une éruption
morbilliforme (Figure1). Les symptômes peuvent précéder
l'éruption d'un ou deux jours.
L'éruption commence au visage et s'étend au
tronc et aux extrémités, dure rarement plus de trois jours
(jawetz et al., 1973).
Les symptômes de la rubéole congénitale sont
classés en deux rubriques:
? Des anomalies malformatives au cours de l'embryogenèse
qui sont surtout
occasionnées par des contagions précoce au cours
du 1èr semestre de la grossesse.
? Une infection chronique et disséminée des
différents organes foetaux. Cette infection peut persister
jusqu'à la naissance (Chosidow, 1994).
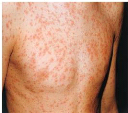
Figure 1: Symptômes de la rubéole (
www.larousse.fr)
ISTMT-IPT 2012-2013

3
III. Infection par le virus de la rubéole III.1.
La rubéole acquise
Il s'agit d'une maladie bénigne qui passe le plus souvent
inaperçue.
Le contage se fait par la pénétration du virus
de la rubéole dans la muqueuse naso-pharyngée ensuite il arrive
au système lymphatique.
· La phase d'incubation est de 14 à 18 jours.
· La phase d'invasion dure moins de deux jours. Elle est
inapparente, elle se caractérise par des courbatures et parfois purpura
de la voile du palais.
· La phase d'état où il y a une
éruption macculo-papuleuse. Elle disparait sans laisser de trace au
3eme jour. Il peut apparaitre (1 cas sur 20000) une
méningo-encéphalite après l'éruption (peut
être mortelle) (Pebret, 2003).
Au cours de cette maladie on peut constater l'apparition de
plusieurs adénopathies qui précédent l'éruption
comme les adénopathies cervicales postérieures, et une
fièvre entre 38 et 38,5 °C, enfin des arthralgies sont
fréquentes et en particulier chez l'adulte.
La guérison totale survient après quelques
jours avec l'acquisition d'une immunité quasi-définitive. Une
réinfection peut être possible mais elle passe inaperçue
(Mammette, 2002).
III.2. Réinfection rubéolique
Une réinfection rubéolique est possible, les Ac
résiduels (même un faible taux d'Ac) jouent le rôle de
barrière pour cette maladie. Ces Ac empêchent la
pénétration et la diffusion du virus dans le corps. Il y a une
multiplication locale du virus dans le pharynx sans virémie.
Cliniquement, la réinfection est inapparente. Elle se traduit par une
remontée des Ac rubéoliques (Mammette, 2002).
III.3. La rubéole congénitale
C'est la forme la plus grave. Elle survient après
l'infestation de la femme enceinte par le virus de la rubéole pour la
première fois au cours de la grossesse.
Au cours de la grossesse, la rubéole peut entrainer:
· Une rubéole congénitale
· Un avortement spontané
· Un retard de croissance intra-utérin.
ISTMT-IPT 2012-2013

4
Chez la femme enceinte, le passage du virus dans le sang
(virémie) lui permet de passer à travers le placenta et atteindre
l'embryon qui est en cours de développement. Il se développe dans
ce cas une infection virale chronique de tous les tissus qui persiste pendant
toute la gestation et même après la naissance.
Le virus infecte les cellules embryonnaires et peut provoquer
l'arrêt des mitoses cellulaires causant des malformations
décelées à la naissance (Pebret, 2003).
La rubéole congénitale peut associer de diverses
atteintes:
? Hématologiques: purpura thrompbopénique,
anémie hémolytique, aplasie médullaire
? Hépatiques: hépatite néo-natale
? Pulmonaire: pneumopathie interstielle
? Neurologique: méningo-encéphalite,
calcification cérébrale, retard psychomoteur lié au
déficit sensoriel (Armengaud, 2003).
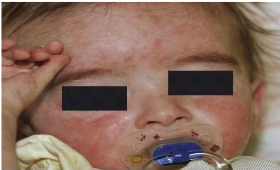
Figure 2: Un enfant atteint de rubéole
congénitale (Lasek-Duriez et al., 2008)
IV. Virus de la rubéole
IV.1. Historique
Dans l'histoire ancienne, la rubéole en tant que
maladie s'est perdue parmi la maladie exanthématique. Dans un examen
approfondi, Griffith a suggéré que la rubéole était
connue en premier par les médecins arabes sous le nom d'al-hamikah. Ils
considèrent la rubéole comme une forme de rougeole.
Deux médecins allemands, De-Bergen en 1752 et Orlow en
1758 sont crédités pour fournir les premières descriptions
cliniques de la rubéole comme une entité spécifique.
ISTMT-IPT 2012-2013

5
Dans les premiers écrits la rubéole était
généralement appelé Rotheln en raison du grand
intérêt des médecins allemands de la maladie au cours de la
période allant du milieu du 18ème siècle au
milieu du 19ème siècle. Le nom allemand
été utilisé dans d'autres pays.
En 1866, un médecin écossais nommé Veale
a décrit 30 cas de rubéole. Dans son exposé, il a
donné à la maladie son nom actuel «rubéole».
En 1881, lors du Congrès international de la
médecine à London un consensus s'est dégagé que la
rubéole est une maladie distincte.
La rubéole a obtenu son importance actuelle en 1941,
lorsque Gregg un ophtalmologue australien a rapporté des anomalies
congénitales chez les bébés de mères qui ont eu la
rubéole en début de la grossesse.
En dépit du scepticisme considérable, les
observations de Gregg ont été confirmées rapidement par
Swan et ses collègues chercheurs australiens et d'autres chercheurs aux
États-Unis et Royaume-Uni.
En 1947, vingt huit communications décrivant 500
enfants souffrant de graves malformations congénitales associées
à la rubéole maternelle étaient apparues dans la
littérature.
L'isolement du virus de la rubéole en 1962 a ouvert la
voie à l'étude définitive de la pandémie de la
rubéole en 1964.
Après l'isolement du virus de la rubéole dans
la culture de tissus, un effort intensif à travers le monde pour
développer des vaccins a été monté, l'accumulation
de ces expériences a donné lieu à un vaste champ de
connaissances liées à la rubéole et la vaccination contre
la rubéole en février 1969.
Trente trois ans depuis l'homologation du vaccin et
l'utilisation universelle aux États-Unis l'apparition annuelle de la
rubéole a chuté de 40.000 cas à moins de 300 (Feigin
et al., 2004).
IV.2. Classification du virus de
rubéole
Le virus de la rubéole est placé dans le genre
Rubivirus de la famille des Togaviridae. À l'heure
actuelle, il est la seule espèce de ce genre. Le virus est similaire sur
le plan physico-chimique aux autres membres de sa famille
(Alphavirus), mais n'est pas lié sérologiquement. Le
virus de la rubéole n'a pas de hôte invertébré (une
caractéristique de tous les Alphavirus), et l'homme est le seul
hôte connu des vertébrés (Feigin et al., 2004).
ISTMT-IPT 2012-2013
IV.3. Morphologie du virus
Le virus de la rubéole est sphérique avec un
diamètre de 60 à 70 nanomètre (nm), et il est
constitué de protéine de capside (C) et deux
glycoprotéines (E1 et E2). E1 (poids moléculaire 58.000) et E2
(poids moléculaire, 42.000 à 47.000) sont glycosylées et
sont situées sur la membrane de surface virale.
E1 est l'hémagglutinine (HA) virale que l'on retrouve
à la surface, elle mesure entre 5 à 6 nm de longueur. La
nucléocapside a un diamètre de 30 à 40 nm et se compose
d'un polypeptide (protéine C) et l'ARN génomique. L'acide
nucléique du virus de la rubéole est un simple brin d'ARN avec un
poids moléculaire de 3,2 à 3,8 106. La couche externe
du virus (enveloppe) est une lipoprotéine dans la nature avec la cellule
hôte des lipides et des polypeptides spécifiques du virus (Feigin
et al., 2004).
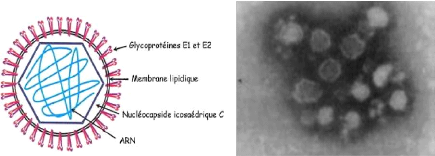
Figure 3: Représentation
schématique du virus de la rubéole (Guillet, 2010)
|
Figure 4: Virus de la rubéole au
microscope électronique (Bienvenu et al., 2004)
|
|
IV.4. Type et classification
antigénique
Le virus de la rubéole contient deux types de
protéines: ? Protéines structurales

6
? Protéines non structurales
ISTMT-IPT 2012-2013

7
IV.4.1. Protéines non structurales
Le rôle des protéines de la rubéole a
été démontré à partir de cellules
infectées par le virus. Les premières études ont
montré plusieurs protéines de poids moléculaire 200, 150,
87, 75 et 27 kilo Dalton (kDa) dans les cellules infectées par le
virus.
Des travaux plus récents ont
révélé que la protéine de 200 kDa est un
précurseur de polyprotéine qui est clivée pour produire
deux produits, de 150 et 90 kDa.
? Produit 150 a une activité enzymatique
protéase.
? Produit 90 a une activité hélicase et
réplicase.
De plus, il y a présence d'une courte région de
fonction inconnue dite motif X et un acide aminé
(méthyltransférase).
Ainsi l'ordre des gènes du virus pour la 5'OFR est
5'-méthyl-X-protéase-hélicase-réplicase-3' (Lee
et al., 2000).
IV.4.2. Protéines structurales
? Protéine de capside C
La protéine de capside est une protéine non
glycosyléé, phosphorylée. Sa masse moléculaire est
entre 33 à 38 kDa. La protéine de capside C contient des clusters
de résidus proline et arginine de nature basique qui sont
impliqués dans leur liaison avec l'ARN génomique du virus formant
ainsi les nucléocapsides virales. L'interaction de la protéine de
capside avec l'ARN viral ne peut pas être uniquement dépendante de
la densité des résidus basiques parce que d'autres régions
de base au sein de la protéine ont été trouvées
pour lier mal. Dans le génome du virus de la rubéole 29
nucléotides tronçon (nucléotide 347 à 375)
interagissent avec la protéine de capside (Lee et al.,
2000).
? Protéines membranaires E1 et E2
Les protéines de l'enveloppe du virus sont E1 et E2,
ces protéines sont des glycoprotéines membranaires.
La glycoprotéine E1 du virus a une masse
moléculaire de 58 kDa, alors que la glycoprotéine E2 est
hétérogène de 42 à 47 kDa.
E1 contient trois sites de N-glycosylation pour toutes les
souches alors que le nombre de sites de N-glycosylation de la protéine
E2 semble varier selon la souche.
ISTMT-IPT 2012-2013

8
Le rôle majeur de la N-glycosylation sur
l'antigénicité et l'immunogénicité d'E1 a
été étudié. Les études dans lesquelles E1 a
été exprimé dans Escherichia coli et ont
indiqué que la glycosylation peut être nécessaire pour le
repliement d'E1.
Les fonctions des protéines E1 et E2 ont
été largement étudiées en utilisant des Ac
monoclonaux, il a été montré que la protéine E1
contient au moins six épitopes différents, dont certains sont
liés à l'hémagglutination et de neutralisation. E1
apparaît comme la protéine de surface principale, avec des
domaines impliqués dans la fixation du virus à la cellule.
La fonction de E2 n'est pas encore totalement
déterminé mais E2 contient hémagglutination partielle et
épitopes neutralisants (Lee et al., 2000).
IV.5. Génome du virus de la
rubéole
Le virus de la rubéole est le seul virus dans la
famille des Togaviridae à avoir un génome qui contient
un seul brin d'ARN de polarité positive, son génome est d'environ
10 kilobases (kb) (Yumei et al., 2007), soit environ 9764
nucléotides.
Le génome contient deux trames de lecture (ORF):
? ORF 5' proximal codant pour 2 protéines non
structurales est qui sont p150 et p90. L'ORF 5' proximal contient environ 6345
nucléotides.
? ORF 3' proximal codant pour les trois protéines
structurales E1, E2 qui sont les protéines de l'enveloppe et enfin C qui
est une protéine de la capside. L'ORF 3' proximal contient environ 3189
nucléotides. Ainsi l'ordre des gènes pour l'ARN 40S (coefficient
de sédimentation) est 5'-p150-p90-C-E2-E1-3'. Le génome du virus
de rubéole a un contenu élevé en G + C de 69%, le plus
élevé de tout virus connu jusqu'à ce jour l'ARN (Lee
et al., 2000).
Le génome contient également des régions
non transcrites (UTR) à son extrémité 5' et 3' et entre
les ORF (la région de jonction) (Yumei et al., 2007).
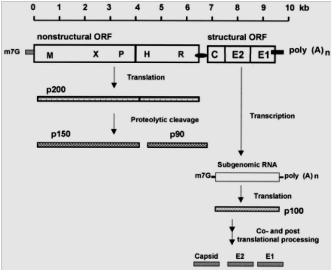
ISTMT-IPT 2012-2013

9
Figure 5: Représentation du génome
de la rubéole (Bienvenu et al., 2004)
IV.6. Réplication du virus
Les effets de la réplication du virus de la
rubéole sur la cellule hôte est dépendante du type de
cellules infectées. Ainsi, il faut être prudent de ne pas
extrapoler d'une lignée cellulaire à l'autre, et plus important
encore, de la réplication du virus de la rubéole dans des
lignées cellulaires à la réplication du virus de la
rubéole chez les humains.
La fixation du virus de la rubéole à des
récepteurs cellulaires se produit probablement par
l'intermédiaire des sites de liaison sur l'E2 et / ou E1
glycoprotéines moléculaires, même si le récepteur
cellulaire du virus de la rubéole n'a pas été
identifié pas plus que le site récepteur de liaisons sur une ou
les deux glycoprotéines (Banatvala et al., 2007).
La pénétration du virus dans la cellule se fait
par le phénomène d'endocytose et relargue sa nucléocapside
dans le cytosol. La réplication du virus se fait dans le cytoplasme.
Après le phénomène de décapsidation, les deux tiers
5' terminaux de l'ARN 40S se traduisent en polypeptides non structuraux
nécessaires à la synthèse de l'ARN complémentaire
de polarité négative.
Cette étape donne naissance à des ARN double
brin, les intermédiaires de réplication. L'ARN messager 24S est
après traduit en protéine C et les glycoprotéines E1 et E2
qui sont essentiels et entrent dans la structure des nouveaux virions. La
protéine C se combine
ISTMT-IPT 2012-2013

10
ISTMT-IPT 2012-2013

11
ISTMT-IPT 2012-2013

12
à L'ARN 40S formant ainsi la nucléocapside. Le
virus acquière son enveloppe par le phénomène de
bourgeonnement à partir des membranes intracellulaires ou plasmiques de
la cellule cible. L'enveloppe est faite des lipides des cellules hôtes et
des glycoprotéines E1 et E2 hérissant ainsi l'enveloppe sous
forme de spicules (Denis, 1999).
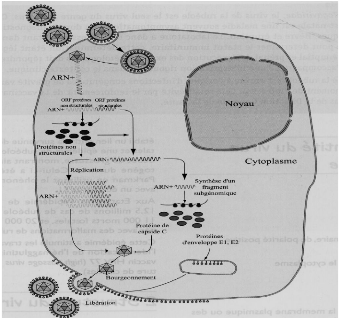
Figure 6: Réplication du virus de la
rubéole (Bienvenu et al., 2004)
V. Réponse immunitaire
Les immuglobulines M (IgM) spécifiques apparaissent
après quelques jours de l'infection et sont suivies par l'apparition des
immuglobulines G (IgG).
Le taux d'IgM augmente jusqu'à un maximum dans les 10
premiers jours puis ce taux diminue pour devenir presque négligeable
après quelques semaines.
L'augmentation rapide des IgM spécifique est utile
pour diagnostiquer l'infection. Les IgG vont être maximales en même
temps que les IgM et persistent plusieurs années, de même pour les
immuglobulines A (IgA) qui sont détectables dans le sérum et dans
les sécrétions naso-pharyngées.
L'immunité cellulaire précède
l'apparition des Ac de quelques jours, est atteint un maximal au même
moment de l'apparition des Ac. Elle reste détectable plusieurs
années (Collier et al., 2004).
La réponse immunitaire contre la rubéole et
d'autres virus implique le traitement de peptides viraux et leur
présentation à la fois CD8+ lymphocytes T cytotoxiques (CTL)
restreints par des allèles Human leukocyte antigen (HLA) de classe I et
de cellules T CD4+ restreints par des allèles HLA de classe II
(Ovsyannikova et al.,2009).
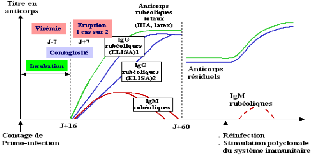
Figure 7: Cinétique d'apparition des
anticorps lors d'une infection et réinfection rubéolique (
www.microbe-edu.org)
VI. Epidémiologie et
prévention
VI.1. Epidémiologie
Le virus se propage par un contact direct entre les humains
(voie respiratoire). La rubéole est une maladie qui touche surtout les
enfants.
Cette maladie est cosmopolite et épidémique qui
se propage le plus souvent au printemps à cause du climat. Elle varie en
fonction de l'âge la zone géographique et surtout le programme de
vaccination dans les pays. Dans les pays tropicaux l'infection par cette
maladie survient chez les enfants à un âge précoce.
Au 19éme siècle
l'épidémie de la rubéole était beaucoup plus
fréquente avec des conséquences dramatiques. Au Etats-Unis la
rubéole a engendré 12,5 million de cas, et 20000 enfants sont
nés avec un syndrome de rubéole congénitale entre 1964 et
1965.
En 1969 cette épidémie a connu une chute
importante en raison des compagnes et la politique de vaccination de certains
pays comme l'Australie, Finlande, France, Grande Bretagne, Suède (Denis,
1999).
VI.2. Prévention et vaccination VI.2.1.
Prévention
Il n'existe pas de traitement curatif de la rubéole.
Aucun traitement préventif n'a fait la preuve de ses
efficacités après le contage. Les gammaglobulines sont
inefficaces.
La prévention repose donc sur la vaccination:
? Vaccination de tous les enfants a partir de l'âge de
12 mois, avec rappel entre 3 et 6 ans dans le but d'atteindre une couverture
vaccinale supérieur a 95%.
? Vaccination de rattrapage systémique de tous les
enfants non vaccinés antérieurement entre 11 et 13 ans.
? Vaccination des femmes non immunisées doit se faire
(chez la femme la sérologie de la rubéole est obligatoire pour le
certificat prénuptial. Pour les femmes enceintes
séronégatives, la vaccination doit être faite après
l'accouchement (Anglaret et al., 2002).
VI.2.2. Vaccination
Le premier vaccin contre le virus de la rubéole a
été fait en 1969.Une seule dose du vaccin entraine des taux d'Ac
chez prés de 95% des personnes sensibles. Ces taux d'Ac persistent au
moins 18 ans chez plus de 90% des personnes vaccinées.
Le vaccin contre la maladie de la rubéole est souvent
bien toléré. Des effets indésirables peuvent survenir au
cours de la vaccination comme le rash (éruption), l'adénopathie,
l'arthrite et la fièvre.
Parmi les contre indications de la vaccination contre cette
maladie, on peut trouver la présence de maladie fébrile,
l'immunodéficience, les antécédents de réaction
anaphylactique à la néomycine et la grossesse.
Le virus vivant atténué de la rubéole
dans le vaccin peut traverser le placenta et infecter le foetus mais aucun cas
d'embryopathie rubéolique n'a été signalé chez les
enfants dont les femmes ont été vaccinées au cours des
premiers mois de la grossesse.
ISTMT-IPT 2012-2013

13
Le vaccin peut être administré avec toute
sécurité en période postpartum, aux femmes allaitante, il
peut aussi être administré aux enfants de femmes enceintes
(Dontigny et al., 2008).
VII. Cellule BHK21 et multiplication du virus de la
rubéole a l'échelle cellulaire
VII.1. Cellule BHK21
La souche baby hamster kidney (BHK21) a été
isolée à partir du rein de hamster syrien. Elle possède
plusieurs caractéristiques et propriétés qui font d'elle
un support génétique facile dans son utilisation:
? Elle doit être facilement clonable afin d'obtenir des
lignées provenant d'une cellule isolée.
? Elle doit posséder une hérédité
stable, qui évolue peu au cours des divisions successives.
? Elle se cultive à la fois en tapis et en suspension.
Le caryotype de la souche BHK21 est stable. Il est
très proche de celui de l'animal. Cette souche possède en total
entre 43 à 44 chromosomes dans son caryotype assez difficile à
distinguer par les techniques de coloration homogène.
Les conditions optimales de clonage correspondent à un
pH de 7,2 et une température de 37°C.
Les milieux MEM et 199 ne permettent pas un clonage correct
de la souche BHK21 (efficacité d'étalement inférieure
à 1/100). Seul le milieu MEM complémenté avec les acides
aminés non essentiels permet cette croissance clonale en présence
de Sérum foetal bovin. Le temps de dédoublement des cellules est
14 heures (Caboche et al., 1973).
Les cellules BHK21 se multiplient rapidement au cours de 48
premières heures et font une couche complète et confluente pour
une incubation de 72 heures (Rahman et al., 2007).
VII.2. Multiplication du virus de la rubéole a
l'échelle cellulaire
La multiplication du virus se fait dans le cytoplasme. L'ARN
du virus va servir de messager. Il y a formation d'un intermédiaire de
réplication. L'ARN est encapsidé et les virions acquièrent
leur peplos par le phénomène de bourgeonnement grâce
à la membrane
ISTMT-IPT 2012-2013
cytoplasmique ou dans les vacuoles intracytoplasmiques et
libérées dans le milieu extérieur.
L'HA présenté sur le peplos apparait sur les
bourgeons de la membrane cytoplasmique. Dans ce cas il est possible de faire
une hemadsorption surtout sur les cellules VERO (lignée cellulaire
provenant de rein de singe cercopithèque) ou BHK21 (Huraux et
al., 1991).
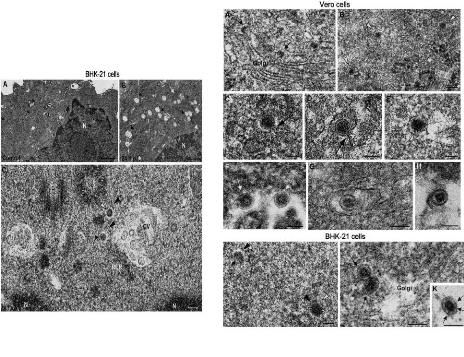
Figure 8: Détection du virion de la
rubéole dans
les cellules BHK21 (Risco et al., 2003) Figure
9: Cellules VERO et BHK21 infectées par
le virus de la rubéole. (Risco et al., 2003)

14
VIII. Diagnostic
La recherche du virus de la rubéole ne se fait que
dans les Laboratoires de virologie de haute technologie, elle est
limitée au diagnostic anténatal. Elle s'effectue soit par
isolement sur culture cellulaire soit par technique Reverse Transcriptase PCR
(RT-PCR) simples ou multiplex.
Le diagnostic sérologique repose soit sur la
présence d'IgM antivirus de la rubéole sans ou avec les IgG soit
sur la séroconversion ou ascension du titre des Ac IgG ou totaux. La
recherche des Ac anti rubéoliques fait appel au titrage des Ac par
l'Inhibition de l'hémagglutination (IHA), méthode
Enzyme-Linked-Immuno-Sorbent-Assay (ELISA)
ISTMT-IPT 2012-2013

15
indirecte ou immunocapture qui permet la différenciation
entre les IgG et IgM. La détermination de l'avidité est aussi
appliquée au Laboratoire spécialisé pour faire la
différence entre la primo-infection (infection acquise) ou
réinfection (Gaudelus, 2008).
VIII.1. Diagnostic direct
VIII.1.1. Recherche du virus par isolement en culture de
cellules
Le virus de rubéole peut se propager dans des cultures
de tissu mais ne donne pas un effet cytopathique (ECP).
Toutefois dans la culture du virus de la rubéole
certains cellules produisent une cytopathologie suffisante détectable
par les observateurs expérimentés (Jawetz et al.,
1973).
On cite ci-dessous quelques lignées cellulaires
animales pour la culture de virus de la rubéole:
· BHK21: de Stoker et Macpherson. C'est une
lignée cellulaire qui provient de rein de bébé hamster,
cette lignée a subi plusieurs transformations et a été
clonée plusieurs fois. Certains clones donnent un ECP alors que d'autre
permettent d'obtenir un titre élève d'hémagglutinine.
· RK13: C'est une lignée cellulaire de rein de
lapin.
· SIRC: Lignée cellulaire issue de cornée
de lapin établie par Leerhoy de l'Institut de Copenhague.
· VERO: Lignée cellulaire qui provient de rein de
singe cercopithèque.
Dans la pratique on utilise surtout:
· RK13 et SIRC pour l'isolement du virus, ces
lignées donnent un ECP total et rapide.
· BHK21 et d'autres lignées comme PS-Y155
(lignée cellulaire de rein de porc) ou BSC1 (lignée cellulaire de
rein de singe) pour la préparation et le titrage de l'HA. La culture in
vitro a permis de comprendre plusieurs phénomènes sur la
pathogénicité de la rubéole (Maurin, 1984).
ISTMT-IPT 2012-2013

16
VIII.1.2. Détection du génome
viral
La détection du génome viral est
réalisée soit par hybridation moléculaire directe ou par
la méthode d'amplification génique méthode de Polymerase
Chain Reaction (PCR).
C'est en 1986 que Terry et al ont rapporté le premier
essai de diagnostic anténatal de l'infection rubéolique par
hybridation moléculaire.
? L'hybridation moléculaire directe repose sur
l'utilisation de sonde localisée dans la région 3' du gène
E1. Cette hybridation permet de détecter 1 à 2 pico-gramme
d'ARN.
? D'autres auteurs ont mis au point la méthode
d'amplification génique en utilisant des amorces dans le gène
E1.
Toutes ces techniques nécessitent la validité sur
un grand nombre de prélèvements.
? La recherche d'ARN viral par PCR nichée (Nested PCR)
semble avoir une excellente sensibilité (détection d'une à
deux copies d'ARN). Elle se fait a partir de la de villosité choriale,
du placenta ou du produit d'avortement (Denis, 1999).
? La méthode RT-PCR a été
développée et évalué pour la détection de
l'ARN du virus de la rubéole directement prélevé à
partir d'échantillons cliniques en utilisant des amorces qui ont
amplifié 592 nucléotides, d'une région variable dans le
gène E1.
La sensibilité de la PCR a été
jugée équivalente à celle des essais déjà
publiés, qui amplifient les petites régions du gène E1
(Cooray et al., 2006).
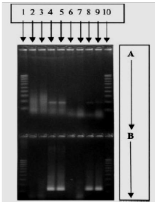
Figure 10: Technique de détection de
l'infection rubéolique a partir du liquide amniotique
de foetus par PCR et électrophorèse
RT-PCR(A),Nested PCR(B) (Bienvenu et al.,2004)
ISTMT-IPT 2012-2013

17
VIII.2. Diagnostic indirect
VIII.2.1. Centrifugation en gradient de
saccharose
L'ultracentrifugation en gradient de densité de
saccharose a permis la séparation des IgG et IgM et de résoudre
le problème chez la femme enceinte ayant en début de grossesse
une suspicion de contamination rubéoleuse (signes cliniques et/ou Ac
à titre élevé). La présence d'IgM spécifique
de la rubéole dans le sang du sujet indique qu'il y a une affection
récente, alors que leur absence est en faveur d'une réponse du
type secondaire chez un individu anciennement protégé. En plus
des IgM, il y a habituellement présence d'IgG à titre
supérieur.
La valeur de cet examen apparaît certaine, mais les IgM
n'étant pratiquement plus décelables après un mois, dans
le sang de la femme ne doit pas excéder cette valeur si nous voulons
disposer de résultats interprétables ( Maurin et al.,
1973).
VIII.2.2. Mesure de l'avidité spécifique
des IgG
La mesure de l'avidité des IgG peut aider à dater
l'infection (Picone et al., 2005).
On a montré que le test d'avidité des IgG est
utile pour différencier entre une récente ou ancienne infection
de la rubéole ou une réinfection, elle est
particulièrement utile pour étudier la rubéole chez les
femmes enceintes (Mubareka et al., 2007).
VIII.2.3. ELISA
(Enzyme-Linked-Immuno-Sorbent-Assay)
Les techniques d'ELISA sont des techniques sensibles et
faciles à réaliser. La stabilité du virus
(stabilité génétiques) fait que ce test sérologique
est fiable (Ellakhdi et al., 2009).
La technique a été appliquée avec
succès pour la détection des Ac spécifiques de la
rubéole.
? Presque les Kits ELISA IgG spécifiques pour la
détection de la rubéole sont tous disponibles dans le commerce et
de type indirect, en utilisant l'Ag de la rubéole fixé à
une phase solide (microplaque de polystyrène des plaques ou des billes
en plastique). La source de l'Ag (peptide, l'antigène du virus
recombinant ou entier) affecte la sensibilité et la
spécificité du test. Après le lavage et
l'élimination des Ag non liés, le sérum dilué est
ajouté et incubé avec l'Ag immobilisé. Les Ac
spécifiques de la rubéole présents dans le sérum se
lient à l'Ag. Ensuite, les Ac non liés sont
éliminés par lavage et un anti-IgG humain conjugué
à enzyme est ajouté pour l'incubation. La quantité du
Conjugué qui se lie à chaque puits est
ISTMT-IPT 2012-2013

18
proportionnelle à la concentration de l'Ac de la
rubéole spécifiques présents dans le sérum du
patient. Les plaques sont ensuite lavées et le Substrat est
ajouté, il en résulte un développement de la couleur. La
réaction enzymatique est arrêtée après une courte
période d'incubation, et la densité optique est mesurée
par un instrument lecteur ELISA.
? Les Kits ELISA IgM disponibles dans le commerce pour la
détection des IgM contre la rubéole spécifique sont
principalement de deux types:
A. ELISA indirecte: Le principe de l'essai a
été décrit ci-dessus pour la rubéole IgG, sauf pour
l'utilisation de l'enzyme et l'anti-IgM humain étiqueté comme
Conjugué. Dans cet essai, des résultats faux négatifs
peuvent se produire en raison d'une concurrence dans le dosage entre les Ac IgG
spécifiques avec une forte affinité, tandis que l'IgM
spécifiques à une plus faible affinité pour l'Ag.
B. ELISA IgM de capture: Dans ces essais
l'Ac anti-IgM humain est fixé à la phase solide pour la capture
des IgM sériques. L'Ag du virus de la rubéole est lié
à un Ac marqué par une enzyme pour détecter le complexe
(Ac-Ag). Ce type d'essai permet d'éliminer la nécessité
d'un prétraitement de l'échantillon avant le dosage
(Mendelson et al., 2006).
| 


