V.3.1. Etapes de titrage de l'HA
Trois lavages des GR avec le Tampon GGB sont
faits.
Les GR 0,25% sont mélangés avec le Tampon
Tacetal.
Dans une plaque de microtitration, la répartition des
solutions est comme suit:
· 75 ul de Tampon Tacetal ont
été mises dans la 1ère cupule.
· Dans les autres cupules 25 ul de Tampon Tacetal
sont ajoutés.
· Dans la 1ère cupule nous avons mis 25
ul de l'HA rubéolique.
· Le contenu de la 1ère cupule est
mélangé. 25ul de la solution (Tampon Tacetal
+HA) sont passés à la 2ème cupule.
Cette procédure est effectuée de la même
manière dans les 7 autres cupules, sauf dans la dernière
(témoin négatif).
Enfin 25 ul de GR dans toutes les cupules sont ajoutés.
? Homogénéiser sur une brique de glace à
+4°C et laisser une heure à température ambiante à
l'abri des vibrations et chocs pour faire la lecture de la plaque.

Figure 25: Titrage de l'hémagglutinine
rubéolique
ISTMT-IPT 2012-2013

33
VI. Validation du procédé de production de
l'HA rubéolique par le test ELISA indirect type IgG
VI.1. Matériel biologique
? Sérums humains
Des sérums (titrés) IgG négatifs,
fortement positifs et moyennement positifs des malades sont utilisés
pour la Validation de l'HA rubéolique déjà
préparée.
Ces sérums qui ont été fournis par le
Service de Virologie Clinique de L'Institut Pasteur de Tunis sont titrés
et conservés à -20°C.
? L'HA rubéolique (Ag)
L'HA rubéolique du lot (1/2013) est utilisé
dans le test ELISA. Le rôle de l'HA est la sensibilisation de la plaque
ELISA.
VI.2. Principe et étapes du test ELISA VI.2.1.
Principe
Le test ELISA indirect IgG pour la détection des Ac
anti rubéoliques de type IgG est une technique immuno-enzymatique. Ce
test permet la visualisation du complexe immun (Ac-Ag) grâce à une
réaction colorée produite par le Substrat chromogène
Ortho-Phénylène-Diamine(OPD) préalablement fixé sur
le Conjugué anti IgG marqué par la peroxydase.

34
ISTMT-IPT 2012-2013
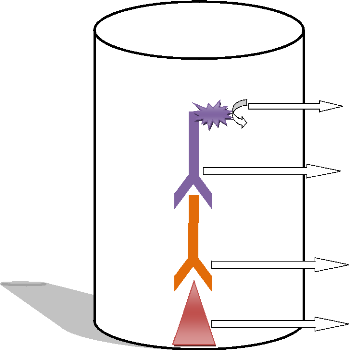
Substrat
chromogène OPD
Conjugué anti IgG humain marqué à la
peroxydase
IgG anti rubéolique
Hémagglutinine rubéolique
Principe du test ELISA indirect
VI.2.2. Réalisation du test ELISA indirect type
IgG
Les étapes du test ELISA indirect sont
résumées comme suit:
? Sensibilité de la plaque (coating de
l'Ag)
L'étape de sensibilisation consiste à mettre dans
chaque cupule de la plaque 100 ul d'HA rubéolique (lot 1/2013)
dilué au 1/50ème et1/100ème dans le
Tampon Carbonate/Bicarbonate (0,1M, pH=9,6) (annexe 5).
Cette étape nécessite un temps d'incubation d'une
heure à 37°C ou une nuit à +4°C.
ISTMT-IPT 2012-2013
|
? Lavage
Après l'étape de sensibilité trois
lavages par le Tampon PBS-Tween (annexe 5) ont
été effectués pour éliminer l'Ag non
fixé.
|
|
Figure 26: Lavage par le Tampon PBS Tween de la
plaque ELISA
? Saturation de la plaque
200 ul de Tampon de saturation PBS-Tween-Gélatine
5% (annexe 5) ont été mises dans chaque cupule de la
plaque ELISA une heure à 37°C pour occuper les sites qui sont
restés vides après l'étape de la sensibilisation.
Cette étape est importante pour éviter les
résultats faux positifs.
? Lavage
Trois lavages successifs par le Tampon PBS-Tween
ont été effectués une deuxième fois pour
éliminer les particules non fixés.
|
? Incubation du sérum
Les sérums à tester ont été
dilués au 1/50éme et au 1/100éme
dans le Tampon PBS-Tween-Gélatine 5% et repartis
à raison de 100 ul dans chaque cupule de la plaque d'ELISA pour une
durée d'incubation d'une heure a 37°C.
|
|
|
Figure 27: Incubation du sérum des
malades
|
? Lavage

35
Cette étape comporte six lavages successifs par le
Tampon PBS-Tween pour éliminer les Ac non fixés
à l'Ag rubéolique.
ISTMT-IPT 2012-2013

36
? Incubation du Conjugué
Le Conjugué anti IgG humain couplé
à l'enzyme peroxydase (annexe 5) a été
dilué à 1/10000 dans le Tampon PBS-Tween-Gélatine
5% et reparti à raison de 100 ul dans chaque cupule pour une
durée d'incubation d'une heure à 37°C.
? Lavage
Chaque cupule de la plaque est lavée six fois par le
Tampon PBS-Tween pour éliminer le
Conjugué anti IgG humain non fixé.
? Incubation du Substrat chromogène OPD
(annexe 5)
Le Substrat chromogène OPD est mis à raison de
100 ul par cupule pour une durée d'incubation de 30 min à
température ambiante à l'obscurité pour le bon
déroulement de la réaction de la dégradation du Substrat
et l'apparition de la couleur orangée (il faut recouvrir la plaque ELISA
par du papier aluminium).
? Arrêt de la réaction
Après les 30 min d'incubation la réaction
enzymatique doit être arrêtée par l'ajout de 50 ul
d'acide sulfurique H2SO4 4N (annexe5) dans chaque
cupule.
? Lecture de la plaque par
spectrophotomètre
La lecture de la plaque ELISA se fait grâce au
spectrophotomètre lecteur de plaque ELISA à une longueur d'onde
comprise entre 492 et 620 nm.
? Le test ELISA indirect est utilisé pour la Validation
de l'HA rubéolique produite. C'est un test de routine qui se base sur la
révélation des Ac IgG dans les sérums grâce à
l'HA préparé au Laboratoire d'Immunotechnologie et
Réactifs Biologiques (LIRB).
~~5
l~
~5e gf0o
~5
di

37
ISTMT-IPT 2012-2013
La culture en masse des cellules BHK21 a permis de produire l'HA
rubéolique. Chaque passage cellulaire nécessite un temps
d'incubation de 48h.
Les différents passages de la culture cellulaire et la
production d'HA sont décrites comme suit:
1 flasque 25 cm 2 1 flasques 75 cm2 2
flasques 150cm2
4 flasques 225cm2 4 bouteilles Roller Inoculation
virale
Production d'HA
Pour le titrage de l'Ag, l'agglutination des GR par l'HA est
révélée par la présence d'une voile tapissant au
fond de la cupule (agglutinats visibles à l'oeil nu).
Tableau 1: Résultats de titrage de
l'HA
|
Cupules
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
Dilutions
|
1/4
|
1/8
|
1/16
|
1/32
|
1/64
|
1/128
|
1/256
|
1/512
|
1/1024
|
Témoin négatif
|
|
Réactifs
|
|
|
|
|
|
|
|
|
|
|
|
(ul):
|
|
|
|
|
|
|
|
|
|
|
|
-Tacetal
|
75
|
25
|
|
25
|
25
|
25
|
25
|
25
|
25
|
25
|
|
25
|
|
-Antigène
|
25
|
---
|
|
---
|
|
---
|
|
---
|
---
|
---
|
---
|
---
|
|
---
|
|
-Dilution
|
|
25
|
|
25
|
|
25
|
|
25
|
25
|
25
|
25
|
25
|
|
|
-Globules rouges
|
25
|
25
|
25
|
25
|
25
|
25
|
25
|
25
|
25
|
25
|
|
|
Résultats
|
|
|
|
|
|
|
|
|
|
|
? Le titre de l'hémagglutinine rubéolique est
compris entre 512 et 1024 unité hémagglutinante (UHA).
·
ISTMT-IPT 2012-2013

38
Ce test est fait 2 fois, avec toujours les même
résultats.
· Ce titre est considéré,
élevé.
Dans le test ELISA indirect IgG 6 sérums ont
été utilisés pour contrôler l'efficacité et
la spécificité du lot d'HA produit par la technique de culture
cellulaire:
· 2 sérums négatifs
· 2 sérums moyennement positifs de titre 13 et 10
UI/ml
· 2 sérums fortement positifs de titre 237 et 228
UI/ml
Ces sérums vont nous servir aussi pour connaitre dans le
stade de préparation du Kit ELISA la dilution adéquate d'HA
à utiliser pour l'étape de la sensibilisation de la plaque
ELISA.
Les résultats des différentes combinaisons
testées sont présentés dans les tableaux suivants:
Tableau 2: Test numéro 1
· Dilution de l'HA = 1/50
· Dilution du sérum = 1/50
· Dilution du Conjugué = 1/10000
· Substrat OPD = 0,5 mg/ml
Référence de sérum
|
Titre connu: UI/ml
|
Densité optique (DO)
492/620 nm
|
Blanc
|
Blanc
|
0,052
|
Blanc
|
Blanc
|
0,066
|
Sérums négatifs
|
587/2013
|
négatif
|
0,225
|
588/2013
|
négatif
|
0,239
|
Sérums moyennement positifs
|
567/2013
|
13 UI/ml
|
0,779
|
436/2013
|
10 UI/ml
|
0,842
|
Sérums fortement positifs
|
623/2013
|
237 UI/ml
|
3,428
|
650/2013
|
228 UI/ml
|
2,952
|
|
ISTMT-IPT 2012-2013

39
Ces résultats nous permettent de déduire
l'absence du bruit de fond puisque le DO du Blanc est de l'ordre de 0,06.
· Dans les cupules des sérums moyennement
positifs et fortement positifs il y a apparition d'une coloration
orangée traduite par une absorbance de l'ordre de 0,779 et 0,842 (soit
un DO > 0,5; 0,5 est le seuil de positivité de notre test ELISA), en
effet dans les cupules des sérums négatifs il n'y a pas de
coloration et le DO des deux sérums négatifs est inférieur
à 0,5.
Tableau 3: Test numéro 2
· Dilution de l'HA = 1/50
· Dilution du sérum = 1/100
· Dilution du Conjugué = 1/10000
· Substrat OPD = 0,5 mg/ml
Référence de sérum
|
Titre connu: UI/ml
|
Densité optique (DO)
492/620 nm
|
Blanc
|
Blanc
|
0,069
|
Blanc
|
Blanc
|
0,057
|
Sérums négatifs
|
587/2013
|
négatif
|
0,220
|
588/2013
|
négatif
|
0,217
|
Sérums moyennement positifs
|
567/2013
|
13 UI/ml
|
0,715
|
436/2013
|
10 UI/ml
|
0,601
|
Sérums fortement positifs
|
623/2013
|
237 UI/ml
|
2,328
|
650/2013
|
228 UI/ml
|
2,265
|
|
Comparé au premier essai seulement la dilution des
sérums a changé de 1/50 à 1/100. Ceci confirme l'absence
de bruit de fond.
· Dans les cupules des sérums moyennement
positifs et fortement positifs il y a apparition de coloration orangée,
de même pour les sérums négatifs la DO est toujours
inferieure a 0,5.
ISTMT-IPT 2012-2013

40
? Pour les sérums moyennement positifs et fortement
positifs la DO a relativement diminué par rapport a une dilution de
sérum de 1/50.
Tableau 4: Test numéro 3
? Dilution de l'HA = 1/100
? Dilution du sérum = 1/100
? Dilution du Conjugué = 1/10000
? Substrat OPD = 0,5 mg/ml
Référence du sérum
|
Titre connu: UI/ml
|
Densité optique (DO)
492/620 nm
|
Blanc
|
Blanc
|
0,021
|
Blanc
|
Blanc
|
0,025
|
Sérums négatifs
|
587/2013
|
négatif
|
0,018
|
588/2013
|
négatif
|
0,020
|
Sérums moyennement positifs
|
567/2013
|
13 UI/ml
|
0,102
|
436/2013
|
10 UI/ml
|
0,099
|
Sérums fortement positifs
|
623/2013
|
237 UI/ml
|
0,130
|
650/2013
|
228 UI/ml
|
0,128
|
|
Dans le 3éme test, le passage d'une
dilution à la fois d'HA et des sérums de 1/50 à 1/100
entraine une baisse importante de l'absorbance surtout pour les sérums
positifs et en particulier les sérums moyennement positifs dont le DO
est devenu inferieur au seuil de positivité.
ISTMT-IPT 2012-2013

41
Tableau 5: Test numéro 4
? Dilution de l'HA = 1/100
? Dilution du sérum = 1/50
? Dilution du Conjugué = 1/10000
? Substrat OPD = 0,5 mg/ml
Référence du sérum
|
Titre connu: UI/ml
|
Densité optique (DO)
492/620 nm
|
Blanc
|
Blanc
|
0,030
|
Blanc
|
Blanc
|
0,027
|
Sérums négatifs
|
587/2013
|
négatif
|
0,111
|
588/2013
|
négatif
|
0,115
|
Sérums moyennement positifs
|
567/2013
|
13 UI/ml
|
0,609
|
436/2013
|
10 UI/ml
|
0,592
|
Sérums fortement positifs
|
623/2013
|
237 UI/ml
|
1,824
|
650/2013
|
228 UI/ml
|
1,997
|
|
Dans le 4ème test nous avons essayé
de garder une dilution d'HA à 1/100 et de prendre les sérums
à 1/50. Ainsi nous avons obtenu des résultats concordants qui
montrent l'absence de bruit de fond. La DO des sérums négatifs
est inferieure à 0,5 (seuil de positivité) et pour les
sérums moyennement positifs et fortement positifs le signal obtenu est
relatif au titre de chaque sérum.
En tenant compte des résultats obtenus avec les 4
essais réalisés nous montrons que dans les conditions des essais
1, 2 et 4 le signal obtenu pour les différents sérums y compris
le Blanc est concordant avec les titres préétablis avec le Kit de
commerce (Kit SIEMENS Enzygnost ELISA IgG) et aussi dans les
conditions préétablies et standardisées pour notre Kit
ELISA IgG Pasteur, développé antérieurement dans notre
Laboratoire.
Pour le lot d'HA que nous avons produit et pour des raisons
de rentabilité économique, nous choisissons les conditions de
l'essai numéro 4 qui fixe une dilution d'HA à 1/100.
ISTMT-IPT 2012-2013

42
Cette dilution sera respectée pour l'étape de
sensibilisation des plaques dans le procédé de préparation
du Kit ELISA IgG Pasteur.
."0-c1-0-51oo
etc
rSPe
P~
ISTMT-IPT 2012-2013

43
Dans le domaine de la virologie la culture cellulaire a
été un moyen qui a permis de
comprendre plusieurs phénomènes sur la
pathogénicité des virus.
En effet la culture du virus de la rubéole sur les
cellules BHK21 a permis la production de
l'hémagglutinine rubéolique.
Pour produire l'hémagglutinine rubéolique il faut
d'abord réussir:
? Le procédé de stérilisation du local et
du matériel par des règles de conduite
strictes dans les salles de culture.
? Le procédé de préparation des
réactifs utilisé dans la culture des cellules BHK21.
? Le procédé de culture des cellules en masse.
? Le procédé de récolte et d'extraction de
l'hémagglutinine rubéolique.
? Le titrage de l'hémagglutinine rubéolique par la
technique d'hémagglutination.
Le lot d'hémagglutinine rubéolique produit a
été validé par le test ELISA indirect IgG.
Les résultats obtenus après le test ELISA
indirect sont positifs selon les critères et les conditions
standardisées.
A l'heure actuelle d'autres travaux de recherche sont en
cours de réalisation au Laboratoire d'Immunotechnologie et
Réactifs Biologiques. Ces travaux sont basés sur
l'amélioration de la qualité de l'hémagglutinine produite,
utilisée pour le diagnostic et la production d'un Kit pour le diagnostic
de cette maladie.
L'objectif de ces travaux est de contribuer au
développement d'un Kit local pour éviter l'importation des Kits
commercialisés destinés au diagnostic de la maladie de la
rubéole.
Jusqu'à maintenant les résultats de ces travaux
sont prometteurs et laissent à espérer un progrès meilleur
dans ce domaine.
ce
OirrliOgr09104
~e
g
·
ISTMT-IPT 2012-2013

44
Anglaret.X, Mortier.E. Maladies infectieuses.
3ème édition. Paris: Editions ESTEM De BOECK
DIFFUSION, Editions MED-LINE, 2002; p 122.
· Armengaud.D. Pédiatrie.
3ème édition. Paris: Editions ESTEM De BOECK
DIFFUSION, Editions MED-LINE, 2003; p 280-281.
· Auletta.AE, Gitnick.GL, Whitmire.CE &
Sever .JL. An Improved Diluent for Rubella Hemagglutination and
Hemagglutination-Inhibition Tests. Applied Microbiology 1968;
16: 691-694.
· Banatvala.J, Peckham.C. Rubella
Viruses. Series Editors: Arie J.Zuckerman, Royal Free and University College
Médical School, London, UK Isa K. Mushahwar, Abbolt Laboratories, Abbolt
Park, USA, 1ère édition. UK: Elsevier, 2007; p 5.
· Bienvenu.AL, Delecroix.É. La
rubeole en 2004. DES de bactériologie-virologie-hygiène, 2004.
· Caboche.M, Giffard.G. Conditions de
clonage et de culture en suspension de la souche BHK21/13 de hamster syrien
Sensibilité des cultures aux inhibiteurs du métabolisme des
acides nucléiques. Ann.bio.anim.bioch.biophys 1973;
13: 643657.
· Chapel.H, Haeney.M, Misbah.S, Snowden.N.
Immunologie clinique De la théorie à la pratique, avec
cas cliniques. 4ème édition. Oxford: Editions De Boeck
Université, 2004; p 330.
· Chosidow.O. Virus et peau. Paris.
Editions ESTEM, 1994; p 200.
·
ISTMT-IPT 2012-2013

45
Collier.L, Oxford.J. Virologie humaine. De la
biologie a la clinique. Médecine - Science Flammarion, 2004; p 99.
· Cooray.S, Warrener.L, Jin.L. Improved
RT-PCR for diagnosis and epidemiological surveillance of rubella. Journal
of Clinical Virology 2006; 35: 7380.
· Denis.F. Les virus transmissibles de
la mère à l'enfant. Paris: Edition John Libby Eurotext ,1999; p
346-357.
· Dontigny.L, Arsenault.MY & Martel.MJ.
Rubéole au cours de la grossesse. Journal of Obstetrics and
Gynaecology Canada 2008; 30: 159-166.
· Ellakhdi.FE, Bjani.A, Takourt.B, Farouqi.B,
Benslimane.A & Fellah.H. Comparaison de deux techniques
immunoenzymatiques ELISA pour la détection des anticorps IgG
sériques. LES TECHNOLOGIES DE LABORATOIRE 2009;
4: 10-14.
· Feigin.RD, Cherry.J, Demmler.R, Kaplan.S.
Textbook of Pediatric Infectious
Diseases volume 2.
5ème Edition. Philadelphia: SAUNDERS, 2004; p 2134-2135.
· Gaudelus.J. Vaccinologie. DOIN EDITEURS.
Wolters Kluwer France, 2008; p 183.
· Guillet.M. Rubéole
congénitale en 2010 et vaccination. Congenital rubella in 2010 and
vaccination. Antibiotiques 2010; 12: 171-180.
· Hedman.K, Salonen.EM, Keski.OJA J &
Raiha.K. Single-serum radial hemolysis to detect recent rubella virus
infection. The Journal of infectious diseases 1986;
154: 1018-1023.
· Huraux.JM, Nicolas.JC, Agut.H.
Virologie. De la biologie a la clinique. Médecine- Science
Flammarion, 1991; p 211.
·
ISTMT-IPT 2012-2013

46
Jawetz.E, Melnick.JL, Adelberg.EA.
MICROBIOLOGIE MEDICALE. Paris: Librairie Maloine S.A. éditeur.
Québec les presses de l'université Laval, 1973; p 373-498.
· Lasek-Duriez.A, Hubiche.T, Aladjidi.N,
Lamireau.T Taïeb.A, & Léauté-Labrèze.C.
Exanthème chronique chez un enfant atteint de rubéole
congénitale. Chronic exanthema in a child with congenital rubella.
Annales de Dermatologie et de Vénéréologie 2008;
135: 222-224.
· Lee.JY, Bowdern.DS. La
réplication du virus de la rubéole et liens vers
Tératogénicité. Clinical Microbiol Reviews 2000;
13: 571-587.
· León.P, de Ory.F, Domingo.C,
López.J.A & Echevarría.J.M. Evaluation of a Latex
Agglutination Test for Screening Antibodies to Rubella Virus. European
Journal of Clinical Microbiology and Infectious Diseases 1988;
7: 196-199.
· Mammette.A .VIROLOGIE MEDICALE.
Collection AZAY presse universitaire de Lyon ,2002; p 204-318.
· Maurin.J. Virologie médicale.
Flammarion médicale science, 1984; p 589
· Maurin.J, Bezançon.J.
Importance de la séparation des immunoglobulines G et M dans la
rubéole: Résultats obtenus par ultracentrifugation.
Médecine et Maladies Infectieuses 1973; 3:
329-334.
· Mendelson.E, Aboudy.Y, Smetana.Z, Tepperberg.M
& Grossman.Z. Laboratory assessment and diagnosis of congenital
viral infections: Rubella, cytomegalovirus (CMV), varicella-zoster virus (VZV),
herpes simplex virus (HSV), parvovirus B19 and human immunodeficiency virus
(HIV). Reproductive Toxicology 2006; 21: 350-382.
·
ISTMT-IPT 2012-2013

47
Mubareka.S, Richards.H, Gray.M & Tipples.G.A.
Evaluation of Commercial Rubella Immunoglobulin G Avidity Assays.
Journal of Clinical Microbiology 2007; 45:
231-233.
· Ovsyannikova.IG, Vierkant.RA, Pankratz.VS,
O'Byrne.MM, Jacobson.RM & Poland.G A. HLA haplotype and supertype
associations with cellular immune responses and cytokine production in healthy
children after rubella vaccine. Vaccine 2009; 27:
3349-3358.
· Pebret.F. Maladies infectieuses
Toutes les pathologies des programmes officiels des études
médicales ou paramedicals.Paris .Editions HEURES DE FRANCE, 2003 ; p
510-511.
· Picone.O, Grangeot-Keros.L.
Rubéole et grossesse.
EMC-Gynécologie-Obstétrique 2005; 2:
343-353
· Risco.C, Carrascosa.JL & Frey.TK.
Structural maturation of rubella virus in the Golgi complex.
Virology 2003; 312: 261-269.
· Sever.JL, Huebner.RJ, Castellano.GA, Sarma.PS,
Fabiyi.A, Schiff.GM et al. Rubella complement fixation test.
Science 1965; 148: 385-387.
· Rahman.S-Ur, Rabbani.M, Sahidullah, Muhammad.K
& Iqball.Z. Studies on In Vitro Culture Characteristics
of Adherent Baby Hamster Kidney-21 (BHK-21). Cell Line. International
journal of agriculture and biology 2007; 9: 821-826.
· Weissfeldt.AS, Sonnenwirth.AC. New
Latex Agglutination Test for Rapid Determination of Rubella Immune Status.
Journal of clinical microbiology 1982; 16:
971-972.
· Yumei.Z, Ushijima.H & Frey.TK.
L'analyse génomique des divers génotypes du virus de la
rubéole. Journal of general virology 2007; 88:
932-941.
ISTMT-IPT 2012-2013
Site internet

48
?
www.larousse.fr
?
www.microbe-edu.org
AnHexes
| 


