II. MATERIEL ET METHODES
II.1 MATERIEL
II.1.1 Matériel végétal
Les fruits de Detarium microcarpum ont été
collectés en janvier 2018 à Guindi dans le département de
Mayo-Dallah, région de Mayo-Kebbi ouest, Tchad.

Figure 16 : photographie des fruits de
Detarium microcarpum
II.1.2 Matériel animal
Dans ce travail, nous avons utilisé les rats (Rattus
norvegicus) (Figure 17) mâles adultes âgés de 3
mois. Le poids de ces animaux variait entre 200-300g. Ils étaient
maintenus dans des conditions favorables d'élevage (au niveau de
l'animalerie du département des Sciences Alimentaires et Nutrition(SAN)
de l'Ecole Nationale des Sciences Agro-Industrielles (ENSAI). Ils recevaient
à volonté et quotidiennement, de l'eau du robinet et les aliments
à base du régime normal formulé selon Hamlat et al.
(2008).
Figure 17 : Photographie de Rattus
norvegicus
2018-2019
Propriétés biologiques de la pulpe du
fruit de Detarium microcarpum (Guill. & Perr)
Rédigé par BOBE MALLAYE 34
II.2 METHODES
II.2.1 Production de la poudre de fruits Detarium
microcarpum
La production de poudre de la pulpe (Figure 18) a
été obtenue à partir des fruits secs qui ont
été décortiqués manuellement, pilés à
l'aide d'un mortier puis tamisés encore manuellement à l'aide
d'un tamis de maille égale à 500 um. la poudre obtenue est
conservée dans les sachets plastiques scellé jusqu'à son
utilisation.
Fruits secs
Décorticage (manuel)
Pilage (mortier)
Tamisage grossier (= 500 um)
Poudre de la pulpe de D. microcarpum
Figure 18 : Procédé de production
de la poudre de la pulpe de Detarium microcarpum. II.2.2
Détermination de la composition chimique de la pulpe de D.
microcarpum
II.2.2.1 Détermination de la teneur en
protéines totales
L'azote total a été déterminé
après minéralisation des échantillons selon la
méthode de Kjeldahl (AFNOR, 1982), et le dosage selon la technique
colorimétrique de Devani et al. (1989).
? Minéralisation
La minéralisation selon Kjeldahl consiste à
détruire la substance organique contenue dans la denrée
alimentaire par l'acide sulferique concentré en présence de 0,5
mg de catalyseur de minéralisation Dumazert (mélange de 200g
NaSO4 + 3,5g de sélénium +3,2g de CuSO4). Pour cela 1g
d'échantillon, 5 mL de H2SO4 concentré, une pincée de
catalyseur de
2018-2019
Propriétés biologiques de la pulpe du
fruit de Detarium microcarpum (Guill. & Perr)
Rédigé par BOBE MALLAYE 35
minéralisation ont été introduits
successivement dans un matras de minéralisation qui a été
porté à chaud sur une rame de minéralisation
jusqu'à obtention d'une solution limpide, soit pendant 6 heures. Apres
refroidissement, le minéralisâ a été
récupéré dans une fiole jaugée de 50mL et son
volume complété au trait de jauge avec de l'eau
distillée.
? Principe de dosage
Le dosage colorimétrique de l'azote selon Devani et
al. (1989) utilise la réaction de Hantzsch. C'est une
méthode basée sur la réaction de l'ammoniac avec
l'acétylacétone et de formaldéhyde en milieu aqueux pour
donner un produit jaune ; le 3,5- diacétyl-1,4-dihydrolutidine (Figure
19)
O HCHO O
|
H3C C CH2
C=O
CH3
|
Formaldehyde
+
NH3
Ammoniac
|
CH2
C=O
CH3
|
C CH3
|
Acétylacétone
Acétylacétone
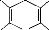
COCH3
H3COC
H3C CH3
H 3,5-diacétyl-1,4-dihydrolutidine (composé
jaune) N
Figure 19: Réaction de l'ammoniac avec
l'acétylacétone et formaldéhyde en milieu aqueux
(réaction de Hantzsch)
Le composé formé présente un maximum
d'absorption à 412 nm et peut être lire par
spectrophotométrie. L'intensité de la coloration est
proportionnelle à la concentration en
azote. Les résultats en g/100g de matière
sèche ont été exprimés par la relation :
Q = [100 × ?? × ??
(???? × ??) ] 100
Avec : q la quantité d'azote correspondant à la
densité optique lue ; f le facteur de dilution ; m la masse de
d'échantillon minéralisé et MS la matière
sèche de l'échantillon analysé.
Le coefficient conventionnel de conversion (6,25) est
utilisé pour convertir l'azote en protéines (AOAC, 1995). La
teneur en protéines brutes totales est donc 6,25Q (g/100gMS), les
résultats étant la moyenne de trois essais.
2018-2019
Propriétés biologiques de la pulpe du
fruit de Detarium microcarpum (Guill. & Perr)
II.2.2.2 Détermination de la teneur en sucres
disponibles ? Extraction des sucres totaux
Dans un tube à essai bouchant de 50 mL contenant 5mL
d'acide sulfurique 1,5N, 0,2g de poudre de la pulpe de D. microcarpum
ont été introduits. Le mélange a été
porté au bain-marie à 100°c pendant 45 minutes, puis
refroidi à température ambiante. 10mL d'éthanol à
70%, 1mL d'acétate de zinc (2g/100mL) et 1mL de ferrocyanure de
potassium (10,6g/100mL) y ont été ajoutés pour la
défécation. Le mélange a alors été
filtré dans un erlenmeyer de 50mL et le volume du filtrat
complété au trait de jauge avec de l'eau distillée.
? Dosages des sucres extraits par la méthode au
phénol
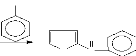
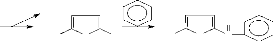
En milieu acide et à chaud, les pentoses et les hexoses
subissent une cyclisation pour donner respectivement le furfural et
l'hydroxyméthyl furfural (Figure 20). Les composés ainsi
formés réagissent avec le phénol pour former un complexe
coloré jaune orangé présentant une absorption maximale
à 450 nm. Le complexe coloré ainsi formé permet le dosage
spectrophotométrie des sucres et leurs dérivés par la
méthode de Dubois et al., (1956).
O
O C
O H
Pentoses H +
? O C H O
Rédigé par BOBE MALLAYE 36
Furfural Complexe jaune orangé
H 2 O
Hydroxyméthylfurfural
Complexe jaune orangé
O H
Figure 20: Equation de la réaction des
oses avec le phénol en milieu acide et à chaud
Hexoses
H +
H 2 O
? H O H 2 C O C H
O
H O H 2 C
O
O C
Soient Q : la quantité des sucres dans la prise d'essai ;
Vt : le volume total de l'extrait ; m : la
prise d'essai en g ; v : le volume d'échantillon
analysé et Hr : la teneur en eau résiduelle.
L'intensité de la coloration est proportionnelle à
la concentration en sucre.
La quantité de sucres en g/100g de MS est donnée
par la relation :
|
Q =
|
100 × q × Vt m × v
|
(100 - Hr)
|
2018-2019
Propriétés biologiques de la pulpe du
fruit de Detarium microcarpum (Guill. & Perr)
Rédigé par BOBE MALLAYE 37
| 


