|

UNIVERSITE CHOUAIB DOUKKALI
Faculté des Sciences EL
Jadida
Département de Biologie
Master spécialisé
« Biotechnologie Appliquée à la
Production Végétale
et Industrie Agroalimentaire
»


Promotion 6 : 2017-2019
Mémoire de Master spécialisé
intitulé :
Etude du pouvoir coagulant et antioxydant
de
l'artichaut sauvage et de l'artichaut cultivé au Maroc
Présenté et soutenu par :
Sylvain HAREMARUGIRA
Le 21/10/2019
Devant le Jury composé de :
Pr. DAHBI A. Faculté Polydisciplinaire de Safi
Président
Pr. CHAOUTI A. Faculté des Sciences d'El Jadida
Examinateur
Pr. BITAR A. Faculté des Sciences d'El Jadida
Encadrant
REMERCIEMENTS
Avant toute chose, je remercie Dieu, le tout puissant, de
m'avoir donné la force, la
patience et la bonne santé pour
achever ce travail.
Je remercie le doyen de la Faculté des Sciences
le professeur Mohammed BLAGHEN
qui m'a accueilli dans cette
institution. Grace à lui j'ai eu la chance de la découvrir et
en
fin d'aboutir aux résultats de ce modeste travail.
Je tiens à remercier également le professeur
Tayeb KOUSSA le coordinateur de Master
Biotechnologie
Appliquée à la Production végétale et Industrie
Agroalimentaire pour ses
conseils et orientation qu'il trouve ici mes
sincères remerciements.
J'adresse mes sincères remerciements à Madame
Aouatif BENALI mon encadrante dans
le laboratoire de
Technologie Alimentaire de l'Institut National de Recherche
Agronomique de
Rabat, d'avoir accepté de m'encadrer lors de mon stage de fin
d'études,
je la remercie pour sa disponibilité et son aide
tout le long de ce modeste travail, qu'elle
trouve ici toutes mes
gratitudes.
Je remercie vivement le Professeur Abdelali BITAR
malgré ses préoccupations a accepté
de
m'accompagner lors de la rédaction et correction de ce mémoire,
ses conseils et
recommandations m'ont été si noble.
Vifs remerciements aux membres du jury Professeur DHABI
Abdallah, Professeur
CHAOUTI Abdellatif et
Professeur BITAR Abdelali qui ont accepté de juger
et
d'évaluer mon travail. Leurs conseils et recommandations m'ont
envoyé à une
amélioration digne.
Mes remerciements
à Monsieur Abdenbi SAADI Technicien du laboratoire
de
Technologie Alimentaire de l'INRA Rabat sans lui ce travail n'aura pas
été achevé.
Je tiens également à
remercier tous les professeurs du master BAVIA, pour leurs efforts
fournis
enfin d'arriver à ce jour, qu'ils trouvent ici mes sincères
remerciements.
Un grand merci à tous mes amis de la 6è
promotion BAVIA, pour leur aide, leur amitié,
leur gentillesse et
leur soutien moral.
Nous remercions également toute personne ayant
contribué de près ou de loin à la
réalisation de
ce travail.
Un grand merci à vous tous.
DEDICACE
Je dédie ce modeste travail
A mes regrettés grands parents, que la terre leur soit
légère.
A mes parents, leur affection m'a toujours été
d'un grand soutien. Qu'ils trouvent dans ce
travail le fruit de leur
indéfectible effort et qu'ils puissent récompenser leur patience.
Que
le bon Dieu vous accorde santé et longévité.
A mes frères et ma soeur : Méthode, Aimable,
Régis et Estella. C'est pour moi l'occasion
de vous remercier pour
tous les efforts, la prière, sacrifices consentis à l'endroit de
ma
modeste personne. Notre force résidera toujours dans notre
entente. Que notre amour
fraternel demeure inébranlable. Infini
attachement.
A mes oncles Léonidas NDABUTWINTARA et Pontien BATAKANWA.
Leur soutien financier et moral ainsi que le respect mutuel m'ont permis
d'arriver à ce moment
précieux.
A mes amis Ménard SABUSHIMIKE et Nadia NITUYIZERE pour
leur conseil et soutien moral m'ont aidé à arriver au bout.
Et à tous mes amis qui sont de près ou de
loin.
SOMMAIRE
INTRODUCTION 1
PREMIERE PARTIE :ETUDE BIBLIOGRAPHIQUE 3
CHAPITRE I. GENERALITES SUR LES PLANTES ETUDIEES
3
I) L'artichaut cultivé 3
I.1. Description botanique des astéracées 3
I.2. Caractères généraux de l'artichaut
cultivé 3
I.2.1. Historique 3
I.2.2. Origine 4
I.2.3. Description morphologique 4
I.2.4. Répartition géographique au Maroc 5
I.2.5. Constituants chimiques de l'artichaut cultivé 5
I.2.6. Utilisations 6
II) L'artichaut sauvage . 7
II.1. Description 7
II.2. Taxonomie et nomenclature 8
II.3. Distribution 9
II.4. Intérêt biologique de la plante 9
II.5. Constituants chimiques 10
CHAPITRE II : LA COAGULATION DU LAIT 10
A. Le lait 10
II.1. Définition et aspects et généraux du
lait 10
II.2. La composition du lait 11
II.2.1. L'eau 11
II.2.2. Les glucides du lait 12
II.2.3. La matière grasse 12
II.2.4. L'Azote non protéique 13
II.2.5. La matière minérale et saline 13
II.2.6. Les vitamines 13
II.2.7. Les proté ines du lait 14
II.2.7.1. Généralités sur la caséine
du lait 15
B. Les enzymes coagulantes 20
II.1. Présure 19
II.1.1. Chymosine 20
II.1.2. Pepsine 20
II.2. Cynarases et Cardosine 21
II.3. Succédanés de la présure 21
II.3.1. Succédanés de présure d'origine
animale 22
II.3.2. Succédanés de présure d'origine
végétale 23
II.3.3. Succédanés de présure d'origine
microbienne 23
II.4. Coagulation du lait 23
II.4.1. Définition 23
II.4.2. Types de coagulation 24
II.4.3. Mécanismes d'action de coagulation 26
CHAPITRE III. LES METABOLITES SECONDAIRES 28
III.1. Composés phénoliques 28
III.2. Flavonoïdes 29
III.3. Les tanins 29
IIEME PARTIE : ETUDE PRATIQUE 32
I. INTRODUCTION 32
II. MATERIEL ET METHODES 32
II.1. Matériel utilisé et échantillonnage
33
II.2. EXTRACTION DES COMPOSES PHENOLIQUES 35
II.2.1. Préparation des extraits 35
II.2.2. Dosage des composés phénoliques 36
II.2.2.1. Dosage des polyphénols totaux 36
II.2.2.2. Dosage des flavonoïdes 36
II.2.2.3. Dosage des tanins condensés 37
II.2.3. Evaluation de l'activité antioxydante des
extraits 37
II.2.3.1. Activité anti radicalaire au radical DPPH 37
II.2.3.2. Activité anti radicalaire au radical l'ABTS.
38
II.2.4. Extraction du système enzymatique des fleurs
40
II.2.4.1. Obtention de l'extrait enzymatique des fleurs 40
II.2.4.2. Dosage de l'activité protéolytique des
extraits enzymatiques. 41
II.2.4.3. Détermination de l'activité coagulante
42
II.3. ANALYSE DES DONNEES STATISTIQUES 43
III. RESULTATS ET DISCUSSION 44
III.1.TENEUR EN EAU DU MATERIEL VEGETAL 44
III.2.DOSAGE DES COMPOSES PHENOLIQUES 44
III.2.1. Polyphénols totaux 44
III.2.2. Flavonoïdes 45
III.2.3. Tanins condensés 46
III.3. EVALUATION DE L'ACTIVITE ANTIOXYDANTE
47
III.3.1. Activité anti radicalaire par DPPH 47
III.3.2. Activité anti radicalaire par l'ABTS 48
III.3.3. Discussion sur les composés phénoliques et
l'activité antioxydante 49
III.4. DETERMINATION DE L'ACTIVITE PROTEOLYTIQUE
53
III.5. DETERMINATION DE L'ACTIVITE COAGULANTE
54
CONCLUSION 56
PERSPECTIVES 57
REFERENCES BIBLIOGRAPHIQUES 58
LISTE DES FIGURES
Figure 1. Aspect morphologique de l'artichaut
cultivé. 4
Figure 2. Aspect morphologique de l'artichaut
sauvage. 8
Figure 3. Structure d'un globule de
matière grasse du lait (Lapointe-Vignola, 2002). 12
Figure 4 : Structure de la micelle de la
caséine (Amiot et al., 2002) 16
Figure 5. Modèle coeur-enveloppe 17
Figure 6. Modèle à sous
unités (à submicelles) 17
Figure 7. Modèle à structure
ouverte 18
Figure 8. Modèle à double liaison
19
Figure 9. Modification de la structure
micellaire au cours de l'acidification 25
Figure 10. Modification de la structure
micellaire au cours de la coagulation présure. 25
Figure 11. Formation d'un caillé par
action de la présure sur les caséines du lait
27
Figure 12. Effet du stress salin sur la concentration
des flavonoïdes au niveau des
feuilles du carthame (Roumeissa et Maya, 2015) 28
Figure 13. Structure de base des
flavonoïdes 29
Figure 14. Exemples de tanins condensés
30
Figure 15. Exemples de tanins hydrolysables
31
Figure 16. Fleur de l'artichaut cultivé
sans ouverture (premier stade) 34
Figure 17. Fleur de l'artichaut cultivé
avec ouverture (second stade) 34
Figure 18. Fleur de l'artichaut sauvage sans
ouverture (premier stade) 34
Figure 19. Fleur de l'artichaut sauvage avec
ouverture (second stade) 34
Figure 20. Moulinex à café 34
Figure 21. Broyeur à sec 34
Figure 22. Lait utilisé après
35
Figure 23. Présure utilisée 35
Figure 24. Oxydation partielle de l'ABTS (Owen
et Johns, 1999). 39
Figure 25. Fleur avant lyophilisation 40
Figure 26. Fleur lyophilisée 40
Figure 27. Macération des fleurs
broyées 41
Figure 28: Extraits enzymatiques de deux
plantes: sauvage et cultivée 41
Figure 29. Concentration des polyphénols
totaux sur les deux stades. 44
Figure 30. Concentration des flavonoïdes
sur les deux stades. 45
Figure 31. Concentration des tanins
condensés sur les deux stades 46
Figure 32. Pourcentage d'inhibition d'un radical
DPPH sur les deux stades. 47
Figure 33. Pourcentage d'inhibition d'un radical
ABTS sur les deux stades. 49
Figure 34. Activité protéolytique
de deux extraits des fleurs comparée avec celle de la
présure 53
Figure 35. Coagulation totale du lait
après incubation au bain marie 55
LISTE DES TABLEAUX
Tableau 1: Identification des pics UHPLC - UV -
MS des métabolites dans les extraits de feuilles d'artichaut (les pics
sont énumérés dans l'ordre du temps de rétention
en
minutes sur la colonne RP-18 (El et al., 2014). 6
Tableau 2. Valeur alimentaire comparative des
cultures maraîchères (FAO, 1998) 7
Tableau 3. Arbre taxonomique de l'artichaut
cultivé et l'artichaut sauvage (Lemordant,
1982 ; Kelly, 2000). 9
Tableau 4. Composition générale du
lait 11
Tableau 5. Composition minérale du lait
de vache (Jeantet et al. 2017). 13
Tableau 6. Composition vitaminique moyenne du
lait cru (Amiot et coll., 2002). 14
Tableau 7. Composition en % de laits de
certaines espèces (Fox, 2011). 15
Tableau 8. Moyennes des concentrations des
polyphénols totaux 45
Tableau 9. Moyennes des concentrations des
flavonoïdes 46
Tableau 10. Moyennes des concentrations des
tanins condensés. 47
Tableau 11. Moyennes de pourcentage d'inhibition
de DPPH. 48
Tableau 12. Moyennes de pourcentage d'inhibition
d'ABTS. 49
Tableau 13. Temps de floculation
différents selon les concentrations de l'extrait et de
présure 54
LISTE DES ABREVIATIONS
Abs : Absorbance
ABTS : acide 2,2'-azino-bis
(3-éthylbenzothiazoline-6-sulphonique)
AC : Activité coagulante
ANP : Azote non protéique
AP : Activité protéoly tique
CO2 : Gaz carbonique
CRRA : Centre Régional de la Recherche
Agronomique
Da: Dalton
DPPH:
2,2-diphényl-1-picrylhydrazyl)
EDTA: Ethylène Diamino Tétra
Acétate
FAO: Food and Agricuture Organization
FLV : Flavonoïdes
IMCU : International Milk-Clotting Units
INRA : Institut National de la Recherche
Agronomique
O2 : Oxygène
OMS : Organisation mondiale de la
Santé
pH : Potentiel d'hydrogène
pHi : pH isoélectrique
PPT : Polyphénols totaux
TCA : Trichloroacetic Acid
TNC : Tanins condensés
Trp : Tryptophane
Tyr : Tyrosine
UP : Unité de présure
UV : Ultra-violet
Présentation de l'institution
d'accueil
L'Institut National de la Recherche Agronomique (INRA), est un
établissement public dont les origines remontent à 1914 avec la
création des premiers services de la recherche agricole officiel. Il a
connu dernièrement une réorganisation structurelle visant la
modernisation de son processus de gestion.
L'INRA opère à travers dix centres
régionaux de la recherche agronomique et 23 domaines
expérimentaux répartis sur le territoire national et couvrant les
divers agro systèmes du pays. L'INRA vise à :
? Analyser la demande sociale et les systèmes de
production ;
? Améliorer la productivité, la
compétitivité et la durabilité de la production
agricole ;
? Caractériser, préserver et valoriser les
ressources naturelles ;
? Améliorer la qualité,
? Valoriser et diversifier les productions
végétales et animales.
Le Centre Régional de la Recherche Agronomique de Rabat
(CRRA) mène ses activités de recherche dans les domaines
prioritaires tels que : Environnementale et la conservation des ressources
naturelles, Protection des plantes, Production animale et les fourrages,
Biotechnologie, Technologie Agro-alimentaire et qualité,
Amélioration des plantes, conservation et valorisation des ressources
phylogénétiques.
L'unité d'accueil au sein du centre de Rabat notamment
celle de la technologie alimentaire a pour mission principale de mener des
activités de recherche pour la valorisation des produits agricoles
d'intérêt et la maitrise de la qualité de la
sécurité sanitaire des produits alimentaires.
1
Introduction
Un grand nombre de plantes (plantes épices,
légumes, plantes aromatiques, médicinales et autre)
possèdent des propriétés biologiques très
intéressantes qui trouvent des applications dans divers domaines
à savoir en agroalimentaire, médecine, pharmacie,
cosmétologie et agriculture (Madina, 2008). Cependant les
composés phénoliques (principalement flavonoïdes, acides
phénoliques et tannins) constituent une richesse largement
exploitée par les industries agro-alimentaire, cosmétique et
pharmaceutique (Nkhili, 2009). L'extraction de principes actifs de ces
métabolites est une étape très importante dans leur
isolement, aussi bien que dans leur identification (Mahmoudi et al., 2013).
Une consommation élevée de fruits et
légumes a pu être associée à la diminution du risque
des maladies métaboliques telles que les pathologies cardiovasculaires,
l'obésité, le diabète, les maladies
neurodégénératives, le cancer dans de nombreuses
études épidémiologiques. De multiples constituants et
micronutriments de ces aliments tels que les fibres, les vitamines, les
minéraux et les polyphénols jouent potentiellement un rôle
dans cet effet protecteur qui s'explique en partie par leurs
propriétés antioxydantes et anti-inflammatoires (Roumeissa et
al., 2015).
Les enzymes sont des protéines qui agissent comme des
catalyseurs hautement efficaces dans les réactions biochimiques.
L'utilisation d'enzymes a souvent de nombreux avantages car cela ne peut pas
être obtenu avec les traitements chimiques traditionnels. Elles
comprennent une qualité de produit supérieure, des coûts de
fabrication inférieurs, moins de déchets et en consommation
d'énergie. Les enzymes industrielles représentent le coeur des
procédés biotechnologiques(Guevara et Raul, 2018).
L'hydrolyse des protéines alimentaires, par exemple,
est mise en oeuvre pour diverses fonctions: amélioration des
caractéristiques nutritionnelles, retarder la
détérioration, modification des propriétés
fonctionnelles différentes (solubilité, moussage, coagulation, et
capacités d'émulsification), prévention des interactions
indésirables, changement de saveurs et d'odeurs et l'élimination
des facteurs toxiques ou inhibiteurs (Pardo et al., 2000).
L'étape clé de la réussite d'un fromage
quel que soit son type est la coagulation. Elle consiste à la formation
d'un gel suite à des modifications physico-chimiques intervenant sur les
micelles de caséines du lait. L'agent coagulant le plus anciennement
utilisé en fromagerie est la présure (Zikiou, 2013). La
coagulation du lait est traditionnellement obtenue par action de la
présure extraite des caillettes provenant des petits ruminants. Le
2
caractère irrégulier de l'approvisionnement en
présure a conduit les industries à utiliser des
préparations enzymatiques coagulant le lait dans lesquelles la chymosine
est remplacée plus ou moins totalement par d'autres enzymes à
mode d'action analogue, et ce, parallèlement à l'usage
traditionnel de la présure de veau qui assurait encore la coagulation de
90 % des fromages en 1980 (Desmazeaud, 1983).
Plusieurs recherches ont été activement
pressées ces dernières années, visant à la mise en
évidence des enzymes de remplacement dits succédanés de la
présure de différentes origines (animales,
végétales et microbiennes), capables de coaguler le lait et
d'assurer des meilleurs rendements fromagers, l'industrie est à
présent capable de produire, en quantité pratiquement
illimité.
A part la valeur nutritive importante de l'artichaut, les
fleurs contiennent des protéases capables de coaguler le lait ayant des
propriétés catalytiques similaires à la chymosine. Ses
bractées sont riches en composés phénoliques en grande
quantité les polyphénols et les flavonoïdes (Petropoulos et
al., 2019).
Dans ce contexte, l'objectif global de ce travail est
centré sur l'étude de deux plantes de la famille des
astéracées Cynara scolymus et Cynara cardunculus
afin d'étudier l'activité protéolytique et coagulante
des fleurs en comparaison avec celle de la présure d'origine
microbienne. Dans une deuxième partie nous allons procéder au
dosage de composés phénoliques contenu dans les bractées
tout en évaluant leur pouvoir d'inhibition des radicaux libres DPPH
(2,2-diphényl-1-picrylhydrazyle) et ABTS (acide 2,2'-azino-bis
(3-éthylbenzothiazoline-6-sulphonique).
3
Ière partie :
ETUDE BIBLIOGRAPHIQUE
CHAPITRE I. Généralités sur les
plantes étudiées
I). L'artichaut cultivé
I.1. Description botanique des
astéracées
La famille des Astéracées (anciennement
nommées « composées ») est une importante famille de
plantes dicotylédones (principalement herbacées) qui comprend
près de 13000 espèces réparties en 1500 genres. Ces
plantes ont la caractéristique commune d'avoir une inflorescence en
capitule, c'est-à-dire une multitude de fleurs sans pédoncule
regroupées sur un réceptacle et entourées de
bractées florales.
Néanmoins, elles sont particulièrement
diversifiées dans les régions sèches, comme le Bassin
Méditerranéen, l'Afrique australe, le Mexique et le Sud-Ouest des
Etats-Unis, les régions arides d'Amérique du Sud (Benkahoul,
2016).
Une étude effectuée dans la région
d'Ouargla dans le sud algérien a permis d'inventorier 37 espèces
dont, 27 ont pu être échantillonnées sur terrain. Les
familles les plus importantes sont les composées (13,51%), les
graminées (10,81%), les chénopodiacées (8,10 %) et les
labiées (8,10%) (Didi et al., 2003)
I.2. Caractères généraux de
l'artichaut cultivé I.2.1. Historique
Au Moyen-Orient on appelle souvent l'artichaut (Figure 1)
«Ardhi Chouki», qui signifie littéralement «épine
de terre». Les mots «Artichaut» en français,
«Carciofo» en italien, «Artichoke» en anglais,
«Alcachofa» en espagnol et «Artishoke» en allemand,
trouvent tous leur origine dans le mot arabe «Harsciof», qui signifie
«épine de terre» (Dridi, 2003). Bigot et al., (1984) ont
été les premiers à affronter le problème de la
propagation in vitro de l'artichaut, ils utilisèrent du matériel
issu de graines pour contourner les difficultés de désinfection
du matériel provenant du champ. Pena-Iglesias et Ayuso (1974) sont
partis de
4
culture d'apex méristèmatique ; ils ont
réussi à obtenir des plants indemnes de virus de `Tudela',
cependant, l'enracinement demeurait problématique (Dridi, 2003).
I.2.2. Origine
L'artichaut est une culture appartenant à la famille
des Astéracées (Tableau 3), originaires de la région
méditerranéenne où il est traditionnellement
cultivé et couramment consommé comme légume. Il est connu
depuis l'Antiquité comme une nourriture et un remède en
médecine (Negro et al., 2012).
I.2.3. Description morphologique
L'artichaut est une plante vivace de 8-15 dm, dressée,
raide, robuste anguleuse (Figure 1). Les feuilles sont blanchâtres ou
tomenteuses (couverte d'une pubescence cotonneuse, entrecroisée,
feutrée) en dessous dépourvues d'épines, pennatipartites
(feuille pennée, à partitions dépassant le milieu de
chaque demi-limbe), les supérieures pennatifides (feuille pennée,
à lobes atteignant à peu près le milieu de chaque
demi-limbe), lobées ou presque entières. Le capitule est souvent
gros.
L'involucre (réunion des bractées,
verticillées ou imbriquées, insérées à la
base d'une ombelle ou de toute inflorescence) à folioles largement
ovales ordinairement échancrées et mucronées au sommet,
charnues à la base (Dridi, 2003).

Figure 1. Aspect morphologique de l'artichaut
cultivé.
5
I.2.4. Répartition géographique au Maroc
La culture d'artichaut est largement distribuée dans le
monde. La production mondiale avoisine 1,32 millions de tonnes (FAO, 2003) sur
une superficie d'environ 122 mille hectares. 67% des superficies mondiales en
artichaut sont localisées en Europe et produisent 66% de la production
mondiale.
Au Maroc, la superficie de la culture de l'artichaut
représente 2,5% de la superficie mondiale et produit 3,4% de la
production mondiale (Elattir et al., 2009).
La superficie de la culture d'artichaut a été de
l'ordre de 8.500 Ha en 1964 et ceci grâce à la haute valeur
ajoutée dégagée par les exportations vers la France.
Cependant en 1981, la superficie a chuté à 6.200 Ha puis à
environ 2.200 Ha en 1984. Cette chute s'explique surtout par la
réduction des exportations, par la baisse des prix sur le marché
local, et par la sécheresse qui a causé la
dégénérescence des plants (Elattir et al., 2009).
Les principales régions de production sont le Gharb
(80%) suivi de la Basse Moulouya, le Saïs et le Haouz. Les surfaces
cultivées sont de l'ordre de 4130ha (2007/08), alors que les superficies
potentiellement cultivables rien que dans le Gharb sont estimées
à 6000 ha (Krira, 2010)
I.2.5. Constituants chimiques de l'artichaut
cultivé
L'artichaut (Cynara scolymus L.) est une plante
méditerranéenne largement utilisée en médecine
traditionnelle pour ses propriétés biologiques attribuées
essentiellement aux polyphénols (Mahmoudi et al., 2013).
Les composants chimiques de l'artichaut ont fait l'objet de
nombreuses études et se sont révélés être une
riche source d'acides caféoylquiniques et de flavonoïdes (Tableau
1). Parmi les hydroxycinnamates, les acides chlorogéniques et l'acide
1,5-dicaféoylquinique sont les composés prédominants
(Petropoulos et al., 2019). Cependant, l'acide 1,3-dicaffeoylquinique
était le composé dicaffeoylquinique majeur rapporté par
d'autres études (Tableau 1) (El et al., 2014).
Les fleurs des espèces de plantes à cardon
(C. cardunculus et C. scolymus) contiennent une grande
quantité de protéases de coagulation du lait (cardosines et
cynarases) ayant des propriétés catalytiques similaires à
la chymosine. Ils appartiennent au même groupe de
6
chymosine (protéinase aspartique, EC. 3.4.23),
jusqu'ici considérée comme la meilleure des protéases pour
la fabrication du fromage (Guevara et Raul, 2018).
Tableau 1: Identification des pics UHPLC - UV - MS des
métabolites dans les extraits de feuilles d'artichaut (les pics sont
énumérés dans l'ordre du temps de rétention en
minutes sur la colonne RP-18 (El et al., 2014).
|
Peak
No.
|
R (min)
|
Identification
|
UV (nm)
|
M-H (m/z)
|
|
1
|
5.90
|
Luteoline-o-glucoside
|
345
|
705
|
|
2
|
6.03
|
5-o- Acide Caffeoylquinique (acide
chlorogenique
|
2950 shd, 325
|
353
|
|
3
|
6.12
|
3-o-acide feruloylquinique
|
290 shd, 325
|
367
|
|
4
|
7.35
|
Luteoline-7-o-rutinoside
(scolymoside)
|
271,341
|
593
|
|
5
|
7.63
|
Luteoline-7-o-glucoside (cynaroside)
|
270,344
|
447
|
|
6
|
7.70
|
Hespertine glucoside
|
Nd
|
463
|
|
7
|
7.87
|
Apigenine-7-o-rhamnosyl-glucoside
|
Nd
|
577
|
|
8
|
7.91
|
Luteoline-7-o-glucuronide
|
Nd
|
461
|
|
9
|
7.95
|
1,5-di-o- acide caffeoylquinique
|
296 shd, 325
|
515
|
|
10
|
8.02
|
1,5-di-o-acide
caffeoylquinique(isomère)
|
296 shd, 325
|
515
|
|
11
|
8.09
|
Acide caffeique conjugué (inconnu)
|
296 shd, 325
|
519
|
|
12
|
8.15
|
Luteoline-7-o-acetyl-glucoside
|
Nd
|
489
|
|
13
|
8.27
|
Apigenine-7-o-glucoside (cosmoside)
|
265,330
|
431
|
|
14
|
9.92
|
Luteoline
|
330
|
285
|
|
15
|
10.32
|
Cynarasaponine E
|
Nd
|
809
|
|
16
|
10.88
|
Acide Trihydroxy octadecadenoique
|
Nd
|
327
|
|
17
|
11.28
|
Cynarasaponine J
|
Nd
|
941
|
|
18
|
11.42
|
Acide trihydroxy octadecenoique
|
Nd
|
329
|
|
19
|
11.53
|
Cynarasaponine C
|
Nd
|
793
|
|
20
|
15.62
|
Acide hydroxy octadecatrienoique
|
Nd
|
293
|
|
21
|
16.43
|
Acide hydroxy octadecadienoique
|
Nd
|
295
|
I.2.6. Utilisations
L'artichaut est cultivé pour ses capitules,
dotés de principes actifs dont la nature phénolique joue un
rôle prépondérant dans leurs caractéristiques
organoleptiques. En alimentation, la valeur nutritive globale du coeur
d'artichaut est comparable, sinon supérieure, à celle de la
majorité des cultures maraîchères (Tableau 2) (Dridi,
2003).
7
Tableau 2: Valeur alimentaire comparative des cultures
maraîchères (FAO, 1998).
Les feuilles sont principalement utilisées pour la
production d'extraits commerciaux de nutraceutiques, enrichies en
polyphénols, considérant que les capitules et les racines, sont
une source d'inuline, utilisés comme ingrédient pré
biotique dans les aliments fonctionnels (Petropoulos et al., 2019). La
tête d'artichaut (capitulum) est un aliment sain en raison de sa faible
teneur en graisse et riches en fibres, protéines, minéraux et
composés phénoliques (Nouraei et al., 2018).
En plus d'être consommé comme aliment,
l'artichaut est reconnu comme un médicament à base de plantes (El
et al., 2014). Les extraits de feuilles peuvent réduire le
cholestérol dans le sérum selon deux mécanismes : soit par
l'induction de son élimination, soit par une action inhibitrice sur sa
synthèse de novo (Dridi, 2003).
II). L'artichaut sauvage II.1.
Description
Cynara cardunculus est une plante herbacée
vivace érigée pouvant mesurer entre 60 et 150 cm (Figure 2), mais
qui peut atteindre la hauteur de 2 m avec un écart de 2 m (W. of
Australia, 2016). Il a une grande racine pivotante qui
régénère chaque année (Pepper, 1996). Les tiges
sont épaisses et rigides, se ramifient souvent dans les parties
supérieures,
8
elles sont côtelées longitudinalement et
recouvertes d'un duvet de coton. hors sol une partie de la plante meurt chaque
année, mais les ramifications se développent à partir du
porte-greffe lors de la prochaine saison de croissance (Kelly, 2000; Botanica,
2011).

Figure 2. Aspect morphologique de l'artichaut
sauvage.
(
https://www.cal-ipc.org/plants/profile/cynara-cardunculus-profile)
Les feuilles sont vert grisâtre sur la face
supérieure et légèrement velues et forment une rosette
basale pouvant atteindre 120 x 30 cm. Les extrémités des feuilles
sont couvertes d'épines jaunâtres / oranges de 5 à 20 mm de
long (Kelly, 2000).
L'inflorescence est isolée au sommet d'une branche, sur
une tige épaisse de 1 à 6 cm de long. Les capitules sont presque
en forme arrondis et ils sont constitués de fleurons bleus, roses ou
violets disposés sur un réceptacle charnu, et entourée
d'un certain nombre de grandes bractées. Les bractées sont de
couleur violacée et se terminent en une épine aplatie (Kelly,
2000).
II.2. Taxonomie et nomenclature
L'artichaut sauvage est une espèce acceptée de
la famille des Asteraceae, parfois appelée famille des Compositae
(Tableau 3). C'est parfois appelé à tort artichaut, une
espèce cultivée étroitement apparentée (Gatto et
al., 2013).
9
Tableau 3. Arbre taxonomique de l'artichaut
cultivé et l'artichaut sauvage
(Lemordant, 1982 ; Kelly,
2000).
Artichaut cultivé Artichaut sauvage
Règne Plantae Plantae
Phylum Spermatophytes Spermatophytes
Subphylum Angiospermes Angiospermes
Classe Equisetopsida Dicotylédones
Famille Astéraceae Astéraceae
Genre Cynara Cynara
Espèce Cynara scolymus Cynra cardunculus
II.3. Distribution
L'artichaut sauvage est originaire de la région
méditerranéenne d'Europe du Sud et d'Afrique du Nord. Il a
été introduit en Australie en tant qu'alimentation et fourrage
potentiels. L'artichaut sauvage pousse principalement là où les
précipitations annuelles dépassent 450 mm. Il peut aussi envahir
les cours d'eau, les bords de routes, les drains et les zones humides dans les
zones à faible pluviosité. C'est le plus compétitif dans
les sols argileux lourds (G. of S. Australia, 2015; Kelly, 2000). Cynara
cardunculus a également été signalé dans le
nord de l'Europe et au Moyen-Orient, ainsi que des mentions isolées
d'Asie centrale et orientale (Kelly, 2000).
II.4. Intérêt biologique de la
plante
Des recherches ont été menées pour
préparer du biodiesel à partir d'huile de Cynara cardunculus
(Alexandre et al., 2012), utilisant le méthanol pour
caractériser les esters méthyliques, en vue de l'utilisation pour
les moteurs à biodiesel (Encinar et al. 2002) ou après
transestérification à l'éthanol pour caractériser
les esters éthyliques obtenus, en vue de son utilisation pour l'allumage
par compression moteurs (Pandino et al., 2011).
La capacité antioxydante des feuilles et de la tige
florale dépendait qualitativement et quantitativement du profil des
acides phénoliques et des flavonoïdes. Les acides
phénoliques et les flavonoïdes contenus dans des parties
normalement non consommées
10
d'artichaut sauvage et cultivé pourraient être
exploités en tant que sources d'antioxydants naturels (Pandino et al.,
2011).
II.5. Constituants chimiques
Différentes études ont été
menées au cours des dernières années pour évaluer
l'huile de Cynara cardunculus, en fonction des rendements obtenus et
des différents modes d'application. Les grains de l'artichaut sauvage
(Cynara cardunculus) ont montré qu'ils renferment des huiles en
composition d'acides gras (Raccuia et al., 2012).
Les principaux composés présents dans la feuille
étaient les dérivés de lutéoline dans les
artichauts du globe et les dérivés d'apigénine chez le
cardon sauvage et cultivé. En plus de Cimiciusa di Mazzarino (var.
Scolymus), les acides caféoylquiniques représentent les
principaux composés phénoliques de la tige florale. `Sylvestris
Creta' (var. sylvestris) et `Violetto di Sicilia' (var. scolymus)
présentent la teneur la plus élevée en acide
caféoylquinique 95% du total des polyphénols mesurés.
(Pandino et al., 2011; KhaKhaldi et al., 2013)
CHAPITRE II : La coagulation du lait
A. Le lait
II.1. Définition et aspects et
généraux du lait
Le lait était défini en 1908 au cours du
congrès international de la répression des fraudes à
Genève comme étant « Le produit intégral de la traite
totale et ininterrompue d'une femelle laitière bien portante, bien
nourrie et nom surmenée. Le lait doit être recueilli proprement et
ne doit pas contenir du colostrum : les laits mal propres présentent des
inconvénients tant du point de vue hygiénique que du point de vue
économique » ( Codou Latyr, 1997; Souheila, 2011).
Le lait est un liquide sécrété par les
glandes mammaires des femelles après la naissance du jeune. Il s'agit
d'un fluide aqueux opaque, blanc, légèrement bleuté, d'une
saveur douceâtre et d'un pH (6.6 à 6.8) légèrement
acide, proche de la neutralité, il peut être
considéré comme une émulsion de matière grasse dans
une solution aqueuse (Zikiou, 2013).
11
II.2. La composition du lait
De très nombreux facteurs peuvent intervenir sur la
composition du lait dont l'espèce, la race, le stade de lactation, la
saison, l'état sanitaire, l'alimentation (Zikiou, 2013).
Le lait est constitué de quatre phases :
? Une émulsion de matière grasse ou phase grasse
constituée de globules gras et de vitamines liposolubles (A, D) ;
? Une phase colloïdale qui est une suspension de
caséines sous forme de micelles ;
? Une phase aqueuse qui contient les constituants solubles du
lait (protéines solubles, lactose, vitamine B et C, sels
minéraux, azote non protéique) ;
? Une phase gazeuse composée d'O2, d'azote et de CO2
dissous qui représente environ 5% du volume du lait.
L'analyse du lait permet de distinguer des composants chimiques
majeurs (Tableau 4) (eau, matière grasse, matières
azotées, glucides et matières minérales) et mineurs
(vitamines et enzymes) (Codou Latyr, 1997).
Tableau 4. Composition générale du
lait
Constituants majeurs Variations limites (%) Valeurs
moyennes (%)
Eau 85,5-89,5 87,6
Matières grasses 2,4-5,5 3,7
Protides 2,9-5,0 3,2
Glucides 3,6-5,5 4,6
Minéraux 0,7-0,9 0,8
Constituants mineurs Vitamines, enzymes, pigments Cellules
diverses, gaz
II.2.1. L'eau
L'eau du lait provient du sang par filtration au niveau de la
glande mammaire. Elle représente la phase dispersante des constituants
non hydrosolubles du lait et la phase solvant des substances solubles
(glucides, matières minérales et vitamines hydrosolubles)
(Tableau 4) (Codou Latyr, 1997).
II.2.2. Les glucides du lait
Dans le lait de vache, les glucides sont
représentés essentiellement par le lactose, ou galactosido 1-4
glucose, qui est synthétisé dans la glande mammaire. C'est un
disaccharide à saveur relativement peu sucré, peu soluble, et
possèdent un groupement réducteur.
Le lactose joue un rôle important dans les produits
laitiers en tant que substrat de fermentation pour les bactéries
lactiques qui l'hydrolysent en glucose et galactose, puis transforment ces
hexoses en acide lactique. (Codou Latyr, 1997).
II.2.3. La matière grasse
Le lait de vache, comme le lait de femme, contient environ 35
g/L de lipides. Les lipides du lait sont en partie synthétisés
dans la glande mammaire. Le fait que le lait de vache présente un
rapport acides gras saturés/acides gras insaturés bien plus
élevé que celui de la nourriture végétale
ingérée par l'animal s'explique toutefois aussi par le fait que
des acides gras non saturés sont hydrolysés dans le rumen de la
vache, sous l'influence des bactéries (Codou Latyr, 1997).
Les globules gras (Figure 3) dans le lait sont en
émulsion huile dans l'eau, chaque globule est formé de
différentes couches de triglycérides : les triglycérides
liquides, à bas point de fusion, sont au centre du globule et les
triglycérides solides, à haut point de fusion se superpose au
précédents. Le globule est entouré à la
périphérie d'une sorte d'enveloppe contenant des phospholipides,
qui jouent le rôle d'émulsifiant dans la stabilité du
globule gras, et des lipoprotéines (Zikiou, 2013). L'objectif principal
de ces lipides est de fournir une source d'énergie au
nouveau-né.
12
Figure 3. Structure d'un globule de matière
grasse du lait (Lapointe-Vignola, 2002).
13
II.2.4. L'Azote non protéique
L'azote non protéique (ANP) correspond à toutes
les molécules renfermant de l'azote, autres que les protéines.
Selon (Alais, 1984), ce sont des substances de bas poids moléculaire.
Elles ne précipitent pas dans les conditions de précipitation des
protéines du lait : acidification, élévation de
température ou addition de présure. Elles sont peu abondantes 1,5
à 16 g/L dans le lait de vache (Zikiou, 2013).
II.2.5. La matière minérale et
saline
Les matières minérales sont
représentées dans le lait à une proportion variant de 8
à 12 grammes par litre. C'est une fraction mineure par rapport aux
lipides, glucides et protides, mais leur importance est considérable.
Les matières salines les plus importantes sont les citrates, le calcium,
le phosphore et les chlorures.
Le lait contient des quantités importantes de
différents minéraux (Tableau 5). Les principaux minéraux
sont calcium, magnésium, sodium et potassium pour les cations et
phosphate, chlorure et citrate pour les anions (Souheila, 2011).
Tableau 5. Composition minérale du lait de vache
(Jeantet et al. 2017).
|
Eléments minéraux
|
Concentration (mg.kg-1)
|
|
Calcium
|
1043-1283
|
|
Magnésium
|
97-146
|
|
Phosphate inorganique
|
1805-2185
|
|
Citrate
|
1323-2079
|
|
Sodium
|
391-644
|
|
Potassium
|
1212-1681
|
|
Chlorure
|
772-1207
|
Les concentrations de calcium rapportées dans diverses
études varient de 25 à 35 mg / 100 ml. Le phosphore à 13 -
16 mg / 100 ml est beaucoup plus constant mais proportionnellement plus faible
à la caséine et au calcium que dans les laits de la plupart des
autres espèces (Williamson, 1944).
II.2.6. Les vitamines
Le lait a presque toutes les vitamines appartenant aux deux
groupes liposoluble et hydrosoluble (Tableau 6). Ces vitamines sont
essentiellement apportées par l'alimentation
14
et se retrouvent dans le lait sous forme de traces. Ainsi leur
taux est en relation avec le régime alimentaire et aussi avec le stade
de lactation. Certaines vitamines sont inactivées par la chaleur, par
l'oxydation ou par la photolyse (effet de la lumière solaire et des
rayonnements) (Laurent, 1992).
On distingue d'une part les vitamines hydrosolubles (vitamine
du groupe B et vitamine C) en quantité constantes, et d'autre part les
vitamines liposolubles (A, D, E et K) (Tableau 6).
Tableau 6. Composition vitaminique moyenne du lait cru
(Amiot et coll., 2002).
|
Vitamines
|
Teneur moyenne (ìg/100ml)
|
|
Vitamines liposolubles
Vitamine A (+carotènes)
Vitamine D
Vitamine E
Vitamine K
|
40
2.4
100
5
|
|
Vitamines hydrosolubles
|
|
|
Vitamine C (acide ascorbique)
|
200
|
|
Vitamine B1 (thiamine)
|
45
|
|
Vitamine B2 (riboflavine)
|
175
|
|
Vitamine B6 (pyridoxine)
|
50
|
|
Vitamine B12 cyanocobalamine)
|
0.45
|
|
Niacine et niacinamide
|
90
|
|
Acide pantothénique
|
350
|
|
Acide folique
|
5.5
|
|
Vitamine H (biotine)
|
3.5
|
II.2.7. Les protéines du lait
Le lait est un fluide sécrété par la
femelle de toutes les espèces de mammifères, principalement pour
répondre aux besoins nutritionnels complets du nouveau-né.
Le lait de renne et de lapin domestique contient aux environs
de 12% de protéines. Cette valeur est supérieure à celle
que peut contenir le lait humain ou de vache. (Tableau 7) (Fox, 2011).
Différentes structures et propriétés physicochimiques
distinguent les protéines du lait. On les classe en deux
catégories d'après leur solubilité dans l'eau et leur
stabilité : d'une part, les différentes caséines qui sont
en suspension colloïdale, qui se regroupent sous forme de micelles,
d'autre part les protéines du sérum qui sont en solution
colloïdale et qui précipitent sous l'action de la chaleur (Zikiou,
2013).
15
Tableau 7. Composition en % de laits de certaines
espèces (Fox, 2011).
|
Espèces
|
Solides totaux
|
Lipides
|
Protéines
|
Lactose
|
Cendres
|
|
Humain
|
12.2
|
3.8
|
1.0
|
7.0
|
0.2
|
|
Vache
|
12.7
|
4.5
|
2.9
|
4.1
|
0.8
|
|
Mouton
|
19.3
|
7.4
|
4.5
|
4.8
|
1.0
|
|
Porc
|
18.8
|
6.8
|
4.8
|
5.5
|
_
|
|
Cheval
|
11.2
|
1.9
|
2.5
|
6.2
|
0.5
|
|
Ane
|
11.7
|
1.4
|
2.0
|
7.4
|
0.5
|
|
Renne
|
33.1
|
16.9
|
11.5
|
2.8
|
_
|
|
Lapin domestique
|
32.8
|
18.3
|
11.9
|
2.1
|
1.8
|
|
Bison
|
14.6
|
3.5
|
4.5
|
5.1
|
0.8
|
|
Eléphant indien
|
31.9
|
11.6
|
4.9
|
4.7
|
0.7
|
|
Ours polaire
|
47.6
|
33.1
|
10.9
|
0.3
|
1.4
|
|
Phoque gris
|
67.7
|
53.1
|
11.2
|
0.7
|
_
|
II.2.7.1. Généralités sur la
caséine du lait
La caséine représente 80 % des protéines
du lait. La caséine constitue le coagulum qui donnera naissance,
après égouttage et maturation, au fromage.
Les protéines du lait peuvent être réparties
en deux catégories :
? les caséines (insoluble à pH: 4.6)
? les protéines du lactosérum (soluble à pH:
4.6)
L'appellation caséine regroupe en fait quatre
protéines majeures : les caséines OEs1, OEs2, f3 et K et des
protéines mineures (existant en plus faibles quantités) ainsi que
des composants issus de l'hydrolyse de la caséine f3 par la plasmine
(ã caséines et protéase-peptones). La micelle de
caséine est une particule sphérique d'un diamètre de 150
à 200 nm (Ado, 2017).
Chez les mammifères, elles permettent la transmission
des nutriments, et particulièrement de minéraux de la mère
à sa progéniture. Les caséines sont des protéines
phosphorylées et naturellement riches en minéraux. De plus, elles
sont principalement associées au phosphate de calcium qui est
indispensable pour le développement des os. Les concentrations en
calcium dans le lait sont si importantes que sans la présence des
caséines celui-ci précipiterait (McMahon et Brown, 2010).
16
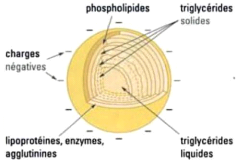
II.2.7.2.1. Structure de la caséine
Jusqu'à maintenant, on a proposé
différents modèles structuraux de micelles et il semble clair que
les micelles sont formées de sous-micelles reliées ensemble par
des ponts phosphate de calcium. Les sous-micelles périphériques
sont plus hydrophiles et contiennent une plus grande proportion de
K-caséine.
La submicelle de caséine n'a pas une structure
homogène (Figure 4). Elle possède un coeur hydrophobe
constitué par la caséine f3 associée aux parties
hydrophobes des autres caséines. En périphérie, on
retrouve les parties hydrophiles des différentes caséines (partie
phosphorylée pour les caséines áS1 et S2) ainsi que la
partie glycosylée de la caséine K. La caséine kappa serait
susceptible de stabiliser 10 fois son propre poids en caséine
áS1, áS2 et f3 (Soumeya, 2017).
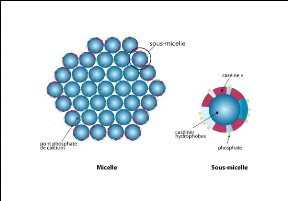
Figure 4 : Structure de la micelle de la caséine
(Amiot et al., 2002).
II.2.7.2.2. Les différents modèles
structuraux des micelles
De nombreux modèles ont été
proposés au fur et à mesure de l'avancée des connaissances
sur les caractéristiques physico-chimiques des micelles de
caséine. Ces modèles reposent sur des méthodologies
différentes et peuvent être classé en trois
catégories: les modèles coeur-enveloppe, les modèles
à sous unités et les modèles à structure ouverte
(Dalgleish et Corredig, 2012).
a. 17
Modèle coeur-enveloppe (Figure 5)
Cette modélisation (Waugh et al., 1970) est
basée d'une part, sur la présence de complexes constitués
de caséines áS et f3 au coeur de la micelle, capable de fixer le
calcium et d'autre part, sur la capacité de la caséine K à
stabiliser les caséines sensibles au calcium. En effet, en
présence de calcium, la précipitation des complexes áS-f3
est évitée par la formation de complexes áS1-k
situés en monocouche en surface de la micelle.
Figure 5. Modèle coeur-enveloppe
b. Modèle à sous unités (à
submicelles) (Figure 6)
La micelle serait composée de sous unités,
appelées submicelles de 10 à 20nm de diamètre qui seraient
l'unité de base de la macrostructure. Ces submicelles sont
structurées comme dans le modèle de Waugh, mais elles sont
reliées entre elles par du phosphate de calcium colloïdal (Schmidt
et al., 1982).
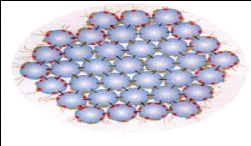
Figure 6. Modèle à sous unités
(à submicelles)
c. 18
Modèle à structure ouverte (Figure
7)
Le modèle à structure ouverte est basé
sur l'existence d'interactions spécifiques entre les caséines
individuelles, conduisant à la formation d'un gel protéique
poreux, dont le phosphate de calcium ferait partie intégrante et ne
serait plus un simple agent de pontage. Cette modélisation
rétablit la notion d'une répartition plus homogène des
caséines au sein de la micelle avec, non seulement la présence de
la caséine K à la surface des micelles, mais aussi celle de
caséines á et â (Holt, 1992).
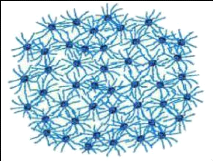
Figure 7. Modèle à structure
ouverte
d. Modèle à double liaison
(Figure 8)
C'est un modèle basé sur la
polymérisation du réseau caséinique. Il s'agit d'un
assemblage de caséines individuelles par des liaisons hydrophobes et des
ponts de phosphate de calcium colloïdal. La formation et
l'intégrité des micelles sont contrôlées par un
équilibre entre les forces attractives et répulsives des micelles
de caséines (forces hydrophobes, forces électrostatiques). D'un
autre côté, du fait que la caséine k ne peut avoir que des
liaisons hydrophobes avec les autres caséines, elle semble agir comme
une chaîne terminale (superficielle) stabilisante (Horne, 2002).
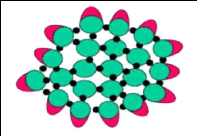
19
Figure 8. Modèle à double
liaison
La formation et l'organisation de la micelle de caséine
implique des liaisons de nature hydrophobe et des liaisons
électrostatiques entre les caséines. Les liaisons
résultant de l'affinité entre les groupements
phosphoséryls et les ions calcium et magnésium interviennent
aussi (Brule et al., 1997). La structure et les propriétés de la
micelle de caséine ont été largement
étudiées en raison de son rôle déterminant dans les
propriétés physico-chimiques du lait et des produits laitiers
(Ado, 2017).
B. Les Enzymes coagulantes
Les protéases (également appelées enzymes
protéolytiques ou protéinases) désignent un groupe
d'enzymes dont la fonction catalytique consiste à hydrolyser les
liaisons peptidiques des protéines. Celles-ci sont largement
distribuées dans tous les végétaux, animaux et
microorganismes (Guevara et Raul, 2018).
Elles sont impliquées dans une grande diversité
de processus cellulaires, notamment la photo-inhibition dans les chloroplastes,
les mécanismes de défense, la mort cellulaire programmée
et la photo morphogenèse chez les jeunes plants en développement
(Mockaitis et Estelle, 2008).
Les protéases sont également impliquées
dans tous les aspects du cycle de vie des plantes, de la mobilisation des
protéines de stockage pendant la germination des graines au lancement
des programmes de mort cellulaire et de sénescence (Guevara et Raul,
2018).
II.1. Présure
La présure est un coagulant du lait essentiel à
la fabrication du fromage. Elle fait passer le lait de l'état liquide
à l'état solide. Le phénomène de coagulation du
lait est rendu possible
20
grâce à la caséine (protéine
contenue dans le lait). La caséine réagit lorsqu'elle est
placée dans un milieu acide généralement obtenu lorsqu'on
ajoute de la présure ou des ferments lactiques dans le lait.
Il existe divers types de présures non issus des sucs
gastriques d'animaux. En effet, la technique de coagulation du lait n'est pas
unique, puisque d'autres méthodes quoique plus lentes permettent cette
étape. Entre autres, il y a la présure microbienne, dont l'enzyme
coagulante est issue de la fermentation de champignons comme le Rhizomucor
miehei, le Rhizomucor pusillus, le Mucor miehei. Des
présures végétales, extraites de plantes comme le figuier,
le gaillet jaune, le petit artichaut sauvage ou les fleurs de chardon sauvage
existent également (Guevara et Raul, 2018).
La présure est toujours considérée comme
étant l'enzyme la plus adaptée pour coaguler le lait dans la
production fromagère, cependant, son utilisation est confrontée
à la contrainte de sacrifice des jeunes veaux (Mohanty et al., 2003). En
conséquence l'industrie fromagère subit une crise dans
l'approvisionnement de ce coagulant et cette situation a donné une
impulsion aux recherches sur les enzymes de remplacement de la présure,
elles concernent diverses sources potentielles de protéases (Zikiou,
2013).
La production de fromage est en croissance constante et il est
prévu que, dans un prochain avenir, l'utilisation des protéases
d'origine végétale vont augmenter, produisant un nouveau fromage
de spécialité favorisant le marché aux fromages (Guevara
et Raul, 2018).
II.1.1. Chymosine
La chymosine est sécrétée inactive sous
forme de « pro-chymosine » dans la caillette. Sous l'action de
l'acidité provenant du suc gastrique, elle se transforme en «
chymosine active ». C'est une protéase acide aspartate. Son poids
moléculaire est de 30 700 Da. Elle est constituée d'une seule
chaîne peptidique renfermant 323 acides aminés (Foltmann et
al.,1979).
II.1.2. Pepsine
La pepsine est une protéase acide
sécrétée dans le sac gastrique de tous les
mammifères après sevrage sous forme de précurseur inactif
appelé pepsinogène d'un poids moléculaire de 42000
daltons. Contrairement à la chymosine, la pepsine à une
acidité plus élevée et une activité coagulante
faible (Soumeya, 2017).
II.2. 21
Cynarases et Cardosine
La Cardosine A est une protéase aspartique
identifiée dans les cellules du chardon Cynara cardunculus. La
cardosine A a été isolée il y a plus de 20 ans et a
été montré qu'elle s'accumule dans les vacuoles de
réserve et les vacuoles lytiques des tissus floraux, et dans les corps
protéiques des graines (Pereira, 2015).
Les fleurs des espèces de plantes à cardon
(C. cardunculus et C. scolymus) contiennent beaucoup de
protéases de coagulation du lait (cardosines et cynarases) ayant des
propriétés catalytiques similaires à la chymosine (Guevara
et Raul, 2018). Elles appartiennent au même groupe de chymosine
(protéinase aspartique, EC. 3.4.23), considérée jusqu'ici
comme la meilleure des protéases pour la fabrication du fromage (Guevara
et Raul, 2018).
Pendant longtemps, elle est utilisée dans la
fabrication de divers fromages à pâte molle au Portugal et en
Espagne, en raison de son activité de coagulation du lait. Cette
activité coagulante est due à l'existence de protéinases
aspartiques présentes dans les fleurs (Pereira, 2015).
II.3. Succédanés de la
présure
La présure traditionnelle telle que la chymosine est
très utilisé dans les industries fromagères. La forte
demande subite l'approvisionnement de la présure est plus difficile. Des
travaux ont été lancés afin de trouver d'autres sources
potentielles de protéase pour remplacer la présure nommées
des succédanés de présure (Nouani et al., 2009).
Les enzymes coagulantes appelées aussi les
succédanés de présure sont classées en 3
catégories selon l'origine de l'enzyme :
· Succédanés de présure d'origine
animale.
· Succédanés de présure d'origine
végétale.
· Succédanés de présure d'origine
microbienne.
Les succédanés de présure doivent
représenter un certain nombre de conditions pour pouvoir les utiliser
:
· L'activité protéolytique doit être
faible comparativement à l'activité coagulante.
· La spécificité protéolytique sur
la â-caséine doit être faible, sinon l'amertume se produit
dans le fromage (Kelly, 2000 ; Fox, 2011).
· La pureté chimique et la qualité
microbiologique doivent être élevées.
·
22
Le rendement fromager devrait être identique à celui
de la présure
· Prix nettement inférieur à celui de la
présure de veau (Nouani et al., 2009).
? Caractéristiques physico-chimiques de
succédanés de présure
A Bonne solubilité dans l'eau :
celle-ci conditionne la répartition du produit et permet l'obtention
d'une coagulation homogène dans toute la masse du lait.
A Une odeur et couleur faible ou nulle de
façon à ne pas modifier l'aspect et les qualités
organoleptiques du fromage.
A Un degré de pureté
élevée, indispensable pour éviter divers accidents dus
à la prolifération des micro-organismes indésirables ou
à des activités d'enzymes contaminants.
A Absence de toxicité pour le
consommateur.
A Activité antibiotique nulle de
façon à ne pas perturber le développement des ferments
lactiques au cours du processus d'élaboration du fromage.
A Activités protéolytique et
lipolytique faibles (Soumeya, 2017).
II.3.1. Succédanés de présure
d'origine animale
Les succédanés de présure d'origine
animale les plus utilisés sont d'origine bovine, porcine et du poulet.
La pepsine A provient de l'estomac d'animaux adultes, sa masse
moléculaire est de 33370 Da et contient 313 acides aminés (Fox,
2011). La pepsine bovine a une activité protéolytique proche de
celle de la chymosine, cette activité dépend du pH du milieu, et
est généralement active dans des milieux acide ou le pH est de
1.5 à 2 et l'activité soit plus élevée. Par contre
dans des milieux basique pH supérieure de 6.3, l'activité baisse
rapidement et le lait ne coagule pas (Eck et Gillis, 1997).
Nommée aussi pepsine B d'origine porcine, elle a une
particularité plus limitée que la pepsine bovine et
dégrade faiblement l'hémoglobine (Linden et Humbert, 1991). Elle
est composée d'une seule chaine polypeptidique de 321 résidus
d'acides aminés et sa masse moléculaire est de 35000 Da (Kageyama
et Takahashi, 1976).
Nommée aussi pepsine C, elle a une forte
activité vis-à-vis l'hémoglobine (Linden et Humbert,
1991). Elle est extrait de pro ventricule de poulet utilisé pour la
fabrication du fromage à pâte molle, les résultats obtenus
sont comparés avec un fromage fait par la présure confirme qu'il
n y a aucune différence dans le rendement et la qualité du
fromage.
23
II.3.2. Succédanés de présure
d'origine végétale
Des travaux très récents menés sur des
substrats de plantes ont été publiés montrant le nouvel
intérêt que suscite les protéases d'origine
végétale (Chazarra et al., 2007; Petropoulos et al., 2019). Il
existe plusieurs préparations coagulantes issues de règne
végétale et sont extraite par macération de
différentes parties de plantes supérieures (Eck et Gillis,
1997).
Parmi les espèces connues de climat
tempéré on peut citer : le gaillet, l'artichaut et le chardon
(Silva et Malkata, 2005). Actuellement la tendance tend vers les coagulants
végétaux grâce à la disponibilité de
matériel végétale et la forte stabilité de
coagulase (Nadhour et Belloul, 2003).
II.3.3. Succédanés de présure
d'origine microbienne
Plusieurs protéases d'origine microbienne ont
été utilisées dans la fabrication du fromage car ils ont
le même fonctionnement que celle de la chymosine. Elles sont produites
par fermentation. Elles présentent des inconvénients telle que
une grande activité protéolytique, un rendement faible dans la
fabrication fromagère (Harboe et al., 2010).
Parmi les espèces microbiennes utilisées pour la
fabrication à grande échelle sont : Rhizomucor miehei,
Rhizomucor pusillus, Cryphonectria parasitica (Claverie-Martìn et
Vega-Hernàndez, 2007). D'après Germonville (2003), la
protéase aspartique produite par Rhizomucor miehei est la plus
utilisée dans les industries fromagères. En Algérie une
protéase transgénique d'origine microbienne Aspergillus niger
var. awamori est actuellement utilisée par les fromagers dans la
coagulation du lait.
II.4. Coagulation du lait II.4.1.
Définition
La coagulation du lait est provoquée par la
dénaturation de la caséine, protéine majoritaire du lait.
Les différentes caséines sont organisées en micelles qui
sont des agrégats de plusieurs molécules de caséine. C'est
un complexe de protéines phosphorées précipitant à
pH 4,6 ou bien sous l'action d'enzymes spécifiques comme par exemple la
chymosine,
24
extrait de macération de la caillette de veau qui, avec
une autre enzyme, la pepsine, forment la présure.
La coagulation enzymatique est une étape essentielle
dans la plupart des fromages où la composante caséine du
système protéique du lait forme un réseau de gel qui
piège les graisses. La chymosine bovine est l'enzyme
préférée utilisée à cette fin; cependant,
des protéases d'origine animale, microbienne et végétale
ont également été utilisées avec succès
(Guevara et Raul, 2018).
II.4.2. Types de coagulation
La coagulation du lait est une étape importante dans la
préparation du fromage. Il s'agit de la transformation du lait liquide
en un gel, appelé aussi coagulum ou caillé. On distingue deux
types de coagulation : la coagulation acide et la coagulation enzymatique.
Cependant, en fromagerie, la coagulation du lait résulte le plus souvent
de l'action combinée d'une enzyme et de l'acidification, seule varie
l'importance relative de leur action coagulante respective (Soumeya, 2017).
II.4.2.1. Coagulation acide
Le mécanisme de la coagulation par voie fermentaire
dite coagulation acide est de nature électrochimique. Elle est induite
par les ferments lactiques. Les genres Lactobacillus, Lactococcus,
Leuconostoc, et Streptococcus sont les plus utilisés tout
en variant en fonction des fromages et des technologies. Le Camembert
présente par exemple une majorité de Lactococcus, et
seuls les laits fermentés par Streptococcus thermophilus et
Lactobacillus bulgaricus peuvent prétendre à
l'appellation yaourt (Ronez, 2012).
Elle consiste à précipiter les caséines
à leur point isoélectrique (pHi = 4,6) soit :
? par acidification biologique à l'aide de
bactéries productrices d'acide lactique (bactéries lactiques
contaminant à l'état naturel le lait ou apportées sous
forme de levains) (Jeantet et Garric, 2005).
? par acidification chimique (injection de CO2 addition de
gluconodeltalactone) (Jeantet et Garric, 2005).
Le gel formé présente une
perméabilité satisfaisante, mais une friabilité
élevée avec une élasticité et plasticité
pratiquement nulles dues au manque de structuration du réseau (Figure
9).
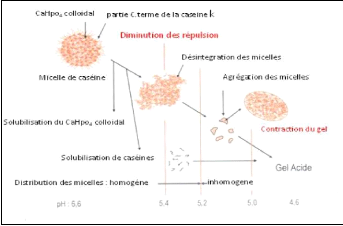
25
Figure 9. Modification de la structure micellaire au
cours de l'acidification
(Jeantet et Garric, 2005)
II.4.2.2. Coagulation enzymatique
Il s'agit de l'action de la présure (plus
précisément de la chymosine) qui va hydrolyser
préférentiellement la caséine á en un site
préférentiel de coupure (Figure 10). La coagulation de type
présure a généralement lieu pour des pH compris entre 6.2
et 6.7, pH pour lesquels la déminéralisation de la micelle est
nulle ou faible. Dans ces conditions, la structure de la micelle est
stabilisée (Lenoir et al., 1985).
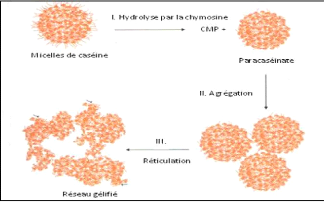
Figure 10. Modification de la structure micellaire au
cours de la coagulation présure
(Jeantet et Garric,
2005).
26
II.4.2.3. Coagulation mixte
Ce type de coagulation consiste en l'action de la
présure et l'acidification du lait. C'est la voie la plus
utilisée dans les industries fromagères en particuliers pour la
fabrication des fromages frais (petit suisse, demi sels....) et des fromages
à pâte molle (Camembert, Brie...) (Soumeya, 2017).
Dans les deux cas, après formation de coagulum,
celui-ci s'exsude et se détache du lactosérum : c'est la
synérèse de caillé ou égouttage. Ce
phénomène de synérèse est rapide pour le coagulum
par emprésurage et lent pour le coagulum acide (Lenoir et al., 1985).
II.4.3. Mécanismes d'action de coagulation
On distingue 3 phases de coagulation :
V' Phase primaire ou hydrolyse enzymatique.
V' Phase secondaire ou agrégation des micelles.
V' Phase tertiaire ou réticulation du gel (Jeantet et
Garric, 2005).
? La phase primaire est la phase enzymatique.
Le caséinomacropeptide, qui constitue un fragment hydrophile et
chargé de la caséine K, est hydrolysé par l'action
enzymatique de la présure (Figure 11) et est éliminé dans
le lactosérum. Le fragment de caséine restant est appelé
paracaséine K et possède des propriétés
hydrophobes. Dans les premières minutes suivant l'apport de l'enzyme
coagulante dans le lait, une diminution de la viscosité du lait
apparaît; elle s'explique par la diminution de la dimension moyenne des
micelles suite à leur hydrolyse (Fox, 2011; Soumeya, 2017).
? La phase secondaire est le début du
rapprochement des micelles (Figure 11). Cette phase démarre lorsque
environ 85 à 90% des caséines K sont hydrolysées à
un pH 6,6
( Soumeya, 2017). La paracaséine K va alors
s'agréger aux caséines hydrophobes áS1 et áS2. Les
caséines K formant le manteau hydrophile délimitant les micelles
voient alors leur hydrophobicité augmenter. Les micelles de
caséine perdent alors leur affinité pour la phase aqueuse et vont
se rapprocher et s'agréger entre elles sous l'effet des interactions
hydrophobes, faisant ainsi cailler le lait (Ronez, 2012).
Le segment 1-105 ou para caséine k est hydrophobe,
basique et reste intégré à la micelle, le segment 106-169
ou caséinomacropeptide est très hydrophile, acide et passe dans
le lactosérum. Des liaisons hydrophobes et électrostatiques
s'établissent alors entre les micelles modifiées et vont
entrainer la formation du gel (Zikiou, 2013).
27
? La phase tertiaire est ce que l'on appelle
la phase de réticulation du gel. Celui-ci devient de plus en plus
organisé et structuré. Au niveau microscopique, on observe un
accroissement des liaisons entre les micelles modifiées (Figure 11),
principalement des interactions hydrophobes et électrostatiques, ainsi
que la formation des ponts phosphocalciques. Elle correspond au niveau
macroscopique au durcissement du gel. (Ronez, 2012).
Les micelles agrégées subissent de profondes
réorganisations par la mise en place de liaisons phosphocalciques et
peut être de ponts disulfures entre les para caséines (Zikiou,
2013). Des liaisons électrostatiques et des liaisons hydrophobes
participent à la formation du gel. Le calcium ionique et le phosphate de
calcium colloïdal jouent aussi un rôle déterminant dans le
phénomène (Soumeya, 2017).
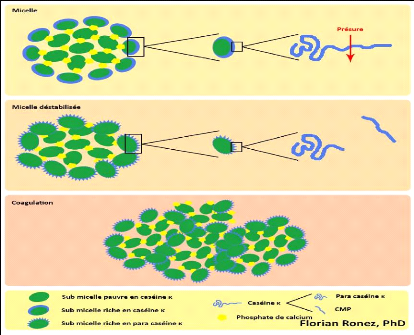
Figure 11. Formation d'un caillé par action de
la présure sur les caséines du lait
(d'après
de modèle de Schmidt & Walstra, 2012)
28
CHAPITRE III. Les métabolites secondaires
Les métabolites secondaires végétaux sont
des molécules essentielles à la vie des plantes et leur
interaction avec l'environnement. Ils sont également des sources
importantes pour les produits pharmaceutiques, les additifs alimentaires et les
arômes.
La concentration de ces molécules dans les
différentes parties des plantes est influencée par plusieurs
facteurs environnementaux tels que la température, l'humidité,
l'intensité lumineuse, l'eau, les sels minéraux et le CO2
(Ramakrishna et Ravishankar, 2011). A titre d'exemple, Gengmao et al., (2015)
ont observé que l'effet du stress salin est hautement significatif sur
la concentration des flavonoïdes (métabolites secondaires) au
niveau des feuilles du carthame (Figure 12) (Roumeissa et Maya, 2015; Rachedi
et al., 2018).
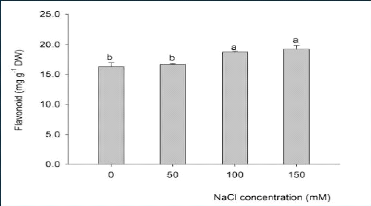
Figure 12. Effet du stress salin sur la concentration
des flavonoïdes au niveau des
feuilles du carthame (Roumeissa
et Maya, 2015)
III.1. Composés phénoliques
Les composés phénoliques sont des substances
présentes dans tous les végétaux et dans tous les organes
de la plante. Ils possèdent un noyau aromatique portant un ou plusieurs
groupements hydroxyles (Roumeissa et Maya, 2015).
Les composés phénoliques jouent un rôle
essentiel dans la structure et la protection des plantes (Stalikas, 2007). Ils
offrent également, pour la santé humaine, une protection contre
certaines maladies impliquant un stress oxydatif, comme les cancers et les
maladies cardiovasculaires et neurodégénératives (Sun et
al., 2011).
29
Les polyphénols sont caractérisés par la
présence d'au moins un noyau benzénique auquel est directement
lié au moins un groupe hydroxyle, libre ou engagé dans une autre
fonction : éther, ester, hétéroside (Boubekri, 2014a).
III.2. Flavonoïdes
Les flavonoïdes constituent un groupe de plus de 6000
composés naturels qui sont quasiment universels chez les plantes
vasculaires. Ils constituent des pigments responsables des colorations jaune,
orange, et rouge de différents organes végétaux. Tous les
flavonoïdes possèdent la même structure de base (C6-C3-C6),
ils contiennent quinze atomes de carbone dans leur structure de base: deux
cycles aromatiques A et B à six atomes de carbones (Figure 13)
liés avec une unité de trois atomes de carbone qui peut ou non
être une partie d'un troisième cycle C (Boubekri, 2014a).
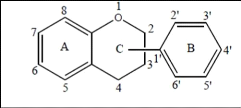
Figure 13. Structure de base des
flavonoïdes
Les flavonoïdes jouent un rôle très
important dans la croissance des plantes, la floraison, la fructification et la
défense contre les maladies et les microorganismes. Ils ont
également un rôle très important pour la santé
humaine. A titre d'exemple, ils sont efficaces pour l'inflammation chronique,
les maladies allergiques, les maladies coronariennes et le cancer. (Roumeissa
et Maya, 2015).
III.3. Les tanins
Les tanins sont des substances poly phénoliques de
structures variées, ayant en commun la propriété de tanner
la peau, c'est-à-dire de rendre imputrescible. Ces substances ont en
effet la propriété de se combiner aux protéines, ce qui
explique leur pouvoir tannant.
On distingue: les tanins hydrolysables et les tanins
condensés. Les tanins sont largement répandus dans les organismes
végétaux et plus particulièrement dans les fruits, les
graines
30
de céréales et diverses boissons. Dans
l'alimentation humaine, les sources les plus importantes de tannins sont le vin
et le thé (Boubekri, 2014b).
III.3.1. Tanins condensés
Ce sont des oligomères ou des polymères de
flavane-3-ol dérivés de la catéchine ou de son
isomère. Ils ont la propriété de coaguler les
protéines du derme, d'où leur utilisation dans le tannage des
peaux (Nadir, 2016).
Les tanins condensés (Figure 14) sont des
polyphénols de masse molaire élevée. Ils résultent
de la polymérisation auto-oxydative ou enzymatique des unités de
flavan-3,4-diol liées majoritairement par les liaisons C4-C8 (parfois
C4-C6) des unités adjacentes, et se nomment ainsi pro anthocyanidines de
type B. Lorsque la condensation se produit entre les unités adjacentes
par la liaison C4-C8 et par une liaison d'éther additionnelle entre et
C7, les pro anthocyanidines sont dits de types A (Boubekri, 2014a).
Figure 14. Exemples de tanins
condensés
III.3.2. Tanins hydrolysables
Les tanins hydrolysables (Figure 15) ou acides tanniques sont
des polymères de l'acide gallique ou de son produit de condensation ;
l'acide éllagique. Ils ont un poids moléculaire plus faible et
précipitent beaucoup moins les protéines que les tanins
condensés.
Ils peuvent diminuer la dégradation des parois dans le
rumen et être hydrolysés dans l'intestin en libérant des
produits toxiques pour le foie et le rein. Ils sont divisés en
31
éllagitannins et gallo tannins. Les gallo tannins
libèrent de l'acide gallique par hydrolyse acide, hydrolyse basique,
à l'eau chaude ou par action enzymatique (Boubekri, 2014a).
Figure 15. Exemples de tanins hydrolysables
32
IIème Partie :
ETUDE PRATIQUE
I. Introduction
Les propriétés biologiques que possèdent
un certain nombre de plantes présentent un intérêt
énorme pour l'Homme dans le domaine agroalimentaire, pharmaceutique,
médicale et même dans la recherche scientifique. Cependant des
composés phénoliques ou des coagulants sont beaucoup
utilisés dans le domaine alimentaire et médical.
Le but de notre travail pratique est de contribuer à la
valorisation de deux plantes du genre Cynara (Cynara scolymus
= artichaut cultivé) et (Cynara cardunculus = artichaut
sauvage) sur l'évaluation de l'activité coagulante des extraits
de fleurs dans le lait de vache en comparaison de celle de la présure.
Aussi, le dosage des composés phénoliques dans les fleurs et
bractées, et l'évaluation de leurs activités
antioxydantes.
Pour rendre compte des résultats de notre travail, nous
avons procédé comme suit :
1. Récolte et lyophilisation des fleurs
2. Extraction enzymatique des fleurs
3. Extraction et dosage des composés
phénoliques dans les bractées et évaluation de
l'activité anti radicalaire
4. Dosage de l'activité protéolytique et
détermination de l'activité coagulante d'extrait des fleurs
II. Matériel et méthodes
Le présent travail a été
réalisé au niveau du laboratoire de Technologie Alimentaire de
l'Institut National de Recherche Agronomique de Rabat (INRA).
La partie expérimentale se partage sur 2 volets à
savoir :
? Volet échantillonnage : inclue
l'échantillonnage du matériel végétal du
l'artichaut sauvage (Cynara cardunculus) et l'artichaut cultivé
(Cynara scolymus), celui du lait frais de bovin et de la
présure.
? Volet biochimique : inclue l'extraction des composés
phénoliques à partir des bractées de l'artichaut
cultivé et celui sauvage, dosage des polyphénols totaux, des
33
flavonoïdes, des tanins condensés et aussi de
l'activité antioxydante par deux méthodes (DPPH, ABTS).
Ce volet inclue aussi l'extraction de l'extrait coagulant du
lait à partir des fleurs de l'artichaut sauvage et de l'artichaut
cultivé, et l'évaluation de l'activité coagulante et
protéolytique de ces extraits dans le lait.
II.1. Matériel utilisé et
échantillonnage
L'échantillonnage de la partie florale de ces deux
plantes a été effectué sur les deux stades
c'est-à-dire le premier stade où il n'y a pas l'ouverture de la
fleur tandis que le second stade correspond à la présence d'une
ouverture concrète de la fleur.
Pour le premier stade, les fleurs de l'artichaut
cultivé (Figure 16) ont été récoltées dans
la région de Sidi Slimane (ville du Nord-Ouest du Maroc, située
environ à 60 km de la ville portuaire de Kénitra) au début
du mois d'avril 2019, et au mois de juin avec l'apparition nette des fleurs
(Figure 17) on a procédé à l'échantillonnage pour
le second stade. Les fleurs de l'artichaut sauvage (Figure 18) ont
été récoltées dans les montagnes d'Oulmès au
début du mois d'avril pour le premier stade et le mois de juin pour le
second stade (Figure 19).
Le matériel végétal utilisé est
constitué de la partie florale (bractées et fleurs) de
l'artichaut Cynara scolymus et Cynara cardunculus. Les fleurs
et les bractées sont séchées par lyophilisation afin de
conserver les molécules sensibles à la chaleur telle que les
enzymes, les protéines. Cette technique de déshydratation
conserve la qualité nutritionnelle et organoleptique des aliments et les
propriétés biologiques des molécules. Après
séchage, le broyage est effectué à l'aide d'un Moulinex
à café (Figure 20) ou un broyeur électrique (Figure
21).

Figure 16. Fleur de l'artichaut cultivé Figure 17.
Fleur de l'artichaut
sans ouverture (premier stade) cultivé avec
ouverture (second
stade)

|
Figure 18. Fleur de l'artichaut sauvage sans ouverture
(premier stade)
|
Figure 19. Fleur de l'artichaut sauvage
avec
ouverture (second stade)
|

34
Figure 20. Moulinex à café Figure 21.
Broyeur à sec
Le lait utilisé pour la détermination de
l'activité coagulante est le lait de vache (Figure 22) et a
été récolté dans la région de Zaër. La
présure (Figure 23) est celle utilisée par la
société Ajbane Chefchaouen spécialisée dans la
fabrication du fromage. Elle est un
35
coagulant microbien issu du mucor pepsine, produit par
fermentation en utilisant une souche sélectionnée du champignon
Rhizomucor miehei.
|
|
|
Figure 22. Lait utilisé
après
ajustement du pH
|
Figure 23. Présure utilisée
|
II.2. Extraction des composés phénoliques
II.2.1. Préparation des extraits
La méthode d'extraction suivie dans notre étude
est l'extraction par macération effectué selon le protocole
proposé par Romani et al., (2006) avec quelques modifications. Le
principe de cette méthode se base sur la macération de
matériel végétal dans un solvant d'extraction
acétone 70% suivi d'une agitation ainsi que la centrifugation pendant 20
minutes. La partie de la plante utilisée est le capitule du chardon et
d'artichaut : bractées.
Le protocole se résume comme suit (Romani et al., 2006) :
2g de poudre de fleur/bractée d'artichaut
Macération au bain marie 40°C avec agitation dans 20
ml d'acétone 70% pendant 3h
Centrifugation pendant 20 minutes (4000t/minute)
Filtration (papier wattman N° 1) Conservation de l'extrait
à -22°C
36
II.2.2. Dosage des composés phénoliques
II.2.2.1. Dosage des polyphénols totaux
Le dosage des polyphénols totaux a été
fait en utilisant le réactif de Folin-Ciocalteu. Cette méthode a
été décrite Singleton et Rossi (1965). Depuis, son
utilisation s'est largement répandue pour caractériser les
extraits végétaux d'origines plus diverses.
Le réactif de Folin-Ciocalteu est un acide de couleur
jaune constitué par un mélange d'acide phosphotungstique
(H3PW12O40) et d'acide phosphomolybdique (H3PMo12O40). Il
est réduit lors de l'oxydation des phénols, en un mélange
d'oxydes bleus de tungstène et de molybdène
(Ribéreau-Gayon et Peynaud, 1968). La coloration produite, dont
l'absorption maximum à 765nm est proportionnelle à la
quantité de polyphénols présents dans les extraits
végétaux (Boizot et Charpentier, 2006).
Les polyphénols (PP) ont été
déterminés par spectrophotométrie, suivant le protocole
appliqué par Li et al. (2007). 100 ìl d'extrait
végétal dilué 20 fois est mélangé avec 500
ìl de réactif de Folin Ciocalteu (FCR) dilué 10 fois dans
de l'eau distillée. Après 4 minutes d'incubation, 400 ìl
de carbonate de sodium (Na2CO3) à concentration de 7,5% sont
ajoutés. Après une incubation du mélange
réactionnel pendant 1 heure 30 minute à température
ambiante en l'obscurité, l'absorbance est mesurée à 765
nm.
La courbe d'étalonnage (Annexe 2) est effectuée
par l'acide gallique à différentes concentrations (0 - 50
ìg/ml), dans les mêmes conditions et les mêmes étapes
du dosage. Les résultats sont ainsi exprimés en mg/ml en se
référant à la courbe d'étalonnage d'acide
gallique.
II.2.2.2. Dosage des flavonoïdes ?
Principe
Les flavonoïdes possèdent un groupement hydroxyle
(OH) libre, en position 5 qui est susceptible de donner avec le groupement CO,
un complexe coloré avec le chlorure d'aluminium.
Les flavonoïdes forment des complexes jaunâtres par
chélation des métaux (fer et aluminium). Ceci traduit le fait que
le métal (Al) perd deux électrons pour s'unir à deux
atomes d'oxygène de la molécule phénolique agissant comme
donneur d'électrons.
37
? Protocole expérimentale
La détermination des flavonoïdes totaux a
été effectuée selon la méthode décrite par
Dehpour et al., (2009) ayant subi quelques modifications : 500 ìl de
chaque extrait à analyser sont ajoutés à 1500 ìl de
acétone 70 %, 100 ìl de AlCl3 à 10 % (m/v), 100 ìl
d'acétate de sodium 1 M et 2,5 ml d'eau distillée.
Le mélange est agité puis incubé à
l'obscurité et à température ambiante pendant 30 min. Le
blanc est réalisé par remplacement de l'extrait par
d'acétone 70% et l'absorbance est mesurée à 415 nm en
utilisant un spectrophotomètre UV (Perkin Elmer). Les résultats
sont exprimés en concentration mg/ml en se référant
à la courbe d'étalonnage de la quercétine. (Annexe 3)
II.2.2.3. Dosage des tanins condensés
Les tanins condensés sont déterminés par
la méthode de la vanilline en milieu acide décrite par
(Taouzinet, 2017). Le réactif de vanilline a été
préparé en mélangeant 4 g de vanilline dans 100 ml de
l'éthanol.
Le mélange a été maintenu à 30
°C avant le dosage. 100 ìl de chaque extrait à analyser ont
été ajoutés à 1500 ìl du réactif de
vanilline 4 % et après on ajoute 750 ìl de HCl concentré
à 37%. Le mélange a été agité puis
incubé à l'obscurité à 30°C pendant 20 min.
L'absorbance est mesurée à 550 nm par un spectrophotomètre
UV (Perkin Elmer) contre un blanc constitué d'un mélange
d'acétone 70% et de HCl (37%) à volume égal. Les
résultats sont exprimés en concentration mg/ml en se
référant à la courbe d'étalonnage du
catéchol (Annexe 4).
II.2.3. Evaluation de l'activité antioxydante des
extraits
L'activité antioxydante a été
évaluée en testant l'activité scavenging du radical DPPH,
et ABTS+.
II.2.3.1. Activité anti radicalaire au radical
DPPH
? Principe
Le test au 2,2-diphényl-2-picryl-hydrazyle (DPPH.),
permet de mesurer le pouvoir réducteur des substances antioxydantes
contenues dans un extrait.
38
Le DPPH est un radical libre de couleur violette qui devient
jaune quand il est réduit par un donneur de proton H+.
DPPH+AH DPPH-H + A.
Où AH est un composé capable de céder un
H+ au radical DPPH (Ibra et al., 2017). ?
Protocole
Le protocole expérimental utilisé est celui de
Ibra et al., (2017) avec quelques modifications. La solution de DPPH est
préparée par solubilisation de 4mg de DPPH dans 100 ml
d'éthanol. 200 ìl de l'extrait mélangé avec 1800
ìl de la solution de DPPH. Le mélange est agité puis
incubé à l'obscurité et à température
ambiante pendant 30 min. Le blanc est réalisé par remplacement de
l'extrait par d'acétone 70% et l'absorbance est mesurée à
517 nm en utilisant un spectrophotomètre UV (Perkin Elmer).
Le pouvoir anti-radicalaire de l'extrait est exprimé en
pourcentage d'inhibition du radical
DPPH :
Où : Contrôle : absorbance du témoin
Extrait : absorbance de l'extrait
II.2.3.2. Activité anti radicalaire au radical
l'ABTS.
? Principe
Ce test est basé sur le mécanisme
d'oxydoréduction de l'ABTS (sel d'ammonium de l'acide 2,2-azino
bis-(3-éthylbenzothiazoline-6-sulfonique)).Au cours de ce test, le sel
d'ABTS perd un électron pour former un radical cation (ABTS. +) de
couleur sombre (vert bleu) en solution. En présence de l'agent
antioxydant, le radical ainsi formé est réduit pour donner le
cation ABTS+, ce qui entraine la décoloration de la solution
(Owen et Johns, 1999).
L'addition d'un antioxydant à une solution de ce
radical cationique entraine la réduction de ce radical et une diminution
de l'absorbance. Cette diminution dépend de l'activité
antioxydant des composés testes, du temps et de la concentration (Re et
al., 1999)
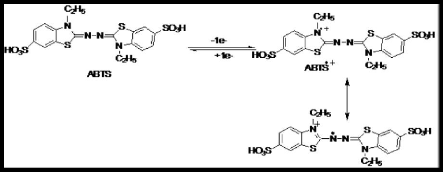
39
Figure 24. Oxydation partielle de
l'ABTS (Owen et Johns, 1999).
? Protocole
Le pourcentage d'inhibition du radical ABTS.+ est
évalué par la méthode de (Nadir, 2016).
La solution d'ABTS. + est préparée par
mélange de 7 mM d'ABTS et de 2,45 mM de persulfate de potassium
incubé pendant 12-16h à l'abri de la lumière et à
température ambiante avant l'utilisation. La solution d'ABTS est
diluée avec l'éthanol jusqu'à l'obtention d'une absorbance
de 0,7(#177; 0,02) à 734 nm. 1,9 ml de la solution d'ABTS sont
additionnés à 100 ìl de l'extrait.
Après l'incubation pendant 7 min à
l'obscurité et à température ambiante, on mesure la
réaction de réduction de la solution d'ABTS à 734 nm. La
capacité antioxydante des extraits testée, est exprimée
par rapport aux concentrations de standard Trolox (TEAC) ; ce qui donne des
indications utiles sur le potentiel antioxydant de l'extrait de plantes.
Le pouvoir anti-radicalaire de l'extrait est exprimé en
pourcentage d'inhibition du radical ABTS+ :

Où : Contrôle : absorbance du témoin
Extrait : absorbance de l'extrait
II.2.4. Extraction du système enzymatique des
fleurs II.2.4.1. Obtention de l'extrait enzymatique des fleurs
Le système enzymatique utilisé a
été obtenu à partir des fleurs lyophilisées (Figure
26). Elles ont subi une congélation pendant trois jours suivis d'une
lyophilisation d'une semaine puis un broyage grâce à un broyeur
électrique.

40
Figure 25. Fleur avant lyophilisation Figure 26. Fleur
lyophilisée
Le protocole utilisé dans ce travail est celui
décrit par Tsouli (1974)et optimisé par (Nouani et al., 2009)
subit quelques modifications : broyage et macération (Figure 27) pendant
24h à température ambiante et à l'obscurité de 10 g
de fleurs sèches dans 100 ml du tampon d'acétate de sodium (0,1 M
à pH 5) additionné de 0,2% d'acide borique afin d'éviter
ultérieurement toute prolifération de microorganismes. Dans le
but d'extraire le maximum de matière enzymatique le tout est
congelé à -22°C pendant 48h puis décongelé
à température ambiante sous une agitation douce pendant 1h, le
liquide est ensuite centrifugé à 4200 g pendant 10 minutes, le
surnageant est ensuite filtré et l'extrait brut des fleurs de
l'artichaut est obtenu (Figure 28).

41
Figure 27. Macération des fleurs
broyées

Figure 28: Extraits enzymatiques de deux plantes:
sauvage et cultivée
II.2.4.2. Dosage de l'activité
protéolytique des extraits enzymatiques.
L'activité protéolytique est mise en
évidence par un dosage colorimétrique des groupements tyrosine
à l'aide du réactif de Folin-Ciocalteu ; conformément
à la technique décrite par Aicha (2003) cité dans Zikiou
et Zidoune (2019) avec quelques modifications. La comparaison de
l'activité protéolytique a été faite entre
l'extrait enzymatique des fleurs séchées et la présure
d'origine microbienne avec un gradient de concentration de: 25%, 50%, 75% et
100%.
42
Mode opératoire
Le dosage de l'activité protéolytique est
réalisé en deux étapes :
? La première étape étant la
réaction enzymatique, dont le mélange est constitué de : 1
ml de l'extrait! présure, 1.5 ml de tampon citrate ! sodium 0.05 M, pH
5.5 et 2.5
ml de la solution caséine à 2.5% dissoute dans du
citrate de sodium 0.02 M.
L'incubation se fait au bain marie à 40°C,
après 1 h on ajoute 5 ml de T.C.A à 4% pour arrêter la
réaction et permet la précipitation de la caséine non
hydrolysée. Les blancs réactionnels sont préparés
de la même manière que l'échantillon sauf qu'ici le TCA est
rajouté bien avant le substrat afin d'empêcher la réaction
enzymatique. La centrifugation a été faite de 3000 rpm pendant 5
minutes enfin de récupérer le surnageant.
? La deuxième étape étant le dosage
colorimétrique, après centrifugation les composés
azotés non protéiques qui se trouvent dans la phase soluble, sont
dosés selon la méthode d'Anson (1958) : 0.5 ml de surnageant avec
2.5 ml de Na2CO3 à 2% dans NaOH 0.1 N.
Après agitation et repos 10 min, on ajoute 0.25 ml de
réactif de Folin-Ciocalteu dilue au 1/2. Bien agiter et incuber 30
minutes à température ambiante. L'absorbance est lue contre le
blanc réactionnel à 750 nm au spectrophotomètre.
L'activité est calculée par
référence à une courbe d'étalonnage établie
en utilisant la tyrosine comme standard. La gamme étalon est
réalisée à partir d'une solution de tyrosine dont les
concentrations sont comprises entre 0 et 80 jig /ml. L'unité de
l'activité protéolytique correspond à 1 jig de la tyrosine
libéré par 1ml d'extrait enzymatique en une heure d'incubation.
La concentration de la tyrosine contenue dans le filtrat est déduite par
référence à une courbe d'étalonnage de la tyrosine
(Annexe 1).
L'activité protéolytique de l'extrait des fleurs
est comparée à celle de la présure, prise comme
témoin.
II.2.4.3. Détermination de l'activité
coagulante
L'activité coagulante est déterminée
selon la méthode de Berridge (1952) et tel que modifié par
Collins et al. (1977), Nouani et al. (2009) et Soumeya (2017). Cette
méthode permet d'exprimer l'activité de l'extrait enzymatique en
force coagulante. Il représente le volume
43
du lait coagulé par unité de volume de l'extrait
enzymatique en 40 min, à 35 ° C et à pH 6,4 en fonction de
la formule. Une unité Soxhlet (US) est définie comme la
quantité d'enzyme qui coagule 1 ml d'une solution de substrat de
Berridge à 30°C pendant 40minutes.
La formule de l'activité coagulante est donc :
AC= 10*V/T*V'
Où :
AC : Activité coagulante.
V : volume du lait à coaguler (10 ml).
T : temps de floculation
V' : volume de l'extrait enzymatique (1ml)
II.3. Analyse des données statistiques
L'analyse des données a été
effectuée par le logiciel Graphpad Prism 7.0 et les analyses
statistiques ANOVA ont été réalisées à
l'aide du logiciel SPSS version 23 . L'analyse de la variance a
été appliquée pour déterminer la différence
significative à p<0,05 entre plantes et stades.
44
III. Résultats et discussion
III.1.Teneur en eau du matériel
végétal
La teneur en eau est le rapport entre le poids sec et le poids
total du matériel végétal
Teneur en eau = poids sec / poids total x 100.
Après lyophilisation de l'échantillon
végétal, la perte d'eau de la fleur de deux plantes a
été considérable. De ce fait pour le premier stade nous
remarquons que la teneur en eau est supérieure à celle du second
stade quand la partie florale est mature. La teneur en eau de la partie florale
utilisée pour toutes ces deux plantes est de 80% pour le premier stade
tandis qu'elle est de 63% pour le second stade.
III.2.Dosage des composés phénoliques
III.2.1. Polyphénols totaux
D'après les analyses statistiques effectuées par
SPSS montrent une différence très significative (p<0,007)
entre le second stade plante cultivée et le premier stade plante
sauvage. Une différence significative (p<0,05) se manifeste entre le
second stade plante sauvage et second stade plante cultivée. La
comparaison des autres stades surtout entre le premier stade plante
cultivée ne montre pas des différences entre eux. Les
résultats des concentrations en polyphénols totaux sont
présentés dans la figure 29.
Figure 29. Concentration des polyphénols totaux
sur les deux stades.
45
D'après cette figure 29 on constate que les
concentrations des polyphénols totaux de la plante sauvage sont
supérieures à ceux de la plante cultivée sur les deux
stades. Les moyennes avec leur valeur standard sont exprimées dans le
tableau 8.
Tableau 8. Moyennes des concentrations des
polyphénols totaux
|
1er stade
|
|
Moyenne (mg/ml)
|
|
PPTs
|
1.08#177;0.15
|
|
|
PPTc
|
0.62#177; 0.08
|
|
2ème stade
|
PPTs
|
0.82#177;0.10
|
|
PPTc
|
0.37#177;0.10
|
|
PPTs : Polyphénols totaux pour extrait de la plante
sauvage ; PPTc : Polyphénols totaux pour extrait de la plante
cultivée
III.2.2. Flavonoïdes
D'après les analyses statistiques avec SPSS, montrent
des différences significatives (p<0,017) entre le premier stade
plante cultivée et le premier stade plante sauvage (p<0,000) et entre
le second stade plante cultivée. Les autres différences hautement
significatives se trouvent entre la plante sauvage au premier stade et plante
cultivée et sauvage au second stade (p<0,000), et aussi les
différences hautement significatives se remarquent entre la plante
cultivée et plante sauvage au second stade (p<0,000). Les
résultats des concentrations en flavonoïdes sont
présentés dans la figure 30.
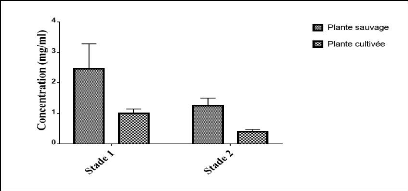
Figure 30. Concentration des flavonoïdes sur les
deux stades.
46
Les extraits de la plante sauvage manifestent des
concentrations en flavonoïdes supérieurs à celles de la
plante cultivée. Les moyennes des concentrations sont mentionnées
dans le tableau 9.
Tableau 9. Moyennes des concentrations des
flavonoïdes
|
1er stade
|
|
Moyenne (mg/ml)
|
|
FLVs
|
2.46#177;0.17
|
|
|
FLVc
|
0.93#177;0.10
|
|
2ème stade
|
FLVs
|
1.34#177;0.10
|
|
FLVc
|
0.40#177;0.12
|
|
FLVs: Flavonoïdes pour l'extrait de la plante sauvage ;
FLVc: Flavonoïdes pour l'extrait de la plante cultivée.
III.2.3. Tanins condensés
D'après les analyses statistiques avec SPSS, montrent
des différences hautement significatives entre le premier stade plante
cultivée et le second stade plante cultivée (p<0,000) et entre
le second stade plante sauvage (p< 0,000). Les autres différences
significatives se trouvent entre la plante sauvage au premier stade et plante
cultivée au second stade (p<0,004), et aussi entre plante sauvage au
premier stade et la plante sauvage au second stade (p<0.01). Les
résultats des concentrations en tanins condensés sont
présentés dans la figure 31 et dans le tableau 10.
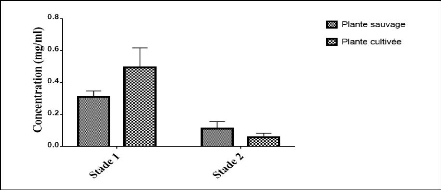
Figure 31. Concentration des tanins condensés
sur les deux stades
47
Les concentrations en tanins condensés sont
élevées en premier stade chez la plante cultivée par
rapport à celles de la plante sauvage tandis qu'au second stade les
concentrations sont un peu élevées cette fois ci pour la plante
sauvage. Les moyennes des concentrations sont mentionnées dans le
tableau 10.
Tableau 10. Moyennes des concentrations des tanins
condensés.
|
1er stade
|
|
Moyenne (mg/ml)
|
|
TNCs
|
0.31#177;0.04
|
|
|
TNCc
|
0.43#177;0.03
|
|
2ème stade
|
TNCs
|
0.10#177;0.014
|
|
TNCc
|
0.08#177;0.02
|
|
TNCs: Tanins condensés pour l'extrait de la plante
sauvage ; TNCc: Tanins condensés pour l'extrait de la plante
cultivée.
III.3. Evaluation de l'activité
antioxydante
III.3.1. Activité anti radicalaire par
DPPH
La différence significative se remarque entre le
premier stade de la plante sauvage et le second stade de la plante sauvage
(p<0.013). Les autres stades ne manifestent pas une différence
significative. Les résultats du pouvoir anti radicalaire par DPPH des
différents extraits pour les deux stades sont rassemblés dans la
figure 32 et le tableau 11.
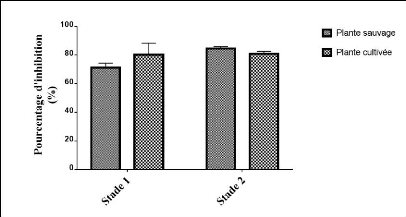
Figure 32. Pourcentage d'inhibition d'un radical DPPH
sur les deux stades.
48
Tous les extraits des plantes montrent des effets scavenger du
radical DPPH sur tous les deux stades. Les moyennes des pourcentages
d'inhibition de DPPH sont rassemblées dans le tableau 11.
Tableau 11. Moyennes de pourcentage d'inhibition de
DPPH.
|
1er stade
|
|
Moyenne (%)
|
|
Extrait sauvage
|
71.2#177;3.1
|
|
|
Extrait cultivé
|
77.2#177;1.8
|
|
2ème stade
|
Extrait sauvage
|
83.8#177;1.9
|
|
Extrait cultivé
|
80.2#177;2.2
|
|
III.3.2. Activité anti radicalaire par
l'ABTS
Afin de valider les résultats de l'efficacité
antioxydante des extraits de Cynara obtenus précédemment
par le test anti-radicalaire du DPPH, nous avons utilisés un
2ième test basé sur la capacité de
piégeage du proton du radical cationique ABTS+. Les
pourcentages d'inhibition pour les extraits de ces plantes sont
représentés par la figure 33 et dans le tableau 12.
D'après les analyses statistiques montrent des
différences hautement significatives (p<0.000) entre le premier stade
de la plante cultivée et le second stade plante cultivée, et
entre le premier stade de la plante cultivée et le second stade plante
sauvage. D'autres différences hautement significatives (p<0.000) se
remarquent entre le premier stade plante sauvage et second stade plante
cultivée, et entre le premier stade plante sauvage et le second stade
plante sauvage. Entre le premier stade de la plante cultivée et le
premier stade plante sauvage, il n'y a pas de différence
significative.
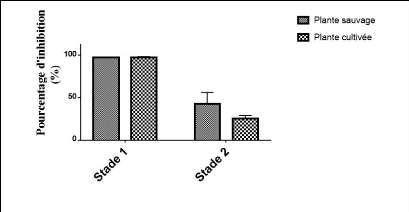
49
Figure 33. Pourcentage d'inhibition d'un radical ABTS
sur les deux stades.
Tous les extraits des plantes montrent des effets scavenger du
radical ABTS sur tous les deux stades malgré une diminution remarquable
de pourcentage au second stade. Les moyennes des pourcentages d'inhibition
d'ABTS sont présentées dans le tableau 12.
Tableau 12. Moyennes de pourcentage d'inhibition
d'ABTS.
|
1er stade
|
|
Moyenne (%)
|
|
Extrait sauvage
|
97.2#177;2.4
|
|
|
Extrait cultivée
|
96.1#177;1.4
|
|
2ème stade
|
Extrait sauvage
|
42.7#177;2.9
|
|
Extrait cultivée
|
25.0#177;2.9
|
|
III.3.3. Discussion sur les composés
phénoliques et l'activité antioxydante
D'après la figure 29 et le tableau 8 montrent que les
concentrations des polyphénols totaux de la plante sauvage sont
supérieures à ceux de la plante cultivée sur les deux
stades. Le premier stade manifeste des concentrations plus
élevées pour les deux plantes que dans le second stade. Ça
peut s'expliquer par le fait que les plantes immatures ont besoin beaucoup de
métabolites secondaires tels que les polyphénols totaux,
flavonoïdes et autres pour se
50
protéger contre conditions climatiques
défavorables, lutter contre les maladies, ravageurs. Au fur et à
mesure que la plante devient mature les concentrations phénoliques
diminuent.
Ces résultats sont similaires à ceux
trouvés par (Velez et al. 2012) disant que entre les plantes ayant le
même temps de récolte, la quantité de phénols est
plus élevée chez le cardon sauvage (var. sylvestris) que
chez le cardon cultivé. En plus Velez et ses collaborateurs (2012)
confirment que la concentration en phénol dans les inflorescences
dépend à la fois du moment de la récolte et de la variante
du cardon. Les extraits obtenus à partir d'inflorescences immatures
présentent des concentrations en phénol supérieures
à celles obtenues d'inflorescences matures.
Les extraits de la plante sauvage manifestent des
concentrations en flavonoïdes supérieurs à celles de la
plante cultivée. En plus c'est avec le premier stade que manifestent
beaucoup de concentrations (Figure 31 et Tableau 9) en flavonoïdes. Comme
les polyphénols totaux, les flavonoïdes participent dans la
protection des végétaux envers les conditions défavorables
et surtout pour les plantes jeunes. On peut ajouter que les plantes qui
poussent spontanément dans la nature ont besoin nécessairement
plus de composés phénoliques pour s'y adapter.
Dixon et Pasinetti, (2010) confirment que la localisation
vacuolaire de nombreux flavonoïdes permet leurs fonctions de filtrage de
la lumière, de photo protection et de pigmentation, mais probablement
pas leurs fonctions antioxydantes. En plus, Vicente et Boscaiu, (2018)
confirment qu'ils remplissent beaucoup des fonctions biologiques,
principalement médiatrices des interactions entre les plantes et
l'environnement et participent à la défense des plantes contre
les agents pathogènes. Ils participent également aux
mécanismes de tolérance pratiquement à tous les types de
stress abiotique, y compris les rayonnements UV, températures
extrêmes, exposition à l'ozone, sécheresse ou
salinité. Ça pourrait expliquer l'abondance des flavonoïdes
dans les bractées de ces deux plantes pour le premier stade où
les plantes sont immatures et aussi dans l'extrait sauvage car les plantes
sauvages pour survivre ont tellement besoin de ces molécules bioactives
en abondance pour s'y adapter.
Les résultats (Tableau 10) ont montré des
faibles concentrations en tanins condensés par rapport aux autres
composés phénoliques tels que les polyphénols totaux et
flavonoïdes. En plus les concentrations en tanins condensés dans
les extraits de la plante cultivée sont supérieures à
celles de l'extrait de plante cultivée. Cela peut être
expliqué par la méthode
51
d'extraction utilisée et aussi selon la nature de
solvants car les tanins condensés sont extraits favorablement par la
méthode de décoction aqueuse. Mahmoudi et al. (2013) le
confirment en disant que la macération semble être meilleure pour
l'extraction des polyphénols totaux et les flavonoïdes avec des
solvants d'extraction tels que l'éthanol et l'acétone. En
revanche, la décoction aqueuse est plus performante pour l'extraction
des tanins condensés alors que pendant notre travail, c'est
l'acétone utilisé comme solvant d'extraction.
De cela, il est important d'optimiser les méthodes
d'extraction enfin d'extraire le maximum de tanins condensés. Nos
résultats montrent des concentrations élevées quand le
matériel végétal renferme plus d'eau c'est-à-dire
pour le premier stade. Malgré le solvant qui n'est pas favorable
à l'extraction des tanins condensés, peut être que la
présence de plus d'eau serait la cause de cette concentration
supérieure au second stade chez la plante cultivée voir
même chez la plante sauvage.
D'après les résultats de notre travail, tous les
extraits de deux plantes que ça soit au premier stade ou second stade
ont montré des effets scavenging contre les radicaux DPPH et l'ABTS.
En effet, les pourcentages d'inhibition ne sont pas les
mêmes pour les deux plantes selon la nature du radical ou selon le stade.
Avec le radical DPPH, les analyses statistiques ne montrent pas une
différence significative au niveau des stades des plantes. En revanche,
entre le premier stade de la plante sauvage et le second stade de la même
plante existe une différence significative (p<0.013). La
différence dans l'activité anti-radicalaire au DPPH serait
probablement due à leur composition en différents composés
phénoliques. La réduction du DPPH n'est
généralement pas due à l'action d'un seul composé
mais aux interactions entre plusieurs composés, ces interactions peuvent
exister dans un extrait mais pas dans un autre, conduisant ainsi à cette
différence d'activité entre les extraits.
Avec le radical ABTS, la différence n'est pas
significative seulement entre le premier stade de la plante cultivée et
le premier stade de la plante sauvage. En revanche les autres stades
manifestent des différences significatives voire même hautement
significative.
De cela, les résultats (Figure 33) sur le pouvoir
antioxydant avec le radical ABTS montrent des pourcentages d'inhibition
(Tableau 12) très élevés au premier stade pour les deux
extraits des plantes autour de 97% et 96% respectivement pour l'extrait sauvage
et l'extrait cultivé. Mais au second stade les pourcentages d'inhibition
diminuent de 42,7 et 25%
52
respectivement ceux d'extrait sauvage et d'extrait
cultivé. Cette diminution d'inhibition pour le second stade serait
expliquée par le fait qu'au fur et à mesure que la plante devient
mature, la concentration en composés phénoliques diminue car
c'est quand une plante immature a besoin beaucoup des métaboliques
secondaires pour se protéger contre les agressions environnementales.
Lors du piégeage des radicaux libres les composés
phénoliques interagissent avec les électrons non appariés
des radicaux et de cela perturbent leur réactivité.
Ça pourrait expliquer pourquoi avec les deux tests on
trouve des pourcentages d'inhibition (Tableau 11 et 12) qui ne sont pas les
mêmes. Peut-être que c'est parce que, malgré que DPPH et
ABTS sont des radicaux libres, ils n'ont pas tous les mêmes
électrons non appariés sur leur couche
périphérique. Le DPPH a un seul électron non
apparié tandis que l'ABTS renferme deux électrons non
appariés. D'où pour inhiber l'ABTS nécessiterait plus de
concentration en composés phénoliques qu'inhiber le DPPH.
Les résultats montrent que les bractées de ces
deux plantes (plante sauvage et plante cultivée) manifestent des
pouvoirs d'inhibition considérables. D'autres auteurs (Ramos et al.
2014) qui ont travaillé sur la partie de la plante d'artichaut ont
trouvé que les extraits de feuilles et de capitules présentaient
les activités antioxydantes les plus faibles. Cependant, tous les
extraits présentaient une activité antioxydante inférieure
à celle de l'acide ascorbique (2,29 #177; 0,11 g / ml) et du BHT (16,02
#177; 3,59 g / ml).
53
III.4. Détermination de l'activité
protéolytique
Toutes les coagulases qu'elles soient animales,
végétales ou microbiennes, sont capables d'hydrolyser la
caséine K, provoquant ainsi la coagulation du lait. Toutefois cette
condition est suffisante pour l'utilisation de ces enzymes en industrie
fromagère (Alais, 1984). Cependant, pour assurer un bon rendement
fromager et pour éviter certains défauts de goût et de
texture qui peuvent apparaitre sur les fromages, ces coagulases doivent
présenter une protéolyse générale faible (Zikiou et
Zidoune, 2019).
Les résultats obtenus montrent que l'activité
protéolytique de la présure microbienne est supérieure
à celle des deux extraits de fleurs. Elle est de 280 ug/ml pour la
concentration de 100% tandis que pour les deux extraits des plantes ont une
activité protéolytique d'environ 90 ug/ml. Et avec 75% de
concentration, on a 250 ug/ml pour la présure, 75 ug/ml pour l'extrait
de fleur de la plante sauvage contre 45 ug/ml pour la plante cultivée.
Et avec 50%, on a 210 ug/ml, 50 ug/ml et 10ug/ml pour l'extrait de la plante
cultivé.
Avec une faible concentration de 25%, seule la présure
manifeste une activité protéolytique de presque de 190 ug/ml et
presque de 10 ug/ml pour la plante sauvage.
|
4 0 0
3 0 0
|
|
|
|
|
Plante sauvage
Plante cultivée
P ré s u re
|
|
2 0 0
1 0 0
0
|
|
|
|
|
|
|
|
|
Figure 34. Activité protéolytique de deux
extraits des fleurs comparée avec celle de la
présure
Les résultats ont montré que l'activité
protéolytique est plus élevée quand la concentration est
élevée. Il n'y a pas d'activité pour la concentration de
25% pour l'extrait de fleurs de la plante cultivée et celle de l'extrait
de fleurs de plante sauvage est plus petite.
Plusieurs auteurs ont parlé de l'activité
excessive de l'extrait floral comparée à celle de la
présure animale, (Cordeiro et al., 1994). Ils ont montré que
l'extrait des fleurs de cardon a
54
une activité protéolytique trois fois plus
importante que celle de la présure animale. Le même
résultat était constaté par (Macedo et al., 1993). Quant
à Roseiro et al., 2003) et Claverie-MartÌn et
Vega-Hernàndez (2007) ont mentionné que l'activité
protéolytique des extraits des fleurs du genre Cynara est
environ le double de celle de la présure traditionnelle.
Par contre, nos résultats de l'activité
protéolytique d'extrait floral comparée à celle de
l'activité de présure microbienne issu du champignon
Rhizomucor miehei ont montré que l'activité d'extrait
floral reste très inférieure à celle de la présure.
Cette contradiction des résultats peuvent être due par le fait que
nos extraits sont utilisés à l'état brut ou la
méthode d'extraction non appropriée. D'où la
nécessité d'optimiser toutes techniques afin d'en déduire
les conditions propices.
III.5. Détermination de l'activité
coagulante
Cette partie est centrée sur la détermination du
temps de floculation (Tableau 13) après avoir ajouté 1ml de
l'extrait enzymatique brut des fleurs dans 10 ml de lait frais de vache
utilisé à une température de 35°C avec un pH de
6,4.
Tableau 13. Temps de floculation différents selon
les concentrations de l'extrait et de
présure
|
concentration
|
5 min
|
10 min
|
15 min
|
25 min
|
40 min
|
1h
|
|
Présure
|
100%
|
_
|
_
|
_
|
_
|
_
|
+
|
|
75%
|
_
|
_
|
_
|
_
|
_
|
+
|
|
50%
|
_
|
_
|
_
|
#177;
|
+
|
+
|
|
25%
|
_
|
_
|
#177;
|
+
|
+
|
+
|
|
Extrait sauvage
|
100%
|
#177;
|
+
|
+
|
+
|
+
|
+
|
|
75%
|
#177;
|
+
|
+
|
+
|
+
|
+
|
|
50%
|
_
|
#177;
|
+
|
+
|
+
|
+
|
|
25%
|
_
|
#177;
|
#177;
|
+
|
+
|
+
|
|
Extrait cultivé
|
100%
|
#177;
|
+
|
+
|
+
|
+
|
+
|
|
75%
|
_
|
+
|
+
|
+
|
+
|
+
|
|
50%
|
_
|
#177;
|
+
|
+
|
+
|
+
|
|
25%
|
_
|
#177;
|
+
|
+
|
+
|
+
|
Légende : #177;: première apparition des
flocons lors de la coagulation ,
· + : coagulation totale ,
· _
: Absence de coagulation.
Le temps de floculation permet de bien déduire la force
coagulante de chaque extrait afin de comparer l'activité coagulante des
deux extraits des fleurs avec celle de la présure en fonction des
différentes concentrations.
55
En effet, le temps de floculation diffère selon la
nature de l'extrait utilisé (Tableau 13). Il est de 5 min pour l'extrait
de fleur de la plante sauvage pour les concentrations de 100% et 75%. Il est de
même pour l'extrait de fleur de la plante cultivée mais seulement
à 100%. Quant à la présure microbienne, nous constatons
que le temps de floculation est très élevé (15 min) avec
une concentration moins élevée (25%).
Nous remarquons qu'avec le temps, la coagulation a
été très complète (Figure 34) selon la
concentration de l'extrait des fleurs et de présure. Ces
résultats sont confirmés aussi par (Chazarra et al.,
2007; García et al., 2015) attestant que la coagulation du lait
dépend également de la concentration d'enzyme. En effet, le temps
de coagulation du lait diminue avec l'augmentation de la concentration en
enzyme. Elle dépend aussi du pH du substrat autour de 4, sans
différence significative du pH étudié entre (3-7) comme
l'indiquent Chazarra et al (2007), Zikiou (2013) et Zikiou et Zidoune (2019)
.Ces auteurs montrent que pour l'extrait des fleurs de cardon,
l'activité passe de 4,16 U.P à pH=5,0 pour se stabiliser à
0,2 U.P. à pH 7,0.

Figure 35. Coagulation totale du lait après
incubation au bain marie
L'activité coagulante pour l'extrait des fleurs (plante
sauvage et cultivée) est de 0,333 UP tandis qu'elle est faible pour la
présure microbienne utilisée comme témoin (0,111 UP).
Certains auteurs (García et al. 2015) ont trouvé
des résultats montrant qu'il y a une différence entre
l'activité coagulante avec l'extrait de la fleur sauvage et
cultivée : l'activité coagulante de l'extrait d'artichaut (plante
cultivée) (46 IMCU ml/1) était
56
inférieure à celle d'extrait de chardon (plante
sauvage) (61 IMCU ml/1) contrairement à ceux qu'on a trouvé
où l'activité coagulante de l'extrait de la plante
cultivée est la même que pour la plante sauvage mais la
différence est remarquable lorsque on dilue les deux extraits. Nos
résultats sont aussi inférieurs à ceux trouvés par
Zikiou et Zidoune (2019) dont l'activité coagulante est de 3,23 UP pour
1 ml de l'extrait. Cette activité peut être due à d'autres
composés contenus dans notre extrait d'où la nécessite de
faire une purification pour avoir des résultats similaires.
D'autres études sur les extraits végétaux
du même genre Cynara montrent des effets intéressants
lors de la fabrication du fromage. Comme l'indique Fernández-Salguero et
Sanjuán (1999) que l'hydrolyse de la caséine s'est
avérée beaucoup plus étendu et plus rapide dans les
fromages fabriqués en utilisant de la présure
végétale (la quantité d'azote soluble à 60, 80 et
100 jours d'affinage était supérieur de plus de 28% à
celui obtenu avec du fromage produit avec de la présure animale).
CONCLUSION
Les résultats obtenus pour l'analyse quantitative des
composés phénoliques des bractées pour les deux plantes,
artichaut cultivé (Cynara scolymus) et sauvage (Cynara
cardunculus), confirment la présence des composés
phénoliques et montre que la plante sauvage est très riche par
rapport à celle cultivée. Dans tous les cas, les composés
phénoliques du premier stade sont supérieurs à ceux du
second stade. Aussi, la plante jeune (premier stade) manifeste des
concentrations en composés phénoliques élevés par
rapport au second stade.
De même les résultats sur le piégeage des
radicaux libres, montrent que l'extrait des bractées de la plante
sauvage manifeste un pourcentage d'inhibition élevé à
celui de l'extrait de la plante cultivée. Cette différence
s'explique par la présence des composés phénoliques
élevés chez la plante sauvage.
L'utilisation des protéases végétales
pourraient intervenir, en remplacement de certaines protéases d'origine
animale ou microbienne importées au prix fort ou d'origine
bactérienne susceptible d'être génétiquement
modifiée.
L'extrait enzymatique des fleurs étudiées dans
notre travail a révélé la présence
d'activité coagulante supérieure à celle trouvée
pour la présure microbienne. Selon la concentration à 100% de
l'extrait enzymatique, seulement à 5 min, on a remarqué
l'apparition des flocons
57
tandis que ça apparaissent à une heure pour la
même concentration de présure. Etant donné que la
coagulation est l'étape primordiale lors de la fabrication du fromage,
cet extrait peut être utilisé par contre l'activité
protéolytique de la présure est supérieure à celle
de l'extrait de deux plantes. A une concentration de 100%, on a trouvé
280 jig /ml pour la présure, 90 jig /ml pour l'extrait de la plante
sauvage et 85 jig /ml de la plante cultivée. A une concentration de 75%,
on a trouvé 250 jig /ml pour la présure, 75 jig /ml pour la
plante sauvage et 45 jig /ml pour la plante cultivée.
L'activité protéolytique diminue au fur et
à mesure que la concentration diminue. En plus l'activité
protéolytique de l'extrait de la plante sauvage est supérieure
à celle de la plante cultivée.
L'apport de cette étude est non négligeable car
les résultats obtenus mettent en évidence la possibilité
d'obtention d'un extrait brut coagulant le lait, à partir d'une
matière première non exploitée jusque-là au Maroc.
Ainsi, et pour des impératifs économiques et technologiques,
l'extrait des fleurs de l'artichaut sauvage et cultivé doit être
pris en considération.
PERSPECTIVES
Les enzymes sont des molécules à forte valeur
ajoutée en agroalimentaire. Pour cela, plusieurs études
méritent d'être poursuivies pour compléter ce modeste
travail et parmi ces études intéressantes nous pouvons citer et
proposer les points suivants :
V' Il est nécessaire d'optimiser les méthodes
d'extraction pour améliorer le rendement, d'appliquer des
méthodes encore plus performantes pour la purification des
protéases comme la chromatographie d'affinité
V' La purification de ces derniers par des méthodes
chromatographiques dans le but d'éliminer les impuretés et mieux
caractériser les enzymes et également pour pouvoir
contrôler la cinétique d'hydrolyse.
V' L'utilisation des extraits dans la fabrication des fromages
et d'autres fins industrielles
V' L'analyse qualitative de l'extrait final afin de
caractériser les métabolites secondaires.
58
Références bibliographiques
Abbas Ali Dehpour, A, B Mohammad Ali Ebrahimzadeh, B Nabavi
Seyed Fazel, et and Nabavi Seyed Mohammadb. 2009. « Antioxidant activity
of the methanol extract of Ferula assafoetida and its essential oil composition
». GRASAS Y ACEITES.
Ado, Rayanatou Issa. 2017. « Etude de la coagulation du lait
par l'extrait de feuilles de Calotropis procera en réponse au contexte
laitier dans la région de Maradi au Niger ». Agro campus Ouest.
Aicha, Mechakra. 2003. « Optimisation des conditions de
production de la protéase neutre par Penicillium camemberti par des
méthodes statistiques [Optimization of the production conditions of the
neutral protease by Penicillium camemberti using statistical methods] ».
Conference Paper, 573.
Alais, C. 1984. « Science du lait: principes des techniques
laitieres ». Paris (France) Ed. SEIPAC.
Alexandre, A. M.R.C., A. M.A. Dias, I. J. Seabra, A. A.T.G.
Portugal, H. C. De Sousa, et M. E.M. Braga. 2012. « Biodiesel obtained
from supercritical carbon dioxide oil of Cynara cardunculus L. »
Journal of Supercritical Fluids 68 (août): 52?63.
Amiot, J., Fournier, F., Lebeuf, Y., Paquin, P., &
Simpson, R. (2002). Composition, propriétés physicochimiques,
valeur nutritive, qualité technologique et technique d'analyse du lait.
In Science et technologie du lait : transformation du lait (Presses in, pp.
1-73). Montréal.
Australia, Government of South. 2015. « Wild Artichoke
(cynara cardunculus ». Natural resources Adelaide and Mt Lofty
Ranges, no November.
Australia, Weeds of. 2016. « Cynara cardunculus (cardoon)
». CABI. 2016.
Beers, E. P., Woffenden, B. J., & Zhao, C. (2000). Plant
proteolytic enzymes: Possible roles during programmed cell death. Plant
Molecular Biology, 44(3), 399-415.
B Foltmann, V B Pedersen, D Kauffman, G Wybrandt. 1979. «
The primary structure of calf chymosin. » Journal of Biological
Chemistry.
Benkahoul, Malika. 2016. « Evaluation, Extraction et
caractérisation de l'activité coagulante des protéases de
deux chardons endémiques, Galactites tomentosa et Onopordum acanthium
». Universite des freres mentouri constantine, Thèse.
Berridge, N. J. 1952. « 488. An improved method of observing
the clotting of milk containing rennin ». Journal of Dairy Research
19 (3): 328?29.
Bigot, Claude, Claude Foury, Monique Casenave, Eric Delacroix,
Claudie Delage, Béatrice Godin, Noël Jego, et Jean Leboeuf. 1984.
« Multiplication in vitro d'artichaut (Cynara scolymus L.) à partir
de semences: comparaison au champ de quelques clones à la lignée
dont ils sont issus EDP Sciences. Vol. 4.
Boizot, Nathalie, et Jean-Paul Charpentier. 2006. «
Méthode rapide d'évaluation du contenu en composés
phénoliques des organes d'un arbre forestier ». Cahier des
Techniques de l'INRA , 79-82. (2006).
Botanica, Tela. 2011. « Cynara cardunculus L. »
Boubekri, Chérifa. 2014a. « Etude de
l'activité antioxydante des polyphenols extraits de solanum melongena
par des techniques electrochimiques ». Université Mohamed Khider-
Biskra. Mémoire.
Boubekri, Chérifa. 2014b. « Etude de
l'activité antioxydante des polyphénols extraits de Solanum
melongena par des techniques électrochimiques ». Theses et
memoires.
Chazarra, Soledad, Lara Sidrach, Dorotea López-Molina,
et José Neptuno Rodríguez-López. 2007. «
Characterization of the milk-clotting properties of extracts from artichoke
(Cynara scolymus, L.) flowers ». International Dairy Journal 17
(12): 1393?1400.
Claverie-Martìn, Félix, et Marìa C.
Vega-Hernàndez. 2007. « Aspartic proteases used in cheese making
». In
59
Industrial Enzymes: Structure, Function and
Applications, 207-19.
Codou Latyr, Fall. 1997. « Etude des fraudes du lait:
mouillage et écrémage ». Université Cheikh Anta Diop
- Dakar,thèse.
Collins, George J., Judy A. Barber, Russ Zajtchuk, David Vahek,
et Lewis A. Malogne. 1977. « The effects of operative stress on the
coagulation profile ». The American Journal of Surgery 133 (5):
612-16.
Cordeiro, Maria C., M. Salome Pais, et Peter E. Brodelius. 1994.
« Tissue-specific expression of multiple forms of cyprosin (aspartic
proteinase) in flowers of Cynara cardunculus ». Physiologia Plantarum
92 (4): 645-53.
Dalgleish D G. (1997). The enzymatic coagulation of milk. In P.
F. Fox (Ed.), Advanced in 78 Dairy Chemistry-1, proteins (Blackie and Son Ldt,
pp. 579-619).
Dalgleish, Douglas G., et Milena Corredig. 2012. « The
Structure of the Casein Micelle of Milk and Its Changes During Processing
». Annual Review of Food Science and Technology 3 (1): 449-67.
Desmazeaud, Michel. 1983. « L'état des
connaissances en matière de nutrition des bactéries lactiques
». HAL archives-ouvertes, 267-316.
Didi, Hadj-Mahammed, et Zabeirou. 2003. « Place des
plantes spontanees dans la medecine traditionnelle de la region de ouargla (
Sahara septentrional Est ) », 47-51.
Dixon, Richard A., et Giulio M. Pasinetti. 2010. «
Flavonoids and isoflavonoids: From plant biology to agriculture and
neuroscience ». Plant Physiology 154 (2): 453-57.
Dridi, Bouthaina. 2003. « Un Systeme integre de
micropropagation del'artichaut (Cynara scolymus L.) ». Universiteit
Gent . Thesis.
Eck A., Gillis J., 1997. Le fromage: de la science a l'assurance
qualité. Ed. Tec & Doc, Lavoisier, Paris, pp : 7-39.
El, Amira S, Mohamed A Farag, Dalia A Al-mahdy, et Ludger A
Wessjohann. 2014. « Phytochemistry Developmental changes in leaf phenolics
composition from three artichoke cvs . ( Cynara scolymus ) as determined via
UHPLC - MS and chemometrics ». Phytochemistry 108: 67-76.
Elattir H., Skiredj A., Ait-Ben Oussaiden R. et Chtaina N.
2009. « Comparaison de cultivars d ' artichaut multipliés par semis
et plantés sous quatre densités dans la région du Gharb au
Maroc 8 », no Lcm: 14-16.
Encinar, J. M., J. F. González, J. J. Rodríguez, et
A. Tejedor. 2002. « Biodiesel fuels from vegetable oils:
Transesterification of Cynara cardunculus L. Oils with ethanol ».
Energy and Fuels 16 (2): 443-50.
Fernández-Salguero, J., et E. Sanjuán. 1999. «
Influence of vegetable and animal rennet on proteolysis during ripening in
ewes' milk cheese ». Food Chemistry 64 (2): 177-83.
Fox, P. F. 2011. « Milk Proteins: General and Historical
Aspects ». Advanced Dairy Chemistry--1 Proteins 1: 1-48.
García, V., S. Rovira, K. Boutoial, D. Álvarez,
et M. B. López. 2015. « A comparison of the use of thistle (Cynara
cardunculus L.) and artichoke (Cynara scolymus L.) aqueous extracts for milk
coagulation ». Dairy Science & Technology 95 (2): 197-208.
Gatto, Angela, Domenico De Paola, Francesca Bagnoli, Giovanni
Giuseppe Vendramin, et Gabriella Sonnante. 2013. « Population structure of
Cynara cardunculus complex and the origin of the conspecific crops artichoke
and cardoon ». Annals of Botany 112 (5): 855-65.
Gengmao, Zhao, Li Shihui, Sun Xing, Wang Yizhou, et Chang
Zipan. 2015. « The role of silicon in physiology of the medicinal plant
(Lonicera japonica L.) under salt stress ». Scientific Reports 5
(août).
Gérard Brule, Loic Roger, et Michel Piot. 1997. «
Caseine phosphopeptide composition ». United States Patent.
60
Germonville. 2003. « Coagulants ». FAO. 2003.
http://agris.fao.org/agris-
search/
search.do?recordID=FR2003001723.
Guevara, Gabriela Maria, et Gustavo Daleo Raul. 2018.
Biotechnological Applications of Plant Proteolytic Enzymes.
Biotechnological Applications of Plant Proteolytic Enzymes.
Harboe, M., M. L. Broe, et K. B. Qvist. 2010. « The
Production, Action and Application of Rennet and Coagulants ». In
Technology of Cheesemaking: Second Edition, 98-129.
Wiley-Blackwell.
Holt, C. 1992. « Structure and stability of bovine casein
micelles. » Advances in protein chemistry 43: 63-151.
Horne, David S. 2002. « Casein structure, self-assembly
and gelation ». Current Opinion in Colloid and Interface
Science.
Ibra, Serigne, Mbacke Dieng, Alioune Dior Fall, Kady
Diatta-badji, Abdou Sarr, Madieye Sene, Moussa Sene, Amadou Mbaye, William
Diatta, et Emmanuel Bassene. 2017. « Evaluation de l ' activité
antioxydante des extraits hydro-ethanoliques des feuilles et écorces de
Piliostigma thonningii Schumach ». International Journal of Biological
and Chemical Sciences 11 (April): 768-76.
Jeantet, Romain, et Gilles Garric. 2005. « Initiation
à la technologie fromagère 2 ». Lavoisier TEC ET
doc,Paris 12: 1-12.
Jeantet, Romain, Sarah Nasser, Anne Moreau, Alain
Hédoux, et Guillaume Delaplace. 2017. « Influence of storage
conditions on the functional properties of micellar casein powder ».
Food and Bioproducts Processing 106: 181-92.
Kelly, M. 2000. « Cynara cardunculus (cardoon) ».
Berkeley: University California Press.
KhaKhaldi, S. et al. (2013), Feten Chaouachi, Riadh Ksouri, et
Mohamed El Gazzah. 2013. « Polyphenolic composition in different organs of
Tunisia populations of Cynara Cardunculus L. and their antioxidant activity
Polyphenolic Composition in Different Organs of Tunisia Populations of Cynara
Cardunculus.L and Their Antioxidant Activity ». Journal of Food and
Nutrition Research 1 (1): 1-6.
Krira, Abdelkrim. 2010. « La culture de l'artichaut dans
le Gharb ». CRRA de Kenitra, 6.
abdelkrim.krira@gmail.com.
Lapointe-Vignola, Carole. 2002. Science et technologie du
lait: transformation du lait. Presses internationales Polytechnique.
Laurent, SINA. 1992. « Controle de qualité du lait
et des produits laitiers fabriqués par la SOCA ». Universite Cheikh
Anta Diop de Dakar. Thèse.
Lemordant, Denis. 1982. « Bézanger-Beauquesne L.,
Pinkas M., Torck M. et Trotin F. - Plantes médicinales des
régions tempérées ». Journal d'agriculture
traditionnelle et de botanique appliquée 29 (1): 108-9.
Lenoir J., Remeuf, et Schneid N., 1985 : Le lait de
fromagerie. In : Eck A. et Gillis J.C. Le fromage de la science à
l'assurance- qualité. 3e ed. Tec. Et Doc. Lavoisier.
Lenoir, Loïc. 2011. « Effet protecteur des
polyphénols de la verveine odorante dans un modèle d'inflammation
colique chez le rat ». UNIVERSITE Blaise Pascale. Thèse.
Li, Hua Bin, Ka Wing Cheng, Chi Chun Wong, King Wai Fan, Feng
Chen, et Yue Jiang. 2007. « Evaluation of antioxidant capacity and total
phenolic content of different fractions of selected microalgae ». Food
Chemistry 102 (3): 771-76.
Macedo, Angela C, F Xavier Malcata, et Jorge C Ollvelra. 1993.
« The Technology, Chemistry, and Microbiology of Serra Cheese: A Review'
».
Madina, KECHKAR. 2008. « Extraction de la silymarine et
étude de son activité antimicrobienne ». Université
Mentouri Constantine. Mémoire.
Mahmoudi Souhila, Mustapha Khali, et Nacera Mahmoudi. 2013.
« Etude de l ' extraction des composés
61
phénoliques de différentes parties de la fleur d '
artichaut ( Cynara scolymus L .) ». Nature & Technologie,
35?40.
McMahon, Donald J., et Rodney J. Brown. 2010. « Enzymic
Coagulation of Casein Micelles: A Review ». Journal of Dairy Science
67 (5): 919?29.
Mockaitis, Keithanne, et Mark Estelle. 2008. « Auxin
Receptors and Plant Development: A New Signaling Paradigm ». Annual
Review of Cell and Developmental Biology 24 (1): 55?80.
Mohanty, Ashok K., Utpal K. Mukhopadhyay, Jai K. Kaushik, Sunita
Grover, et Virender K. Batish. 2003. « Isolation, purification and
characterization of chymosin from riverine buffalo (Bubalos bubalis) ».
Journal of Dairy Research 70 (1): 37?43.
Nadir, TIGRINE. 2016. « Activité antioxydante des
extraits d ' écorce et de pulpe de Citrus limon et Citrus sinensis
». Université Abderrahmane Mira de Bejaia. Mémoire.
Negro, Donatella, Vincenzo Montesano, Sabrina Grieco, Pasquale
Crupi, Giulio Sarli, Antonino De Lisi, et Gabriella Sonnante. 2012. «
Polyphenol Compounds in Artichoke Plant Tissues and Varieties ».
Journal of Food Science 77 (2).
Nkhili, Ez-zohra. 2009. « Polyphénols de
l'alimentation: extraction, interactions avec les ions du fer et du cuivre,
oxydation et pouvoir antioxydant ».
http://www.theses.fr,
janvier.
Nouani, A., Etienne Dako, Slimane Belbraouet, et Adjehi Thomas
Dadie. 2009. « Characterization of the Purified Coagulant Extracts Derived
from Artichoke Flowers ( Cynara scolymus ) and from the Fig Tree Latex ( Ficus
carica ) in Light of Their Use in the Manufacture of Traditional Cheeses in
Algeria ». Journal of Food Technology, no January.
Nouani, A, E Dako, A Morsli, N Belhamiche, S Belbraouet, M.M
Bellal, et A. Dadie. 2009. « Characterization of the Purified Coagulant
Extracts Derived from Artichoke Flowers (Cynara scolymus) and from the Fig Tree
(Ficus carica) in Light of Their Use in the Manufacture of Traditional Cheeses
in Algeria ». Journal of Food Technology 7 (1684?8462): 20?29.
Nouraei, Sina, Mehdi Rahimmalek, et Ghodratollah Saeidi. 2018.
« Variation in polyphenolic composition, antioxidants and physiological
characteristics of globe artichoke (Cynara cardunculus var. scolymus Hayek L.)
as affected by drought stress ». Scientia Horticulturae 233
(October 2017): 378?85.
Owen, P L, et T Johns. 1999. « Xanthine oxidase
inhibitory activity of northeastern North American plant remedies used for
gout. » Journal of ethnopharmacology 64 (2): 149?60.
Pandino, Gaetano, Sara Lombardo, Giovanni Mauromicale, et Gary
Williamson. 2011. « Phenolic acids and flavonoids in leaf and floral stem
of cultivated and wild Cynara cardunculus L. genotypes ». Food
Chemistry 126 (2): 417?22.
Pardo, Mercedes, Malcolm Ward, Aida Pitarch, Miguel
Sánchez, César Nombela, Walter Blackstock, et Concha Gil. 2000.
« Cross-species identification of novel Candida albicans immunogenic
proteins by combination of two-dimensional polyacrylamide gel electrophoresis
and mass spectrometry ». Electrophoresis 21 (13): 2651?59.
Pena-Iglesias, Ayuso et. 1974. « Les maladies des plantes
maraîchères, 3e éd. - Charles-Marie Messiaen, Dominique
Blancard, Francis Rouxel - Google Livres ». Editions Quae. 1974.
Pepper, Kelly et. 1996. « Invasive Plant Species of the
World ». CABI. 1996.
Pereira, Cláudia. 2015. « Cardosin A Molecular
Determinants and Biosynthetic Pathways ». Universtit2 Paris- Sud.
Petropoulos, Spyridon, Ângela Fernandes, Carla Pereira,
Nikos Tzortzakis, Josiana Vaz, Marina Sokoviæ, Lillian Barros, et Isabel
C F R Ferreira. 2019. Bioactivities, chemical composition and nutritional
value of Cynara cardunculus L. seeds. Food Chemistry. Elsevier
Ltd.
Raccuia, S.A., M.G. Melilli, I. Piscioneri, et N. Sharma.
2012. « Evaluation of fatty acids composition in grain oil of cardoon
(cynara cardunculus l.) ». Acta Horticulturae, no 942
(janvier): 463?68.
62
Rachedi, Fahima Ali, Souad Meraghni, Nourhene Touaibia, et
Sabrina M. 2018. « Analyse quantitative des composés
phénoliques d ' une endémique algérienne Scabiosa
Atropurpurea sub. Maritima L. » Bulletin de la Société
Royale des Sciences de Liège 87 (3): 13-21.
Ramakrishna, Akula, et Gokare Aswathanarayana Ravishankar.
2011. « Influence of abiotic stress signals on secondary metabolites in
plants ». Plant Signaling and Behavior.
Ramos, Patrícia A.B., Sónia A.O. Santos,
Ângela R. Guerra, Olinda Guerreiro, Carmen S.R. Freire, Sílvia M.
Rocha, Maria F. Duarte, et Armando J.D. Silvestre. 2014. « Phenolic
composition and antioxidant activity of different morphological parts of Cynara
cardunculus L. var. altilis (DC) ». Industrial Crops and Products
61: 460-71.
Re, Roberta, Nicoletta Pellegrini, Anna Proteggente, Ananth
Pannala, Min Yang, et Catherine Rice-Evans. 1999. « Antioxidant activity
applying an improved ABTS radical cation decolorization assay ». Free
Radical Biology and Medicine 26 (9-10): 1231-37.
Ribéreau-Gayon, J. Peynaud, E. 1968. « Les
composés phénoliques des végétaux, Traité
d'oenologie- ». Scientific Research Publishing.
Romani, A., F. Ieri, B. Turchetti, N. Mulinacci, F. F.
Vincieri, et P. Buzzini. 2006. « Analysis of condensed and hydrolysable
tannins from commercial plant extracts ». Journal of Pharmaceutical
and Biomedical Analysis 41 (2): 415-20.
Ronez, Florian. 2012. « Exploration fonctionnelle et
valorisation industrielle de la protéine de choc thermique
bactérienne Lo18 ».
http://www.theses.fr,
avril.
Roseiro, Luisa Bivar, Manuela Barbosa, Jennifer M Ames, et R
Andrew Wilbey. 2003. « Cheesemaking with vegetable coagulants-the use of
Cynara L. for the production of ovine milk cheeses ». International
Journal of Dairy Technology 56 (2): 76-85.
Roumeissa, Lehout, et Laib Maya. 2015. « Comparaison de
trois méthodes d'extraction des composés phénoliques et
des flavonoïdes à partir de la plante médicinale: Artemisia
herba alba Asso ». Université des Frères Mentouri
Constantine. Mémoire
Schaller, A. (2004). A cut above the rest: the regulatory
function of plant proteases. Planta, 220(2), 183- 197.
Schmidt, Manfred, W. H. Stockmayer, Marc L. Mansfield, Manfred
Schmidt, et Marc L. Mansfield. 1982. « Short-Time Behavior of the Dynamic
Structure Factor for Flexible-Chain Molecules ». Macromolecules
15 (6): 1609-11.
Silva S.V, & Malcata, F.X. 2000. Action of cardosin A from
Cynara humilis on ovine and caprine caseinates. Journal of Dairy Research, 67,
449-457.
Singleton, V. L., et Joseph A. Rossi. 1965. « Colorimetry
of Total Phenolics with Phosphomolybdic-Phosphotungstic Acid Reagents ».
American Journal of Enology and Viticulture 16 (3).
Souheila, Ghaoues. 2011. « Evaluation de la
qualité physico-chimique et organoleptique de cinq marques de laits
reconstitués partiellement écrémés
commercialisés dans l'est Algérien ». Université
MENTOURI - Constantine.
Soumeya, Boucetta Sabrina Boubrit. 2017. « Extraction,
purification et caractérisation d'une enzyme protéolytique issue
de caillettes de bovins adultes. Aptitudes technologiques des extraits ».
Université M'hamed Bougara Boumerdes.
Stalikas, Constantine D. 2007. « Extraction, separation,
and detection methods for phenolic acids and flavonoids. » Journal of
separation science 30 (18): 3268-95.
Sun, Peng Gang, Lin Gao, et Jia Song. 2011. «
Identification of conserved protein complexes by module alignment. »
International journal of data mining and bioinformatics 5 (6):
593-610.
Taouzinet, Mouloud. 2017. « Thème Extraction , dosage
et fractionnement sur CCM des composés phénoliques des feuilles
de Melia azedarach . » Université A. Mira - Bejaia.
63
Tsouli, J. 1974. « Etude comparée de
l'activité enzymatique de 3 variétés d'artichauts du genre
Cinara Cardunculus L sur la coagulation du lait ». Vol. 54.
Velez, Zélia, Marco Campinho, Ângela Guerra,
Laura García, Patricia Ramos, Olinda Guerreiro, Laura Felício,
Fernando Schmitt, et Maria Duarte. 2012. « Biological Characterization of
Cynara cardunculus L. Methanolic Extracts: Antioxidant, Anti-proliferative,
Anti-migratory and Anti-angiogenic Activities ». Agriculture 2
(4): 472?92.
Vicente, Oscar, et Monica Boscaiu. 2018. « Flavonoids:
Antioxidant compounds for plant defence... and for a healthy human diet ».
Notulae Botanicae Horti Agrobotanici Cluj-Napoca 46 (1): 14?21.
Waugh, David F., Lawrence K. Creamer, Charles W. Slattery, et
George W. Dresdner. 1970. « Core Polymers of Casein Micelles ».
Biochemistry 9 (4): 786?95.
Williamson, Martin B. 1944. « The amino acid composition
of human proteins ». Research Laboratories, S. IV. A. Corporation,
Chagrin Falls, Ohio), 7.
Yegin, Sirma, et Peter Dekker. 2013. « Progress in the
field of aspartic proteinases in cheese manufacturing: Structures, functions,
catalytic mechanism, inhibition, and engineering ». Dairy Science and
Technology 93 (6): 565?94.
Zikiou, Abdellah. 2013. « La coagulation du lait par
l'extrait des fleurs de cardon (Cynara cardunculus ) ». Universite
Constantine -1.
Zikiou, Abdellah, et Mohammed Zidoune. 2019. « Enzymatic
extract from flowers of Algerian spontaneous Cynara cardunculus: Milk-clotting
properties and use in the manufacture of a Camembert-type cheese ».
International Journal of Dairy Technology 72 (1): 89?99.
Annexes
Gammes d'étalonnage
1.
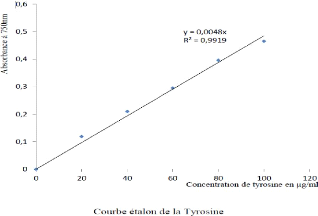
Concentration de
|
0
|
20
|
40
|
60
|
80
|
100
|
Tyr (jig /ml)
|
|
|
|
|
|
|
Solution mère de
|
0
|
0.1
|
0.2
|
0.3
|
0.4
|
0.5
|
Tyr (ml)
|
|
|
|
|
|
|
T.C.A (ml)
|
0.5
|
0.4
|
0.3
|
0.2
|
0.1
|
0
|
Na2CO3
|
2.5
|
2.5
|
2.5
|
2.5
|
2.5
|
2.5
|
Folin-Ciocalteu
dilué au 1/2
|
0.25
|
0.25
|
0.25
|
0.25
|
0.25
|
0.25
|
|
2.
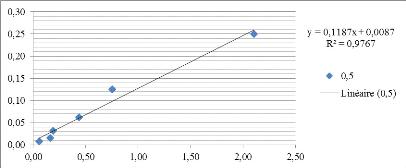
64
Gamme d'étalonnage de l'acide gallique
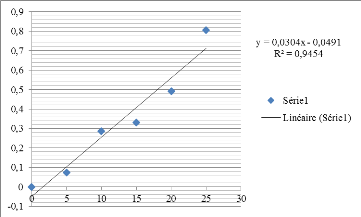
3.
65
Gamme d'étalonnage de la
quércétine
4.
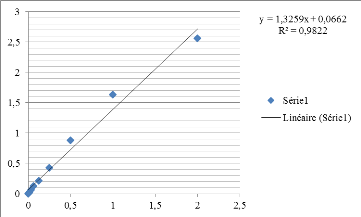
Gamme d'étalonnage de catéchine
| 


