III.2.2. Flavonoïdes
D'après les analyses statistiques avec SPSS, montrent
des différences significatives (p<0,017) entre le premier stade
plante cultivée et le premier stade plante sauvage (p<0,000) et entre
le second stade plante cultivée. Les autres différences hautement
significatives se trouvent entre la plante sauvage au premier stade et plante
cultivée et sauvage au second stade (p<0,000), et aussi les
différences hautement significatives se remarquent entre la plante
cultivée et plante sauvage au second stade (p<0,000). Les
résultats des concentrations en flavonoïdes sont
présentés dans la figure 30.
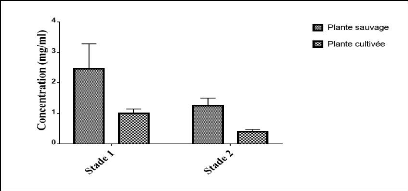
Figure 30. Concentration des flavonoïdes sur les
deux stades.
46
Les extraits de la plante sauvage manifestent des
concentrations en flavonoïdes supérieurs à celles de la
plante cultivée. Les moyennes des concentrations sont mentionnées
dans le tableau 9.
Tableau 9. Moyennes des concentrations des
flavonoïdes
|
1er stade
|
|
Moyenne (mg/ml)
|
|
FLVs
|
2.46#177;0.17
|
|
|
FLVc
|
0.93#177;0.10
|
|
2ème stade
|
FLVs
|
1.34#177;0.10
|
|
FLVc
|
0.40#177;0.12
|
|
FLVs: Flavonoïdes pour l'extrait de la plante sauvage ;
FLVc: Flavonoïdes pour l'extrait de la plante cultivée.
III.2.3. Tanins condensés
D'après les analyses statistiques avec SPSS, montrent
des différences hautement significatives entre le premier stade plante
cultivée et le second stade plante cultivée (p<0,000) et entre
le second stade plante sauvage (p< 0,000). Les autres différences
significatives se trouvent entre la plante sauvage au premier stade et plante
cultivée au second stade (p<0,004), et aussi entre plante sauvage au
premier stade et la plante sauvage au second stade (p<0.01). Les
résultats des concentrations en tanins condensés sont
présentés dans la figure 31 et dans le tableau 10.
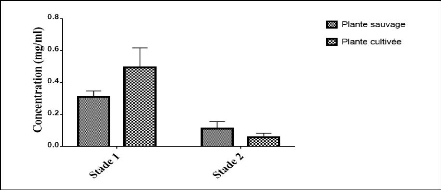
Figure 31. Concentration des tanins condensés
sur les deux stades
47
Les concentrations en tanins condensés sont
élevées en premier stade chez la plante cultivée par
rapport à celles de la plante sauvage tandis qu'au second stade les
concentrations sont un peu élevées cette fois ci pour la plante
sauvage. Les moyennes des concentrations sont mentionnées dans le
tableau 10.
Tableau 10. Moyennes des concentrations des tanins
condensés.
|
1er stade
|
|
Moyenne (mg/ml)
|
|
TNCs
|
0.31#177;0.04
|
|
|
TNCc
|
0.43#177;0.03
|
|
2ème stade
|
TNCs
|
0.10#177;0.014
|
|
TNCc
|
0.08#177;0.02
|
|
TNCs: Tanins condensés pour l'extrait de la plante
sauvage ; TNCc: Tanins condensés pour l'extrait de la plante
cultivée.
III.3. Evaluation de l'activité
antioxydante
III.3.1. Activité anti radicalaire par
DPPH
La différence significative se remarque entre le
premier stade de la plante sauvage et le second stade de la plante sauvage
(p<0.013). Les autres stades ne manifestent pas une différence
significative. Les résultats du pouvoir anti radicalaire par DPPH des
différents extraits pour les deux stades sont rassemblés dans la
figure 32 et le tableau 11.
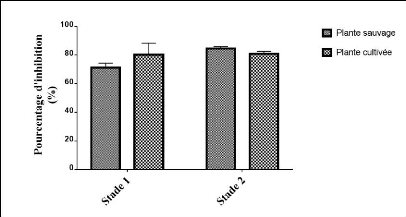
Figure 32. Pourcentage d'inhibition d'un radical DPPH
sur les deux stades.
48
Tous les extraits des plantes montrent des effets scavenger du
radical DPPH sur tous les deux stades. Les moyennes des pourcentages
d'inhibition de DPPH sont rassemblées dans le tableau 11.
Tableau 11. Moyennes de pourcentage d'inhibition de
DPPH.
|
1er stade
|
|
Moyenne (%)
|
|
Extrait sauvage
|
71.2#177;3.1
|
|
|
Extrait cultivé
|
77.2#177;1.8
|
|
2ème stade
|
Extrait sauvage
|
83.8#177;1.9
|
|
Extrait cultivé
|
80.2#177;2.2
|
|
III.3.2. Activité anti radicalaire par
l'ABTS
Afin de valider les résultats de l'efficacité
antioxydante des extraits de Cynara obtenus précédemment
par le test anti-radicalaire du DPPH, nous avons utilisés un
2ième test basé sur la capacité de
piégeage du proton du radical cationique ABTS+. Les
pourcentages d'inhibition pour les extraits de ces plantes sont
représentés par la figure 33 et dans le tableau 12.
D'après les analyses statistiques montrent des
différences hautement significatives (p<0.000) entre le premier stade
de la plante cultivée et le second stade plante cultivée, et
entre le premier stade de la plante cultivée et le second stade plante
sauvage. D'autres différences hautement significatives (p<0.000) se
remarquent entre le premier stade plante sauvage et second stade plante
cultivée, et entre le premier stade plante sauvage et le second stade
plante sauvage. Entre le premier stade de la plante cultivée et le
premier stade plante sauvage, il n'y a pas de différence
significative.
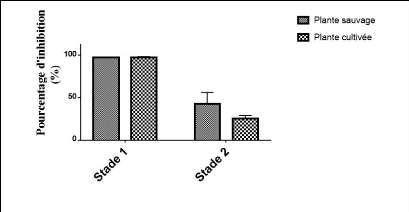
49
Figure 33. Pourcentage d'inhibition d'un radical ABTS
sur les deux stades.
Tous les extraits des plantes montrent des effets scavenger du
radical ABTS sur tous les deux stades malgré une diminution remarquable
de pourcentage au second stade. Les moyennes des pourcentages d'inhibition
d'ABTS sont présentées dans le tableau 12.
Tableau 12. Moyennes de pourcentage d'inhibition
d'ABTS.
|
1er stade
|
|
Moyenne (%)
|
|
Extrait sauvage
|
97.2#177;2.4
|
|
|
Extrait cultivée
|
96.1#177;1.4
|
|
2ème stade
|
Extrait sauvage
|
42.7#177;2.9
|
|
Extrait cultivée
|
25.0#177;2.9
|
|
III.3.3. Discussion sur les composés
phénoliques et l'activité antioxydante
D'après la figure 29 et le tableau 8 montrent que les
concentrations des polyphénols totaux de la plante sauvage sont
supérieures à ceux de la plante cultivée sur les deux
stades. Le premier stade manifeste des concentrations plus
élevées pour les deux plantes que dans le second stade. Ça
peut s'expliquer par le fait que les plantes immatures ont besoin beaucoup de
métabolites secondaires tels que les polyphénols totaux,
flavonoïdes et autres pour se
50
protéger contre conditions climatiques
défavorables, lutter contre les maladies, ravageurs. Au fur et à
mesure que la plante devient mature les concentrations phénoliques
diminuent.
Ces résultats sont similaires à ceux
trouvés par (Velez et al. 2012) disant que entre les plantes ayant le
même temps de récolte, la quantité de phénols est
plus élevée chez le cardon sauvage (var. sylvestris) que
chez le cardon cultivé. En plus Velez et ses collaborateurs (2012)
confirment que la concentration en phénol dans les inflorescences
dépend à la fois du moment de la récolte et de la variante
du cardon. Les extraits obtenus à partir d'inflorescences immatures
présentent des concentrations en phénol supérieures
à celles obtenues d'inflorescences matures.
Les extraits de la plante sauvage manifestent des
concentrations en flavonoïdes supérieurs à celles de la
plante cultivée. En plus c'est avec le premier stade que manifestent
beaucoup de concentrations (Figure 31 et Tableau 9) en flavonoïdes. Comme
les polyphénols totaux, les flavonoïdes participent dans la
protection des végétaux envers les conditions défavorables
et surtout pour les plantes jeunes. On peut ajouter que les plantes qui
poussent spontanément dans la nature ont besoin nécessairement
plus de composés phénoliques pour s'y adapter.
Dixon et Pasinetti, (2010) confirment que la localisation
vacuolaire de nombreux flavonoïdes permet leurs fonctions de filtrage de
la lumière, de photo protection et de pigmentation, mais probablement
pas leurs fonctions antioxydantes. En plus, Vicente et Boscaiu, (2018)
confirment qu'ils remplissent beaucoup des fonctions biologiques,
principalement médiatrices des interactions entre les plantes et
l'environnement et participent à la défense des plantes contre
les agents pathogènes. Ils participent également aux
mécanismes de tolérance pratiquement à tous les types de
stress abiotique, y compris les rayonnements UV, températures
extrêmes, exposition à l'ozone, sécheresse ou
salinité. Ça pourrait expliquer l'abondance des flavonoïdes
dans les bractées de ces deux plantes pour le premier stade où
les plantes sont immatures et aussi dans l'extrait sauvage car les plantes
sauvages pour survivre ont tellement besoin de ces molécules bioactives
en abondance pour s'y adapter.
Les résultats (Tableau 10) ont montré des
faibles concentrations en tanins condensés par rapport aux autres
composés phénoliques tels que les polyphénols totaux et
flavonoïdes. En plus les concentrations en tanins condensés dans
les extraits de la plante cultivée sont supérieures à
celles de l'extrait de plante cultivée. Cela peut être
expliqué par la méthode
51
d'extraction utilisée et aussi selon la nature de
solvants car les tanins condensés sont extraits favorablement par la
méthode de décoction aqueuse. Mahmoudi et al. (2013) le
confirment en disant que la macération semble être meilleure pour
l'extraction des polyphénols totaux et les flavonoïdes avec des
solvants d'extraction tels que l'éthanol et l'acétone. En
revanche, la décoction aqueuse est plus performante pour l'extraction
des tanins condensés alors que pendant notre travail, c'est
l'acétone utilisé comme solvant d'extraction.
De cela, il est important d'optimiser les méthodes
d'extraction enfin d'extraire le maximum de tanins condensés. Nos
résultats montrent des concentrations élevées quand le
matériel végétal renferme plus d'eau c'est-à-dire
pour le premier stade. Malgré le solvant qui n'est pas favorable
à l'extraction des tanins condensés, peut être que la
présence de plus d'eau serait la cause de cette concentration
supérieure au second stade chez la plante cultivée voir
même chez la plante sauvage.
D'après les résultats de notre travail, tous les
extraits de deux plantes que ça soit au premier stade ou second stade
ont montré des effets scavenging contre les radicaux DPPH et l'ABTS.
En effet, les pourcentages d'inhibition ne sont pas les
mêmes pour les deux plantes selon la nature du radical ou selon le stade.
Avec le radical DPPH, les analyses statistiques ne montrent pas une
différence significative au niveau des stades des plantes. En revanche,
entre le premier stade de la plante sauvage et le second stade de la même
plante existe une différence significative (p<0.013). La
différence dans l'activité anti-radicalaire au DPPH serait
probablement due à leur composition en différents composés
phénoliques. La réduction du DPPH n'est
généralement pas due à l'action d'un seul composé
mais aux interactions entre plusieurs composés, ces interactions peuvent
exister dans un extrait mais pas dans un autre, conduisant ainsi à cette
différence d'activité entre les extraits.
Avec le radical ABTS, la différence n'est pas
significative seulement entre le premier stade de la plante cultivée et
le premier stade de la plante sauvage. En revanche les autres stades
manifestent des différences significatives voire même hautement
significative.
De cela, les résultats (Figure 33) sur le pouvoir
antioxydant avec le radical ABTS montrent des pourcentages d'inhibition
(Tableau 12) très élevés au premier stade pour les deux
extraits des plantes autour de 97% et 96% respectivement pour l'extrait sauvage
et l'extrait cultivé. Mais au second stade les pourcentages d'inhibition
diminuent de 42,7 et 25%
52
respectivement ceux d'extrait sauvage et d'extrait
cultivé. Cette diminution d'inhibition pour le second stade serait
expliquée par le fait qu'au fur et à mesure que la plante devient
mature, la concentration en composés phénoliques diminue car
c'est quand une plante immature a besoin beaucoup des métaboliques
secondaires pour se protéger contre les agressions environnementales.
Lors du piégeage des radicaux libres les composés
phénoliques interagissent avec les électrons non appariés
des radicaux et de cela perturbent leur réactivité.
Ça pourrait expliquer pourquoi avec les deux tests on
trouve des pourcentages d'inhibition (Tableau 11 et 12) qui ne sont pas les
mêmes. Peut-être que c'est parce que, malgré que DPPH et
ABTS sont des radicaux libres, ils n'ont pas tous les mêmes
électrons non appariés sur leur couche
périphérique. Le DPPH a un seul électron non
apparié tandis que l'ABTS renferme deux électrons non
appariés. D'où pour inhiber l'ABTS nécessiterait plus de
concentration en composés phénoliques qu'inhiber le DPPH.
Les résultats montrent que les bractées de ces
deux plantes (plante sauvage et plante cultivée) manifestent des
pouvoirs d'inhibition considérables. D'autres auteurs (Ramos et al.
2014) qui ont travaillé sur la partie de la plante d'artichaut ont
trouvé que les extraits de feuilles et de capitules présentaient
les activités antioxydantes les plus faibles. Cependant, tous les
extraits présentaient une activité antioxydante inférieure
à celle de l'acide ascorbique (2,29 #177; 0,11 g / ml) et du BHT (16,02
#177; 3,59 g / ml).
53
III.4. Détermination de l'activité
protéolytique
Toutes les coagulases qu'elles soient animales,
végétales ou microbiennes, sont capables d'hydrolyser la
caséine K, provoquant ainsi la coagulation du lait. Toutefois cette
condition est suffisante pour l'utilisation de ces enzymes en industrie
fromagère (Alais, 1984). Cependant, pour assurer un bon rendement
fromager et pour éviter certains défauts de goût et de
texture qui peuvent apparaitre sur les fromages, ces coagulases doivent
présenter une protéolyse générale faible (Zikiou et
Zidoune, 2019).
Les résultats obtenus montrent que l'activité
protéolytique de la présure microbienne est supérieure
à celle des deux extraits de fleurs. Elle est de 280 ug/ml pour la
concentration de 100% tandis que pour les deux extraits des plantes ont une
activité protéolytique d'environ 90 ug/ml. Et avec 75% de
concentration, on a 250 ug/ml pour la présure, 75 ug/ml pour l'extrait
de fleur de la plante sauvage contre 45 ug/ml pour la plante cultivée.
Et avec 50%, on a 210 ug/ml, 50 ug/ml et 10ug/ml pour l'extrait de la plante
cultivé.
Avec une faible concentration de 25%, seule la présure
manifeste une activité protéolytique de presque de 190 ug/ml et
presque de 10 ug/ml pour la plante sauvage.
|
4 0 0
3 0 0
|
|
|
|
|
Plante sauvage
Plante cultivée
P ré s u re
|
|
2 0 0
1 0 0
0
|
|
|
|
|
|
|
|
|
Figure 34. Activité protéolytique de deux
extraits des fleurs comparée avec celle de la
présure
Les résultats ont montré que l'activité
protéolytique est plus élevée quand la concentration est
élevée. Il n'y a pas d'activité pour la concentration de
25% pour l'extrait de fleurs de la plante cultivée et celle de l'extrait
de fleurs de plante sauvage est plus petite.
Plusieurs auteurs ont parlé de l'activité
excessive de l'extrait floral comparée à celle de la
présure animale, (Cordeiro et al., 1994). Ils ont montré que
l'extrait des fleurs de cardon a
54
une activité protéolytique trois fois plus
importante que celle de la présure animale. Le même
résultat était constaté par (Macedo et al., 1993). Quant
à Roseiro et al., 2003) et Claverie-MartÌn et
Vega-Hernàndez (2007) ont mentionné que l'activité
protéolytique des extraits des fleurs du genre Cynara est
environ le double de celle de la présure traditionnelle.
Par contre, nos résultats de l'activité
protéolytique d'extrait floral comparée à celle de
l'activité de présure microbienne issu du champignon
Rhizomucor miehei ont montré que l'activité d'extrait
floral reste très inférieure à celle de la présure.
Cette contradiction des résultats peuvent être due par le fait que
nos extraits sont utilisés à l'état brut ou la
méthode d'extraction non appropriée. D'où la
nécessité d'optimiser toutes techniques afin d'en déduire
les conditions propices.
III.5. Détermination de l'activité
coagulante
Cette partie est centrée sur la détermination du
temps de floculation (Tableau 13) après avoir ajouté 1ml de
l'extrait enzymatique brut des fleurs dans 10 ml de lait frais de vache
utilisé à une température de 35°C avec un pH de
6,4.
Tableau 13. Temps de floculation différents selon
les concentrations de l'extrait et de
présure
|
concentration
|
5 min
|
10 min
|
15 min
|
25 min
|
40 min
|
1h
|
|
Présure
|
100%
|
_
|
_
|
_
|
_
|
_
|
+
|
|
75%
|
_
|
_
|
_
|
_
|
_
|
+
|
|
50%
|
_
|
_
|
_
|
#177;
|
+
|
+
|
|
25%
|
_
|
_
|
#177;
|
+
|
+
|
+
|
|
Extrait sauvage
|
100%
|
#177;
|
+
|
+
|
+
|
+
|
+
|
|
75%
|
#177;
|
+
|
+
|
+
|
+
|
+
|
|
50%
|
_
|
#177;
|
+
|
+
|
+
|
+
|
|
25%
|
_
|
#177;
|
#177;
|
+
|
+
|
+
|
|
Extrait cultivé
|
100%
|
#177;
|
+
|
+
|
+
|
+
|
+
|
|
75%
|
_
|
+
|
+
|
+
|
+
|
+
|
|
50%
|
_
|
#177;
|
+
|
+
|
+
|
+
|
|
25%
|
_
|
#177;
|
+
|
+
|
+
|
+
|
Légende : #177;: première apparition des
flocons lors de la coagulation ,
· + : coagulation totale ,
· _
: Absence de coagulation.
Le temps de floculation permet de bien déduire la force
coagulante de chaque extrait afin de comparer l'activité coagulante des
deux extraits des fleurs avec celle de la présure en fonction des
différentes concentrations.
55
En effet, le temps de floculation diffère selon la
nature de l'extrait utilisé (Tableau 13). Il est de 5 min pour l'extrait
de fleur de la plante sauvage pour les concentrations de 100% et 75%. Il est de
même pour l'extrait de fleur de la plante cultivée mais seulement
à 100%. Quant à la présure microbienne, nous constatons
que le temps de floculation est très élevé (15 min) avec
une concentration moins élevée (25%).
Nous remarquons qu'avec le temps, la coagulation a
été très complète (Figure 34) selon la
concentration de l'extrait des fleurs et de présure. Ces
résultats sont confirmés aussi par (Chazarra et al.,
2007; García et al., 2015) attestant que la coagulation du lait
dépend également de la concentration d'enzyme. En effet, le temps
de coagulation du lait diminue avec l'augmentation de la concentration en
enzyme. Elle dépend aussi du pH du substrat autour de 4, sans
différence significative du pH étudié entre (3-7) comme
l'indiquent Chazarra et al (2007), Zikiou (2013) et Zikiou et Zidoune (2019)
.Ces auteurs montrent que pour l'extrait des fleurs de cardon,
l'activité passe de 4,16 U.P à pH=5,0 pour se stabiliser à
0,2 U.P. à pH 7,0.

Figure 35. Coagulation totale du lait après
incubation au bain marie
L'activité coagulante pour l'extrait des fleurs (plante
sauvage et cultivée) est de 0,333 UP tandis qu'elle est faible pour la
présure microbienne utilisée comme témoin (0,111 UP).
Certains auteurs (García et al. 2015) ont trouvé
des résultats montrant qu'il y a une différence entre
l'activité coagulante avec l'extrait de la fleur sauvage et
cultivée : l'activité coagulante de l'extrait d'artichaut (plante
cultivée) (46 IMCU ml/1) était
56
inférieure à celle d'extrait de chardon (plante
sauvage) (61 IMCU ml/1) contrairement à ceux qu'on a trouvé
où l'activité coagulante de l'extrait de la plante
cultivée est la même que pour la plante sauvage mais la
différence est remarquable lorsque on dilue les deux extraits. Nos
résultats sont aussi inférieurs à ceux trouvés par
Zikiou et Zidoune (2019) dont l'activité coagulante est de 3,23 UP pour
1 ml de l'extrait. Cette activité peut être due à d'autres
composés contenus dans notre extrait d'où la nécessite de
faire une purification pour avoir des résultats similaires.
D'autres études sur les extraits végétaux
du même genre Cynara montrent des effets intéressants
lors de la fabrication du fromage. Comme l'indique Fernández-Salguero et
Sanjuán (1999) que l'hydrolyse de la caséine s'est
avérée beaucoup plus étendu et plus rapide dans les
fromages fabriqués en utilisant de la présure
végétale (la quantité d'azote soluble à 60, 80 et
100 jours d'affinage était supérieur de plus de 28% à
celui obtenu avec du fromage produit avec de la présure animale).
| 


