|
|
RÉPUBLIQUE DU CAMEROUN
N
PAIX-TRAVAIL-PATRIE
*********
UNIVERSITÉ DE DSCHANG
*********
École Doctorale
|
|
REPUBLIC OF CAMEROON
PEACE-WORK-FATHERLAND
*********
UNIVERSITY OF DSCHANG
*********
Post Graduate School
|
|
RÉPUBLIQUE DU
CAMEROUN
PAIX-TRAVAIL-PATRIE
*********
UNIVERSITÉ DE DSCHANG
*********
École Doctorale
|
|
REPUBLIC OF CAMEROON
PEACE-WORK-FATHERLAND
*********
UNIVERSITY OF DSCHANG
*********
Post Graduate School
|
DSCHANG SCHOOL 0F SCIENCES AND TECHNOLOGY
UNITÉ DE RECHERCHE DE MICROBIOLOGIE ET DES SUBSTANCES
ANTIMICROBIENNES
(URMSA)
PREVALENCE DE L'OBESITE ABDOMINALE ET ANTIBIORESISTANCE
CHEZ LES PATIENTS SOUFFRANT DES INFECTIONS ENTERIQUES VENUS EN CONSULTATION A
L'HOPITAL AD-LUCEM DE MBOUDA
SUJET :
Mémoire soutenu publiquement en vue de l'obtention du
Diplôme de Master en Biochimie
Option : Biochimie Clinique
Par :
GUISSERBE YAWALLE
Matricule : CM-UDS-16SCI1057
Licence en Sciences Pharmaceutiques
Sous la direction de :
KUETE Victor
Professeur
Année académique 2018-2019
FICHE DE CERTIFICATION DE L'ORIGINALITE DU TRAVAIL
|
Je soussigné GUISSERBE YAWALLE atteste
que la présente thèse est le fruit de mes travaux de recherche
effectués dans le Laboratoire de Biochimie, d'Hématologie et de
Bactériologie de l'hôpital AD-LUCEM de Mbouda en collaboration
avec l'Unité de Recherche de Microbiologie et des Substances
Antimicrobiennes (URMSA), du Département de Biochimie de
l'Université de Dschang, sous la direction du Professeur KUETE
Victor.
Cette thèse est authentique et n'a pas
été antérieurement présentée pour
l'acquisition de quelque grade universitaire que ce soit.
L'auteur :
Le..................................
GUISSERBE YAWALLE
Le directeur :
Le..................................
Professeur KUETE Victor
(Professeur)
Je dédie ce travail à
Mon feu père YAWALLE MEUGUIRI
et
Ma mère MAGOU Rosalie
Avant tout, je remercie le Dieu Tout Puissant pour m'avoir
donné la force, la foi et de m'avoir permis d'arriver à ce
stade.
Au terme de ce travail, je tiens à exprimer ma profonde
reconnaissance et gratitude au Pr KUETE Victor, pour m'avoir accepté
dans son équipe de recherche et d'avoir dirigé ce mémoire
de master. Qu'il me soit permis de vous remercier pour votre encadrement
scientifique, vos conseils précieux et pour m'avoir indiqué les
bienfaits du travail en équipe. Toute ma reconnaissance pour l'excellent
encadreur que vous avez été pour moi.
J'exprime ma profonde et respectueuse gratitude au Pr KUIATE
J-R. pour ses conseils et ses encouragements.
Je tiens à dire particulièrement merci au Dr
MBAVENG TSAFACK Armelle pour tout son soutien multiforme.
J'adresse mes remerciements aux enseignants du
Département de Biochimie : Pr GATSING D., Pr TELEFO P. B., Pr ZAMBOU N.
F., Pr WOMENI H. M., Pr TUME C. B., Pr DZOYEM J. P., Pr SIMO G., Pr KOUITCHEU
M. L. B., Pr TAMOKOU J. D. D., Dr KENGNE N.A.P., Dr KUATE D., Dr AGBOR E. E.,
Dr NJATENG G. S. S., Dr BIAPA N. P. C., Dr KLANG M. J., Dr INNOCENT M. A., Dr
NGOH N. G. B., Dr KAKTCHAM P. M., Dr GOKA C. M.S.et M. GUETIYA W. R. Pour leur
disponibilité tout au long de la réalisation de ce travail, je
tiens à remercier
J'adresse ma reconnaissance à M. MARBOU J.T.Wpour ses
conseils, encouragements et son aide qui a rendu possible la collecte de mes
échantillons, soyez rassurés de ma profonde gratitude.
Les ainés de l'équipe de recherche à
laquelle j'appartiens, à savoir Dr FANKAM A. G., Dr TANKEO S. B., Dr
VOUKENG I. K., Dr SEUKEP A., Dr DJEUSSI D., M. DZOTAM J., Mme NGALANI O. ;
plus particulièrement M. WAMBA N. E. B., M. NAYIM P., Mme MANEKENG T.
H., Mme NGUENANG S. G., pour vos conseils et encouragement,
Merci à tous mes camarades de promotion ASSAFACK B,
NGUEFACK N J, BISSO TATAH P, N. B., DJENGUEMTAR J., FEUDJIO A. F., FEUDJIO H.
B. L., KUATE T. C. R., MACHE R. A., NFOR G. N., SAMBA M. A. R. pour tous les
moments d'échanges et de convivialité pendant la
réalisation de ce travail.
J'adresse toute ma reconnaissance à mon grand
frère TAIKI Y et ma belle-soeur TELBE B E. Je vous remercie pour votre
aide très précieuse, pour votre gentillesse. Trouvez ici
l'expression de ma profonde gratitude.
Mes frères et soeurs, PAYANG Y, HOUSSOUBE Y, ZEMAYE Y,
TAMINBE.R. et GEBBAY, je vous remercie pour votre soutien, vos prières
en ma faveur et vos encouragements durant les moments difficiles de ce
travail.
Je remercie sincèrement tous mes amis : MBAILASSEM
B., ABDOU D., BADAWE G., NODJIHITEBAYE T., SERYABE L., ETOUKE B T, HOUCHIAKNE
G., MANDO S. R., MASSAO B., TEOBA N., TARINAN A., ALLAGUERNE C. et. Je n'aurai
jamais pu réaliser ce travail sans votre soutien. Merci pour tout.
Je remercie du fond du coeur NDAMNSA F, aucun mot ne peut
exprimer ma reconnaissance pour tout ce que tu as fait pour moi dans le cadre
de la réalisation de ce travail.
Je ne saurais clore mes remerciements sans penser à
tous ceux qui m'ont soutenu et dont les noms ne sont pas mentionnés
ici.
AMC : Amoxicilline +acide
clavulanique
AMP: Adenosine Monophosphate
AMX: Amoxicilline
ATB: Antibiotique
CAZ: Ceftazidime
CDC: Center of Disease
Control
CHL: Chloramphénicol
CIP: Ciprofloxocine
COT : Cotrimoxazole
CPD: Cefpodoxime
CRP: Protéine C-Réactive
CSCQ: Centre Suisse de Contrôle
Qualité
CTR: Ceftriaxone
DOX: Doxycycline
GEN: Gentamycine
HDL-C: High Density Lipoprotein
Cholesterol
HTA: Hypertension Artérielle
IgA: Immunoglobuline A
IgG: Immunoglobuline G
IMC : Indice de Masse Corporelle
INSPQ : Institut National de
Santé Publique du Québec
LDL-C: Low Density Lipoprotein
Cholesterol
MDR:
Multi-Drug-Resistance
NIT: Nitrofurantoin
SRAA : Système
Rénine-Angiotensine-Aldostérone
NOR: Norfloxacine
OIE: Office International des Epizooties
OMS : Organisation Mondiale de la
Santé
SAS: Syndrome d'Apnée de Sommeil
SDR:
Specific-Drug-Resistance
TG: Triglyceride
UNICEF: Fonds des Nations Unies pour
l'Enfance
WHO: World Healht
Organization
TABLE DES MATIERES
FICHE DE CERTIFICATION DE L'ORIGINALITE DU
TRAVAIL
i
DEDICACES
ii
REMERCIEMENTS
iii
LISTE DES ABRIEVIATIONS
v
LISTE DES TABLEAUX
v
LISTE DES ANNEXES
vi
RESUME
vii
ABSTRACT
viii
INTRODUCTION
1
CHAPITRE I : REVUE DE
LITTERATURE
3
I.1.GENERALITE SUR L'OBESITE ABDOMINALE
4
I.1.2.Données épidémiologiques
sur l'obésité abdominale
4
I.1.3.Différents Types
d'obésités
5
I.1.4. Facteurs favorisant le développement
de l'obésité
6
I.1.5.Evaluation de l'obésité
9
I.1.6. Traitement de l'obésité
10
I.1.7.Les conséquences de
l'obésité
12
I.2. TRACTUS GASTRO-INTESTINAL ET
INFECTIEUSES BACTERIENNES
16
I.2.1. Données
épidémiologiques
16
I.2.3. Fonctions du tractus gastro-intestinal
16
I.2.4. Maladies entériques d'origine
bactérienne
17
CHAPITRE II : MATERIEL ET
METHODES
26
II.1.MATERIEL
27
II.1.1.Site d'étude
27
II.1.2.Type, période et population
d'étude
27
II.1.3.Taille d'échantillon
27
II.1.4. Echantillonnage
27
II.1.5 Matériel biologique
28
II.1.6. Réactifs
28
II.1.7.Appareils
28
II.1.8.Milieux de culture et antibiotiques
29
I.2.METHODES
29
II.2.1.Prélèvement des selles et du
sang des patients
29
II.2.4. Antibiogramme
35
II.3 ANALYSES STATISTIQUES
37
CHIPITRE III : RESULTATS ET
DISCUSSION
38
III.1.RESULTATS
39
III.1.1.Caractéristique
sociodémographiques de la population
39
III.1.2.Variation des paramètres
sociodémographiques en fonctions du statut obésité
abdominale
40
III.1.3. Variation des paramètres biologiques
en fonction du sexe et du statut obésité abdominale
41
III.1.4. Variation des paramètres biologiques
en fonction de la tranche d'âge et du statut obésité
abdominale.
43
III.1.5. Distribution des isolats bactéries
dans la population d'étude
44
III.1.6. Distribution des isolats bactériens
en fonction du statut obésité abdominale
45
III.1.7. Distribution de la résistance des
isolats bactériens en fonction du statut obésité
abdominale
46
III.1.8. Distribution de la multi-résistance
des isolats bactériens en fonction du statut obésité
51
III.2. DISCUSSION
52
CONCLUSION, RECOMMANDATIONS ET
PERSPECTIVES
55
REFERENCES
57
ANNEXES
69
Figure 1 : Structure et
aspect microscopique des Enterobacteriaceae
2
Figure 2: Les
différents mécanismes de résistance aux antibiotiques
utilisés par une bactérie Gram-négative
25
Figure 3 :
Répartition de la population d'étude en fonction de la tranche
d'âge.
39
Figure 4 : Distribution
des isolats bactériens dans la population d'étude
45
Figure 5 : Distribution
des isolats bactériens en fonction du statut obésité
46
Figure 6 : distribution
de la multi-résistance en fonction du statut obésité
abdominale
51
Tableau I :
Critères d'identification biochimiques des
bactéries isolées
2
Tableau II :
Critères d'identification biochimiques des
Staphylococcus sp isolées
35
Tableau V :
Répartition des paramètres sociodémographiques en fonction
du statut obésité abdominale
41
Tableau VI : Variation
des paramètres biologiques en fonction du sexe et du statut
obésité abdominale
42
Tableau VII : Variation
des paramètres biologiques en fonction de la tranche d'âge et du
statut obésité abdominale
44
Tableau VIII :
Résistance de E. coli (n=81) en fonction du statut
obésité abdominale.
47
Tableau IX :
Résistance de Shigella sp (n=14) en fonction du statut
obésité
48
Tableau
X : Résistance de Salmonella
sp (n=24) en fonction du statut obésité
49
Tableau XI :
Résistance de Proteus sp (n=28) en fonction du statut
obésité abdominale
50
Tableau XII :
Résistance de Staphylococcus sp (n=32) en fonction du statut
obésité abdominale
51
Annexe 1: Résultats
complets des patients obèses
b
Annexe
2:résultats complets des patients non obeses
e
Annexe 3 :Nombre
d'isolats sensibles, intermédiaires et résistants aux
antibiotiques testés chez les patients obèses
i
Annexe 4: Nombre d'isolats
sensibles, intermédiaires et résistants aux antibiotiques
testés chez les patients non obèses
j
Annexe 5 : notice
d'information
k
Annexe 6: consentement du
participant
m
Annexe 7 : fiche
d'enquête clinique
n
Annexe 8: Clairance
éthique
p
Les maladies entériques sévissent dans les pays
de l'Afrique sub-saharienne sur des modes endémiques et/ou
épidémiques, avec des taux de mortalité encore trop
élevés malgré les efforts déployés par l'OMS
et l'UNICEF grâce au programme de lutte contre les maladies
diarrhéiques. L'obésité abdominale ou viscérale
elle, est une maladie multifactorielle et souvent considérée
comme la résultante d'un déséquilibre entre l'apport
alimentaire et la dépense énergétique. Existe-t-il un lien
entre les bactéries entériques résistantes et
l'excès des graisses viscérales des patients obèses ?
L'objectif dans ce travail était d'étudier la prévalence
de l'obésité abdominale ainsi que la sensibilité des
bactéries responsables des infections entériques chez les
patients venus en consultation à l'Hôpital AD-LUCEM de Mbouda
à fin de fournir des données permettant d'améliorer leur
prise en charge. Pour atteindre cet objectif, le profil de
susceptibilité des bactéries isolées chez les patients
souffrant d'infections entériques et présentant un
caractère obese a été établi.
Une étude transversale a été
effectuée de Février à Juin 2018 sur 115 patients
souffrant d'infections entériques dont 58 patients étaient obeses
; le dosage du glucose (par réaction enzymatique), la mesure du
périmètre abdominale, de même que celui de la
protéine C-réactive (par réaction immunologique) ont
été réalisé. Les bactéries ont
été isolées des selles et identifiées au moyen des
galeries Api 20E, par la suite, un antibiogramme a été
effectué par diffusion sur milieu solide.
Par ces techniques nous avons montré que la
prévalence de l'obésité abdominale était de 50,43%
dans la population générale, soit 19,13% chez les hommes et
31,30% chez les femmes.
Les résultats obtenus après culture des selles
ont révélé que la souche dominante la plus
représentative des agents pathogènes du tube digestif des
patients était Escherichia coli avec 65,52% chez les obeses et
75,44% chez les non obeses.
D'après les résultats de l'antibiogramme, 38,54%
des patients obèses et 32,40% des patients non obèses avaient
développé une multi-résistance aux antibiotiques usuels
(résistance à au moins trois familles d'antibiotiques
différentes).
Au vue de ses résultats, nous pouvons dont
déduire que l'obésité abdominale augmente la
multi-résistance bactérienne. Ce qui confirme l'importance de sa
prise en charge particulière.
Mots clés : Obésité
abdominale, anti-bio-résistance, bactéries entériques,
prévalence et Mbouda
Enteric diseases are prevalent in sub-Saharan African
countries in endemic and / or epidemic modes, with mortality rates still too
high despite the efforts of WHO and UNICEF through the control program
diarrheal diseases. Abdominal or visceral obesity is a multifactorial disease
and often considered as the result of an imbalance between food intake and
energy expenditure. Is there a link between resistant enteric bacteria and
excess visceral fat in obese patients? The objective in this work was to study
the prevalence of abdominal obesity as well as the sensitivity of bacteria
responsible for enteric infections in patients who came for consultation at
AD-LUCEM Hospital Mbouda in order to provide data allowing improve their care.
To achieve this objective, the susceptibility profile of bacteria isolated from
patients with enteric and obese infections has been established.
A cross-sectional study was carried out from February to June
2018 on 115 patients suffering from enteric infections of which 58 patients
were obese; the determination of glucose (by enzymatic reaction), the
measurement of the abdominal perimeter, as well as that of the C-reactive
protein (by immunological reaction) were carried out. The bacteria were
isolated from the stool and identified by means of Api 20E galleries, after
which an antibiogram was performed by diffusion on solid medium.
Using these techniques we have shown that the prevalence of
abdominal obesity was 50.43% in the general population, 19.13% for men and
31.30% for women.
The results obtained after stool culture revealed that the
dominant strain most representative of the pathogens of the digestive tract of
the patients was Escherichia coli with 65.52% in the obese and 75.44% in the
non obese.
According to the results of the antibiogram, 38.54% of obese
patients and 32.40% of non-obese patients had developed a multi-resistance to
usual antibiotics (resistance to at least three families of different
antibiotics).
In view of its results, we can deduce that abdominal obesity
increases bacterial multi-resistance. This confirms the importance of its
special care.
Key words: Abdominal obesity,
anti-bio-resistance, enteric bacteria, prevalence and Mbouda
Les maladies entériques d'étiologie infectieuses
représentent selon l'institut national de santé publique du
Québec (INSPQ, 2017), un fardeau significatif parmi l'ensemble des
maladies infectieuses. Dans les pays de l'Afrique sub-saharienne, les maladies
entériques sévissent sur des modes endémiques et/ou
épidémiques, avec des taux de mortalité encore trop
élevés malgré les efforts déployés par
l'organisation mondiale de la santé (OMS) et le Fonds des Nations unies
pour l'enfance (UNICEF) grâce aux programmes de lutte contre les maladies
diarrhéiques (INSPQ, 2017). Parmi ces maladies entériques, les
infections à Salmonella, Shigella, E.coli,
Vibrio cholerae et Rotavirus restent encore un
problème majeur de santé publique (INSPQ, 2017) ; les
infections entériques avec ou sans diarrhées ont des effets
profonds sur l'absorption intestinale, la nutrition tout comme la
mortalité globale (Petri et al. 2008). L'espoir de
contrôle de ces maladies entériques repose sur l'usage des
antibiotiques, qui inhibent ou détruisent la croissance
bactérienne, sans affecter l'hôte (cellules eucaryotes) (Office
International des Epizooties, OIE, 2015). Mais ces dernières
années, certaines bactéries ont démontré une
résistance partielle ou totale vis-à-vis de nombreuses classes
d'antibiotiques constituant un problème de santé publique (OIE,
2015). Ensemble avec l'organisme, ces bactéries forment un
système qui fonctionne en symbiose, et par ailleurs, elles interviennent
sur le transit intestinal, le métabolisme du cholestérol, et la
dégradation des nutriments (lipides, glucides, protides) (Kristell,
2010). Cependant, les cas de rupture de l'équilibre homme-microbiote,
ont permis l'avenue d'un pan nouveau de la médecine couvrant les
maladies inflammatoires parmi lesquelles l'obésité et certains
aspects de l'athérosclérose (Mounier, 2009). En cas de
dysfonctionnement métabolique, la flore intestinale peut assurer un
excès de production de nutriment énergétiques concourant
au développement d'une obésité, ou transloquer à
travers la barrière intestinale et causer une inflammation des
adipocytes causant une résistance à l'insuline
génératrice de diabète (Mounier, 2009).
L'obésité abdominale, est une accumulation
anormale ou excessive de graisse dans les tissus adipeux, pouvant engendrer de
graves problèmes de santé (OMS, 2006). C'est une maladie
multifactorielle et souvent considérée comme la résultante
d'un déséquilibre entre l'apport alimentaire et la dépense
énergétique (Zoltan etal., 2009). Selon le type
d'alimentation, l'intestin pourrait contribuer d'une part à la
modification de l'extraction calorique à partir des aliments, et d'autre
part, au changement de la dépense énergétique (Zoltan
etal., 2009).Plus de 1,9 milliards d'adultes de 18 ans et plus dans le
monde sont en surpoids et 600 millions sont obèses (OMS, 2014). La
prévalence de l'obésité augmente
régulièrement dans les pays industrialisés (WHO, 2001).
Parmi les patients obèses, il existe un sous-groupe
caractérisé par une accumulation sélective de graisse
intra-abdominale. Cette obésité abdominale (OA) est
identifiée comme un facteur de risque de développer des anomalies
métaboliques faisant le lit du diabète de type 2 et des maladies
cardiovasculaires (Nicklas et al., 2004). En France, La
prévalence de l'OA (tour de taille =94 cm pour les hommes et =80 cm pour
les femmes) était de 41,6% et 48,5% respectivement chez les hommes et
les femmes (Mattaetal., 2016). Au Maroc, une
étude comparative de la prévalence du surpoids, de
l'obésité et de l'obésité abdominale a
rapporté en 2014 que la prévalence globale du surpoids et de
l'obésité était respectivement 38,78% et 30,61 % et
prévalence de l'obésité abdominale était encore
plus élevée 88,76% (Sellam et al 2014). Au Cameroun,
plus de 2 millions de camerounais sont affectés par
l'obésité, d'après une récente publication, 9,6% de
la population camerounaise est obèse (OMS, 2016).
L'obésité abdominale et la présence des
bactéries résistantes aux antimicrobiens standards chez les
patients hypothèquent leur pronostic vital. Quel serait le profil de
résistance des bactéries entériques chez les patients
obèses ? De nombreux auteurs se sont déjà
intéressés aux infections entériques sous divers aspects
en occurrence épidémiologique, clinique voire
thérapeutique. A notre connaissance et jusqu'à ce jour, peu de
travaux associent l'obésité abdominale, les infections et la
multi-résistance. Ainsi, nous nous sommes proposé dans ce
travail, d'étudier l'antibiorésistance des patients obeses
soufrant d'infections entériques venus en consultation à
l'Hôpital AD-LUCEM de Mbouda à fin de fournir des données
permettant d'améliorer leur prise en charge. Plus spécifiquement,
il s'agissait pour nous de :
ü déterminer la fréquence de
l'obésité abdominale à travers la mesure du tour
taille ;
ü isoler et identifier les bactéries ;
ü déterminer le profil de résistance des
bactéries chez les patients obèses et non obèses.
CHAPITRE I : REVUE DE
LITTERATURE
|
I.1.GENERALITE SUR L'OBESITE
ABDOMINALE
L'obésité abdominale est définie comme
une accumulation anormale ou excessive de graisse dans les tissus
viscéraux, pouvant engendrer des problèmes de santé (OMS,
2003). Cette accumulation des graisses dans les tissus
viscéraux résulte non seulement d'un simple
déséquilibre énergétique entre les gains d'origine
alimentaire et les pertes résultant de l'activité physique ;
mais aussi d'autres facteurs (génétiques et environnementaux)
(Zoltan et al., 2009), elle est un problème majeur de
santé publique mondiale responsable de l'augmentation de la
prévalence de nombreuses pathologies métaboliques et
cardiovasculaires (Ng etal., 2013). Les hyperlipidémies
accompagnent l'obésité abdominale et résultent des
concentrations plasmatiques élevées de cholestérol LDL
(low-density lipoprotein) et de triglycérides (Moor et
al., 2017). Mais elles incluent aussi les valeurs anormales de
cholestérol-HDL (high-density lipoprotein) et
d'apo-lipoprotéines B et A1 (Noubiap et al., 2015).
I.1.2.Données
épidémiologiques sur l'obésité abdominale
La proportion de personnes obèses varie selon les pays
et dépend des changements environnementaux et comportementaux
apportés par le développement économique, la modernisation
et l'urbanisation. Ainsi, la variation de la prévalence de
l'épidémie de l'obésité abdominale parmi les
différentes races et les communautés peut être
attribuée à l'hérédité, à
l'âge, au sexe, au régime alimentaire, au style de vie et au
comportement (Afridi et Khan, 2004). L'obésité abdominale est
associée a une augmentation de prévalence des facteurs de risque
cardiovasculaire d'après l'étude ObEpi, 42,5 % des patients
obèses ont au moins un facteur de risque cardiovasculaire (comme une
hypertension artérielle, une hypercholestérolémie, un
diabète...) lorsque seulement 18,6 % des sujets de poids normal ont un
de ces facteurs de risque. Le profil le plus à risque cardiovasculaire
étant associé à la répartition abdominale de
l'obésité, aussi dénommée obésité
androïde ou centrale et le marqueur du risque cardiovasculaire (Dievard,
2005).
La prévalence de l'obésité se majore dans
tous les pays du monde et en France elle augmente de 5 % par an. C'est
l'obésité abdominale qui est surtout associée à une
augmentation du risque cardiovasculaire et non la seule augmentation absolue de
la masse grasse. L'excès de graisse viscérale est associée
à un profil glucido-lipidique athérogène avec une
hyper-insulinémie, une augmentation des LDL petites et denses, une
diminution du HDL, contribuant à multiplier le risque coronarien par 20
(Dievard, 2005).Chez les hommes et les femmes le tour de taille moyen a
augmenté respectivement de 3,8 cm et 6,7 en 15 ans, passant de 91,3 cm
et 79,8 cm en 1997 à 95,1 cm et 86,5 cm en 2012 (ObEpi, 2012).En
Afrique, le nombre d'obèses a pratiquement doublé, passant de 5,4
millions en 1990 à 10,6 millions en 2014. Près de la
moitié d'Asiatiques vivaient en surpoids ou obèses en 2014 (OMS,
2016).Au Cameroun, plus de 2 millions de camerounais sont affectés par
l'obésité, d'après une récente publication, 9,6% de
la population camerounaise est obèse (OMS, 2016), mais la
prévalence de l'obésité abdominale est mal connue.
Cependant, Etoundi et al. rapportent une prévalence de
l'obésité générale de 33,3 % chez les femmes du
village Foto dans la région de l'Ouest (Mandengue et al.,
2015)
I.1.3.Différents Types
d'obésités
Il existe plusieurs types d'obésité, car sous ce
terme se cachent différentes formes des maladies qui ne
présentent pas les mêmes risques (Encyclopédie Larousse,
2010).
I.1.3.1.Obésités androïdes ou
abdominales
Pour ce type, la masse grasse s'installe dans la partie haute
du corps. Cette forme serait plus dangereuse pour la santé,
entraînant plus facilement des problèmes d'hypertension, de
diabète ou des troubles cardiovasculaire (Croteau, 2007). Elle concerne
beaucoup plus les hommes que les femmes et elle est difficile à
diagnostiquer, car elle peut exister même lorsque l'IMC est normal ou peu
élevé (Encyclopédie Larousse,
2006).L'obésité abdominale (appréciée par une
augmentation de tour de taille) est un meilleur prédicateur du risque de
maladies cardio-métaboliques que l'obésité en
elle-même (évaluée par l'indice de masse corporelle). Ces
obésités sont cliniquement définies par un rapport
Taille/Hanche, inférieur à 0,85 chez la femme et supérieur
à 1 chez l'homme (Haffner, 2006).
I.1.3.2.Obésités gynoïdes ou
fémorales
Pour ce type, la masse grasse s'observe plutôt dans le
bas du corps (fesses et cuisses), elles sont caractéristiques
d'obésités féminines (Encyclopédie Larousse, 2006).
Celles-ci auraient moins de retentissements sur la santé,
entraînant principalement des problèmes articulaires ou des
insuffisances veineuses. Elles sont néanmoins plus difficiles à
vaincre que l'obésité androïde par le fait qu'elles ne se
compliquent qu'exceptionnellement en cas de diabète et très
rarement de maladies cardiovasculaires. Celles-ci se répercutent plus
à volontiers, de par la masse graisseuse totale et l'excès
pondéral, générant des complications
ostéo-articulaires et respiratoires ainsi que certaines formes
d'insuffisance cardiaque. La mesure de tour de taille, serait un meilleur
révélateur des risques liés à
l'obésité (Vulgaris médical, 2009)
I.1.3.3. Obésités mixtes
C'est une forme d'obésités combinant les deux
formes précédentes (obésité androïde et
gynoïde) (Encyclopédie Larousse, 2010).
I.1.4. Facteurs favorisant le
développement de l'obésité
L'obésité est une maladie complexe et
multifactorielle, il s'agit d'un déséquilibre sur une
période prolongée de la balance énergétique
(Ashwell etal., 1982). Il existe une très grande
inégalité interindividuelle liée à
différents facteurs. Cependant, des interactions complexes entre des
facteurs biologiques, comportementaux, sociaux et environnementaux sont
impliquées dans la régulation de la balance
énergétique (Tsigos etal., 2008);les mauvaises habitudes
alimentaires et la sédentarité semblent avoir joué le
rôle le plus déterminant dans la récente
épidémie mondiale d'obésité (Hofbauer, 2002).
I.1.4.1. Facteurs alimentaires
Selon l'OMS, des données issues de sources diverses
suggèrent que les aliments ayant une densité
énergétique élevée (riches en lipides ou en sucre
et pauvres en fibres), les boissons sucrées et une grande taille des
portions augmentent le risque d'apports énergétiques excessifs
(OMS, 2007).
I.1.4.2. Activités physiques
L'activité physique joue un rôle important dans
la régulation physiologique du poids; en particulier, elle agit sur la
dépense énergétique totale, le bilan lipidique et les
apports alimentaires. (OMS, 2003).
Les données transversales révèlent
souvent un rapport inverse entre IMC et activité physique (Rising
etal., 1994), indiquant que les sujets obèses ou
présentant un surpoids sont moins actifs que leurs homologues minces.
Toutefois, ces corrélations ne mettent pas en évidence une
relation de cause à effet et il est difficile de savoir avec certitude
si les sujets obèses sont moins actifs du fait de leur
obésité, ou si c'est leur faible degré d'activité
qui a provoqué l'obésité. En outre, la tendance
séculaire à l'augmentation de la prévalence de
l'obésité que l'on observe semble s'accompagner en
parallèle d'une diminution de l'activité physique et d'une
augmentation des comportements sédentaires (Prentice et Jebb,1995).
I.1.4.3.Les facteurs génétiques
La génétique joue un rôle important dans
le contrôle du poids corporel; ce facteur a été
prouvé expérimentalement par la mise en évidence du
gène ob codant pour la leptine, qui est une hormone peptidique de 16 kDa
ayant 167 acides aminés (Gaucher et al., 2003) régulant
le poids corporel en diminuant l'appétit et en augmentant les
dépenses énergétiques, l'insuffisance de la leptine
conduit à l'hyperphagie et à l'obésité (Zhang,
1994).
I.1.4.4.Facteurs environnementaux
Les facteurs environnementaux jouent un rôle très
important dans le développement de l'obésité. Les
modifications des habitudes de vie liées aux changements de
l'environnement contribuent à altérer l'équilibre
énergétique au profit de l'augmentation des réserves
énergétiques et du poids (Bourron et Moreau, 2014).
I.1.4.5.Sédentarisme
Le mode de vie sédentaire est un facteur important de
la survenue de l'obésité et de ce fait, la forte réduction
de l'activité physique due au développement des transports
(voiture, transports en commun, ascenseurs...) et les nouvelles technologies
(télécommandes, télévision, ordinateurs...) ne
permettent pas d'équilibrer le bilan énergétique (Hill et
Melanson, 1999 ; Hill etal., 2000)
I.1.4.6.Climatisation artificielle et chauffage
Depuis les années 1980, les nouvelles technologies ont
permis la mise en place de climatisation et de chauffage facilitant la
stabilisation de la température, corporelle. Le corps ne lutte pas
contre les variations de températures ce qui n'occasionne pas de
dépenses énergétiques importantes au niveau du tissu
adipeux brun, affaiblit le système de thermorégulation et modifie
le taux métabolique de base (Johnson etal., 2011).
I.1.4.7.Facteurs socioculturels
Les facteurs socioculturels et de niveau de vie jouent un
rôle déterminant dans la répartition des populations
à risque. La prévalence du surpoids et de l'obésité
est plus importante chez les catégories socioéconomiques les
moins favorisées aux conseils nutritionnels que les autres. De plus,
pour des raisons culturelles et économiques, elles n'ont que
difficilement accès à une alimentation équilibrée,
riche en fruits et légumes, en viandes et en poissons.
L'obésité est deux fois plus répandue au sein de ces
catégories (13,8% chez les ouvriers, 13,2% chez les employés) que
dans les catégories plus aisées (7,1% pour les cadres
supérieurs) (Faure, 2000).
I.1.4.8.Facteurs médicamenteux
L'utilisation des médicaments comme les
antidépresseurs tricycliques, lithium; bêtabloquants, sulfamides
hypoglycémiants, insuline, corticostéroïdes, cyproheptadine,
acide valproïque, neuroleptiques et certains contraceptifs
stéroïdiens, peut favoriser une prise de poids. Les adultes suivant
un traitement prolongé par les corticostéroïdes pour une
polyarthrite rhumatoïde risquent une prise de poids, puisque les effets
secondaires de ce médicament imposent une activité physique
limitée (OMS, 2003).
I.1.4.9.Facteurs psychologiques
Toutes sortes d'événements dans la vie et la
manière d'y faire face sont des facteurs déterminants. Cela peut
précipiter une personne vers une aggravation de son problème
sous-jacent comme un trouble du comportement alimentaire ou déclencher
une dépression et la perte du contrôle de soi avec une baisse de
l'estime qu'on se porte (OMS, 2003)
I.1.4.10.facteurs microbiologiques
Une nouvelle étude a montré que la composition
de la flore intestinale, ainsi que la façon dont elle est
contrôlée parle système immunitaire, peuvent jouer un
rôle majeur dans la capacité de prendre du poids (Pigenet, 2012).
La symbiose homme-microbes aboutissant à une homéostasie et une
tolérance dans l'analyse génétique, moléculaire et
cellulaire est un des grands défis de la microbiologie. De ce domaine,
en particulier dans les ruptures de cet équilibre homme-microbiote,
réside un coté nouveau de la médecine couvrant les
maladies inflammatoires de l'intestin, l'obésité, le
diabète et certains aspects de l'athérosclérose, ainsi que
certains cancers comme le cancer du côlon (Mounier etal., 2009).
La flore intestinale, dans de condition de dysfonctionnement
métaboliques peut assurer un excès de production de nutriments
énergétiques participant au développement d'une
obésité, ou transloquer à travers la barrière
intestinale et causer une inflammation des adipocytes causant une
résistance à l'insuline génératrice de
diabète (Mounier etal., 2009).
Les acides gras insaturés sont activateurs des
macrophages qui en retour peuvent stimuler la lipolyse, mais les repas riches
en graisses et hydrates de carbone induisent une endotoxinemie stimulant les
macrophages, d'autant plus que dans l'obésité la chute de
l'adiponectine ne les protège pas (Bernard, 2013). Parallèlement
le même profil alimentaire induit des changements profonds dans le
microbiote intestinal, augmentant la perméabilité de la
barrière intestinale, ce qui facile l'entrée d'antigènes
microbiens bien à même de stimuler les défenses
immunitaires (Bernard, 2013).
I.1.5.Evaluation de
l'obésité
Le diagnostic d'une obésité abdominale passe par
l'évaluation de plusieurs paramètres :
I.1.5.1. Indice de Masse Corporelle (IMC)
C'est l'indice le plus couramment utilisé en pratique
clinique pour définir le surpoids ou classer l'obésité. Sa
définition a été établie par les compagnies
d'assurances Américaines sur les courbes de mortalité aux
Etats-Unis, puis confirmée par les études
épidémiologiques européennes. C'est le rapport du poids
(en kilogrammes) sur le carré de la taille (en mètre
carre) : IMC (kg/m²) = Poids (kg)/ Taille² (m²) (WHO,
2001).
I.1.5.2. Mesure du périmètre abdominal
Le périmètre abdominal (ou tour de taille) est
une mesure pratique et simple, sans rapport avec la taille (Popkin
etal., 1995), qui est en corrélation étroite avec l'IMC
et le rapport tour de taille/tour de hanches (Horton etal., 1995) et
qui constitue un indicateur approximatif de la masse grasse intra abdominale
(Flatt etal., 1985 ; Flatt, 1988) et de lamasse grasse totale (Schutz
etal., 1989). En effet, quelle que soit l'accumulation de masse grasse
totale, les hommes ont en moyenne deux fois plus de graisse abdominale que les
femmes non ménopausées (Lemieux etal., 1993).
L'obésité abdominale est définie selon les recommandations
de la Haute Autorité de Santé (HAS) par un tour de taille = 94 cm
pour les hommes et = 80 cm pour les femmes (HAS, 2011).
I.1.5.3.Formule de Lorentz ou poids théorique
Elle permet d'estimer le poids théorique d'un individu,
elle se définit comme: Poids théorique (kg)=Taille -100 -[(Taille
-150)/A], A égale à 4 pour une femme et 2 pour un homme.
L'obésité est définie par une valeur supérieure de
20% à ce poids théorique (OMS, 2003).
I.1.5.4. Rapport taille sur hanche (RTH)
A partir de la mesure du périmètre abdominal, on
peut calculer le rapport Taille sur Hanche. Ce rapport permet d'étudier
la répartition du tissu adipeux et de qualifier le morphotype de
l'obésité. Ainsi, la mesure du périmètre abdominal
et le RTH permettent de typer l'obésité, selon la
répartition du tissu adipeux (OMS, 2003).
I.1.5.5. Protéines c-réactive ou CRP
L'immunité non spécifique est
caractérisée par l'inflammation immaculée par la
présence dans le sang des marqueurs de l'inflammation. La
protéine C-réactive (CRP) est l'une des protéines
produites par les hépatocytes pendant une réaction inflammatoire
(Rdker, 2003). Son taux sanguin normal est inférieur à 6 mg/l. Sa
concentration augmente très rapidement lors d'une infection
bactérienne que lors d'une infection virale ou parasitaire (CSCQ, 2015).
Selon le Centre Suisse de Contrôle Qualité, une concentration
comprise entre 6 et 40 mg/l fait suspecter une infection virale ou parasitaire
tandis qu'une concentration supérieure à 40 mg/l est en
générale le signe d'infections bactériennes (CSCQ,
2015).Toutefois, il est à noter que la CRP seule ne permet pas de faire
un diagnostic précis bien qu'il permet de dire clairement qu'il y a une
attaque bactérienne. Les infections bactériennes et fongiques
provoquent une forte augmentation de la concentration sanguine de CRP
comparées aux infections virales (Peltola et Jaakkola, 1987). Dans de
cas signalés de l'obésité abdominale, un certains nombres
de traitements sont à envisager.
I.1.6. Traitement de
l'obésité
L'obésité abdominale est une maladie chronique
et récidivante relevant d'un traitement au long cours, qui ne se limite
pas sur la simple prescription d'un régime. Différents
éléments conditionnent les choix stratégiques :
l'importance de l'obésité abdominale, ses déterminants et
conséquences, les comorbidités et le stade évolutif (WHO,
2001). En effet, il existe de très nombreux traitements contre
l'obésité abdominale, notamment les traitements non
médicamenteux, les traitements pharmacologiques et la chirurgie.
I.1.6.1. Traitement non médicamenteux
Plusieurs éléments peuvent contribuer à
la diminution du poids : les pratiques d'activité physique, le
contrôle du régime alimentaire et les interventions
psychologiques.
I.1.6.1.1. Activités et exercices physiques
L'activité physique a de nombreux effets
bénéfiques quels que soient le tour de taille et l'âge.
Pour perdre du poids il est plus efficace d'associer l'exercice physique au
régime que de faire l'un ou l'autre isolément (Skender
etal., 1996); l'exercice physique limite également la perte de
tissu maigre au cours des régimes amaigrissants (Garrow et Summerbell,
1995) et limite la reprise de poids (Wing, 1992 ; Skender et al.,
1996).
I.1.6.1.2. Prise en charge alimentaire
Globalement les mesures diététiques sont
à mettre en place systématiquement en prévention
secondaire, et dès lors que le LDL-cholestérol dépasse 1,3
g/l ou la triglycéridémie dépasse 1,5 g/l en
prévention primaire (Moulin et Vergès, 2016). Une modification du
style de vie individualisée combinant activité physique, apports
alimentaires encadrés et pas forcément centré sur la perte
de poids pourrait avoir un impact sur le risque de maladies cardiovasculaires
à long terme. Ce sont les recommandations consistant à mettre en
place une diététique de type diète
méditerranéenne avec consommation abondante d'huile d'olive et de
fruits à coque qui ont le niveau de preuve le plus élevé
actuellement (Moulin et Vergès, 2016). Il est très important non
seulement pour des patients dyslipidémies mais aussi pour des personnes
saines de consommer des aliments moins transformés et pauvres en acides
gras trans, en encourageant l'utilisation d'huile végétale
à domicile, et en veillant à un approvisionnement adéquat
et durable des aliments riches en poisson, fruits, légumes,
céréales et noix (OMS, 2003).
I.1.6.1.3. Interventions psychologiques
La thérapie comportementale et la thérapie
comportementale cognitive visent à changer les habitudes qui contribuent
à la surcharge pondérale. D'après des études
randomisées, la combinaison d'une telle intervention et d'un
régime amaigrissant entraîne une perte de poids
supplémentaire (Shaw etal., 2005).
I.1.6.2. Traitement médicamenteux
Il fait appel à la prescription des statines ; ces
dernières se trouvent le plus souvent nécessaire en cas de haut
risque et possibles aussi en cas de risque intermédiaire (Downs et
O'Malley, 2015). Commencer par une posologie faible et l'augmenter en fonction
de l'efficacité et de la tolérance (Simvastatine 20 à 40
mg ; Pravastatine 40 à 80 mg ; Lovastatine 20 à 80 mg
et Atorvastatine 10 mg) (Downs et O'Malley, 2015). Une cible de
LDL-cholestérol inférieure à 0,70 g/l est
préconisée ; si elle n'est pas atteinte sous
monothérapie avec une dose maximale tolérée de statines,
l'adjonction d'Ezetimibe sera envisagée (Moulin et Vergès, 2016).
En cas d'effets secondaires avec une forte dose de statine ou une association
statine-Ezetimibe, l'utilisation d'une dose modérée de statine
avec une cible de LDL-cholestérol inférieure à 1 g/l est
préconisée. En cas d'intolérance aux statines, une
monothérapie par Ezetimibe sera employée (Moulin et
Vergès, 2016).
Le Xenical® (orlistat) est
proposé dans le traitement des obésités importantes, en
complément des règles diététiques; en effet, il
s'agit d'un dérivé semi-synthétique de la lipstatine qui
agit dans la lumière du tube digestif en se liant de façon
covalente aux résidus sérine des récepteurs gastrique et
pancréatique de la lipase et s'oppose à l'absorption des graisses
(Guerciolini, 1997).
Le rimonabant est un inhibiteur des
récepteurs aux cannabinoïdes de type I. Il permet une
réduction significative du poids ainsi que des troubles
métaboliques associés (diabète, dyslipidémies) (Van
Gaal etal., 2005). L'utilisation de ce médicament permettrait
de diminuer le tour de taille et d'améliorer les taux en HDL
cholestérol et en triglycérides (Padwal et Majumdar, 2007).
I.1.6.3.Traitements chirurgicaux
Plusieurs méthodes chirurgicales sont utilisées
pour traiter l'obésité abdominale. On estime aujourd'hui que la
chirurgie gastrique est le traitement le plus efficace pour faire perdre du
poids et maintenir cette perte de poids chez des sujets dont
l'obésité est grave ou très grave. En se basant sur le
coût/kg de poids perdu, on a estimé qu'au bout de 4ans, le
traitement chirurgical était moins onéreux que n'importe quel
autre traitement (Kral, 1995).Le ballon intra-gastrique est un traitement
mécanique de l'obésité abdominale. Il consiste en la mise
en place temporaire (six mois) d'un ballon intra-gastrique gonflé
à l'eau ou à l'air et qui entraîne une distension gastrique
favorisant la satiété et permettant de diminuer les ingesta
(Coffin, 2011). Les conséquences sont à noter en cas
d'échec rencontré de ces traitements ou de non traitement.
I.1.7.Les conséquences de
l'obésité
Les conséquences de l'obésité abdominale
pour la santé sont nombreuses et variées, allant d'un risque
accru de décès prématuré à plusieurs
maladies non mortelles mais débilitantes ayant des effets
indésirables sur la qualité de vie. La mortalité
s'accroît dès que e le tour de taille dépasse 80cm chez la
femme et 94cm chez l'homme et l'espérance de vie diminue d'autant plus
que cet indicateur croit (Berrington de Gonzalez, 2010). Parmi les maladies et
infections liées à l'obésité nous pouvons
citer : Les maladies cardiovasculaires, plusieurs types de cancers, le
diabète de type II, la maladie du foie gras, l'embolisme pulmonaire, le
syndrome des ovaires polykystiques, les désordres reproductifs, les
problèmes sociaux et psychologiques, l'apnée du sommeil, etc
(Hamisu et Alice, 2008)
I.1.7.1.Diabètes
Pour qu'un patient obèse développe un
diabète de type 2, il faut que la cellule â soit incapable de
compenser pleinement la baisse de sensibilité à l'insuline. La
dysfonction â-cellulaire existe d'ailleurs avant la survenue de
l'hyperglycémie chez les patients obèses à risque de
développer un diabète (Bourron, 2012). Le risque de
développer un diabète de type 2 (diabète de la
maturité) croît fortement avec tour de taille, il est
multiplié par 10 chez la femme ayant un tour de taille supérieur
à 80cm (supérieur à 94cm chez l'homme) par rapport aux
valeurs basses (Chan et al., 1994 ; Carey et al., 1997). De
la même façon, la perte de poids est associée à une
diminution du risque de diabète, particulièrement chez les sujets
obèses et en surpoids (Tuomilheto et al., 2011 ; Wannamethee
et al., 2005). À la suite des travaux de Reaven (1988), de
nombreux auteurs considèrent d'ailleurs que le tour de taille est un
indicateur qui pourrait être plus pertinent que l'IMC pour le risque de
diabète : l'élévation du tour de taille serait
l'élément central du syndrome métabolique qui marque la
phase d'insulino-résistance accompagnant le développement du
diabète de type 2.
I.1.7.2.Hypertensions
La progression de l'obésité dans le monde est en
grande partie responsable de l'hypertension artérielle (HTA) (Pathak
et al., 2007). Les travaux de Wolf et al. (1997) ont
démontré que le risque d'HTA est plus de 5 fois supérieure
chez les sujets obèses que chez ceux ayant un poids normal. La relation
positive entre le tour de taille et la pression artérielle systolique et
diastolique était décrite par Kannei et al. (1967). Les
travaux de Dyar et al. (1989) ont montré que la relation
positive IMC-Pression Artérielle était indépendante de
l'âge, de la consommation de l'alcool, du statut tabagique et de
l'excrétion de sodium et de potassium. L'effet du poids se manifeste
pour des surcharges pondérales modérées et est
considérablement accru en cas d'obésité à
distribution abdominale. Les mécanismes responsables de cette
hypertension artérielle augmentent les résistances vasculaires
périphériques ou le débit cardiaque (Pathak et
al., 2007). Cette dernière est-elle même due à la
libération de pro fibrinogène et d'inhibiteur de l'activateur du
plasminogène par les adipocytes avec une baisse de l'activateur du
plasminogène (Skurk et Hauner, 2004). La découverte des
capacités sécrétoires de l'adipocyte souligne le
rôle actif du tissu adipeux viscéral dans la genèse de
l'HTA. D'autres mécanismes sont impliqués, comme l'activation du
système sympathique, les phénomènes inflammatoires,
l'activation du système rénine-angiotensine-aldostérone
(SRAA), la dysfonction endothéliale (Pathak et al., 2007).
I.1.7.3.Cancers
Des risques plus importants de cancers de l'endomètre,
des ovaires, du col utérin et de cancer du sein chez la femme
ménopausée ont été documentés chez les
femmes obèses, tandis qu'il semblerait qu'il y ait un risque accru de
cancer de la prostate chez les hommes obèses. Cependant, l'incidence
accrue de ces cancers chez les obèses est plus importante chez ceux qui
présentent une répartition abdominale de la graisse et l'on pense
qu'elle est une conséquence directe de changements hormonaux (Schapira
et al., 1994). L'incidence des cancers gastro-intestinaux, par exemple
du cancer colorectal et du cancer de la vésicule biliaire, a
également été positivement associée au poids ou
à l'obésité dans certaines études, mais pas dans
toutes, et l'hypernéphrome a régulièrement
été associé au surpoids et à
l'obésité, surtout chez la femme (Le Marchand et al.,
1992; Wolk et al., 1996).
I.1.7.4.Dyslipidémies
Les dyslipidémies sont des maladies métaboliques
très fréquentes, caractérisées par une augmentation
des teneurs en triglycérides (TG), en cholestérol total, du
cholestérol des lipoprotéines de faible densité (C-LDL) et
une diminution des lipoprotéines de haute densité (C-HDL). Toutes
ces anomalies lipidiques contribuent à l'augmentation du risque
cardio-métabolique engendré par un excès de tissu adipeux
viscéral. Cet excès de tissu adipeux semble directement à
l'origine des dyslipidémies associée à
l'obésité abdominale en induisant une augmentation du flux
d'acides gras libres vers le foie et participant ainsi à
l'insulino-résistance (Vaessen et al., 2007).
I.1.7.5.Obésité et psychologie
Les problèmes psychologiques rencontrés chez les
obèses (les femmes étant plus touchées que les hommes)
sont plus graves chez ceux qui sont également atteints de maladies
chroniques ou de lésions, par exemple polyarthrite rhumatoïde,
cancer ou lésion de la moelle épinière (Sullivan et
al., 1993). On peut donc penser que le véritable coût social
et économique des conséquences non mortelles de
l'obésité est sérieusement sous-estimé. Colilla
et al. (2000) avaient montré que les employeurs et les autres
collègues de services considèrent souvent les hommes et femmes en
surpoids comme plus paresseux, moins compétents et incapable
d'autodiscipline, comparé aux individus non obèses.
I.1.7.6.Obésité et reproduction
L'obésité abdominale, facteur de
morbi-mortalité, est considérée comme un véritable
problème de santé publique. En gynécologie, ses
conséquences sur la fertilité et la contraception sont
sévères : infertilité, résultats décevants
en assistance médicale à la procréation (AMP), fausses
couches spontanées, malformations congénitales, complications
obstétricales et néonatales, diminution de l'efficacité
des contraceptifs oraux. Ces conséquences sont
généralement corrigées par une perte de poids obtenue par
le biais des méthodes médicochirurgicales ou comportementales
(Deruelle, 2011). Un tour de taille supérieur à
80cmmultiplié par trois le risque d'infertilité anovulatoire;
chez les femmes en simple surpoids (IMC entre 25 et 29,9 Kg/ m²), le
risque relatif est également augmente a 1,2; la prévalence du
syndrome des ovaires polykystiques est également plus forte (Lefebvre,
2008).Lorsque le tour de taille de la mère est élevé avant
la grossesse, cela prédispose statistiquement à des
bébés plus gros, et dont le foie est plus riche en graisse, ainsi
qu'à un risque augmenté de troubles du métabolisme (Modi
et al., 2011), reste à faire la part des causes
génétiques et seulement liées à
l'obésité de la mère et à comprendre les liens de
causes à effets.
I.1.7.7. Complications rénales
L'obésité abdominale est associée
à une augmentation du risque d'atteinte rénale chronique :
protéinurie et insuffisance rénale, dont la fréquence
varie en fonction des études et des analyses non ajustées de
façon systématique sur les autres facteurs de risque (Praga et
Morales, 2006). Indépendamment de l'insulino-résistance et de
l'hypertension, l'obésité abdominale pourrait avoir des effets
propres sur le rein (Navarro-Diaz et al., 2008).
I.1.7.8. Complications respiratoires
Les conséquences respiratoires des
obésités sont généralement sous-estimées et
jouent un rôle majeur dans la morbidité et la surmortalité.
Ces complications respiratoires sont le syndrome restrictif, le syndrome de
apnée de sommeil (SAS), le syndrome d'hypoventilation alvéolaire,
l'hypertension artérielle pulmonaire ainsi que l'asthme. L'augmentation
du tissu adipeux abdominal altère la fonction respiratoire :
réduction du volume expiratoire forcé, de la capacité
vitale, de la capacité totale, du volume résiduel fonctionnel et
de la réserve expiratoire. La restriction pulmonaire est due à la
diminution de la compliance de la paroi thoracique et à l'augmentation
de la pression sous-diaphragmatique en cas d'obésité abdominale.
La force des muscles respiratoires peut être diminuée ou
insuffisante (Poulain et al., 2006)
I.1.7.9. Troubles neurologiques
Les dommages psychologiques causés par le surpoids et
l'obésité abdominale constituent un lourd fardeau pour la
santé (Xu et al., 2011). Ce trouble peut aller de l'abaissement
auto-estime de la dépression clinique.
L'obésité abdominale augmente
considérablement le risque de contracter la maladie d'Alzheimer. Il
existe une forte corrélation entre le tour de taille et des niveaux
élevés d'amyloïde, c'est-à-dire la protéine
qui s'accumule dans le cerveau d'Alzheimer, détruisant les cellules
nerveuses et produit les problèmes cognitifs et comportementaux. Bien
que la nature précise de cette association reste obscure, les
changements physiologiques communs à l'obésité peuvent
favoriser la maladie d'Alzheimer et la démence (Profenno et al.,
2010 ; Mazza et al., 2011).
I.2. TRACTUS GASTRO-INTESTINAL ET
INFECTIEUSES BACTERIENNES
Une infection entérique est une infection qui se rapporte
à l'intestin grêle.
I.2.1. Données
épidémiologiques
Les maladies entériques représentent la
deuxième cause de mortalité chez les enfants de moins de 5 ans,
avec 2,5 milliards de cas estimés, conduisant à 1,5 millions de
morts chaque année (IDEA, 2015). Le «Center of Disease Control
(CDC)» estime qu'aux Etats-Unis, environ 48 millions de personnes
sont contaminées chaque année par des infections
entériques d'origines alimentaires et environ 3000 personnes en
décèdent. En 2012, 1090 cas de maladies entériques ont
été déclarés en Montérégie au canada,
et dont 82 % (894) des cas étaient d'origine bactériennes
(Gariépy etal., 2015). C'est ainsi que selon les statistiques
de l'OMS, en 2015 la région africaine enregistrait le fardeau le plus
élevé de maladies entériques d'origine
bactériennes.
I.2.3.
Fonctions du tractus gastro-intestinal
Le tube digestif possède cinq fonctions principales
(Bonaz, 2011):
· Motricité: elle assure la
propagation des aliments le long du tube digestif grâce aux muscles
lisses digestif et au plexus nerveux intrinsèque;
· Sécrétion: biliaire,
pancréatique, salivaire, gastrique, intestinale, de l'eau, des
électrolytes et de substances organiques telles que les enzymes
(indispensables à la digestion), du mucus, des immunoglobulines (IgA),
des facteurs de croissance, du cholestérol, des phospholipides, des
acides biliaires et de la bilirubine;
· Digestion (avec pour siège
principal l'intestin grêle): elle débute dès la mastication
lors de la sécrétion salivaire, se poursuit dans l'estomac, le
pancréas et dans l'intestin;
· Absorption: elle est la
résultante de flux permanents et abondants d'eau et de substance
dissoutes de la lumière du tube digestif vers le milieu extracellulaire
et inversement. Elle permet la régulation du milieu intérieur et
ceci à travers la pinocytose, la diffusion passive et les transports
actifs et passifs;
· L'immunité: la muqueuse
digestive est un environnement riche en antigènes d'origine alimentaire,
microbienne ou virale; cette muqueuse est associée à un tissu
lymphoïde et comprend les nodules lymphoïdes isolés, les
cellules lymphoïdes isolées dans la muqueuse, les IgA
sécrétoires (Bonaz, 2011).
I.2.4.
Maladies entériques d'origine bactérienne
Les infections entériques sont des maladies qui
touchent les intestins. Ces pathologies peuvent êtres causées par
les bactéries, les virus et les parasites (Majowicz et al.,
2005). Dans les cadres spécifiques des maladies d'origines
bactériennes touchant l'intestin, un nombre restreint de
bactéries provoque ces infections.
La thérapie antimicrobienne spécifique est
indiquée pour certains cas confirmés, notamment des shigelloses,
des infections à Escherichia. coli.
entéro-toxinogènes et entéro-invasives, des fièvres
typhoïdes et le choléra. La thérapie antimicrobienne peut
jouer un rôle dans la sévérité et le prolongement
des gastroentérites à Salmonella non typhique et du syndrome
hémolytique de E. coli (Hsun-Chinetal., 2014).
I.2.4.1. Bactéries responsables des maladies
entériques
L'appréciation d'une pathologie entérique
d'étiologie bactérienne repose en première intention sur
l'anamnèse et l'analyse clinique du patient. La coproculture vient
confirmer ou infirmer l'hypothèse diagnostic (Majowicz et al.,
2005). La famille des Enterobacteriaceae comprend 130 espèces
et de nombreux genres répondants aux caractéristiques suivantes:
bacilles à Gram négatif, aéro-anaérobies, mobiles
ou immobiles, facilement cultivables, exigeant une température
adéquate, fermentant le glucose, dépourvue d'oxydase
(Breed et Murray, 1937).
D'une façon générale, les
bactéries sont composées d'une paroi cellulaire, d'une membrane
plasmique et du cytoplasme. Elles sont constituées
d'éléments essentiels à leur vie qui sont regroupés
en structures constantes et inconstantes. Les structures constantes sont les
éléments que l'on rencontre obligatoirement chez toutes les
bactéries à l'exemple du chromosome, du plasmide et les
structures inconstantes ne sont retrouvées que chez certaines
bactéries à l'exemple des cils et flagelle (Deniset al.,
2007). La figure I ci-dessous nous renseigne sur la structure
bactérienne.
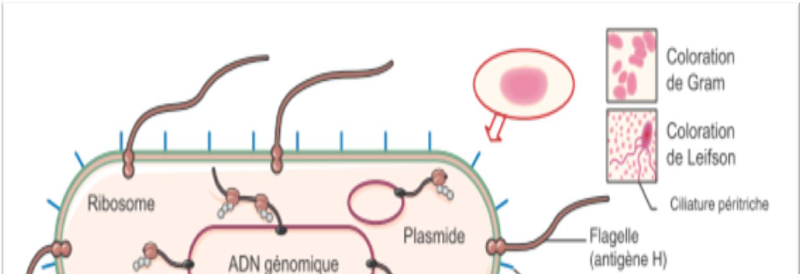
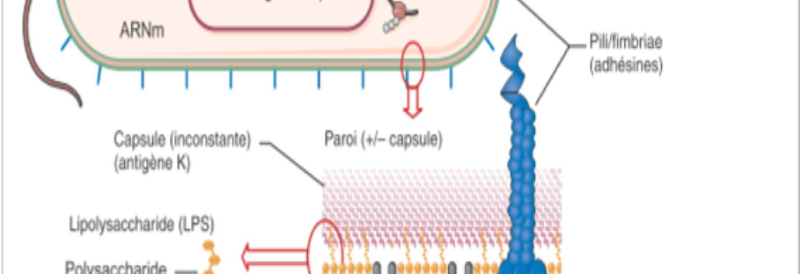
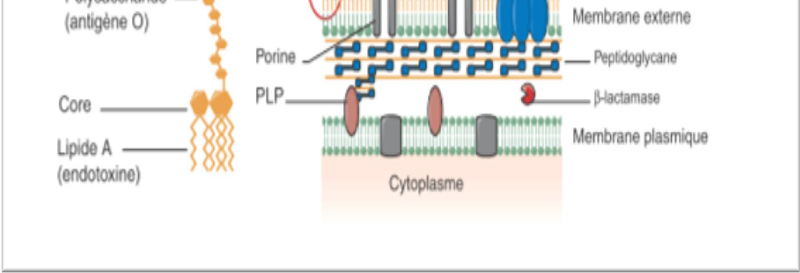
Figure 1 :Structure et aspect microscopique des
Enterobacteriaceae
(Source : Deniset al., 2007)
Les genres les plus couramment rencontrés et
isolés en bactériologie clinique sont: Eschirichia,
Klebsiella,Enterobacter, Citrobacter, Salmonella, Shigella, Serratia, Proteus,
Morganella, Providencia,(Breed et Murray, 1937).
I.2.4.1.1. E. coli
Encore appelé colibacille, c'est l'espèce la
plus fréquemment isolée dans les laboratoires de microbiologie.
Elle est aérobie, mobile, à gram négatif et commensale du
tube digestif de l'homme et des animaux (Miltgen, 2016). C'est le premier germe
impliqué dans les infections communautaires et nosocomiales.Le genre
Escherichia comprend cinq espèces: E. coli, E. albertii, E.
fergusonii, E. hermanii, E. vulneris, E. blattae. Cependant, au sein de ce
genre, l'espèce E. Coli représente la
quasi-totalité des isolats humains; elle présente une grande
diversité sur le plan génétique et de pouvoir
pathogène et responsable des diarrhées sanglantes liées
à la production de toxines, des gastroentérites infantiles, des
syndromes dysentériques avec invasion de la muqueuse intestinale (Denis
et al., 2007).
I.2.4.1.2. Salmonella sp.
Les salmonelles sont des entérobactéries du
genre Salmonella, nommées ainsi en l'honneur du médecin
vétérinaire américain Daniel Elmer Salmon (Harizi, 2009).
Ce sont des bacilles gram négatif, mobiles à ciliature
péritriche habituellement à l'exception de Salmonella
gallinarum pullorum et aérobie (Thiaw, 1998). Le nouveau
système taxonomique classe le genre Salmonella en trois espèces:
Salmonella bongori, Salmonella enterica et Salmonella
subterranea qui est une souche isolée d'un sédiment acide et
contaminé par les nitrates et l'uranium. La seconde espèce est la
plus importante comporte six sous-espèces classées sur la base de
critères phénotypiques: Salmonella enterica subsp. arizonae,
Salmonella enterica subsp. diarizonae, Salmonella enterica
subspenterica (fréquent chez l'homme et les animaux à sang
chaud), Salmonella enterica subsp. Houtenae., Salmonella
enterica subsp. indica.et Salmonella enterica subsp.
salamae. (Thiaw, 1998; Navoun, 2005).
Les salmonelloses, infections dues aux salmonelles sont
classées en trois groupes : les salmonelloses majeures (causées
par les Salmonellatyphi et paratyphi A, B et C et
caractérisées par des fièvres thyphoïdes et
paratyphoïdes), les salmonelloses mineures (responsables des
toxi-infections alimentaires) et les formes extra-digestives (diarrhées
qui remontent les voies urinaires, méningites chez le nourrisson,
cholécystites et infections pulmonaires) (Miltgen, 2016).
I.2.4.1.3. Shigella sp.
Ces bactéries furent décrites pour la
première fois par Chantemesse et Widal en 1888. Ils avaient isolé
des selles de malades présentant un syndrome dysentérique (Le
Minor, L; Veron, N. 1989) Nommé Shigella en l'honneur du
bactériologiste japonais Kiyoshi SHIGA qui a découvert le bacille
de la dysenterie en 1897 (Dufour, 2005) Bien que faisant partie sur le plan
génétique de l'espèce Escherichia coli, le genre
Shigella a été conservé dans la taxonomie pour
des raisons médicales. Ce genre comprend quatre « espèces
» ou sous-groupes A, B, C, D pouvant comporter un ou plusieurs serotypes :
groupe A, S. dysenteriae avec 15 serotypes; groupe B, S. flexneri
avec 6 serotypes; groupe C, S. boydii avec 18 serotypes; et
groupe D, S. sonnei avec un seul serotype (Denis et al.,
2007). et peuvent développer certaines complications telles que les
encéphalopathies létales toxiques, ou syndrome Ekiri et les
syndromes urémiques hémolytiques (Gaurav et al.,
2013).
I.2.4.1.4. Proteus sp.
Les Proteus sont des bactéries à Gram
négatif en forme de bacilles, aérobies facultatifs, ne fermentant
pas généralement le lactose. Ce sont des pathogènes
opportunistes chez les humains (Diala, 2015). Les proteus appartiennent
à la famille des entérobacbactéries et présentent
des caractéristiques de mobilité invasive que l'on observe dans
un milieu à agar non-inhibiteur par une diffusion sur toute la surface
de la gélose (Mordi et Momoh, 2009). Les Proteus peuvent être
classées en espèces nommées Proteus mirabilis
(retrouvée communément chez les humains dans les infections
urinaires et les plaies infectées et constitue 90% des infections
à Proteus), Proteus vulgaris (retrouvés chez les
patients immunodéprimés ou sous antibiothérapie à
long terme), Proteus rettgeri, Proteus penneri et Proteus
morganii.Tous les Proteus sont oxydase négatifs, non
capsulées, non sporulées activement mobiles et ont la
capacité d'induire une pathologie (Mordi et Momoh, 2009).
I.2.4.1.5. Klebsiella sp.
Ce sont des bacilles à Gam négatif (coloration
bipolaire fréquente) de la famille des Enterobacteriaceae, toujours
immobiles et de dimensions comparables à Escherichia coli. Ils
contiennent sept espèces que sont: Klebsiella pneumoniae, Klebsiella
oxytoca, Klebsiella ozanae, Klebsiella rhinoscleromatis, Klebsiella planticola,
Klebsiella terrigena et Klebsiella ornitholytica (Kone, 2010). Les
Klebsielles possèdent une toxine comme Escherichia coli,
responsable de nombreuses pathologies. Ce qui leur confère la
pathogénécité c'est la taille et la
spécificité de leur capsule; en effet, cette dernière les
protège contre la phagocytose, s'oppose à la
pénétration des antibiotiques et à l'action
bactéricide du sérum (Kone, 2010).
I.2.4.1.6. Enterobacter sp.
Les Enterobacters sont des entérobactéries
mobiles, Voges-Proskauer (VP) +, commensaux du tube digestif et
pathogènes opportunistes responsables des pathologies digestives, des
infections urinaires, de septicémies, de méningites (mortelle
chez les enfants) (Wilberger et al., 2012 ; Santos et al.,
2015). Elles ont été à la base connues
régulièrement comme étant les causes des infections
nosocomiales chez les immunodéprimés, les patients
diabétiques avec pour site d'infection régulier le tractus
gastro-intestinal, le tractus urinaire, le système nerveux central et
les voies respiratoires. Il en existe plusieurs espèces:
Enterobacter claocae, Enterobacter aerogenes, Enterobacter agglomerans,
Enterobacter gergoviae, Enterobacter sakazakii. Elles ont une grande
fréquence de co-infection avec certains pathogènes dans le foie
et dans les poumons (Wilberger et al., 2012 ; Santos et al.,
2015).
I.2.4.1.7. Citrobacter sp.
Le genre Citrobacter comporte les bactéries
Gramnégatif en forme de bacilles, de la famille des
entérobactéries mobiles et aérobies facultatifs. Elles
peuvent être seules ou regroupées en paires, non capsulées
à caractère mobiles grâce à cinq flagelles polaires
en un pôle. Elles possèdent les caractères biochimiques de
la famille des entérobactéries et sont negatifs au test de
Voges-Prokauer, avec production d'acide sulfurique (H2S+) (Citrobacter
freundii.), indole-, lactose+ (Santos et al., 2015). Le genre
citrobacter comprend les espèces suivants : Citrobacter
farmeri.,Citrobacter braakii., Citrobacter freundii., Citrobacter koseri.,
Citrobacter amalonaticus., Citrobacter gilleni., Citrobacter murliniae.,
Citrobacter redentium., Citrobacter sedlakii., Citrobacter werkmanii.,
et Citrobacter youngae (Santos et al., 2015). Les
souches de Citrobacter sont isolées chez les patients comme
pathogènes opportunistes secondaires et causant des épisodes
sporadiques et épidémiques de méningite avec une grande
incidence d'abcès cérébral et d'endocardite chez les
patients hospitalisés. Elles sont liées à de nombreuses
maladies incluant celles des infections du tractus urinaire, du tractus
respiratoire, des plaies, des os, des méninges, des intestins et du
sang. Elles sont à haut risque chez les enfants et les
immunodéprimés (Santos et al., 2015).
I.2.4.1.8.Staphylococcus sp
Genre bactérien constitué de cocci à Gram
positif groupés en amas, dont de nombreuses espèces sont
commensales (vivant sur un hôte sans le nuire) de la peau et des
muqueuses de l'homme et des animaux (Dubos, 2012). Certaines espèces de
staphylocoque sont néanmoins susceptibles de provoquer des maladies chez
l'homme, la plus virulente étant Staphylococcus aureus, ou
staphylocoque doré. Cette bactérie est susceptible de
sécréter différentes toxines (hémolysines,
leucocidine, toxines épidermolytiques, entérotoxines, toxine du
syndrome de choc toxique) et des enzymes (coagulase, fibrinolysine,
hyaluronidase), qui entraînent des lésions suppuratives et
nécrotiques ainsi que différentes maladies appelées
staphylococcies et staphylococcémies. Parmi les nombreuses autres
espèces de staphylocoque, regroupées sous le terme de
staphylocoques à coagulase négative (car ils ne
sécrètent pas de coagulase), Staphylococcus epidermidis,
Staphylococcus hominis et Staphylococcus saprophyticus
(à l'origine, notamment, d'infections urinaires basses chez la femme)
sont celles qui sont le plus souvent responsables de maladies (Martin et
Vincent, 2005). Ces staphylocoques, dont la virulence pour l'homme est bien
moindre que celle de Staphylococcus aureus, se comportent souvent
comme des bactéries opportunistes (septicémies sur
matériel étranger, notamment sur cathéter) (Monnet,
2012).
Ces bactéries ci-dessus décrites
représentent une menaces notoire pour les êtres humains, il faut
donc un bon traitement et suivi pour leur prise en charge.
I.2.4.2.Antibiothérapie
I.2.4.2.1 Définition
Il s'agit du traitement des infections bactériennes au
moyen des antibiotiques. Les bactériologistes définissent
l'antibiotique comme étant une substance d'origine naturelle ou
synthétique inhibant (si bactériostatique) ou tuant (si
bactéricide) les bactéries pathogènes à faible
concentration, et possédant une toxicité spécifique
vis-à-vis de celles-ci sans avoir à affecter la cellule
hôte (Ziai, 2014). On regroupe les antibiotiques selon plusieurs
critères:
· Le spectre d'action (large ou étroit);
· Le type d'action (bactéricide ou
bactériostatique);
· L'origine des antibiotiques (naturelle ou
synthétique);
· Le mode d'action ;
· La composition chimique (dérivés d'un
seul acide aminé, dérivés de deux acides aminés,
peptides chimiques, aminosides, macrolides, stéroïdes...);
· Le caractère de résistance :
ü Résistance exclusivement chromosomique par
mutation ;
ü Résistance extra-chromosomique plasmidique
(multi-résistance transférable);
· La charge électrique (acide, basique ou
amphotère) (Nafti, 2008).
I.2.4.2.2Classification des antibiotiques en fonction
de leur mode d'action
· Les antibiotiques agissant sur la paroi
bactérienne :ce sont les inhibiteurs du peptidoglycane.
Ils sont bactéricides et on trouve parmi ces antibiotiques : les
betalactamines, les glycopeptides et la fosfomycine (SOMIPEV, 2017).
· Les antibiotiques agissant sur la membrane
cytoplasmique: la polymixine B et la colistine sont deux antibiotiques
qui agissent sur la membrane plasmique, en perturbant sa synthèse. Ils
sont actifs sur les bacilles à gram négatif (SOMIPEV, 2017)
· Les antibiotiques inhibant la synthèse
protéines : après fixation sur des constituants
spécifiques du ribosome (sous unité 30S et 50S), ces
antibiotiques vont empêcher la traduction de l'ARNm et donc la formation
de nouvelles protéines. C'est le cas des tétracyclines,
aminosides, chloramphénicol, macrolides, acide fucidique et
linézolide (SOMIPEV, 2017);
· Les antibiotiques inhibant la synthèse
ou le fonctionnement de l'acide nucléique : les antibiotiques
de la famille des quinolones et aminoglycosides agissent sur l'ADN gyrase et
aussi sur l'ADN topo-isomérase IV inhibant le métabolisme de
l'ADN de la bactérie (Cocito et Giambattista, 1990);
· Inhibiteurs de la synthèse des
folates : les agents antibactériens aboutissent à cet
effet en agissant sur la dihydrofolate réductase ou la
dihydropteroate-synthase qui sont des enzymes impliquées dans la
synthèse des folates (Bourne, 2014).
Ces antibiotiques doivent être prescrit pour une bonne
cause et les doses doivent être respectée ; en effet, toutes
prises anarchiques ou sans avis du médecin peuvent provoquer des
problèmes de résistance.
I.2.4.3. Résistance des bactéries
entériques aux antibiotiques
On parle de résistance bactérienne lorsqu'un
antibiotique perd sa capacité à inhiber efficacement la
croissance bactérienne c'est-à-dire que les bactéries
continuent à se multiplier en présence de concentrations
thérapeutiques d'antibiotiques. Cette résistance aurait deux
origines essentielles, naturelles et acquises. La première est
programmée au niveau génomique alors que la seconde est
développée en fonction des conditions métaboliques (Julian
et Dorothy, 2010).
I.2.4.3.1. Résistance naturelle ou
intrinsèque
Une résistance intrinsèque se définit
comme une caractéristique fonctionnelle ou structurelle conférant
une certaine tolérance, (Muylaert et Mainil, 2012). La résistance
intrinsèque à un antibiotique est essentiellement due à la
présence de gènes chromosomiques ; elle est donc commune à
toutes les bactéries d'une même espèce. Elle peut
être due à des particularités structurales s'opposant
à l'action de l'antibiotique sur sa cible comme la présence d'une
membrane externe chez les bactéries à Gram négatif les
rendant naturellement résistantes aux antibiotiques de poids
moléculaire élevé comme les glycopeptides. La
résistance naturelle peut enfin être médiée par
l'expression constitutive ou induite d'une enzyme d'inactivation ou par la mise
en oeuvre d'un processus d'échappement vis-à-vis de
l'antibiotique (Diallo, 2013).
I.2.4.3.2. Résistance acquise
Ce terme est utilisé pour désigner le
résultat d'un processus permettant à des bactéries d'une
espèce originellement sensible de devenir résistante à un
ou plusieurs antibiotiques (Diallo, 2013). Une bactérie peut
acquérir une résistance aux antibiotiques par deux grands
mécanismes génétiques : l'un a pour support le
chromosome et définit une résistance chromosomique
(résultant d'une mutation), l'autre a pour support les plasmides
(liée à la synthèse de protéines additionnelles) ou
les éléments transposables ou les intégrons et
définit une résistance extra-chromosomique (Lozniewski et Rabaud,
2010).
I.2.4.3.3. Mécanismes de la résistance
bactérienne
Les bactéries ont développé
différents mécanismes afin de neutraliser l'action des agents
antibactériens, la figure II nous renseigne sur ces mécanismes.
Il s'agit entre autre de:
· Inactivation enzymatique de
l'antibiotique : elle représente le principal
mécanisme de résistance aux bêta-lactames, aminoglycosides,
phénicolés, MLS (macrolides, lincosamides, streptogramines), les
tétracyclines, la fosfomycine et plus récemment pour les
fluoroquinolones. Les plus grands producteurs de â-lactamases sont les
staphylocoques, mais surtout les Gram négatifs ; les
anaérobies produisent surtout des céphalosporinases;la
chloramphénicol-acétylase confère aux Gram-positifs et
négatifs une résistance au chloramphénicol (Muylaert et
Mainil, 2012);
· Modification ou remplacement de la cible de
l'antibiotique : ce mécanisme est particulièrement
important pour des résistances aux pénicillines, aux
glycopeptides et aux molécules du groupe MLS chez les bactéries
Gram-positives, et pour les résistances aux quinolones chez les
bactéries Gram positives et Gram-négatives (Muylaert et Mainil,
2012);
· L'efflux actif : il est
médié par des protéines transmembranaires connues sous le
terme de pompes à efflux ou transporteurs actifs. C'est un
mécanisme nécessitant de l'énergie et utilisé par
les bactéries pour expulser à l'extérieur des
métabolites et des composés toxiques étrangers tels que
des antibiotiques et d'autres médicaments (Muylaert et Mainil, 2012).
Les pompes SDR (specific drug-resistance) sont utilisées par les
bactéries Gram-négatifs pour résister aux
tétracyclines principalement, tandis que les pompes MDR
(multiple-drug-resistance) sont retrouvées chez les bactéries
telles que P. aeruginosa, Escherichia coli, S. aureus (Muylaert et
Mainil, 2012);
· Perméabilité
réduite : il s'agit d'un mécanisme de
résistance cliniquement très important chez les bactéries
Gram-négatives plus précisément chez P.
aeruginosa et les Enterobacteriaceae, à causes de large spectre
d'antibiotiques qu'elles ciblent. Les structures en cause sont les porines,
canaux aqueux constitués de trois molécules de protéines
qui laissent diffuser diverses molécules de faible masse
moléculaire comme les antibiotiques. Le dysfonctionnement de l'une
d'entre elles peut entrainer une résistance à divers
antibiotiques comme les ß-lactamines, l'acide nalidixique, le
triméthoprime, la fosfomycine, la tétracycline ou encore le
chloramphénicol (Muylaert et Mainil, 2012 ; Diallo, 2013) ;
· Protection de la cible de
l'antibiotique : c'est un mode de résistance bien connu
pour la famille des tétracyclines et plus récemment décrit
pour les quinolones et les fluoroquinolones. Ainsi, on ne dénombre pas
moins de huit protéines de protection ribosomale qui confèrent
une résistance aux tétracyclines en les déplaçant
de leur site de fixation par la création d'un encombrement
stérique au niveau du ribosome (Muylaert et Mainil, 2012);
· Piégeage de l'antibiotique :
Les bactéries sont capables de piéger un antibiotique en
augmentant la production de sa cible ou en produisant une autre molécule
possédant une affinité pour ce dernier. Il en résulte une
diminution de la concentration de l'antibiotique à l'état libre
au niveau de la cible. C'est le cas de la résistance aux glycopeptides
chez certaines souches de S. aureus, et à la tobramycine chez
E. coli (Muylaert et Mainil, 2012).

Figure 2: Les différents
mécanismes de résistance aux antibiotiques utilisés par
une bactérie Gram-négative (Source : Muylaert et Mainil,
2012)
CHAPITRE II : MATERIEL
ET METHODES
|
II.1.MATERIEL
II.1.1.Site d'étude
La collecte de données et les analyses pour ce travail
ont été effectuées à l'hôpital Ad-lucem de
Mbouda sous autorisation du Directeur de l'établissement et en suite les
isolats bactériens ont été conservés au
département de biochimie. Cette zone a été choisie en
raison de la disponibilité des équipements nécessaires
à l'aboutissement de cette recherche et aussi pour la forte
prévalence de l'antibio-résistance qui y sévit.
II.1.2.Type, période et
population d'étude
Il s'agit d'une étude transversale qui a
été effectuée de Février 2018 à Juin 2018
à l'Hôpital AD-LUCEM de Mbouda. Nos participants étaient
constitués des patients venus en consultation pour troubles
entériques.
II.1.3.Taille
d'échantillon
La taille de l'échantillon recommandée a
été calculée à base de la formule de
LORENZ :
Où : N= taille
d'échantillon requise ;
t = niveau de confiance à 95% (valeur
type de 1,96);
p = prévalence estimative de la
multi-résistance dans la zone de projet (29,7%) ;
m = marge d'erreur à 5% (valeur type
de 0,05) ou 10% ;
À cause de la prévalence de la
multi-résistance dans la localité de Mbouda qui est de 29,7%
(Marbou et Kuete, 2017).
II.1.4. Echantillonnage
Les échantillons ont été collectés
par nous même à l'Hôpital AD-LUCEM de Mbouda sur des
personnes venues en consultation dans cet hôpital. Pour ce faire nous
avons obtenue, une autorisation du Directeur du dit hôpital et une
clairance éthique « Ref CE CBI/ 110/
ERCC/CAMBIN (2017)» (annexe9). Les patients reçus en
consultation ont été approchés, le but de cette
étude leur a été expliqué ainsi que l'importance de
leur participation et leur consentement libre et éclairé a
été demandé (annexe 7). Chez les consentant, un
questionnaire leur a été administré (annexe 8).
II.1.4.1.Critères
d'inclusion
Toutes personnes âgées de 20ans et plus en
surpoids, obèses, sans distinction de sexe présentant les
symptômes des infections entériques ont fait partie de cette
étude.
II.1.4.2.Critères de non inclusion
Etaient non-inclus dans cette étude, les patients
immunodéprimés, les personnes atteintes d'hépatites et les
participants ayant refusé de signer le consentement,les femmes
enceintes, les patients de moins de 20ans et sous antibiothérapie.
II.1.4.3.Considération
éthique
Une clairance d'éthique a été
obtenue auprès du CAMBIM. L'étude a été
menée conformément au Déclaration de Helsinki. Tous les
participants avaient donnés leur consentement écrit à
participer à cette étude et le refus de participer à
l'étude a été respecté (annexes 7). Les
prélèvements ont été effectués par des
techniciens spécialisés et les résultats obtenus ont
été exploités uniquement dans un but scientifique et
conservés dans la stricte confidentialité par usage de code donc
l'accès a été restreint uniquement aux membres de
l'équipe de recherche. Les participants de cette étude ont
été informés dans les moindres détails des
objectifs, méthodes, bénéfices, risques et
inconvénients potentiels liés à l'expérimentation
(annexe 6). Au cours donc de l'étude les patients avaient aussi pour
avantage de savoir leur statut d'obésité ainsi que des
bactéries responsables des infections intestinales ce qui leur avait
permis de consulter un médecin pour leur prise en charge.
II.1.5
Matériel biologique
Le matériel biologique comportait les selles et le sang
des patients venus se faire consultés pour des troubles
entériques.
II.1.6. Réactifs
Les réactifs nécessaires à cet effet
étaient constitués du kit de la protéine C-réactive
(TAYTEC, Canada), l'Alcool o 90° et le glycérol.
II.1.7.Appareils
L'appareillage était constitué comme
suit :
· D'un incubateur (THERMO Scientific, Thermo Fischer
Scientific, USA), qui permet d'assurer et de maintenir la température
optimale pour les cultures bactériennes,
· D'un microscope (OPTIKA Microscope, Contrada, Italie),
qui permet d'observer les bactéries isolées entre lame et lamelle
afin d'objectiver le critère de mobilité et le gram.
· D'une centrifugeuse (DRAGONLAB, Rheinland, Chine) qui
permet de préparer le sérum à partir du sang total
· Du spectrophotomètre (MaestroNano, MaestroGen,
USA), qui permet de mesurer la densité optique des échantillons
à analyser,
II.1.8.Milieux de culture et
antibiotiques
Dans cette étude, nous avons utilisé :
· La Gélose SS (Liofilchem SRL,
ContradaVoltarrosto, Italie) pour la recherche des espèces de
Salmonella et Shigella;
· La Gélose Eosine bleu de
méthylène(EMB) (Accumix, Mol, Belgique) pour la recherche des
entérobactéries ;
· La gélose Mac Conkey (Accumix, Mol, Belgique)
pour la recherche des entérobactéries et des espèces de
Pseudomonas ;
· La gélose Mannitol Salt agar (Accumix,
Mol, Belgique) pour la recherche des espèces de
Staphylococcus ;
· La gélose nutritive (Liofilchem SRL,
ContradaVoltarrosto, Italie) pour la purification et l'activation de toutes les
bactéries ;
· La gélose de Mueller Hinton Agar
(Accumix, Mol, Belgique) pour la réalisation des antibiogrammes ;
· Le bouillon de Mueller Hinton broth (Accumix,
Mol, Belgique) pour la conservation des isolats ;
· Les disques d'antibiotiques usuels (Biogram, Verna
industrial Estate, Verna Goa, Inde) ont été utilisés dans
la réalisation de l'antibiogramme.
I.2.METHODES
II.2.1.Prélèvement
des selles et du sang des patients
Pour mener à bien notre travail, les selles et le sang
des patients venus consulter pour les infections entériques ont
été prélevés. Environ 10g de selles ont
été prélevés chez chaque patient et introduit dans
une boite à selle stérile puis fermé hermétiquement
et étiqueté. Pour ce qui est du sang, la surface du site de
piqûre aété préalablement nettoyé, et
à l'aide des gants stériles et des seringues un
prélèvement a été effectué et
collecté environ 4ml de sang dans un tube sec pour le dosage de la
protéine C-réactive. Les tests de HIV, d'hépatite et de
grossesse ont été systématiquement effectués en vue
de l'inclusion définitive ou de l'exclusion d'un patient.
II.2.2.Détermination de
l'obésité androïdes ou abdominales et de quelques
paramètres biologiques et anthropométriques
II.2.2.1.Détermination de l'obésité
androïdes ou abdominales à travers la mesure du tour de
taille
Le mot obésité sera utilisé dans le
document pour designer l'obésité androïdes ou abdominales.
Le tour de taille a été mesuré à l'aide d'un
mètre ruban (cm) appliqué directement sur la peau, à
mi-distance entre la base inferieure de la dernière cote et la
crête iliaque supérieure, en position debout, pieds écartes
d'environ 25 à 30 cm à la fin d'une expiration normale.
L'obésité abdominale est définie selon Tour de taille
(dans une population d'origine Européenne ou en Afrique du Nord) :
supérieur ou égal à 94 centimètres chez l'homme et
supérieur ou égal à 80 centimètres chez la femme
(Omar et al., 2017).
II.2.2.2.Détermination de la glycémie
Il s'agit de la détermination du taux de glucose dans
le sang d'un patient. Sa surveillance permet de repérer, diagnostiquer
ou surveiller un diabète. L'appareil utilisé à cet effet
permettait le dosage instantané de la glycémie : il
s'agissait du glucomètre (ACCU-CHEK, Mannheim, Allemagne).
· Principe
Il est basé sur l'utilisation de la technologie des
biosenseurs. L'enzyme glucose déshydrogénase réagit en
présence du glucose, provoque une réaction chimique qui se
traduit par un changement de couleur de la zone réactive. Le lecteur
calcule alors le résultat glycémique correspondant à la
coloration obtenue (Roche, 2017)).
· Procédure
Après avoir effectué un
prélèvement de sang, la bandelette à glycémie avait
été fixée sur le glucomètre jusqu'à attente
d'un signal de dépôt de sang qui s'affichait sur l'écran du
glucomètre. Apres dépôt de la goutte de sang, celle-ci
était analysée en 5 secondes et le résultat apparaissait
sur l'écran du glucomètre en mg/dl.
· Lecture
Les valeurs normales de glycémie se situent entre 0,7
à 1,1 g/l pour les non diabétiques et de 0,7 à 1,26 g/l
pour les diabétiques connus (Roche, 2017).
II.2. 2.3.Dosage de la CRP
· Principe
Le CRP-LATEX est un test d'agglutination basé sur la
détection quantitative et semi-quantitative de Protéine
C-Réactive dans le sérum (Vitros, 2009). Les particules de latex
couvertes d'IgG (Immunoglobuline G) humains sont agglutinées quand ils
sont mélangés avec des échantillons contenant la CRP. La
CRP est présente dans le sérum normal, elle augmente
significativement après des formes de blessures des tissus, des
infections bactériennes et virales, l'inflammation et néoplasmes
malveillants.
· Procédure
Elle est réalisée sur le plasma ou sérum
après agitation sur un vortex mécanique à
80-100r.p .m pendant 2 minutes ; une goutte de 50ul CRP-latex et du
sérum ont été ajoutée sur les cercles de la plaque
du test. Les goutes sont mélangées par un strie, en utilisant
toutes les surfaces de cercle et en utilisant une différence de strie
pour chaque sérum et un mouvement de rotation est réalisé
sur les cercles ; ensuite l'agglutination est examinée pendant une
période n'excédant pas 2 minutes.
· Lecture
Suivant la classification établie par Palosuo et
al., en 1986, une concentration de 6 mg/l correspond à une
concentration normale de CRP, une concentration comprise entre 6 et 40 mg/l
(infections virales ou parasitaires) et pour une concentration
supérieure à 40 mg/l (infections bactériennes).
II.2.2.4.Détermination de la T.A (tension
artérielle)
La technique de détermination de la tension
artérielle couramment utilisée en pratique clinique aujourd'hui a
été inventée en 1905 par P. Korotkoff. Elle consiste
à mesurer au manomètre la contre-pression exercée sur une
artère par un brassard gonflable tout en auscultant l'artère
(ATP, 2004). Elle utilise un sphygmomanomètre ou tensiomètre, et
un stéthoscope.
· Procédure de la mesure
Il s'agit d'amener d'abord la pression du brassard à
une valeur supérieure à la pression systolique pour bloquer la
circulation artérielle dans le bras. On laisse ensuite la pression du
brassard diminuer progressivement jusqu'à la valeur limite à
partir de laquelle la pression artérielle est suffisante pour laisser de
nouveau passer le sang dans l'artère : C'est la pression
systolique. En poursuivant le dégonflage, on amène la pression du
brassard à une valeur à partir de laquelle il n'y a plus
d'obstacle au flux artériel : C'est la pression diastolique.
· Lecture
Les valeurs de T.A ont été
interprétées selon le rapport du NCEP (2004) qui considère
les valeurs suivantes : T.A diastolique normale :
60-99mmHg ; T.A systolique normale :
100-139mmHg.
II.2.3.Isolement et identification
des bactéries
L'isolement des bactéries s'est faite après
culture des échantillons de selles sur des milieux gélosés
préalablement préparés selon les recommandations
indiquées par le fabriquant.
II.2.3.1.Isolement et
identification d'Escherichia coli
L'isolement de Escherichia coli, a été
fait dans une suspension de selles dans 5 ml d'eau distillée
stérile. Cette suspension a été par la suite
ensemencée simultanément par stries sur les géloses EMB
(Eosine Méthylène Blue) et Mac Conkey. Après incubation
pendant 24 heures à 37°C, nous avons observé sur le milieu
EMB, des colonies violettes, semi-bombées de 2 à 3 mm avec un
reflet métallique. Nous avons par la suite observé sur Mac Conkey
des colonies roses-rouges de 2 à 3 mm entourées d'halo vif
indiquant la fermentation du lactose. Avec ces observations, nous avons
suspecté la présence de Escherichia coli et nous avons
effectué une purification sur une autre gélose EMB à
37°C pendant 18 heures.
La confirmation de l'identité de l'isolat a
été réalisée en utilisant les galeries API 20E avec
la culture de 18 heures sur la gélose nutritive. Pour se faire, il
était d'abord question d'effecteur une observation microscopique entre
lame et lamelle pour vérifier la mobilité (E. coli est
plus ou moins mobile). Par la suite, 5 ml de suspension bactérienne a
été préparée dans de l'eau distillée
stérile d'opacité légère correspondant à
l'échelle 0,5 de McFarland (1,5.108 UFC/ml). La suspension a
été par la suite distribuée dans les tubes et cupules
Citrate (CIT), Voges-Proskauer (VP) et Gélatine (GEL). Pour les tubes
Arginine dihydrolase (ADH), Lysine décarboxylase (LDC), Ornithine
décarboxylase (ODC), Sulfure d'hydrogène (H2S), Urée
(URE); la galerie était par la suite Incubée à 37°C
pendant 24 heures. Après ce temps, on vérifiait si le tube
Glucose est positif ou plus de trois tests étaient positifs. Dans le cas
contraire, la galerie était ré-incubée de nouveau pendant
24 heures et on ajoutait par la suite dans le tube TDA, le réactif TDA
(chlorure de fer III), dans le tube indole, le réactif James, dans le
tube VP, le réactif VP (soude ou potasse). La confirmation de
Escherichia coli a été faite selon les
caractéristiques biochimiques présents dans le tableau I.
II.2.3.2.Isolement et identification de Shigella sp
Les bactéries du genre Shigella sp. ne
produisent pas de sulfure d'hydrogène et ne fermentent pas le lactose.
Les selles des patients ont été ensemencées sur le milieu
gélosé SS et, puis ont été incubées pendant
24h à 37°C. Une de ces colonies à centre noir a
été par la suite ensemencée sur la gélose Mac
Conkey, puis une autre sur EMB. Les colonies incolores sur le milieu Mac Conkey
étaient des Shigella sp , ainsi que celles qui avaient une
couleur grisâtre et transparentes sur le milieu EMB. Ces isolats ont
été par la suite purifiés sur la gélose SS suivie
d'une observation à l'état frais au microscope optique
(Shigellaest immobile), avant d'être identifié sur
galeries API 20E comme précédemment décrit pour E.
coli. Les caractères biochimiques du tableau I nous permettaient de
confirmer les Shigella sp.
II.2.3.3.Isolement et
identification de Salmonella sp.
Les bactéries du genre Salmonella sp. sont
productrices de sulfure d'hydrogène et ne fermentent pas le lactose. Les
selles des patients ont été ensemencées sur le milieu
gélosé SS puis ont été incubées pendant 24h
à 37°c. Une de ces colonies à centre noir a
été par la suite ensemencée sur la gélose Mac
Conkey, puis une autre sur EMB. Les colonies incolores sur le milieu Mac Conkey
étaient des Salmonella sp , ainsi que celles qui avaient une
couleur grisâtre et transparentes sur le milieu EMB. Ces isolats ont
été par la suite purifiés sur la gélose SS suivie
d'une observation à l'état frais (Salmonella est
mobile), avant d'être identifié sur galeries API 20E comme
décrit pour E. coli. Les caractères biochimiques du
tableau I nous permettaient de confirmer les Salmonella sp.
II.2.3.4.Isolement et
identification de Proteus sp.
Les Proteus sp. sont des bactéries
productrices de sulfure d'hydrogène et d'aldéhyde. Pour les
isoler, nous avons réalisé une culture des selles sur la
gélose Mac Conkey et EMB. Ces bactéries sont jaune ou saumon
à centre noir sur milieu Hektoen et grisâtre avec une pellicule
autour de la colonie lorsqu'on les cultive sur la gélose EMB. Ainsi, une
colonie présentant ces caractéristiques a été
purifiée sur la gélose nutritive suivit d'une observation
à l'état frais (Proteus est très mobile). La
confirmation de l'identité de l'isolat a été faite par
ensemencement sur galerie API 20E comme décrit pour E. coli.
Les caractères biochimiques du tableau I nous permettaient de conclure
pour Proteus sp.
II.2.3.5.Isolement et identification de Staphylococcus
sp.
Sur le milieu Mannitol, les colonies présentant des
aspects macroscopiques caractéristiques du genre Staphylococcus
ont été prélevés, le développement
bactérien sur le milieu de mannitol ne constitue qu'une indication,
d'autres bactéries (entérocoques) peuvent y être
cultivées. Sur ce milieu, les colonies de Staphylococcus
apparaissent souvent pigmentées et entourées d'une auréole
jaune dans le cas où le mannitol est fermenté, si non les
colonies sont de couleur blanche. Les colonies sont arrondies à bords
régulier de 1 à 2 mm de diamètre après 18 à
24h d'incubation à 37°C.Les caractères biochimiques du
tableau II nous permettaient de conclure pour Staphylococcussp.
Tableau
I :Critères d'identification biochimiques des bactéries
isolées
|
espèces
Tests
|
SAL
|
SHIG sp
|
E .coli
|
PROT sp
|
|
Mobilité
|
+
|
-
|
+
|
+
|
|
ARA
|
+
|
d
|
+
|
-
|
|
AMY
|
-
|
|
-
|
|
|
LAC
|
-
|
-
|
+
|
-
|
|
SAC
|
-
|
-
|
d
|
|
|
RHA
|
+
|
d
|
d
|
|
|
SOR
|
+
|
|
+
|
|
|
INO
|
d
|
-
|
-
|
|
|
MAN
|
+
|
d
|
d
|
|
|
GLU
|
+
|
+
|
+
|
|
|
GEL
|
-
|
-
|
-
|
|
|
VP
|
-
|
-
|
-
|
|
|
IND
|
-
|
d
|
+
|
|
|
TDA
|
-
|
-
|
-
|
+
|
|
URE
|
-
|
-
|
-
|
+
|
|
H2S
|
+
|
-
|
-
|
|
|
CIT
|
+
|
-
|
-
|
|
|
ODC
|
+
|
d
|
d
|
|
|
LDC
|
+
|
-
|
d
|
|
|
ADH
|
-
|
d
|
d
|
-
|
|
ONPG
|
-
|
d
|
+
|
-
|
ONPG: Orthonitrophényl-b-D-Galactopyranoside; ADH:
Arginine Dihydrolase; LDC: Lysine Décarboxylase; ODC: Ornithine
Décarboxylase; CIT: Citrate de Simmon; H2S: Sulfure
d'hydrogène; URE: Uréase; TDA: Tryptophane Désaminase;
IND: Indole; VP: Voges-Proskauer; GEL: Gélatine hydolase; GLU: Glucose;
MAN: Mannitol; INO: Inositol; SOR: Sorbitol; RHA: Rhamnose; SAC: Saccharose;
LAC: Lactose; AMY: Amydaline; ARA: Arabinose; SAL: Salmonelles; E.coli: Escherichia Coli; PROT: Proteus; SHIG :
Shigelle ; + : Résultat positif ; -
: Résultat négatif ; d : différents types
biochimiques
Tableau
II :Critères d'identification biochimiques des Staphylococcus sp
isolées
|
Test
|
LAC
|
GEL
|
VP
|
IND
|
URE
|
ODC
|
|
STAPH sp
|
+
|
+
|
+
|
-
|
-
|
-
|
ODC: Ornithine Décarboxylase; URE: Uréase;
IND: Indole; VP: Voges-Proskauer; GEL: Gélatine hydolase; LAC: Lactose;
STAPH : Staphylocoques ; + : Résultat
positif ; - : Résultat négatif.
II.2.3.6.Test de la catalase
Toutes les bactéries identifiées ont subi un
test à la catalase avant l'identification finale sur galerie API 20E.
Pour ce faire, nous avons utilisé des lames microscopiques sur
lesquelles nous avons déposé un isolat bactérien. La
levure de bière (Saccharomyces cerevisiae) a été
utilisée comme contrôle positif. Nous avons par la suite
déposé à l'aide d'une pipette Pasteur quelques gouttes de
peroxyde d'hydrogène. L'effervescence était
considérée comme réaction positive (catalase positive).
Toutes les entérobactéries sont catalase positive.
II.2.3.7. Conservation des
isolats
Les isolats bactériens ont été par la
suite conservés dans le bouillon de Mueller Hinton et du
glycérol (cryoprotecteur) dans les proportions 50:50 et
congelés.
II.2.4. Antibiogramme
C'est une technique de laboratoire visant à tester la
sensibilité d'un isolat bactérien vis-à-vis de plusieurs
antibiotiques.
·
Principe
Cette technique consiste à ensemencer
uniformément sur une gélose, des microorganismes à
étudier, et à déposer à la surface de cette
gélose des disques de papier buvard imprégnés des
différents antibiotiques à tester. Chaque antibiotique diffuse au
sein de la gélose et produit un diamètre d'inhibition au terme
d'une incubation, traduisant l'action de cet antibiotique aux
différentes souches bactériennes.
· Protocole et
interprétation des résultats
Il a été à partir d'un isolat de 18
heures sur gélose nutritive, préparé une suspension dans
l'eau physiologique de turbidité équivalente au standard
McFarland 0,5(1,5.108 UFC/ml) (McFarland et Jama, 1907); ensuite,
dans une boite de Pétri (90mm), ensuite coulé aseptiquement de la
gélose de Mueller Hinton préalablement préparée,
à un épaisseur de 4 mm; après solidification du milieu,
celui-ci a été ensemencé avec 5ml d'une suspension
bactérienne diluée au 1/100e (correspondant à
106 UFC/ml) préalablement préparée.
L'excès de suspension a été retiré et les boites de
Pétri ont été placées pour séchage pendant 5
minutes à 37°C à l'incubateur suivi du dépôt
des disques d'antibiotiques. L'ensemble a été ensuite
laissé à la température ambiante pendant 30 minutes pour
permettre la diffusion de l'antibiotique dans la gélose. Après
une incubation à 37°C pendant 18 à 24 heures, les
diamètres des zones d'inhibition des antibiotiques ont été
mesurés. Nous avons utilisé les recommandations de la
Société Française de Microbiologie (2013 et 2017) pour
classer les différents microorganismes en sensible, intermédiaire
et résistant aux antibiotiques testés partants des
diamètres des zones d'inhibitions (Tableaux III et IV).
Tableau
III :Charge du disque et diamètres critiques des
antibiotiques : cas des entérobactéries
|
Mécanisme d'action
|
Famille d'antibiotiques
|
Noms des antibiotiques
|
Charge du disque (ug)
|
Diamètre critique des antibiotiques
(mm)
|
|
S = - R<
|
|
Inhibiteurs de la synthèse des enveloppes
bactériennes
|
Bêta-lactamines
|
Ceftriaxone
|
30
|
25- 22
|
|
Cefodoxime
|
10
|
21 -21
|
|
Ceftazidime
|
10
|
22 - 19
|
|
Amoxicilline
|
20
|
19 - 19
|
|
Amoxiclav
|
30
|
19 - 19
|
|
Inhibiteurs de la synthèse des acides
nucléiques
|
Quinolones
|
Norfloxacine
|
10
|
22 - 19
|
|
Ciprofloxacine
|
30
|
26 - 24
|
|
Inhibiteurs de la synthèse des protéines
|
Aminosides
|
Gentamycine
|
10
|
17 - 14
|
|
Phénicolés
|
Chloramphénicol
|
30
|
17 17
|
|
Cyclines
|
Doxycycline
|
30
|
19 - 17
|
|
Inhibiteurs de la synthèse de l'acide folique
|
Sulfamides
|
Cotrimoxazole
|
25
|
14 - 11
|
|
Mécanismes complexes ou méconnus
|
Produits nitrés
|
Nitrofurantoïne
|
100
|
11 - 11
|
R= résistant ; I= intermédiaire ;
S= sensible ; mm= millimètre ; ug=microgramme.
Tableau IV : Charge du disque et
diamètres critiques des antibiotiques : cas des staphylocoques
|
Mécanisme d'action
|
Famille d'antibiotique
|
Noms des antibiotiques
|
Charge du disque (ug)
|
Diamètre critique des antibiotiques
(mm)
|
|
=S - R<
|
|
Inhibiteurs de la synthèse des enveloppes
bactériennes
|
Bêta-lactamines
|
Oxacilline
|
5
|
27 - 21
|
|
Inhibiteurs de la synthèse des protéines
|
Aminosides
|
Gentamycine
|
10
|
18 - 18
|
|
Amikacine
|
30
|
24 - 18
|
|
Phénicolés
|
Chloramphénicol
|
30
|
18 - 18
|
|
Cyclines
|
Doxycycline
|
30
|
22 - 19
|
|
Inhibiteurs de la synthèse de l'acide folique
|
Sulfamides
|
Cotrimoxazole
|
25
|
17 - 14
|
R= résistant ; I= intermédiaire ;
S= sensible ; mm= millimètre ; ug=microgramme.
II.3
ANALYSES STATISTIQUES
La résistance des bactéries a été
classée en fonction des diamètres d'inhibition ; elle
était dite multi-résistance si elles sont résistantes
à plus ou à trois familles d'antibiotiques, puis associé
au statut obésité. Le test de Khi-deux a été
utilisé pour comparer les variables catégorielles et le test t
pour les variables continues. Une valeur de p = 0,05 a été
considérée comme statistiquement significative.
CHIPITRE III :
RESULTATS ET DISCUSSION
|
III.1.RESULTATS
Des 115 patients consentants et remplissants les
critères d'inclusion qui ont participé à cette
étude, 46 (40%) étaient constitués des hommes et 69 (60%)
des femmes avec un âge moyen de 41,41#177; 15,39. La définition de
l'obésité abdominale selon le tour de taille a donné une
prévalence générale de 50,43%, soit 19,13% (n=22) pour les
hommes avec un âge moyen de 39,17#177; 15,45 et de 31,30% (n=36) (tableau
VI) pour les femmes avec un âge moyen de 42,91#177;15,28.
III.1.1.Caractéristique sociodémographiquesde la
population
La figure ci-dessous présente la répartition de
la population d'étude en fonction de la tranche d'âge après
standardisation et il en ressort que la tranche la plus représentative
est celle de 20 à 30 ans (30 ans exclus) avec une fréquence de
31,30% (n=36) (Figure 3).
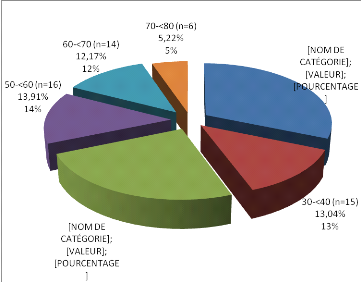
Figure 3
: Répartition de la population d'étude en fonction de la tranche
d'âge.
III.1.2.Variation des paramètres
sociodémographiques en fonctions du statut obésité
abdominale
La distribution de l'obésité abdominale en
fonction du sexe tel que représentée dans le tableau V ci-dessous
a montré que cette affection était plus représentée
chez les femmes par rapport aux hommes avec des pourcentages respectifs de
52,17% (n=36) et 47,83% (n=22) comparé à 52,17% (n=24) et 47,83%
(n=33) respectivement des hommes et femmes non obèses, mais cette
variation n'est pas significative (P=0,39). On observe aussi dans ce tableau
que l'âge était significativement corrélé au
développement de l'obésité abdominale, cependant, on note
dans cette étude que la tranche d'âge la plus affectée par
l'obésité abdominale était celle de [40-50[avec une
prévalence significative de 71,43% (n=20)des obèses
comparés à 28,57% (n=8)des participants non obèses
(X²=19,19 ; P=0,00).On observe également que le niveau
scolaire affecte significativement le développement de
l'obésité abdominale, ce constat est marqué par un taux
élevé d'obèses chez les participants qui n'avaient pas un
niveau universitaire, soit 54,37% (n=56), comparé aux participants non
obèses chez qui on note 43,63% (n=47), ce taux est significatif
(X²=0,69 ; P=0,01). L'alcoolisme et le tabagisme sont des facteurs de
risque connus de l'obésité, mais dans notre étude, on n'a
pas enregistré des variations significatives par rapport à
l'obésité (P>0,05) (tableau V). Les patients
diabétiquesreprésentaient55, 56%(n=10) chez les obeses et 44,44%
(n=8) des non obèses, ce qui n'était pas significatif (P=0,41)
(tableau V). Quant à l'hypertension, elleconcernait66, 67%(n=16) des
obèses comparés à la population non obèse chez qui
l'on rencontrait 33,33% (n=8) avec une différence significative (p=0,02)
(Tableau V).
Tableau
V : Répartition des paramètres sociodémographiques en
fonction du statut obésité abdominale
|
Paramètres
sociodémographiques
|
Obèses (n=58)
|
Non obèses (n=57)
|
X2
|
P-value
|
|
Sexe
|
Hommes (n=46)
|
22(47,83%)
|
24(52,17%)
|
0,07
|
0,39
|
|
Femmes (n=69)
|
36(52,17%)
|
33(47,83%)
|
|
Tranche d'âge
|
[20-30[(n=36)
|
9 (25%)
|
75 (75,00%)
|
19,19
|
0,00
|
|
[30-40[(n=15)
|
10(66,67%)
|
5 (33,33%)
|
|
[40-50[(n=28)
|
20 (71,43%)
|
8 (28,57%)
|
|
[50-60[(n=16)
|
11 (68,75%)
|
5 (31,25%)
|
|
[60-70[(n=14)
|
5 (35,71%)
|
9 (64,29%)
|
|
[70-80[(n=6)
|
3 (50,00%)
|
3 (50,00%)
|
|
Niveau d'éducation
|
Aucun
|
Oui (n=7)
|
5 (71,43%)
|
2 (28,57%)
|
0,57
|
0,22
|
|
Non (n=108)
|
53(49 ,07%)
|
55 (50,93%)
|
|
Primaire
|
Oui (n=41)
|
23 (56,10%)
|
18 (43,90%)
|
0,50
|
0,23
|
|
Non (n=74)
|
35 (47,30%)
|
39 (52,70%)
|
|
Secondaire
|
Oui (n=55)
|
28 (50,91%)
|
27 (49,09%)
|
0,00
|
0,53
|
|
Non (n=60)
|
30 (50,00%)
|
30 (50,00%)
|
|
Universitaire
|
Oui (n=12)
|
2 (16,67%)
|
10 (83,33%)
|
4,69
|
0,01
|
|
Non (n=103)
|
56 (54,37%)
|
47 (43,63%)
|
|
Alcool
|
Oui (n=83)
|
44(53,01%)
|
39 (46,98%)
|
0,46
|
0,24
|
|
Non (n= 32)
|
14 (43,75%)
|
18 (56,25%)
|
|
Tabagisme
|
Oui (n=2)
|
2 (100%)
|
0 (0,00%)
|
0,49
|
0,25
|
|
Non (n=113)
|
56 (49,56%)
|
57 (50,44%)
|
|
Diabète
|
Oui (n=18)
|
10 (55,56%)
|
8 (44,44%)
|
0,04
|
0,41
|
|
Non (n=97)
|
48 (49,48%)
|
49 (50,52%)
|
|
Hypertension
|
Oui (n=24)
|
16 (66,67%)
|
8 (33,33%)
|
2,42
|
0,02
|
|
Non (n=91)
|
42 (46,15%)
|
49 (53,85%)
|
III.1.3.
Variation des paramètres biologiques en fonction du sexe et du statut
obésité abdominale
Les résultats du tableau VI renseignant sur la relation
des valeurs moyennes des paramètres biologiques par sexe et en fonction
du statut d'obésité abdominale, ont révélé
que chez l'homme, les moyennes des tours de taille (109,12 #177;
19,66)étaient plus élevées pour les obèses par
rapport aux hommes non obeses chez qui on a enregistré 80,75#177;11,45.
Nous avons noté aussi que chez les hommes obèses, les valeurs des
pressions systoliques (134,18 #177; 22,79), diastoliques (81,36 #177; 13,00),
des glycémies et des CRP (31,36 #177; 58,25) étaient sans
particularité, comparé aux hommes non obèses qui avaient
des valeurs (134,54#177;23,80, 79,20#177;11, 63, 1,07#177;0,36 et
38,16#177;87,63) respectivement non significatives (P>0,05) (tableau VI).
Pour ce qui est de la population féminine, nous avons
constaté que les valeurs moyennes des pressions systoliques (135,02
#177; 22,52), des glycémies (1,23 #177; 0,73) et des tours de taille
(102,46 #177; 18,20) chez les patientes obèses étaient
considérablement élevées comparé aux valeurs des
femmes non obèses qui étaient respectivement (122,57 #177; 17,66,
0,97 #177; 0,30 et 75,42 #177; 8,62) non significatives (P>0,05) (tableau
V). Dans cette population, nous avons noté aussi que les variations des
moyennes des pressions diastoliques (83,61 #177; 13,78) et des CRP (14,83 #177;
3,04) chez les obèses étaient sans particularité dans la
population contrôle (77,15 #177; 12,63 et 15,09 #177; 4,07)
respectivement sans différence significative (P>0,05) (tableau VI)
Tableau
VI : Variation des paramètres biologiques en fonction du sexe et du
statut obésité abdominale
|
Chez les obèses
|
|
Paramètres biologiques
|
Hommes (n=22)
|
Femmes (n=36)
|
P-value
|
|
Glycémie
|
1,08 #177; 0,48
|
1,23 #177; 0,73
|
0,60
|
|
Tour de taille
|
109,12#177; 19,66
|
102,46#177; 18,20
|
0,07
|
|
Pression diastolique
|
81,36 #177; 13,00
|
83,61 #177; 13,78
|
0,70
|
|
Pression systolique
|
134,18 #177; 22,79
|
135,02 #177; 22,52
|
0,77
|
|
CRP
|
31,36 #177; 6,58
|
14,83 #177; 3,04
|
0,34
|
|
Chez les non obèses
|
|
Paramètres biologiques
|
Hommes (n=24)
|
Femmes (n=33)
|
P-value
|
|
Glycémie
|
1,07#177;0,36
|
0,97 #177; 0,30
|
0,36
|
|
Tour de taille
|
80,75#177;11,45
|
75,42#177; 8,62
|
0,00
|
|
Pression diastolique
|
79,20#177;11,63
|
77,15 #177; 12,63
|
0,36
|
|
Pression systolique
|
134,54#177;23,80
|
122,57 #177; 17,66
|
0,04
|
|
CRP
|
38,16#177;7,63
|
15,09 #177; 4,07
|
0,69
|
CRP : Protéine C réactive
III.1.4. Variation des
paramètres biologiques en fonction de la tranche d'âge et du
statut obésité abdominale.
L'analyse des moyennes des paramètres biologiques en
fonction des tranches d'âge et du statut obésité abdominale
ont montré que les valeurs moyennes des glycémies augmentent chez
les participants obèses avec une maximale de [60-70[(1,51#177;0,46),
comparé aux valeurs chez les participants non obèses chez qui la
maximale était de 1,16#177;0,43 dans cette même tranche
d'âge, mais ces variations étaient non significatives (P>0,05)
(tableau VII). On a noté dans ce même tableau que les moyennes des
tours de taille les plus élevés étaient constituées
des patients de plus de 30ans avec des maximales entre 40 à 60 ans. Les
tranches d'âges de [30-40[, [50-60[et [70-80[étaient
marquées par une élévation des moyennes des pressions
systoliques 135,20 #177;30,44, 148,00 #177; 18,53, 159,33 #177;
25,00respectivement chez les obèses par rapport aux participants non
obèses chez qui on remarque118, 20#177; 9,57, 127,00 et #177;19,96 et
142,33 #177; 38,52 respectivement avec une P-value significative (p=0,01)
(tableau VII).Les résultats de CRP ont démarqué avec des
moyennes élevées dans certaines tranches d'âges chez les
obèses [30-40[et[40-50[respectivement de 24,40#177;7,46 et
29,10#177;8,21 comparés aux moyennes des non obèses chez qui nous
on note7,20#177;2,68 et 13,50#177;3,29, mais non significatives
(P>0,05)(tableau VII).
Tableau VII : Variation des
paramètres biologiques en fonction de la tranche d'âge et du
statut obésité abdominale
|
Chez les obèses
|
|
Paramètres biologiques
|
[20-30[(n= 9)
|
[30-40[(n=10)
|
[40-50[(n=20)
|
[50-60[(n=11)
|
[60-70[(n=5)
|
[70-80[(n=3)
|
P-value
|
|
Glycémie
|
0,88#177;0,09
|
1,16#177;0,44
|
1,19#177;0,58
|
1,29#177;0,74
|
1,51#177;0,46
|
1,05#177;0,28
|
0,38
|
|
Tour de
taille
|
94,00#177;14,50
|
97,50#177;10,87
|
107,00#177;23,04
|
109,45#177;18,42
|
102,60#177;23,25
|
100,33#177;20,55
|
0,37
|
|
Pression diastolique
|
73 ,66#177;13,20
|
82,90#177;12,39
|
81,10#177;11,06
|
87,36#177;15,47
|
90,80#177;17,06
|
90,33#177;6,65
|
0,28
|
|
Pression systolique
|
116,66
#177;15,93
|
135,20
#177;30,44
|
129,80
#177;15,66
|
148,00
#177;18,53
|
141,80
#177;19,52
|
159,33
#177;25,00
|
0,01
|
|
CRP
|
16,00#177;1,00
|
24,40#177;7,46
|
29,10#177;8,21
|
14,72#177;3,01
|
9,60#177;8,04
|
8,00#177;3,46
|
0,98
|
|
Chez les non obèses
|
|
Paramètres biologiques
|
[20-30[(n= 29)
|
[30-40[(n=5)
|
[40-50[(n=8)
|
[50-60[(n=5)
|
[60-70[(n=9)
|
[70-80[(n=3)
|
P-value
|
|
Glycémie
|
0,94#177;0,21
|
0,85#177;0,09
|
1,05#177;0,48
|
1,16#177;0,51
|
1,16#177;0,43
|
1,06#177;0,21
|
0,42
|
|
Tour de
Taille
|
77,88#177;10,05
|
80,20#177;3,19
|
78,25#177;6,98
|
79,80#177;12,45
|
77,11#177;14,64
|
68,00#177;7,21
|
0,43
|
|
Pression diastolique
|
75,07#177;11,13
|
71,40#177;9,37
|
86,25#177;12,18
|
80,20#177;12,17
|
80,88#177;14,93
|
81,33#177;9,01
|
0,21
|
|
Pression systolique
|
121,77
#177;17,57
|
118,20
#177;9,57
|
134,62
#177;24,34
|
127,00
#177;19,96
|
139,55
#177;22,94
|
142,33
#177;38,52
|
0,17
|
|
CRP
|
29,03#177;3,02
|
7,20#177;0,68
|
13,50#177;1,29
|
24,00#177;2,24
|
38,66#177;10,08
|
6,00#177;0,00
|
0,39
|
III.1.5. Distribution des isolats bactéries dans la
population d'étude
La figure 4 montre la répartition des bactéries
isolées dans la population d'étude, il ressort de cette figure
que les bactéries du genre E. coli étaient largement
présentes dans la population d'étude avec une fréquence de
70,43% (n=81). On a noté également dans cette même figure
27,83% (n=32) des staphylocoques, 24,35% (n=28) des proteus, 20,87%
(n=24), des salmonelles et 12,17% (n=14) des shigelles.

Figure
4 : Distribution des isolats bactériens dans la population
d'étude
III.1.6. Distribution des isolats bactériens en
fonction du statut obésité abdominale
Les bactéries responsables des infections
entériques chez les populations obèses et non obèses
reçus en consultation à l'hôpital AD-LUCEM de Mbouda de
février à juin 2018 ont été isolées et
identifiées par culture sur milieux spécifiques, observations
microscopiques à l'état frais et après coloration de gram
et par identification biochimique grâce à des galeries API 20E. La
figure ci-dessous récapitule les résultats obtenus.
La figure 5 présente les résultats de la
distribution des isolats bactériens en fonction du statut
obésité abdominale. Il en ressort de cette figure que la
fréquence des infections à Escherichia coli est plus
élevée chez les patients obèses et non obèses. Il
montre aussi une prédominance des infections à Salmonella sp
26,32% ; (n=57) chez les patients non obèses comparé
aux patients obèses chez qui nous avons noté 15,52% (n=58). Par
ailleurs il existe une faible variation entre les taux d'infections à
Shigella sp, à Proteus sp et à
Staphylococcus sp dans les deux populations.
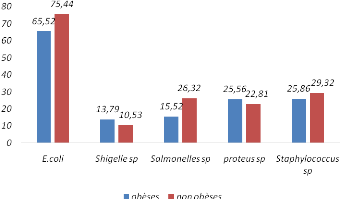
Figure
5 : Distribution des isolats bactériens en fonction du statut
obésité
III.1.7. Distribution de la résistance des isolats
bactériens en fonction du statut obésité abdominale
Le tableau VIII nous renseigne sur le profil de
résistance de E. coli en fonction du statut
obésité abdominale, il relève que, ces bactéries
avaient une résistante très élevée aux
antibiotiques usuels testés soient 100,00% (n=38) à
l'amoxicilline (AMX), 92,11% (n=35) à l'amoxicilline + acide
clavulanique (AMC), 84,21% (n=32) à cotrimoxozole (COT) et 81,58%
(n=31) à doxycycline (DOX) chez les patients obèses,
comparé aux participants contrôles chez qui nous avons noté
des résistances à 97,67% (n=42), 79,07% (n=34), 88,37% (n=38) et
48,84% (n=21) respectivement à ces antibiotiques. Ces variations
étaient non significatives (P>0,05) avec les trois premiers
antibiotiques mais significatives pour la DOX (P=0,00).
Tableau
VIII : Résistance de E. coli (n=81) en fonction du statut
obésité abdominale.
|
ATB
|
Obèses (n=38)
|
Non obèses (n=43)
|
X²
|
P-value
|
|
CTR
|
S (n=51)
|
21 (55,26%)
|
30 (69,77%)
|
1,25
|
0,13
|
|
R (n=30)
|
17 (44,74%)
|
13 (30,23)
|
|
CPD
|
S (n=37)
|
14 (36,84%)
|
23 (53,49%)
|
1,63
|
0,10
|
|
R (n=44)
|
24 (63,16%)
|
20 (46,51%)
|
|
CAZ
|
S (n=45)
|
20 (52,63%)
|
25 (58,14%)
|
0,07
|
0,39
|
|
R (n=36)
|
18 (47, 37%)
|
18 (41, 86%)
|
|
AMX
|
S (n=1)
|
0 (0, 00%)
|
1 (2, 33%)
|
0,00
|
0,53
|
|
R (n=80)
|
38 (100%)
|
42 (97, 67%)
|
|
AMC
|
S (n=12)
|
3 (7, 89%)
|
9 (20, 93%)
|
1,78
|
0,08
|
|
R (n=69)
|
35 (92, 11%)
|
34 (79, 07%)
|
|
CIP
|
S (n=69)
|
34 (89, 47%)
|
35 (81, 40%)
|
0,50
|
0,24
|
|
R (n=12)
|
4 (10, 53%)
|
8 (18, 60%)
|
|
NOR
|
S (n=66)
|
33 (86, 84%)
|
33 (76, 74%)
|
0,77
|
0,18
|
|
R (n=15)
|
5 (13, 16%)
|
10 (23, 26%)
|
|
CHL
|
S (n=56)
|
23 (60,53%)
|
33 (76,74%)
|
1,78
|
0,09
|
|
R (n=25)
|
15 (39,47%)
|
10 (23,26%)
|
|
GEN
|
S (n=63)
|
25 (65,79%)
|
38 (88,37%)
|
4,71
|
0,01
|
|
R (n=18)
|
13 (34,21%)
|
5 (11,63%)
|
|
DOX
|
S (n=29)
|
7 (18,42%)
|
22 (51,16%)
|
8,03
|
0,00
|
|
R (n=52)
|
31 (81,58%)
|
21 (48,84%)
|
|
COT
|
S (n=11)
|
6 (15,79%)
|
5 (11,63%)
|
0,04
|
0,41
|
|
R (n=70)
|
32 (84,21%)
|
38 (88,37%)
|
|
NIT
|
S (n=60)
|
25 (65,79%)
|
35 (81,40%)
|
1,81
|
0,08
|
|
R (n=21)
|
13 (34,21%)
|
8 (18,60%)
|
CTR :Ceftriaxone ;
CPD:Cefpodoxime ; CAZ:Ceftazidime ;
AMX : Amoxicilline ;
AMC :Amoxicilline +acide clavulanique ;
CIP : Ciprofloxocine ; NOR:
Norfloxacine ; CHL: Chloramphénicol ;
GEN: Gentamycine ; DOX:
Doxycycline ; COT : Cotrimoxazole ;
NIT: Nitrofurantoine ; R:
Résistant ; S : Sensible ;
ATB: Antibiotique.
Le tableau IX montre la résistance de Shigella
sp en fonction du statut obésité abdominale, il en ressort
de ce tableau que les isolats de Shigelles sont résistants
à 100,00% vis-à-vis de l'amoxicilline dans la population
obèse (n=8) et non obèse (n=6) ; on note également
une résistance à 100,00% (n=8) face à l'amoxicilline +
acide clavulanique et à75,00% vis-à-vis de cotrimoxazole chez les
patients obèses par rapport à la population contrôle
respectivement 83,33% (n=5) et 83,33%, mais non significative (P>0,05). Dans
ce tableau on remarque en plus que la ciprofloxacine et le
chloramphénicol ne sont résistants que chez les personnes
obèses 37,50% et 25,00% avec une différence non significative
(P>0,05).
Tableau
IX : Résistance de Shigella sp (n=14) en fonction du statut
obésité
|
ATB
|
Obèses (n=8)
|
Non obèses (n=6)
|
X²
|
P-value
|
|
CTR
|
S (n=7)
|
4 (50,00%)
|
3 (50,00%)
|
0,00
|
0,70
|
|
R (n=7)
|
4 (50,00%)
|
3 (50,00%)
|
|
CPD
|
S (n=4)
|
2 (25,00%)
|
2 (33,33%)
|
0,00
|
0,59
|
|
R (n=10)
|
6 (75,00%)
|
4 (66,67%)
|
|
CAZ
|
S (n=5)
|
2 (25,00%)
|
3 (50,00%)
|
0,16
|
0,34
|
|
R (n=9)
|
6 (75,00%)
|
3 (50,00%)
|
|
AMX
|
S (n=0)
|
0 (0,00%)
|
0 (0,00%)
|
0,00
|
1,00
|
|
R (n=14)
|
8 (100,00%)
|
6 (100,00%)
|
|
AMC
|
S (n=1)
|
0 (0,00%)
|
1 (16,67%)
|
0,02
|
0,42
|
|
R (n=13)
|
8 (100,00%)
|
5 (83,33%)
|
|
CIP
|
S (n=11)
|
5 (62,50%)
|
6 (100,00%)
|
1,06
|
0,15
|
|
R (n=3)
|
3 (37,50%)
|
0 (0,00%)
|
|
NOR
|
S (n=12)
|
7 (87,50%)
|
5 (83,33%)
|
0,00
|
0,69
|
|
R (n=2)
|
1 (12,50%)
|
1 (16,67%)
|
|
CHL
|
S (n=12)
|
6 (75,00%)
|
6 (100,00%)
|
0,30
|
0,30
|
|
R (n=2)
|
2 (25,00%)
|
0 (0,00%)
|
|
GEN
|
S (n=11)
|
7 (87,50%)
|
4 (66,67%)
|
0,07
|
0,38
|
|
R (n=3)
|
1 (12,50%)
|
2 (33,33%)
|
|
DOX
|
S (n=6)
|
3 (37,50%)
|
3 (50,00%)
|
0,00
|
0,52
|
|
R (n=8)
|
5 (62,50%)
|
3 (50,00%)
|
|
COT
|
S (n=3)
|
2 (25,00%)
|
1 (16,67%)
|
0,00
|
0,61
|
|
R (n=11)
|
6 (75,00%)
|
5 (83,33%)
|
|
NIT
|
S (n=13)
|
8 (100,00%)
|
5 (83,33%)
|
0,02
|
0,42
|
|
R (n=1)
|
0 (0,00%)
|
1 (16,67%)
|
CTR : Ceftriaxone ;
CPD: Cefpodoxime ; CAZ:
Ceftazidime ; AMX : Amoxicilline ;
AMC :Amoxicilline +acide clavulanique ;
CIP : Ciprofloxocine ; NOR:
Norfloxacine ; CHL: Chloramphénicol ;
GEN: Gentamycine ; DOX:
Doxycycline ; COT : Cotrimoxazole ;
NIT: Nitrofurantoine ; R:
Résistant ; S : Sensible ;
ATB: Antibiotique.
Le tableau X présente la résistance
Salmonella sp en fonction du statut obésité abdominale,
cependant il montre que les isolats des Salmonella sp sont aussi
résistants à 100,00% à l'amoxicilline dans les deux
populations, à 66,67% (n=6) à l'amoxicilline + acide
clavulanique, 88,89% (n=8) à cotrimoxazole et à 66,67% (n=6)
à la doxycycline chez les obèses, comparativement à la
population contrôle chez qui on a 100,00% (n=15), 80,00% (n=12) et 66,67%
(n=10) respectivement pour ces antibiotiques, ces variations sont
significatives pour l'amoxicilline + acide clavulanique (P=0,04) et non
significatives pour les autres antibiotiques (P>0,05).
Tableau
X : Résistance de Salmonella sp (n=24) en fonction du statut
obésité
|
ATB
|
Obèses (n=9)
|
Non obèses (n=15)
|
X²
|
P-value
|
|
CTR
|
S (n=18)
|
7 (77,78%)
|
11 (73,33%)
|
0,00
|
0,60
|
|
R (n=6)
|
2 (22,22%)
|
4 (26,67%)
|
|
CPD
|
S (n=16)
|
6 (66,67%)
|
10 (66,67%)
|
0,00
|
0,66
|
|
R (n=8)
|
3 (33,33%)
|
5 (33,33%)
|
|
CAZ
|
S (n=20)
|
7 (77,77%)
|
13 (86,67%)
|
0,00
|
0,70
|
|
R (n=4)
|
2 (22,22%)
|
2 (13,33%)
|
|
AMX
|
S (n=0)
|
0 (0,00%)
|
0 (0,00%)
|
0,00
|
1,00
|
|
R (n=24)
|
9(100,00%)
|
15 (100,00%)
|
|
AMC
|
S (n=3)
|
3 (33,33%)
|
0 (0,00%)
|
3,07
|
0,04
|
|
R (n=21)
|
6 (66,67%)
|
15 (100,00%)
|
|
CIP
|
S (n=22)
|
8 (88,89%)
|
14 (93,33%)
|
0,00
|
0,61
|
|
R (n=2)
|
1 (11,11%)
|
1 (6,67%)
|
|
NOR
|
S (n=22)
|
8 (88,89%)
|
14 (93,33%)
|
0,00
|
0,61
|
|
R (n=2)
|
1 (11,11%)
|
1 (6,67%)
|
|
CHL
|
S (n=16)
|
5 (55,56%)
|
11 (73,33%)
|
0,20
|
0,32
|
|
R (n=8)
|
4 (44,44%)
|
4 (26,67%)
|
|
GEN
|
S (n=17)
|
7 (77,78%)
|
10 (66,67%)
|
0,01
|
0,46
|
|
R (n=7)
|
2 (22,22%)
|
5 (33,33%)
|
|
DOX
|
S (n=8)
|
3 (33,33%)
|
5 (33,33%)
|
0,00
|
0,66
|
|
R (n=16)
|
6 (66,67%)
|
10 (66,67%)
|
|
COT
|
S (n=4)
|
1 (11,11%)
|
3 (20,00%)
|
0,00
|
0,51
|
|
R (n=20)
|
8 (88,89%)
|
12 (80,00%)
|
|
NIT
|
S (n=)
|
6 (66,67%)
|
12 (80,00%)
|
0,05
|
0,39
|
|
R (n=)
|
3 (33,33%)
|
3 (20,00%)
|
CTR : Ceftriaxone ;
CPD: Cefpodoxime ; CAZ:
Ceftazidime ; AMX : Amoxicilline ;
AMC :Amoxicilline +acide clavulanique ;
CIP : Ciprofloxocine ; NOR:
Norfloxacine ; CHL: Chloramphénicol ;
GEN: Gentamycine ; DOX:
Doxycycline ; COT : Cotrimoxazole ;
NIT: Nitrofurantoine ; R:
Résistant ; S : Sensible ;
ATB: Antibiotique.
Le tableau XI présente la résistance de
Proteus sp en fonction du statut obésité, on observe
dans ce tableau une résistance à 100,00% à l'amoxicilline
chez les personnes obèses et non obèses et à 86,67% (n=13)
à l'amoxiclav chez les obèses, comparé à 92,31%
(n=12) chez les non obèses mais ces variations ne sont pas
significatives (P>0,05).
Tableau
XI : Résistance de Proteus sp (n=28) en fonction du statut
obésité abdominale
|
ATB
|
Obèses (n=15)
|
Non obèses (n=13)
|
X²
|
P-value
|
|
CTR
|
S (n=16)
|
9 (60,00%)
|
7 (53,85%)
|
0,00
|
0,52
|
|
R (n=12)
|
6 (40,00%)
|
6 (46,15%)
|
|
CPD
|
S (n=16)
|
8 (53,33%)
|
8 (61,54%)
|
0,00
|
0,47
|
|
R (n=12)
|
7 (46,67%)
|
5 (38,46%)
|
|
CAZ
|
S (n=14)
|
6 (40,00%)
|
8 (61,54%)
|
0,57
|
0,22
|
|
R (n=14)
|
9 (60,00%)
|
5 (38,46%)
|
|
AMX
|
S (n=0)
|
0 (0,00%)
|
0 (0,00%)
|
0,00
|
1,00
|
|
R (n=28)
|
15 (100,00%)
|
13 (100,00%)
|
|
AMC
|
S (n=3)
|
2 (13,33%)
|
1 (7,69%)
|
0,00
|
0,55
|
|
R (n=25)
|
13 (86,67%)
|
12 (92, 31%)
|
|
CIP
|
S (n=22)
|
12 (80, 00%)
|
10 (76, 92%)
|
0,00
|
0,60
|
|
R (n=6)
|
3 (20, 00%)
|
3 (23, 08%)
|
|
NOR
|
S (n=20)
|
9 (60, 00%)
|
11 (84, 62%)
|
1,03
|
0,15
|
|
R (n=8)
|
6 (40, 00%)
|
2 (15, 38%)
|
|
CHL
|
S (n=15)
|
8 (53, 33%)
|
7 (53, 85%)
|
0,00
|
0,63
|
|
R (n=13)
|
7 (46, 67%)
|
6 (46, 15%)
|
|
GEN
|
S (n=23)
|
14 (93, 33%)
|
9 (69, 23%)
|
1,35
|
0,12
|
|
R (n=5)
|
1 (6, 67%)
|
4 (30, 77%)
|
|
DOX
|
S (n=11)
|
6 (40, 00%)
|
5 (38, 46%)
|
0,00
|
0,61
|
|
R (n=17)
|
9 (60, 00%)
|
8 (61, 54%)
|
|
COT
|
S (n=13)
|
6 (40, 00%)
|
7 (53, 85%)
|
0,12
|
0,36
|
|
R (n=15)
|
9 (60, 00%)
|
6 (46, 15%)
|
|
NIT
|
S (n=)
|
12 (80, 00%)
|
13 (100, 00%)
|
1,19
|
0,13
|
|
R (n=)
|
3 (20, 00%)
|
0 (0, 00%)
|
CTR : Ceftriaxone ;
CPD: Cefpodoxime ; CAZ:
Ceftazidime ; AMX : Amoxicilline ;
AMC :Amoxicilline +acide clavulanique ;
CIP : Ciprofloxocine ; NOR:
Norfloxacine ; C: Chloramphénicol ;
GEN: Gentamycine ; DOX:
Doxycycline ; COT : Cotrimoxazole ;
NIT: Nitrofurantoine ; R:
Résistant ; S : Sensible ;
ATB: Antibiotique.
Le tableau XII montre la résistance de
Staphylococcus sp en fonction du statut obésité,
il en ressort que les isolats de staphylocoques étaient
résistants à 100,00% à l'oxacycline et doxycycline et
à 73,33% (n=11) à cotrimoxazole chez les participants
obèses comparé à la population contrôle chez qui on
note des résistances à 94,12% (n=16), à 73,47% (n=13) et
à 64,71% (n=11) respectivement à ces mêmes antibiotiques,
mais cette variation était non significative (P>0,05).
Tableau
XII : Résistance de Staphylococcus sp (n=32) en fonction du statut
obésité abdominale
|
ATB
|
Obèses (n=15)
|
Non obèses (n=17)
|
X²
|
P-value
|
|
AMK
|
S (n=30)
|
14 (93,33%)
|
16 (94,12%)
|
0,00
|
0,53
|
|
R (n=2)
|
1 (6,67%)
|
1 (5,88%)
|
|
OXA
|
S (n=1)
|
0 (0,00%)
|
1 (5,88%)
|
0,00
|
0,48
|
|
R (n=31)
|
15 (100%)
|
16 (94,12%)
|
|
CHL
|
S (n=18)
|
9 (60,00%)
|
9 (52,94%)
|
0,00
|
0,48
|
|
R (n=14)
|
6 (40,00%)
|
8 (47,06%)
|
|
GEN
|
S (n=25)
|
10 (66,67%)
|
15 (88,24%)
|
1,09
|
0,14
|
|
R (n=7)
|
5 (33,33%)
|
2 (11,76%)
|
|
COT
|
S (=10)
|
4 (26,67%)
|
6 (35,29%)
|
0,02
|
0,44
|
|
R (n=22)
|
11 (73,33%)
|
11 (64,71%)
|
|
DOX
|
S (n=4)
|
0 (0,00%)
|
4 (23,53%)
|
2,16
|
0,06
|
|
R (n=28)
|
15 (100%)
|
13 (76,47%)
|
AMK :
Amykacine ; OXA :
Oxacilline ; CHL: Chloramphénicol ;
GEN: Gentamycine ; DOX:
Doxycycline ; COT : Cotrimoxazole ;
R: Résistant ; S : Sensible ;
ATB: Antibiotique.
III.1.8. Distribution de la multi-résistance des
isolats bactériens en fonction du statut obésité
La figure 6 indique la distribution de la
multi-résistance des isolats bactériens en fonction du statut
obésité, elle souligne que chez les obèses, les souches
isolées ont des fréquences de multi-résistances
élevée comparé à celles des participants non
obèses. Nous avons donc noté une prévalence de la
multi-résistance de38, 54% chez les participants obeses compare
à32, 40% Chez les non obeses.
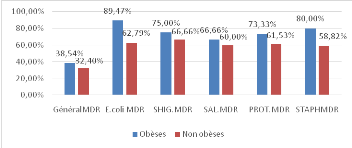
Figure 6 : distribution
de la multi-résistance en fonction du statut obésité
abdominale
III.2.
DISCUSSION
Pour notre étude qui portait sur la prévalence
de l'obésité abdominale et la résistance des
bactéries responsables des infections entériques à
l'hôpital AD-LUCEM de Mbouda, 115 patients remplissaient les
critères d'inclusion de notre étude. Les résultats obtenus
font état d'une prévalence de 50,43% de l'obésité
abdominale, soit 19,13% chez les hommes et de 31,30% chez les femmes. Ces
résultats corroborent ceux de Pouchain et al. (2009), qui ont
rapporté que la prévalence de l'obésité abdominale
à Lyon était de 55,9 % chez les femmes et de 47,9 % chez les
hommes. Une corrélation a été obtenue (p=0,00) entre
l'âge et le développement de l'obésité abdominale,
elle rapporte que la tranche d'âge la plus affectée par cette
obésité était celle de [40-50[avec une fréquence de
71,43% des obèses comparé à 28,57% des non obèses,
ces résultats montrent que l'âge est bien un facteur favorisant
l'obésité abdominale et vont en accord avec le rapport de ObEpi
en 2012 en France, qui a montré que l'obésité abdominale
croit avec l'âge. Le niveau scolaire semble également avoir un
effet significatif sur le développement de l'obésité
abdominale, on a constaté que le taux d'obèses est
élevé chez les participants ayant un bas niveau scolaire, soit
41,6% et 48,5% respectivement chez les hommes et les femmes, ces
résultats vont en accord avec les travaux de Matta et al(2016) en
France, qui ont rapporté que l'âge, le sexe et l'éducation
sont des facteurs prédisposant à l'obésité. En fin
l'hypertension, était constituée 66,67% (n=16) des obèses
comparés à la population non obèse chez qui l'on
rencontrait 33,33% (n=8) avec une différence significative (p=0,02), ce
qui va en accord avec l'affirmation de Pathak et al(2007), qui disait
que la progression de l'obésité dans le monde est en grande
partie responsable de l'hypertension artérielle.
Bien qu'elles ne soient pas significatives, les valeurs
moyennes de glycémie étaient plus élevées chez des
patients atteints d'obésité abdominale par rapport à la
population non obèse ; ceci rejoint les normes de l'OMS qui
considère le diabète comme étant une conséquence de
l'obésité abdominale. On a observé une valeur moyenne de
CRP élevée dans la population obèse comparée
à la population non obèse, ceci pourrait s'expliquer par le fait
que l'obésité est associée à un état
inflammatoire chronique de faible intensité qui se caractérise
par une augmentation des niveaux circulants des marqueurs de l'inflammation
systémique parmi lesquels la CRP (Vidal, 2003). Les valeurs moyennes
élevées des tours de taille observées chez les femmes
obèses par rapport aux hommes obèses témoignent la forte
prévalence de l'obésité abdominale chez ces
dernières.
Il ressort des analyses des isolats bactériens que,
E. coli était un entéropathogène le plus
dominante dans la population totale avec une fréquence de 70,43%. On a
noté également une augmentation des infections à
staphylococcus sp. (27,83%), àproteus sp. (24,35%),
à salmonella sp. (20,87%), et à shigella sp.
(12,17%) ; ces résultats corroborent ceux des travaux obtenus par
Marbou et Kuete en 2017 dans la même localité et dont la
fréquence était de 83,2%. Ceci pourrait être dû au
fait que E. coli soit la principale bactérie qui colonise
l'intestin (Nataro et Kaper, 1998).
Les résultats de la distribution des isolats
bactériens en fonction du statut obésité abdominale,
montrent que la fréquence des infections à Escherichia coli
est plus élevée chez les patients obèses et non
obèses ; Ils montrent aussi une prédominance des infections
à Salmonella sp (26,32%); chez les patients non obèses
comparés aux patients obèses chez qui nous avons noté une
fréquence de (15,52%). Par ailleurs il existe une faible variation entre
les taux d'infections à Shigella sp, à Proteus
sp et à Staphylococcus sp dans les deux populations. Ceci
est en accord avec les travaux de Carr et al(2018) en France, qui ont
rapporté que E. coli est un facteur déterminant dans la
propension à l'obésité.
La résistance bactérienne aux antibiotiques est
l'aptitude qu'à celle-ci de croître en présence d'une
concentration d'antibiotique supérieure à la concentration qui
inhibe la majorité des souches de la même espèce (Goossens
et al., 2006).
L'automédication plaiderait en faveur de
l'élévation de la résistance des isolats de E. coli,
Shigella sp, Salmonella sp et des Proteus spapparue chez les participants
obèses aux antibiotiques de la famille des bêta-lactamines, soit
100,00% à l'amoxicilline et 92,11%, 100,00%, 66,67% et 86,67% à
l'amoxicilline +acide clavulanique, respectivement vis à vis des isolats
sus-cités. Ces résistances seraient dues à la production
des enzymes bêta-lactamases qui hydrolysent les antibiotiques de la
famille des bêta-lactamines (pénicillinases) (Ruppé et
al., 2015)une surexpression des pompes à efflux de type
Resistance Nodulation Cell Division (RND) (Pages et al.,
2004; Chevalier et al., 2009; Kuete et al., 2010).
La résistance des E. coli et Salmonella
spcontrecotrimoxozole (84,21% et 88,67%) et à doxycycline (81,58%
et 66,67%) chez les obèses serait due soit à
l'imperméabilité des bactéries, soit à la
modification du site récepteur des antibiotiques, responsables de
l'expulsion de ces derniers (Puyt, 2010). La résistance significative de
E. coli à la Doxycycline pourrait s'expliquer par
l'imperméabilité de cette bactérie aux antibiotiques de la
famille des tétracyclines (Puyt, 2010).
La résistance des Shigelle sp. à la
cotrimoxazole (75,00%), à la ciprofloxacine (37,50%) et au
chloramphénicol (25,00%) serait due soit à la modification du
site récepteur des antibiotiques, soit à une mutation des porines
qui permet de réduire la perméabilité de ces antibiotiques
donc la résistance (Weiss et al., 2001).
La forte résistance des Staphylococcus sp soit
(100,00%) à l'oxacilline et doxycycline, à cotrimoxazole (73,33%)
chez les patients obèses pourrait s'expliquer par le fait que les
staphylocoques synthétisent les bêta-lactamases pour hydrolyser
les antibiotiques issus de la famille des bêta-lactamines (oxacilline).
Quant à la résistance à la doxycycline et au
cotrimoxazole, elle serait due à l'imperméabilité des
bactéries et à la modification du site récepteur
respectivement (Muylaert et Mainil, 2012).
Presque toutes les souches bactériennes isolées
et testées étaient sensibles à l'action de la
ciprofloxacine et du Nitrofurantoine dans les deux populations, Ramakrishna et
Singaracharya ont trouvé des résultats similaires en Inde avec
une sensibilité 90,78% faces aux bactéries Gram-négatives.
Le mode d'action du Nitrofurantoine n'est pas encore bien connu ;mais, il
est reconnu que dès son entrée dans la cellule
bactérienne, son site actif (est le groupe nitro) est activé par
les nitroréductases microbiennes, qui agiront par la suite en inhibant
un certain nombre d'enzymes bactériennes impliquées dans le
métabolisme glucidique à trois niveaux du cycle de Krebs, tout en
interférant aussi avec la synthèse de la paroi cellulaire. Cet
antibiotique est très actif sur les bactéries
multi-résistantes (Maria, 2014).
La multi-résistance se définie comme la
résistance d'une bactérie à trois ou plus de trois
antibiotiques appartenant aux familles d'antibiotiques différentes
(Martinez, 2009).De cette définition, on retient dans cette étude
que chez les patients obèses, toutes les souches isolées ont des
fréquences de multi-résistantes élevée
comparé à celles des participants non obèses. Nous avons
donc noté une prévalence de la multi-résistance de 38,54%
chez les participants obeses. Ce qui corrobore avec les travaux de Laxminarayan
et al(2013) en France qui ont montré que la fréquence
élevée de la multi-résistance des
entérobactéries est dû à la production de
bêta-lactamases.
CONCLUSION, RECOMMANDATIONS
ET PERSPECTIVES
|
La présente étude avait pour objectif
d'étudier la prévalence de l'obésité abdominale et
de la résistance des bactéries responsables des infections
entériques chez des patients venus en consultation à
l'hôpital AD-LUCEM de MBOUDA. Au terme de ce travail, les conclusions
suivantes peuvent être tirées :
Ø La prévalence de l'obésité
abdominale définie selon le tour de taille était de 50,43%, soit
19,13% chez les hommes et de 31,30% chez les femmes ;
Ø Il existe une fréquence plus
élevée des infections à Escherichia coli chez les
patients obèses et non obèses (65,62% et 75,44% respectivement)
comparée aux autres entérobactéries. Contrairement
à Escherichia coli, les infections à Salmonella
sp (26,32%) étaient élevées chez les patients non
obèses comparés aux patients obèses chez qui nous avons
noté une prévalence de 15,52%.La multi-résistance des
bactéries impliquées dans les infections entériques est
plus forte chez les patients obèses que chez des patients non
obèses ;
Les anomalies observées chez les patients obèses
sont probablement associées à l'excès des graisses dans
les tissus adipeux. La prévalence majeure du statut obese augmente le
développement de la multirésistance. Ainsi pour une meilleure
prise en charge des infections entériques, une meilleure surveillance de
l'obésité est indispensable.
Ces résultats obtenus suscitent les recommandations
suivantes aux autorités administratives, aux personnels de santé
et aux patients :
Ø Le renforcement des campagnes de sensibilisation
relatives à l'automédication, facteur de la
multi-résistance des bactéries chez les patients.
Ø La formation continue du personnel sanitaire dans la
prise en charge et l'adoption de doses des médicaments chez des
personnes obèses tout en tenant compte de la capacité des
bactéries opportunistes à développer la
multi-résistance chez ces patients.
Ø Inscription dans le carnet de santé des
patients le calcul de tour de taille et l'IMC pour contrôler
l'obésité et ses complications.
Comme perspective, nous envisageons dans le futur
Ø D'tendre nos travaux dans d'autres régions du
Cameroun et au Tchad ;
Ø Augmenter la taille de notre échantillonnage
afin de comparer des résultats plus consistants.
Afrid A.K., Khan A. (2004). Prevalence and
etiology of obesity an overview. Pakistan Journal of Nutrition.
3(1):14-25
Ashwell M., Chinn S., Stalley S., Garrow J.S.
(1982). Female fat distribution - a simple classification based on two
circumferencemeasurements.International Journal of Obesity.6:
143-52
Bernard Guy-Grand. (2013). Cahiers de
nutrition et diététique : Immunité et
obésité. Elsevier Masson SAS, 48 (4): 155-156
Berrington de Gonzalez A., Hartge P., Cerhan J.R.,
Hannan L., Maclnnis R.J. (2010). Body-mass index and
mortality among 1.46 million white adults. New England Journal of
Medicine, 363:2211-2219
Bonaz B. (2011).
Généralités sur le tube digestif. Notes de cours.
Université Joseph Fourier de Grenoble, France. 35 pages,
Bourne R. (2014). Utility of the biosynthetic
folate pathway for targets in antimicrobial discovery. Antibiotics 3:
1-28
Bourron O. (2012).Physiologie et
physiopathologie de la dysfonction â-cellulaire dans
l'obésité: Quels mécanismes? Diabète et
obésité, 7(60):182-186.
Breed N. R., Murray E.G.D. (1937). Family IV.
Enterobacteriaceae Rahn. In: R.S.
Carey V.J., Walters E.E., Colditz G.A., Solomon C.G.,
Willett W.C. (1997). Body fat distribution and risk of
insulin-dependent diabetes mellitus in women. The Nurses'Health Study.
American Journal Epidemiology, 145: 614-619
Chan J.M., Eimm E.B., Colditz G.A., Stampfer M.J.,
Willett W.C. (1994). Obesity, fat distribution and weight gain as risk
factors for clinical diabetes in men. Diabetes Care, 17: 961-969
Chevalier J., Pagès J.M., Eyraud A.,
Malléa M. (2000). Membrane permeability modifications are
involved in antibiotic resistance in Klebsiella pneumonia.
Biochemical and Biophysical Research Communications, 274: 496-499.
Christopher K., Bruno E. (2003).
Identification of bacterial species. In Tested studies for laboratory teaching.
Ed., O'Donnell MA. Proceedings of the 24th Workshop/Conference of the
Association for Biology Laboratory Education, 24:103-130.
Clinical Laboratory Standards Institute (CLSI).
(2014). Performance Standards for Antimicrobial Susceptibility
Testing; 18th Informational Supplement. CLSI standard M100-S18. Wayne, PA:
Clinical and Laboratory Standards Institute.
Cocito C., Giambattista M. (1990). Les
antibiotiques inhibiteurs de la synthèse protéique.
Medecine/sciences, 6(1): 46-54.
Coffin B. (2011). Traitements
mécaniques: ballon intragastrique. Traité Médecine et
Chirurgie de l'obésité. Medecine Sciences Publications.
Lavoisier, 477-479pages
Colilla S., Rotimi C., Cooper R. (2000).
Genetic inheritance of body mass index in African-American and African
families.Genetic Epidemiology. 18(4):360-376.
CSCQ. (2015).
http://www.cscq.ch/SiteCSCQ/FichierPDF_FR/crp.pdf. Consulté le 08 juin
2018
Denis F., Ploy C. M., Martin C., Bingen E et Quentin
R. (2007). Bactériologie médicale : Techniques usuelles.
Ed. Elsevier Masson SAS, P.335-401
Deruelle P. (2011). Gynécologie
Obstétrique et Fertilité. Original Research Article
39(2):100-105
Diallo A. (2015).Escherichia coli
pathogènes et résistantes aux antibiotiques dans les effluents
d'origine humaine et animale : Prévalence et caractérisation
avant et après traitement épuratoire. Thèse de
doctorat : microbiologie. Toulouse : l'Université de
Toulouse.204 pages.
Dievart F. (2005). Le cardiologue,
l'obésité abdominale et le risque cardiovasculaire.
Synthèse pour la pratique. Clinique Villette, DUNKERQUE, N° 212
Dubos R. (2012). Résistance aux
antibiotiques : une impasse thérapeutique Implications nationales et
internationales .Séance thématique inter-académique; de
médecine, Académie nationale de Pharmacie, Académie
vétérinaire de France. Compte rendu: 128pages
Dufour J.P. (2005). Les diarrhées du
macaque cynomolgus (Macaca fasciculaires): essai de prophylaxie dans un
élevage de l'île Maurice. Université Paul-Sabatier De
Toulouse. Thèse pour obtenir le grade de docteur
vétérinaire. p. 65.
Dyar A.R., Elliott P. (1989). On behalf of
the INTERSALT Cooperative research Group. The INTERSALT study: relations of
body mass index to blood pressure. Journal of Human hypertension, 3:
299-308
Epand R., Walker C., Epand F., Magarvey N. (2016).
Molecular mechanisms of membrane targeting antibiotics. Biochimica
et Biophysica Acta, 1858: 980-987.
Etoundi N.L.S., Longo F., Melaman S.F., Temgoua T.S.,
Bopelet M. (2012): Obésité, hypertension
artérielle et diabète dans la population des femmes de l'Ouest du
Cameroun. Medicine d'Afrique Noire; 48: 391-3.
Faure E. (2000); Mise à jour,
Jordan-Meille, Mars 2002. L'obésité.
Flatt J.P. (1988). Importance of nutrient
balance in body weight regulation. Diabetes/Metabolism Reviews,
4:571-581.
Flatt J.P., Ravussin E., Acheson K.J., Jéquier
E. (1985). Effects of dietary fat on postprandial substrate oxidation
and on carbohydrate and fat balances. Journal of Clinical
Investigation, 76: 1019-1024.
Friedewald W., Levy R., Fredrickson D.
(1978). Estimation of the concentration of low density lipoprotein
cholesterol in plasma without use of the preparative ultracentrifuge. Clin
Chem, 18:499-502.
Garrow J.S., Summerbell C.D. (1995).
Meta-analysis: effect of exercise, with or without dieting, on the
body composition of overweight subjects. European Journal of Clinical
Nutrition, 49:1-10.
Gaurav A., Singh S.P., Gill, J.P.S; Kumar, R; Kumar,
D. (2013). Isolation and identification of Shigella spp. from human
fecal samples collected from Pantnagar, India. Vet World, 6(7):
376-379.
Goossens H., Guillemot D., Ferech M., Schlemmer B.,
Coster, M., van Breda M., Baker L.J., Cars O., Davey P.G. (2006).
National campaigns to improve antibiotic use.European Journal of Clinical
Pharmacology, 62: 373-379.
Guerciolini R. (1997). Mode of action of
orlistat. International Journal of Obesity and Related Metabolic
Disorders, 21 (3):12-23.
Haffner S.M. (2006). Abdominal Obesity,
Insulin Resistance, and Cardiovascular Risk in Pre-Diabetes and Type 2
Diabetes. European Heart journal, 8: 20-25.
Haute Autorité de santé.
(2011). Surpoids et obésité de l'adulte : prise en
charge médicale de premier recours. Recommandation de bonne pratique.
Paris: HAS, 133pages.
Hill J.O., Melanson E.L. (1999). Overview of
the determinants of overweight and obesity: Current evidence and research
issues. Medicine and science in sport and exercise, 31: 515-521
Hill J.O., Wyatt H.R., Melanson E.L. (2000).
Genetic and environmental contributions to obesity. Medical clinics of
north America, 84:333-346
Hofbauer K.G. (2002). Molecular pathways to
obesity. International Journal of Obesity Related Metabolic Disorders,
26(2): 18-27.
Horton T.J., Drougas H., Brachey A., Reed G.W., Peters
J.C., Hill J.O. (1995). Fat and carbohydrate overfeeding in humans:
different effects on energy storage. American Journal of Clinical
Nutrition, 62:19-29.
Hsun-Chin C., Chien-Chang C., Shih-Yen C., Cheng-Hsun
C. (2014). Bacterial enteric infections in children: etiology,
clinical manifestations and antimicrobial therapy. Expert review of
anti-infective therapy, 10: 629-638.
John R., Downs M.D., Patrick G.O'Malley.
(2015). Management of Dyslipidemia for Cardiovascular Disease Risk
Reduction: Synopsis of the U.S. Department of Veterans Affairs and U.S.
Department of Defense Clinical Practice Guideline. Annals of Internal
Medicine, 163 (4): 291-297.
Johnson F., Mavrogianni A., Ucci M., Vidal-Puig A.,
Wardle J. (2011). Could increased time spent in a thermal comfort zone
contribute to population increases in obesity? Obesity Reviews,
12(7):543-551
Julian D and Dorothy D. (2010). Origins and
evolution of antibiotic resistance. Microbiology and Molecular Biology
Reviews, 74: 417-433.
Kannei W.B., Brand N., Skinner J.J., Dawber T.R.,
McNamara P.M. (1967). The relation of adiposity to blod pressure and
developpement of hypertension: the Framingham study. Annals of internal
Medicine, 67: 48-59
Kral J. (1995). Surgical treatment of
obesity. In: Wadden TA, Van Itallie TB. Treatment of the seriously obese
patient. New York, Guilford Press, 496-506.
Kuete V., Ngameni B., Tangmouo G.J., Bolla J.M.,
Alibert-Franco S., Ngadjui T.B., Pagès J.M. (2010). Efflux
Pumps Are Involved in the Defense of Gram-Negative Bacteria against the Natural
Products Isobavachalcone and Diospyrone. Antimicrobial Agents and
Chemotherapy. 54 (5): 1749-1752.
Laxminarayan R et al. (2015). Les
bactéries multi-résistantes en 2015: du SARM aux BLSE et EPC,
épidémiologie, causes et conséquenceslancet infect
dis;13 (12):1057-98
Le Minor L., Veron N. (1989).
Bactériologie Médicale. Flam Med. Science, Paris,
333-318; 773-823.
Lemieux S., Prud'homme D., Bouchard C., Tremblay A.,
Desprès J.P. (1993).Sex differences in the relation of visceral
adipose tissue accumulation to total body fatness. American Journal of
Clinical Nutrition, 58: 463-467.
Lore E.S. (2016):santé plus de 2
millions de Camerounais affetés par l'obésité[archive].
Cameroun-info.net. (consulté le 04 Mars 2018).
Majowicz S.E., Edge V.L., Fazil A et Coll.
(2005). « Estimating the under-reporting rate for infectious
gastrointestinal illness in Ontario». Revue Canadienne de Santé
Publique, 96(3): 178-181.
Mandengue S.H., Bita Fouda A.A., Epacka E.M., Moumbe
T.S., Kollo B. (2015). Épidémiologie de
l'obésité en milieu estudiantin à Douala, Cameroun.
Medecine et Santé Tropicales, 25 : 386-391
Maria Jose Munoz-Davila. (2014). Role of old
antibiotics in the era of antibiotic resistance. Highlighted Nitrofurantoin for
the treatment of lower urinary tract infections. Review; Antibiotics,
3: 39-48.
Martin C., Vincent J.L. (2005). Sepsis
sévère et choc septique édition Springer- Verlag,
France. P: 171.
Martinez J.L. (2009). The role of natural
environments in the evolution of resistance traits in pathogenic bacteria.
Proc. Biol. Sc, 276(1667): 2521-2530.
Matta J., Zins M., Feral-Pierssens A.L., Carette C.,
Ozguler A., Goldberg M et al. (2016). Prévalence du
surpoids, de l'obésité et des facteurs de risque
cardio-métaboliques dans la cohorte Constances. Bull
Epidémiologie Hebdomadaire, 6(640): 35-36.
Mazza M., Marano G., Traversi G., Bria P., Mazza S.
(2011). Primary cerebral blood flow deficiency and Alzheimer's
disease: Shadows and Lights. Journal of Alzheimer'sDisease,
23(3):375-389.
McFarland J., Jama M.D. (1907).
Néphélomètre: un instrument pour estimer le nombre de
bactéries des suspensions utilisées pour calcul de l'indice et
opsoniques pour les vaccins. XLIX, (14): 1176-1178.
Meghdas I., Hamze M., Baida N., Izard D.
(2004).Taxonomie du genre pseudomonas:Rétrospective et
actualité. Le banese Science Journal, 5(1), 115-138.
Meziani M. (2012) Contribution du diagnostic
biochimique bactérien dans l'établissement des parentés
phylogénétiques : Cas des Entérobactéries et
Pseudomonas. Mémoire de Magistère, Université Mentouri
Constantine.132 pages
Meziani M. (2012). Mémoire de
Magistère, Contribution du diagnostic biochimique bactérien dans
l'établissement des parentés phylogénétiques : Cas
des Entérobactéries et Pseudomonas, Université Mentouri
Constantine. p.3.
Modi N., Murgasova D., Rikke R.M., Thomas E., Hyde L.,
Matthew J., Gale C., Santhakumaran S., Caroline J., Afshin A., Bell J. D. J.
(2011). The Influence ofMaternal Body Mass Index on Infant Adiposity
and Hepatic Lipid Content; PediatricResearch, 70(3):287-291.
Monnet T. (2011). Les infections nosocomiales
: l'importance d'un suivi épidémiologique et de l'identification
rapide des bactéries en cause. Thèse de doctorat en pharmacie,
diplôme d'état, faculté de pharmacie de Grenoble.
Mordi R., Momoh M. (2009). Incidence of
Proteus species in wound infections and their sensitivity pattern in the
University of Benin Teaching Hospital. African Journal of
Biotechnology, 8 (5): 725-730.
Moulin P., Vergès B. (2016). Principes
de prise en charge des dyslipidémies de l'adulte : Médecine
Clinique endocrinologie et diabète, 80: 14.
Mounier J., Popoff M.R., Enninga J., Frame M.C.,
Sansonetti P.J., Van Nhieu G.T. (2009) « The IpaC carboxyterminal
effector domain mediates Src-dependent actin polymerization during Shigella
invasion of epithelial cells »,PLoS Pathog., 5(1): e1000271.
Mukherjee M., Basu S., Mukherjee S.K., Majumder
M.(2013): Multidrug-resistance and extended spectrum beta-lactamase
production in uropathogenic E. coli which were isolated from hospitalized
patients in Kolkata, India. J Clin Diagn Res, 7: 449.
Muylaert A., MAINIL j.g. (2012).
Résistances bactériennes aux antibiotiques : les
mécanismes et leur « contagiosité » Ann.
Méd. Vét. 156, 109-123.
Navarro-Diaz M., Serra A., Lopez D., Granada M., Bayes
B., Romero R. (2008). Obesity, inflammation, and kidney disease.
Kidney International,111:15-18.
Ng M., Fleming T., Robinson M. et al.Global
(2014), regional, and national prevalence of overweight and
obesity in children and adults during 1980-2013:a systematic analysis for the
Global Burden of Disease Study 2013 [archive] The Lancet, 384:
766-781.
Ngounou M.D.F., Etapelong S.G et Kollo B.
(2012):Epidémiologie de l'obésité en milieu du
travail à Douala, Cameroun.Rev Med Brux;33:
131-7
Nicklas B.J., Penninx B.W., Cesari M et al.
(2004). Association of visceral adipose tissue with incident
myocardial infarction in older men and women The Health, aging and body
composition study. Am J Epidemiol, 160:741-9.
Omar L., Salwa L., Nadia M., Maria L.,
Frédéric D., and Chakib L. (2017).Dépistage et
prévalence des principaux composants du syndrome métabolique chez
les professionnels de soins au Maroc. Innovative Space of Scientific
Research Journals, 20(3): 863-869
Organisation Mondiale de la Santé.
(2000). Rapport d'une consultation de l'OMS-Obésité :
prévention et prise en charge de l'épidémie mondiale.
Série de rapports techniques. Genève, (894)
Organisation Mondiale de la Santé.
(2006).Obésité et surpoids [en ligne],
disponible sur
http://www.who.int (consulté
le 10 février 2018).
Organisation Mondiale de la Santé.
(2007).Le défi de l'obésité dans la région
européenne de l'OMS et les stratégies de lutte. OMS.10
Septembre.
Organisation Mondiale de la Santé.
(2014): Obésité : prévention et prise en charge
de l'épidémie mondiale. Rapport technique.
Genève, 894: 15-65
Organisation Mondiale de la Santé. (2016).
Obésité et surpoids : Aide-mémoire
N°311[en ligne] disponible sur
<http://www.who.int/mediacentre/factsheets/fs311/fr/> (consulté le
10 Mars 2018)
Padwal R.S., Majumdar S.R., (2007).Drug
treatments for obesity: orlistat, sibutramine, and rimonabant.Lancet,
369: 71-77.
Pagès J.M. (2004). « Porines
bactériennes et sensibilité aux antibiotiques ».
médecine/sciences, 20 (3): 346-351.
Paquot N., De Flines J., Rorive M. (2012).
L'obésité: un modèle d'interactions complexes entre
génétique et environnement. Revue Médicale de
Liège, 67(5-6): 332-336.
Pathak A., Rouet P., Despas F., Jourdan G., Verwaerde
P., Galinier M., Senard J.M. (2007). Obésité et
hypertension artérielle : épidémiologie, physiopathologie
et priseen charge. MT Cardio, 3(3):169-77.
Peltola H., Jaakkola M. (1987). C-reactive
protein in early detection of bacteremic versus viral infections in
immunocompetent and compromised children. Issue. Volume, 113 (4):
641-646.
Popkin B.M., Paeratakul S., Zhai F., Ge K.
(1995).Dietary and environmental correlates of obesity in a population
study in China. Obesity Research, 3(2):135-143.
Pouchain D., Amouyel Ph., Bringer J et al.
(2009).Prévalence de l'obésité abdominale en
médecine générale et corrélations avec les facteurs
de risque cardiovasculaire Médecine générale - Lyon 85
pages.
Poulain M., Doucet M., Major G.C., DrapeauV.,
Sériès F., Boulet L.P., Tremblay A., Maltais F. (2006).
The effect of obesity on chronic respiratory diseases:pathophysiology
and therapeutic strategies. Canadian Medical Association
Journal,174:1293-1299.
Profenno L.A., Porsteinsson A.P., Faraone S.V. (2010).
Meta-analysis of Alzheimer's disease risk with obesity, diabetes, and
related disorders. Biologycal Psychiatry;67(6):505-512.
Reaven G.M. (1988). Banting lecture: role of
insulin resistance in human disease. Diabetes, 37: 1595-1607
Ricquier D. (1994).
Obésité et recherche. médecine/sciences, 10:
1079-1081.
Ridker P.M. (2003). Clinical application of
C-reactive protein for cardiovas-cular disease detection and prevention.
Circulation. Pub Med, 107: 363-369.
Rising R., Harper I.T., Fontvieille R.T., Ferraro
R.T., Spraul M et Ravussin E. (1994).Determinants of total daily
energy expenditure: variability in physical activity. American Journal of
Clinical Nutrition, 59: 800-804.
Santos G.S., Solidônio E., Costa M., I.F.A.C de
Souza., Silva G., Sena K.X.F.R. (2015). Study of the
Enterobacteriaceae Group CESP (Citrobacter, Enterobacter, Serratia,
Providencia, Morganella and Hafnia) A. Méndez-Vilas, 12:
794-805.
Schapira D.V.,Clark R.A., Kumar N.B., Aziz N.M.
(1994). Visceral obesity and breast cancer risk. Cancer,
74:632-639.
Schulz L.O., Schoeller D.A. (1994).A
compilation of total daily energy expenditures and body weights in healthy
adults. American Journal of Clinical Nutrition, 60: 676-681.
Sellam E.B., Bour A. (2014). Etat
nutritionnel chez des femmes de l'oriental marocain.Antropo,
31 :77-88
Shaw K.A., O'Rourke P., Del Mar C., Kenardy J.
(2005).Psychological interventions for overweight or obesity.
Cochrane Database of Systematic Reviews. 18(2).
Skender M.L., Goodrick G.K., Del Junco D.J., Reeves
R.S., Darnell L., Gotto A.M., Foreyt J.P. (1996). Comparison of 2 year
weight loss trends in behavioral treatments of obesity: diet, exercise, and
combination interventions. Journal of the American Dietetic
Association, 96: 342-346.
Skurk T., Hauner H. (2004). Obesity and
impaired fibrinolysis : role of adipose production of plasminogen activator
inhibitor-1 . International Journal of Obesity RelatedMetabolic
Disorder. 28 :1357-64.
Sullivan M., Karlsonn J., Sjostrom L., Backman L.,
Bengtsson C., Bouchard C., Dahlgren S., Johsson E., Larsson B., Lindstedt S.
(1993). Swedish obese subjects(SOS) --an intervention study of
obesity. Baseline evaluation of health andpsychosocial functioning in the first
1743 subjects examined.International Journal ofObesity and Related
Metabolic Disorders, 17:503-512.
Thiaw A. (1998). Les Salmonelloses Au C.H.U.
De Fann: Aspects Bactériologiques. Université CHEIKH ANTA DIOP.
Dakar, Sénégal 136 pages.
Tsigos C., Hainer V., Basdevant A., Finer N., Fried M.
(2008).Management of obesity in adults: european clinical practice
guidelines. Obesity Facts, 1(2): 106-116.
Tuomilheto J.,Lindstrom J., Eriksson J.G. (2011).
Prevention of type 2 diabetes mellitus by changes in life style among
subjects with impaired glucose tolerance. New EnglandJournal
ofMedicine, 344: 1343-1350
Vaessen S., Twisk J., Kastelein J. et Kuivenhoven J.
(2007). Gene Therapy in Disorders of Lipoprotein Metabolism. Current
Gene Therapy, 7: 35-37
Van Gaal L.F., Aila L., Rissanen M., Scheen A.J.,
Ziegler O., Rössner S. (2005). Effects of the cannabinoid-1
receptor blocker rimonabant on weight reduction andcardiovascular risk factors
in overweight patients: 1-year experience from the RIO-Europe study,
365: 1389-1397.
Vulgaris-medical. (2009).
Obésité (Classification): Définition
Wannamethee S.G., Shaper A.G., Walker M. (2005).
Overweight and obesity and weight change in middle aged men: impact on
cardiovascular disease and diabetes. JournalEpidemiology Community
Health.59: 134-139
Weiss K., Azavedo D., Restieri J., Quach C.,
Laverdiere C., Rubin E. (2001). In vitro activity of a novel ketolide,
ABT-773 against invasive strains of Streptococcus pneumoniae.
Journal of Antimicrobial Chemotherapy, 48: 407-409.
WHO. (2001). Obesity:
preventing and managing the global epidemic: Report of a WHO consultation. WHO
Technical Report Series, (894).
Wilberger M. S., Kate E.A., Sasha R., Matt M.C., Luiz
E.B. (2012). Beta-Lactam Antibiotic Resistance among Enterobacter spp.
Isolated from Infection in Animals. Advances in Microbiology, 2:
129-137. 9pages
Wiliane J.T.M et Victor K. (2017). Bacterial
resistance and immunologicalprofiles in HIV-infected and non-infectedpatients
at Mbouda AD LUCEM Hospital in Cameroon:Journal of Infection and Public
Health, 10: 269-276
Wing R.R. (1992). Behavioral treatment of
severe obesity. American Journal of Clinical Nutrition, 55(2):
545-555.
Wolf H.K., Tuomilehto J., Kuulasmaa K., Domarkiene S.,
Cepaitis Z., Molarius A., Sans S., DobsonA., Keil U., Rywik S. (1997).
Blood pressure levels in the 41 populationsof the WHO MONICA project.
Journal Human of Hypertension. 11(11) :733-742.
Wolk A., Lindblad P., Adami H.O. (1996).
Nutrition and renal cell cancer. Cancer Causes and Control, 7:5-18.
Xu Y., Ramos E.J., Middleton F., Romanova I., Quinn
R., Chen C. (2004). Gene expression profiles post Roux-en-Y
gastricbypass. Surgery, 136(2):246-5
Zhang Y., Proenca R., Maffei M., Barone M., Leopold L
et Friedman J.M. (1994).Positional cloning of the mouse obese gene and
its human homologue. Nature. 372: 425-432.
ZIAI S. (2014). La résistance
bactérienne aux antibiotiques : apparition et stratégies de
lutte : Thèse de doctorat: santé. Limoges :
université de Limoges, 151 pages.
Zoltan P., Elisabetta B.H., Carpentier A.A et Golay
A.H. (2009): Rev Med Suisse, 662-666.
Annexe
1: Résultats complets des patients obèses
|
Code
|
Age
|
Sexe
|
poids
|
taille
|
IMC
|
T. Taille
|
glycémie
|
T.A
|
CRP
|
Bactéries
|
diamètre d'inhibition des antibiotiques (mm)
|
|
|
|
|
|
|
|
|
|
|
isolées et
|
CTR
|
CPD
|
CAZ
|
AMX
|
AMC
|
CIP
|
NOR
|
CHL
|
GEN
|
DOX
|
COT
|
NIT
|
AMK
|
OXA
|
|
|
|
|
|
|
|
|
|
|
Identifiées
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
46
|
M
|
93
|
1,58
|
37,25
|
112
|
0,7
|
137/83
|
6
|
E.coli
|
|
30S
|
23S
|
20I
|
00R
|
10R
|
30S
|
28S
|
25S
|
20S
|
20S
|
00R
|
08R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
32S
|
09R
|
19I
|
00R
|
00R
|
20R
|
30S
|
30S
|
16I
|
14R
|
00R
|
16S
|
/
|
/
|
|
2
|
73
|
M
|
76
|
1,58
|
30,44
|
97
|
1,01
|
134/84
|
6
|
E.coli
|
|
08R
|
00R
|
13R
|
09R
|
00R
|
34S
|
28S
|
07R
|
10R
|
09R
|
00R
|
13S
|
/
|
/
|
|
3
|
43
|
M
|
75
|
1,56
|
30,81
|
99
|
2,83
|
135/90
|
6
|
Proteus sp
|
19R
|
20R
|
09R
|
00R
|
00R
|
22R
|
09R
|
18S
|
14I
|
20S
|
16S
|
08R
|
/
|
/
|
|
4
|
37
|
M
|
85
|
1,68
|
30,11
|
96
|
0,99
|
143/80
|
6
|
Salmonella sp
|
28S
|
27S
|
23S
|
00R
|
19I
|
36S
|
23S
|
28S
|
22S
|
17I
|
00R
|
32S
|
/
|
/
|
|
5
|
47
|
F
|
83
|
1,64
|
30,85
|
98
|
2,23
|
123/80
|
6
|
E.coli
|
|
20R
|
14R
|
18R
|
00R
|
00R
|
28S
|
22S
|
25S
|
19S
|
10R
|
00R
|
10R
|
/
|
/
|
|
6
|
70
|
M
|
86
|
1,6
|
33,59
|
100
|
0,8
|
160/79
|
6
|
E.coli
|
|
26S
|
24S
|
20I
|
00R
|
00R
|
30S
|
14R
|
15R
|
14I
|
10R
|
00R
|
11I
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
08R
|
22S
|
08R
|
00R
|
/
|
20I
|
07R
|
|
7
|
36
|
F
|
87
|
1,53
|
37,16
|
101
|
0,85
|
113/93
|
6
|
E.coli
|
|
20R
|
12R
|
15R
|
00R
|
17R
|
30S
|
20I
|
20S
|
20S
|
16R
|
00R
|
07R
|
/
|
/
|
|
8
|
42
|
F
|
107
|
1,6
|
41,79
|
122
|
1,03
|
147/86
|
192
|
E.coli
|
|
20R
|
16R
|
00R
|
00R
|
00R
|
08R
|
00R
|
20R
|
00R
|
00R
|
00R
|
08R
|
08R
|
00R
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
00R
|
11R
|
14R
|
00R
|
/
|
/
|
/
|
|
9
|
57
|
F
|
75
|
1,52
|
32,46
|
92
|
0,89
|
138/80
|
12
|
E.coli
|
|
32S
|
26S
|
24S
|
00R
|
00R
|
34S
|
30S
|
30S
|
21S
|
12R
|
00R
|
12S
|
/
|
/
|
|
10
|
25
|
F
|
94
|
1,52
|
40,68
|
99
|
0,98
|
146/90
|
6
|
E.coli
|
|
20R
|
20R
|
18R
|
00R
|
08R
|
24I
|
10R
|
11R
|
17I
|
09R
|
00R
|
16S
|
/
|
/
|
|
11
|
60
|
F
|
84
|
1,58
|
33,64
|
90
|
1,1
|
140/72
|
24
|
E.coli
|
|
33S
|
20R
|
23S
|
00R
|
00R
|
30S
|
32S
|
33S
|
19S
|
17I
|
00R
|
19S
|
/
|
/
|
|
12
|
43
|
M
|
106
|
1,78
|
33,45
|
101
|
1,1
|
122/76
|
6
|
E.coli
|
|
32S
|
10R
|
26S
|
00R
|
14R
|
33S
|
28S
|
32S
|
22S
|
08R
|
11I
|
19S
|
/
|
/
|
|
13
|
42
|
M
|
88
|
1,7
|
30,44
|
94
|
0,89
|
120/71
|
6
|
Shigella sp
|
14R
|
20R
|
25S
|
00R
|
07R
|
16R
|
20I
|
14R
|
22S
|
20S
|
20S
|
15S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
30S
|
21S
|
19I
|
16I
|
/
|
26S
|
14R
|
|
14
|
38
|
M
|
81
|
1,62
|
30,86
|
95
|
0,91
|
116/56
|
192
|
E.coli
|
|
11R
|
25S
|
25S
|
00R
|
07R
|
28S
|
22S
|
10R
|
10R
|
08R
|
00R
|
16S
|
/
|
/
|
|
15
|
51
|
M
|
107
|
1,59
|
42,32
|
130
|
0,87
|
140/66
|
96
|
Proteus sp
|
32S
|
25S
|
23S
|
14R
|
20S
|
36S
|
30S
|
33S
|
21S
|
25S
|
00R
|
15S
|
/
|
/
|
|
16
|
25
|
F
|
81
|
1,62
|
30,86
|
90
|
0,9
|
137/86
|
6
|
Salmonella sp
|
36S
|
24S
|
25S
|
00R
|
00R
|
32S
|
23S
|
14R
|
16I
|
09R
|
08R
|
19S
|
/
|
/
|
|
17
|
30
|
M
|
83
|
1,54
|
34,99
|
96
|
0,71
|
135/72
|
6
|
Shigella sp
|
28S
|
23S
|
18R
|
00R
|
16R
|
30S
|
24S
|
30S
|
20S
|
20S
|
00R
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
26S
|
25S
|
24S
|
00R
|
06R
|
21R
|
18R
|
30S
|
20S
|
10R
|
00R
|
18S
|
/
|
/
|
|
18
|
70
|
M
|
88
|
1,67
|
31,55
|
124
|
1,36
|
184/86
|
12
|
Shigella sp
|
20R
|
18R
|
10R
|
00R
|
00R
|
25I
|
23S
|
26S
|
20S
|
09R
|
00R
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
20S
|
11R
|
00R
|
/
|
20I
|
08R
|
|
19
|
40
|
F
|
140
|
1,6
|
40,58
|
120
|
0,8
|
102/78
|
6
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
32S
|
22S
|
00R
|
00R
|
/
|
25S
|
00R
|
|
20
|
34
|
F
|
86
|
1,6
|
33,59
|
98
|
2,34
|
113/70
|
6
|
E.coli
|
|
10R
|
11R
|
00R
|
00R
|
00R
|
10R
|
20I
|
09R
|
08R
|
00R
|
10R
|
10R
|
/
|
/
|
|
21
|
43
|
M
|
94
|
1,6
|
36,71
|
100
|
0,9
|
154/70
|
192
|
Shigella sp
|
10R
|
00R
|
00R
|
00R
|
00R
|
21R
|
13R
|
00R
|
20S
|
14R
|
00R
|
16S
|
/
|
/
|
|
22
|
40
|
M
|
98
|
1,75
|
32
|
98
|
0,75
|
114/68
|
6
|
Salmonella sp
|
16R
|
00R
|
25S
|
00R
|
16R
|
35S
|
20I
|
14R
|
15I
|
21S
|
00R
|
13S
|
/
|
/
|
|
23
|
42
|
F
|
88
|
1,55
|
36,62
|
120
|
1,62
|
110/68
|
6
|
E.coli
|
|
23I
|
08R
|
00R
|
00R
|
00R
|
28S
|
25S
|
30S
|
18S
|
16R
|
00R
|
10R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
32S
|
20R
|
10R
|
00R
|
00R
|
22R
|
31S
|
32S
|
14I
|
00R
|
00R
|
09R
|
/
|
/
|
|
24
|
40
|
F
|
90
|
1,6
|
35,15
|
92
|
0,92
|
140/70
|
6
|
E.coli
|
|
24I
|
23S
|
00R
|
00R
|
08R
|
30S
|
20I
|
21S
|
16I
|
10R
|
00R
|
14S
|
/
|
/
|
|
25
|
37
|
M
|
101
|
1,72
|
34,14
|
120
|
1,1
|
192/81
|
6
|
E.coli
|
|
20R
|
20R
|
10R
|
00R
|
00R
|
28S
|
23S
|
17I
|
00R
|
08R
|
00R
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
30S
|
14I
|
07R
|
10R
|
/
|
24S
|
12R
|
|
26
|
69
|
F
|
72
|
1,53
|
30,75
|
95
|
0,75
|
119/62
|
6
|
Proteus sp
|
14R
|
29S
|
18R
|
00R
|
07R
|
31S
|
28S
|
15R
|
14I
|
11R
|
00R
|
16S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
23S
|
16I
|
10R
|
10R
|
/
|
20I
|
00R
|
|
27
|
31
|
M
|
87
|
1,63
|
32,74
|
102
|
1,06
|
111/86
|
6
|
Proteus sp
|
20R
|
20R
|
12R
|
00R
|
00R
|
25I
|
13R
|
12R
|
16I
|
19S
|
18S
|
11I
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
00R
|
22S
|
00R
|
00R
|
/
|
21I
|
00R
|
|
28
|
31
|
F
|
92
|
1,52
|
39,81
|
103
|
1,28
|
176/104
|
6
|
E.coli
|
|
14R
|
22S
|
25S
|
10R
|
10R
|
20R
|
08R
|
20S
|
16I
|
10R
|
00R
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
35S
|
30S
|
28S
|
00R
|
19I
|
32S
|
20I
|
29S
|
21S
|
21S
|
00R
|
20S
|
/
|
/
|
|
29
|
25
|
F
|
76
|
1,58
|
30,44
|
82
|
0,76
|
124/76
|
6
|
E.coli
|
|
23I
|
20R
|
18R
|
11R
|
19I
|
34S
|
24S
|
18S
|
14I
|
19S
|
00R
|
14S
|
/
|
/
|
|
30
|
52
|
F
|
114
|
1,65
|
41,87
|
111
|
0,87
|
128/80
|
6
|
E.coli
|
|
18R
|
20R
|
20I
|
00R
|
00R
|
37S
|
25S
|
20S
|
20S
|
15R
|
00R
|
14S
|
/
|
/
|
|
31
|
23
|
M
|
95
|
1,68
|
33,65
|
102
|
0,84
|
103/61
|
6
|
E.coli
|
|
30S
|
25S
|
21I
|
00R
|
00R
|
30S
|
26S
|
31S
|
25S
|
09R
|
00R
|
20S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
25S
|
18S
|
08R
|
20S
|
/
|
20I
|
00R
|
|
32
|
21
|
M
|
76
|
1,59
|
30,06
|
95
|
0,96
|
104/77
|
6
|
Shigella sp
|
24I
|
20R
|
11R
|
00R
|
00R
|
30S
|
25S
|
27S
|
12R
|
10R
|
00R
|
13S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
25S
|
14I
|
07R
|
14I
|
/
|
26S
|
00R
|
|
33
|
33
|
F
|
77
|
1,48
|
35,15
|
100
|
1,19
|
101/66
|
6
|
Proteus sp
|
32S
|
24S
|
24S
|
00R
|
00R
|
22R
|
20I
|
30S
|
18S
|
10R
|
00R
|
18S
|
/
|
/
|
|
34
|
60
|
F
|
115
|
1,58
|
46,06
|
144
|
4,11
|
170/105
|
6
|
E.coli
|
|
30S
|
20R
|
14R
|
00R
|
00R
|
28S
|
20I
|
25S
|
00R
|
00R
|
13I
|
08R
|
/
|
/
|
|
35
|
60
|
F
|
76
|
1,58
|
30,52
|
90
|
0,89
|
150/104
|
6
|
E.coli
|
|
12R
|
25S
|
16R
|
00R
|
00R
|
33S
|
26S
|
25S
|
20S
|
00R
|
00R
|
18S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
30S
|
25S
|
20I
|
18R
|
19I
|
28S
|
24S
|
30S
|
21S
|
00R
|
16S
|
13S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
18I
|
10R
|
08R
|
13R
|
/
|
20I
|
00R
|
|
36
|
54
|
F
|
112
|
1,57
|
45,43
|
149
|
3,24
|
174/101
|
6
|
E.coli
|
|
00R
|
00R
|
14R
|
00R
|
00R
|
30S
|
32S
|
23S
|
10R
|
08R
|
07R
|
09R
|
/
|
/
|
|
37
|
45
|
F
|
126
|
1,58
|
50,47
|
162
|
0,89
|
134/80
|
6
|
E.coli
|
|
32S
|
26S
|
26S
|
08R
|
08R
|
34S
|
28S
|
33S
|
21S
|
06R
|
08R
|
13S
|
/
|
/
|
|
38
|
60
|
F
|
80
|
1,63
|
30,11
|
94
|
0,7
|
130/73
|
6
|
E.coli
|
|
25S
|
15R
|
22S
|
00R
|
00R
|
35S
|
25S
|
24S
|
10R
|
09R
|
00R
|
00R
|
/
|
/
|
|
39
|
52
|
F
|
120
|
1,58
|
48,06
|
118
|
1,02
|
152/82
|
6
|
E.coli
|
|
28S
|
20R
|
20I
|
17R
|
07R
|
30S
|
30S
|
20S
|
23S
|
11R
|
12I
|
09R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
33S
|
22S
|
18R
|
00R
|
16R
|
35S
|
20I
|
25S
|
14I
|
12R
|
00R
|
12S
|
/
|
/
|
|
40
|
42
|
M
|
89
|
1,67
|
31,91
|
94
|
1,02
|
121/82
|
6
|
Salmonella sp
|
28S
|
23S
|
19I
|
00R
|
00R
|
36S
|
30S
|
28S
|
20S
|
19S
|
00R
|
08R
|
/
|
/
|
|
41
|
36
|
F
|
90
|
1,52
|
38,95
|
103
|
1,21
|
152/70
|
24
|
Proteus sp
|
20R
|
18R
|
10R
|
00R
|
00R
|
20R
|
00R
|
08R
|
16I
|
00R
|
18S
|
10R
|
/
|
/
|
|
42
|
50
|
F
|
108
|
1,73
|
36,08
|
100
|
1,1
|
154/89
|
6
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
|
15R
|
22S
|
10R
|
14I
|
/
|
28S
|
00R
|
|
43
|
42
|
M
|
84
|
1,65
|
30,85
|
98
|
0,83
|
136/73
|
6
|
E.coli
|
|
20R
|
14R
|
18R
|
10R
|
18R
|
28S
|
20I
|
13R
|
20S
|
22S
|
00R
|
00R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
22I
|
25S
|
21I
|
18R
|
20S
|
30S
|
25S
|
25S
|
22S
|
15R
|
20S
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
20S
|
22S
|
15R
|
08R
|
|
25S
|
00R
|
|
44
|
28
|
F
|
75
|
1,54
|
31,62
|
82
|
0,8
|
111/90
|
6
|
E.coli
|
|
22SSI
|
14R
|
24S
|
00R
|
00R
|
35S
|
27S
|
13R
|
20S
|
12R
|
00R
|
12S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
30S
|
26S
|
14R
|
00R
|
00R
|
30S
|
28S
|
00R
|
20S
|
12R
|
20S
|
13S
|
|
/
|
|
45
|
28
|
F
|
106
|
1,5
|
46,88
|
123
|
0,74
|
100/82
|
6
|
E.coli
|
|
23I
|
30S
|
30S
|
00R
|
O8R
|
35S
|
23S
|
00R
|
20S
|
15R
|
00R
|
15S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
15R
|
10R
|
22S
|
10R
|
08R
|
30S
|
23S
|
09R
|
20S
|
14R
|
09R
|
20S
|
/
|
/
|
|
46
|
54
|
F
|
88
|
1,6
|
34,37
|
88
|
0,99
|
175/103
|
6
|
E.coli
|
|
25S
|
26S
|
20I
|
00R
|
00R
|
35S
|
20I
|
15R
|
10R
|
17I
|
00R
|
15S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
00R
|
00R
|
18R
|
00R
|
00R
|
20R
|
30S
|
00R
|
10R
|
08R
|
00R
|
10R
|
/
|
/
|
|
47
|
48
|
M
|
93
|
1,68
|
32,95
|
105
|
1,02
|
140/94
|
96
|
E.coli
|
|
24I
|
18R
|
20I
|
00R
|
14R
|
26S
|
20I
|
13R
|
11R
|
08R
|
00R
|
18S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
19R
|
20R
|
12R
|
00R
|
09R
|
18R
|
22S
|
10R
|
20S
|
09R
|
09R
|
11I
|
/
|
/
|
|
48
|
42
|
F
|
88
|
1,57
|
35,7
|
82
|
1
|
150/66
|
6
|
E.coli
|
|
26S
|
30S
|
25S
|
00R
|
00R
|
31S
|
26S
|
22S
|
10R
|
12R
|
10R
|
16S
|
/
|
/
|
|
49
|
55
|
F
|
85
|
1,68
|
30,11
|
120
|
0,93
|
137/73
|
6
|
Proteus sp
|
25S
|
08R
|
18R
|
00R
|
00R
|
36S
|
12R
|
20S
|
10R
|
10R
|
11I
|
10R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
20S
|
10R
|
11R
|
00R
|
/
|
25S
|
00R
|
|
50
|
48
|
F
|
99
|
1,6
|
38,67
|
101
|
0,78
|
100/76
|
6
|
Salmonella sp
|
28S
|
30S
|
19I
|
08R
|
00R
|
36S
|
30S
|
28S
|
20S
|
00R
|
10R
|
15S
|
/
|
/
|
|
51
|
25
|
F
|
77
|
1,6
|
30,07
|
80
|
0,97
|
110/84
|
96
|
E.coli
|
|
27S
|
19R
|
22S
|
00R
|
06R
|
11R
|
00R
|
28S
|
18S
|
07R
|
00R
|
18S
|
/
|
/
|
|
52
|
57
|
F
|
70
|
1,43
|
34,23
|
102
|
0,82
|
139/93
|
6
|
E.coli
|
|
19R
|
23S
|
00R
|
00R
|
00R
|
33S
|
25S
|
14R
|
20S
|
15R
|
00R
|
10R
|
/
|
/
|
|
53
|
50
|
F
|
80
|
1,52
|
34,62
|
98
|
1,33
|
170/80
|
6
|
Proteus sp
|
23I
|
15R
|
10R
|
08R
|
10R
|
33S
|
00R
|
11R
|
19S
|
10R
|
00R
|
16S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
12R
|
14I
|
23S
|
00R
|
/
|
21I
|
00R
|
|
54
|
41
|
F
|
77
|
1,6
|
30,07
|
90
|
1,2
|
151/104
|
6
|
E.coli
|
|
30S
|
09R
|
08R
|
00R
|
00R
|
30S
|
25S
|
20S
|
20S
|
16R
|
00R
|
16S
|
/
|
/
|
|
55
|
50
|
M
|
78
|
1,51
|
34,2
|
96
|
2,13
|
121/77
|
6
|
E.coli
|
|
00R
|
00R
|
23S
|
00R
|
00R
|
35S
|
26S
|
25S
|
10R
|
20S
|
00R
|
20S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
30S
|
28S
|
25S
|
00R
|
00R
|
13R
|
20I
|
26S
|
20S
|
10S
|
20S
|
15S
|
/
|
/
|
|
56
|
25
|
F
|
77
|
1,58
|
30,85
|
105
|
0,98
|
115/74
|
6
|
E.coli
|
|
25S
|
22S
|
20I
|
00R
|
09R
|
36S
|
32S
|
10R
|
20S
|
00R
|
08R
|
14S
|
/
|
/
|
|
57
|
41
|
M
|
142
|
1,63
|
53,44
|
170
|
1,1
|
130/60
|
6
|
E.coli
|
|
19R
|
13R
|
16R
|
10R
|
19I
|
28S
|
20I
|
13R
|
20S
|
22S
|
00R
|
00R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
30S
|
22S
|
22S
|
00R
|
12R
|
30S
|
25S
|
29S
|
19S
|
17I
|
17S
|
12S
|
/
|
/
|
|
58
|
47
|
F
|
92
|
1,6
|
35,93
|
100
|
2,29
|
130/87
|
6
|
E.coli
|
|
08R
|
18R
|
16R
|
00R
|
00R
|
34S
|
28S
|
10R
|
13R
|
10R
|
00R
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
20R
|
18R
|
10R
|
00R
|
00R
|
25S
|
23S
|
26S
|
22S
|
10R
|
00R
|
16S
|
/
|
/
|
Annexe 2:résultats complets des patients non
obeses
|
code
|
Age
|
Sexe
|
poids
|
taille
|
IMC
|
T. Taille
|
Glycémie
|
T.A
|
CRP
|
Bactéries
|
|
Diamètres d'inhibition des antibiotiques (mm)
|
|
|
|
|
|
|
|
|
|
|
isolées et
|
|
CTR
|
CPD
|
CAZ
|
AMX
|
AMC
|
CIP
|
NOR
|
CHL
|
GEN
|
DOX
|
COT
|
NIT
|
AMK
|
OXA
|
|
|
|
|
|
|
|
|
|
|
identifiées
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
20
|
M
|
65
|
1,68
|
23,03
|
79
|
0,93
|
130/73
|
96
|
E.coli
|
|
30S
|
25S
|
21I
|
00R
|
00R
|
32S
|
20I
|
30S
|
18S
|
20S
|
08R
|
20S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
12R
|
00R
|
20I
|
00R
|
00R
|
28S
|
08R
|
30S
|
22S
|
11R
|
00R
|
19S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
10R
|
14R
|
23S
|
16S
|
/
|
26S
|
12R
|
|
2
|
28
|
M
|
69
|
1,73
|
23,87
|
80
|
1,52
|
112/73
|
6
|
E.coli
|
|
25S
|
16R
|
10R
|
00R
|
14R
|
35S
|
22S
|
30S
|
20S
|
24S
|
00R
|
20S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
20S
|
00R
|
22S
|
/
|
24S
|
00R
|
|
3
|
28
|
M
|
78
|
1,78
|
24,61
|
86
|
0,89
|
122/71
|
6
|
E.coli
|
|
25S
|
15R
|
20R
|
00R
|
00R
|
26S
|
15R
|
23S
|
20S
|
22S
|
00R
|
16S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
|
20R
|
19R
|
00R
|
00R
|
00R
|
27S
|
17R
|
20S
|
22S
|
18I
|
00R
|
00R
|
/
|
/
|
|
4
|
64
|
M
|
84
|
1,68
|
29,76
|
104
|
1,07
|
157/76
|
6
|
Salmonella sp
|
26S
|
23S
|
22S
|
00R
|
00R
|
30S
|
27S
|
30S
|
10R
|
00R
|
00R
|
07R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
|
14R
|
29S
|
18R
|
00R
|
07R
|
31S
|
28S
|
15R
|
14R
|
00R
|
00R
|
15S
|
/
|
/
|
|
5
|
20
|
F
|
67
|
1,67
|
24,02
|
82
|
0,99
|
115/108
|
6
|
E.coli
|
|
34S
|
20R
|
23S
|
00R
|
18R
|
36S
|
30S
|
28S
|
22S
|
22S
|
00R
|
16S
|
/
|
/
|
|
6
|
20
|
M
|
57
|
1,7
|
19,72
|
54
|
1,6
|
118/83
|
6
|
E.coli
|
|
28S
|
29S
|
14R
|
06R
|
00R
|
12R
|
00R
|
30S
|
18S
|
08R
|
10R
|
18S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
09R
|
14I
|
00R
|
00R
|
/
|
22I
|
00R
|
|
7
|
28
|
F
|
62
|
1,6
|
24,21
|
78
|
0,9
|
166/93
|
12
|
E.coli
|
|
00R
|
10R
|
00R
|
00R
|
00R
|
35S
|
27S
|
25S
|
10R
|
20S
|
10R
|
08R
|
/
|
/
|
|
8
|
60
|
F
|
61
|
1,64
|
22,67
|
70
|
0,8
|
140/83
|
6
|
E.coli
|
|
16R
|
10R
|
26S
|
08R
|
00R
|
25I
|
15R
|
10R
|
20S
|
20S
|
00R
|
12S
|
/
|
/
|
|
/
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
|
35S
|
30S
|
25S
|
09R
|
00R
|
30S
|
20I
|
17I
|
22S
|
17I
|
00R
|
14S
|
/
|
/
|
|
9
|
41
|
M
|
77
|
1,78
|
24,3
|
85
|
0,99
|
128/96
|
6
|
E.coli
|
|
30S
|
18R
|
19I
|
00R
|
00R
|
30S
|
28S
|
12R
|
20S
|
09R
|
16S
|
18S
|
/
|
/
|
|
10
|
24
|
F
|
60
|
1,58
|
24,03
|
75
|
0,93
|
112/81
|
6
|
E.coli
|
|
30S
|
23S
|
11R
|
00R
|
19I
|
33S
|
30S
|
26S
|
22S
|
18I
|
07R
|
16S
|
/
|
/
|
|
11
|
26
|
M
|
60
|
1,6
|
23,43
|
78
|
0,71
|
118/83
|
6
|
Proteus sp
|
|
12R
|
25S
|
22S
|
00R
|
08R
|
20R
|
25S
|
16R
|
00R
|
18I
|
00R
|
12S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
22S
|
00R
|
00R
|
00R
|
/
|
22I
|
00R
|
|
12
|
74
|
F
|
50
|
1,52
|
21,54
|
74
|
0,88
|
144/64
|
6
|
Salmonella sp
|
22I
|
28S
|
26S
|
00R
|
10R
|
32S
|
19I
|
20S
|
20S
|
19I
|
10R
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
20S
|
14I
|
10R
|
00R
|
/
|
25S
|
00R
|
|
13
|
60
|
M
|
59
|
1,58
|
23,63
|
68
|
1,97
|
134/76
|
192
|
E.coli
|
|
23I
|
19R
|
20I
|
18R
|
21S
|
34S
|
24S
|
20S
|
19S
|
20S
|
00R
|
13S
|
/
|
/
|
|
14
|
21
|
M
|
72
|
1,73
|
24
|
80
|
1,26
|
119/75
|
6
|
E.coli
|
|
22I
|
20R
|
19I
|
12R
|
19I
|
35S
|
32S
|
30S
|
18S
|
17I
|
08R
|
12S
|
/
|
/
|
|
15
|
27
|
M
|
85
|
1,69
|
29,76
|
92
|
1
|
180/68
|
394
|
Salmonella sp
|
34S
|
26S
|
23S
|
08R
|
14R
|
37S
|
26S
|
24S
|
20S
|
18I
|
20S
|
19S
|
/
|
/
|
|
16
|
21
|
M
|
70
|
1,62
|
26,67
|
90
|
0,86
|
112/77
|
6
|
E.coli
|
|
10R
|
18R
|
20I
|
00R
|
00R
|
32S
|
20I
|
28S
|
20S
|
08R
|
00R
|
18S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
|
18R
|
16R
|
10R
|
00R
|
00R
|
26S
|
22S
|
24S
|
20S
|
10R
|
00R
|
14S
|
/
|
/
|
|
17
|
42
|
M
|
100
|
1,94
|
26,57
|
90
|
0,79
|
130/101
|
6
|
E.coli
|
|
22I
|
00R
|
08R
|
00R
|
20S
|
09R
|
26S
|
34S
|
20S
|
00R
|
00R
|
00R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
|
20R
|
00R
|
26S
|
09R
|
23S
|
30S
|
20I
|
30S
|
20S
|
19I
|
00R
|
20S
|
/
|
/
|
|
18
|
58
|
F
|
66
|
1,73
|
25,75
|
65
|
1,07
|
113/69
|
96
|
E.coli
|
|
27S
|
26S
|
18R
|
00R
|
00R
|
30S
|
15R
|
30S
|
22S
|
00R
|
00R
|
12S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
12R
|
09R
|
28S
|
00R
|
00R
|
35S
|
24S
|
28S
|
10R
|
00R
|
00R
|
16S
|
/
|
/
|
|
19
|
52
|
F
|
47
|
1,5
|
20,8
|
70
|
0,72
|
103/53
|
6
|
E.coli
|
|
31S
|
24S
|
23S
|
00R
|
00R
|
11R
|
10R
|
19S
|
20S
|
09R
|
06R
|
13S
|
/
|
/
|
|
20
|
26
|
F
|
57
|
1,57
|
26,37
|
65
|
1,2
|
96/90
|
48
|
E.coli
|
|
26S
|
25S
|
20I
|
00R
|
15R
|
36S
|
30S
|
28S
|
23S
|
19S
|
00R
|
20S
|
/
|
/
|
|
21
|
40
|
F
|
64
|
1,6
|
23,79
|
80
|
0,94
|
109/76
|
48
|
E.coli
|
|
12R
|
24S
|
20I
|
10R
|
00R
|
27S
|
25S
|
25S
|
20S
|
13R
|
00R
|
18S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
|
30S
|
30S
|
25S
|
00R
|
00R
|
30S
|
25S
|
27S
|
13R
|
15R
|
00R
|
15S
|
/
|
/
|
|
22
|
29
|
M
|
76
|
1,73
|
25,4
|
90
|
0,94
|
130/82
|
6
|
Proteus sp
|
|
24I
|
09R
|
10R
|
00R
|
00R
|
37S
|
30S
|
28S
|
22S
|
21S
|
20S
|
18S
|
/
|
/
|
|
23
|
31
|
F
|
61
|
1,9
|
18,82
|
76
|
0,86
|
105/64
|
6
|
Proteus sp
|
|
29S
|
25S
|
21I
|
18R
|
20S
|
34S
|
30S
|
25S
|
22S
|
20S
|
00R
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
10R
|
27S
|
09R
|
10R
|
|
25S
|
00R
|
|
24
|
45
|
M
|
66
|
1,6
|
25,75
|
78
|
0,9
|
184/105
|
6
|
E.coli
|
|
14R
|
28S
|
20I
|
00R
|
00R
|
34S
|
20I
|
34S
|
21S
|
18I
|
00R
|
09R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
|
30S
|
26S
|
20I
|
00R
|
00R
|
38S
|
23S
|
20S
|
27S
|
15R
|
11R
|
11I
|
/
|
/
|
|
25
|
21
|
F
|
51
|
1,65
|
18,73
|
60
|
0,71
|
110/82
|
6
|
E.coli
|
|
28S
|
30S
|
12R
|
00R
|
10R
|
34S
|
28S
|
30S
|
18S
|
00R
|
13S
|
18S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
23S
|
16I
|
10R
|
14I
|
/
|
25S
|
00R
|
|
26
|
58
|
F
|
64
|
1,58
|
25,44
|
90
|
1,9
|
125/80
|
6
|
E.coli
|
|
25S
|
09R
|
20I
|
00R
|
19I
|
30S
|
32S
|
30S
|
21S
|
00R
|
09R
|
18S
|
/
|
/
|
|
27
|
40
|
F
|
70
|
1,58
|
28,04
|
79
|
0,9
|
125/82
|
24
|
Proteus sp
|
|
28S
|
20R
|
20I
|
00R
|
00R
|
34S
|
24S
|
30S
|
16I
|
11R
|
18S
|
16S
|
/
|
/
|
|
28
|
23
|
F
|
70
|
1,66
|
25,4
|
79
|
0,89
|
120/63
|
6
|
E.coli
|
|
14R
|
24S
|
20I
|
00R
|
08R
|
30S
|
12R
|
25S
|
28S
|
00R
|
08R
|
15S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
30S
|
20R
|
23S
|
00R
|
00R
|
32S
|
25S
|
20S
|
20S
|
18S
|
00R
|
14S
|
/
|
/
|
|
29
|
26
|
M
|
76
|
1,74
|
25,1
|
94
|
0,99
|
113/54
|
6
|
E.coli
|
|
25S
|
20R
|
25S
|
00R
|
07R
|
23R
|
30S
|
09R
|
10R
|
00R
|
26S
|
16S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
25S
|
18S
|
00R
|
20S
|
/
|
21I
|
00R
|
|
30
|
25
|
F
|
60
|
1,65
|
22,03
|
77
|
0,98
|
104/96
|
6
|
Proteus sp
|
|
36S
|
33S
|
23S
|
00R
|
16R
|
35S
|
25S
|
20S
|
18S
|
25S
|
20S
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
09R
|
21S
|
00R
|
00R
|
/
|
28S
|
00R
|
|
31
|
50
|
F
|
80
|
1,66
|
26,72
|
80
|
0,69
|
144/63
|
6
|
E.coli
|
|
27S
|
21I
|
20I
|
00R
|
08R
|
26S
|
22S
|
28S
|
18S
|
11R
|
00R
|
15S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
11R
|
18S
|
10R
|
20S
|
/
|
26S
|
12R
|
|
32
|
32
|
M
|
69
|
1,7
|
22,87
|
85
|
0,72
|
123/78
|
6
|
E.coli
|
|
32S
|
27S
|
24S
|
00R
|
18R
|
36S
|
30S
|
30S
|
22S
|
16R
|
00R
|
23S
|
/
|
/
|
|
33
|
23
|
F
|
60
|
1,63
|
22,58
|
85
|
0,84
|
118/91
|
6
|
E.coli
|
|
28S
|
21I
|
09R
|
00R
|
00R
|
28S
|
25S
|
20S
|
18S
|
14R
|
00R
|
11I
|
/
|
/
|
|
34
|
67
|
M
|
85
|
1,73
|
28,4
|
75
|
1,84
|
178/91
|
24
|
E.coli
|
|
10R
|
24S
|
26S
|
00R
|
06R
|
30S
|
25S
|
12R
|
11R
|
08R
|
00R
|
26S
|
/
|
/
|
|
35
|
68
|
F
|
70
|
1,62
|
26,67
|
85
|
0,92
|
150/90
|
6
|
E.coli
|
|
27S
|
24S
|
23S
|
00R
|
00R
|
34S
|
22S
|
17I
|
14I
|
19I
|
00R
|
16S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
30S
|
24S
|
20I
|
00R
|
00R
|
30S
|
33S
|
12R
|
22S
|
26S
|
00R
|
14S
|
/
|
/
|
|
36
|
70
|
M
|
67
|
1,7
|
23,18
|
60
|
1,3
|
180/97
|
6
|
E.coli
|
|
23I
|
20R
|
00R
|
00R
|
14R
|
30S
|
25S
|
30S
|
19S
|
21S
|
09R
|
20S
|
/
|
/
|
|
37
|
79
|
F
|
48
|
1,5
|
21,33
|
70
|
1,02
|
103/97
|
6
|
E.coli
|
|
27S
|
30S
|
19I
|
18R
|
12R
|
36S
|
30S
|
17I
|
18S
|
18I
|
08R
|
10R
|
/
|
/
|
|
38
|
60
|
F
|
77
|
1,65
|
28,28
|
78
|
0,88
|
144/69
|
48
|
Proteus sp
|
|
15R
|
22S
|
25S
|
10R
|
00R
|
36S
|
14R
|
16R
|
21S
|
00R
|
20S
|
11I
|
/
|
/
|
|
39
|
20
|
M
|
67
|
1,73
|
22,38
|
68
|
0,81
|
110/71
|
6
|
E.coli
|
|
30S
|
00R
|
09R
|
00R
|
00R
|
00R
|
00R
|
14R
|
12R
|
07R
|
00R
|
22S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
|
30S
|
26S
|
30S
|
15R
|
13R
|
32S
|
30S
|
32S
|
22S
|
18I
|
28S
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
32S
|
24S
|
23S
|
00R
|
O7R
|
32S
|
30S
|
30S
|
21S
|
10R
|
07R
|
16S
|
/
|
/
|
|
40
|
49
|
F
|
60
|
1,65
|
22,03
|
70
|
0,89
|
123/59
|
6
|
E.coli
|
|
24I
|
26S
|
16R
|
00R
|
00R
|
30S
|
27S
|
12R
|
22S
|
18I
|
00R
|
07R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
30S
|
30S
|
23S
|
00R
|
09R
|
35S
|
30S
|
16R
|
09R
|
12R
|
00R
|
08R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
24S
|
16I
|
00R
|
09R
|
/
|
19I
|
00R
|
|
41
|
66
|
F
|
67
|
1,6
|
26,17
|
84
|
1,1
|
113/70
|
6
|
Proteus sp
|
|
20R
|
22S
|
16R
|
00R
|
07R
|
28S
|
25S
|
32S
|
18S
|
13R
|
00R
|
15S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
20S
|
16I
|
07R
|
12R
|
/
|
23I
|
00R
|
|
42
|
28
|
F
|
78
|
1,63
|
29,36
|
74
|
0,86
|
112/59
|
6
|
E.coli
|
|
10R
|
00R
|
15R
|
00R
|
00R
|
08R
|
00R
|
34S
|
14I
|
08R
|
00R
|
13S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
|
00R
|
00R
|
00R
|
10R
|
12R
|
06R
|
25I
|
11R
|
10R
|
18I
|
00R
|
14S
|
/
|
/
|
|
43
|
20
|
M
|
73
|
1,76
|
23,56
|
84
|
0,9
|
130/92
|
96
|
Salmonella sp
|
35S
|
30S
|
23S
|
00R
|
08R
|
35S
|
25S
|
15R
|
09R
|
00R
|
00R
|
20S
|
/
|
/
|
|
44
|
40
|
F
|
55
|
1,56
|
19,48
|
74
|
0,81
|
120/90
|
6
|
E.coli
|
|
17R
|
09R
|
20I
|
18R
|
16R
|
30S
|
20I
|
15R
|
20S
|
23S
|
00R
|
00R
|
/
|
/
|
|
45
|
25
|
F
|
54
|
1,6
|
21,09
|
89
|
0,88
|
140/100
|
6
|
Salmonella sp
|
32S
|
28S
|
20I
|
00R
|
00R
|
35S
|
23S
|
20S
|
10R
|
00R
|
00R
|
10R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Proteus sp
|
|
00R
|
00R
|
13R
|
00R
|
00R
|
30S
|
11R
|
00R
|
16I
|
20S
|
00R
|
11I
|
/
|
/
|
|
46
|
25
|
M
|
65
|
1,73
|
21,71
|
76
|
0,76
|
133/90
|
6
|
E.coli
|
|
27S
|
22S
|
16S
|
00R
|
10R
|
25I
|
20S
|
28S
|
27S
|
18I
|
00R
|
18S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
00R
|
20S
|
00R
|
00R
|
/
|
10R
|
21I
|
|
47
|
53
|
M
|
81
|
1,7
|
28,02
|
94
|
1,46
|
150/87
|
6
|
Proteus sp
|
|
26S
|
20R
|
23S
|
00R
|
08R
|
30S
|
30S
|
07R
|
22S
|
14R
|
18S
|
16S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
07R
|
20S
|
20I
|
00R
|
/
|
25S
|
15R
|
|
48
|
30
|
F
|
72
|
1,62
|
27,43
|
80
|
0,86
|
130/80
|
12
|
E.coli
|
|
19R
|
13R
|
16R
|
10R
|
19I
|
28S
|
20I
|
13R
|
20S
|
22S
|
00R
|
00R
|
/
|
/
|
|
49
|
37
|
F
|
79
|
1,65
|
29,01
|
80
|
0,84
|
120/81
|
6
|
E.coli
|
|
00R
|
00R
|
00R
|
00R
|
07R
|
10R
|
10R
|
28S
|
12R
|
10R
|
00R
|
21S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
20S
|
20S
|
00R
|
24S
|
/
|
21I
|
08R
|
|
50
|
44
|
F
|
60
|
1,56
|
24,65
|
70
|
2,24
|
158/60
|
6
|
E.coli
|
|
28S
|
28S
|
20I
|
00R
|
00R
|
10R
|
00R
|
09R
|
20S
|
08R
|
00R
|
10R
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Shigella sp
|
|
24I
|
20R
|
10R
|
00R
|
00R
|
30S
|
24S
|
25S
|
12R
|
08R
|
00R
|
13S
|
/
|
/
|
|
51
|
30
|
F
|
66
|
1,66
|
23,95
|
80
|
0,98
|
113/90
|
6
|
Salmonella sp
|
20R
|
23S
|
20I
|
00R
|
00R
|
30S
|
15R
|
16R
|
15I
|
00R
|
00R
|
14S
|
/
|
/
|
|
52
|
66
|
F
|
50
|
1,64
|
18,59
|
50
|
1,09
|
140/54
|
48
|
E.coli
|
|
22I
|
30S
|
22S
|
09R
|
09R
|
32S
|
20I
|
17I
|
16I
|
20S
|
00R
|
11I
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
33S
|
08R
|
26S
|
00R
|
00R
|
38S
|
31S
|
28S
|
10R
|
19S
|
00R
|
12S
|
/
|
/
|
|
53
|
28
|
M
|
65
|
1,66
|
23,63
|
78
|
0,75
|
114/90
|
6
|
E.coli
|
|
20R
|
23S
|
10R
|
00R
|
19I
|
32S
|
22S
|
20S
|
20S
|
17I
|
11I
|
18S
|
/
|
/
|
|
54
|
64
|
F
|
55
|
1,61
|
21,21
|
80
|
0,8
|
100/70
|
12
|
E.coli
|
|
27S
|
00R
|
11R
|
00R
|
09R
|
30S
|
20I
|
27S
|
18S
|
10R
|
25S
|
20S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
16R
|
19S
|
00R
|
10R
|
/
|
26S
|
00R
|
|
55
|
24
|
F
|
71
|
1,63
|
26,72
|
80
|
0,9
|
120/70
|
12
|
E.coli
|
|
30S
|
28S
|
29S
|
19I
|
23S
|
32S
|
28S
|
30S
|
20S
|
18I
|
10R
|
19S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
17R
|
20R
|
18R
|
15R
|
20S
|
30S
|
20I
|
15R
|
21S
|
10R
|
20S
|
14S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Staphylococcus sp
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
29S
|
20S
|
00R
|
00R
|
/
|
22I
|
06R
|
|
56
|
28
|
M
|
72
|
1,7
|
24,91
|
70
|
0,76
|
124/71
|
6
|
E.coli
|
|
27S
|
22S
|
24S
|
16R
|
19I
|
34S
|
30S
|
20S
|
17S
|
18SR
|
14S
|
13S
|
/
|
/
|
|
57
|
23
|
F
|
57
|
1,66
|
20,68
|
60
|
0,8
|
110/70
|
6
|
E.coli
|
|
14R
|
09R
|
18R
|
00R
|
00R
|
27R
|
21I
|
10R
|
20S
|
10R
|
00R
|
20S
|
/
|
/
|
|
|
|
|
|
|
|
|
|
|
|
Salmonella sp
|
30S
|
26S
|
27S
|
12R
|
14R
|
35S
|
29S
|
30S
|
22S
|
10R
|
20S
|
13S
|
/
|
/
|
Annexe
3 :Nombre d'isolats sensibles, intermédiaires et résistants
aux antibiotiques testés chez les patients obèses
|
|
Nombre
|
|
|
Nombre d'isolats sensibles, intermédiaires et
résistants aux antibiotiques testés
|
|
|
d'isolats
|
|
|
|
|
|
|
|
|
CTR
|
CPD
|
CAZ
|
AMX
|
AMC
|
CIP
|
NOR
|
CHL
|
GEN
|
DOX
|
COT
|
NIT
|
AMK
|
OXA
|
|
E.coli
|
|
38
|
Sensibles
|
|
15
|
14
|
20
|
00
|
01
|
33
|
25
|
22
|
20
|
05
|
05
|
24
|
/
|
/
|
|
|
|
Intermédiaires
|
06
|
00
|
00
|
00
|
02
|
01
|
08
|
01
|
05
|
02
|
01
|
01
|
/
|
/
|
|
|
|
Résistants
|
17
|
24
|
18
|
38
|
35
|
04
|
05
|
15
|
13
|
31
|
32
|
13
|
/
|
/
|
|
Shigella sp
|
08
|
Sensibles
|
|
03
|
02
|
01
|
00
|
00
|
04
|
06
|
06
|
06
|
02
|
02
|
08
|
/
|
/
|
|
|
|
Intermédiaires
|
01
|
00
|
01
|
00
|
00
|
01
|
01
|
00
|
01
|
01
|
00
|
00
|
/
|
/
|
|
|
|
Résistants
|
04
|
06
|
06
|
08
|
08
|
03
|
01
|
02
|
01
|
05
|
06
|
00
|
/
|
/
|
|
Salmonella sp
|
09
|
Sensibles
|
|
07
|
06
|
05
|
00
|
00
|
08
|
06
|
05
|
03
|
02
|
01
|
06
|
/
|
/
|
|
|
|
Intermédiaires
|
00
|
00
|
02
|
00
|
03
|
00
|
02
|
00
|
04
|
01
|
00
|
00
|
/
|
/
|
|
|
|
Résistants
|
02
|
03
|
02
|
09
|
06
|
01
|
01
|
04
|
02
|
06
|
08
|
03
|
/
|
/
|
|
Proteus sp
|
15
|
Sensibles
|
|
07
|
08
|
05
|
00
|
02
|
10
|
06
|
08
|
08
|
05
|
05
|
10
|
/
|
/
|
|
|
|
Intermédiaires
|
02
|
00
|
01
|
00
|
00
|
02
|
03
|
00
|
06
|
01
|
01
|
02
|
/
|
/
|
|
|
|
Résistants
|
06
|
07
|
09
|
15
|
13
|
03
|
06
|
07
|
01
|
09
|
09
|
03
|
/
|
/
|
|
Staphylococcus sp
|
15
|
Sensibles
|
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
08
|
07
|
00
|
01
|
/
|
07
|
00
|
|
|
|
Intermédiaires
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
01
|
03
|
00
|
03
|
/
|
07
|
00
|
|
Total
|
|
85
|
Résistants
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
06
|
05
|
15
|
11
|
/
|
01
|
15
|
Annexe
4: Nombre d'isolats sensibles, intermédiaires et résistants aux
antibiotiques testés chez les patients non obèses
|
|
Nombre
|
|
|
Nombre d'isolats sensibles, intermédiaires et
résistants aux antibiotiques testés
|
|
|
d'isolats
|
|
|
|
|
|
|
|
|
CTR
|
CPD
|
CAZ
|
AMX
|
AMC
|
CIP
|
NOR
|
CHL
|
GEN
|
DOX
|
COT
|
NIT
|
AMK
|
OXA
|
|
E.coli
|
|
43
|
Sensibles
|
|
24
|
21
|
25
|
00
|
02
|
33
|
26
|
30
|
35
|
12
|
02
|
33
|
/
|
/
|
|
|
|
Intermédiaires
|
06
|
02
|
00
|
01
|
06
|
02
|
07
|
03
|
03
|
08
|
03
|
02
|
/
|
/
|
|
|
|
Résistants
|
13
|
20
|
18
|
42
|
34
|
08
|
10
|
10
|
05
|
21
|
38
|
08
|
/
|
/
|
|
Shigella sp
|
06
|
Sensibles
|
|
02
|
02
|
03
|
00
|
01
|
06
|
04
|
06
|
04
|
01
|
01
|
05
|
/
|
/
|
|
|
|
Intermédiaires
|
01
|
00
|
00
|
00
|
00
|
00
|
01
|
00
|
00
|
02
|
00
|
00
|
/
|
/
|
|
|
|
Résistants
|
03
|
04
|
03
|
06
|
05
|
00
|
01
|
00
|
02
|
03
|
05
|
01
|
/
|
/
|
|
Salmonella sp
|
15
|
Sensibles
|
|
10
|
10
|
09
|
00
|
00
|
14
|
12
|
11
|
10
|
03
|
03
|
12
|
/
|
/
|
|
|
|
Intermédiaires
|
01
|
03
|
04
|
00
|
00
|
00
|
02
|
00
|
00
|
02
|
00
|
00
|
/
|
/
|
|
|
|
Résistants
|
04
|
05
|
02
|
15
|
15
|
01
|
01
|
04
|
05
|
10
|
12
|
03
|
/
|
/
|
|
Proteus sp
|
13
|
Sensibles
|
|
06
|
08
|
05
|
00
|
01
|
10
|
10
|
06
|
06
|
03
|
07
|
10
|
/
|
/
|
|
|
|
Intermédiaires
|
01
|
00
|
03
|
00
|
00
|
00
|
01
|
01
|
03
|
02
|
00
|
03
|
/
|
/
|
|
|
|
Résistants
|
06
|
05
|
05
|
13
|
12
|
03
|
02
|
06
|
04
|
08
|
06
|
00
|
/
|
/
|
|
Staphylococcus sp
|
17
|
Sensibles
|
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
09
|
14
|
03
|
05
|
/
|
09
|
00
|
|
|
|
Intermédiaires
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
00
|
01
|
01
|
01
|
/
|
07
|
01
|
|
Total
|
|
94
|
Résistants
|
/
|
/
|
/
|
/
|
/
|
/
|
/
|
08
|
02
|
13
|
11
|
/
|
01
|
16
|
Annexe 5 : notice
d'information
GUISSERBE YAWALLE
Etudiant en Master II
Option : Biochimie Clinique
Département de Biochimie
Faculté de Sciences
Université de Dschang
Tél: 00237 6 50 54 20 80/6 55 10 96 62
Adresse mail: waguisse@gmail.com
Mbouda le..................................

Document d'information des Individus participant au
projet de recherche :
THEME : «PREVALANCE DE L'OBESITE
ABDOMINALEET L'ANTIBIORESISTANCE CHEZ LES PATIENTS SOUFFRANT DES INFECTIONS
ENTERIQUES VENUS EN CONSULTATION A L'HOPITAL AD-LUCEM DE MBOUDA
».
PROBLEMES ET OBJECTIFS VISES
Les maladies entériques et diarrhéiques ont
été classées comme problèmes de santé
publique par l'OMS car elles touchent pratiquement toutes les tranches
d'âge mais beaucoup plus celle des enfants de moins de 5 ans où
l'estimation est de 2,5 milliards de cas dans le monde et par an.
Habituellement causées par des agents pathogènes tels que les
campylobactéries, les salmonelles et l'Escherichia coli, leur traitement
repose sur la prise des médicaments antibiotiques qui inhibent ou
détruisent la croissance bactérienne. Mais, il a
été démontré qu'au fil du temps, certaines
bactéries ont développées des mécanismes de
résistances contre les antibiotiques qui leur sont destinés. Il
se pose donc la question à savoir, quelles sont les origines de ces
phénomènes de résistances mis au point par des
bactéries ? C'est dans cette optique que nous avons défini
le thème ci-haut, qui vise à étudier la relation entre
l'obésité et l'antibiorésistance bactérienne. Nous
avons donc choisi la localité de Mbouda parce que la prévalence
de la multirésistance y est forte (29,7%).
· Objectif
général :
Permettre une bonne surveillance épidémiologique
et la correction des traitements à base des antibiotiques.
· Objectifs
spécifiques :
ü Déterminer la fréquence de
l'obésité à travers la détermination de l'indice de
masse corporelle ;
ü Evaluer les risques d'inflammation des organes vitaux
à travers le dosage de la protéine C-réactive ;
ü déterminer la distribution et le profil de
résistance des bactéries chez les personnes obèses et non
obèses.
· Bénéfices
Si vous participez à cette étude, vous recevrez
les résultats de vos examens gratuitement et vous recevrez toutes les
informations que vous désirerez, relatives à l'étude et
à votre pathologie. Ainsi vous contribuerez non seulement pour votre
compte personnel, mais aussi pour toutes personnes vivant dans la même
situation que vous.
· Risques
éventuels :
Durant le prélèvement sanguin, il peut arriver que
vous ressentiez une légère douleur ou un léger gonflement
au site de la ponction, soyez sans crainte ce sera passager.
· Indemnité :
Vous
ne recevrez pas d'argent pour participer à cette recherche.
· Confidentialité :
Les informations collectées durant cette recherche
seront conservées confidentiellement. Un seul code confidentiel
permettra d'identifier vos prélèvements. La liste des noms de
sujets et des codes correspondants sera gardée de façon
sécurisée, et ne sera pas diffusée excepté au
médecin chargé de votre suivi / Direction du Centre.
· Droit de refuser ou
d'abandonner :
Vous n'êtes pas obligé de participer à
cette recherche tout comme vous avez aussi le droit de retirer votre accord
pour cette étude a n'importe quel moment et en toute liberté.
· Qui contacter ? :
Ce programme de recherche a été soumis et
approuvé par le Ministère de la Santé de notre pays
à travers le Comité d'éthique CRESCH. Ce comité
doit s'assurer que tous ceux qui participent à cette recherche sont
protégés. Si vous avez un doute de la véracité de
ce document ou même des questions à poser maintenant ou plus tard
concernant votre sécurité et surtout de la
confidentialité, vous pouvez contacter l'investigateur, le
co-investigateur ou le CRESCH.
Investigateur, tél : (+237) 6 55 10 96
62
-Département de biochimie de l'université de
Dschang,
-CRESCH
Annexe 6: consentement du
participant
J'ai été invité à participer à
un programme de recherche intitulé :
«PREVALANCE DE L'OBESITE ABDOMINALE ET
L'ANTIBIORESISTANCE CHEZ LES PATIENTS SOUFFRANT DES INFECTIONS ENTERIQUES VENUS
EN CONSULTATION A L'HOPITAL AD-LUCEM DE MBOUDA ».
- Je confirme avoir été informé et
éclairé sur le but et l'intérêt de cette recherche
scientifique.
- J'accepte de participer à cette recherche
scientifique
- J'autorise que les prélèvements de mon sang et
de mes selles soient utilisés dans le cadre de
cette étude
- J'accepte aussi que toutes nouvelles méthodes qui
puissent être développées et pouvant améliorer les
résultats de la présente étude puisse être faite sur
mes prélèvements.
Nom, prénom du Superviseur :
Pr KUETE Victor
Signature:
Nom, prénom de l'investigateur ayant
informé et éclairé le participant:
GUISSERBE YAWALLE
Signature:
Nom, prénomdu
participant:
......................................
......................................
Signature ou empreinte digitale:
Nom, prénom représentant légaldu
participant (si nécessaire) :
................................................
Signature ou empreinte digitale:
Nom et Prénom d'un témoin de
l'équipe médicale (Si accord par un représentant
légal du patient) :
...........................................................................................................................
Signature ou empreinte digitale:
Annexe 7 : fiche
d'enquête clinique
|
I. Information Générale
|
|
1. Code de l'étude:
..........................................
2. Age du participant:......................................
Sexe ........................................................................
|
|
3. Plus haut niveau d'éducation: Primaire Secondaire
Universitaire
4.
Village:...........................................................
Profession:.............................................................
5. Taille (mètre):............... Masse
(Kg):.................. Périmètre abdominale
(mètre):...................
|
|
6. Tension (mMg) Diastole= .......................
Systole=..................................
A.11. Glycémie (g/l):
.......................................... Hémoglobine:
..................
|
|
II. Profile du participant
|
|
1. Informations sur la prise de
médicaments
|
|
1.1. Prenez-vous un médicament actuellement? Oui
Non
1.2. Si Oui le(s)
nom(s).........................................................................................................................................
1.3. Contre quelle(s)
maladie(e)?............................................................................................................
1.4. Qui vous a conseillé ce(s)
médicament(s).................................................................................................
1.5. Où avez-vous acheté ce(s)
médicament(s)................................................................................................
1.6. Prenez-vous des médicaments traditionnels? Oui
Non
1.7. Si Oui pour traiter
quoi?..............................................................................................................................
|
|
2. Informations sur les maladies et
antécédents
|
|
2.1. Soufrez-vous de l'une des maladies suivantes: Diabète
Hypertension Ou une autre,
préciser........................................................................................................................................................................
2.2. Quelqu'un(e) dans votre famille a-t-il (elle) eu cette
maladie? Oui Non
2.3. Si Oui, précisé: la mère le
père grand père grande mère
frère/soeur Autre membre de la famille, Précisé
ici...........................................................................................................................
2.4. Quelqu'un(e) dans votre famille a-t-il (elle) un grand corps
(grande masse corporelle)? Oui Non
2.5. Si Oui, précisé: la mère le
père grand père grande mère
frère/soeur Autre membre de la famille, Précisé
ici...........................................................................................................................
|
|
B.3. Informations sur les habitudes
alimentaires
|
|
B.3.1. Fumez-vous la cigarette? Oui par le passé
jamais fumé
B.3.2. Quelle boisson buvez-vous habituellement? Le vin rouge
le wiski la bière
le vin blanc ne boit jamais
B.3.3. Combien de fois en moyenne avez-vous bu cette boisson par
jour le mois passé?
jamais consommé , 1 fois/mois , 1 fois/en 15
jours , 1 fois/semaine , 2 à 3 fois/ semaine , 4
à 6 fois/ semaine , 1 fois/ jour , 2 fois/ jour , 3
fois/ jour
B.3.4. vous puisez votre eau à boire
où?......................................................................................................
B.3.5. Quel (s) repas consommez-vous (cocher et écrire
dans les vides) :
(1) Taro sauce............................... combien de
fois le mois passé,.............................................
(2) Couscous maïs sauce............................
combien de fois le mois
passé,.............................................
(3) Couscous manioc sauce..........................
combien de fois le mois
passé,.............................................
(4) Haricot (pilet ou sauté), combien de fois
le mois passé,.............................................
(5) Riz sauce............................... combien de
fois le mois passé,.............................................
(6) Pate alimantaires (Spaghetti, macaroni,...) combien de
fois le mois passé,.......................................
(7) pain, combien de fois par
semaine,.............................................
(8) viandes, combien de fois le mois
passé,.............................................
(9) poissons, combien de fois le mois
passé,.............................................
(10) oeufs, combien de fois par
semaine,.............................................
(11) féculents (manioc ou tapioca), combien de fois
le mois passé,.............................................
(12) légumes (feuille de manioc, morelle noire, ...),
combien de fois le mois passé,..............................
(13) fruits (orange, papaye, ananas, avocat,...,)combien de fois
le mois passé,.................................
(14) beurre et fromage, combien de fois le mois
passé,.............................................
(15) lait et yaourt, combien de fois le mois
passé,.............................................
(16) huile rouge et friture, combien de fois le mois
passé,.............................................
(17) huile raffinée, combien de fois le mois
passé,.............................................
(18) produits sucrés et bonbons, combien de fois
le mois passé,.............................................
(19) Autres nourritures, préciser
ici........................................................................................................................
......................................................................................................................................................................................
|
|
B.4. Informations sur la pratique sportive
|
|
B.4.1. Vous avez pratiqué l'une des activités
suivantes au cours du mois passé: la marche la course la
bicyclette soulever des poids la danse gymnastique
travailler dans la cour
travailler dans le champ
|
|
B.4.2. Vous avez pratiquez cette activité combien de fois
le mois passé?...................................................
|
|
C. Question
|
|
Avez-vous des questions ou
commentaires?.......................................................................................................
.....................................................................................................................................................................................
|
N.B.: Préciser ici les autres informations
données par le participant qui ne se trouvent pas dans le
questionnaire:..........................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Annexe 8: Clairance
éthique

|
|



