1.3 L'anisotropie élastique à
l'échelle du tissu ligneux
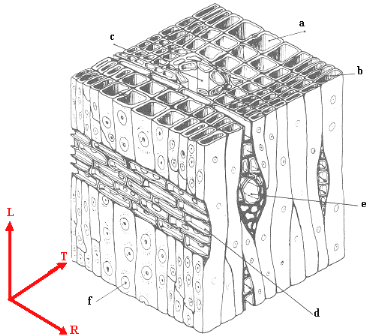
Figure 1.7 Organisation cellulaire d'un bois de
résineux (Guitard, 1987)
a : trachéide dans le bois de printemps b :
trachéide dans le bois d'été
c : canal résinifère d : rayon
ligneux
e : rayon ligneux avec canal
résinifère
f : ponctuation.
La nature, le nombre et l'organisation spatiale des
cellules du bois peuvent être décrits par l'observation de
trois coupes matérielles (LR, RT, TL) identifiées en
définissant la base
r r r
( R , T , L ) comme le repère d'orthotropie du
matériau bois (Figure 1.7). Ces plans de
référence décrivent le « plan
ligneux » d'une espèce. Bien que l'architecture du cerne
soit considérée comme un caractère systématique,
quasiment invariable pour une même essence, puisque
génétiquement prédéterminée, la
proportion des différentes cellules qui constituent
« le plan ligneux » est très fortement
dépendante des conditions de croissance de l'arbre
(substrat, climat,...).
A partir de différentes observations
(microphotographies) et dans le cas des résineux présentant
une organisation du plan ligneux relativement simple, il est possible
d'assimiler le matériau bois à une structure
alvéolée de type nid d'abeille.
22
Inventaire des facteurs essentiels de la variabilité intra
arbre des propriétés mécaniques des tissus ligneux
Sous l'hypothèse d'une masse volumique de la
matière ligneuse constante (i.e. assimilée à
celle des parois cellulaires), le module d'Young macroscopique
longitudinal (noté par la suite
EL) peut être alors évalué à partir du
module élastique pariétal correspondant et de la
porosité
(Gibson et al, 1988). Ce passage micro-macro
s'avère bien plus délicat dans le plan transverse. A
cette échelle, et dans ce même plan de description
(où les démarches d'homogénéisations apparaissent
relativement complexes), la morphologie cellulaire joue un rôle important
et conduit à une importante anisotropie élastique (Farruggia,
1998, Farruggia et
al, 1996, 2000).
1.3.1 La morphologie cellulaire
Selon divers auteurs (Gillis, 1972, Gibson et al, 1988,
Koponen et al, 1989, 1991, Perré et al,
1994, Farruggia, 1998, Farruggia et al, 1996, 2000,
Perré, 1998, Holmberg et al, 1999), pour une même
porosité, les propriétés élastiques
transverses macroscopiques de structures tubulaires de type nids
d'abeilles sont fortement variables (modules élastiques). Gillis
(1972)
a ainsi montré que des bois de densité
proches pourront posséder des modules élastiques transverses
(ER et ET) très différents s'ils se distinguent les uns
des autres par la forme
(morphologie cellulaire) ou par la disposition
spatiale de leurs cellules (arrangement cellulaire).
R

Figure 1.8 : Deux morphologies cellulaires
envisagées : (a) modèle de Gibson et al (1988), (b) modèle
de Guitard et al (2002)
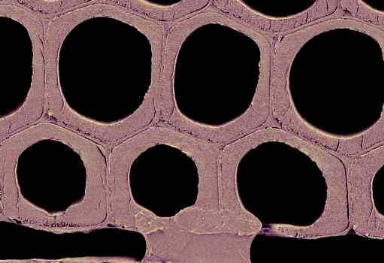
Figure1.9 : Micrographie
électronique (ESEM) montrant le cas d'une
cellule hexagonale sur P. radiata, (d'après Donaldson, 2003)
Barre d'échelle 16 um
Figure 1.10 : Cellule de

forme quasi rectangulaire de P. abies observée par
double coloration safranine/ bleu alcyan (Ruelle, 2003). Barre d'échelle
25 um
Le tissu ligneux est ici défini comme un ensemble
de cellules identiques, regroupées en
réseau, et assurant dans l'arbre, la même
fonction physiologique (conduction de la sève brute, fonction
mécanique de support, conduction et renfort radial respectivement
pour les trois cellules essentielles constituant le bois initial, le bois
final et les rayons ligneux).
Pour prédire le comportement macroscopique
élastique d'une structure aussi hétérogène dans
sa constitution que le bois, et ce à partir de sa
morphologie et des propriétés microscopiques
de ses constituants, la littérature fait
généralement état de nombreuses démarches
de changement d'échelles (Gillis, 1972, Farruggia, 1998, Badel 1999,
Badel et al, 1999, Perré,
23
Inventaire des facteurs essentiels de la variabilité intra
arbre des propriétés mécaniques des tissus ligneux
1998) consistant en la représentation d'un milieu
équivalent et en la construction d'un modèle
applicable à ce même milieu.
De telles approches, impliquent la désignation d'une
cellule ou d'un ensemble de cellules
(Volume Elémentaire Représentatif) comme
élément(s) unitaire(s) du milieu périodique, ce qui
apparaît, à priori, assez délicat compte tenu de la
variabilité intra et interspécifique de la forme
géométrique de la cellule ligneuse constatée
habituellement chez les résineux comme chez les feuillus (Venet et
al, 1986, Watanabe et al, 1999, 2000).
1.3.1.1 Choix de la cellule unitaire comme élément
architectural représentatif du tissu ligneux
Une grande variabilité de formes cellulaires
La forme microscopiquement observable des cellules de
résineux peut être tour à tour approximativement
rectangulaire (Keller, 1999), hexagonale (Decoux et al, non
publié), ou variable selon le type de tissu ligneux (hexagonal
et rectangulaire respectivement pour les cellules initiales et finales
du bois normal de Picea abies, Bergander, 2001, voire presque
circulaire pour les cellules de bois de compression de plusieurs essences
résineuses, Timell,
1986, Ruelle, 2003). Les Figures 1.9 et 1.10 illustrent
ainsi, pour deux essences résineuses
(Pinus radiata et Picea abies), un exemple de morphologie
cellulaire rencontrée dans le bois final dit « normal ».
Certains récents travaux (Marion, 2001, Sarèn
et al, 2001), menés sur Picea abies, ont montré, par
analyse d'images, une importante variabilité inter cerne de la
morphologie cellulaire.
L' « indice de circularité » des cellules de
bois normal décroît ainsi avec l'âge de la couche
d'accroissement ; la forme des lumens est proche de l'ovale
prés de la moelle et devient progressivement rectangulaire au fur
et à mesure d'une progression radiale vers le cambium. Des
précisions complémentaires sur ces évolutions
morphologiques intra cerne seront fournies ultérieurement
(chapitre 3).
Devant un tel éventail de formes cellulaires
possibles, les modélisations du comportement mécanique
tissulaire admettent donc nécessairement une morphologie
cellulaire simplifiée
(moyenne), n'ayant pour but que de préciser les
éléments de la cellule ligneuse susceptibles
de répondre à des sollicitations mécaniques
spécifiques (traction, compression, flexion).
Des paramètres géométriques communs aux
différents modèles de cellule ?
Les modules d'élasticité des
différents tissus étant le reflet direct du comportement
de la cellule à une sollicitation spécifique (traction et/ou
compression, éventuellement flexion), à modules
élastiques de double paroi identiques, les différences les
plus notables entre les propriétés élastiques
tissulaires rencontrées dans la bibliographie, proviennent
donc, essentiellement, de la géométrie cellulaire adoptée
dans chaque modèle.
Des modèles assimilant la morphologie cellulaire à
un rectangle (modèles proposés par Navi
et al, 1995, Holmberg et al, 1999, Guitard
et al, 2002) ou à une structure hexagonale (modèles
de Gibson et al, 1988, Koponen et al,
1991) conduisent ainsi chacun à des évaluations de
modules élastiques de tissu sensiblement différentes
(respectivement par excès et par défaut). Dans le cadre de
schématisation du plan ligneux par différents
réseaux de cellules hexagonales, l'épaisseur
pariétale dans le coin cellulaire constitue de plus un
paramètre essentiel (rôle de renfort) dans
l'évaluation du module élastique tissulaire
tangentiel
(Watanabe et al, 2000).
24
Inventaire des facteurs essentiels de la variabilité intra
arbre des propriétés mécaniques des tissus ligneux
Néanmoins, et même s'ils apparaissent de
prime abord différents, les paramètres
géométriques traduisant la forme
générale de la cellule « moyenne » sont
généralement communs (le lien est plus ou moins direct) aux
schématisation de forme envisagées.
Ainsi la variable , du modèle hexagonal de
Gibson et al (1988), (Figure 1.8a), ou son équivalent
RCW fixé à 30 degrés dans la modélisation
proposée par Koponen et al (1991), fournissent tous les deux
une indication de l'angle entre la direction radiale R du bois et celle
de l'élément de paroi soumis à une
flexion lors d'un chargement tangentiel. Avec une description du plan
ligneux par un nid d'abeille à élément
rectangulaire (Figure 1.8b), les facteurs de forme précédents
sont pris égaux à zéro dans le modèle de Guitard
et al (2002). L'influence de ce même paramètre angulaire
n'est néanmoins pas ignorée dans ce dernier modèle, elle
est prise en compte de façon indirecte en considérant que
l'épaisseur (eR) de la paroi radiale peut être différente
de l'épaisseur (eT ) de la paroi tangentielle.
On notera enfin une autre singularité du modèle
à cellules rectangulaires envisagé par Guitard
et al (2002). La longueur de paroi fléchie prise
en compte est égale au diamètre (DR) diminué
de deux fois l'épaisseur de paroi
(eT), contrairement au modèle proposé par Gibson
et al,
(1988) considérant le diamètre cellulaire,
indépendamment de l'épaisseur pariétale. A
porosité
fixée, cette différence conférera, a
priori, une plus grande rigidité au nid d'abeille tissulaire, puisque
les dimensions de l'élément cellulaire soumis à la flexion
sont moindres. Une étude complémentaire sur la part d'anisotropie
tissulaire imputable à la flexion des parois sera donc menée plus
loin (chapitre 3).
1.3.1.2 Disposition spatiale des cellules dans le plan transverse
: l'arrangement cellulaire
Admettant une organisation bidimensionnelle du cerne,
Khale et al (1994), ont décrit l'architecture du plan
ligneux de résineux, à partir de microphotographies. Dans la
direction radiale, les cellules (provenant de la division d'une même
initiale cambiale) sont globalement alignées (elles forment en fait de
petits « zig zag », combinaison de paroi orientées dans la
direction radiale et dans la direction tangentielle), tandis qu'une
distribution bien plus anarchique est constatée dans la direction
tangentielle. Le long d'une même disposition « zig zag », les
auteurs précisent que le faible nombre de paroi tendant à
s'éloigner de la direction radiale permet de supposer que lors d'un
chargement radial tous les efforts sont supportés par
les parois disposées en prolongement les unes des
autres (soumises à une telle sollicitation, les parois tangentielles
ne joueraient le rôle que d'entretoise, Bergander et al,
2000a, 2000b, Guitard et al, 2002).
D'autres travaux essentiels, visant à obtenir
un maillage numérique de tissu ligneux, aboutissent, sur les
résineux, à ces mêmes conclusions (Perré et
al, 98, Farruggia, 1998). On notera ici que les équations
développées par l'ensemble des auteurs, à partir
des théories classiques de la résistance des matériaux,
ne sont que des approximations du comportement mécanique complexe du
plan ligneux (lors de tout chargement, l'absence d'alignement dans la direction
tangentielle induit l'existence de régions à haute concentration
de contraintes).
Les Figures 1.11 et 1.12 illustrent, dans le plan transverse de
deux résineux (Pinus pinaster et
Pinus radiata), l'existence d'une disposition quasi
ordonnée des parois cellulaires dans la
r r
direction radiale R et d'une orientation bien plus
aléatoire dans la direction tangentielle T .
25
Inventaire des facteurs essentiels de la variabilité intra
arbre des propriétés mécaniques des tissus ligneux

R
T
Figure 1.11 : Microscopie confocale associée
à l'auto fluorescence de la lignine sur Pinus
radiata (site internet www.forestresearch.co.nz).
Fenêtre de 160*160 um.

R
T
Figure 1.12 : Double coloration à la safranine
bleu alcyan sur Pinus pinaster, (Ruelle, 2003). Barre d'échelle, 25
um
1.3.1.3 Une estimation des modules élastiques tranverses
tissulaires par excès ?
Dans leurs appréciations du comportement
mécanique tissulaire, la plupart des modélisations admettent le
collage parfait par la lignine de deux parois cellulaires
contiguës (double cloison). Dans le cadre de la cohésion de
l'ensemble des cellules disposées en réseau, excluant tout
mouvement entre parois voisines, la rigidité à la flexion est
nettement supérieure
(flexion réduite d'un facteur 4 pour une
porosité de 0,64, Perré et al, 1994) à celle
obtenue en autorisant un glissement sans frottement entre les parois de deux
cellules adjacentes (permis par une lamelle mitoyenne hypothétique).
La réalité, en terme de rigidité
tissulaire en flexion, se situe sans doute entre ces deux
dernières propositions « limites », en raison d'une part d'une
morphologie moyenne cellulaire
de résineux plus fréquemment proche de
l'ovale (Marion, 2001, Hunter, 2001) ou de l'hexagonal (Decoux et
al, non publié) que du rectangulaire (Navi et al, 1995,
Guitard et al,
2002), et de l'existence de lignifications différentes
entre les parois radiales et tangentielles
(Bosshard, 1956).
| 


