Lorsque le chlore est introduit dans l'eau, une
première réaction instantanée se produit entre le l'acide
hypochloreux HOCl et la matière organique présente dans l'eau
pour donner les chloramines (Cockx, 2005):
· Monochloramine : HOCl + NH3
? NH2Cl + H2O
(II.26)
· Dichloramine : HOCl +
NH2Cl ? NHCl2 +
H2O (II.27)
· Trichloramine : HOCl + NHCl2
? NCl3 + H2O (II.28)
Il est à préciser que le chlore consommé
par la matière organique n'a aucun rôle désinfectant :
c'est ce qu'on appelle demande en chlore. Lorsque la matière organique
est épuisée, la formation du chlore libre peut commencer pour
amorcer la désinfection. La figure ci-dessous décrit les
transformations successives engendrées par l'ajout de doses croissantes
de chlore à une eau faible en matière organique (graphique
gauche) et pour une eau riche en matière organique (graphique droit). A
partir du point d'origine les doses ajoutées réagissent avec la
matière organique ce qui engendre la production des monochloramines et
ce jusqu'au point maximum de la courbe « Demande ». Au-delà de
ce pont les monochloramines sont transformées en dichloramines et en
acide chlorhydrique HCl. Le point PC est un point de changement de l'allure de
la courbe appelé point critique, il est atteint lorsque la demande en
chlore est satisfaite. Au-delà de ce point, le chlore ajouté est
du chlore libre efficace pour la désinfection et qui croit à la
même allure que les doses de chlore appliquées.
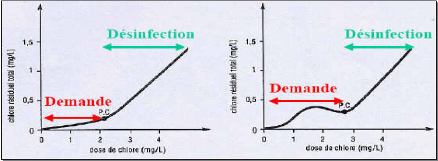
Figure II.1:Demande en chlore (Cockx,
2005)
I-2-4/ Principaux facteurs
physicochimiques
influençant la
dégradation du chlore dans
l'eau
17
Savoir les aspects physico-chimiques derrière la
dégradation de chlore est indispensable si nous devons développer
une stratégie capable de désinfecter un système
d'adduction d'eau potable, en même temps, de préserver la
qualité d'eau jusqu'au point de distribution, sans employer plus
désinfectant que nécessaire. Dans ce sens, la modélisation
du taux de dégradation du chlore est essentielle pour projeter
correctement de nouveaux systèmes ou pour faire des changements de
celles existantes.
La dégradation du taux de chlore et les modèles
de propagation traitent le tronçon de conduite comme s'il était
un réacteur chimique. Pour ce réacteur, on supposé que le
chlore entre d'une extrémité, se consomme dans l'eau
(dégradation en bloc) par les micros organismes et par les biofilms
fixé à ces parois et transporté à l'autre
extrémité de la conduite par la convection. Le chlore peut
également réagir avec la conduite elle-même. Le
mécanisme de dégradation (réaction) et de transport de
chlore est schématiquement décrit sur le schéma au
dessous. Par conséquent, le phénomène de réaction
du désinfectant avec l'eau dans les tronçons du réseau se
produit aussi bien dans la veine liquide qu'au niveau de la paroi.
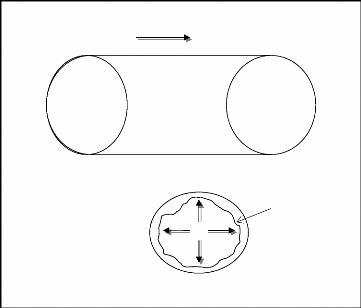
Concentration importante
Convection et dégradation axiale par la masse
d'eau
Diffusion Radial et dégradation par les
biofilms
Concentration moins
importante
Biofilms
Figure II.2:Description schématique du
modèle de transport 2-D de chlore
II-2-4-1/ pH et
minéralisation
Dans le réseau, le pH et la minéralisation sont
importants pour le contrôle de la corrosion, l'agressivité d'eau,
l'action du désinfectant et la précipitation des
éléments dissous. Mais le pH peut
18
varier le long de la distribution du fait d'une
évolution de la concentration de CO2 dissous, ou bien parce que l'eau
traitée n'était pas forcément à l'équilibre
calcocarbonique en sortie de la station. Une aération dans un
réservoir peut rendre une eau dure et incrustante par une perte de CO2,
ce qui risque alors d'obturer les conduites par dépôt de tartre.
La solution est l'addition de CO2 et/ou l'extraction de CaCO3, qui sert
à restaurer l'équilibre. Inversement, une eau chargé CO2
agressif (avec un pH bas) a tendance à attaquer les matériaux
qu'elle rencontre avec des conséquences importantes: dissolution de
ciments, attaque des métaux ferreux (corrosion) ou attaque de
métaux toxiques tels que le plomb. Des solutions envisageables sont
l'élimination de CO2 agressif, l'addition de chaux pour la mise à
l'équilibre calcocarbonique ou un traitement de
reminéralisation.
II-2-4-2/ Température
Une température élevée peut favoriser
des goûts ou odeurs désagréables. De plus, elle
accélère la plupart des réactions physico-chimiques et
biologiques dans le réseau, influence la croissance bactérienne,
dissipe l'effet du désinfectant résiduel en agissant sur les
constantes d'équilibre et accélère la corrosion.
L'activité bactérienne s'accroît nettement lorsque la
température dépasse 15°C.
II-2-4-3/ Oxygène dissous
Toute baisse de la teneur en oxygène dissous
détectée sur le réseau peut être
interprétée comme un signe de croissance biologique. Dans le cas
où le réseau est correctement entretenu, une anaérobiose
répandue ne se produit qu'avec des temps de séjour très
longs.
II-2-4-4/ Turbidité
Si la turbidité d'eau est supérieure à
0.4 NTU, l'action des désinfectants est ralentie, voire annulée.
Les colloïdes responsables de la turbidité peuvent protéger
les bactéries des oxydants. Ainsi, un traitement de chlore libre
à 0.4 mg/l pendant une heure, qui donne normalement une garantie
bactériologique à l'eau, n'est actif que si la turbidité
est inférieure à 0.4 NTU.
II-2-4-5/ Matière
organique
Elle représente une source nutritive essentielle pour
la prolifération bactérienne, le contenu en
éléments organiques carbonés est aujourd'hui
considéré comme un facteur primordial dans la maîtrise de
la qualité microbiologique d'eau dans le réseau. En effet une
consommation de la matière organique s'accompagne d'un accroissement de
la densité bactérienne au niveau du biofilm.
II-2-4-6/ Dureté
19
Une eau trop douce a un effet corrosif sur les canalisations
et peut amener dans l'eau une présence excessive de métaux (tel
le plomb) provenant des canalisations. La dureté d'eau n'a pas
d'incidence sur la santé (observatoire régional de
l'environnement Poitou-Charentes). Elle se calcule en degré
français (°F) correspondant à 4 mg de calcium ou 2,4 mg de
magnésium par litre d'eau. La valeur idéale est de 15°F.
II-2-4-7/ Ions fer
L'influence des ions de fer sur la dégradation du
chlore existe au cours de l'oxydation des ions Fe2+ (sous forme de
bicarbonate) en ions Fe3+ (sous forme d'hydroxyde de fer) en milieu
alcalin et dure (présence de la molécule de carbonate de
magnésium ou de calcium), qui est une réaction très rapide
en solution, où le chlore réagit avec le calcium ou
magnésium.
I I-2-4-8/ La nitrite
Le chlore libre oxyde les ions nitrites en ions nitrates.



