II.3. LES PARAMETRES INFLUENTS SUR LA LIXIVIATION EN
TAS
Le but d'une lixiviation est la solubilisation très
poussée de l'élément métal utile. Pour y parvenir,
plusieurs paramètres entrent en ligne de compte. Ces paramètres
sont classés suivant les avantages qu'ils donnent du point de vue
thermodynamique et cinétique.
II.3.1. PARAMETRES THERMODYNAMIQUE II.3.1.1.
Généralités
L'étude de l'aspect thermodynamique de lixiviation
s'avère importante car elle nous renseigne sur la stabilité ou
l'instabilité d'un composé chimique ; la possibilité ou
l'impossibilité d'une réaction chimique de se dérouler; le
sens dans lequel se déroule la réaction ainsi que le point
d'équilibre pour un système réactionnel donné
(Pourbaix, 1963).
Les conditions de mise en solution des espèces
métalliques (ion, oxyde, hydroxyde, métal, sulfure) sont
étudiées en fonction du pH et du potentiel
d'oxydoréduction de la solution grâce à un diagramme
appelé « diagramme de Pourbaix », spécifique pour
chaque métal.
II.3.1.2. Diagrammes de Pourbaix
Nous allons faire une approche thermodynamique à l'aide
des diagrammes de Pourbaix qui permettent de représenter dans un plan
tension-pH les domaines de prédominance des différentes
espèces d'un élément ; Cela pour faire une
prévision qualitative des réactions d'oxydoréduction dans
différents domaines de pH (Dulière, 2005).
Pour ce travail, nous allons nous intéresser aux
diagrammes de Pourbaix des systèmes Cu- H2O, Co-H2O et Fe- H2O à
25°C.
II.3.1.2.1. Diagramme d'équilibre tension - pH du
système Cu - H2O
Le diagramme donné à la figure 4 nous montre que
les ions Cu2+ sont stables en milieu acide et oxydant. L'oxyde ainsi
que les hydroxydes cuivrique peuvent être solubilisés en milieux
acide suivant les réactions de dissolutions chimiques [II.5] et [II.6].
:
Page | 14
- CuO + 2H+ = Cu2+ + H2O [II.5]
Avec log [Cu2+]= 7,89 - 2 pH [II.6]
- Cu(OH)2 + 2H+ = Cu2+ + 2H2O [II.7]
Avec log [Cu2+]= 7,89 - 2 pH [II.8]
On doit travailler à pH< 4,6 pour avoir les ions
Cu2+ afin d'éviter la précipitation de ces
derniers.
- Cu2O + 2H+? 2Cu2+ + H2O + 2e [II.9]
Avec E = 0,203 + 0,0591pH - log [Cu2+]
[II.10]
Cette réaction n'est possible qu'en présence d'un
oxydant, sinon on a la réaction :
- Cu2O+ 2H+? Cu2+ + Cu + H2O [II.11]
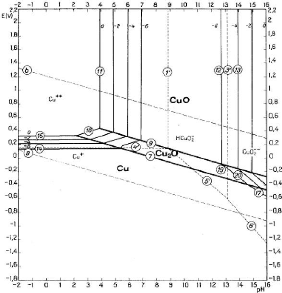
Figure 4: Diagramme d'équilibre tension - pH du
système Cu - H2O à 25°C
(Source : M Pourbaix,
1963)
Page | 15
2.1.1.1.1. Diagramme d'équilibre tension - pH du
système Co - H2O
Après observation et examen de la figure 5 qui suit, le
constat est que l'ion Coi+ne peut être présent que dans
des conditions très oxydantes et très acides. On procède
donc à la réduction du
+
Co en Col+partant du Co203 ; pour se
faire, il faut travailler en milieu acide avec usage d'un réducteur. La
réaction est la suivante:
- Co203 + 6H+ + 2e +
-* Co+ H [II.12]
Avec E0 = 1,746 - 0,1773 pH - 0,0591 1og[
Co3+] [II.13]
D'après la théorie, le Co2O3 ne peut
être stable à toute température et, d'après
Pourbaix, il peut être obtenu à l'état pur à partir
de l'hydroxyde de cobalt trivalent Co(OH) 3 qui lui est stable
à basse température. Bien que les propriétés
thermodynamiques de l'oxyde de cobalt trivalent hydraté soient peut
différentes de celles de Co2O3, leurs comportements
hydrométallurgique sont interprétées de la même
manière sur le diagramme.
Le CoO2 (oxyde de cobalt tétravalent) mentionné
dans le diagramme est instable dans la nature ; il se transforme en oxyde
trivalent.
On peut également obtenir l'ion cobalteux à partir
de la réaction [II.14]
- Co0 + 2H+-* Co' + H [II.14]
Page | 16
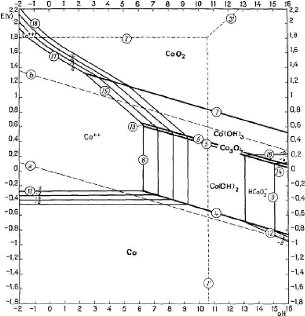
Figure 5: Diagramme d'équilibre tension - pH du
système Co - H2O à 25°C
(Source : M Pourbaix,
1963)
2.1.1.1.2. Diagramme d'équilibre tension - pH du
système Fe - H2O
Nous exploitons ce diagramme dans notre travail par ce que le
minéraux cuprifères sont toujours accompagnés du fer comme
impureté principale.
On constate sur la figure 6 que le fer sous forme
d'hématite est stable dans un domaine oxydant et moins acide. La
présence d'un réducteur en milieu acide favorise la formation de
l'ion ferreux suivant la réaction [II.16]:
- Fe203 + 6H+ + 2e - -* 2Fe2+ +
3H20 [II.15]
- Avec: E0 = 0,728 - 0,1773 pH - 0,0591 1og
[Fe3+] [II.16]
Le fer sous forme de Fe3O4 est stable à des pH
moins acide et à des potentiels plus oxydants que ceux de Fe2+
la réaction étant :
- Fe3O4 + 8H+ + 2e- ? 3Fe2+
+ 4H2O [II.17]
Il est à noter que la thermodynamique permet de
prédire si la lixiviation d'un métal donné est possible
dans une solution appropriée mais ne permet pas de dire à quelle
vitesse elle a lieu.
Page | 17
- Avec : E° = 0,980 - 0,2364 pH - 0,0886 log
(Fe2+) [II.18]
On peut aussi, par dissolution de , obtenir l'ion ferreux par la
réaction :
- --* [II.19]
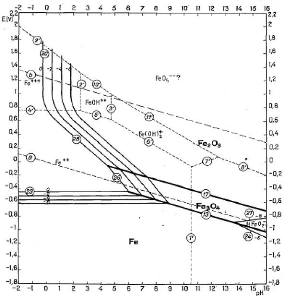
Figure 6 : Diagramme d'équilibre tension - pH du
système Fe - H2O à 25°C
(Source : M Pourbaix,
1963)
Il est donc à noter qu'il est conseillé de
travailler dans les conditions telles que les oxydes ne passent pas en
solution. Au cas où le fer passait en solution sous forme d'ions
ferreux, il faut l'oxydé en ions ferriques et porter le pH de la
solution entre 2 et 3 pour précipiter l'hydroxyde Fe(OH)3.
Mais cette précipitation de cet hydroxyde
Fe(OH)3, pour ce qui concerne la lixiviation en tas, elle peut
être à la base du blocage de la percolation de la solution.
| 


