3-3-5 Le fer
Le fer est un élément assez abondant dans les
roches sous formes de silicates, d'oxydes et hydroxydes, de carbonates et de
sulfures. Le fer est soluble à l'état d'ion Fe++ (ion
ferreux) mais insoluble à l'état Fe+++ (ion ferrique).
Les nappes captives isolées des échanges avec la surface sont en
conditions réductrices : leur eau est ferrugineuse. Ce fer dissous
précipite en milieu oxydant, en particulier au niveau des sources et
à la sortie des conduites. La présence de fer dans l'eau peut
favoriser la prolifération de certaines souches de bactéries qui
précipitent le fer où corrodent les canalisations.
L'existence dans l'eau du fer ferrique dissous exige un pH
bas, ce qui n'est pas caractéristique pour toutes les eaux naturelles.
C'est pourquoi la majeure partie de tout ce fer ferrique se trouve à
l'état colloïdal, ou en suspension finement dispersée. En
présence de l'oxygène de l'air, le fer bivalent contenu dans les
eaux s'oxyde en fer ferrique ; une eau contenant 50mg/l de fer ferreux
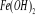 parait claire et incolore. Laissée au repos à l'air
libre, elle devient trouble et il se précipite au fond du
récipient un dépôt rougeâtre de rouille. [18] parait claire et incolore. Laissée au repos à l'air
libre, elle devient trouble et il se précipite au fond du
récipient un dépôt rougeâtre de rouille. [18]
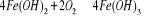
Dans la région de MEKNES (Maroc), la teneur en fer pour
les eaux souterraines est comprise entre 0,032 et 0,280 mg/l.
Les concentrations élevées de fer
confèrent un goût désagréable et peuvent donner des
dépôts dans les tuyaux et diminuer ainsi leur section vive.
L'excès de fer peut provoquer des taches ou ternir la coloration des
vêtements. Il semble que la consommation prolongée d'une eau
contenant un excès de fer peut provoquer des maladies hépatiques
et augmenter le risque d'infarctus. C'est pourquoi les normes d'eau potable
limitent le taux de fer à 0,3 mg/l. [19]
3-3-6 Les phosphates
Les phosphates sont des composés phosphorés.
Dans la nature, le phosphore (P) est généralement présent
sous forme de molécules de phosphates. Parmi les phosphates
présents dans l'eau, on distingue couramment :
- les ortho phosphates (H2PO4-,
HPO42-, PO43-), qui sont des sels
minéraux de l'acide phosphorique (H3PO4). Cette
forme, parfois notée o-P, est également appelée lors de la
mesure des concentrations dans les eaux « phosphore réactif »
;
Ø les polyphosphates (ou phosphates condensés),
qui correspondent à des molécules plus complexes de phosphates
minéraux. On parle également de « phosphore hydrolysable
» dans l'acide ;
Ø les phosphates organiques, qui correspondent
à des molécules de phosphates associées à des
molécules à bases carbonées, comme dans la matière
organique vivante ou morte (animaux, végétaux, microorganismes,
etc.).
Dans l'eau, les phosphates inorganiques (ortho phosphates et
polyphosphates) et les phosphates organiques peuvent se retrouver sous formes
dissoutes et/ou particulaires (associés aux particules en suspension, de
sédiment, ou de sol).
Lors de la détermination des concentrations en
phosphates dans une matrice quelconque (eau, sol, aliment), suivant les cas, la
teneur en phosphates est exprimée en grammes de PO4, de
P2O5 ou de P par litre.
Ainsi : 1 g.L-1 de PO4 = 0,747
g.L-1 de P2O5 = 0,326 g.L-1 de
P.
Sources de phosphate
Contrairement à l'azote, les composés gazeux du
phosphore sont presque inexistants dans l'atmosphère. Il n'existe donc
pas de réservoir atmosphérique important de phosphore.
Le phosphore est naturellement présent dans certaines
roches (ignées ou sédimentaires). Le lessivage de celles-ci par
les processus naturels d'érosion conduit à sa solubilisation dans
les milieux aquatiques. En absence d'intervention humaine, les eaux de surfaces
contiennent cependant très peu de phosphates.
Les phosphates sont moins aisément lessivables que les
nitrates. Ils s'adsorbent aisément aux particules de sol, de
sédiment et aux particules en suspension pour former des complexes
organiques ou minéraux. Par conséquent lors de l'infiltration de
l'eau dans les sols, une fraction des phosphates initialement dissous dans
l'eau sera retenue par les particules de sol.
Une partie est généralement
entraînée et contamine les eaux superficielles et les nappes
phréatiques.
L'urine et les fèces excrétées par les
animaux et les hommes constituent également une source de phosphore. Si
cette source peut être considérée comme naturelle,
l'élevage (troupeaux, aquaculture) constitue une pollution
supplémentaire. Les agglomérations urbaines conduisent à
des concentrations ponctuelles des rejets.
Les rejets d'eaux domestiques constituent
généralement la principale source de pollution des eaux par les
phosphates. En France, les rejets de phosphore sont estimés à
environ 70 000 tonnes par an, dont 51 % d'origine urbaine. A
proximité des grands centres urbains, cette part est beaucoup plus
importante. L'usage de tripolyphosphates de sodium (TPPS) comme additifs dans
les lessives textiles et les produits pour lave-vaisselle constitue une autre
source de contamination des eaux par les phosphates. Cette source de pollution
a été réglementée dans divers pays (Etats-Unis,
Japon, certains pays Européens) et est en cours de diminution effective.
Dans les pays où la production agricole intensive est
particulièrement développée, l'utilisation d'engrais
phosphatés peut constituer la principale source artificielle
d'enrichissement des eaux en phosphore. La fertilisation des terres agricoles
est à la source d'une pollution diffuse des eaux. En 1997, la
Société Française de Chimie estimait la consommation
mondiale de fertilisants phosphatés à 32 000 000 tonnes par an.
En 1999, les consommations Française et Européenne étaient
respectivement de 966 000 et 3 467 000 tonnes par an (UE, 2002). Le phosphore
utilisé comme engrais est principalement dispersé sous forme de
superphosphates (ortho phosphates solubles), et est donc fortement bio
disponible.
Les autres usages industriels du phosphore (chimie de
synthèse, photographie, lithographie, etc.) constituent des sources
ponctuelles moins importantes de contamination des eaux.
Il est enfin important de noter que le phosphore
utilisé comme fertilisant est épandu sur les sols et est par
conséquent susceptible d'être en partie assimilé par les
végétaux ou fixé sur les particules de sol.
Effets connus sur l'environnement
Comme l'azote, le phosphore est un constituant essentiel de la
matière organique et est un nutriment indispensable pour les organismes
vivants. Cependant il doit être considéré comme un polluant
lorsqu'il est présent à de fortes concentrations dans
l'environnement. Les rejets de phosphore dans les écosystèmes
aquatiques constituent l'un des plus sérieux problèmes
environnementaux car ils contribuent à accélérer
l'eutrophisation de ces milieux. Dans les eaux douces, ce sont cependant les
apports de phosphore qui sont généralement à l'origine
d'un disfonctionnement des écosystèmes. Dans les eaux naturelles,
le ratio entre les quantités d'N et de P disponibles est
généralement supérieur à 16. Par conséquent,
même en cas de pollution du milieu par l'azote, si aucun apport de P
n'est réalisé, les algues ne pourront pas se développer.
La pollution des eaux par le phosphore est donc très souvent à
l'origine de développements algaux importants et conduit à la
dystrophisation (eutrophisation accélérée) des lacs et
rivières.
Effets connus sur la santé humaine
Si les composés phosphorés utilisés
à hautes concentrations dans l'industrie (phosphore blanc qui est par
exemple un constituant de la mort-aux-rats, P rouge, P noir, etc.) peuvent
avoir des effets très toxiques sur l'homme, les concentrations
normalement observées dans l'eau ou dans l'habitat semblent ne pas
présenter de risque direct pour la santé humaine. C'est surtout
par l'intermédiaire des nombreuses perturbations des
écosystèmes aquatiques qui sont imputables aux pollutions par les
phosphates que cet élément a des répercussions sur
l'être humain.
| 


