I.8.1. 2. L'énergie cristalline de
cohésion
L'énergie de liaison est l'énergie
nécessaire pour former le cristal à partir des ions qui le
composent prés à l'état gazeux. Ou bien c'est
l'énergie totale de liaison des ions dans le cristal. En thermodynamique
cette énergie correspond à la quantité de chaleur
échangée pendant la réaction chimique pour former le
cristal. Cette quantité de chaleur est égale à la
variation de l'énergie de l'enthalpie AH, donc en peut écrire
:
E = AH (I. 5)
Cette énergie de liaison des cristaux ioniques comporte
essentiellement deux termes, un terme qui représente l'énergie
d'attraction et l'autre représente l'énergie de
répulsion.
E = Eatt +
Erép (I.6)
D'après l'approximation de Born-Mayer, l'énergie
totale E donnée en fonction de la distance r séparant les atomes
les plus proches voisins par la relation suivante :
? M ? r
2
E H
= A = _ + ?
Z Z e N a
. . . . + B . exp( )
_ (I.7)
? ?
L r ? p
Où Z , Z les nombres atomiques pour les
deux types d'ions (cation et anion),
M est la constante de Madelung.
B est une constante, qui peut être
déterminée en minimisant l'énergie E par rapport à
r.
+ ? 2
? Z Z e N M
. . . . ? P
a
E ? ? ? ? ?
(1 ) (I.8)
équi ? r r
0 j 0
pPeut être déterminé expérimentalement
en faisant appel à la compressibilité des solides [15,16]. Dans
le cas de ZnO on trouve que :
E équi= -255.98 Kcal/mol
I.8.1.3. Structure électrique de bandes
:
On rappelle que la structure électronique de
l'oxygène et de zinc a les configurations suivantes : Zn :
1s2 2s2 2p6 3s2 3p6
3d10 4s2
O : 1s2 2s2 2p4
Les états 2p de l'oxygène forment la bande de
valence, les états 4s de zinc constituent la zone de conduction.
L'observation de la figure I.11 montre que le ZnO est un semi
conducteur à gap directe [24], le minimum de la bande de conduction et
le maximum de la bande de valence est située au point IT de la zone de
brillouin. La largeur de la bande interdite est de l'ordre de 3.3eV, et lui
permet des transitions verticales entre la bande de valence et la bande de
conduction, et aussi d'avoir des transitions radiatives. D'autre part, le ZnO
possède une bande excitonique très large (=60meV) qui est la plus
large dans la famille II-VI [27]. Ce qui nous permettons de remarquer l'effet
excitonique même à la température ambiante.
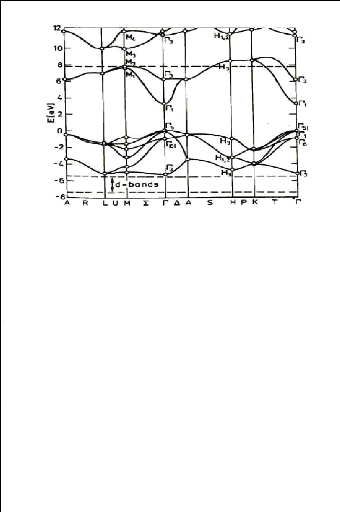
Figure I.11 : Structure des bandes
d'énergie de ZnO [28].
I.8.2. Propriétés optiques et
luminescence:
Le tableau II.5 indique quelques propriétés
optiques de ZnO. Ces dernières sont très sensibles à la
présence d'impuretés, les études par photoluminescence
[28] ont montré que la présence de Li favorise une
émission visible centrale autour de 600 nm, cette émission
noté DAP résulte d'une transition radiative d'un électron
situé à un niveau donneur vers le niveau accepteur de Li. La
présence des ions de Fe+3 donne elle aussi naissance à
une émission visible centré autour de 700 nm. D'autre part on
note que les propriétés optiques de ZnO sont très
sensibles à la présence des centres isoélectroniques tel
que Hg par exemple, ces centres jouent le rôle des centres de
recombinaison pour les porteurs de charges, dans le cas de Hg l'étude
réalisé par Tomasini et al [30] a montré la
présence d'une bande d'émission situé entre 3.28 et 2.85
eV reliée directement à la présence de Hg dans le spectre
de photoluminescence.
Figure I.5. Quelques
propriétés optiques de ZnO.
|
Constante diélectrique
|
=
// 8 .7
e? =7. 8
|
|
Coefficient d'absorption
|
104 cm-1
|
|
Indice de réfraction à 560 nm
|
1.8-1.9
|
|
Indice de réfraction à 590 nm
|
2.013-2.029
|
|
Largeur de la bande excitonique
|
60 meV
|
|
Transmittance
|
> 90%
|
Les traitements thermiques tels que les recuits thermiques ont
un effet important sur les propriétés optiques de ZnO, Chen et
al. A montré que l'absorption optique de ZnO dans la région
violette et UV augmente considérablement après un recuit sous air
ou sous une atmosphère d'azote [31,32], et que l'intensité de
l'émission verte dépend fortement des conditions
d'élaboration et de la température de recuit [33,34], cette
intensité varie en fonction de la température de recuit selon une
loi d'Arrhenius:
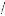
I = I 0 exp(--E a KT
r ) (II.9)
Avec :
Tr : température de recuit
Ea : énergie d'activation =1.035eV.
D'autre partN. Pawar et al [24] ont remarqué que la
transparence optique de ZnO dans les régions visible et proche
infrarouge du spectre solaire est une conséquence de son grand gap
(Eg=3.3eV), le seuil fondamental d'absorption de ZnO se situant dans
l'ultraviolet. La forme du spectre d'absorption intrinsèque peut
être observée seulement sur les couches minces à cause de
leur grand coefficient d'absorption [28]. Cette étude a montré
une montée abrupte du coefficient d'absorption aux environs de A=385nm
(E g=3.3eV).
L'oxyde de zinc est un matériau transparent dont
l'indice de réfraction sous la forme massive est égal à 2
[29]. Par ailleurs sous forme de couche mince, son indice de réfraction
et son coefficient d'absorption varient en fonction des conditions
d'élaboration. L'indice de réfraction a une valeur qui varie
entre 1,90 et 2,20 suivant les auteurs [24,25]. L'amélioration de la
stoechiométrie de ZnO conduit à une diminution du coefficient
d'absorption et à une augmentation de l'énergie de la bande
interdite [18,19]. L'oxyde de zinc dopé entre dans la classe des oxydes
transparents conducteurs dits TCO. Très peu dopé, il peut
être utilisé en luminescence [62].
I.8.3. Propriétés électriques
:
Le tableau I.6 regroupe quelques propriétés
électriques de ZnO. L'oxyde de zinc est un semiconducteur du groupe
AIVBII qui présente une bande interdite d'environ 3,3 eV, ce
qui permet de le classer parmi les semi-conducteurs à large bande
interdite [26]. Cette valeur de bande interdite peut varier suivant le mode de
préparation et le taux de dopage, entre 3,30 eV et 3,39 eV [63,64].
Cependant, il est possible de modifier largement les propriétés
d'oxyde de zinc par le dopage :
soit en s'écartant de la stoechiométrie ZnO,
principalement par l'introduction d'atomes de zinc en excès en position
interstitielle, ou par la création de lacunes d'oxygène (les
centres créés se comportent alors comme des donneurs
d'électrons)[30] ;
soit en substituant des atomes de zinc ou d'oxygène du
réseau par des atomes étrangers de valence différente
(élément du groupe III, F-, Cl-).
Il est intéressant de noter que le dopage de ZnO avec
l'aluminium fait diminuer la concentration de Zn en position interstitielle,
réduisant de ce fait la rapidité d'oxydation du Zn [60].
En pratique, on obtient uniquement par dopage une semi
conductivité de type n. Les taux de dopage obtenus peuvent être
très élevés (de l'ordre de 1020
atomes/cm3), permettant d'atteindre des résistivités
très faibles (de l'ordre de 10-4 ?.cm) [30]. En
général, la grande conductivité des couches d'oxydes pures
est due à la forte concentration en porteurs (électrons),
étant donné que la mobilité dans ces couches est
considérablement plus faible que celle en volume du matériau
correspondant. La forte concentration en électrons est attribuée
à la déviation par rapport à la stoechiométrie (ou
défauts dans la structure). La déviation à la
stoechiométrie peut être due aux lacunes d'anions [32] ou à
un excès de cations en position interstitielle [33]. La
nature exacte des défauts de structure dans la plupart des cas est
encore incertaine. La réaction de formation de ZnO
stoechiométrique [18].
Zn + + + e + O = ZnO
1
2 (I.10)
2
2
Dernièrement la conductivité de type p a
été obtenue par Wyckoff [64], ce qui
était impossible avant.
Les propriétés électriques de ZnO ont
été étudiées depuis longtemps ce qui lui permis
d'avoir un très vaste domaine d'utilisation, mais les faibles valeurs de
la mobilité des porteurs ne lui permettent pas une quelconque
compétition dans le domaine des composants électriques. Cependant
ce problème est résolu maintenant avec l'utilisation de la
méthode SVP (Seeded Vapor Phase) dans la préparation des
monocristaux de ZnO par Eagle-Picher, où des mobilités de l'ordre
de 200 cm2/V.s à 300 K ont été remarqué
[65]. Les propriétés électriques des
cristaux de ZnO surtout les cristaux non dopés dépendent
fortement de la méthode et des conditions
thermodynamiques de croissance de ces cristaux [66,67]. L'effet
de la non stoechiométrie sur les propriétés
électriques de ZnO a été étudiée par
plusieurs auteurs dont Majumder et al [61].
De nombreuses études ont montré qu'un traitement
thermique adéquataprès la croissance des cristaux de ZnO (recuit
à haute température) peut changer considérablement les
propriétés électriques des cristaux. Par exemple il a
été remarqué que pour des cristaux de ZnO
présentant une haute résistivité et avec une grande
concentration des porteurs de charge [42, 43, 62], cependant un traitement sous
air ou sous oxygène donne un effet opposé pour des cristaux de
faible résistivité [44,45].
I.9.Différents types de défauts dans le ZnO
:
Les défauts présents dans le ZnO dépendent
de la méthode de croissance et des conditions d'élaboration de ce
matériau. On pourra énumérer les défauts
suivants:
- défauts ponctuels (interstitiels, lacunes, atomes
étrangers).
- défauts linéaires (dislocations et sous joint de
grains).
- défauts plans (macles, joints de grains).
Il existe d'autres types de défauts d'ordre thermique
(Phonon) ou électrique (électrons, trous, excitons, ).
Tableau I.6. Quelques
propriétés électriques de ZnO.
|
Nature de la bande interdite
|
|
directe
|
|
Largeur de la bande interdite à 4.2 k
|
|
3.4eV
|
|
Largeur de la bande interdite à 300 k
|
|
3.34 #177; 0.02 (eV)
|
|
Type de conductivité
|
|
n et (p)
|
|
Mobilité maximale des électrons
|
|
200 cm2/V.s
|
|
Masse effective des électrons
|
|
0.28 m0
|
|
Masse effective des trous
|
|
0.60 m0
|
|
Densité d'états dans BC
|
|
3.71 1018 cm-3
|
|
Densité d'états dans BV
|
|
1.16 1019 cm-3
|
|
Vitesse thermique des électrons
|
|
2.2 107 cm.s-1
|
|
Vitesse thermique des trous
|
|
1.5 107 cm.s-1
|
|
Résistivité maximale
|
|
106 Ù.cm
|
|
Résistivité minimale
|
|
10-1 Ù.cm
|
|
Chapitre II
Élaboration et dopage des
couches minces de ZnO
|
II.1. Introduction:
Dans ce chapitre nous portons un intérêt
particulier à la technique de déposition des couches minces par
spray ultrasonique « pulvérisation ultrasonique ». Celle ci
est une alternative relativement simple qui utilise des moyens traditionnels et
non coûteux [15,16]. Sa mise en oeuvre est localement réalisable.
Elle présente, également, l'avantage d'élaborer des
couches minces sur des surfaces importantes comme celles des cellules solaires
ou d'écrans plats [83]. A partir des avantages cités
précédemment nous avons sélectionné ce
procédé d'élaboration et nous avons opté pour son
utilisation dans notre travail.
Pour cette raison nous avons réalisé, un banc de
dépôt de couches minces par spray ultrasonique. Celui-ci sera
détaillé par la suite.
II.3. La technique de spray ultrasonique
II.2.1. Pulvérisation ultrasonique des
liquides
La pulvérisation ultrasonique est basée sur
l'exploitation de l'énergie des ondes acoustiques de haute
fréquence (les ultrasons) pour fractionner des films liquides en une
multitude de petites gouttelettes de tailles uniformes qui sortent du bec sous
forme d'un jet. Les pulvérisateurs destinés à fonctionner
à des fréquences relativement faibles (quelques dizaines de KHz)
consistent en deux éléments piézoélectriques,
générateurs de vibrations mécaniques, fixés entre
un support et un amplificateur d'amplitude des vibrations [19]. Les travaux
expérimentaux réalisés confirment les
propriétés suivantes de la pulvérisation ultrasonique des
liquides:
· distribution très étroite du
diamètre des gouttelettes;
· possibilité de contrôler le diamètre
moyen des gouttelettes et le débit du liquide à pulvériser
de manière indépendante ;
· possibilité de pulvériser de très
petits débits;
· grande facilité de transport des gouttelettes par
un gaz porteur et modification aisée de la
forme du jet des
gouttelettes ainsi que de leur concentration suivant le flux de ce gaz;
· très faible consommation d'énergie.
| 


