I.8. Synthèse bibliographique des
propriétés de ZnO : I.8.1. Propriétés
cristallographiques :
I.8.1.1. Structure cristalline :
Les semi-conducteurs II-VI excepté CdO cristallisent soit
dans la structure sphalerite (CFC) soit dans la structure wurtzite
(hexagonale).
L'oxyde de zinc peut exister dans la nature sous forme de
poudre ou de cristal massif. Il se présente sous forme de minéral
[5]. Le tableau (II.1) illustre quelques propriétés
générales de ZnO.
Tableau I.1: Quelques
propriétés générales de ZnO.
Densité (g/cm3)
|
5.6
|
Point de fusion (°C)
|
1975
|
Enthalpie de formation (k cal/mole)
|
83.17
|
Solubilité dans H2O à 29°C (g/100ml)
|
0.00016
|
|
Du point de vue cristallographique le ZnO peut exister selon
les conditions d'élaboration, sous trois types de structures
différentes. La première est la structure hexagonale stable dans
les conditions normales, la seconde est la structure cubique, qui est instable
et qui apparaît sous des pressions élevées [14],
la troisième c'est la structure Rock -Salt qui apparaît
sous des pressions très élevées c'est pour ces raisons
qu'on va s'intéresser aux deux premières structures seulement,
car elles possèdent des énergies de formation très
voisines. Le tableau (II.2) illustre la différence entre ces deux
structures.
Tableau I.2:Comparaison entre les
propriétés des deux structures de ZnO.
|
Structure wurtzite
|
Structure cubique
|
Paramètre de réseau (A)
|
a=3.24
c=5.20
|
a= 4.28
|
Coordination (Z)
|
2
|
4
|
Densité (g/cm3)
|
5.6
|
6.9
|
Groupe spatial
|
P63mc
|
Fm3m
|
Condition d'apparition (kbar)
|
Pression atmosphérique
|
Haute pression p~100
|
|
ZnO cristallise selon la structure la plus stable;
c'est-à-dire la structure wurtzite; dans laquelle les ions
d'oxygène sont disposés suivant un réseau de type
hexagonal compact [15,16], et ou les atomes de zinc occupent la moitié
des positions interstitielles tétraédriques ayant le même
arrangement que les ions d'oxygène (figure I.9). En fait l'environnement
de chaque ion n'est pas une symétrie exactement
tétraédrique.
Le phénomène de la
piézoélectricité du ZnO apparaît lorsque la distance
entre les proches voisins dans la direction C est plus petite que pour les
autres voisins.
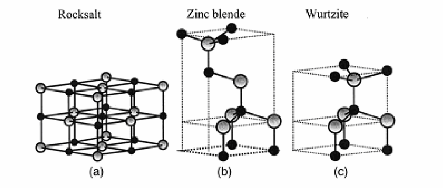
Figure .I.8 :
Représentation les structures de ZnO : (a) cubique
rocksalt, (b) cubique zinc
blendeet (c) hexagonal wurtzite.
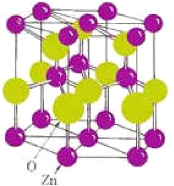
Figure I.9: La structure
cristallographique du ZnO (wurzite) [11].
Chaque atome de zinc est entouré par quatre atomes
d'oxygène situés aux sommets d'un tétraèdre. En
fait, l'atome de zinc n'est pas exactement au centre du tétraèdre
mais déplacé de 0,11 A dans une direction parallèle
à l'axe c. Les molécules d'oxyde maintiennent donc, dans une
certaine mesure, leur individualité, contrairement à ce que l'on
attendrait d'un cristal purement ionique. Ce phénomène est
dû à l'homopolaritédes liaisons Zn -O [19].
D'après les valeurs des rayons ioniques du cation et
de l'anion, indiquées dans le tableau II.3, on peut se rendre compte que
la structure est relativement ouverte. En effet, les atomes de zinc et
d'oxygène n'occupent que 40 % du volume du cristal [19], laissant des
espaces vides de rayon 0,95 A. Il est possible que, dans certaines conditions,
des atomes de zinc en excès puissent se loger dans ces espaces
c'est-à-dire en position interstitielle. Cette caractéristique
permet d'expliquer certaines propriétés particulières de
l'oxyde, liées aux phénomènes de semiconductivité,
de photoconductivité, de luminescence, ainsi que les
propriétés catalytiques et chimiques du solide [20].
Tableau I.3: Rayons atomiques et ioniques des
atomes de zinc et d'oxygène dans ZnO.
Liaison covalente
|
Zn neutre : 1,31 A
|
O neutre : 0,66 A
|
Liaison ionique
|
Zn2+ : 0,70 A
Zn2+ : 0,78
A
Zn2+ : 0,60 A
|
O2- : 1,32 A (Pauling) [21] O2- : 1,24 A
(Goldsmith) [22] O2- : 1,38 A (Shannon) [23]
|
|
On dit que la formule de coordinence est : L'empilement de la
structure wurtzite est AaBbA de plans Zn et O successivement. La maille
élémentaire est de type prismatique, constituée de:
· deux atomes de Zn occupant les sites :(0, 0, 0) et (1/3,
2/3, 1/2)
. deux atomes de O occupant les sites : (0, 0, 3/8) et (1/3,
2/3, 7/8)
L'oxyde de zinc appartient au groupe spatial P63mc [7,18] il
possède:
· un réseau primitif
· un axe hélicoïdal 63 d'ordre 6,
parallèle à l'axe [0001], constitué d'une rotation de
?1 autour de l'axe c plus une translation de
c.
3 2

? un miroir plan de type (0 1 1 0) perpendiculaire à
l'axe [0 1 1 0] et parallèle au plan formé
par les axes a et c.

·
et parallèle au plan (0 1 1 0) , qui est
un plan de glissement c perpendiculaire à l'axe [0 1 1
0]
.
1
la combinaison d'un miroir plan m et une translation de
c
2
D'autre part le ZnO appartient à la classe cristalline
6mm.
Vu la disposition alternée des atomes, la structure
wurtzite de ZnO présente une polarité cristallographique le long
de l'axe [0001].
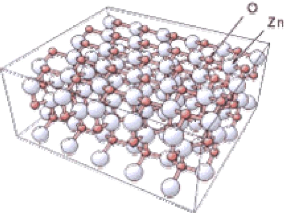
Figure I.10: Structure hexagonale
wurzite de ZnO l'axe c perpendiculaire à la surface
[19].
Tableau I.4: Récapitulatif
des caractéristiques de l'oxyde de zinc
|
Réseau
|
|
|
Hexagonal, wurtzite
|
|
Paramètre de maille
|
|
|
A= 3,2499 Å
c/a=1,6019
c=5,2060 Å
|
|
Distance entre O2- voisins
|
et
|
Zn+2, les plus proche
|
Suivant l'axe c d=1,96 Å
Pour les trois autres d=1,98 Å
|
|
Rayon cristallin
tétraédrique.
|
pour
|
une coordination
|
Zn+2=0,74 Å O2-=1,24 Å
|
La condition de stabilité de cette structure est
donnée par la relation suivante :
R
0 .225 ~ <
a
R c
0.4 1 4 (I.1)
Où Ra et Rc
représentent le rayon de l'anion et celui du cation respectivement.
L'origine de cette condition provient de la considération suivante:
> Pour une structure H.C, on a :
3 c 2
R a R c 8 c
+ = , ? 2 (I.2)
a 3
2 Ra -< a (I.3)
> Comme la structure HC dérive de la structure C.F.C.
de la blende, on a aussi : R a ? 0 .4 1 4 (I.4)
R c
| 


