Chapitre 2. Matériel et méthodes
2.1. Description de la zone d'étude
L'étude a été menée sur le campus
principal de l'Université de Yaoundé I (Fig. 4). Il est
situé en plein cSur de la ville de Yaoundé, au sommet de la
colline Ngoa-Ekelle au lieu dit plateau Atemengue, dans l'arrondissement de
Yaoundé III, dans le département du Mfoundi, avec pour
coordonnées géographiques 32 hémisphère Nord
à 777873 m du méridien central et à 426826 m de
l'équateur.
La superficie du campus occupée est d'environ 59 hectares,
y compris les terrains de sport (DIDP).
La couverture pédologique est formée de sols
ferrallitiques rajeunis avec érosion et remaniés, intimement
associés à des sols minéraux bruns et à des sols
peu évolués (Valerie, 1995).
La végétation est composée
essentiellement de graminées. Les formations herbacées
hydrophiles poussent dans les bas fonds marécageux. On note la
présence d'arbustes, d'arbres fruitiers, de plantes ornementales, et
d'espaces cultivables par endroits.
Le climat est équatorial de type guinéen avec en
moyenne 1500 à 1600 mm de pluie par an, réparties en quatre
saisons : une grande saison sèche de mi-novembre à mi-mars; une
petite saison des pluies de mi-mars à fin juin ; une petite saison
sèche de juillet à août et une grande saison des pluies de
septembre à mi-novembre. Les températures moyennes varient entre
18,9 et 27,9°C (Suchel et Tsalefack, 1995). L'hygrométrie moyenne
mensuelle est toujours supérieure à 70% (Omoko, 1984).
Le relief est accidenté avec une altitude moyenne de
750m, et un bas fond marécageux où se trouvent les étangs,
les bassins de piscicultures et où sont drainées les eaux de
ruissellement ainsi que les eaux usées provenant du campus (restaurant,
cité universitaire, laboratoires). On note par endroit des collections
d'eau stagnante, parfois très polluées et/ou riches en
matière organique; un manque de système de drainage des eaux et
un centre d'épuration des eaux usées non fonctionnel. Un ruisseau
permanent traverse le campus.

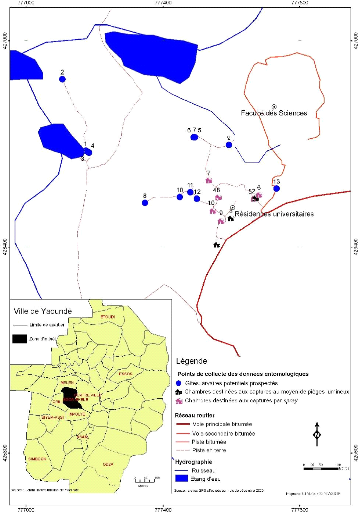
Figure 4 : Zone d'étude et localisation
des points de collecte des donn

2.2. Points de capture
L'étude s'est déroulée de mars 2005
à février 2006. Le choix des gîtes larvaires a
été fait après la première descente sur le terrain,
au cours de laquelle différents types de gîtes potentiels ont
été prospectés ; tous ceux qui ont été
positifs (présence de la larve de moustique) ont été
retenus. Ainsi, un suivi a été fait dans 13 gîtes tous les
trois mois. La capture des moustiques adultes a été faite dans 10
chambres de la Cité Universitaire, dont 4 destinées à la
capture au moyen des pièges lumineux et 6 pour la capture par
pulvérisation intra-domiciliaire d'insecticide. Toutes ces chambres ont
été choisies au hasard au rez-dechaussée dans 6
bâtiments de la Cité Universitaire avec le consentement des
occupants.
2.3. Mesure des paramètres climatologiques
(température, hygrométrie et pluviométrie) -
La température et l'hygrométrie : les
relevés hebdomadaires ont été effectués grâce
à un thermo-hygromètre enregistreur qui indique la
température et l'humidité ambiante et enregistre leurs valeurs
maximales et minimales, l'appareil est resté sur le site en permanence
pendant toute la durée de l'étude.
- La pluviométrie : les hauteurs des
précipitations ont été relevées grâce
à un pluviomètre à lecture directe gradué en
millimètres. Les relevés ont été faits
journalièrement.
2.4. Collecte des données
entomologiques
L'échantillonnage des moustiques a été fait
aux stades pré-imaginaux et adulte.
2.4.1. Récolte des stades
pré-imaginaux
Les larves et/ou les nymphes ont été
collectées à quatre reprises pendant les mois de mars, juin,
septembre et décembre dans treize gîtes numérotés.
La position de chaque gîte a été relevée dans la
projection UTM et le système géodésique WGS84, grâce
à un appareil GPS portatif.
La méthode de collecte utilisée est celle du
«dipping» ou trempage (Service, 1993). Elle consiste à
prélever l'eau du gîte à l'aide d'une louche ou d'un petit
bac, puis y observer la présence des larves de moustiques. Elles sont
alors prélevées à l'aide d'une pipette et
transférées dans un récipient portant le numéro du
gîte et contenant l'eau du gîte. Ensuite, les larves sont
transportées à l'insectarium de l'OCEAC et mises en
élevage avant identification.

2.4.2. Capture des moustiques adultes
Deux méthodes de capture ont été
utilisées: la capture au moyen de pièges lumineux du type CDC
avec un volontaire dormant sous moustiquaire non imprégnée et la
capture par pulvérisation intra domiciliaire d'insecticide commercial au
pyrèthre.
2.4.2.1. La capture au moyen de pièges lumineux
type CDC
La capture a été effectuée de mars
à décembre 2005 dans quatre chambres de la cité
universitaire, à raison d'une nuit de collecte par mois. Le piège
lumineux CDC pourvu d'une lampe à incandescence et d'un moteur est
installé à environ 1,5 m du sol, auprès d'un lit couvert
d'une moustiquaire non imprégnée d'insecticide (Fig. 5). Le
volontaire dort sous la moustiquaire, à l'endroit habituel de son lieu
de repos. Les moustiques qui entrent dans la chambre pour le piquer sont
attirés par la lumière du piège (les autres
lumières de la chambre étant éteintes) ; le moteur, en
faisant tourner une petite hélice, aspirera les insectes attirés
pour les refouler dans une cage en tulle. Ils seront collectés le
lendemain et transportés au laboratoire pour identification.
2.4.2.2. La capture par pulvérisation
intra-domiciliaire d'insecticide
La capture a été effectuée dans six
autres chambres de la cité universitaire, à raison d'une
matinée par mois pendant la même période. Pour ce faire,
toutes les ouvertures sont fermées pour éviter que les moustiques
ne s'échappent, puis des draps blancs sont étalés au sol.
Après pulvérisation des bombes insecticides du commerce
(Wanfu®), on laisse s'écouler environ dix minutes ;
puis, à l'aide des pinces fines, les moustiques tombés sur les
draps sont prélevés et mis dans les boîtes de pétri
(référencées) (Fig. 6) et transportés au
laboratoire pour identification. Cette méthode nous permet de
récupérer tous les moustiques dans une pièce bien
fermée et d'évaluer la composition de la faune endophile.


Figure 5 : Piège lumineux type CDC
Figure 6 : Récolte des moustiques après
pulvérisation intra-domiciliaire d'insecticide
|
Aiguille
Moustique Minutie
Paillette
|
Figure 7 : Moustique monté sur minutie

2.5. Elevage et montage des moustiques
Les larves récoltées ont été
séparées en sous familles (Culicinae, Anophelinae). Les
larves de Culex tigripes ont rapidement été
isolées des autres Culicinae à cause de leur action
prédatrice. Ensuite, ces larves ont été mises dans des
bacs couverts de tulle moustiquaire, contenant l'eau de source et portant
chacun une étiquette. Sur chaque étiquette, nous avons
indiqué la sous famille et le numéro du gîte. Nous passions
tous les matins les nourrir avec de la farine pour alevins (Tétra
Min® Baby), et trier les nymphes qui étaient
transférées dans des boîtes en verre puis placés
dans une cage couverte de tulle moustiquaire, en vue de l'émergence des
adultes. Ceux-ci étaient nourris avec une solution de sucre à
10%.
A l'émergence, les moustiques adultes sont tués
et montés sur minutie pour identification morphologique. Sur un
moustique couché dorso-ventralement, on insère une minutie
montée sur paillette au centre du thorax entre les deux pattes
médianes. Puis, cette paillette est épinglée par une
grosse aiguille sur laquelle on insère d'autres paillettes. Sur ces
paillettes, on inscrit les informations se rapportant au moustique. Le
moustique ainsi monté est identifié,
référencé (Fig. 7), et conservé dans une
boîte de collection.
2.6. Identification des spécimens
Nous avons utilisé les techniques morphologiques
classiques et les tests moléculaires pour les anophèles.
2.6.1. Identification morphologique
Les adultes issus de l'élevage et des captures ont
été examinés sous la loupe binoculaire et
identifiés à l'aide des clés d'identification
morphologiques établies par Gillies et De Meillon (1968) et Gillies et
Coetzee (1987) pour les anophèles, Edwards (1941), Jupp (1996) et par
référence aux collections de l'OCEAC pour les Culicinae.
Le tableau 1 présente les caractères morphologiques distinctifs
de quelques moustiques adultes. Chaque anophèle identifié est
placé individuellement dans un tube eppendorf de 1,5 ml contenant du
silicagel (dessiccateur), puis il lui est attribué un numéro. Les
anophèles ainsi collectés sont conservés à -
20°C. Ils seront utilisés pour les techniques de biologie
moléculaire et de biochimie au laboratoire.

Tableau 1 : Caractères morphologiques
distinctifs des espèces identifiées (Gillies et De Meillon, 1968;
Gillies et Coetzee, 1987; Jupp, 1996)
|
Espèces
|
Caractères distinctifs
|
|
An. gambiae s.l
|
Palpe à trois bandes pâles; cinq taches pâles
au niveau de la costa, dont deux basales; base de la première nervure
pâle; pattes tachetées.
|
|
Ae. albopictus
|
Scutum avec une large ligne médiane argentée qui
part de la marge antérieure jusqu'à la zone
préscutellaire; scutum sans tache pâle à l'angle.
|
|
Cx. quinquefasciatus
|
Apex du proboscis souvent pâle; sternites blancs non
bandés; tergites à bande basale pâle.
|
|
Cx. duttoni
|
Trompe avec un anneau pâle bien défini au milieu;
soie mésépimérale inférieure présente ;
tarses à anneaux pâles, tibia moyen avec une bande pâle
antérieure.
|
|
Cx. tigripes
|
Moustique de grande taille; fémurs et tibias,
excepté le fémur postérieur, portent en avant une
rangée d'environ 10 petites taches pâles sur fond sombre.
|
|
Cx. chorleyi
|
Proboscis entièrement sombre; tergite avec une mince bande
basale pâle incomplète sur certains segments.
|
|
Cx. decens
|
Ecailles scutales uniformément brun rougeâtre, palpe
entièrement sombre chez le mâle ; tergite avec une large bande
basale.
|
|
Cx. guiarti
|
Tergite sans bande basale ; abdomen avec taches pâles
baso-latérales ; flagellum 3 et 4 plus courts que les autres.
|
|
Cx. univittatus
|
Fémur moyen avec une ligne pâle longitudinale ;
fémur moyen avec une dorsale noire s'étendant jusqu' à
l'extrémité basale du fémur; tergite avec une large bande
basale confluente et une tache baso-latérale.
|
|
Cx. poicilipes
|
Trompe avec un anneau pâle bien défini au milieu;
pas de soie mésépimérale inférieure ; fémurs
et tibias avec des rangées de petites taches antérieures ; tarses
à anneaux pâles aux articulations.
|
|
Ma. africana
|
Ecailles pâles du thorax formant des taches ; face
antérieure des tibias portant des taches blanches bien
séparées les unes des autres.
|
|
Ma. uniformis
|
Ecailles pâles du thorax formant deux bandes
longitudinales; taches pâles des faces antérieures des tibias plus
ou moins confluentes.
|

2.6.2. Identification moléculaire des
anophèles du complexe An. gambiae
Les espèces et les formes moléculaires ont
été identifiées par la technique de PCR-RFLP
(Restriction Fragment Length Polymorphism); celle-ci permet de
déterminer simultanément les espèces du complexe An.
gambiae ainsi que les formes moléculaires M et S lorsqu'il s'agit
d~An. gambiae s.s. sur la base d'un polymorphisme de séquence
observé sur l'ADN
ribosomal (Fanello et al., 2002). Cette
méthode résulte de la combinaison des protocoles établis
par Scott et al. (1993) et Favia et al. (1997). Cette
technique d'identification par la biologie moléculaire comporte
plusieurs étapes: la préparation du matériel biologique,
l'amplification de l'ADN par PCR, la digestion enzymatique,
l'électrophorèse et la révélation des bandes.
2.6.2.1. Préparation du matériel
biologique
Le moustique est sorti de son tube de conservation et
déposé sur une feuille de papier. Les pattes (2 pattes) sont
coupées à l'aide des pinces fines et introduites dans un
microtube portant le numéro du moustique. Le reste du moustique est
remis dans le tube de conservation pour d'autres fins (ELISA CSP si le
moustique a été capturé au stade adulte par exemple). Les
pinces sont ensuite nettoyées avec du papier essuie tout, puis la
dissection du moustique suivant nécessite une nouvelle feuille de papier
pour éviter une éventuelle contamination. En effet, un tout petit
fragment de patte peut donner l'ADN suffisant pour être à
l'origine d'une contamination.
Les ailes ou un petit fragment de l'abdomen peuvent
également être utilisés comme matériel de
départ.
| 


