ANNEXES
Protocole
Expérimentale :
Broyage
Séchage « l'étuve 50-60
°C »
Matière Végétale
« Tomates et pelures»
Extraction
Pesée
Analyses Physico-chimiques
Extraction des polyphénols à partir des fruits et
pelures
Dosage de Lycopène
Extraits Phénoliques
Dosage des polyphénols totaux
Dosage des Flavonoides
Dosage des Antocyanes
Evaluation du pouvoir
Anti -oxydant
Annexes 1 :
Les courbes d'étalonnages :
Préparation d'acide Gallique :
2mg d'Acide Gallique + 1ml éthanol
C = (cxv)/m
C : Teneur en (mg d'acide gallique / g de matière
sèche)
c : Concentration d'acide Gallique établie
à partir de la courbe d'étalonnage (mg/ml)
v : Volume de l'extrait méthanolique
m : Poids de la matière sèche(g).
On dilue la solution standardisé d'acide Gallique de
manière à avoir les Concentrations suivante :
2/1/0.5/0.25/0.12/0.06/0.03/0.01 mg/ml
On dilue 0.5ml de chacune de ces solutions dans 5ml d'ED.
Puis on ajoute 0.5ml de Réactif de Folin et on laisse
reposer 3mn.
On ajoute ensuite 0.5ml de la solution saturée de
Na2CO3 à 10%
La couleur bleu commence à apparaître.
Après 1 heure du Temps on mesure la DO des ces solutions avec un
spectrophotomètre UV à 750nm.
|
DO
|
0,158
|
0,33
|
0,452
|
0,622
|
0,85
|
1,0353
|
1,2
|
|
Concentration mg/ml
|
0,0156
|
0,0187
|
0,0312
|
0,0375
|
0,0625
|
0,1
|
0,125
|
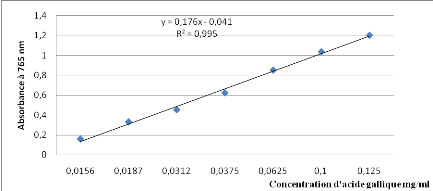
Fig. Courbe d'étalonnage des
polyphénols totaux
Courbe d'étalonnage des
Catéchines
|
Concentration mg/ml
|
4,637
|
9,274
|
13,911
|
18,548
|
23,185
|
27,822
|
32,459
|
37,096
|
|
Absorbance nm
|
0,09
|
0,186
|
0,264
|
0,408
|
0,493
|
0,632
|
0,738
|
0,933
|
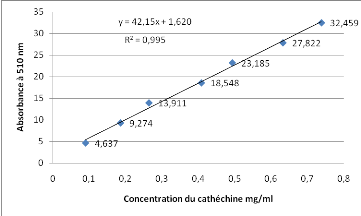
Fig. Courbe d'étalonnage des
Flavonoïdes
Courbe d'étalonnage des sucres
totaux
|
Absorbance nm
|
0
|
0,002
|
0,004
|
0,006
|
0,008
|
0,01
|
|
Concentration mg/ml
|
0
|
0,076
|
0,138
|
0,209
|
0,301
|
0,41
|
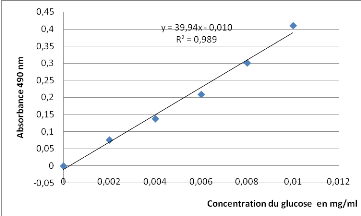
Fig. Courbe d'étalonnage des sucres
totaux
Courbe d'étalonnage du
lycopène
|
Concentrations mg/ml
|
0
|
0,0021
|
0,005
|
0,007
|
0,009
|
|
DO
|
0
|
0,556
|
1,349
|
1,998
|
2,5
|
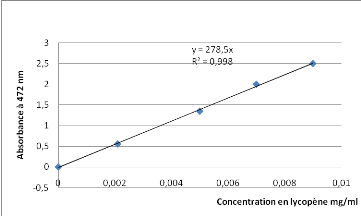
Fig. Courbe d'étalonnage du
lycopène
Courbe du pouvoir réducteur d'acide
ascorbique
|
Concentrations mg/ml
|
0,01562
|
0,03125
|
0,06125
|
0,125
|
0,25
|
0,5
|
|
DO
|
0,409
|
0,865
|
1,456
|
2,113
|
2,575
|
2,889
|
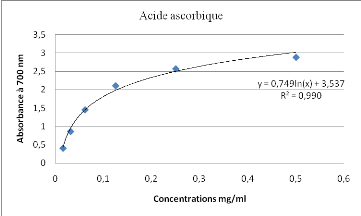
Fig. Pouvoir réducteur d'acide
ascorbique
Préparation des Solutions :
Préparation du Folin Ciocalteu :
Selon Djeridane et al, (2006), la solution du
Folin- Ciocalteu doit être diluée à 1/10.
Donc, on place 1 ml du réactif concentré dans
une fiole et on complète jusqu'à 10 ml avec l'eau
distillée.
Préparation d'une solution de 250ml de
NaOH 0.1 :
1. Calcul de la masse NaOH pour préparer 250 ml de
0.1N
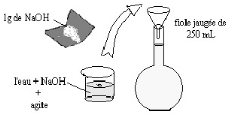
n = (mNaOH / M NaOH) x Z (eq)
/ V (l)
donc :
mNaOH = n x M NaOH x V (l)
/ Z (eq)
2. La masse Molaire :
M = 23+16+1= 40 g/mole
Z = 1
Alors :
m NaOH = 0.1 x 40 x 0.25/1 = 1 g
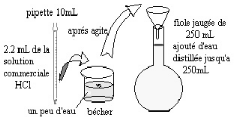
Préparation d'une solution de 0.1N HCl
de 250 ml
1. On calcul la concentration de la solution commerciale (
solution mère) du HCl :
La masse volumique de la solution mère est
donnée par la relation :
d= umère / ueau
umère = d x ueau = 1.18 x 1000 =
1180g/l
un litre de solution mère a une masse de 1180 g.comme
le pourcentage massique en acide HCl est de 35% , on peut dire que :
1L de solution mère contient m = 1180 x ( 35 x 100) =
413 g d'HCl
2. La masse molaire d'HCl :
M (HCl) = 1+3505 = 36.5 g/mole
1L de solution mère contient n = m/M = 413 /63 = 11.31
mole d'acide
La concentration molaire volumique de la solution mère
est donc :
C mère = n/v = 11.31 /1 = 11.31 mole/l
3. Préparation d'une solution diluée
(fille) :
nfille = n mère /
Cfille x V fille = Cmère x V
mère ? 0.1 x 0.25 =11.31 x V mère
prélevé
donc : V mère prélevé =
0.0022 l = 2.2ml prélevé de la solution mère d'HCl pour
préparer une solution de 0.1N de 250 ml
Préparation d'une solution tampon de
phosphate (0.1 M)
Solution A: 0.1M
Na2HPO4 · 2H2O 35.61
g
ou Na2HPO4 · 7H2O 53.65
g
ou Na2HPO4 · 12H2O 71.64
g
et on ajoute H2O pour 1 L de solution
Solution B: 0.1 M
NaH2PO4 · H2O 27.6 g
ou NaH2PO4 · 2H2O
31.21
et on ajoute H2O pour 1 L de solution
Préparer en mélangeant deux solutions comme est
indiqué dans ce tableau et diluer à 100 ml avec H2O
distillée
|
pH à 25 °C
|
Solution A
|
Solution B
|
|
6.4
|
13.25
|
36.75
|
|
6.6
|
18.75
|
31.25
|
|
6.8
|
24.5
|
25.5
|
|
7.0
|
30.5
|
19.5
|
|
7.2
|
36.0
|
14.0
|
|
7.4
|
40.5
|
9.5
|
|
7.6
|
43.5
|
6.5
|
|
7.8
|
43.75
|
4.25
|
|
8.0
|
47.35
|
2.65
|
| 


