Chapitre II. Pathologies du tractus génital de la
brebis
1. Pathologies du vagin 1.1. Vaginites
Les vaginites simples sont dues à l'action de germes
saprophytes (streptocoques, colibacilles...). Elles résultent d'une
manipulation non hygiénique lors de l'accouchement, d'examens vaginaux,
de saillies ou d'inséminations artificielles. Les symptômes sont
souvent locaux. L'exploration vaginale est douloureuse. La muqueuse est
congestionnée et peut présenter, dans les cas les plus anciens,
des granulations translucides correspondant à des amas lymphocytaires
(Hanzen, 2016).
1.2. Kystes des conduits de Gartner
Les kystes des conduits de Gartner (vestiges des conduits
mésonéphrotiques) doivent être distingués des kystes
des glandes de Bartholin (glandes vestibulaires). Les premiers sont
localisés sur le plancher vaginal, les seconds dans le vestibule
vulvaire (Hanzen, 2016).
1.3. Prolapsus vaginal
Le prolapsus vaginal se rencontre chez diverses espèces
animales. Il est particulièrement connu chez la vache et la brebis. Il
se manifeste dans la deuxième moitié de la gestation et surtout
dans les semaines et jours qui précèdent le part.
9
Chez la brebis, le prolapsus vaginal survient au
moment du part. Il est fréquemment conditionné par la non
dilatation du col. Les efforts expulsifs sont incessants et ils finissent par
libérer le vagin de ses attaches pelviennes. Dans cette espèce,
l'accident est aussi fréquemment associé à certaines
maladies de gestation telle la paraplégie ante-partum et la
toxémie de gestation sans que soit connue la cause précise de
cette relation (Dérivaux et Ectors, 1980).
1.4. Vaginisme
Le vaginisme désigne un état morbide
caractérisé par une hyperesthésie souvent douloureuse de
la vulve et du vagin. Elle entraîne une contracture réflexe et
spasmodique du sphincter vulvaire gênant et empêchant la saillie.
Elle résulte d'une pathologie vaginale ou peut parfois être
d'origine idiopathique (Hanzen, 2016).
1.5. Pneumo et Urovagin
Le pneumovagin est une accumulation d'air dans le vagin
résultant d'une déformation acquise de la vulve et du vagin due
au relâchement des muscles et des ligaments. La vulve et le vagin se
trouvent ainsi inclinés vers la cavité pelvienne et prennent une
position de plus en plus horizontale. De plus, Le manque de tonicité des
lèvres vulvaires primaire ou secondaire à des lésions
résultant d'un accouchement dystocique entraîne leur manque de
coaptation et l'entrée d'air dans le vagin.
L'urovagin suit généralement le pneumovagin car
le vagin devient distendu et prend de plus en plus une orientation oblique de
l'arrière vers l'avant et plonge dans la cavité abdominale. Il en
résulte une accumulation d'urine dans la portion antérieure du
vagin (Hanzen, 2016).
2. Pathologies de l'ovaire
2.1. Anomalies de développement 2.1.1.
Agénésie ovarienne
L'agénésie de l'un ou des deux ovaires n'est
observée que très rarement chez les mammifères domestiques
et les ruminants. Des cas d'anomalies du développement rénal
peuvent accompagner l'agénésie latérale ou
bilatérale de l'ovaire (Donald, 1994).
Lors de l'agénésie bilatérale, les
organes génitaux sont complètement absents. Dans les cas ou ils
sont présents, ils sont alors très réduits dus à un
développement incomplet. Cette anomalie de développement est
très souvent d'origine génétique liée à un
gène récessif en rapport avec le sexe femelle (Arthur
et al., 1992).
2.1.2. Hypoplasie ovarienne
L'hypoplasie a été définie comme
étant « un développement ovarien incomplet où
l'ovaire affecté ou une partie de l'ovaire seulement ne porte aucun
follicule » (Lagerlöf et Boyd, 1953). L'hypoplasie
est habituellement bilatérale, mais elle varie considérablement
dans sa symétrie et sa sévérité selon
l'espèce et l'individu. Cette dernière est très souvent
accompagnée de l'infantilisme, ce qui justifie la taille réduite
de l'ensemble du tractus génital.
10
2.2. Anomalies fonctionnelles 2.2.1. Kyste para
ovarien
Parfois confondus avec de vrais kystes ovariens, le terme de
kyste para ovarien est utilisé vaguement comme référence
à une variété de structures kystiques localisées au
voisinage de l'ovaire. De tels kystes peuvent provenir des reliquats des
conduits mésonéphrotiques ou paramésonéphrotiques.
Les kystes para ovariens sont de taille et de forme variable, sphérique
ou ovale. Leur diamètre peut atteindre ou dépasser 10cm dans
certains cas (Jubb et Palmer, 1993).
2.2.2. Kyste ovarien
Le kyste ovarien est depuis longtemps reconnu comme une cause
majeure d'infertilité chez les ruminants. On le désigne sous
différentes appellations : dégénérescence kystique
ovarienne, follicule kystique ou kyste folliculaire. Divers facteurs sont
impliqués dans l'apparition des kystes : l'âge, la saison, la
production laitière, la génétique et d'autres plus
spécifique comme la nutrition, le postpartum, les infections
utérines ou le stress. Elles sont dues à des perturbations du
cycle ovarien ou à un dysfonctionnement de l'axe
hypothalamo-hypophyso-ovarien (Smith, 2002).
2.2.3. Oophorite
L'oophorite ou inflammation de l'ovaire est plutôt rare.
Elle fait le plus souvent suite à une métrite. Plus rarement, la
contamination à A. pyogenes est d'origine
hématogène (Hanzen, 2016).
3. Pathologies de l'utérus
3.1. Anomalies congénitales
3.1.1. Atrésie, aplasie et hypoplasie
utérines
Il s'agit d'un défaut de développement de
l'utérus. Cette anomalie, bien qu'assez courante chez les bovins, est au
contraire très rare chez l'espèce ovine. L'atrésie
représente environ 20% des pathologies dépistées chez les
agnelles (Smith, 1998).
L'aplasie totale est extrêmement rare à
l'exception de certains cas de free martinisme et d'hermaphrodisme. La plupart
des cas recensés, présentent l'aplasie d'un segment au niveau
d'une seule corne ou bien plus rarement, les deux cornes en même temps
(Einarsson et Gustafsson, 1970).
3.1.2. Utérus unicorne ou mono-corne
Cette pathologie se traduit par l'absence congénitale
d'une corne de l'utérus. Souvent, une petite portion cornuelle est tout
de même présente. Bien que cette anomalie provoque une
réduction de la fertilité chez la femelle, elle n'empêche
tout de même pas la gestation chez la vache et la brebis (Mc
Entee, 1990).
Cette malformation congénitale est observée
particulièrement chez l'espèce ovine. Gustafsson et
Holmberg (1966) ont rapporté un cas d'utérus unicorne
sur 502 utérus de brebis étudiés.
11
3.1.3. Utérus didelphe
Anomalie congénitale d'origine génétique
qui survient suite à la fusion incomplète de la partie
postérieure des canaux de Müller au cours du développement
foetale. Cette pathologie rare se manifeste par l'apparition d'un double vagin
et d'un double col et chacun s'ouvre séparément de leur
coté dans une corne utérine, « utérus didelphe »
(Mc Entee, 1990 ; Buergelt, 1997).
4. Anomalies des trompes utérines 4.1.
Hydrosalpinx
L'hydrosalpinx se défini par la présence de
liquide séreux clair, enkysté dans la trompe utérine,
laquelle apparait très distendue et dilatée. L'hydrosalpinx est
souvent bilatéral. Il peut occuper la totalité de la surface de
l'organe comme il peut se restreindre à une seule région bien
délimitée. La paroi de la trompe apparait fine et transparente.
Cette lésion peut apparaitre suite à une salpingite chronique,
une malformation tubaire et divers troubles endocriniens ou autres facteurs
encore mal connus (François, 2008 ; Palmieri et al.,
2011).
4.2. Pyosalpinx
La lésion du pyosalpinx est moins commune que
l'hydrosalpinx. Elle se présente sous forme d'une accumulation de pus
assez importante dans l'oviducte, ce qui conduit à l'obstruction de la
lumière de ce dernier. Cette affection peut être
accompagnée par des adhérences entre le mésosalpinx et la
paroi externe de l'oviducte (Jubb, 1985).
4.3. Salpingite
La salpingite est l'inflammation des cornes utérines.
Généralement bilatérale, elle peut être aigue ou
chronique, spécifique ou bien non spécifique
(François, 2008 ; Palmieri et al., 2011). Le
plus souvent, elle fait suite à une complication infectieuse du post
partum, tout particulièrement l'endométrite. Les
pathogènes associés à la salpingite chez les animaux
d'élevage sont : Ureaplasma spp., Mycoplasma spp., Campylobacter
spp., Tritrichomonas spp., et quelques autres bactéries
(Buergelt, 1997). La salpingite n'apparait pas aussi
fréquemment chez la brebis comme chez la vache (Emady et
al., 1975).
5. Infections du corps de l'utérus
La métrite est l'inflammation de l'une des tuniques de
l'utérus. L'endométrite est l'inflammation de l'endomètre.
Quant au pyromètre, c'est l'accumulation de pus dans la cavité
utérine.
La plupart des infections utérines démarrent au
niveau de l'endomètre et sont associées à l'accouplement,
la gestation, l'involution utérine en période du postpartum, mais
également aux avortements (Arthur et Noakes, 1992 ; Mc Entee,
1990 ; Kiran et Erer, 1995).
5.1. Endométrite
L'endométrite représente la lésion la
plus fréquente au niveau de l'utérus des brebis. Elle se
présente soit sous forme aigue (métrite) soit sous forme
chronique (séro-hémorragique ou suppurée).
L'endométrite aigue succède
généralement aux inflammations cervico-vaginales, comme elle peut
aussi être secondaire à un avortement ou une mise-bas
(Arthur et Noakes, 1992 ; Mc Entee, 1990 ; Kiran et Erer,
1995).
12
5.2. Pyomètre
Le pyomètre est défini comme une accumulation de
pus dans la cavité utérine. Des écoulements vaginaux
purulents intermittents peuvent êtres observés (Arthur,
1975).
Cette infection se produit soit suite à l'accouplement
ou bien après la période de parturition. La plus part des cas de
pyomètre post coitum enregistrés en élevage sont dus
à Tritrichomonas fetus, tandis que le pyomètre du post
partum est généralement causé par Actinomyces pyogenes
(Corynebacterium pyogenes) (Olson et al., 1984 ; Mc
Entee, 1990).
5.3. Pathologies de la gestation en relation avec la mort
foetale
La mort foetale peut survenir durant différents stades
de la gestation. Elle est dans la plupart du temps suivie d'une expulsion du
foetus non viable. Cependant dans certains cas, le foetus n'est pas
expulsé en dehors de la cavité utérine, ce qui conduit
à l'apparition de pathologies telles que la momification ou la
macération. Il peut se produire également une transformation
emphysémateuse du foetus.
La momification consiste en la transformation aseptique du
foetus. Les liquides allantoïdiens et amniotiques se résorbent. Le
placenta se désengrène et s'accole au foetus. Les muscles se
rétractent et on observe une lyse de la peau ainsi que la transformation
du foetus en une masse brunâtre et gluante. Cette affection
présente des étiologies multiples et encore peu
étudiées (Hanzen, 2004).
La macération est quant à elle plus rare
comparée à la momification. Elle est surtout observée chez
l'espèce bovine. Elle est définie comme une digestion
bactérienne du foetus et se caractérise pas l'imprégnation
liquidienne lente des tissus ce qui conduit à leur ramollissement et
dissolution (Jubb, 1985).
Totalement différent des deux affections
précédentes, l'emphysème foetal est quant à lui
définit comme étant une décomposition gazeuse du foetus,
il se caractérise par un oedème sous-cutané
généralisé et la boursouflure du foetus.
6. Anomalies du col de l'utérus
6.1. Cervicite
Cette affection se présente sous forme d'une
inflammation infectieuse ou non du col de l'utérus. Elle peut être
aigue ou bien chronique. Dans la plupart des cas, elle fait suite aux
manipulations obstétricales lors de dystocies faites dans le non respect
des mesures d'hygiène. La cervicite peut se compliquer en
évoluant de façon ascendante pour provoquer des métrites
plus au moins graves (Hanzen, 2009).
Matériel et méthodes
13
MATERIEL & METHODES
1. Objectifs de l'étude
Cette étude porte sur le diagnostic en post mortem des
pathologies de l'appareil génital chez la brebis. L'échantillon
des matrices analysées a été collecté au niveau de
l'abattoir des Eucalyptus, dans la wilaya d'Alger, durant une période de
3 mois, allant du 1er avril au 30 juin 2021. Outre le diagnostic des
pathologies, ce travail a également pour objectif le dénombrement
et l'estimation de la fréquence des différentes affections. Ces
dernières ont un impact direct sur le rendement des élevages en
Algérie et induisent d'importantes pertes économiques chaque
année.
En effet, ces pertes sont la conséquence de la
réduction du rendement laitier et viandeux. Ce dernier est lié
à l'allongement de l'intervalle vêlage-vêlage, à la
reforme prématurée des femelles, à l'abattage des femelles
gestantes du à un mauvais diagnostic de gestation voire carrément
l'absence de l'examen de gestation en ante mortem dans certains abattoirs.
Néanmoins, il y a lieu de souligner qu'au niveau de
l'abattoir des Eucalyptus, la majorité des cas de gestation
rencontrés étaient en début de conception (moins de 2
mois) et nous pouvons considérer que ces animaux n'ont pu être
diagnostiqués comme étant gestants en raison de la taille
réduite du foetus. Ceci témoigne du sérieux des
vétérinaires inspecteurs de cet abattoir dans leur travail et de
leur compétence.
En prenant en compte toutes ces conditions, nous visons à
travers notre enquête à :
· Déterminer les types d'anomalies existantes au
niveau des appareils génitaux des brebis, ainsi que leur
fréquence.
· Recenser les cas de brebis réformées en
étant gestantes.
· Effectuer une étude microscopique et
macroscopique de nos échantillons, et mettre en évidence les
caractéristiques microscopiques des diverses lésions
retrouvées au niveau de l'utérus et de l'ovaire.
2. Matériel
· Matrices de brebis collectées au niveau de
l'abattoir des Eucalyptus,
· Pieds à coulis et mètre ruban : pour la
mesure des mensurations anatomiques des matrices,
· Gants chirurgicaux : pour éviter toute
contamination lors des manipulations,
· Une glacière : pour la conservation des
matrices en bon état lors du transport de l'abattoir vers le
laboratoire,
· La planche : pour s'en servir comme plan de travail
pour le découpage des différents fragments dont nous avons
besoin,
· La lame de bistouri : elle sert à inciser
minutieusement les anneaux cervicaux, ovaires, et cornes utérines pour
l'obtention de nos fragments d'échantillons,
· Les boites : pour conserver nos échantillons
à l'abri de l'air,
· Du formol : qui est un liquide de conservation,
· Des blouses,
· La paraffine : milieu d'inclusion de
l'échantillon,
· Lames et lamelles,
· Automate à déshydratation,
·
14
Automate à inclusion : pour baigner le
prélèvement dans de la paraffine,
· Barres de Leuckart : petits moules en métal pour
la mise en bloc de la paraffine,
· Un Microtome : pour la confection des coupes
histologiques,
· Un Microscope : pour l'observation après
coloration,
· Les colorants : hématoxyline, éosine,
hématéine,
· Alcools, toluène, eau distillée.
3. Méthodes
3.1. Population et lieu d'étude
Le choix de l'abattoir des Eucalyptus comme source pour nos
prélèvements, a été motivé d'une part, par
le grand nombre d'animaux abattus de manière journalière à
son niveau, notamment les brebis, qui sont la population ciblée par
notre étude, et d'autre part, par le nombre important de fonctionnaires
et professionnels du domaine travaillant au sein de cet établissement,
qui nous ont été d'une très grande aide dans nos
recherches. Il faut noter également la proximité de cet abattoir
par rapport à l'université des sciences et technologies de Bab
Ezzouar (USTHB), ainsi qu'à l'école nationale supérieure
vétérinaire (ENSV) au sein de laquelle se trouve le laboratoire
d'histologie et anatomopathologie ou nous avons effectué notre
pratique.
L'origine des cheptels d'où proviennent les femelles
admises à l'abattoir pour divers motifs d'abattage était
inconnue. C'est pour cela que nous n'avons pas pu recueillir les
antécédents, commémoratifs et autres informations
nécessaires à leur identification.
3.2. Examen macroscopique
Pour l'examen macroscopique en post mortem, nous avons
procéder de manière systématique en commençant par
une inspection visuelle des matrices complètes, suivie d'une palpation
des différentes parties de l'appareil génital en allant du col
utérin (cervix) et remontant progressivement vers le corps, les cornes,
les oviductes et enfin les ovaires.
Étant donné la manière dont les matrices
ont étés sectionnées au niveau du vagin par le personnel
de l'abattoir, nous étions obligés de nous en tenir qu'au
traitement des anomalies du tractus génital « interne » dans
notre étude. Les tractus génitaux incomplets ont eux
étés recalés.
Une fois gantés, et à l'aide d'un bistouri, nous
avons commencé par effectuer une importante incision longitudinale en
partant du vagin pour pouvoir examiner l'intérieur du cervix, du corps
et enfin des cornes utérines. La muqueuse de l'utérus ainsi que
les trompes sont alors examinées avec une grande attention. Les divers
anomalies qu'on a pu rencontrer ont toutes étaient notées dans un
registre, et des photos ont également été prises à
l'aide d'un Smartphone.
a. Examen des utéri
L'examen macroscopique des utéri a consisté en
une inspection et palpation, puis incision franche des corps, des cornes et
cols utérins.
L'examen de ces divers segments utérins est
effectué dans le but de détecter des anomalies telles que :
l'endométrite, le pyromètre, la salpingite, l'utérus
unicorne, l'utérus didelphe, l'atrophie de l'endomètre,
l'hyperplasie, l'hydromètre, la métrite, ainsi que certains cas
rares de tumeurs etc.
15
Après l'examen macroscopique externe, vient l'examen
interne des utéri. On procède à la dissection de
l'appareil génital en utilisant un ciseau, on commence à
découper graduellement à partir du vagin jusqu'au cornes
utérines. Une fois l'intérieur du tractus génital visible,
nous procédons à l'examen soigneux de la muqueuse utérine
et on prend note de toute lésion inflammatoire visible comme
l'oedème, la congestion ou bien la présence de foyers
hémorragiques. Il est tout aussi important de rechercher la
présence d'exsudats et infiltrats inflammatoires et identifier leur
nature (séreuse, muqueuse, séro-muqueux, fibrineuse, purulente,
ou bien hémorragique).
b. Examen des oviductes
Pour ce segment du tractus génital, nous nous sommes
tenues à effectuer uniquement une inspection et palpation étant
donné la taille très réduite des oviductes, leur
consistance très fine et leur diamètre assez réduit.
L'oviducte tiens un rôle très important dans la
fonction de reproduction. C'est pourquoi nous avons prêté une
attention particulière à la forme de l'oviducte et à la
coaptation de l'infundibulum à l'ovaire. L'examen à ce niveau
consiste en la recherche de signes d'adhérences, d'éventuels
foyers obstructions, toute modification de l'aspect, du volume, de la taille,
ainsi que la nature du contenu renfermé à l'intérieur des
oviductes si présent.
Le but de cet examen était de détecter
éventuellement certaines lésions communes au niveau de l'oviducte
telles que : l'hydrosalpinx, le pyosalpinx, la salpingite, l'aplasie des
oviductes, l'obstruction/occlusion, les oviductes accessoires, et plus rarement
les tumeurs de l'oviducte.
c. Examen des ovaires
L'examen des ovaires par inspection et palpation est
automatiquement suivi d'une incision longitudinale à l'aide d'un
bistouri. L'incision permet d'extérioriser le contenu de l'ovaire et
éventuellement les follicules kystiques ou les corps jaune. Elle permet
également d'apprécier la taille des follicules ovariens,
d'identifier approximativement le stade de développement et
d'apprécier le niveau d'adhérence des structures ovariennes au
parenchyme ovigère.
Les anomalies les plus recherchées au niveau de
l'ovaire sont : l'hypoplasie et l'aplasie ovarienne, les kystes ovariens et
para ovariens, les ovarites, mais aussi les tumeurs ovariennes.
3.3. Examen microscopique
Sur 269 matrices de brebis récoltées, des
prélèvements ont été effectués sur les corps
utérins, les ovaires et les salpinx des matrices lésées
mais également sur quelques matrices saines. L'étude histologique
de nos échantillons a été réalisée au niveau
du laboratoire d'anatomopathologie de l'école nationale
supérieure vétérinaire (ENSV).
a. Mode de prélèvement
Au niveau de l'ovaire et de l'utérus, des fragments de
1cm de long sur 1cm de large, et d'environ 0,5cm d'épaisseur ont
été découpés à l'aide d'un bistouri. Tout en
prenant soin d'inclurent les différentes couches des parois ovariennes
et utérines pour obtenir la meilleure coupe possible et avoir un bon
résultat pour l'observation microscopique.
b. Techniques histologiques
Afin d'effectuer l'observation microscopique indispensable
à notre étude, il est nécessaire de monter une lame
histologique de bonne qualité et observable au microscope sans
16
difficultés. Ceci n'est possible que par la bonne
exécution de « la technique histologique classique » qui
permet le traitement adéquat des échantillons en
préservant les divers fragments des parois ovariennes et utérines
prélevées.
La technique d'histologie classique consiste, d'une
manière générale, en la fixation de l'échantillon,
son inclusion à la paraffine, la réalisation de fines coupes et
la coloration.
? Le prélèvement
Notre prélèvement doit avoir été
préalablement fait de manière propre et délicate afin de
ne pas causer la désorganisation tissulaire des différentes
couches histologiques.
? La fixation
Cette étape est très importante. Elle a pour but
la conservation des structures tissulaires dans un état aussi proche que
possible de l'état in vivo, et ce par l'inhibition de toutes
activités mitotiques et enzymatiques ainsi que les attaques
bactériennes qui peuvent mener très rapidement vers une
dégradation cellulaire et dénaturation de
l'échantillon.
Les fixateurs les plus utilisés en pratique sont le
Formol et le liquide de Bouin. On immerge notre prélèvement dans
un grand volume de formol 10%. La durée de fixation varie selon le
volume du prélèvement (Figure A2a).
? La déshydratation et
l'éclaircissement
On prépare d'abord une pièce
d'échantillon en coupant délicatement notre fragment
préalablement fixé de façon à obtenir une couche de
2 mm d'épaisseur environ. On place cette couche préparée
dans une cassette en plastique numérotée au crayon noir pour
identifier le prélèvement.
La déshydratation se déroule par l'immersion de
nos cassettes dans une série de bains d'alcool à concentrations
croissantes (de l'alcool dilué à 50° jusqu'à l'alcool
absolu à 100°) (Figure A2b).
L'éclaircissement ou bien l'imprégnation
consiste à éliminer les traces d'alcool absolu par immersion des
cassettes dans un bain de toluène (Figure A2b). Ces deux étapes
ont pour but de préparer notre échantillon à son inclusion
dans la paraffine en chassant l'eau intra cellulaire étant donné
que la paraffine est hydrophobe. Ces étapes durent 24 heures.
? L'inclusion à la paraffine ou
l'enrobage
Le prélèvement va baigner dans de la paraffine
(résine blanche opaque) fondue, chauffée à 56° dans
une étuve pendant 4 heures. La paraffine va alors infiltrer toutes les
cellules de notre échantillon (Figure A2c). Cette étape est
réalisée au niveau d'un automate de paraffine, aussi
appelé appareil d'enrobage de paraffine.
? La mise en blocs
Après 4 heures d'inclusion, la paraffine liquide est
coulée dans un petit moule en métal appelé « barres
de Leuckart ». On y place notre échantillon et après toute
une nuit de refroidissement au congélateur, on obtient enfin « un
bloc de paraffine » dur avec le prélèvement à
l'intérieur, prêt à être utilisé (Figures A2d
et A2e).
17
> Confection des coupes histologiques ou
microtomie
Cette étape consiste en le passage du bloc de paraffine
contenant la pièce histologique dans un microtome, afin d'obtenir des
coupes fines de 2 à 5 ìm qui seront disposées en une
série régulière sous forme de ruban.
Pour la réalisation des coupes nous avons utilisés
un microtome de type « Leica », constitué :
- D'un porte-objet, support du bloc en paraffine fixé par
la pince à objet,
- D'un bouton de réglage pour définir
l'épaisseur des coupes,
- D'un rasoir soutenu par le porte-rasoir qui est maintenu par
des vis de serrage qui ont
comme rôle le réglage de l'angle d'inclinaison du
rasoir, en tenant compte du biseau,
- D'une roue motrice actionnable par une manivelle.
Une fois cette étape de microtomie terminée, la
préparation des lames histologiques comporte alors 3 étapes :
· L'étalement : après
avoir numéroté la lame, on procède à
l'étalement de segments de ruban de paraffine sur des lames en verre,
contenant un liquide d'étalement tel que « l'eau albumineuse »
(Figure A2f).
· Le collage : les lames en verre sont
alors placées sur une plaque chauffante réglée à
40°C et y reste pendant 15 minutes (Figure A2g).
· Le séchage : consiste à
faire incliner les lames en verre, et les sécher au papier buvard.
> Le déparaffinage
Cette étape consiste à éliminer la
paraffine, c'est-à-dire le milieu d'inclusion, en plaçant les
lames sur une plaque chauffante de 45° à 60°C pendant 15
minutes, afin d'éliminer la paraffine périphérique.
> La réhydratation
A pour but l'élimination de la paraffine intracellulaire,
en immergeant les lames dans une série de bains d'alcool à
concentrations décroissantes, en partant d'un alcool à 100°
jusqu'à l'alcool à 50°, puis on finit par un dernier lavage
à l'eau distillée.
> La coloration des lames
Une fois notre lame déparaffinée et
réhydratée, elle est prête pour l'étape de la
coloration proprement dite.
Cette étape a pour but de mettre en évidence les
différents constituants tissulaires (noyau, membrane plasmique,
cytoplasme) et ce, en accentuant les contrastes entre ces divers
éléments, ce qui permettra une parfaite observation au microscope
optique.
Pour notre étude nous avons opté pour une
coloration à l'Hémalun Éosine (HE) qui a pour principe de
colorer le noyau cellulaire par une laque aluminique basique, l'Hémalun
(en violet foncé) et le cytoplasme par un seul colorant acide,
l'Éosine (en rose pâle) (mode opératoire en Annexe 1 et
figure A3).
18
? Le montage des lames et l'observation
microscopique
Le montage consiste à mettre par-dessus la coupe
étalée sur une lame une autre lamelle et les coller l'une
à l'autre à l'aide d'une résine synthétique
spéciale de type « Eukit ». La lame histologique est enfin
prête pour l'observation au microscope optique.
Les éléments histologiques
recherchés lors de l'observation microscopique
Les éléments auxquels nous nous intéressons
lors de l'examen histologique sont :
? Dans l'ovaire : les parois des follicules
ovariens et corps jaunes. On prête une
attention particulière lors de cas de kystes ovariens
à :
? La granulosa : si elle est bien
présente ou absente, et le nombre de ses couches
cellulaires.
? La thèque interne : la forme et le type
de ses cellules et sa disposition par rapport à la
lame basale.
? La lame basale : présente ou absente
? Dans l'utérus :
- L'aspect de l'épithélium de surface.
- L'aspect glandulaire.
- La présence de possibles changements vasculaires au
niveau du stroma utérin.
3.4. Analyse statistique
Les données ont été
présentées en pourcentage et l'analyse a été
réalisée à l'aide de STATISTICA (Version 10, Stat Soft
France, 2003). Les différences dans les pourcentages des
différentes pathologies ont été évaluées par
le test du Chi deux. Le niveau de signification a été fixé
à P<0,05.
Résultats
& Discussion
19
RÉSULTATS
1. Étude macroscopique
D'après la figure 4, nous constatons que sur les 269
tractus génitaux examinées, 26 matrices étaient gravides
soit (9,67%), et 243 (90,33%) non gravides.
Sur ces derniers, 209 (86%) tractus n'ont
présenté aucune anomalie visible après examen, que ce soit
au niveau des ovaires, des oviductes ou bien des utéri.
Sur le reste des 34 matrices soit (14%), nous avons pu noter
différents types de lésions que nous décrierons
ci-dessous.

Ovaires
polykystique
1 cas (2,94%)
Pathologies ovariennes
(2,94%)
Normaux
209 (86%)
Free martinisme 1 cas (2,94%)
Pathologies
congénitales
(8,82%)
utérus unicorne
1 cas (2,94%)
Malformation cervicale
1 cas (2,94%)
Non gestants
243 (90,33%)
Appareils génitaux
269
Pathologiques
34 (14%)
Pathologies des oviductes
(11,76%)
Salpingite
3 cas (8.82%)
Kyste para ovarien
1 cas (2,92%)
Gestants
26 (9,67%)
Rupture utérine 4 cas (11,77%)
infections
utérines
19 cas (55,88%)
Pathologies de l'utérus:
(76,47%)
Prolapsus
2 cas (5,88%)
Cervicite
1 cas (2,94%)
Figure 4. Résultats de l'étude
macroscopique des tractus génitaux de brebis en post-mortem.

20
Figure 5. Deux matrices gravides (Aspects
interne et externe) (Photos personnelles).

Figure 6. Deux cas de gestation
gémellaire à différents stades de développement
(Photos personnelles).

Figure 7. Utérus normal Figure 8.
Utérus normal Figure 9. Utérus
non gravide (Photo avec présence de avec un cervix
personnelle). follicules sur l'ovaire normal (Photo
(Photo personnelle). personnelle).
21
1.1. Anomalies relevées sur
l'utérus
Les lésions macroscopiques que nous avons pu rencontrer
sur l'utérus sont essentiellement des lésions de la muqueuse
utérine en cas d'infections (congestion, nécrose, présence
d'adhérences avec des sécrétions anormales dans la
cavité utérine) (Figure 10), une déchirure de la paroi
utérine avec des traces d'adhérences et du tissu cicatriciel, des
cas de malformations : utérus unicorne, utérus atrophié
dans un cas de free martinisme, un prolapsus (Figure 12) et une malformation
cervicale. Nous avons également noté trois cas de salpingite
(Figure 13) ainsi qu'une cervicite (Figure 11). Il est important de noter que
certaines de ces lésions peuvent êtres présentes sur une
même matrice à la fois.
Les fréquences avec lesquelles ces lésions ont
été isolées sur les matrices examinées sont
regroupées dans le tableau 2:
Tableau 2. Nombre et fréquences
d'utéri présentant les différentes lésions
macroscopiques.
|
Lésions
|
Nombre
|
%
|
|
Infections utérines
|
19
|
76,47
|
|
Rupture utérine
|
4
|
|
Prolapsus
|
2
|
|
Cervicite
|
1
|
|
Anomalies congénitales
|
Utérus unicorne
|
1
|
8,82
|
|
Malformation
cervicale
|
1
|
|
Free martinisme
(utérus atrophié)
|
1
|
Le tableau 2 montre que les lésions utérines ont
été relevées avec une fréquence assez
élevée (76,47%) tandis que les anomalies congénitales
présentent une fréquence bien plus basse (8,82%) (P<0.0001).
Les infections utérines représentent les pathologies les plus
fréquentes au niveau de l'utérus avec un taux de 55,88% (19 cas),
suivies par la rupture utérine avec 11,77% (4 cas), le prolapsus avec un
taux de 5,88% (2 cas) et enfin la cervicite avec le taux le plus bas qui est de
2,94% (1 cas).
Les anomalies congénitales ont été
relevées avec un taux de 8,82%. Elles sont réparties avec un
même taux de 2,94% sur : 1 cas d'utérus unicorne, 1 cas de
malformation cervicale et 1 cas de Free Martinisme.

22
Figure 10. Aspect macroscopique d'une infection
utérine (Photos Figure 11. Cervicite (Photo
personnelles). personnelle).
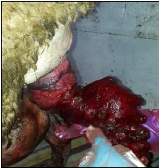
Figure 12. Prolapsus utérin (Photo
personnelle). 1.2. Anomalies relevées sur les
oviductes
Dans le tableau suivant, on a noté les différentes
lésions observées sur les oviductes examinés :
Tableau 3. Nombre et fréquences des
lésions observées sur les oviductes.
|
Lésion
|
Nombre*
|
Pourcentage
|
|
Salpingite
|
3
|
8.82%
|
|
Kyste para-ovarien (Kyste de l'oviducte)
|
1
|
2,92%
|
(*) Plus d'une lésion ont pu êtres relevées
sur un même oviducte.
La salpingite a été relevée avec un taux
plus élevé (8.82%) par rapport au kyste para ovarien, lequel a un
taux de (2,92%) (P<0.05).

Figure 13. Salpingites (Photos personnelles).
23
Figure 14. Kyste para-ovarien (Photo
personnelle). 1.3. Anomalies relevées sur les
ovaires
L'examen méticuleux des ovaires des 269 appareils
génitaux de notre étude a révélé la
présence d'un seul cas d'ovaire kystique avec un taux de (2,94%), d'un
diamètre dépassant 17mm.
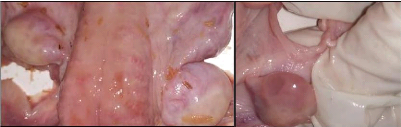
Figure 15. Ovaire portant un corps jaune et
des follicules (Photos personnelles).
2. Étude microscopique
Dans notre étude, nous avons effectué l'examen
histologique au microscope optique des lames obtenues après
préparation des échantillons. Après examen, nous avons pu
reconnaitre les structures normales des parenchymes des différentes
parties constituant la matrice (ovaires, oviductes, utérus et cervix).
Comme nous avons également pu observer certaines structures
pathologiques de ces tissus et les comparer avec les tissus sains.
24
2.1. Observation microscopique des
utéri
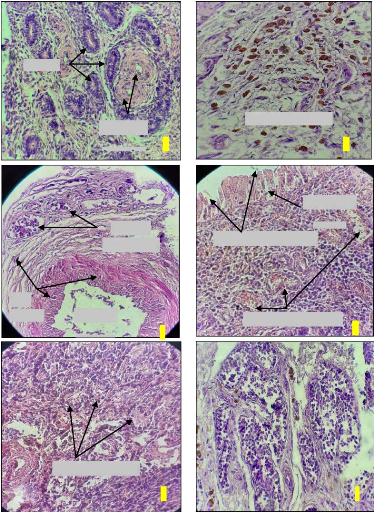
VS
Cell. Inflam.
Glandes
Glandes détruites
Vaisseau
Vaisseaux
dégénérées
Glandes
Glandes
dégénérées
d
c
e
a
Épithélium
abrasé
Infiltration par le pus
Muqueuse détruite
b
f
Coupe de l'utérus montrant : (a)
Muqueuses utérines normales (G×400), (b) destruction
complète de la muqueuse utérine (c) Infection utérine avec
dégénérescence des glandes et vascularite (G×400),
(d) infection utérine avec un épithélium de surface
abrasé par endroits, infiltré de cellules inflammatoires avec une
coloration jaune par endroits indiquant une infiltration par le pus
(G×100), (e) infection utérine chronique avec destruction des
glandes (G×400), (f) infection utérine chronique avec une
destruction massive de la muqueuse utérine et les glandes presque non
reconnaissables (G×400).
Figure 16. Coupes d'utéri montrant
différents aspects d'infections utérines
(photos
personnelles).
25
Une muqueuse utérine saine (Figure 16a) ne montre aucun
signe d'inflammation (présence de cellules inflammatoires, fibrose,
congestion). Les glandes et les vaisseaux sanguins sont bien
délimités et bien visibles avec une lumière claire. Lors
d'une infection utérine (Figures 16b, 16c, 16d, 16e et 16f) et en
fonction du stade de l'infection, la muqueuse utérine est envahie par
les cellules inflammatoires qui entourent les glandes. Ces dernières,
commencent à dégénérer et finissent par ne plus
être visibles à des stades très avancés de
l'infection (stades chroniques). Au stade chronique de l'inflammation, on
décèle également des traces de fibrose.
L'épithélium de surface apparait abrasé dans quelques
zones et semble coloré en jaune par endroits, ce qui est un signe d'une
infiltration par le pus (Figure 16d).
2.2. Observation microscopique des ovaires

Thèque Interne
Thèque externe
Lame basale
Liquide folliculaire
Granulosa
a
Granulosa
dégénérée
Granulosa
folliculaire
Liquide folliculaire
Liquide
Thèque interne
d
b c
Coupes d'ovaires montrant : (a) (G×100), (b) (G×400)
des parties de follicules ovariens normaux avec des couches multiples de la
granulosa, (c) corps jaune normal avec les grandes et les petites cellules
lutéales entremêlées et d'aspect compact (G×400), (d)
kyste ovarien folliculaire.
Figure 17. Coupe d'ovaires montrant la
structure normale du follicule et du corps jaune
ainsi que celle d'un kyste ovarien (Photo personnelles).
Sur les figure 17a et 17b, nous pouvons observer deux coupes
de follicules ovariens normaux contenant du liquide folliculaire et
présentant une granulosa compacte en plusieurs couches
séparées de la thèque interne par une lame basale, ainsi
qu'une thèque externe vers la périphérie du follicule.
En revanche sur la figure 17d, à la différence
du follicule normal, le kyste ovarien folliculaire est un follicule qui n'a pas
ovulé et qui présente une disparition graduelle des couches de la
granulosa à des stades avancés. La lame basale disparait
progressivement et les cellules de la granulosa se mêlent aux cellules de
la thèque interne. Ces dernières sont gonflées, et perdent
leur arrangement caractéristique parallèle à la lame
basale.
26
Sur la figure 17c, on peut observer la coupe d'un corps jaune
normal présentant des grandes et des petites cellules lutéales
entremêlées et serrées les unes aux autres.
2.3. Observation microscopique du cervix
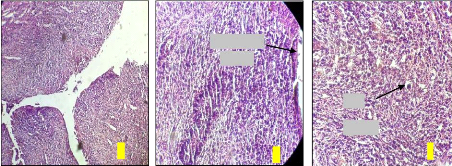
a b c
Épithélium
absent
Cell.
Inflam.
Coupes de cervix atteints d'une cervicite :
(a) cervicite (G×40), (b),(c) cervicite avec présence de cellules
inflammatoires, absence d'épithélium de surface et
absence de glandes (G×400).
Figure 18. Coupe de cervix atteints de
cervicite (Photos personnelles).
Les figures 18a, 18b et 18c présentent des coupes au
niveau du col de l'utérus. On constate que ces cols sont atteints d'une
cervicite en raison d'une forte infiltration de la muqueuse par les cellules
inflammatoires (cellules en violet foncé), l'épithélium de
surface est quasi absent et les glandes sont
dégénérées.
2.4. Observation microscopique des oviductes

Replis de la muqueuse
Épithélium + villosités
a
b
Les replis de la muqueuse sont conservés Destruction
complète des replis
Figure 19. Coupe au niveau d'un oviducte
normal (19a) et pathologique (19b) (Photos
personnelles).
La figure 19a montre l'aspect microscopique d'un oviducte normal
et la figure 19b celui d'un oviducte pathologique.
27
DISCUSSION
L'objectif de l'étude macroscopique effectuée
sur les matrices de brebis récupérées au niveau de
l'abattoir des Eucalyptus à Alger est la mise en évidence
d'anomalies macroscopiques de l'appareil génital qui pourrait être
à l'origine de l'infertilité chez la brebis. Après cette
étude, nous avons pu mettre en évidence la fréquence des
anomalies macroscopiques dans les matrices des brebis abattues au niveau de cet
abattoir ainsi que la fréquence des femelles gestantes et ce sur une
durée limitée de 3 mois.
Sur 269 matrices examinées, 26 étaient gravides
soit 9.67%. Les foetus étaient tous âgés de moins de 2
mois. Ceci ne peut être attribué à un manque de
sérieux des vétérinaires de l'abattoir des Eucalyptus mais
plutôt à la difficulté en terme de temps et de
matériel de poser un diagnostic de gestation dans un abattoir lorsque la
brebis est en début de gestation.
La majeure partie des matrices examinées étaient
d'apparence normale. Toutefois, une fréquence de 14% d'anomalie a
été observée que ce soit sur l'utérus, l'oviducte
ou les ovaires. Cette fréquence est plus faible par rapport à
celle rapportée par Niar (2005) chez la race Rembi qui
est 25%. Elle est également faible par rapport à celle
rapportée par Khammar et al. (2013) chez la
race El Awrassi qui est de 22.86% et très faible à celle
rapportée par Moghaddam et Gooraninejad (2007) qui a
atteint un taux de 92%. La fréquence basse d'anomalies que nous avons
relevées pourrait être due soit à la taille réduite
de notre échantillon soit à une amélioration des
conditions d'élevage dans les fermes.
La fréquence des anomalies congénitales est de
8.82%. Trois cas seulement de malformation ont été
rencontrés à savoir :
? 1 cas d'utérus unicorne
? 1 cas de free martinisme
? 1 cas de malformation cervicale
Pour le free martinisme, il est fréquemment
décrit chez les bovins. En revanche, il est considéré
comme rare chez les ovins, la fréquence habituellement indiquée
est de l'ordre de 1% (Marcum, 1974). Dans notre étude,
sa fréquence est de 2.94%.
Dans notre étude, les pathologies utérines ont
été observées avec une proportion assez forte de 76,47%.
Cette proportion est bien plus élevée comparée à
celle rapportée par Moghaddam et Gooraninejad (2007)
qui est de 20,1%, et elle très proche de celle rapportée
par Abdul et al. (2007) qui est de 70%.
En ce basant sur l'existence de divers signes d'inflammation
au niveau des utéri comme la congestion, la présence d'un contenu
anormal au niveau des cornes utérines, la présence de taches
hémorragiques ou toute autre coloration anormale, nous avons pu mettre
en place un diagnostic d'infections utérines assez fiable mais sans
différencier entre endométrite et métrite.
L'infection utérine a été notée
dans cette étude sur 19 tractus, soit un taux de 55,88%.
Histologiquement, les muqueuses utérines étaient à
différents stades de l'inflammation : certaines matrices
n'étaient qu'au début de l'inflammation avec une muqueuse envahie
par les cellules inflammatoires, des glandes en début de
dégénérescence. On a également noté des
traces d'infiltration par le pus. D'autres utéri présentaient des
muqueuses complètement détruites, à un stade chronique de
l'inflammation, où les glandes sont à peine reconnaissables
28
au microscope avec des traces de fibrose. Ces résultats
sont souvent la conséquence d'une mauvaise hygiène durant la
parturition et le post-partum.
Quatre (04) cas de rupture utérine ont également
été observés avec un taux de 11,77%, deux (2) prolapsus
utérins avec un taux de 5,88% et enfin, un (01) cas de cervicite
(2,94%). Dans certains cas, ces pathologies en été
rencontrées en concomitance avec l'infection utérine. Ceci
s'explique par le fait que les agents infectieux du vagin peuvent passer dans
le cervix et l'utérus et provoquer une cervicite et une
endométrite.
L'examen minutieux des ovaires des 269 appareils
génitaux des brebis faisant l'objet de notre étude a
révélé la présence d'un seul cas de kyste ovarien.
Ce dernier est parmi les lésions les plus faiblement notées dans
notre travail avec une fréquence de 2,94%, un taux quasi similaire
à celui signalé par Alostra et al.
(1998), Smith et al. (1999) et
Dawood et al. (2010) qui est de 0,19 à 2%
ainsi que celui de Moghaddam et Gooraninejad (2007) qui est de
0,01 à 2,4%. Gustafsson et Holmberg (1966) ont, quant
à eux, rapporté une fréquence de 0,6% de kystes ovariens
suite à l'examen post-mortem de 502 organes génitaux de
l'espèce ovine.
On constate donc une cohérence entre les
résultats signalés dans notre travail et les résultats des
études effectués auparavant retrouvés dans la
bibliographie. Toutefois, on peut justifier la subtile divergence qui a pu
être notée à divers facteurs épidémiologiques
qui diffèrent d'une région à une autre, le nombre
d'animaux constituant la population étudiée (importance de
l'échantillon) ainsi que le moment de la réalisation de
l'étude et les critères de diagnostic variables choisis par les
différents auteurs.
Par contre, si l'on compare la fréquence de notre
étude effectuée sur l'espèce ovine par rapport à
celle notée chez l'espèce bovine, on trouvera que la
fréquence des anomalies du tractus génital en
général chez les bovins est bien plus élevée avec
un taux de 60,20% (Mimoune, 2016).
Idem pour la fréquence plus particulièrement des
anomalies ovariennes chez l'espèce bovine, qui est tout aussi
élevée avec une fréquence de 18,2% (Mimoune, 2016)
par rapport à celle de la brebis avec une fréquence de
10%.
On constate donc que la pathologie du kyste ovarien est
caractéristique de l'espèce bovine, et plus rarement
rencontrée chez la brebis.
L'observation microscopique des coupes d'ovaire nous a permis
de voir la structure normale du follicule ovarien et celle du corps jaune et de
les différentier d'un kyste ovarien. En effet, le kyste ovarien chez la
brebis se définie comme toute structure folliculaire anovulatoire
dépassant 17mm de diamètre, persistant sur l'ovaire au moins 10
jours en absence d'une structure lutéale. Il est
caractérisé par une disparition graduelle des cellules de la
granulosa, sachant que les cellules restantes préservent leur apparence
morphologique. Les cellules thécales sont hypertrophiées, perdant
leur arrangement caractéristique parallèle à la lame
basale (Mimoune, 2016). A travers l'examen histologique, nous
avons pu connaitre le type qui est folliculaire.
La fréquence des anomalies de l'oviducte est de 11.76%.
Trois cas de salpingite ont été rencontrés soit 8.82% des
anomalies. Il est relativement élevé par rapport au taux de
salpingites annoncé par Benchaïb (2007) qui est de
0.41% chez la brebis. Ces cas sont généralement associés
avec des endométrites ce qui peut témoigner de l'infection
ascendante de l'oviducte.
29
Un cas de kyste para ovarien a également
été repéré au niveau de l'oviducte avec un taux de
2.92%.
Les kystes para ovariens sont des structures kystiques qui se
produisent au niveau du ligament large près des ovaires et de
l'utérus. Ces kystes peuvent causer par compression, une sténose
de la lumière de l'oviducte quand ils sont très larges
(Mimoune, 2016).
| 


