III.2.2.2- Analyse de la matrice de
corrélation
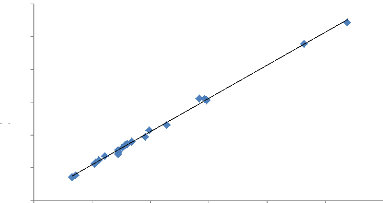
Nous constatons qu'après exclusion de 14% des
échantillons ayant présenté une erreur analytique
inférieure à -5 et supérieure à +5, il y a une
bonne corrélation entre la somme de cation et celle des anions avec un
coefficient de 0,997 (figure 24).
Aussi nous faisons une analyse statistique entre les
différents paramètres physico-chimiques croisés deux
à deux et avec la somme des ions (tableau 3).
Les corrélations les plus importantes des
différents paramètres sont celles existant entre la somme des
ions et le HCO3- (0,94), le TDS (0,93), le Na+ (0,95),
Ca2+ (0,84). Il y a aussi une bonne corrélation entre les
différents paramètres : TDS et K+(0,91), TDS et
Na+ (1,00), TDS et Ca2+ (0,82), TDS et HCO3-
(0,95), le K+ et Na+ (0,91), K+ et
HCO3- (0,91), le Na+ et HCO3-(0,95)
(tableau 3).
12
10
8
6
?Cations
4
2
0
R2 = 0,9974
0 2 4 6 8 10 12
?anions
Figure 24: Corrélation entre somme des
cations et somme des anions
Etude hydrogéologique et
caractérisation des aquifères du Batha Est Université de
N'Djaména
Mémoire de master, présenté et
soutenu par : BETOLOUM VINCENT 44
Tableau 3: Matrice de corrélation entre les
paramètres physico-chimiques
|
Paramètres
|
pH
|
5°C
|
TDS
|
Ca++
|
Mg++
|
K+
|
NH4+
|
Na+
|
Fer dissous
|
Cl-
|
NO3-
|
HCO3-
|
SO4-
|
|
pH
|
1,00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5°C
|
-0,05
|
1,00
|
|
|
|
|
|
|
|
|
|
|
|
|
TDS
|
-0,16
|
0,55
|
1,00
|
|
|
|
|
|
|
|
|
|
|
|
Ca++
|
-0,47
|
0,59
|
0,82
|
1,00
|
|
|
|
|
|
|
|
|
|
|
Mg++
|
-0,27
|
0,15
|
0,25
|
0,54
|
1,00
|
|
|
|
|
|
|
|
|
|
K+
|
-0,04
|
0,41
|
0,91
|
0,43
|
0,15
|
1,00
|
|
|
|
|
|
|
|
|
NH4+
|
-0,12
|
0,02
|
0,32
|
0,27
|
-0,14
|
0,53
|
1,00
|
|
|
|
|
|
|
|
Na+
|
-0,16
|
0,55
|
1,00
|
0,61
|
0,25
|
0,91
|
0,32
|
1,00
|
|
|
|
|
|
|
Fer dissous
|
0,12
|
-0,27
|
-0,04
|
-0,18
|
-0,10
|
-0,05
|
-0,19
|
-0,04
|
1,00
|
|
|
|
|
|
Cl-
|
-0,65
|
0,41
|
0,20
|
0,81
|
0,51
|
-0,05
|
-0,08
|
0,21
|
-0,05
|
1,00
|
|
|
|
|
NO3-
|
-0,34
|
0,28
|
0,34
|
0,54
|
0,23
|
0,43
|
0,64
|
0,34
|
-0,03
|
0,34
|
1,00
|
|
|
|
HCO3-
|
-0,14
|
0,45
|
0,95
|
0,65
|
0,39
|
0,91
|
0,38
|
0,95
|
-0,13
|
0,18
|
0,36
|
1,00
|
|
|
SO4-
|
-0,12
|
0,61
|
0,26
|
0,68
|
0,44
|
0,35
|
0,00
|
0,50
|
-0,07
|
0,51
|
0,35
|
0,41
|
1,00
|
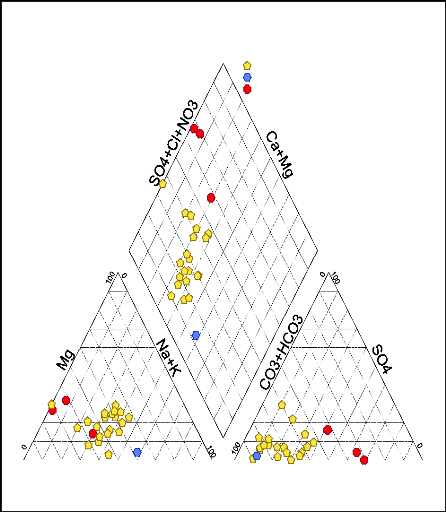
III.2.2.2- Les faciès chimiques des eaux
souterraines du Batha Est
Pour étudier l'évolution chimique des eaux
souterraines de notre zone d'étude, nous avons utilisé le
diagramme de minéralisation de Piper. Ce diagramme est constitué
d'un triangle des cations, d'un triangle des anions et d'un losange où
l'intersection de ces ions nous permet de déterminer le faciès
chimique de chaque échantillon.
Etude hydrogéologique et
caractérisation des aquifères du Batha Est Université de
N'Djaména
100 0 0 100
Ca Cl+NO3
0 0
Diagramme de Piper
100
100
Bicarbonatée calcique et
magnésienne
Bicarbonatée sodique et
potassique
Chlorurée et sulfatée calcique et
magnésienne
Mémoire de master, présenté et
soutenu par : BETOLOUM VINCENT 45
Figure 25: Diagramme de piper
Il se dégage de ce diagramme de Piper trois faciès
suivants :
y' Le faciès bicarbonaté calcique et
magnésien représente 84% des échantillons analysés
;
y' Le faciès chloruré et sulfaté calcique
et magnésien représente 12% des échantillons
analysés ;
y' Le faciès bicarbonaté sodique et potassique
représente 4% des échantillons analysés.
Etude hydrogéologique et
caractérisation des aquifères du Batha Est Université de
N'Djaména
Mémoire de master, présenté et
soutenu par : BETOLOUM VINCENT 46
|
|



