2. Procedure experimentale
L'analyse des inhibiteurs de l'alpha amylase est effectuee par la
quantification du sucre reducteur libere dans le milieu (maltose).
L'activite inhibitrice de l'enzyme est exprimee par la diminution
des unites du maltose libere dans le milieu reactiormel.
La methode suivie est celle de Bernfeld (1955), elle est basee
sur le dinitrosalicylique DNS qui stoppe la reaction enzymatique (changement de
pH) et forme un complexe avec le maltose dormant une coloration rouge dont
l'absorbance est mesuree a 530 nm.
Chapitre V: effets des extraits phenoliques sur les
enzymes 1. a- Amylase
2.1. La courbe d'etalonnage du maltose
A partir d'une solution mere aqueuse preparee du maltose de
concentration massique 0.03 mo1/1, des solutions filles sont ainsi preparees de
concentration allant de 0.0005 mo1/1 jusqu'a 0.002 mo1/1. Dans un tube, on
introduit 2 ml de la solution du maltose puis on ajoute 1 ml du reactif DNS (1
g de DNS, 200 mg de phenol cristallin, 20 g de double tartarate de sodium, et
50 mg sulfite de sodium dissous dans la soude de 1% [eau/volume] [prepare
frais]) qui est chauffe a 100 °C pendant 5 min, aprês
refroidissement, le mélange est complete a 10 ml d'eau distillee. La
lecture de l'absorbance de chaque solution est effectuee a l'aide d'un
spectrophotomêtre de Shimadzu 1601 a une longueur d'onde de 530 nm contre
un blanc (méme solution sans la solution du maltose) ce qui nous permet
de tracer la courbe d'etalormage (figure V. 1. 2) (Sigma
Aldrich, 1999) :
|
g 0,9
§
0,8
4
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
|
|
0 0,0005 0,001 0,0015 0,002 0,0025
Concentration du maltose mol/I
Figure V. 1. 2. La courbe d'etalormage de
maltose.
2. 2. Activite de 1' a- amylase
Le milieu reactiormel contient 100 ill des extraits
phenoliques, 50 IA de l'a- amylase sont pre incubes pendant 30 minutes,
aprês lml de solution d'amidon 1% (m/v) est ajoute puis incube a
37°C pendant 10 minutes, par la suite le milieu est traite de la
méme fawn que la courbe d'etalormage du maltose et la lecture est
effectuee a 530 nm. Un blanc a ete place sans extrait phenolique, et encore
sans l'a-amylase (E. Kokiladevi et al, 2005).
La representation graphique 1/V = f ([polyphenols]), nous
renseigne sur le type d'inhibition et permet de determiner les constantes
cinetiques en presence et en absence des extraits phenoliques.
3. Resultats et discussion
A l'aide des mesures spectrophotometriques realisees sur
l'activite enzymatique de l'a amylase et comparativement a la representation de
Michaelis-Menten, on apercoit que cet enzyme presente une cinetique
michaelienne (figure V. 1. 3).
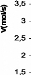
1
0,5
0 2 4 6 8 10 12 14 16
Am idon (NM)
Figure V. 1. 3. La cinetique enzymatique de l'a
-amylase.
Les differentes parametres cinetiques de l'enzyme (V.,
KM) sont determines selon l'equation en double inverse de Lineweaver
Burk [1/ V = f (1/ S)] (figure. V.1.4).
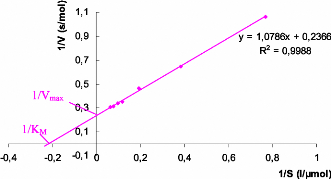
Figure V. 1. 4. Representation de
Lineweaver-Burk de l'enzyme michaelienne a- amylase.
A partir de la representation de Lineweaver-Burk de l'a-
amylase, la vitesse maximale V. est de 3, 846 mol/s et la constante de
Michaelis KM est de 4, 347 mM.
L'etude de l'effet des extraits phenoliques sur l'activite de
l'a- amylase est effectuee a l'aide d'un spectre UV-visible Shimadzu 1601,
mesurant la concentration de maltose libere qui est transforms par la suite en
une vitesse en mol/s.
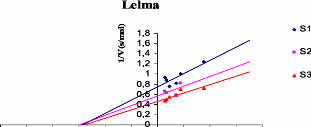
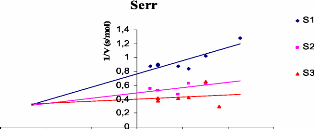
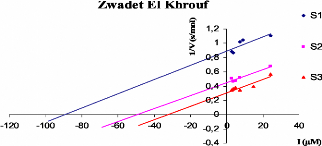
D'apres les traces (figure V. 1. 5) representant la variation
de l'inverse des vitesses reactionnelles en fonction des concentrations des
extraits phenoliques exprimees en 1.1M (en considerant une masse molaire
moyenne des polyphenols de l'ordre de 500g) pour differentes concentrations de
substrats, nous avons determine le type et la constante d'inhibition
(Ki) de chaque echantillon.
-
· S1
· S2 A S3
120 -100 -80 -60 -40 -20 0 20 40 60 80
· S1
· S2
· S3
- 60 -40 -20 0 20 40 60
· S1 S2 A S3
Figure V. 1. 5. Representations graphiques
1/V = f ([polyphenols]) de chaque extrait phenolique tel que 1/V (s/ADO),
([S3]> [S2]> [Si]).
Les constantes d'inhibition (Ki) sont calculees a
partir de ces graphes par la projection du point d'intersection des droites sur
l'axe des abscisses, tandis que le type d'inhibition est deduit a partir du
point de rencontre de ces traces. Le tableau V. 1. 1 regroupe les differents
resultats obtenus.
Chapitre V: effets des extraits phenoliques sur
les enzymes 1. a-
Amylase
Tableau V. 1. 1. Le type
d'inhibition et la constante d'inhibition de chaque plante
Plante Type d'inhibition Ki (pM)
Foulia I I
Gondale / I
Lelma Non competitif 58
Remth / I
Reguig / I
Serr Non competitif 46
Zwadet Elkhrouf incompetitif ND
ND: Non determine
Les resultats obtenus montrent que parmi les sept plantes it
y'a seulement trois plantes qui ont un pouvoir inhibiteur de l'a-amylase de
type non competitif pour "Lelma" et "Serr" et de type incompetitif pour "Zwadet
Elkhrouf'.
Nous avons teste les extraits phenoliques des sept plantes
etudiees vis-à-vis a l'inhibition enzymatique car on peut trouver les
extraits qui inhibent mais qui ne peuvent pas apparaitre dans les traces 1/V= f
(I), pour cela nous avons appliqué la methode de Qiang II et al
(Qiang .H et al, 2006) qui determine le
pourcentage d'inhibition suivant cette relation:
Inhibition (%) = [1 - (test d'activite
/ contrOle)]* 100
tel que: test d'activite est le test en presence l'inhibiteur, le
contnile est le test sans inhibiteur. Les resultats obtenus sont consigns dans
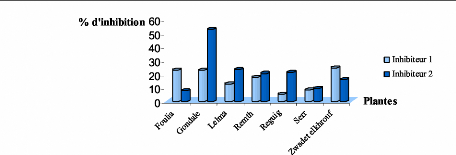
le tableau V.1. 2 et presentes dans l'histogramme (figure V. 1. 6).
Tableau V. 1. 2: Le pourcentage d'inhibition de
chaque plante.
|
|
|
|
Plante
|
Pourcentage d'inhibition
Inhibiteur 1
Inhibiteur 2
|
|
Foulia
|
22,84
|
7,71
|
|
Gondale
|
22,63
|
52,57
|
|
Lelma
|
12,65
|
23,25
|
|
Remth
|
17,48
|
20,37
|
|
Reguig
|
5,14
|
21
|
|
Serr
|
8,12
|
9,46
|
|
Zwadet Elkhrouf
|
24,48
|
15,94
|
q Inhibiteur 1
q Inhibiteur 2
% d'inhibition 60
50 40 30 20 10
Plante s
0
b tp* 4.° 00
Figure V.1.6. Le taux d'inhibition de
l'a-amylase avec deux concentrations d'inhibiteur croissantes (Rd <
[I2]) et une seule concentration de substrat.
Nous remarquons que l'extrait "Gondale" possede un pourcentage
d'inhibition le plus eleve de l'ordre de 52,57 %, alors que cet extrait ne
repond pas au graphique 1/V = f (I) car ce type de graphique a ete obtenu a des
concentrations nes faibles en phenols.
Le taux d'inhibition augmente lorsque la concentration
d'inhibiteur augmente a l'exception de deux plantes : "Foulia" et "Zwadet
Elkhrouf' et ceci peut étre explique par l'effet activateur qui est du a
la concentration elevee en composes phenoliques.
4. Conclusion
Les inhibiteurs de l'a amylase sont diversifies et
generalement synthetiques utilises comme medicament contre le diabete exemple
l'acarbose, mais toujours on s'interesse a la nature pour la recherche des
inhibiteurs de cette enzyme, beaucoup des plantes medicinales sont connus dans
ce domain ; nos plantes sont des plantes sahariennes qui contiennent les
phenols connus par leur pouvoir d'inhiber les enzymes et surtout les
flavonokles du a leurs structures chimiques.
Parmi les sept plantes seulement trois plantes qui ont le
pouvoir inhibiteur de l'enzyme sachant que ces plantes ont subit la méme
procedure d'extraction des composes phenoliques ce qui explique que
l'inhibiteur est specifique capable de bloquer le site actif de l'enzyme.
| 


