Chapitre V: effets des extraits phenoliques sur les
enzymes 2. Ttypsine
1. Principe de la methode
Dans cette partie du travail, on s'interesse
a l'evaluation de l'effet des composes phenoliques des extraits (des plantes
investiguees) sur l'activite enzymatique de la trypsine pancreatique bovine.
Cette enzyme hydrolyse le Na- Benzoyle- DL- Arginine -p-
Nitroaniline (BAPNA) en produit principal le Na- Benzoyle- DL- Arginine
incolore et le -p- Nitroaniline qui est de couleur jaune detectable en visible
suivant cette reaction (figure V. 2. 1):
H-,INT NH2
|
0
NO
|
BAPNA
Tiypsine
|
|
|
|
|
|
|
|
|
|
1-12N
|
|
N.,NH
|
|
-p- Nitroaniline
H2N NTT) (405 nm)
Na- Benzoyle- DL- Arginine
Figure V. 2. 1. L'action de la trypsine sur le
BAPNA (Anonyme, 2004). 2. Procedure
experimentale
L'analyse des inhibiteurs de la trypsine est effectuee par la
mesure de la vitesse de la reaction enzymatique dans le mode cinetique
(kinetic) dans le spectrophotometre Shimadzu 1601. Le milieu reactionnel (3 ml)
contient 200 1.t1 de la trypsine (0,16 mg/ml) dans 1,6 ml de tampon tris
(trishydroxymethylaminomethane) C41-1111103 de
concentration molaire 50 mM avec le chlorure de calcium CaC12 de
concentration molaire 10 mM et de pH= 8,2. La cinetique enzymatique (t = 300
secondes) debute apres l'addition de 1 ml de substrat (a differentes
concentrations) ; le blanc est depourvu de l'enzyme et les inhibiteurs.
Chapitre V: effets des extraits phenoliques sur
les enzymes 2. Ttypsine L'activite
inhibitrice des polyphenols est mesuree de la méme fawn en introduisant
200 IA de differentes concentrations des extraits phenoliques.
3. Resultats et discussion
A l'aide des mesures spectrophotometriques realisees sur
l'activite enzymatique de la trypsine et comparativement a la representation de
Michaelis-Menten, on apercoit que cet enzyme presente une cinetique
michaelienne (figure V. 2. 2).
V (AA/s)
0,03
0,025 -
0,02 -
0,015 -
0,01
0,005 -
0 0,5 1 1,5 2
S(mM)
Figure V. 2. 2. La cinetique enzymatique de la
trypsine.
Les differentes parametres cinetiques de l'enzyme (V.,
KM) sont determines selon l'equation en double inverse de Lineweaver
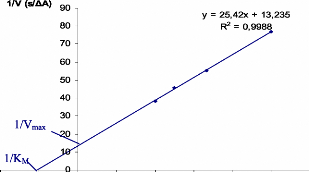
Burk [1/ V = f (1/ S)] (figure V. 2. 3).
1/V (s/AA)
90
1/K
-1 -0,5 0 0,5 1 1,5 2 2,5 3
1/S (1/mM)
Figure V. 2.3. Representation de Lineweaver-Burk
de l'enzyme michaelienne trypsine.
A partir de la representation de Lineweaver-Burk de la trypsine,
la vitesse maximale V. est de 0.0769 AA/s et la constante de Michaelis
KM est de 2 mM.
Chapitre V: effets des extraits phenoliques sur
les enzymes 2. Ttypsine
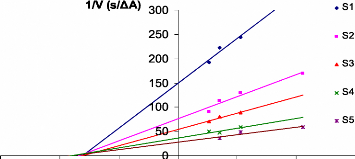
Parmi les sept plantes etudiees, on trouve uniquement que
l'extrait "Foulia" qui possêde un pouvoir inhibiteur vis-a-vis de la
trypsine (Figure. V. 2. 4). Le type d'inhibition dans ce cas est non competitif
avec une constante d'inhibition Ki de l'ordre de 16 gM.
-30 -20 -10 0 10 20 30
I (PM)
Figure V. 2. 4. Representation graphique 1/V = f
([polyphenols]) de Foulia tel que ([S1] < [S2] <
[S3] < [S4] < [S5]).
Nous avons essaye de determiner le pourcentage d'inhibition de
tous les autres extraits y compris l'extrait "Foulia", pour ce faire nous avons
fixe la concentration des inhibiteurs et nous avons calcule le taux
d'inhibition suivant la methode de Qiang II et al (Qiang .H et
al, 2006). Les resultats obtenus sont regroupes dans le
tableau V.2.1 et representes dans l'histogramme (figure V. 2.5).
Tableau V. 2.1. Le pourcentage d'inhibition de
chaque plante.
|
Plante
|
Pourcentage d'inhibition
Substrat
|
|
Foulia
|
20,04
|
|
Gondale
|
5,44
|
|
Lelma
|
16,83
|
|
Remth
|
22,03
|
|
Reguig
|
21,78
|
|
Serr
|
21,78
|
|
Zwadet Elkhrouf
|
15,10
|
o
% 30 d'inhibition
20- °
d
--7
plantes
10-
·SIS)
Figure V. 2. 5. Le taux d'inhibition de la
trypsine avec une concentration fixe de substrat et d'inhibiteur.
On remarque que les valeurs du pourcentage d'inhibition
varient de 5,44 % pour l'extrait "Gondale" a 22.03 % pour l'extrait "Remth",
les valeurs trouvees prouvent que le taux d'inhibition est independant de la
concentrations des phenols, on peut conclure que l'inhibition enzymatique
depend du type des composes phenoliques (relation structure -- activite).
4. Conclusion
Les inhibiteurs de la trypsine sont diversifies et
generalement synthetiques utilises comme medicament contre plusieurs maladies
par exemple la pancreatite, mais toujours on cherche des extraits naturels des
plantes qui peuvent etre des inhibiteurs de cette enzyme, beaucoup des plantes
medicinales sont connus dans ce domain ; nos plantes sont des plantes
sahariennes qui contient des principes actifs connus par leur pouvoir d'inhiber
les enzymes et notamment les composes a structure phenolique.
Parmi les sept plantes seulement une seule plante qui a le
pouvoir inhibiteur de l'enzyme sachant que les sept plantes ont subit les
mémes procedures experimentales ce qui explique que l'inhibiteur est
specifique capable de bloquer le site actif de l'enzyme.
L'inhibition enzymatique de la trypsine depend de differentes
parametres tel que : La concentration de substrat.
Le type d'inhibiteur et la nature de sa structure chimique (sa
relation avec le site catalytique).
La concentration de l'inhibiteur.
| 


